INTRODUZIONE ALLA PARTE
SPERIMENTALE
31
Dalle prime scoperte fatte alla fine degli anni ottanta, le conoscenze sul ruolo dell’NO in fisiologia e patologia si sono accresciute in maniera notevole.
La scoperta che l’NO, un radicale di azoto conosciuto inizialmente per le sue proprietà tossiche, fosse in realtà un importante mediatore fisiologico, cardine della regolazione del tono vascolare, e coinvolto nella regolazione di importanti funzioni biologiche anche al di fuori del sistema vascolare, è stato uno dei più importanti progressi della scienza negli ultimi vent’anni.
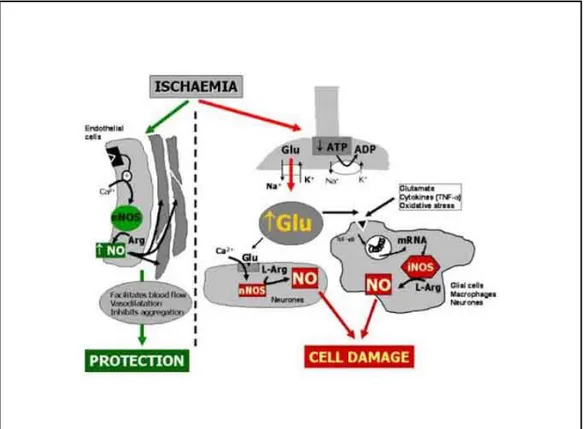
L’NO nell’ischemia cerebrale svolge sia ruoli benefici che dannosi in relazione al momento della sua produzione dopo il danno ischemico, al tipo di isoforma di NOS coinvolta e al tipo di cellula che produce NO. Sono state identificate 3 isoforme della NOS: n-NOS (neuronale), i-NOS (inducibile), e-NOS (endoteliale).
Immediatamente dopo l’evento ischemico, NO rilasciato da e-NOS svolge azioni protettive in quanto promuove vasodilatazione ed inibizione dell’aggregazione piastrinica. L’effetto vasodilante è mediato dal GMPC prodotto nella muscolatura
liscia tramite l’attivazione della guanilato ciclasi (GCs).
Tuttavia, col progredire del fenomeno, l’NO prodotto da iperattivazione di n-NOS, e-NOS e i-NOS contribuisce al danno tissutale con un iniziale deterioramento metabolico, portando all’infarto. Per quanto riguarda il danno tissutale, è ben noto il coinvolgimento di livelli elevati di NO prodotti da n-NOS e i-NOS. I fattori responsabili della iperattivazione di n-NOS in condizioni ischemiche sono numerosi; l’ipossia e il rilascio di grandi quantità di glutammato conseguenti all’aumento di calcio intracellulare, e alla depolarizzazione evocata dall’incremento di potassio extracellulare. Ciò causa una iperproduzione di NO, che reagisce con l’anione superossido generando radicali liberi molto tossici, tra cui ONOO-. I radicali liberi, al di là delle funzioni fisiologiche che svolgono a vari livelli nella vita cellulare, possono provocare danni sensibili alle macromolecole biologiche quando sono prodotti in condizioni eccessive, o comunque in concentrazioni tali da ridurre o annullare la capacità di difesa antiossidante. Se le difese antiossidanti della cellula risultano insufficienti a contrastare l’azione dei radicali liberi, si verifica lo STRESS OSSIDATIVO e la cellula può risultare danneggiata. Il danno può interessare i fosfolipidi di membrana fino alla loro
32
distruzione, gli acidi nucleici con accumulo di mutazioni ed alterazioni dell’espressione genetica, e le proteine con alterazione delle strutture e perdita di funzione enzimatica, di trasporto, recettoriale.
Inoltre le alterazioni metaboliche che si verificano durante l’ischemia e la successiva riperfusione, risultano dall’espressione e dal rilascio di citochine che attivano la i-NOS in diversi tipi di cellule tra cui quelle del sistema nervoso centrale. L’NO può produrre livelli citotossici di i-NOS e l’incremento dei livelli di i-NOS contribuisce al progressivo danno ischemico.
Figura 16: Duplice ruolo dell’NO
L’NO è per tanto una molecola capace di svolgere funzioni diverse e contrapposte in rapporto alla sua concentrazione e al sito di produzione. L’NO a basse concentrazione è in grado di indurre effetti benefici sia nelle malattie cardiovascolari svolgendo un’azione vasodilatante con conseguente inibizione
33
dell’aggregazione piastrinica, sia nelle malattie neurodegenerative in quanto è in grado di funzione da antiossidante verso i ROS.
Le alte concentrazioni dell’NO, invece sono la causa principale delle degenerazioni di tali malattie con conseguente aumento dello stress ossidativo, dannoso per le macromolecole biologiche.
La conoscenza delle proprietà biochimiche e farmacologiche dell’NO, ha condotto alla progettazione di nuovi farmaci che sono il risultato della combinazione di inibitori selettivi della n-NOS con donatori NO.
Gli inibitori della n-NOS agiscono da falsi substrati della NOS con conseguente riduzione della produzione di NO e degli effetti dannosi che ne conseguono. I donatori di NO, a differenza, agiscono sui recettori NMDA del glutammato e, tramite una s-nitrosilazione ne bloccano l’attività in modo da alleviare o prevenire il progredire dei processi neurodegenerativi che si verificano nel corso del danno ischemico. Inoltre, sempre tramite una s-nitrosilazione, sono anche in grado di interagire con i gruppi tiolici delle caspasi promuovendo l’inattivazione di queste proteine, coinvolte nell’apoptosi, riducendo la morte neuronale e il danno cerebrale.
Questa combinazione di farmaci duali (NO-NOS) rappresenta un innovativo e unico approccio terapeutico neuroprotettivo il quale può portare ad un cambiamento nella comprensione meccanicistica dei processi neurodegenerativi e dei mezzi per esercitare un controllo efficace dell’ischemia neuronale attraverso nuove strategie terapeutiche.
34
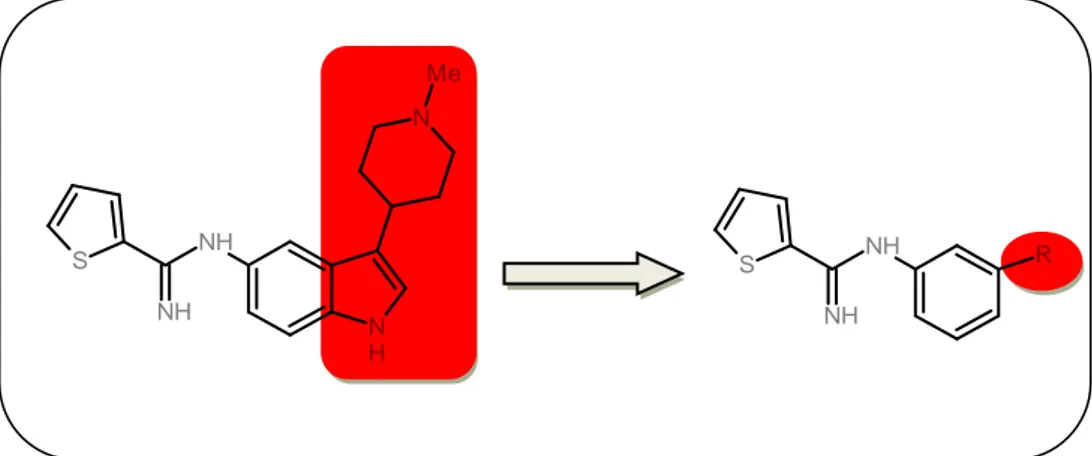
Tra gli inibitori della NOS descritti in letteratura alcuni sono caratterizzati dalla presenza nella loro struttura molecolare di una porzione tiofenica che sembrerebbe costituire l’elemento strutturale fondamentale per una ottimale e selettiva attività anti ischemica.
In particolare nel 2006 ricercatori della Maddaford S. Etan progettarono un derivato che in vitro ha mostrato buone proprietà inibitorie nei confronti della n-NOS (IC501.88). N H NH S N NH Me
Figura 17: Struttura dell’inibitore selettivo n-NOS
E’ un inibitore selettivo della n-NOS che induce una diminuzione nella sintesi di NO.
La comprensione del duplice ruolo dell’NO nell’ischemia cerebrale ha spinto molti ricercatori a sviluppare nuovi farmaci ‘smart ligands’ capaci di interargire simultaneamente sulla via metabolica dell’NO considerata rilevante per la genesi e la progressione della patologia ischemica.
L’applicazione di questo dualismo dell’NO ha condotto alla progettazione di nuove molecole con conseguente miglioramento dell’attività terapeutica.
Nella mia tesi di laurea sono stati presi in considerazione tali inibitori della NOS per lo sviluppo di nuovi e più efficaci agenti neuroprotettivi. Prendendo come riferimento la struttura dell’inibitore selettivo n-NOS sono stati identificati nuovi derivati tiofenici 1, 2 in modo da incrementare l’attività per la n-NOS, ma anche la solubilità e la biodisponibilità.
35 N H NH S N NH Me R NH S NH
Figura 18: Formula generale dei composti sintetizzari
In particolare i composti sintetizzati in questa tesi presentano l’eliminazione della costrizione indolica e in posizione meta del gruppo aromatico vi è la presenza di un raggruppamento metilpiperazinico (1). Il composto 2 è il risultato della combinazione di 1 attraverso una funzione carbammica ed una catena nitropropilica che dovrebbe rilasciare in vivo NO (2).
R NH S NH NH S NH N N O O ONO2 2 NH S NH N NH 1
36
SCHEMA 1
S S NH N H2 N N - BOC NH S NH N N - BOC 8 NH S NH N NH 1 NH S NH N N O O ONO2 2+
O2NO OH+
Cl OH 10 9 II III 4 7 I IVReagenti e condizioni: I: EtOH, t.a., 12 h; II: HCl, AcOEt; t.a., 1 h; III: AgNO3,
37
I composti finali 1, 2 sono stati ottenuti seguendo la procedura sintetica illustrata nello Schema 1.
Il derivato naftalenico 4 ottenuto seguendo la procedura riportata nello Schema 2, è stato sottoposto a reazione di sostituzione con il derivato piperazinico 7 ottenuto seguendo la procedura riportata nello Schema 3, in presenza di EtOH fornendo l’intermedio 8 protretto sull’N piperazinico con il gruppo terz-butil formiato (Boc). Il composto 8 è stato successivamente deprotetto per trattamento con HCl/AcOEt per dare il corrispondente composto finale 1. La successiva reazione del derivato 3-idrossipropil-1-nitrato (10) con il composto 1 in presenza di CDI ha condotto al corrispondente composto finale 2.
Il derivato 10 è stato ottenuto tramite una reazione di nitrazione del 3-cloro-propanolo commerciale in presenza di AgNO3 e CH3CN.
38
SCHEMA 2
S S NH NH2 S S 3 NH2 S O I II 4Regenti e condizioni: I: Reattivo di Lawesson, clorobenzene, 130ºC, 12 h; II: CHCl3, 2-bromo-metil naftalene, 62º C, 12h.
Il derivato 4 è stato ottenuto seguendo la procedura sintetica illustrata nello Schema 2.
Il tiofene-2-carbossamide commerciale è stato fatto reagire con il reattivo di Lawesson in clorobenzene per dare la corrispondente tioammide 3, che è stata sottoposta a reazione di sostituzione con il 2-bromo-metilnaftalene portando alla formazione dell’intermedio naftalenico 4.
39
SCHEMA 3
O2N N N - BOC 6 N H2 N N - BOC 7 NO2 Br N H N - BOC N H NH+
I II III 5Reagenti e condizioni: I: CH2Cl2, Boc, 0º C, 2 h; II: DMF, K2CO3, t.a., 4 h;
III: H2, Pd/C, AcOEt, t.a., 12 h.
Il composto 7 è stato ottenuto seguendo la procedura sintetica illustrata nello Schema 3.
La piperazina commerciale è stata fatta reagire con il Boc in presenza di CH2Cl2
generando l’intermedio 5, che è stato sottoposto a reazione di sostituzione con il bromo –nitro benzene in presenza di K2CO3 e DMF fornendo il corrispondente
nitro derivato 6. La successiva reazione di riduzione del gruppo nitro tramite idrogenazione catalitica in presenza di Pd/C ha condotto alla corrispondente ammina 7.