2. HSP
2.1 CARATTERISTICHE GENERALI
Un organismo soggetto a stress metabolico o ambientale reagisce con dei cambiamenti che coinvolgono l’individuo anche a livello cellulare e molecolare. Questo insieme di reazioni prevede, in più, la sintesi di determinate proteine quali: l’enzima citocromo P450, le metallotioneine e le heat shock protein (Hsp). La sintesi di queste ultime è stata studiata soprattutto come risposta cellulare a stress di tipo termico.
La scoperta delle Hsp viene attribuita a Ritossa [21] che, nel 1962, le rinviene in cellule salivari del moscerino della frutta, Drosophila busckii, in conseguenza di uno shock termico. In seguito a questa scoperta numerosi studiosi si interessarono alle Hsp, evidenziando l'espressione di queste proteine anche in altri tipi di tessuto umano e animale, nonché vegetale.
Le Hsp sono una famiglia di proteine altamente conservate a livello cellulare [22]. L’espressione di alcune possono essere indotte da diversi tipi di stress (come la deprivazione di nutrienti, i raggi UV e l’ipossia, i metalli pesanti e lo stress ossidativo e tossico, le infezioni e l’esposizione a citochine infiammatorie) [23, 24], mentre altre possono essere indotte solo da un unico tipo di stress.
Nei mammiferi le Hsp sono normalmente presenti nelle cellule nella forma costitutiva (Hsc), con il compito di regolare il metabolismo proteico e l’omeostasi cellulare [25] e nella forma inducibile (Hsp), la cui espressione a livello cellulare è evidenziabile in conseguenza di uno stress acuto [26, 27].
In base al loro peso molecolare le Hsp vengono raggruppate in diverse famiglie. Le principali sono:
- Hsp70: assistono la sintesi della catena polipeptidica e garantiscono il corretto ripiegamento della struttura proteica, agiscono come chaperon molecolari e partecipano alla riparazione o alla degradazione di proteine alterate o denaturate.
- Hsp90: svolgono un ruolo di sostegno tra alcuni componenti del citoscheletro e gli enzimi ed i recettori per gli ormoni steroidei.
- small Hsp (sHsp): hanno basso peso molecolare e possiedono diverse funzioni che sono specie-specifiche ed è stato proposto che esse agiscano da chaperon molecolari e impediscano l’aggregazione proteica irreversibile.
Diversamente dalle altre, le sHsp sembrano non avere una funzione costitutiva, in quanto sono indotte solamente dopo un evento stressante [28]. Sebbene queste proteine abbiano un’emivita relativamente molto breve (6-9 h in drosofila) il loro livello rimane elevato nell’organismo anche molto tempo dopo la fine dello stress.
2.1.1 Sintesi
Le molecole come le Hsp, sono ubiquitarie e altamente conservate. Esse sono vitali per tutta la vita di una cellula ma in condizioni di stress la loro sintesi viene aumentata.
In organismi eucariotici l’espressione del mRNA delle Hsp è mediato da Heat shock factors (HSF) e tra questi l’HSF-I gioca un ruolo chiave nella risposta da shock termico. Nel citoplasma delle cellule quiescenti l’HSF è complessato con varie Hsp come Hsp70 o Hsp90. Dopo un evento stressorio le proteine danneggiate si accumulano e provocano il rilascio degli HSF dai complessi con Hsp70 o Hsp90. Questo processo dà inizio alla trimerizzazione, traslocazione nucleare e fosforilazione di HSF-I, che sono i primi passaggi essenziali per il suo legame con lo speciale segmento di nucleotidi detto Heat Shock Element (HSE), nella regione promotrice dei geni Hsp.
Tutti questi passaggi sono adiuvati da numerose co-chaperonine delle Hsp maggiori (Hsp70 e Hsp90) e da altre proteine [29].
La struttura nucleosomiale del segmento di DNA che contiene l’HSE è riorganizzata da una speciale macchina proteica, chiamata GAGA-factor [30].
È interessante sapere che molti geni per Hsp reclutano una RNA polimerasi-II DNA-dipendente attiva anche in assenza di HSF. Questa polimerasi trascrive un piccolo segmento del gene ma si arresta quando lega il complesso iniziale dei fattori di trascrizione che legano la regione TATA.
Durante lo stress tutte le fasi successive della sintesi proteica vengono bloccate (splicing del RNA, esportazione nucleare e traduzione stessa). Ma l’heat-shock-RNA ha diverse strategie per aggirare questi problemi: i trascritti primari di solito non contengono introni oppure la sequenza codificante la proteina stessa inizia dopo l’introne e la trascrizione può iniziare dall’introne [31]; inoltre il riconoscimento delle RNA delle Hsp spesso utilizza altre strade e evita l’uso di fattori di inizio trascrizione che sono inattivati durante lo stress.
2.1.2 Regolazione dell’espressione delle Hsp
In condizioni fisiologiche le Hsp hanno il ruolo di housekeeping e fungono da chaperonine molecolari che guidano il corretto folding delle proteine di nuova sintesi, ma la loro espressione può essere costitutiva (Hsc) o inducibile (Hsp) a seconda delle condizioni cellulari: in condizioni di stress, come lo shock termico, le Hsp inducibili sono altamente up-regolate da Heat Shock Factors (HSF), che sono generati come parte di uno heat shock response (HSR), per mantenere l’omeostasi cellulare e sviluppare le funzioni di sopravvivenza della cellula.
In condizioni di stress HSF-I passa dalla sua forma inattiva alla forma attiva, tuttavia non è chiaro il meccanismo attraverso il quale lo stress “attivi” l’HSF-I né come la cellula possa percepire il segnale di stress.
Morimoto e collaboratori (1996) hanno proposto il modello della proteotossicità, basato sull'evidenza sperimentale che proteine estranee o denaturate risultano essere potenti induttori di sintesi delle Hsp. Secondo questo modello un agente stressante provocherebbe la denaturazione di determinate proteine cellulari e le Hsp70 interverrebbero nei meccanismi preposti alla loro riparazione. La conseguenza sarebbe una diminuzione della disponibilità citosolica delle Hsp70 tale da indurre il rilascio delle Hsp70 complessate con l'HSF-I. Una volta libero l'HSF-I si trasferirebbe nel nucleo dove muterebbe allo stato trimerico a sua volta in grado di legarsi alle zone promoter del gene per l’Hsp. Qui rimarrebbe legato ma in forma inattiva: solo la fosforilazione indotta dallo stress attiverebbe il fattore HSF-I e quindi la sintesi di Hsp70. Questo processo sarebbe in grado di autoregolarsi, in quanto un'elevata disponibilita di Hsp70 favorirebbe un loro legame con l'HSF-I e un
successivo distaccamento di quest'ultimo dalla zona promoter, interrompendo quindi la sintesi di Hsp.
Sono state formulate diverse ipotesi inerenti i meccanismi di trasduzione del segnale indotto dallo stress ed in grado di regolare la sintesi delle Hsp. Voellmy, nel 1996 ipotizzò un ruolo importante della variazione nei potenziali redox della cellula, quale elemento di regolazione nella produzione di Hsp [32].
Calderwood nel 1993 indicò l’aumento della concentrazione di calcio intracellulare e la stimolazione di alcuni enzimi (fosfolipasi C e A2) come secondi messaggeri importanti nella trasduzione del segnale [33].
Bensaude nel 1996 ipotizzò che cambiamenti fisici della membrana plasmatica (elasticità e fluidità) potessero essere coinvolti nella sintesi delle Hsp [34].
Nonostante vi siano numerose ipotesi, il meccanismo esatto attraverso il quale la cellula "riconosce" lo stato di stress, e traduce tale segnale in reazioni che portano alla sintesi proteica, non è ancora del tutto chiaro.
2.1.3 Funzioni
Le Hsp sono l’unica classe di proteine evoluta per contrastare gli effetti di eventi stressogeni: prevengono l’instabilità delle proteine e agiscono da veri e propri difensori dell’integrità cellulare.
Le Hsp infatti hanno il compito cruciale di garantire il corretto ripiegamento delle proteine, di prevenirne l’aggregazione e di degradare le proteine instabili, nonché di facilitarne il trasporto all’interno dei compartimenti cellulari [35, 36].
Alcune Hsp hanno inoltre un ruolo fondamentale nell’interazione tra gli ormoni steroidei e i loro recettori [22] e inducono termo-tolleranza contro forti stress termici [37].
Per questi motivi la maggior parte delle Hsp sono considerate come delle chaperonine molecolari cioè “proteine che legano e stabilizzano un altrimenti instabile proteina e, controllandone il legame e il rilascio, facilitano il suo destino in
vivo: sia di folding, assemblamento oligomerico, trasporto in un particolare
La maggior parte delle chaperonine prevengono l’aggregazione degli intermedi di folding delle proteine “appiccicose”.
Due classi molto importanti per questa funzione sono le small Hsp e la famiglia delle Hsp90 considerate come gli organismi che si occupano del riciclo, e che legano i loro target e li mantengono in una forma “competente” finchè l’intera cellula non recupera le energie per completare il corretto folding della proteina.
I membri della famiglia delle Hsp90 legano molti peptidi sia in vitro che in
vivo, compresi alcuni peptidi liberi intracellulari che fuggono dagli apparati
proteolitici e che possono interferire con i sistemi di segnale [39] creando gravi danni alle normali funzioni cellulari.
Le chaperonine non determinano la struttura terziaria di una proteina ma la aiutano a trovare il corretto ripiegamento in maniera più efficiente. Questo meccanismo aumenta la resa ma non il tasso di folding proteico.
I monomeri di chaperonine non lavorano mai da soli, infatti di solito formano oligomeri e/o sono aiutati da co-chaperonine. Il refolding delle proteine richiede energia, quindi non è strano che gli chaperons leghino e idrolizzino ATP. Tuttavia il tasso di idrolisi di ATP è lento e questo fornisce il tempo alla proteina-target di ripiegarsi.
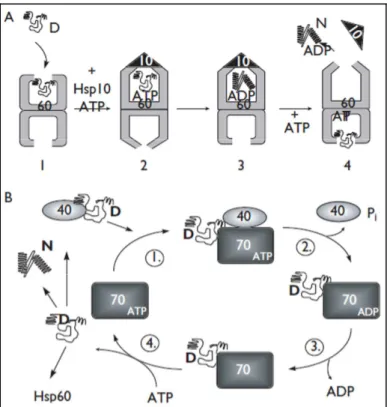
Nella Figura 2 è illustrato il meccanismo d’azione di due importanti classi di chaperonine molecolari: Hsp60 e Hsp70.
La Hsp60 lega la proteina target nella sua cavità interna dell’oligomero e viene completamente isolata dall’esterno grazie all’associazione con l’Hsp10 che fa da tappo. L’ambiente protetto della cavità dell’Hsp60 previene l’aggregazione casuale della proteina. Il legame e l’idrolisi dell’ATP induce ampi cambiamento conformazionale nell’Hsp60 che aiutano ad ammorbidire il core idrofobico della proteina target per favorire un processo di parziale unfolding. Durante questo processo l’acqua può entrare e facilitare la riorganizzaizone [40]. L’idrolisi dell’ATP e il legame con un nuovo target sull’altro lato fa rilasciare il tappo di Hsp10 e libera la proteina target iniziale.
Per molte proteine denaturate o danneggiate un singolo passaggio dall’Hsp60 non basta e devono passare ripetutamente da cicli di unfolding-refolding.
La Hsp70 lega la proteina target attraverso l’aiuto di un co-chaperon (Hsp40). Mentre Hsp70 idrolizza ATP alcune proteine acquisiscono la loro conformazione originale mentre altre necessitano dell’azione del Hsp60.
Contrariamente alla Hsp60, la Hsp70 lega una piccolo peptide della proteina-target: tra i 7 aminoacidi legati almeno 3-4 sono idrofobici. Il segmento legato da Hsp70 adotta una conformazione molto estesa, che richiede unfolding di strutture secondarie [41].
2.1.4 Trasduzione del segnale
Quasi tutte le classi di chaperonine sono coinvolte in eventi di signaling. Le sHsp vengono fosforilate da stress-kinasi e aumentano i livelli di glutatione ridotto nel citoplasma [42]; l’Hsp70 protegge le cellule dallo stress ossidativo e inibisce le stress-kinasi e l’apoptosi [43]; l’Hsp60 mitocondriale (liberata dopo la rottura della membrana mitocondriale), promuove l’apoptosi attivando delle caspasi [44].
L’Hsp90 ha un ruolo particolare tra le chaperonine di segnale. È un organizzatore-chiave per molti complessi citoplasmatici, infatti lega vari recettori steroidei, alcune kinasi seriniche o tirosiniche (incluse Src e Raf) e aiuta queste
proteine a raggiungere la loro forma di segnale attiva e a regolare la loro associazione con altre proteine e membrane.
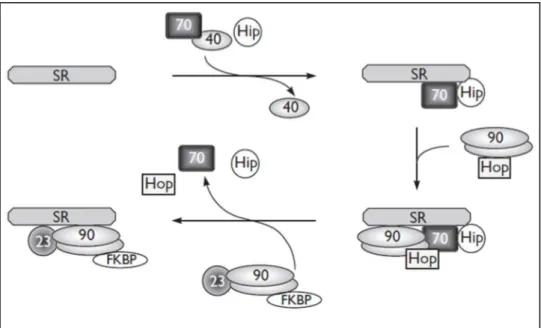
Ad esempio in Figura 3 vediamo la maturazione del recettore per gli ormoni steroidei (SR).
Figura 3. Azione del Hsp90 nell’organizzazione del recettore per ormoni steroidei.
Questo tipo di chaperonine si legano ai recettori proteici di nuova sintesi in maniera sequenziale: prima l’Hsp70, coi suoi co-chaperon Hsp40 e Hip, si lega al SR; successivamente si unisce anche Hsp90, già associato con la chaperonina di collegamento Hop; infine la peptidil prolil cis-trans isomerasi (una delle FKBP) si unisce al complesso aiutando a ridirezionare il SR verso la sua destinazione cellulare finale. Inoltre la piccola chaperonina p23 stabilizza il complesso prevenendo la sua dissociazione prematura. Quando l’ormone steroideo si lega al suo recettore questo si stacca da Hsp90 e trasloca nel nucleo facendo legare il dimero recettore-ormone all’elemento della regione di DNA che regola la risposta allo steroide.
2.1.5 Hsp nelle patologie
Le chaperonine sono importanti molecole che garantiscono la sopravvivenza cellulare. Infatti la loro sintesi aumenta sensibilmente nei casi in cui l’omeostasi conformazionale delle proteine viene perturbata (soprattutto da piccoli stress quali alchol e scottature, ma anche infezioni batteriche e alcuni farmaci) [45].
Anche l’ischemia e il conseguente danno ossidativo da riperfusione sono perturbazioni comuni negli organismi superiori. Currie et al. nel 1988 hanno dimostrato che l’induzione di alcune chaperonine possono prevenire il danno al muscolo cardiaco dato da queste condizioni [46].
L’induzione di Hsp pare essere benefica anche in organi trapiantati: infatti il ripristino della temperatura corporea, dopo l’ischemia fredda, riduce l’eventualità di danni da impianto e il rischio di un rigetto [47].
Chaperonine, invecchiamento e disturbi neurodegenerativi
L’ invecchiamento è solitamente descritto come la conseguenza di una alterata funzionalità dei processi di riparazione cellulare (sistema immunitario, riparazione del DNA, eliminazione dei radicali liberi…), e gli chaperon molecolari, che catalizzano il refolding di proteine danneggiate, potrebbero essere parte di questo processo.
A confermare questa ipotesi c’è il dato che negli organismi invecchiati, si trova un maggior livello di proteine danneggiate e l’induzione del Hsp70 è compromessa. Al contrario, una più efficiente induzione delle Hsp porta ad un aumento delle aspettative di vita nei lieviti, in Drosophila e in C. elegans [48].
Il danno proteico è particolarmente pericoloso quando interessa le cellule neuronali. Nella maggior parte dei disturbi neurodegenerativi (sindrome di Alzheimer, di Parkinson, di Huntington, di Wilson…), le cellule nervose accumulano una ingente quantità di aggregati proteici. Questi aggregati di solito includono vari tipi di Hsp come Hsp27, Hsp70 e Hsp90; questo potrebbe riflettere la dura e vana lotta di queste potenti chaperonine contro i processi di aggregazione. Infatti è stato dimostrato che una over-espressione di Hsp70, o altre Hsp, protegge la Drosophila dalla aggregazione indotta da poliglutamine in una neurodegenerazione simile all’Huntington.
Chaperonine e risposta immunitaria
Le chaperonine sono tra le proteine più conservate [49].
I batteri invasori affrontano notevoli cambiamenti quando attaccano una cellula ospite, conseguentemente vanno incontro ad un ampia produzione di Hsp, alcune delle quali vengono espresse sulla stessa superficie batterica. Data la loro struttura conservata le Hsp batteriche, soprattutto l’omologo batterico di Hsp70, diventa un segnale di riconoscimento comune, e quindi provoca una risposta immunitaria ad alta capacità [50].
Ci sono almeno due dozzine di infezioni in cui è stata riportata una risposta immunitaria contro le Hsp (ad esempio la tubercolosi, leprosi, la legionaria e la febbre Q) ma in alcuni sfortunati casi (artrite reumatoide, lupus eritematoso, sclerosi multipla e diabete mellito insulino-dipendente) certe proteine dell’organismo ospite ricordano alcuni epitopi delle Hsp batteriche. In questi pazienti la classica risposta immunitaria antibatterica attacca le cellule che portano queste proteine e sviluppa una grave forma di risposta auto-immune.
La vaccinazione con epitopi modificati dell’omologo batterico del Hsp70 diminuisce, e a volte previene lo sviluppo dei disturbi [50].
2.2 HSP70
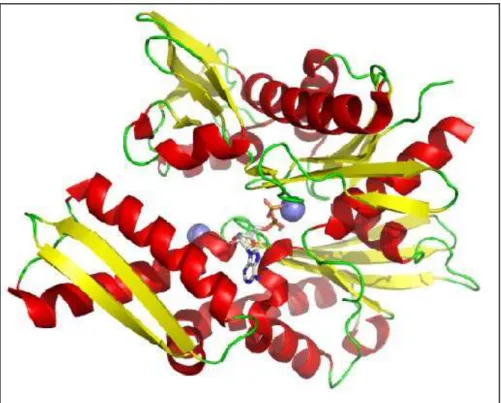
La famiglia delle Hsp70 è costituita da proteine che hanno due principali domini funzionali: il primo presente nella porzione N-terminale della proteina, di circa 40 kDa, con funzione ATPasica, e il secondo presente nella porzione C-terminale della proteina, di circa 25 kDa, peptide-binding. I due domini sono separati da una regione cardine sensibile al taglio delle proteasi.
Dal momento che le Hsp70 sono localizzate nel citosol, nel reticolo endoplasmatico (ER) e nei mitocondri, all’estremità N-terminale dei precursori delle forme destinate ad essere trasportate all’interno di tali organelli è presente un peptide di transito con una sequenza variabile.
Per molte Hsp70, la presenza di un subdominio l’estremità C-terminale di circa 5kDa, è indispensabile per consentire l’interazione con i propri co-chaperon.
Il sito che lega l’ATP, presente nel dominio all’N-terminale, è situato alla base di una sacca profonda posizionata tra i due lobi strutturali, e il nucleotide che lega il core del dominio dell’ATPasi ha una struttura terziaria simile a quella dell’esochinasi [51] per cui il meccanismo di fosfotransferasi e il cambiamento conformazionale indotto dal substrato delle due proteine potrebbe essere simile.
Il dominio che lega il peptide contiene un subdominio β-sandwich dove risiede la sacca che lega il peptide, e i residui che rivestono la sacca, interagiscono con il tratto idrofobico esposto delle catene polipeptidiche unfolded.
Figura 4. Struttura della molecola dell’Hsp70.
Un’estensione ad α-elica, presente al C-terminale, funge da porta per intrappolare il peptide legato nella sacca di legame, tale meccanismo consente di mantenere i complessi per un lungo tempo [52].
Il legame con l’ATP provoca un movimento conformazionale all’interno del dominio dell’ATPasi che viene trasdotto al dominio che lega il peptide, con conseguente apertura della sacca di legame mediante il sollevamento della porta ad
α-elica. In seguito a tale arrangiamento strutturale aperto, il legame e il rilascio del
peptide può avvenire rapidamente.
L’idrolisi dell’ATP, provoca la chiusura della porta sulla sacca di legame, intrappolando il peptide legato [52].
L’ampio spettro di funzioni delle Hsp70 è dovuto all’intervento di co-chaperonine che, originate durante l’evoluzione dalla diversificazione dei geni delle Hsp70, svolgono specifiche funzioni cellulari in cooperazione con le Hsp70 stesse.
Il co-chaperon DnaJ (la Hsp40 batterica) di E. coli è un attivatore della funzione ATPasica della Hsp70, e l’idrolisi dell’ATP sembra essere associato con il legame del substrato. Infatti, quando l’ATP è legato alla DnaK (la Hsp70 batterica), il dominio peptide-binding presenta una bassa affinità per il substrato; in tale forma i peptidi substrati possono essere legati o rilasciati dalla DnaK con maggiore libertà.
L’idrolisi dell’ATP, stimolata dalla DnaJ [53] provoca un cambiamento conformazionale del dominio che lega il substrato, che aumenta l’affinità di legame per il substrato della DnaK.
La chaperonina GrpE (la Hsp24 batterica) in E. Coli è un altro regolatore delle Hsp70: legandosi al dominio che lega l’ATP della DnaK, stimola lo scambio nucleotidico spostando la DnaJ e l’ADP, consentendo un altro ciclo di legame dell’ATP [54]. Nello stesso momento il substrato viene rilasciato, e un nuovo peptide può legarsi per dare il via ad un nuovo ciclo.
Molto probabilmente Hip è una proteina oligomerica che si lega al dominio delle Hsc70 degli eucarioti e che lega l’ADP [55] attraverso l’interazione con il suo peptide tetratrico ripetuto [56] e stabilizza lo stato dell’ADP delle Hsc70, mantenendo alta l’affinità ed è un attivatore dell’attività di folding [57].
BAG-1 è un regolatore negativo della Hsc70 [58] infatti interagisce, con elevata
affinità, con il dominio dell’ATPasi delle Hsc70 attraverso una regione di 45 amminoacidi (dominio BAG) vicino alla sua estremità C-terminale. Tale interazione stimola l’idrolisi dell’ATP e accelera il rilascio dell’ADP in modo simile a ciò che fa GrpE con la DnaK anche se sono strutturalmente differenti [59].
Anche BAG-1 inibisce l’attività dello chaperone e agisce come un antagonista competitivo al legame di Hip.
Hop è una proteina eucariotica che presenta un tetratrico peptide repeats
(TPRs), e ha la capacità di legare fra loro Hsp70 e Hsp90 per formare un complesso di chaperonine multi funzionale [60].
Hop promuove un ottimo refolding ma quando sono presenti sia le Hsp70 che le Hsp90 forma un complesso preferenziale con le Hsp70 che legano l’ADP. Hop non ha effetto sull’attività dell’ATPasi o sulla dissociazione dell’ADP, ciò indica che esso non agisce come fattore per lo scambio di nucleotidi.
Sembra che sia Hip che Hop interagiscano con il dominio C-terminale delle Hsp70 localizzate nel citosol, e tale interazione dipende dalla presenza al C-terminale di quattro specifici amminoacidi EEVD [61].
Hip interagisce anche con il dominio dell’ATPasi delle Hsp70 attraverso le sue TPRs [56].
Un altro TPR è CHIP, che interagendo con l’Hsc70, agisce come un regolatore negativo dell’attività ATPasica delle Hsp40.
Negli eucarioti i cognates di Hsp70 e Hsc70, si associano in dimeri, trimeri e oligomeri, possibili forme conservate inattive di chaperons. Durante i periodi di stress, gli oligomeri sono riconvertiti in monomeri attivi. Questa associazione richiede determinanti al C-terminale ed è inteso come un meccanismo di autoregolazione quando i peptidi substrato sono presenti in concentrazioni non saturanti [62].
Come precedentemente descritto nella descrizione generale delle Hsp, anche la sintesi delle Hsp70 non varia: l’induzione dal calore delle Hsp70 è mediata dai fattori di trascrizione heat shock (HSF) che, una volta trimerizzati, legano elementi heat shock (HSE) nei promotori.
In condizioni di riposo l’Hsp70 si trova legato all’HSF inattivo o come Hsp70 libero. Durante lo shock da calore, il pool di Hsp70 libero è ridotto perché si lega alle proteine denaturate dal calore. per lo stesso motivo si ha lo scioglimento dei complessi HSF-Hsp70.
A questo punto l’HSF rimasta libera si trimerizza, e in questa forma attiva si dirige nel nucleo dove promuove la trascrizione dell’Hsp70 aumentandone quindi la quantità. Le Hsp70 in eccesso catturano gli HSF liberi prima che essi siano portati al nucleo e formino una struttura trimerica.
Le Hsp70 partecipano al folding delle proteine attraverso cicli ripetuti di: legame al peptide, idrolisi dell’ATP e rilascio del peptide
Nel lume del Reticolo Endoplasmatico (ER), dove i pathways dei precursori delle proteine di secrezione sono generalmente co-traslocati, si rtova un membro della famiglia delle Hsp70, BiP. Esso è considerato uno dei diversi chaperon ad essere coinvolto nella traslocazione dei precursori delle proteine attraverso la membrana del ER, nel folding delle proteine, nell’assemblaggio e nel legame a proteine con folding errato nel lume del ER. L’espressione di BiP è indotta da condizioni di stress che portano le proteine ad avere un folding errato [63].
Recenti studi hanno mostrato che l’overespressione di BiP allevia lo stress al ER mediante il ripristino del processamento delle proteine secrete e il folding [64].