U
NIVERSITÀ DEGLI STUDI DI
P
ISA
F
ACOLTÀ DI
S
CIENZE
M.F.N.
CORSO DI LAUREA IN SCIENZE BIOLOGICHE
T
ESI DI
L
AUREA
Risposta fototattica alla radiazione UV del
ciliato Oprhyoglena flava
Candidato:
Relatori:
Pierluigi Grandini
Dott. Francesco Ghetti
Dott. Giovanni Checcucci
Riassunto
Molti protisti sono capaci di percepire variazioni spaziali e temporali della radiazione ambientale e di usarle come fonte di informazione per modificare opportunamente il loro comportamento motorio e posizionarsi nel proprio habitat nel modo più favorevole per il metabolismo e la sopravvivenza.
Molti studi sono stati effettuati su microalghe e protozoi ciliati per quantificare le loro risposte fotomotorie in termini di risposta spettrale alla radiazione visibile, cioè con lo scopo di determinarne lo spettro d’azione. Poiché negli ultimi decenni, a causa dell’assottigliamento dello strato d’ozono stratosferico, si è assistito ad un incremento sulla superficie terrestre (e quindi anche negli ambienti acquatici superficiali) della radiazione ultravioletta, che è potenzialmente dannosa per molte molecole biologiche e strutture cellulari, è interessante dal punto di vista ecologico estendere gli studi spettrali non solo nella radiazione UV-A (315-400 nm) ma anche nell’UV-B (280-315 nm).
In questo lavoro di tesi sono stati analizzati i risultati di esperimenti sul protozoo ciliato Ophryglena flava, la cui capacità fototattica era già stata studiata in precedenza, determinandone uno spettro d’azione nello spettro visibile.
Le misure analizzate in questo lavoro di tesi erano state effettuate all’Okazaki
Large Spectrograph presso il National Institute of Basic Biology (Okazaki, Giappone),
esponendo i microorganismi a intensità crescenti di radiazione UV a lunghezze d’onda fra 280 e 400 nm, con intervalli di 10 nm, e videoregistrando l’attività motoria per alcuni secondi dall’inizio dell’irraggiamento.
Poiché l’analisi automatica dei filmati così ottenuti non sembrava attendibile, le videoregistrazioni sono state scomposte in serie di immagini statiche successive e analizzate in sequenza per una corretta ricostruzione delle traiettorie del moto cellulare e
quindi ottenere i vettori che rappresentino lo spostamento di ciascun microrganismo dall’inizio dell’irraggiamento alla fine del periodo di osservazione. Questi insiemi di vettori spostamento sono stati analizzati allo scopo di ottenere curve dose-effetto, per ogni intensità di radiazione ed ogni lunghezza d’onda, e quindi determinare uno spettro d’azione.
Abstract
Many protozoan ciliates are capable to perceive spatial and temporal changes of the environmental radiation and to use them as source of information for opportunely modifying their motile behaviour and in order to find in the habitat a more favourable position for metabolism and survival.
Several studies have been conducted on microalgae and protozoan ciliates to quantify their photomotile behaviour as a spectral response to visible radiation, that is with the purpose to determine the action spectrum. Since in the last decades there has been an increase of ultraviolet radiation, potentially harmful to many biological molecules and cellular structures, on the surface of Earth (and also on the superficial aquatic environment), because of the stratospheric ozone reduction, it is very interesting from the ecological point of view to extend the spectral studies not only in UV-A (315 - 400nm), but also in the UV-B (280 – 315 nm) spectral range.
In this thesis we analyse the result of experiments conducted on the ciliated protozoan Ophryoglena flava, whose phototactical capability in the visible range was previously studied, to determine an action spectrum.
The measurements analysed in this work have been collected at the Okazaki
Large Spectrograph of the National Institute for Basic Biology (Okazaki, Japan),
exposing O. flava cells to increasing intensities of UV radiation of wavelengths between 280 e 400 nm, with intervals of 10 nm, and video-recording the motile activity for a few seconds from the beginning of irradiation.
Since the automatic analysis of these recordings did not seem reliable, the video-recording have been separated in sequences of static images and analysed in succession in order to correctly reconstruct the cellular trajectories and therefore to obtain the
vectors that represent the movement of each microorganism from the beginning of the irradiation to the end of the observation period.
These vectors movement have been analysed to obtain the dose-effect curves for every intensity and every wavelength, in order to determine the action spectrum.
INDICE
RIASSUNTO. p. 2 - 5
1. INTRODUZIONE. p. 8
1.1 Risposte fotomotorie in microorganismi p. 10
1.2 Il Fotomovimento nei Ciliati. p. 17
1.3 I fotorecettori. p. 25
1.4 Tecniche per lo studio delle fotorisposte. p. 30
1.5 Cenni su Ophryoglena flava. p. 33
1.6 La spettroscopia d’azione. p. 37
1.7 Scopo della tesi. p. 40
2. ANALISI DEI DATI E RISULTATI. P. 42
2.1 Registrazione del moto dei microorganismi. p. 42
2.2 Analisi del moto dei microorganismi 1. p. 44
2.3 Cenni alla statistica usata per l’analisi dei dati p. 50
2.4 Analisi del moto dei microorganismi 2. p. 59
3. CONCLUSIONI E PROSPETTIVE. p. 66
4. RIFERIMENTI BIBLIOGRAFICI . p. 67
1. INTRODUZIONE
Negli ultimi tre decenni è stato osservato un aumento della radiazione ultravioletta sulla superficie terrestre, per effetto della riduzione dello strato di ozono stratosferico, causata dell’immissione nell’atmosfera di vari gas di origine industriale. Questo aumento interessa in modo particolare la banda spettrale UV-B (280-315 nm), che è dannosa per la salute umana, per gli organismi fotosintetici e per i microorganismi che popolano gli strati superficiali degli ecosistemi acquatici (Häder, 2006)
In molti esperimenti si è visto come l’esposizione di vari organismi a intensità crescente di radiazione solare causi una significativa diminuzione della motilità. Ma schermando la radiazione con opportuni filtri o con uno strato di ozono, si è osservato un aumento della resistenza al danno, evidenziando quindi che la causa principale di diminuzione di motilità è la componente UV-B della radiazione solare.
Oltre il gran numero di studi sugli effetti dannosi della radiazione UV-B sulla biosfera, varie ricerche hanno evidenziato che molte specie animali e vegetali mostrano reazioni di fuga dalla radiazione UV: numerose specie di pesci e invertebrati possiedono fotorecettori per l’ultravioletto utili per sfuggire alle lunghezze d’onda dannose dell’UV e per un proprio sistema di orientamento. La radiazione UV quindi potrebbe essere un fattore importante per la distribuzione spaziale della specie, la migrazione e i rapporti preda-predatore all’interno di un ecosistema. (Leech et al., 2003).
Anche molte specie planctoniche, mostrano reazioni di fuga nei confronti dell’UV-B. Ad esempio alcune specie del crostaceo cladocero del genere Daphnia, in presenza di esposizione a radiazione solare completa, scendono rapidamente lungo la colonna d’acqua, mentre in assenza di UV-B e corte lunghezze d’onda UV-A (315-400 nm) rimangono in superficie (Leech e Williamson, 2001).
Tuttavia, l’esposizione alla radiazione ultravioletta, oltre a causare danni alla motilità e al metabolismo cellulare, può alterare proprio i meccanismi molecolari che regolano il fotoorientamento, facendo sì che i microorganismi non siano più in grado di posizionarsi correttamente nella colonna d’acqua, per trovare le condizioni più favorevoli alla sopravvivenza e alla crescita (Martini et al., 1997).
1. 1 Le risposte fotomotorie nei microrganismi
La risposte fotomotorie dei microrganismi sono il risultato della capacità di questi sistemi biologici relativamente semplici (batteri, alghe unicellulari e protozoi), di percepire variazioni spaziali e temporali della luce ambientale e di reagire a questi cambiamenti, modificando il loro comportamento motorio per ottenere le condizioni d’illuminazione più opportune per la sopravvivenza. Queste risposte sono processi fotobiologici in cui la luce costituisce una fonte d’informazione e non una fonte di energia per il metabolismo, come avviene nella fotosintesi.
Nei sistemi unicellulari la connessione tra la percezione dello stimolo luminoso e l’alterazione del battito ciliare, o flagellare, che da origine alla risposta fotomotoria, è costituita solo da eventi molecolari, senza la mediazione di una rete neurale.
In questo processo, fulcro centrale è lo stimolo luminoso; infatti, lo stimolo luminoso è il segnale in ingresso per il fotorecettore, dove l’energia trasportata dai fotoni viene assorbita dalle molecole di un pigmento, che produce un segnale di tipo chimico e/o fisico; questo segnale, tramite un sistema di elaborazione e/o amplificazione, regola il funzionamento dell’apparato motore della cellula. Questa parte del processo (dal fotorecettore all’apparato motore) è definita catena di trasduzione sensoriale.
Il primo passo importante nello studio del processo di fototrasduzione sensoriale è l’identificazione delle molecole che svolgono la funzione di fotorecettori e quali trasformazioni chimiche e/o fisiche avvengono nella loro struttura molecolare per effetto dell’assorbimento della luce.
Nel caso sia possibile identificare la struttura fotorecettrice all’interno della cellula, si può tentare di isolarla ed estrarre il pigmento per studiarne in vitro le proprietà spettroscopiche, chimiche e biochimiche.
In molti casi però l’isolamento risulta difficoltoso e quindi si può tentare
un’indagine in vivo tramite tecniche microspettrofluorimetriche e
microspettrofotometriche, che consentono lo studio di strutture cellulari intatte.
A queste tecniche d’indagine in vivo si può affiancare lo spettro d’azione, che è sostanzialmente una via indiretta ma efficace per identificare la natura del pigmento responsabile del fotoprocesso.
Molte specie facenti parte dei protisti vivono in ambienti acquatici e si orientano nella colonna d’acqua attraverso vari stimoli, tra cui la luce e la gravità. Le reazioni motorie a stimoli fotosensoriali sono un fattore importantissimo per la distribuzione spaziale delle specie plantoniche nella colonna d’acqua. Infatti, si è osservato che nelle ore diurne in presenza di una maggiore intensità luminosa vi è una maggiore migrazione di microorganismi verso gli strati più profondi, per allontanarsi dalla radiazione solare eccessiva e quindi potenzialmente dannosa, mentre durante la notte vi è un movimento di risalita. Le specie fitoplantoniche si servono del fotoorientamento per ottimizzare la produttività fotosintetica, ma anche molte specie non fotosintetiche mostrano capacità fototattica, sia per raggiungere zone illuminate ricche di prede, sia per sfuggire al danno da radiazione. Alcuni protisti non fotosintetici, come ad esempio Blepharisma
japonicum, sono ricchi di pigmenti endogeni fotosensibilizzanti e mostrano reazioni
fotofobiche, sia all’UV che alla radiazione visibile, che permettono loro di evitare la produzione fotosensibilizzata di specie reattive dell’ossigeno.
Nell’ambito delle ricerche sugli effetti dell’aumento di radiazione UV, è quindi un aspetto importante lo studio del danno alla motilità e al fotoorientamento dei microorganismi acquatici.
Il “Committee on Behavioral Terminology“ ha dato una serie di indicazioni per una uniformità di terminologia ogni qual volta si affronti lo studio del comportamento
motorio dei microrganismi (Diehn et al, 1997). Tale commissione ha definito come stimolo ogni quantità di energia o materia che, interagendo con l’organismo può suscitare una risposta; questa, a sua volta, è definita come ogni alterazione, indotta da uno stimolo, dell’attività dell’apparato motorio dell’organismo. La natura dello stimolo viene indicata da vari prefissi: “foto“ per evidenziare gli stimoli luminosi, “chemo“ per stimoli chimici.
Le risposte sono state convenzionalmente suddivise in Cinesi e Risposte Fobiche.
Nelle Cinesi, lo stato di attività dell’organismo varia al variare dell’intensità dello stimolo. Si parla di cinesi positiva quando l’attività dell’organismo è maggiore in presenza dello stimolo che in sua assenza. In caso contrario si dice cinesi negativa. A seconda di quale è il parametro di attività influenzato dalla presenza dello stimolo si possono distinguere varie cinesi. Ad esempio il termine ortocinesi indica che la velocità lineare dell’organismo è il parametro la cui attività è influenzata dallo stimolo; nella clinocinesi il parametro influenzato è la frequenza dei cambiamenti di direzione.
In questo schema di nomenclatura la tassia è riportata come una conseguenza comportamentale: non è quindi una risposta, ma piuttosto il risultato di una o più svariate risposte, innescate da uno stimolo e che tradotte portano ad una alterazione dell’apparato motorio. La tassia è definita come “il movimento orientato rispetto alla provenienza di uno stimolo“ e si dice che è positiva quando l’organismo si dirige verso lo stimolo, negativa quando se ne allontana.
Nelle risposte fobiche una improvvisa variazione d’intensità, provocata da un qualunque stimolo, causa un’alterazione transitoria dell’attività dell’organismo. Queste possono essere di tipo up se vi è un aumento d’intensità dello stimolo, di step-down quando sono innescate da una sua diminuzione. La risposta fobica, in generale, si
manifesta con brusche variazioni di velocità (generalmente un arresto), seguite da un cambiamento di direzione repentino. Il tutto è transitorio, poiché, dopo un certo tempo e quindi dopo aver attuato i meccanismi di risposta, l’organismo riprende il suo comportamento naturale per mezzo dell’adattamento.
Esistono esempi complessi e assai particolari. Ad esempio il ciliato Fabrea
Salina si orienta in presenza di luce unidirezionale, ma con una efficienza molto minore
rispetto al ciliato Ophryoglena flava. Il meccanismo è lo stesso, cioè con un cambiamento della direzione di nuoto a seguito della percezione dello stimolo di radiazione direzionale avvertito, solo che, mentre O. flava in presenza di luce, modifica la sua direzione in maniera netta ed evidente giungendo a compiere quasi delle linee rette, Fabrea salina, anche in presenza di luce sembra muoversi di moto casuale. Osservando lo spostamento in un arco di tempo abbastanza lungo si nota che tale spostamento non è altro che il risultato di un avvicinamento per tentativi verso la sorgente luminosa.
Non sempre però si è in presenza di un comportamento fototattico vero e proprio. Infatti la sorgente di luce crea un gradiente luminoso (cioè una variazione spaziale dell’intensità luminosa) al quale il microrganismo può essere sensibile, piuttosto che percepire realmente la direzione da cui la luce previene. Il tipo di risposta prodotto dalla cellula a seguito dello stimolo, ci da indicazioni importanti a questo proposito; infatti si potrà osservare uno spostamento dovuto solamente ad un fenomeno di accumulo (e non di reale fototassi), in quanto la cellula si muove non verso la sorgente di luce ma bensì verso la zona in cui l’intensità luminosa è maggiore.
Nel caso di Fabrea salina sono stati eseguiti degli esperimenti (Colombetti et al,
1992) che hanno dimostrato che questo ciliato non è sensibile ai gradienti luminosi.
dalla luce unidirezionale deriva da una percezione della direzione di provenienza dello stimolo. Siamo quindi di fronte ad una tassia: la discriminazione della direzione di provenienza della luce fa sì che la probabilità che la cellula cambi direzione sia minore quando essa è orientata verso la sorgente di luce.
Gli studi eseguiti su alcuni ciliati (Kuhlmann), in base al comportamento fototattico e/o fotofobico, hanno portato alla suddivisione in quattro categorie in base alla presenza di organuli specializzati. Nella pagina seguente vi è uno schema classificatore creato da Kuhlmann.
I ciliati oggetto di studio in questa tesi, come anche tutti gli appartenenti al sottordine Ophryoglenina, possiedono l’organulo di Lieberkühn. Esso è situato in prossimità della zona orale e più precisamente unito alle bande di ciglia delle AZM (Adhoral Zone Membranelles), tant’è che in passato era ascritto come organo importante deputato all’alimentazione. Studi più recenti (Kuhlmann) hanno evidenziato l’importanza dell’organo di Lieberkühn nel processo di fototassi: probabilmente esso non contiene le molecole di pigmento fotorecettore, ma favorisce l’individuazione della direzione del fascio luminoso, funzionando come uno schermo o lente (analogo al cristallino degli occhi) capace di convogliare la radiazione proveniente dall’esterno verso una zona dove sono presenti molecole di fotorecettore.
1.2. Il Fotomovimento nei Ciliati.
I ciliati sono organismi unicellulari, eucarioti, non fotosintetici appartenenti al regno dei Protisti. Essendo una rilevante frazione del microzooplancton, essi rappresentano un’importante componente della catena alimentare; fungono, infatti, da cibo per lo zooplancton e per i grandi organismi acquatici (Finlay et al, 1996). I ciliati, data la loro capacità di adattamento, sono diffusi in quasi tutti gli habitat ed essendo predatori di molte alghe flagellate e batteri contribuiscono a mantenere l’equilibrio ecologico degli ambienti acquatici.
Come indica il loro nome, caratteristica fondamentale dei ciliati è quella di essere forniti di ciglia, strutture microtubulari che originano da granuli basali (cinetosomi) situati nella cortex, cioè sotto la superficie cellulare. La struttura microtubulare 9+2 è detta anche assonema ciliare. Nella membrana ciliare sono localizzati i canali per il Ca2+ e per il Mg2+ che sono coinvolti nella regolazione della frequenza del battito ciliare. Il Ca2+ ha, inoltre, un ruolo fondamentale nel processo di trasduzione degli stimoli sensoriali. Le ciglia non sono implicate solo nel movimento. Molti microorganismi, infatti, nella zona adorale possiedono delle ciglia modificate, dette membranelle adorali, che hanno un ruolo nella cattura del cibo.
Nei ciliati troviamo anche dei vacuoli contrattili, organuli subcellulari che regolano la pressione osmotica intracellulare controllando l’influsso di acqua dal mezzo esterno generalmente ipotonico rispetto al citoplasma. Altra caratteristica dei ciliati è quella di avere più nuclei. Moltissime specie hanno, infatti, uno o più micronuclei diploidi implicati nel processo di coniugazione e un macronucleo polipoide che controlla l’omeostasi cellulare. Data la loro funzione, i macronuclei contengono sia cromatina che RNA, mentre i micronuclei contengono solo cromatina. Le cellule che
mancano di micronuclei non fanno coniugazione e si dividono solamente per fissione binaria. (Dorit et al, 1997; Jerome, 1996) .
Molti ciliati hanno cicli vitali composti da diversi stadi. In alcuni di questi cambiano solo forma, in altri perdono o modificano alcune delle loro funzioni come, ad esempio, la capacità di nuotare o di percepire la luce. In alcuni stadi infatti essi perdono le ciglia e/o gli organuli fotorecettori.
I ciliati, come molti altri microorganismi, sono capaci di percepire e rispondere a stimoli fisici e chimici quali la temperatura, la luce, le sostanze chimiche. Tutto ciò permette loro di esplorare l’ambiente e di trovare gli habitat migliori nei quali vivere.
Tra i vari stimoli ambientali la luce ha sicuramente un ruolo importante, sebbene questi microorganismi non la usino come fonte di energia. E’stato ipotizzato che nei ciliati la capacità di percepire e rispondere alla luce sia implicata nei meccanismi di difesa, nell’assicurarsi il cibo costituito per la maggior parte di essi da alghe o altri microorganismi fotosintetici o, ancora, nella coniugazione. La risposta alla luce di questi microorganismi consiste in una variazione del loro moto, cioè in un cambiamento della direzione del nuoto e/o della velocità.
Molti ciliati sono dotati di organelli specializzati per raccogliere gli stimoli luminosi, interpretarli questi e tradurli in segnali per alterare il comportamento motorio. Questo ha portato ad adottare delle strategie caratteristiche basate o sulla direzionalità (fototassi) o sulla non direzionalità (risposte fotofobiche, fotocinesi) dello stimolo luminoso.
La fototassi è il risultato della ricerca della direzionalità della luce ed è definita positiva o negativa a seconda dell’attrazione o allontanamento dalla sorgente. La fototassi necessita di un apparato fotorecettore molto particolare e specializzato.
L’insieme di eventi che costituiscono una fotorisposta possono essere divisi in tre step: percezione dello stimolo, trasduzione del segnale, risposta motoria. Come si è precedentemente accnnato, in base alla diversa risposta motoria sono stati definiti diversi tipi di fotorisposta (Colombetti & Marangoni, 1991; Lenci & Colombetti, 1978), i principali sono:
FOTOCINESI: nella quale l’intensità di luce influisce sulla velocità del moto del microorganismo.
REAZIONI FOTOFOBICHE: nelle quali una brusca variazione dell’intensità della luce induce un arresto del moto del microrganismo seguito da una ripresa dello stesso in direzione casuale. Le risposte fotofobiche, sono dette di step-up o step-down se sono causate rispettivamente da un aumento o una diminuzione dell’intensità di luce.
FOTOTASSI: nella quale il microorganismo, una volta individuata la direzione di provenienza della luce, si muove verso di essa (fototassi positiva) o in direzione opposta (fototassi negativa).
Come effetto secondario di una o più fotorisposte primarie si ha fotoaccumulo o fotodispersione dei microorganismi, i due tipi di fotorisposta per primi descritti in letteratura. Nel fotoaccumulo le cellule si concentrano in zone dove l’intensità della luce è maggiore, il contrario avviene nella fotodispersione in cui le cellule si concentrano in zone dove l’intensità della luce è minore.
Molti esperimenti con irraggiamento mediante sorgenti artificiali sono stati effettuati sui due ciliati Blepharisma japonicum (che vive in acqua dolce) e Fabrea
salina (che vive in ambienti ipersalini, come le pozze di marea), appartenenti entrambi
all’ordine Heterotrichida, ed entrambi caratterizzati dalla presenza di granuli contenenti pigmenti, simili per conformazione molecolare all’ipericina. Queste due specie sono caratterizzate da diverso comportamento sia per quanto riguarda la
fotomotilità, sia per quanto riguarda la sensibilità ai danni provocati dalle radiazioni ultraviolette.
Blepharisma japonicum risponde a bruschi aumenti dell’intensità luminosa
attuando una risposta di step-up: questo tipo di risposta fa si che le cellule tendano ad accumularsi in zone scarsamente illuminate. Le cellule di Blepharisma japonicum sono generalmente colorate di rosso, a causa della presenza del pigmento blefarismina. Il pigmento è organizzato in granuli posizionati in file parallele alle cinezie, sotto la membrana plasmatica.
La blefarismina è un fotosensibilizzante: l’esposizione a intensità luminose troppo elevate causa la fuoriuscita del pigmento dai granuli e le cellule muoiono per gli effetti fototossici che questa molecola produce. L’esposizione prolungata a luce non eccessivamente intensa converte la blefarismina in ossiblefarismina, che da al protozoo un caratteristico colore blu. Entrambi questi pigmenti svolgono il ruolo di fotorecettori per dare la risposta fotofobia di step-up.
Gli studi condotti su Blepharisma japonicum (Sgarbossa et al., 1995) hanno dimostrato che l’esposizione della forma rossa del protozoo a radiazione UV-B causa una diminuzione di velocità, una diminuzione della percentuale di cellule mobili e tra queste, una diminuzioni di circa il 50% di cellule che esibiscono la risposta di step-up in seguito ad illuminazione. L ‘esposizione alle radiazioni UV-B non altera in maniera significativa gli spettri di assorbimento e di emissione di fluorescenza delle cellule.
Successivi studi condotti su B. japonicum (Lenci et al, 1997) hanno mostrato che la risposta di step-up può essere innescata anche da radiazioni UV-B.
Fabrea salina, in condizioni normali, mostra un comportamento di fototassi
positiva, ovvero, movimento verso la fonte luminosa e una risposta fotofobica di step-down, ovvero un brusco stop seguito da un cambiamento di direzione, dovuto ad un
calo di intensità luminosa. Come Blepharisma japonicum è caratterizzato dalla presenza di granuli di pigmento (anche se in minor quantità) situati sotto la membrana plasmatica parallelamente alle cinezie. Lo spettro d’azione della fototassi di Fabrea salina (Marangoni et al., 1994) risulta essere molto simile a quello del Paramecium bursaria, che è caratterizzato dalla presenza di una molecola pseudo-rodopsina simile. L’ipotesi sulla presenza di questa molecola anche in F. salina sono state confermate mediante l’utilizzo di tecniche di immunofluorescenza con l’ausilio di anticorpi anti-rodopsina.
Studi al microscopio elettronico a trasmissione hanno mostrato che i granuli di entrambi i ciliati presentano dei collegamenti con la membrana plasmatici. Inoltre, i granuli di entrambe le specie presentano al loro interno una struttura a lamelle che può richiamare ad esempio quella dei coni e dei bastoncelli presenti nella retina.
Per quanto riguarda il danno riscontrato in termini di efficienza fototattica, sono state avanzate alcune spiegazioni. L’aumento di velocità rende improponibile che il calo di efficienza fototattica sia dovuta ad un generico rallentamento del moto cellulare. Le misure di fluorescenza effettuate sulle cellule prima e dopo l’irraggiamento non hanno mostrato sostanziali variazioni dello spettro di emissione delle cellule.
:
Figura 1.2.1
Figura 1.2.2
Figura 1.2.3
Risposte comportamentali di microrganismi:
Figura 1.2.1: schema del meccanismo della Fototassi.
Figura 1.2.2: schema del meccanismo delle Risposte fotofobiche. Figura 1.2.3; schema del meccanismo della Fotocinesi.
In alcuni ciliati la fotorisposta varia in relazione allo stato di nutrimento e/o in funzione del ciclo vitale. Stentor coeruleus e Fabrea salina se lasciati per lungo tempo senza cibo risultano essere meno sensibili alla luce mentre, in condizioni di nutrimento normali, fanno rispettivamente fototassi negativa e fototassi positiva. Chlamydodon
mnemosyne si muove verso la luce prima di cibarsi e lontano da essa dopo aver
mangiato. In alcuni degli appartenenti alla famiglia delle Ophryoglenidae, tra i quali O.
flava e O. catenula, si è osservato che nei momenti precedenti la nutrizione gli
organismi fanno fototassi positiva, mentre nei momenti successivi fanno fototassi negativa. In questi ciliati la fototassi varia non solo in relazione al cibo, ma anche durante tutto il ciclo vitale che risulta essere composto da più stadi intermedi. Gli stadi descritti in letteratura sono quelli di teronte, trofonte, protomonte, tomonte e tomiti. Nei vari stadi le cellule sono diverse per dimensioni, per forma e sensibilità alla luce (Kuhlmann, 1998; Kuhlmann, 1993). Negli stadi di trofonte e di teronte le cellule sono molto sensibili alla luce e si muovono verso di essa. Opposto comportamento mostrano i protomonti, che fanno fototassi negativa. I tomonti, che sono per la maggior parte immobili, si dividono in quattro tomiti che si differenziano di nuovo in teronti.
L’organulo di Lieberkühn è sempre presente durante tutto il ciclo, ma è difficilmente visibile negli stadi che seguono la nutrizione perché viene mascherato dai vacuoli alimentari. In alcune particolari condizioni si possono osservare gli stadi di ciste o microtomiti nei quali le cellule non mostrano un preciso comportamento fototattico. Anche Porpostoma notatum ha un ciclo vitale simile a quello descritto per O. flava e
O. catenula, durante il quale mostra diverso comportamento alla luce. I teronti si
muovono, infatti, sia verso la luce che in direzione opposta, mentre i protomonti e i tomonti mostrano una chiara fototassi negativa.
Figura 1.2.4
Figura 1.2.4: Schematizzazione della catena di traduzione sensoriale nei microrganismi che
1.3. I fotorecettori.
Il sistema fotorecettoriale è generalmente costituito da un organello contenente un cromoforo legato ad un’apoproteina e, in molti organismi, da alcune strutture complementari tra cui: una struttura simile allo stigma algale, i granuli pigmentati, l’organulo di Lieberkühn.
Lo stigma delle alghe è un organulo a se stante spesso localizzato nella parte basale di un flagello (Foster et al, 1980) . Esso è formato da uno o più strati di globuli lipidici contenenti carotenoidi (Omodeo et al, 1980). Ha generalmente forma concava, con la concavità rivolta verso la porzione di membrana contenente i fotorecettori (Kuhlmann,1998; Kuhlmann et al, 1997). La sua forma e le sue proprietà ottiche fanno di questo organulo un elemento indispensabile all’individuazione della direzione di provenienza della luce.
In ciliati quali Chlamydodon mnemosyne e Nassula citrea la struttura detta stigma è formata da numerose vescicole spesso interconnesse a formare delle catene. La porzione di questa struttura contenente la maggior parte delle vescicole, è collocata vicino alla membrana cellulare. In C. mnemosyne lo stigma viene formato dopo la divisione cellulare e scompare prima della nutrizione. Questo ciliato fa fototassi positiva fino all’assunzione del cibo, dopo non mostra fotosensibilità e successivamente fa fototassi negativa. Ciò ha indotto alcuni autori a ipotizzare per lo stigma una funzione schermante nei confronti della luce. Questa ipotesi sarebbe confermata dal fatto che le cellule mostrano capacità fototattica anche dopo la nutrizione, sebbene in questa fase lo stigma abbia una dimensione ridotta. Detta capacità fototattica sembra essere connessa alla presenza dei vacuoli alimentari.
Porpostoma notatum possiede un organulo complesso di forma concava e una
struttura composta da strati amorfi di citoplasma e strati a organizzazione ordinata tipo cristalli bidimensionali. Si pensa che quest’organulo abbia la funzione di riflettere la luce incidente sui fotorecettori, localizzati nella porzione di membrana cellulare posta vicino alla superficie concava dell’organulo stesso.
Altri ciliati, invece di organuli, hanno dei granuli pigmentati posti sotto la membrana cellulare e distribuiti longitudinalmente lungo il corpo cellulare, tra i corpi ciliari. In questo caso i fotorecettori sono localizzati sulla membrana del granulo e all’interno dello stesso. Tra i vari organismi che possiedono i granuli i più studiati sono
Blepharisma japonicum, Stentor coeruleus (Tao et al,1994,; Matsuoka et al.,1993) e Fabrea salina.
Le famiglie delle Ichthyophthiriidae e delle Ophryoglenidae, alla quale appartengono tra gli altri O. flava, O. catenula e O. ovariovora, possiedono un tipico organulo, detto organulo di Lieberkühn. Esso è elettrondenso, ha forma di lente concavo-convessa, con la concavità rivolta verso la cavità orale delle cellule e rifrange la luce (Kuhlmann,1998). La parte concava è caratterizzata da estrusioni, le creste, circondate da membrana plasmatica. Se l’organulo viene rimosso (Koizumi & Kobayashi, 1989) le cellule mostrano una riduzione della capacità di percepire lo stimolo luminoso anche se questa non viene eliminata totalmente. L’organulo rimosso viene formato nuovamente nella divisione successiva.
Per alcuni cromofori estratti dalle cellule è stato possibile ottenere informazioni sulle proprietà strutturali e funzionali. Gli spettri d’assorbimento di questi cromofori comparati a quelli ottenuti, su diversi ciliati, con la spettroscopia d’azione hanno dato la possibilità di individuare il cromoforo responsabile delle fotorisposte.
Tra i cromofori di cui si conoscono le proprietà chimico-fisiche ci sono quelli di
Blepharisma japonicum e Stentor coeruleus. Lo spettro d’assorbimento del cromoforo
di B. japonicum, blefarismina, mostra tre picchi a 480, 540 e 590 nm; mentre quello di
S. coeruleus, stentorina, mostra picchi a 480, 540 e 610 nm. Entrambi i pigmenti
risultano avere proprietà chimiche e strutturali simili a quelle dell’ipericina (Falk, 1999), molecola di origine vegetale con un’alta capacità fotosensibilizzante. In B.
japonicum sono stati trovati cinque omologhi del cromoforo blefarismina (Maeda et al,
1997; Spitzner et al, 1998). Sotto l’azione della luce questo cromoforo cambia, diventa ossidato e si trasforma nella ossiblefarismina (Giese, 1973), la cui struttura chimica è più simile a quella della stentorina e dell’ipericina di quanto non lo sia quella della forma al buio. Entrambe le forme del pigmento sembrano attivare la trasduzione fotosensoriale in Blepharisma. Sebbene le proprietrà del cromoforo in Blepharisma siano state largamente analizzate, non si può dire lo stesso per l’apoproteina. Alcune analisi rivelano la presenza di una proteina con un peso molecolare di 200 kDa (Matsuoka et al,1993), altre di una con un peso di 30 kDa. (Gioffrè et al, 1993). Gli autori sembrano concordare solo sulla struttura monomerica della proteina. In Stentor le cose sembrano essere più chiare; sono state infatti isolate la stentorina 1 che è altamente fluorescente e la stentorina 2 che invece lo è meno.
In Chlamydodon mnemosyne lo spettro d’azione per la fototassi negativa mostra picchi a 390 e 470 nm (Selbach et al,1999), questo indicherebbe la presenza di un pigmento flavinico come in Loxodes. La presenza di un recettore flavinico in C.
mnemosyne è anche supportata dall’autofluorescenza di una regione della membrana
plasmatica adiacente allo stigma. La fluorescenza decade però troppo rapidamente per misurarne uno spettro.
In Fabrea salina lo spettro d’azione per le risposte di fototassi positiva mostra due picchi a 420 e 580 nm. Risultati simili sono quelli ottenuti in Paramecium bursaria, il cui spettro d’azione ha due picchi a 420 e 570 nm (Matsuoka & Nakaoka, 1988), e nel quale si ipotizza che il pigmento sia di tipo rodopsinico. Ipotesi sostenuta sia dalla riduzione della fototassi in presenza di idrossilammina che interferisce nel legame tra lisina e retinale, sia da esperimenti immunocitochimici (Nakaoka et al, 1991). Anche in
F. salina, l’idrossilammina riduce la fototassi e gli anticorpi policlonali anti-rodopsina
si legano ad una proteina di membrana (Podestà et al, 1994). La presenza di due picchi nello spettro d’azione di entrambi potrebbe essere dovuta a due rodopsine come avviene in H. salinarum (Foster, 2001). Analisi fluorimetriche hanno però evidenziato che nei granuli di Fabrea è presente un pigmento ipericinico. Utilizzando lunghezze d’onda di eccitazione tra 337 e 425 nm nelle cellule si osserva una fluorescenza rossa con picchi a 590, 615 e 655, simili ai picchi di fluorescenza del pigmento di B. japonicum (Marangoni et al, 1996). Questo porterebbe a ipotizzare per Fabrea un pigmento di tipo ipericinico. In Fabrea la fluorescenza diventa molto alta e facilmente misurabile se le cellule sono trattate con glutaraldeide (necessaria alla loro immobilizzazione) e quindi non vitali. Questo probabilmente perché nelle cellule vive essa è mascherata dall’interazione del cromoforo con la componente proteica, similmente a ciò che accade in Stentor in cui la stentorina in vivo mostra una modesta fluorescenza. Fabrea potrebbe quindi contenere due sistemi fotoricettivi funzionanti allo stesso tempo nella stessa cellula.
L’identificazione e l’isolamento dei pigmenti fotorecettori nei ciliati è a volte problematica in quanto, diversamente da Stentor e Blepharisma, in molti microorganismi la quantità di pigmenti è scarsa (Kim I. H. et al, 1984).
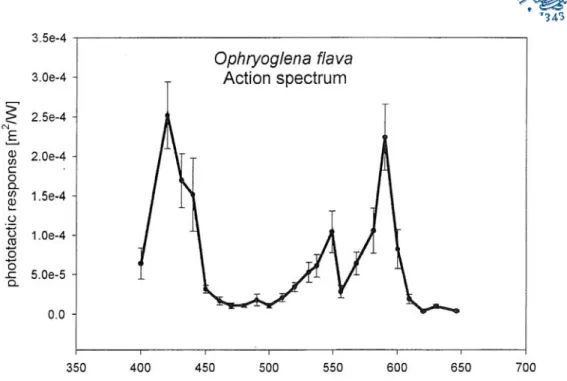
Questo è il caso di Ophryoglena flava, ciliato istofago mancante di una pigmentazione evidente. Lo spettro d’azione di questo ciliato mostra due picchi principali a 420 e 590 nm, paragonabili a quelli degli spettri di P. bursaria e F. salina, e uno minore a 540 nm (Cadetti et al, 2000). La presenza nello spettro di quest’ultimo picco può far ipotizzare che il pigmento coinvolto sia ipericino-simile come in S.
coeruleus e B. japonicum. Le misure di microscopia elettronica non hanno rilevato la
presenza di alcuna struttura simile ai granuli pigmentati, così come quelle di microscopia confocale non hanno rilevato alcuna fluorescenza. La discussione sul tipo di cromoforo presente in O. flava è ancora aperta.
Si presume che alcuni pigmenti coinvolti nella fotoricezione siano implicati anche in altre funzioni cellulari. Ad esempio, il cromoforo che è stato descritto in
Blepharisma, la blefarismina, agisce come sostanza difensiva contro i predatori. Infatti,
quando attaccato da Dileptus margaritifer, Blepharisma disgrega i granuli contenenti il pigmento e il predatore fugge (Harumoto et al, 1998). Le varianti albine di B.
japonicum sono più vulnerabili all’azione dei predatori e questo conferma il ruolo di
1.4. Tecniche per lo studio dei fotorecettori.
Le metodologie e le tecniche comunemente usate per lo studio delle proprietà dei fotorecettori sono molteplici. Una metodologia classica è la spettroscopia d’azione che permette di misurare la fotosensibilità delle cellule alle diverse lunghezze d’onda e, quindi, fornire informazioni sulla natura del pigmento coinvolto nella fotoricezione (Ghetti & Checcucci, 1997). Non sempre la spettroscopia d’azione permette una precisa individuazione del pigmento responsabile della fotorisposta sia perché molti pigmenti hanno spettri di assorbimento simili, sia perché le proprietà di assorbimento di un pigmento in vivo possono essere fortemente influenzate dall’ambiente molecolare circostante. La microspettroscopia d’assorbimento, insieme a quella di fluorescenza, è una tecnica che non altera l’integrità dell’organismo o le componenti subcellulari. Entrambe queste tecniche permettono di determinare esattamente le varie reazioni che si susseguono nel campione, i cambiamenti di queste reazioni e le diverse relazioni col mezzo esterno. In molti casi la labilità e la reversibilità delle reazioni implicate nella fototrasduzione rendono la microspettroscopia l’unico metodo d’indagine. Comunque, c’è da rilevare che le proprietà spettroscopiche dei pigmenti isolati potrebbero essere leggermente diverse da quelle che la molecola possiede nell’ambiente cellulare. Quindi nonostante che le informazioni spettroscopiche ottenute dagli estratti siano fondamentali, è necessario tenere conto della differenza tra la situazione in vitro e quella
in vivo.
L’estrazione e purificazione dei cromofori e delle relative apoproteine è fondamentale per conoscerne le caratteristiche chimico-fisiche. I pigmenti, apoproteine e cromofori, sono spesso molecole di membrana e la loro estrazione è generalmente effettuata con detergenti. Questo procedimento fornisce campioni parzialmente puri, dato che nel campione estratto possono essere presenti molecole diverse dal pigmento di
interesse. Per ottenere campioni di maggiore purezza si può far ricorso alla cromatografia per affinità e successivamente alla cromatografia ad alta pressione (HPLC). Per l’identificazione del pigmento così ottenuto si ricorre alla Gas cromatografia-Spettrografia di massa (GC-MS), che permette di conoscere la formula e la massa atomica della molecola in esame. Per ottenere la sequenza amminoacidica delle apoproteine isolate si ricorre anche ai sequenziatori automatici, mentre per ottenere la sequenza genica sono usate tecniche di biologia molecolare. Tra queste, l’ibridazione del DNA consente di avere una valutazione del grado di omologia tra sequenze di specie diverse.
Una particolare attenzione è stata riservata allo studio dei ceppi mutanti mancanti del pigmento o di una molecola implicata nella via di trasduzione chimica del messaggio luminoso. Lo studio comportamentale di questi mutanti ha fornito numerose informazioni sul ruolo delle diverse componenti della trasduzione.
cromoforo
Figura 1.4.1
Figura 1.4.2
Figura 1.4.3 cromoforo
1.5. Cenni su Ophryoglena flava
Il protozoo Ophyroglena flava è un protista ciliato, appartenente all’ordine
Hymenostomatida del Phylum Ciliophora e più recentemente, indicato come subphylum Alveolata (Paulin, 1996). Il suo habitat naturale è generalmente l’acqua dolce
(tipicamente piccoli stagni), ha un ciclo vitale comprendente più stadi, descritti in letteratura, caratterizzati da diverse fasi comprendenti una diversa morfologia, una particolare motilità e una diversa risposta fototattica. E’ istofago, ovvero si nutre di tessuto di metazoi morti o feriti.
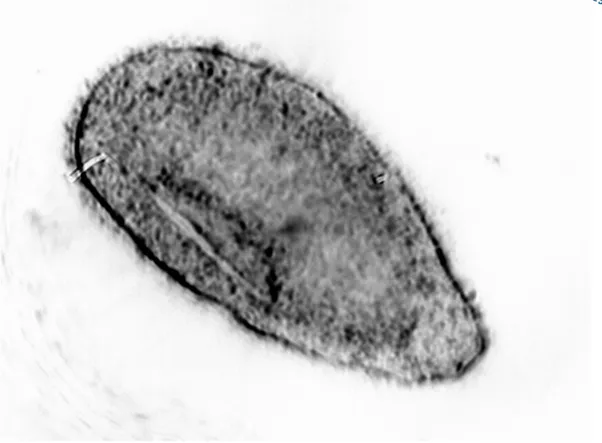
Fase importante dal punto di vista scientifico è lo stadio in cui l’organismo è alla ricerca del cibo. Esso prende il nome di teronte: l’organismo assume una forma allungata e affusolata di dimensioni che vanno da circa 300 – 500 µm lungo l’asse maggiore e di circa 100 µm lungo l’asse minore.
Dopo l’assunzione del cibo la cellula perde la sua capacità di movimento assumendo una morfologia di tipo cistico. All’interno della cisti, il ciliato si divide per mitosi (stadio di tomite); successivamente, le cellule riacquistano la motilità (stadio di teronte) e iniziano a mostrare le proprietà fototattiche. L’influenza della nutrizione sul ciclo vitale di O. flava consente, somministrando il cibo ad intervalli regolari, di sincronizzare le colture cellulari e di studiare la risposta fototattica a varie distanze di tempo dal momento della nutrizione, assunto come istante iniziale.
Quando si somministra del cibo, l’organismo mette in funzione i suoi recettori chemotattici e in presenza luce, si osserva che si ha una preferenza di movimento verso il cibo piuttosto che verso la sorgente luminosa. Quando i teronti, cominciano a nutrirsi della preda, si assistono a mutazioni conformazionali che portano all’ingrossamento dei vacuoli alimentari e ad un sostanziale cambiamento strutturale. La cellula diventa più affusolata con l’estremità appuntita rivolta posteriormente, rotondeggiante, tipo pera,
dove la parte più affusolata è la parte anteriore; questo stadio prende il nome di trofonte. Una volta finito di cibarsi l’organismo si allontana lentamente entra nel stadio detto tomonte.
I tomonti, nuotano per breve tempo, circa alcune ore, per poi arrestarsi e iniziare un processo di cambiamento fisiologico che porterà alla formazione delle cisti riproduttive. Ogni cisti si divide in due e nel giro di 24 ore darà origine ad una nuova divisione, portando il numero totale di 4 cisti dette tomiti. Avvenuto ciò, i tomiti si differenziano in teronti, riacquistando la motilità e dando origine, di nuovo, al ciclo vitale di Ophryoglena flava.
Figura 1.5.1
Figura 1.5.2
Figura 1.5.3
Differenti stadi del ciclo vitale di O. flava.
Figura 1.5.1.: tomiti durante la fase di divisione cellulare; si nota il sottile involucro intorno ai tomiti che
si forma quando la cellula va in divisione.
Figura 1.5.2: ingrandimento della figura 1 dove si notano i vacuoli alimentari. Figura 1.5.3: cellula dopo 24 ore dal nutrimento, stadio di teronte.
Figura 1.5.4 Immagine fotografica al microscopio ottico di un teronte di O. flava.
1.6. La spettroscopia d’azione.
La spettroscopia d’azione è un metodo per studiare in vivo le proprietà di assorbimento e, in alcuni casi, le reazioni primarie dei fotorecettori coinvolti nella risposta biologica oggetto di studio. Tale tecnica può essere usata per studiare tutti i fenomeni che dipendono dalla luce, per i quali si possa definire una risposta riproducibile. Essa consiste nell’analisi quantitativa della risposta del sistema in dipendenza dalla lunghezza d’onda della radiazione stimolante. Il risultato di questa analisi, lo spettro d’azione, è la misura dell’efficienza relativa della radiazione di diverse lunghezze d’onda nel provocare l'effetto studiato.
In generale la spettroscopia d’azione ha come scopo quello di dare informazioni sulla natura del pigmento coinvolto in una particolare fotorisposta. Infatti quando l’isolamento e la caratterizzazione biochimica di un fotorecettore non sono possibili, varie tecniche sono disponibili per l'identificazione del pigmento fotorecettore (ad esempio la microspettrofotometria o la microspettrofluorimetria), ma solo la spettroscopia d’azione permette di stabilire un collegamento diretto tra l’assorbimento dei fotoni da parte del presunto fotosistema e la risposta osservata.
Il termine “spettro d’azione” è stato coniato negli anni '40, ma il concetto è molto più antico. Già nel 1882 Engelmann fece degli esperimenti in cui furono determinate le caratteristiche spettrali del pigmento responsabile della produzione fotosintetica di ossigeno e cioè la clorofilla.
Per determinare uno spettro d’azione è importante stabilire una grandezza fisica o numerica per quantificare la fotorisposta (ad esempio la lunghezza o peso di una pianta, la concentrazione di enzimi o di gas, il numero di microorganismi accumulati, ecc…).
Considerando la relazione che esiste tra il numero di fotoni assorbiti dal fotorecettore e il numero delle molecole di fotorecettore che producono la risposta osservata, livelli uguali di risposta a differenti lunghezze d’onda dovrebbero corrispondere a quantità uguali di fotoni assorbiti (Ghetti e Checcucci, 1996).
L'efficienza della radiazione nell'indurre la fotorisposta ad una certa lunghezza d'onda, può essere quantificata come l'inverso del numero di fotoni necessario perché il sistema biologico produca un particolare livello di fotorisposta. Lo spettro d'azione può quindi essere rappresentato riportando questa quantità in funzione delle varie lunghezze d'onda usate nell'esperimento (Ghetti e Checcucci, 1996).
Lo studio di un fenomeno tramite la spettroscopia d’azione si avvale di due metodi fondamentali: l’irraggiamento monocromatico e quello policromatico.
Nell’irraggiamento monocromatico, quale quello che è stato usato per raccogliere i dati oggetto di studio in questa tesi, si assume che ogni lunghezza d’onda sia indipendente dall’altra nel determinare un effetto biologico e che non ci siano effetti aggiuntivi dovuti alla contemporanea presenza di diverse bande spettrali. Gli spettri d’azione monocromatici forniscono quindi informazioni sugli effetti della radiazione UV-B senza interferenze dovute ai processi indotti da lunghezze d’onda diverse.
Gli spettri d’azione determinati in condizioni di irraggiamento policromatico possono dare informazioni riguardo la generale risposta del sistema biologico considerato, prendendo in considerazione il contributo di tutti i processi dipendenti dalla radiazione.
Per ricavare uno spettro d’azione da dati sperimentali ottenuti in seguito ad irraggiamenti monocromatici, si determinano per ogni lunghezza d'onda dalle curve dose-effetto da cui si ricavano i valori di intensità della radiazione necessari per ottenere
il 50% della risposta massima. Si riportano quindi su un grafico i reciproci di tali valori in funzione della lunghezza d'onda. Poiché lo spettro d’azione fornisce informazioni sulla risposta biologica relativa alle varie lunghezze d’onda, l’ordinata degli spettri d’azione viene comunemente denominata "efficacia relativa".
1.7. Scopo della Tesi.
Lo spettro d’azione per la fototassi di Ophryoglena flava nello spettro visibile (determinato da Cadetti et al, 2000) è riportato in Figura 1.7.1.
Per capire se O. flava sia in grado di rispondere fototatticamente anche alla radiazione UV, sono state effettuate misure allo spettrografo del National Institute for Basic Biology (NIBB, Okazaki, Giappone). Il sistema di analisi computerizzata del moto di microorganismi utilizzato presso questo istituto ha permesso di determinare lo spettro d’azione riportato in Figura 1.7.2.
Poiché il sistema di analisi era in origine stato concepito per studiare il moto di microalghe e non di ciliati, si è reso necessario un controllo dei dati ottenuti con un metodo non automatico, simile a quello usato fino a pochi anni fa, che si avvaleva di un videoregistratore e dell’analisi visuale di un operatore umano.
Scopo di questa tesi è stato quindi l’analisi dei video digitali ripresi durante gli esperimenti effettuati presso il NIBB, scomponendoli in singoli fotogrammi per ricostruire le tracce del moto cellulare e quindi ricavare parametri del moto che permettessero di determinare la presenza di fototassi, sia essa negativa o positiva, come nel caso dello spettro visibile e come sembra suggerire lo spettro determinato con il sistema automatico.
Figura 1.7.1: Spettro d’ azione della fototassi di Ophryoglena flava nello spettro visibile (da Cadetti et al, 2000).
0
5
10
15
20
25
30
280
300
320
340
360
380
Lunghezza d'onda (nm)
R
is
p
o
s
ta
fo
to
ta
tti
c
a
(u
.a
.)
400
Figura 1.7.2: Spettro d’ azione della fototassi di Ophryoglena flava nello spettro UV
determinato allo spettrografo del National Institute for Basic Biology (Okazaki, Giappone) per mezzo di un sistema di analisi computerizzata del moto di microorganismi.
2. Analisi dei dati e risultati
2.1. Registrazione del moto dei microorganismi.
Gli esperimenti presso lo spettrografo del NIBB di Okazaki sono stati effettuati su Ophryoglena flava nello stadio di teronte. Per gli esperimenti, i campioni venivano posti in vetrini con una camera di osservazione quadrata. Il moto dei microorganismi veniva osservato tramite un microscopio e un telecamera digitale, collegata alla scheda video di un computer e registrato direttamente su hard disk. Per l’osservazione, i campioni erano illuminati con luce infrarossa, verso la quale O. flava non mostra attività fototattico.
Il microscopio veniva posizionato opportunamente sul banco dello spettrografo, in modo da irraggiare i campioni con la lunghezza d’onda desiderata. L’intensità della radiazione UV veniva regolata per mezzo di filtri neutri e misurata con un “photon density meter“.
La radiazione di stimolo, data l’ampiezza dello spettrografo e le dimensioni ridotte dei campioni, è da considerarsi praticamente monocromatica. L’intervallo di lunghezze d’onda utilizzato si estendeva da 280 nm a 400 nm.
Figura 2.1.1
Figura 2.1.2
Figura 2.1.1 Rappresentazione schematica dello spettrografo di Okazaki. Figura 2.1.2 Il banco di lavoro dello spettrografo di Okazaki.
2.2. Analisi del moto dei microorganismi 1.
Nel nostro lavoro di tesi, i filmati che registrano il moto di organismi di
Ophryoglena flava, alle varie lunghezze d’onda e intensità di radiazione UV, sono stati
analizzati scomponendoli in una serie di immagini statiche. Poiché le riprese venivano effettuate in campo oscuro, le cellule di O. flava appaiono come macchie bianche su fondo nero.
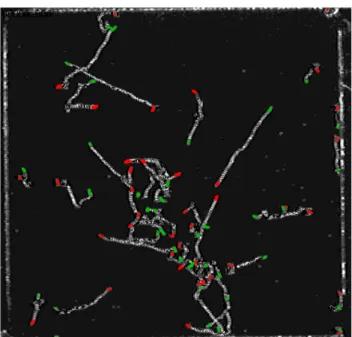
Le immagini ottenute da ciascun filmato sono state sovrapposte rendendo lo sfondo trasparente, in modo che alla fine dell’elaborazione si avesse una singola immagine che mostrava le tracce delle varie cellule come linee semi continue. L’inizio e la fine di ogni traccia erano colorate rispettivamente di verde e di rosso, per facilitare l’analisi successiva.
L’analisi veniva eseguita per gruppi successivi di 10 immagini ciascuno, in modo da poter seguire accuratamente e numerare ciascuna traccia e così evitare le ambiguità dovute agli incroci di tracce, causati dal passaggio di due o più organismi nello stesso punto nello stesso istante o ad istanti successivi. A mano a mano che si procedeva con questa tecnica, si otteneva una immagine con le varie tracce in crescita, ciascuna con il suo numero identificativo lungo tutto il percorso, che veniva ricostruito alla fine nella sua totalità.
Figura 2.2.1
Figura 2.2.2
Figura 2.2.3
Nelle figure 2.2.1- 2- 3 sono rappresentate le cellule di Ophryoglena flava a varie intensità e lunghezza
Figura 2.2.4
Figura 2.2.5
Figura 2.2.6
Le figure 2.2.4-5-6 rappresentano le cellule di O. flava colorate di rosso alla fine della stimolazione
Figura 2.2.7
Figura 2.2.8
Figura 2.2.9
Figura 2.2.10
Le figure 2.2.7-8-9-10: rappresentano i diversi intermedi creati per analizzare il motodalle cellule,
Una volta che tutti i fotogrammi di ciascun video sono stati sovrapposti, si aveva quindi un’unica immagine con le tracce di tutte le cellule del campione visibili come linee semi-continue bianche (con indicazione dell’inizio e fine traccia in colore) su fondo nero.
Per ottenere questo risultato per tutte le lunghezze d’onda e per tutte le intensità luminose sono stati esaminati circa 15.000 fotogrammi.
Nelle immagini mostrate in questa tesi la radiazione UV di stimolazione proviene dal lato superiore.
A questo punto, avendo ben chiaro quale fosse il punto di partenza e quello di arrivo per ogni traccia, si sono determinate le coordinate cartesiane di ciascun punto di partenza e di arrivo per poter rappresentare lo spostamento di ciascuna cellula dall’inizio alla fine dell’irraggiamento UV con un vettore.
Le tracce che presentavano alterazioni del comportamento motorio dovute ad urti con altre cellule o con le pareti della camera non sono state considerate nell’analisi successiva.
Figure 2.2.11: E’ possibile osservare colorati di verde e di rosso rispettivamente i punti iniziali e finali
2.3 Cenni alla statistica usata per l’analisi dei dati .
Dopo aver calcolato la lunghezza e l’angolo formato con la direzione di provenienza della radiazione UV di stimolazione, i vettori così ottenuti sono stati riportati nell’origine di un diagramma polare con asse delle ascisse verso tale direzione.
I diagrammi polari sono riportati nelle pagine successive.
Per ogni esperimento sono state calcolate la lunghezza del vettore medio (r) e l’angolo medio.
Per un campione con N cellule, il parametro r è dato da
r = (1/N)*√[(∑ sen θi)2 + (∑ cos θi)2]
e l’angolo medio è calcolato come
<θ> = arctang (<y>/<x>) dove
<y> = (1/N)* ∑ sen θi <x> = ( 1/N)* ∑ cos θi
dove θi è l’angolo fra ciascun vettore e la direzione della radiazione UV.
La lunghezza del vettore medio è compresa tra 0 e 1 ed è indice del grado di anisotropia di una distribuzione, cioè tanto più r tende a 1 tanto più il moto delle cellule nel campione sperimentale tende verso una particolare direzione indicata dall’angolo medio; quando r è uguale a 0 la distribuzione del moto è totalmente uniforme.
La varianza circolare è stata calcolata utilizzando la lunghezza del vettore medio, applicando la formula
V = 1 – r
La deviazione standard, invece è stata calcolata utilizzando come formula
280 nm - 2,10 µM/m²s
400 400 400 400 300 300 300 300 200 200 200 200 100 100 100 100 0 90 180 270290 nm - 0,41 µM/m²s
400 300 200 100 400 400 400 300 300 300 200 200 200 100 100 100 0 90 180 270300 nm - 6.15 µM/m²s
250 250 250 250 200 200 200 200 150 150 150 150 100 100 100 100 50 50 50 50 0 90 180 270310 nm - 0,88 µM/m²s
300 300 300 300 250 250 250 250 200 200 200 200 150 150 150 150 100 100 100 100 50 50 50 50 0 90 180 270320 nm - 0,09 µM/m²s
150 150 150 150 125 125 125 125 100 100 100 100 75 75 75 75 50 50 50 50 25 25 25 25 0 90 180 270330 nm - 2,14 µM/m²s
400 300 200 100 400 400 400 300 300 300 200 200 200 100 100 100 0 90 180 270340 nm - 3.72 µM/m²s
200 200 200 200 150 150 150 150 100 100 100 100 50 50 50 50 0 90 180 270350 nm - 0.37 µM/m²s
250 250 250 250 200 200 200 200 150 150 150 150 100 100 100 100 50 50 50 50 0 90 180 270360 nm - 0.19 µM/m²s
200 200 200 200 150 150 150 150 100 100 100 100 50 50 50 50 0 90 180 270370 nm - 0.67 µM/m²s
300 250 200 150 100 50 300 300 300 250 250 250 200 200 200 150 150 150 100 100 100 50 50 50 0 90 180 270380 nm - 0.65 µM/m²s
150 150 150 150 125 125 125 125 100 100 100 100 75 75 75 75 50 50 50 50 25 25 25 25 0 90 180 270390 nm - 2.72 µM/m²s
250 250 250 250 200 200 200 200 150 150 150 150 100 100 100 100 50 50 50 50 0 90 180 270I grafici delle pagine seguenti mostrano l’andamento dei parametri vettore medio e angolo medio (rispettivamente in rosso e in blu) al crescere dell’intensità della radiazione UV per ogni lunghezza d’onda esaminata.
Il vettore medio non sembra evidenziare una particolare direzionalità del moto a nessuna lunghezza d’onda ed in particolare a 340 nm e 360 nm, dove il sistema automatico di analisi usato al NIBB mostrava una rilevante attività fototattica positiva.
280 nm tutte le intensità 0 50 100 150 200 250 300 0 10 20 30 40 A n go lo v e ttor e m e di o 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Lu ng he z z a v e tto re m e d io Intensità µM/m ²s 290 nm tutte le intensità 0 50 100 150 200 0 10 20 30 40 A n go lo v e tt or e me di o (gr a di ) 0 0,2 0,4 0,6 0,8 1 Lu ng he z z a v e tto re me di o Intensità µM/m ²s 300 nm tutte le intensità 0 10 20 30 40 50 60 70 80 90 0 10 20 30 40 50 A n go lo v e tto re m e di o (g ra d i) 0,00 0,20 0,40 0,60 0,80 1,00 Lu ng he z z a v e tt o re me di o Intensità µM/m ²s
310 nm tutte le intensità 0 20 40 60 80 100 0 5 10 15 20 A ngolo v e tt o re m e dio (g rad i) 0 0,2 0,4 0,6 0,8 1 Lung he z z a v e tt ore me d io Intensità µM/m²s 320 nm tutte le intensità 0 20 40 60 80 100 120 0 0,5 1 1,5 2 2,5 A ngolo v e tt ore m e dio (g rad i) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Lunghe z z a v e tt o re m e dio Intensità µM/m²s 330 nm tutte le intensità 0 5 10 15 20 25 30 35 40 45 50 0 0,5 1 1,5 2 2,5 3 A ngol o vettor e medi o (gradi ) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Lunghez z a vet tor e medi o Intensità µM/m²s
340 nm tutte le intensità 0 20 40 60 80 100 120 0,00 1,00 2,00 3,00 4,00 A n go lo v e ttor e m e di o (gr a d i) 0 0,2 0,4 0,6 0,8 1 Lu ngh e z z a v e tt o re me d io Intensità µM/m ²s 350 nm tutte le intensità 0 20 40 60 80 100 120 140 160 180 200 0,00 0,50 1,00 1,50 2,00 2,50 A ngolo v e tt o re m e dio (g rad i) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Lunghe z z a v e tt ore m e dio Intensità µM/m²s 360 nm tutte le intensità 0 20 40 60 80 100 120 140 0 0,5 1 1,5 2 2,5 3 A n g o lo vet to re m e di o(g ra d i) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Lu ng h e z z a v e tt o re me di o Intensità µM/m ²s
370 nm tutte le intensità 0 20 40 60 80 100 120 140 160 180 0 1 2 3 4 5 A n g o lo v e tt o re m e d io (g ra di ) 0 0,2 0,4 0,6 0,8 1 Lu ng he z z a v e tt or e me di o Intensità µM/m ²s 380 nm tutte le intensità 0 50 100 150 200 0,00 20,00 40,00 60,00 80,00 100,00 A n go lo v e tto re m e di o (g ra d i) 0 0,2 0,4 0,6 0,8 1 Lu ng he z z a v e tt o re me di o Intensità µM/m ²s 390 nm tutte le intensità 0 20 40 60 80 100 120 140 160 180 0,00 20,00 40,00 60,00 80,00 100,00 A n go lo v e tto re m e di o (g ra d i) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 Lu ng he z z a v e tto re m e d io Intensità µM/m ²s
2.4. Analisi del moto dei microorganismi 2.
Poiché l’analisi effettuata con il calcolo del vettore medio e dell’angolo medio dello spostamento della popolazione cellulare per ogni esperimento non mostrava alcuna attività fototattica per la radiazione UV, abbiamo analizzato le immagini con un metodo alternativo.
Dopo aver idealmente diviso la camera sperimentale in due parti uguali, una verso la direzione di provenienza della radiazione UV, l’altra in direzione opposta, abbiamo contato il numero di cellule in ciascuna delle due parti all’inizio e alla fine di ciascun esperimento e normalizzato il numero ottenuto al numero totale di cellule dell’esperimento.
In questo modo si poteva vedere se l’irraggiamento UV provocava uno spostamento globale della popolazione cellulare verso lo stimolo o in direzione opposta.
Figura 1
Figura 2
Figura 1 Fotogramma iniziale con il conteggio degli organismi sia sopra che sotto la linea di riferimento. Figura 2 Fotogramma finale con il nuovo conteggio di O.flava sia sopra che sotto la linea di riferimento.
I grafici delle pagine seguenti mostrano l’andamento del numero (normalizzato) di cellule che si sono mosse da una parte all’altra della camera di osservazione durante l’irraggiamento UV. Il numero è positivo se lo spostamento è verso la direzione della sorgente di radiazione, negativo in caso contrario.
Anche questo metodo di analisi sembra non confermare lo spettro d’azione ottenuto presso il NIBB.
280 nm -0,2 -0,15 -0,1 -0,05 0 0,05 0,1 0,15 0,2 0,25 0 5 10 15 20 25 30 35 Ri sposta fototatti ca (a. u .) Intensità µM/m²s 290 nm -0,3 -0,2 -0,1 0 0,1 0,2 0 5 10 15 20 25 30 35 Ri sposta fo totatti ca (a. u .) Intensità µM/m²s 300 nm -0,1 -0,08 -0,06 -0,04 -0,02 0 0,02 0,04 0,06 0,08 0 10 20 30 40 5 Ri sposta fototatti ca (a. u .) 0 Intensità µM/m²s
310 nm -0,05 0 0,05 0,1 0,15 0 2 4 6 8 10 12 14 16 Ri sposta fo totatti ca (a. u .) Intensità µM/m²s 320 nm -0,3 -0,2 -0,1 0 0,1 0,2 0 0,5 1 1,5 2 2,5 Ri sposta fo totatti ca (a. u .) Intensità µM/m²s 330 nm 0 0,02 0,04 0,06 0,08 0,1 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 Ri sposta f o totatti ca ( a. u. ) Intensità µM/m²s
340 nm -0,1 -0,05 0 0,05 0,1 0,15 0 0,5 1 1,5 2 2,5 3 3,5 4 Ri sposta fo totatti ca (a. u .) Intensità µM/m²s 350 nm -0,1 -0,05 0 0,05 0,1 0,15 0 0,5 1 1,5 2 2 Ri sposta fo totatti ca (a. u .) ,5 Intensità µM/m²s 360 nm -0,15 -0,1 -0,05 0 0,05 0,1 0,15 0,2 0,25 0 0,5 1 1,5 2 2,5 3 ri sposta fot o tatti ca (a. u .) Intensità µM/m²s
370 nm -0,2 -0,15 -0,1 -0,05 0 0,05 0,1 0,15 0,2 0 1 2 3 4 5 Ri sposta fo totatti ca (a. u .) Intensità µM/m²s 380 nm -1 -0,8 -0,6 -0,4 -0,2 0 0,2 0,4 0 20 40 60 80 1 Ri sposta fo totatti ca (a. u .) 00 Intensità µM/m²s 390 nm -0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 0 10 20 30 40 50 60 70 80 90 100 Risp os ta fo to ta ttic a (a .u .) Intensità µM/m²s
5. Conclusioni e prospettive.
L’analisi non automatica dei risultati degli esperimenti effettuati su Ophryoglena
flava presso lo spettrografo del NIBB non conferma lo spettro d’azione determinato per
mezzo di analisi computerizzata al momento degli esperimenti.
Al contrario non si è evidenziata una particolare attività fototattica verso la radiazione UV a nessuna delle lunghezze d’onda esaminate.
Il proseguimento di queste indagini richiederà di effettuare esperimenti volti a determinare quale sia il fotorecettore per la fototassi del ciliato nello spettro visibile, per poi isolare e caratterizzare le specie molecolari responsabili della fotorecezione e possibilmente il meccanismo della trasduzione del segnale da stimolo luminoso a risposta motoria. Sarà quindi possibile studiare le caratteristiche spettroscopiche del fotorecettore nell’ultravioletto e, nel caso che esso sia in grado di assorbire fotoni anche in questa banda spettrale, formulare ipotesi sul perché questo assorbimento non costituisca un segnale motorio per O. flava.