UNIVERSITA’ DEGLI STUDI DI PISA Facoltà di Scienze Matematiche, Fisiche e Naturali
Corso di Laurea specialistica in Biologia Marina
ANALISI DEI PRINCIPALI PARAMETRI MORFOLOGICI E RIPRODUTTIVI DI CORALLIUM RUBRUM IN DUE POPOLAZIONI
DISTINTE:
PORTOFINO E CAP DE CREUS
Relatori: Dott.ssa Ilaria Vielmini Candidato: Lorenzo Moscatelli Prof. Giovanni Santangelo
Ai miei genitori
“ I'll never give up never give in ,won't stop believing cause I'm gonna win. “ (Jorn Lande con Masterplan – Spirit Never Die)
INDICE
RIASSUNTO ABSTRACT
1. INTRODUZIONE: Corallium rubrum
1.1. -Sistematica ……… 1.2. -Fauna associata ……….. 1.3. -Morfologia ……… 1.4. -Riproduzione ……… 1.5. –Distribuzione ………. 1.6. -Alimentazione ……… 1.7. -Ciclo vitale ………. 1.8. -Pesca e morie ………..
1.9. -Storia della ricerca ………..
1.10.-Dinamica delle popolazioni naturali ……… 1.11.-Scopo della tesi ……….
2. MATERIALI E METODI:
2.1. -Aree di studio utilizzate ………. 2.2. -Metodi di campionamento ……… 2.3. -Struttura di popolazione ……… 2. 3. 1.- Densità ……… 2. 3. 2.- distribuzione di frequenza della taglia delle colonie …………... 2.4. -Analisi dei parametri morfologici ………. 2. 4. 1.- Analisi delle ramificazioni ………... 2. 4. 2.- Fertilità e fecondità ………..
3. RISULTATI:
3.1.-Struttura di popolazione……… 3. 1. 1.- Densità ……… 3. 1. 2.- Taglia frequenza ……….
3.2.-Analisi dei parametri morfologici ……….. 3. 2. 1.- Analisi delle ramificazioni ………. 3. 2. 2.- Fertilità e fecondità ………
4. DISCUSSIONI & COCLUSIONI 5. BIBLIOGRAFIA
RIASSUNTO
Il corallo rosso (Corallium rubrum L. 1758) è una specie endemica del Mediterraneo che vive in un intervallo batimetrico compreso tra 10 e 600 m. Negli ultimi decenni il corallo rosso è stato oggetto di un’intensa pesca a causa del suo alto valore commerciale. Nell’ambito della distribuzione batimetrica di
C. rubrum è possibile distinguere due tipi di popolazioni: quelle più superficiali
(10 – 50m), caratterizzate da alta densità di colonie di piccole dimensioni e spesso parassitate da spugne perforanti (Clionidi) che ne abbassano il valore economico, e le popolazioni più profonde (oltre gli 50 metri), con colonie di taglia maggiore e maggior valore economico, ma con densità meno elevate.
Le popolazioni superficiali sono soggette a diversi tipi di disturbo, sia di tipo antropico, intenzionale (il prelievo) ed accidentale (ad esempio il turismo subacqueo), che di tipo ambientale (Global Climate Change). Lo studio di queste popolazioni è quindi importante ai fini della gestione in quanto, nonostante la specie non possa essere considerata a rischio di estinzione, alcune di esse potrebbero andare incontro ad una estinzione locale. Per arrivare a strumenti di gestione efficaci è fondamentale comprendere la dinamica delle popolazioni d’interesse. Considerato che ai fini della conservazione ogni singola popolazione deve essere considerata come singola unità di gestione, è necessario studiare le caratteristiche demografiche (accrescimento, output riproduttivo, struttura di età, struttura sessuale) di ciascuna specifica popolazione.
Il presente lavoro di tesi si inserisce in uno studio più ampio sulla demografia del corallo rosso in due popolazioni superficiali: Cap de Creus (Costa Brava, Spagna) e Portofino (Liguria, Italia). In entrambi i casi si tratta di Aree Marine Protette in cui il corallo rosso costituisce un richiamo per il turismo
subacqueo, con la differenza che nell’area di Cap de Creus il piano di gestione dell’AMP regola il prelievo commerciale della risorsa.
Scopo di questo lavoro di tesi è di indagare i più appropriati descrittori morfologici delle colonie in relazione alla struttura della popolazione (densità e taglia) e all’età, nelle due popolazioni prese in esame e valutare se morfologie differenti possono influire sull’output riproduttivo della popolazione. A tal fine sono stati misurati: peso, altezza, diametro, numero e ordine delle ramificazioni. Per ogni colonia è stato inoltre contato il numero dei polipi presenti all’apice, al centro e alla base di ogni singolo ramo e sono stati determinati sesso, fertilità (percentuale di polipi fertili) e fecondità (numero di uova per polipo fertile).
ABSTRACT
Mediterranean red coral (Corallium rubrum) is endemic to the Mediterranean Sea, living in a bathymetric range between 10 and 600 m. In recent decades, C. rubrum has been object of an intensive harvesting effort because of its high commercial value. Within the bathymetric distribution of C.
rubrum it is possible to distinguish two different populations: shallow ones (10 -
80m) characterized by dense but small colonies, often infested by boring sponges (Clionidi), whose reduce their economic value, and deep populations (below 80 m), characterized by colonies greater in size, of high economic value but less dense.
Shallow populations are threatened by different disturbances both due to human impact, intentional (harvesting) and accidental (damage inflicted by underwater scuba divers) and to environmental factors (i.e. Global Climate Change). The study of these populations is essential to management purposes because, although the species cannot be considered at risk of extinction, some populations could go through a local or at least economical extinction. For these reasons it is crucial to understand the dynamics of populations of interest in order to achieve effective management tools.
Furthermore, to conservation aim, each population should be considered as a single specific management unit with specific characteristics, so a population specific approach is favorable in demographic studies.
This thesis is part of a larger study on the demography of Corallium
rubrum in two distinct shallow populations: Cap de Creus (Costa Brava, Spain)
and Portofino (Liguria, Italy). Both areas are Marine Protected Areas (MPAs) since 1999 and in both Mediterranean red coral is an important underwater
touristic attraction but in Cap de Creus harvesting is regulated, while it is banned in Portofino.
The aim of this thesis is to investigate the most appropriate colony morphological descriptors in relation to population structure (density and size) and age structure, for each specific area, and to assess whether different morphologies can affect the larval output.
To this goal weight, height, diameter, number and order of branches have been measured. For each colony the number of polyps present in the branch tip, in the central part of the branch and at the base of were counted. Further, for each colony, sex has been determined, and for female colonies fertility (the percentage of fertile polyps) and fecundity (number of eggs per polyp fertile) have been estimated.
1. INTRODUZIONE
1.1 Sistematica
Corallium rubrum (L.1758), specie endemica del Mediterraneo, fa parte
del Phylum Cnidaria, classe Anthozoa, sottoclasse Ottocorallia, ordine Gorgonacea.
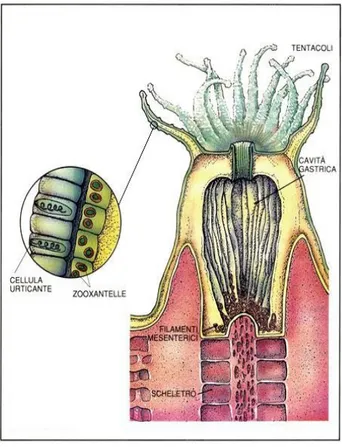
Il phylum degli Cnidari è rappresentato da quelli che possono definirsi gli organismi più semplici fra gli Eumetazoi; essi infatti mancano di veri e propri organi, di un capo e di un vero centro di coordinazione nervosa. Gli Cnidari sono caratterizzati da una simmetria raggiata e si possono osservare due differenti forme strutturali durante il ciclo vitale: la forma polipoide (Fig. 1) e quella medusoide (Fig. 2).
Fig. 1: Forma polipoide, sessile, di solito caratterizzata da riproduzione asessuale (Particolare di Esacorallo da Barnes modificato)
Fig. 2: Forma medusoide, a vita libera, caratterizzata da riproduzione sessuale.
La prima ha il corpo strutturato in una tipica forma a sacco con due estremità, quella superiore, disco orale, aperta all’esterno e circondata da tentacoli, da cui entra l’alimento ed escono i prodotti di rifiuto; quella inferiore, disco basale fissa al substrato.
I singoli polipi presentano simmetria radiale, assenza di sensibilità alla luce e un sistema nervoso non gerarchizzato e reticolare. Sono di norma sessili sedentari, possono assumere anche forme coloniali.
La seconda forma strutturale è quella medusoide, ovvero a polipo rovesciato. Può essere immaginata come un sacco leggermente appiattito, dove si riconoscono una zona superiore convessa, l'esombrella, ed una regione inferiore concava, detta subombrella, al cui centro è posta la bocca che si collega alla cavità gastrovascolare mediante una struttura tubulare chiamata manubrium. Dal margine subombrellare si propagano dei tentacoli urticanti a scopo di predazione e di difesa. Il corpo consiste di tre strati: l’ectoderma (più esterno); la mesoglea (strato gelatinoso intermedio) e il gastroderma (più interno).
Nel ciclo vitale della classe degli Antozoi, della quale fa parte anche il C.
rubrum (Fig. 3), è presente solamente la generazione polipoide; i polipi possono
essere solitari, come ad esempio nelle attinie, o coloniali, come appunto nel corallo rosso. La struttura di un polipo è allargata sulla superficie superiore dove è possibile distinguere un disco orale, circondato da tentacoli cavi, in numero di 8 negli Ottocoralli e di 6, o multiplo, negli Esacoralli, a funzione predatoria. All’interno del polipo è ospitata la cavità digerente, settata longitudinalmente da pareti verticali, mesenteri, che convergono a raggiera verso l’asse centrale.
Fig.3: schema di sezione di C. rubrum (Da Barnes, modificato)
La terminazione aborale di un polipo è invece quella aderente allo sclerasse, ovvero, l’asse scheletrico centrale della colonia. Negli Antozoi, in funzione del numero e della struttura dei tentacoli, si distinguono due sottoclassi: gli Hexacorallia, caratterizzata da mesenteri e tentacoli in numero di
sei o suo multiplo, la cui forma è liscia e priva di ramificazioni pinnate e gli Octocorallia caratterizzata da mesenteri e tentacoli in numero di 8 e pinnati. Nella prima sottoclasse si ritrovano, organismi come Cerianthus membranaceus, Ordine ceriantaria, o Corynactis viridis, corallomorfo di minute dimensioni presente nel Mar Mediterraneo. Nella seconda invece ci sono specie come
Alcyonum palmatum, alcionario presente sui fondi fangosi del Mar Mediterraneo
e Corallium rubrum.
Entrambe le sottoclassi sono caratterizzate da specie coloniali in cui i polipi sono fra loro collegati da tessuto, cenosarco o cenenchima, a sua volta attraversato longitudinalmente da tubuli gastrodermici. Tutta la superficie della colonia risulta rivestita da uno strato di ectoderma che va ad unirsi a quello di ogni singolo polipo, così da far rimanere fuori solo la porzione orale del polipo, retraibile.
Lo sclerasse, come accennato, è lo “scheletro” interno del corallo che, negli ottocoralli, è indispensabile per il sostegno della colonia stessa ed è composto da calcite e scleriti. Il processo di calcificazione avviene in maniera distinta lungo l’asse della colonia.
Agli apici delle ramificazioni il processo di calcificazione consiste primariamente in aggregazione di scleriti; questi possono essere diversi in forma e dimensione in funzione dell’area geografica di provenienza (Bavestrello et al. 1997).
Lungo lo scheletro assiale, invece, il processo di crescita è ad opera degli scleroblasti che calcificano attorno all’asse principale secondo un andamento centrifugo, senza coinvolgere gli scleriti (Allemand et al. 1996).
Esternamente lo sclerasse è coperto da un tessuto, simil spugnoso, forato in prossimità del polo orale di un polipo, il cenenchima. Il margine interno di questo tessuto è attraversato da una serie di solchi longitudinali nei quali alloggiano i tubuli gastrodermici, questi sono a loro volta connessi,
trasversalmente, con le cavità gastrovascolari dei polipi, generando un sistema unico di trasporto delle sostanze alimentari lungo l’intera colonia. L’intensa colorazione rosso accesa, sia dello sclerasse che del cenosarco, che contribuisce a rendere il corallo così prezioso, è data dalla presenza di carotenoidi assunti in parte durante l’alimentazione (Cvejic et al. 2007).
4 5
Fig. 4: frammenti di C. rubrum (tratto da Corail: Lacaze-Duthiers)
1.2 Fauna associata
Le colonie di Corallium rubrum offrono un habitat esclusivo per diversi organismi, che vivono cibandosi e riproducendosi sui rami delle colonie, tra tutti i più comuni sono il mollusco gasteropode Pseudosimnia carnea (Poiret, 1789) (Fig. 6), della famiglia degli Amphiperatidae, e il gamberetto, crostaceo decapode, Ballssia gasti (Balls, 1921)(Fig. 7). Pseudosimnia carnea è un gasteropode che vive sulle colonie dei gorgonacei di cui si nutre e su cui depone le uova (Theodor, 1967; Santangelo e Navarra, 1984). La sua colorazione è tipicamente rossa, probabilmente per l’assunzione dei carotenoidi presenti nello sclerasse, omocromia alimentare (Ghisotti e Melone, 1969). Per quanto riguarda
Ballssia gasti si tratta di un gamberetto palemonide di cui si hanno poche
segnalazioni, (Abbiati & Santangelo,1989; Manconi e Mori, 1990). La sua distribuzione è strettamente correlata a quella di C. rubrum (Garcia Raso, 1984) alle cui colonie è saldamente ancorata e di cui assume la colorazione con un effetto altamente mimetico.
Fig. 6: Pseudosimnia carnea Fig. 7: Ballssia gasti
Quasi certamente la prima, come le altre specie cogeneriche, si nutre del cenosarco e dei polipi del gorgonaceo. E’ invece probabile che il secondo si alimenti asportando il film batterico e il muco presenti sulla superficie della colonia, fungendo così da 'pulitore'. Per quanto riguarda B. gasti è stato visto in
laboratorio che quando questi organismi vengono rimossi dalla colonia, la colorazione, tende rapidamente ad essere perduta, ma viene riacquistata quando il crostaceo torna ad insediarsi sulla colonia. Per quanto riguarda invece P.
carnea, il colore risulta essere di un rosso cupo in ogni situazione. Numerose
altri organismi vivono sopra o in stretta associazione con le colonie di corallo rosso. Un recente studio sui molluschi associati al C. rubrum ha dimostrato come tra le specie più comuni viventi su di esso vi sono esemplari di Muricidae, tra cui l'Ocinebrina paddeui, endemica delle colonie di corallo rosso di Alghero e Coralliophila spp. (Crocetta & Spanu, 2008). Oltre questi possiamo trovare anche altri organismi, come poriferi che possono vivere nelle sue immediate vicinanze (Fig. 9) oppure, come accade per le spugne perforanti, i clionidi, che infestano il suo sclerasse (Fig. 8). Grazie ad analisi microscopiche delle basi delle colonie è stato inoltre possibile identificare alcuni organismi componenti tanatocenosi: esoscheletri di briozoi (47%), tubi di policheti serpuloidei (36,5%) e colonie morte di corallo (10,2%), bivalvi ed Esacoralli erano presenti in percentuali minori (Caforio, 1990).
Fig. 8: Cliona orientalis Fig. 9: Spugne vicine a delle colonie
Nell’ambito della distribuzione batimetrica di Corallium rubrum è possibile distinguere due tipi di popolazioni: quelle più superficiali (10 – 80 m), caratterizzate da colonie dense, di piccole dimensioni e spesso infestate da spugne perforanti (Clionidi) che ne abbassano il valore economico, e quelle più profonde (oltre i 80 metri), caratterizzate da colonie di taglia maggiore meno dense e di maggior pregio economico.
A basse profondità, si trovano con maggiore frequenza colonie a forma arbustosa di piccole dimensioni e con scarse ramificazioni. Talvolta nelle pareti verticali o nelle zone più esposte delle grotte si possono trovare colonie dalla struttura arborescente su di un solo piano. All’interno di cavità, Russo e Cicogna (1996) notano come le ramificazioni tendono ad essere posizionate anche su un numero maggiore di piani.
Da un punto di vista morfologico, le colonie profonde, pescate a scopo commerciale, hanno un’altezza media che varia dai 10 ai 15 cm, evidenziando un diametro della base di 10 –15 mm e un peso medio che si aggira intorno ai 50 – 100 g.
Biologi della Stazione marina di Endoume, presso Marsiglia, hanno rilevato come colonie giovani, non ancora ramificate, incrementino la loro altezza di 4-6 millimetri l'anno, mentre colonie dotate di ramificazioni secondarie avrebbero un allungamento dei rami di 2-5 mm l'anno (Russo e Cicogna; 1996). Peraltro, le informazioni fornite dai corallari sono molto discordanti: alcuni danno un tasso di allungamento annuo dei rami di 1-7 centimetri, altri addirittura di 7-15 centimetri. Tuttavia, anche in questo caso si riscontra una certa variabilità legata alla densità delle popolazioni. Studi demografici in situ, hanno evidenziato che, per effetto della competizione intraspecifica per lo spazio e l'alimento, le colonie di maggiori dimensioni si rinvengono in banchi alquanto radi e, al contrario, popolazioni molto dense sono costituite mediamente da colonie di piccole dimensioni (Rossi et al. 2008). Solo
orientativamente si può proporre l'esempio di un banco con una densità media di 400 colonie per metro quadrato, aventi dimensioni medie di 5-6 centimetri di altezza e 5 millimetri di diametro di base (Russo e Cicogna, 1996).
Nonostante in un passato non troppo lontano fosse possibile rinvenire colonie la cui altezza superava i 50 cm (Garrabou e Harmelin, 2002) ed il cui peso raggiungeva 1 kg (Pax e Muller, 1962), attualmente, a causa dell’elevatissimo sfruttamento commerciale, con picchi negli anni ’60, la maggioranza delle colonie degli stock superficiali ha un’altezza non superiore ai 4-6 cm (Garrabou et al. 2001; Santangelo et al.2003; Tsounis, 2005) ed è assai raro trovare colonie più alte di 20 cm (Garrabou e Harmelin, 2002).
Il corallo rosso è, come già introdotto, un organismo sessile e filtratore passivo; le colonie, quindi, durante la crescita tendono ad assumere forme tali da ottimizzare i processi di cattura dell'alimento da parte dei polipi. La diversa morfologia delle colonie è quindi vincolata anche all'intensità e alla direzione delle correnti portatrici di alimento (Russo e Cicogna, 1996).
Studi condotti su altre specie di gorgonacei, hanno dimostrato come la crescita in altezza delle colonie sia inversamente proporzionale all'intensità del flusso di corrente: pertanto colonie allungate e con ramificazioni sottili sarebbero caratteristiche di ambienti a basso idrodinamismo, mentre colonie tozze e con ramificazioni robuste sarebbero tipiche di ambienti a elevato idrodinamismo. Ancora, la disposizione planare, a ventaglio, delle ramificazioni è di colonie soggette a flussi di corrente unidimensionali, mentre la disposizione in più piani, a cespuglio, la si riscontra in colonie soggette a flussi di corrente bidimensionali (Russo e Cicogna, 1996).
Sebbene numerose ricerche siano state portate avanti sulla biologia e l’ecologia riproduttiva degli ottocoralli (e.g. Grigg 1977; Sebens 1983; Brazeau e Laskjer 1989; 1990; Babcock 1990; West et al. 1993; Coma et al. 1995; Beiring & Laskjer 2000), pochi sono gli studi condotti sulla riproduzione del corallo rosso. Il corallo rosso è una specie longeva, iteropara, gonocorica sia a livello di polipo che di colonia, che si riproduce una volta all’anno durante la stagione estiva (Barletta et al. 1968; Vighi, 1972; Santangelo et al, 2003; Tsounis et al, 2006). La fecondazione è interna così come lo sviluppo della larva. La fecondazione avviene nella cavità gastrovascolare dei polipi femminili, dove si trova l’ovocita maturo. Trascorso il periodo embrionale, che va dai 20 ai 30 giorni, le planule arrivano nello stomodeo del polipo, dove rimangono per alcune ore prima di uscire dalla cavità orale.
Fig. 10: Polipo femminile aperto, si notano le uova perfettamente sferiche a diversi stadi di sviluppo (a). Sacche spermatiche legate alla cavità centrale (b).
La maturazione delle gonadi segue un preciso ciclo stagionale ed avviene in modo diverso nei due sessi.
Per quanto riguarda gli ovociti, essi si sviluppano in un periodo che dura circa due anni e in ogni stagione riproduttiva è possibile riconoscere due
differenti generazioni, una più grande e una di dimensioni minori che non ha ancora raggiunto lo sviluppo finale (fig.10 a).
Le sacche spermatiche hanno invece uno sviluppo annuale che inizia in autunno-inverno e termina durante il periodo estivo (Vighi 1972; Santangelo et
al., 2003; Tsounis et al. 2006) (fig.10 b).
Per quanto riguarda l’aspetto esterno, le uova presentano una forma regolarmente tondeggiante e limitatamente al corallo rosso, e non anche per le paramuricee una colorazione tendente al giallo; la stessa specifica vale anche per le sacche spermatiche, che, invece, sono caratterizzate da una forma irregolare e da una colorazione biancastra, quasi lattiginosa (Fig: 10; Lacaze - Duthiers 1864; Vighi 1972).
La grandezza degli ovociti e delle sacche spermatiche tende ad aumentare con l’avvicinarsi del periodo di riproduzione (Santangelo et al., 2003; Tsounis
et al. 2006). Nel corso di uno studio condotto su diverse popolazioni lungo la
Costa Brava, Spagna Orientale, è stato dimostrato che il diametro degli ovociti e delle sacche spermatiche varia tra 500 e 900 µm (Tsounis et al. 2006). In questo intervallo ricade anche il diametro medio degli ovociti rilevato da Santangelo et
al. (2003) per la popolazione di Calafuria.
Sia le gonadi femminili che quelle maschili sono immerse nei tessuti del setto mesenterico e si separano da questi non appena raggiungono la maturità. 1.5 Ciclo vitale
Nonostante la riproduzione asessuale sia un tipo di riproduzione comune negli antozoi (Jackson 1986; Karlson 1986) ad oggi non è stata accertata la riproduzione asessuale nel corallo rosso (Santangelo & Abbiati 2001) quindi, il reclutamento, l’apporto cioè di nuovi individui ad una popolazione naturale
tramite riproduzione è considerato prodotto della riproduzione sessuale (Fig. 11).
La larva, lecitotrofica, è una planula caratterizzata da una forma allungata, molto simile a quella di una clava, presentante una colorazione bianca ed è fornita di ciglia. Appena emessa nella colonna d’acqua, la planula mostra una certa indifferenza alla luce ed un comportamento geotattico negativo, che diviene positivo prima dell’insediamento (Weinberg, 1979). La durata del periodo di vita libera in natura della larva non è ancora nota; in laboratorio varia dai 4 ai 12 giorni, dopodiché la planula si fissa al substrato e metamorfosa in un piccolo polipo; tale trasformazione avviene in un mese e, dopo 15 giorni, appaiono le prime spicole. Nell’arco di 30 giorni è possibile verificare la prima scissione agamica; la colonia si accresce tramite riproduzione asessuata.
Come tutte le larve degli invertebrati marini sessili, anche la planula del
Corallium rubrum ha bisogno di particolari condizioni per l’insediamento. Studi
portati avanti in acquario hanno messo in evidenza una netta preferenza della larva per substrati coralligeni, con basse percentuali di insediamento su vetro e plexiglass (Chessa et al.1992), mentre studi svolti in situ su substrati artificiali, in ambiente naturale, hanno mostrato una preferenza per marmo, di composizione chimica simile al carbonato di calcio del coralligeno, rispetto a cotto e PVC (Bertuccelli 1999, Bramanti et al. 2005, 2007).
1.6 Alimentazione
Il corallo rosso mediterraneo presenta un’alimentazione di tipo sospensivoro passivo (suspension feeders); si alimenta di organismi planctonici e particolato organico, che filtra nella colonna d’acqua grazie ai tentacoli, ricoperti da muco, che permettono la cattura delle particelle. I tentacoli possono allungarsi e dare origine ad un filamento lungo fino a tre volte il tentacolo stesso. Durante la cattura il filamento si contrae e si accorcia, avvolgendosi a spirale intorno alla particella alimentare (Abel 1970).
La dieta di Corallium rubrum si compone principalmente di POM della colonna d’acqua, di cui fanno parte organismi appartenenti al nanoplancton e al picoplanton nonostante sia in grado di assorbire anche la sostanza organica disciolta (DOM) (Picciano e Ferrier-Pagès, 2006; Tsounis et al. 2006).
Una volta che i tentacoli hanno attirato le particelle alimentari al polo orale del polipo, selezionano la particella e “decidono” se ingerirla o disfarsene. Tutta la colonia ha in comune un unico sistema gastrovascolare che permette ai diversi polipi di alimentarsi anche se non direttamente coinvolti nell’attività di filtrazione. Non possedendo una apertura anale, tutte le sostanze non assimilate e i prodotti di scarto vengono espulsi attraverso il disco orale.
1.7 Distribuzione
Il corallo rosso è una specie endemica del Mediterraneo (Fig. 12) presente nei popolamenti sciafili di substrato duro delle biocenosi coralligene e di grotte semioscure (Pérès e Picard 1964) fino a 600 metri di profondità.
Fig 12: cartina della distribuzione del C.rubrum
La specie è presente in tutto il Mediterraneo mentre al di fuori del medesimo, la sua presenza è stata segnalata alle Isole Canarie, nella parte
meridionale del Portogallo, nell’arcipelago di Capo Verde, in Mauritania e in Senegal (Barletta et al. 1968) (Fig. 13).
Fig 13: cartina della distribuzione del C. rubrum nella coste atlantiche africane
La presenza di Corallium rubrum è influenzata da diversi fattori ambientali quali la luminosità, la temperatura e l’esposizione alle correnti (Laborel e Vacelet, 1961; Marchetti, 1965; Stiller & Rivoire, 1984).
Il corallo rosso troverebbe condizioni ottimali di vita ad un'irradianza relativa compresa tra il 2, 1 e l'1 per cento (ma tollera valori tra lo 0, 01 e l'1, 1 per cento) di quella presente alla superficie del mare in un giorno soleggiato; questi valori si riscontrano generalmente ad una profondità compresa tra 40 e 80 metri, in acque abbastanza limpide (Laborel e Vacelet 1961, Marchetti 1965, Stiller & Rivoire 1984). È probabile, infatti, che il corallo prediliga habitat caratterizzati da un delicato equilibrio fra la quantità di particellato presente nell'acqua, che deve essere sufficiente al sostentamento alimentare delle colonie, e il regime idrodinamico, che deve essere abbastanza elevato per mantenere il
particellato in sospensione, evitando una eccessiva sedimentazione con conseguente soffocamento dei polipi. Studi su differenti popolazioni superficiali indicano la loro vulnerabilità alla mortalità a causa dell’innalzamento della temperatura dell’acqua (Garrabou et al. 2001; Bramanti et al. 2005; Santangelo
et al. 2007). La maggior parte degli studi su C. rubrum sono focalizzati sulle
popolazioni superficiali e, per quanto riguarda le coste italiane, le uniche popolazioni studiate in dettaglio, sono quelle di Portofino (Genova) e Calafuria (Livorno) (Abbiati et al, 1993; Catteneo-Vietti et al, 1993; Santangelo et al. 2004; Costantini et. al, 2007). I dati sulle altre popolazioni superficiali italiane sono scarsi e frammentari e, per ovviare a questa carenza di dati il nostro gruppo di ricerca, in collaborazione con SSI Italia, ha organizzato un censimento delle popolazioni di corallo rosso delle coste italiane utilizzando l’aiuto dei subacquei sportivi. I primi risultati mostrano che popolazioni di corallo rosso sono presenti ben distribuite lungo tutta la costa occidentale italiana.
1.8 Pesca e morie
Il Corallium rubrum è una specie che è stata sfruttata fin dai tempi più antichi; la storia del corallo rosso si interseca con quella umana già nel periodo Neolitico e da allora la fama e l’apprezzamento per questo organismo sono aumentati con il susseguirsi delle epoche e delle civiltà. Sumeri, Greci e Romani utilizzavano il corallo rosso come gioiello ed amuleto e tutt’oggi viene utilizzato per la produzione di monili e oggetti decorativi a cui nel passato venivano attribuiti poteri magici – apotropaici, virtù farmaceutiche e valenza religiosa.
Tipicamente il corallo rosso veniva pescato con la croce di S. Andrea, o ingegno, uno strumento composto da barre di ferro incrociate e da una rete (Fig. 14); questo strumento risulta altamente distruttivo in quanto, trainato da un’imbarcazione, raschia le pareti sottomarine e il substrato, strappando le
colonie di corallo e danneggiando i fondali. L’uso di questo strumento è stato proibito, dalla comunità europea, nel 1994 in tutta Europa.
Fig. 14: Croce di Sant’ Andrea
Fig 15: primordiale attrezzatura da sommozzatori per la pesca del corallo (Venezia, 1768 - 1778. - Incisore: anonimo)
Negli anni ’60, con la facile fruibilità dell’immersione ad aria, sommozzatori, professionisti e non, hanno effettuato un prelievo incontrollato, principalmente a carico delle popolazioni superficiali, più facilmente raggiungibili, provocandone un intenso declino. A causa del massiccio prelievo, il corallo rosso superficiale è praticamente scomparso lungo tutto l’arco Ligure, (fatta eccezione per popolamenti superficiali come quello di Portofino;
Marchetti 1965), nell’Arcipelago Toscano si sono quasi completamente esaurite le popolazioni di interesse commerciale e negli ultimi 15 anni la quantità del corallo pescato in tutto Mediterraneo è diminuita del 66% (Santangelo et al. 2001). Nella regolamentazione della pesca del corallo rosso nel Mediterraneo, grande importanza riveste il decreto numero 792/29 del 15 aprile 2009 emanato dalla regione Sardegna. Il decreto regola caratteri salienti quali il periodo di pesca, che va dal 1 maggio 2009 al 15 ottobre 2009; il numero di autorizzazioni rilasciate, pari a 30 esclusivamente a pescatori professionisti, titolari di autorizzazione regionale, ma in particolare il divieto di prelievo entro gli 80 m di profondità, così da preservare le popolazioni superficiali.
Rispetto al decreto del 2008 vanno evidenziate due modifiche di grande importanza quali l’estensione del periodo di pesca di un mese e l’aumento di 10 autorizzazioni. Questo allargamento in tempi e quantità è derivato dai dati confortanti forniti dal dipartimento di biologia animale ed ecologia della Università di Cagliari, da cui risulta che la regolamentazione fatta negli anni dalla regione Sardegna per la pesca del C. rubrum ha prodotto effetti benefici sullo “stato della risorsa”, determinando un miglioramento dei parametri biometrici della risorsa stessa.
Come già introdotto, negli ultimi decenni, una minaccia alla distribuzione e allo stato di salute delle popolazioni di corallo rosso superficiale, è rappresentata dal riscaldamento climatico globale.
Nell’estate del 1999 e del 2003, alcune popolazioni superficiali di C.
rubrum del Mediterraneo occidentale sono state colpite da eventi di moria di
massa che hanno interessato anche altri invertebrati sessili, tra i quali altri gorgonacei come Eunicella cavolini, Eunicella singularis e Paramuricea
clavata. Le morie sono state registrate a partire dal mese di agosto e si sono
al Golfo di Genova, e si protrae fino al Golfo di Marsiglia (Perez et al. 2000; Garrabou et al. 2001; Linares et al. 2005; Coma et al. 2006; Cupido et al. 2008). Questo fenomeno si è verificato contemporaneamente ad un aumento della temperatura dell’acqua ed ad un abbassamento anomalo del termoclino, che ha interessato le acque del Mediterraneo nord occidentale (Perez et al. 2000; Romano et al. 2000). In particolare a 20 metri di profondità è stato registrato un aumento di circa 6°C rispetto all’anno precedente (da 17.3°C nel 1998 a 23.1°C nel 1999), temperature superiori ai 20°C si sono registrate fino a 40 metri e il termoclino si è abbassato dai 20 ai 40 metri di profondità. Anomalie di questa entità hanno provocato degli stress fisiologici e dato la possibilità ad agenti patogeni di proliferare con facilità (Cerrano et al. 2000; Coma et al. 2006).
Simulazioni effettuate sulla base di modelli demografici indicano che l’effetto sinergico del prelievo e del riscaldamento dell’acqua potrebbero portare alcune popolazioni superficiali all’estinzione (Santangelo et al. 2007)
1.9 Storia della ricerca
Le prime descrizioni di Corallium rubrum risalgono al 300 a.C. (Weinberg S.), dove Teofrasto definisce il corallo rosso “come somigliante ad
una radice che cresce nel mare” e Ovidio nelle sue Metamorfosi ne parla come
di una “molle erba marina che indurisce a contatto con l’aria”. Dal primo secolo a.C. fino al Rinascimento nessuna descrizione fornì nuovi dettagli, sebbene nel periodo rinascimentale alcuni autori cercarono di verificare la consistenza molle del corallo vivente. Tuttavia la comunità scientifica iniziò a interessarsi realmente al corallo rosso tra la fine del XVII e l’inizio del XVIII secolo. Tra l’ultimo trentennio del 1600 e la metà del 1700 gli studiosi discussero a lungo se la natura del corallo rosso fosse minerale, vegetale o
animale, fino a che nel 1784 Carlo Linneo lo collocò (denominandolo successivamente Gorgonia nobilis, Linneo, 1789) nel regno animale insieme a quegli organismi da lui precedentemente definiti zoofiti (Plantae vegetantes
floribus animates) sotto il taxa Vermes. Il nome C. rubrum fu utilizzato per la
prima volta nel 1816 da Lamark, e nel 1821 Lamouroux affermò l’endemicità mediterranea della specie: “è solo nel Mediterraneo che cresce il più prezioso di
tutti i polipi.” Ma è nel 1864 che venne pubblicata l’ultima parola sul C. rubrum, la superba monografia Histore naturelle du Corail di Henri
Lacaze-Duthiers. Nella sua opera il naturalista francese fornì una dettagliata descrizione, esatta e moderna, della distribuzione geografica, dell’ecologia, dell’anatomia dei polipi e del cenosarco, degli scleriti dello scheletro, della riproduzione della specie ed anche della pesca in Algeria, delle industrie e del commercio ad esso collegati. Dopo questa pubblicazione l’interesse scientifico per il corallo rosso scemò. Nella prima metà del ventesimo secolo la ricerca venne interrotta e ricominciò dopo la seconda guerra mondiale, ricevendo nuova linfa dalla nascita della subacquea e da Pierre Drach, che nel 1948 sviluppò nuove tecniche di osservazione adatte alle scienze marine. Dal dopo guerra fino agli anni ’80 diversi autori (Laborel & Vacelet 1958; 1961) Laubier (1966), Barletta, Marchetti & Vighi (1968), Vighi (1970; 1972) Gamulin-Brida (1974) Carpine & Grasshoff (1975) e Weinberg (1975, 1978, 1979, 1980), studiarono in situ le caratteristiche biologiche del corallo rosso. Tra queste ricordiamo gli studi di Vighi sul ciclo riproduttivo di C. rubrum, e quelli sull’Habitat di Laborel & Vacelet precisate successivamente da Weinberg che condusse anche alcuni esperimenti in situ, riguardanti il tasso di crescita, la tolleranza al cambiamento dei parametri fisici in seguito a trapianto e in laboratorio per indagare sul comportamento delle planule. Nel 1975 (Carpine & Grasshoff) furono pubblicate le prime fotografie degli scleriti di C. rubrum effettuate utilizzando il microscopio a scansione elettronica (SEM). In seguito al massiccio sfruttamento
del corallo, dagli anni ’80 si iniziarono a sviluppare nuove tecniche e studi spesso legati alla conservazione e alla gestione della specie tra cui molti studi sulla dinamica di popolazione (Santangelo et al.1993).
1.10 Dinamica delle popolazioni naturali
Lo studio della dinamica di popolazione ha un ruolo fondamentale in ecologia. In natura, infatti, le popolazioni non sono in grado di mantenere la loro dimensione inalterata nel tempo e nello spazio e tutte quelle che vengono studiate sono soggette a continui cambiamenti. Questi processi possono avvenire molto lentamente o in tempi relativamente brevi, con conseguenze di vario tipo per la singola popolazione. La demografia di una popolazione è basata su due caratteristiche degli organismi viventi:
1)Nascita;
2)Sopravvivenza (Ebert, 1999).
I primi studi di demografia, intesi come studio sistematico delle relazioni tra nascite, morti e migrazioni, risalgono al XVII secolo, quando si iniziarono ad usare i registri delle nascite e delle morti per descrivere le popolazioni umane (Graunt, 1662; Halley, 1693 a, b; dati riportati da Fenchel, 1987) e per cercare di studiare e prevedere le variazioni nel numero di individui (Bertuglia e Vaio, 2003). Nel 1798 Thomas Robert Malthus introdusse il modello esponenziale di crescita, basato su un’equazione differenziale lineare, che prevedeva una crescita indefinita delle popolazioni. Una crescita di questo tipo, il cui valore istantaneo è dato dal tasso intrinseco di accrescimento “r”, si può verificare solo in condizioni ottimali, ovvero in un ambiente in cui lo spazio e le risorse non siano fattori limitanti. Condizioni di questo tipo sono molto rare per le popolazioni naturali, sia perché intervengono fattori ambientali che si possono opporre alla crescita, sia perché la maggior parte degli organismi viventi si
riproduce in un determinato periodo dell’anno e il periodo riproduttivo, in cui la popolazione aumenta, è seguito da un declino causato dalla mortalità e dalle emigrazioni.
Nel 1838 Verhulst introdusse il modello demografico logistico, non lineare, che permise di descrivere la crescita non esponenziale dell’abbondanza numerica verso un livello di saturazione (Verhulst, 1845). L’equazione logistica dN/dt=rN(1-N/K), descrive l’accrescimento continuo di una popolazione attraverso una curva sigmoide caratterizzata da una prima fase di crescita esponenziale, seguita da un rallentamento che tende all’asintoto y=K (capacità portante). Il numero d’individui di una popolazione non può crescere oltre un certo valore K, definito come il numero massimo di individui che un ambiente può sopportare. Sopra tale valore la dimensione della popolazione tende a diminuire (Ricklefs,1997). I concetti elaborati nel campo della demografia umana possono essere ritenuti validi per tutte le popolazioni naturali, fatto che ha permesso anche agli ecologi di utilizzare gli strumenti messi a disposizione da questa disciplina.
I modelli demografici consentono di effettuare proiezioni dell’andamento della popolazione nel tempo e rappresentano quindi uno strumento valido per studiare le popolazioni di specie a rischio e sovrasfruttate come il corallo rosso. La dinamica di una popolazione risente della struttura sessuale della popolazione stessa: piccole differenze nella sex ratio o nell’età della maturità sessuale, possono portare ad enormi differenze nel successo riproduttivo e, quindi, nell’andamento della popolazione nel tempo.
Uno degli strumenti più utilizzati per lo studio della dinamica di popolazione sono le “life tables”, cioè tabelle che riassumono le caratteristiche del ciclo vitale di una popolazione. Una “life table” viene quindi costruita utilizzando i dati sulla mortalità, natalità e struttura sessuale di una popolazione. Esistono due tipi di life tables :
-Life tables per coorte (classe di età): una singola coorte di individui viene seguita dalla nascita alla morte dell’ultimo sopravvivente. Questa metodologia è molto accurata, in quanto permette di ottenere la stima effettiva della mortalità; tuttavia richiede lunghi periodi di tempo in quanto direttamente proporzionale alla durata del ciclo vitale della specie esaminata, quindi di difficile impiego per lo studio di organismi mobili e/o longevi.
-Life tables statiche: si riferiscono alla struttura di età di una popolazione in uno specifico momento In questo tipo di life tables la mortalità risulta dalla stima della differenza fra il numero di individui in una classe di età e quello nella classe successiva. In tal modo si possono ottenere istantaneamente i dati sulla sopravvivenza di tutte le classi di età da cui è formata la popolazione. Questa metodologia può essere però utilizzata solamente nell’ipotesi in cui l’età degli individui sia conosciuta o possa essere ricavata da indici attendibili come, nel caso degli ottocoralli, dalla sclerocronologia.
Nel caso di specie iteropare, (specie con più eventi riproduttivi nel corso della vita), con generazioni parzialmente sovrapposte, la costruzione di “life tables” risulta più complessa a causa della contemporanea presenza di recruits, giovani ed adulti. Queste difficoltà sono attenuate nel caso in cui vengono studiati organismi sessili che possono essere mappati, fotografati o marcati (Beagon, 1986).
Dalle “life tables” è possibile costruire le curve di sopravvivenza che possono essere considerate come una rappresentazione grafica della probabilità di sopravvivenza fino a diverse età (Beagon, 1986). Quando il tasso di mortalità decresce la curva è concava; quando invece il tasso di mortalità è all’incirca costante, la curva di sopravvivenza è rettilinea; infine, quando il tasso di mortalità cresce la curva è convessa. Secondo la classificazione di Pearl (1928) le tre curve sono definite rispettivamente di “tipo I”, di “tipo II” e di “tipo III” (Fig. 16). In pratica, però, la maggior parte delle specie, nel corso della vita, non
presenta un unico tipo di curva, ma una successione di forme che cambiano in base al periodo di analisi.
Fig.16: Classificazione delle curve di sopravvivenza (Beagon et al., 1989).
Un altro modo per determinare il tasso di crescita e i tassi di riproduzione di una popolazione, è quello di utilizzare le matrici di Leslie-Lewis, che permettono di proiettare una classe di età alla classe successiva (Ebert 1999, Ricklefs, 1997). Il modello di Leslie-Lewis è in grado di fornire una descrizione di popolazioni che si riproducono in periodi fissi e limitati dell’anno.
I dati contenuti nelle life tables insieme alle matrici di transizione di Leslie-Lewis, costituiscono la base per l’elaborazione di modelli matematici che permettono di valutare lo stato attuale di una popolazione e di ipotizzare l’andamento della stessa in futuro, anche in seguito a forti stress (Ebert 1999, Beissinger and McCullough 2002).
I modelli demografici vengono molto utilizzati, soprattutto nel campo della biologia della conservazione per studiare le popolazioni a rischio di estinzione o sovrasfruttate (vedi corallo rosso), nonché per monitorare lo stato di salute della popolazione stessa; diagnosticare le cause di situazioni anomale
(sovrasfruttamento, cambiamenti climatici, etc.) al fine di suggerire interventi idonei per la gestione, nel suo complesso, della risorsa stessa (Fujiwara & Caswell 2003; Santangelo et al. 2007; Bramanti et al. 2009).Va quindi evidenziato come conoscenze appropriate sulla biologia riproduttiva siano essenziali e fondamentali per comprendere le dinamiche di popolazione degli organismi marini (Santangelo 2003).
1.11 Scopo della tesi
La presente tesi si inserisce in un più ampio lavoro di demografia di due popolazioni superficiali di Corallium rubrum. Come già introdotto, diverse popolazioni di corallo rosso superficiale hanno subito o subiscono un prelievo da parte di pescatori, ma questo prelievo non è regolamentato sulla base di studi specifici di gestione.
Attraverso l’analisi dei parametri demografici, è invece possibile ottenere modelli e proiezioni dello stato delle popolazioni nel tempo e comprendere quindi gli interventi più appropriati alla conservazione di ciascuna popolazione in base alle specifiche caratteristiche.
A fianco alla necessità di creare opportuni modelli di gestione c’è l’esigenza di sviluppare appropriati strumenti di raccolta dati, relativi alla struttura della popolazione, basandosi su leggi di crescita e caratteri morfologici delle colonie, evitando campionamenti impattanti e fornendo pratici metodi di stock assessment.
A tal fine in questa tesi sono stati raccolti dati relativi a parametri morfologici per le colonie di due distinte popolazioni superficiali e messi in relazione con l’età e con i parametri riproduttivi.
2. MATERIALI E METODI
2.1 Aree di studio
Le due popolazioni superficiali di corallo rosso mediterraneo investigate sono quella di Portofino (Genova, Italia, 44°18’15”N, 09°12’27” E) e quella di Cap de Creus (Costa Brava, Spagna, 42°20’1” N, 03°16’30” E) (Fig. 17).
Fig. 17: Posizione delle due aree di prelievo dei campioni
Il Promontorio di Portofino (Fig. 18), dista da Genova circa 36 km, e si estende per 6 miglia nautiche a Ovest del golfo del Tigullio ed a Est del Golfo Paradiso. Dal 1999 in quest’area è stata istituita l’Area Marina Protetta (AMP) di Portofino. La falesia del Promontorio di Portofino è un’area della Liguria in cui è registrata la presenza di un importante popolamento di corallo. Il primo censimento di corallo rosso in quest’area è stato svolto da Tortonese (1958;
1961). Studi condotti in periodi successivi evidenziano i suoi massimi valori di densità di corallo a 40 m di profondità con valori compresi tra 200 e 800 colonie/m2 (Cattaneo Vietti et al.1993). Le immersioni atte al campionamento
sono state fatte nei siti scelti in maniera casuale di Grotta gamberi, Grotta di Marcante, Testa del Leone ed Altare.
La pesca del corallo rosso è vietata in assoluto in ogni zona.
Fig.18: immagine satellitare di Portofino.
Cap de Creus (Fig. 19) è una penisola nella parte nord occidentale della Costa Brava, al confine con la Francia. Area Marina Protetta dal 1999, Cap de Creus si estende per 10787 ettari in terra e per 3073 ettari in mare, per un totale di 40 km di costa. Questa penisola può essere considerata come la zona a
maggior prelievo di corallo rosso lungo la Costa brava. In quest’area, infatti, la raccolta del corallo rosso è regolamentata ed esclusiva per i pescatori in possesso di licenza attiva. Il numero delle licenze è modesto, 7 - 11, ma sempre più frequente è la pesca di frodo. Il periodo di pesca parte all’inizio di Maggio e, la quantità di risorsa pescata in questa zona oscilla tra le 0, 8 – 1, 7 t all’anno. Le popolazioni oggetto di prelievo sono quelle superficiali, (30 – 50 m), e durante ogni immersione un pescatore raccoglie 0, 5 – 2 kg di corallo rosso (Tsounis et al.2007). I dati sono stati raccolti in quattro differenti siti scelti casualmente all’interno della zona di Cap de Creus: Furallon de Culip, Les Ielles, Caialles e Forcats.
2.2 Metodi di campionamento
Il campionamento è basato su un modello sperimentale multifattoriale per ANOVA: Area Geografica, con due livelli Portofino e Cap de Creus, random; Sito, gerarchizzato nel fattore Area Geografica, con quattro livelli (Sito 1, 2, 3, 4). Per ciascuna area geografica, in ciascun sito, sono stati campionati tre quadrati da 400 cm2, nel mese di giugno 2008 a una profondità compresa tra 30
e 35 m. Per ogni quadrato sono state scattate quattro fotografie delle colonie adulte, dopodiché queste sono state prelevate selettivamente con l’ausilio di martello e scalpello. Successivamente la stessa superficie è stata fotografata con sottoquadrati da 10 cm x 10 cm per stimare il numero di reclute. Le fotografie sono state fatte con una macchina fotografica digitale Canon G10 equipaggiata con scafandro Ikelite e flash TTL Ikelite. Nel corso delle operazioni di grattaggio sono state raccolte solo colonie di corallo rosso così da rendere quanto più possibile minimi i danni al substrato coralligeno. Dopo il prelievo le colonie sono state conservate in barattoli contenenti formalina al 4% in acqua di mare, per poter poi effettuare le successive analisi di laboratorio. Durante le immersioni sono state utilizzate miscele NITROX 32 che, rispetto all’aria, permettono tempi di immersioni più lunghi.
2.3 Struttura di popolazione 2.3.1 Densità
Lo studio della densità degli individui adulti è stato eseguito grazie all’analisi delle fotografie ottenute prima del grattaggio di ogni singolo quadrato e anche grazie al conteggio delle colonie presenti in ogni barattolo. La densità delle reclute è stata stimata sempre grazie alle fotografie scattate però dopo il
grattaggio. I dati sono stati raccolti secondo il disegno sperimentale prima citato e analizzati utilizzando il sistema della analisi della varianza (ANOVA).
2.3.2 Distribuzione di frequenza della taglia delle colonie
Al fine di ottenere dati sulla struttura di taglia della popolazione le colonie sono state divise in classi per ciascun descrittore considerato: diametro (1 mm), altezza (10 mm), peso (0.5 g) e numero di ramificazioni.
2.4 Analisi dei parametri morfologici
Ai rami di ogni colonia è stato assegnato un ordine crescente procedendo dalla base verso l’apice (i rami originati da uno stesso punto di internodo appartengono allo stesso ordine) e, per ciascun ordine, è stato contato il numero di rami. Per ogni ramo è stato contato il numero di polipi ed infine ad ogni colonia è stata assegnata una sigla per il riconoscimento (Fig. 20).
Fig. 20: schema degli ordini di ramificazione di una colonia di C. rubrum Internodo
L’analisi di tutte le colonie di C. rubrum è stata fatta grazie all’impiego di uno stereomicroscopio con un ingrandimento da 20 a 40 X. Per effettuare poi le analisi sui polipi, si è utilizzato un bisturi per incidere il cenosarco attorno al singolo polipo così da rendere possibile il sollevamento di quest’ultimo per poter analizzare la cavità gastrovascolare all’interno della quale, in vicinanza dei setti mesenterici, è possibile rinvenire le gonadi dell’animale, come accennato in precedenza. Ogni colonia è stata analizzata in laboratorio utilizzando la seguente metodologia: in ogni singola colonia è stata effettuata la conta di tutti i polipi presenti su ogni ramo. Tutti i rami sono stati suddivisi in tre differenti sezioni: base; centro; apice. In ogni ramo e per tutti i segmenti sono stati analizzati tre polipi nelle colonie caratterizzate da una morfologia pluriramificata, mentre sono stati analizzati 5 polipi in quelle uniramate.
Per il riconoscimento del sesso di ogni singolo individuo si è analizzato la prima gonade trovata nella colonia al microscopio ottico (con un ingrandimento massimo di 100 X). Nel caso in cui, dopo l’analisi di tutti i polipi, nessuna gonade venisse rivenuta, la colonia era dichiarata sterile. Dopo la determinazione del sesso si è proseguito ad analizzare solo i polipi delle colonie femminili, contando gli ovociti trovati all’interno di ciascun polipo.
Per ogni colonia, sia maschile che femminile, sono state prese diverse misure: il diametro a 0.5 cm dalla base (± 0.05 mm) e l’altezza dalla base alla ramificazione più distale (± 0.05 mm) sono stati misurati con un calibro di precisione mentre il peso è stato misurato con una bilancia di precisione (± 0.01g)
2.4.1 Analisi delle ramificazioni
colonia e i parametri morfologici: diametro, altezza, peso e numero di polipi. Dall’analisi delle colonie in laboratorio è emerso che alcune presentavano dei rami staccati accidentalmente. Per le relazioni il tra numero di rami con il diametro e con l’altezza, si è proceduto considerando tutti i rami, compresi quindi quelli spezzati. Per le relazioni con il peso e il numero di polipi si sono comunque utilizzate tutte le colonie sottraendo al numero totale di rami quelli mancanti, denominati a questo scopo, rami effettivi.
La significatività della correlazione tra le variabili esaminate è stata valutata col test di Pearson, dopo aver verificato che i dati rispettassero l’assunto della normalità.
2.4.2 Fertilità e fecondità
Per stimare la fertilità delle colonie e la fecondità dei polipi sono stati contati gli oociti. La fertilità viene definita come la percentuale di polipi fertili all’interno della colonia dove, per polipo fertile, si intende un polipo che contiene almeno un oocita. La fecondità è stata stimata in base al numero di oociti prodotti da ogni polipo fertile. Fertilità e fecondità delle colonie femminili sono state confrontate nelle due aree esaminate e messe in relazione con il numero delle ramificazioni.
3.1 Struttura di popolazione 3.1.1 Densità
In totale sono state prelevate e analizzate, in una area di 400 cm2 , 620
colonie adulte di cui 477 per Portofino e 143 per Cap de Creus per un valore di densità media a Portofino di 39.75 ± 4.55 ind/400 cm2 (±err. st.) e di 11.92 ±
1.44 ind/400 cm2 (±err. st.) per Cap de Creus (rapporto d’analisi di 4 a 1 tra
Portofino e Cap de Creus)(Fig. 21).
Fig. 21: densità degli individui adulti nelle due aree geografiche (PTF: Portofino; CDC: Cap de Creus)
Questa differenza di densità, a favore della popolazione ligure, è altamente significativa (ANOVA a una via P = 0.0066).
Anche per le reclute è presente una marcata differenza nel numero di individui tra le due aree geografiche; i valori variano infatti tra 17.54 ± 4.10
ind/400 cm2 (±err. st.) a Portofino e di 5.65 ± 1.64 ind/400 cm2 (±err. st.) per
Cap de Creus (Fig. 22)
Fig. 22: densità delle reclute nelle due aree geografiche (PTF: Portofino; CDC: Cap de Creus)
Il reclutamento a Portofino è cinque volte superiore che a Cap de Creus (ANOVA a una via P = 0.0007)
3.1.2 Taglia frequenza
Per quanto riguarda le classi di diametro le due popolazioni presentano distribuzione simile, anche se si può notare una maggior percentuale di reclute nella popolazione di Portofino e una maggior presenza di individui di classe 4 a Cap de Creus (Fig. 23)
Fig. 23: frequenza percentuale degli individui per classi di diametro (1 mm) nelle due aree geografiche (in blu: Portofino; in rosso: Cap de Creus)
La distribuzione della classi di altezza presenta moda differente tra le due popolazioni, infatti la classe di altezza più frequente è quella compresa tra 21 e 30 mm a Portofino, mentre a Cap de Creus sono più frequenti colonie di maggior altezza, 31 – 40 mm, ma mancano totalmente colonie inferiori ai 20 mm (Fig. 24)
Fig. 24: frequenza percentuale degli individui per classi di altezza (10 mm) nelle due aree geografiche (in blu: Portofino; in rosso: Cap de Creus)
La distribuzione delle classi di peso delle due popolazioni presenta un andamento a curva monotona (Fig. 25)
Fig. 25: frequenza percentuale degli individui per classi di peso (0.5 g) nelle due aree geografiche (in blu: Portofino; in rosso: Cap de Creus)
A Portofino la popolazione è equamente distribuita tra le classi di ramificazione considerate, anche se si può notare una scarsa presenza di ramificazioni non dicotomiche, corrispondenti alle classi 2, 4, 6, 8. Nella popolazione di Cap de Creus le colonie sono principalmente composte da tre ordini di rami, anche se comunque tutte le classi di ramificazione sono rappresentate (Fig. 26)
Fig. 26: frequenza percentuale degli individui per numero di ramificazione nelle due aree geografiche (in blu: Portofino; in rosso: Cap de Creus)
3.2 Analisi dei parametri morfologici 3.2.1 Analisi delle ramificazioni
In Fig. 27 è illustrata la relazione esponenziale ottenuta tra il numero delle ramificazioni e il diametro per le colonie della popolazione di Portofino.
y = 2.7379x0.2569 R2 = 0.4483 0 1 2 3 4 5 6 7 8 9 10 0 10 20 30 40 50 numero ramificazioni d ia m e tr o ( m m )
Fig. 27: Rappresentazione della relazione tra il numero delle ramificazioni ed il diametro (mm) per la popolazione di Portofino. (P < 0.01; N = 422)
Anche per la popolazione di Cap de Creus è presente una relazione esponenziale tra il diametro ed il numero di ramificazioni (Pearson's correlation: 0.61; P < 0.05; Fig 28). y = 2.9822x0.1876 R2 = 0.4085 0 1 2 3 4 5 6 7 8 9 10 0 10 20 30 40 numero ramificazioni d ia m e tr o ( m m )
Fig. 28: : Rappresentazione della relazione tra il numero delle ramificazioni ed il diametro (mm) per la popolazione di Cap de Creus (P < 0.01; N = 136)
ramificazioni e l’altezza delle colonie esaminate per la popolazione di Portofino y = 20.487x0.3755 R2 = 0.4784 0 20 40 60 80 100 120 0 10 20 30 40 50 numero ramificazioni a lt e zz a ( m m )
Fig. 29: Rappresentazione della relazione tra il numero delle ramificazioni e l’altezza delle colonie (mm) per la popolazione di Portofino (P < 0.01; N = 422)
La relazione per la popolazione di Cap de Creus, relativa ai parametri numero di ramificazioni vs altezza, è rappresentata in Fig. 30.
y = 24.175x0.2842 R2 = 0.4353 0 20 40 60 80 100 120 0 10 20 30 40 numero ramificazioni a lt e zz a ( m m )
Fig. 30 Rappresentazione della relazione tra il numero delle ramificazioni ed l’altezza (mm) per la popolazione di Cap de Creus (P < 0.01; N = 136)
In fig. 31 e 32 sono rappresentate le relazioni tra il numero di ramificazioni e la biomassa rispettivamente per le popolazioni di Portofino e Cap de Creus.
y = 0.4399x0.6455 R2 = 0.4468 0 2 4 6 8 10 12 14 0 10 20 30 40 numero ramificazioni p e s o ( g )
Fig. 31 Rappresentazione della relazione tra il numero delle ramificazioni ed il peso (g) per la popolazione di Portofino (P < 0.01; N = 422) y = 0.3095x0.8436 R2 = 0.5666 0 2 4 6 8 10 12 14 0 10 20 30 40 50 numero ramificazioni p e s o ( g )
Fig. 32 Rappresentazione della relazione tra il numero delle ramificazioni ed il peso (g) per la popolazione di Cap de Creus (P < 0.01; N = 136)
3.2.2 Fertilità e fecondità
In Fig. 33 sono riportati i valori di fertilità % media e di fecondità media per numero di ramificazioni nella popolazione di Portofino, calcolati su un totale di 189 individui di sesso femminile.
Fig. 33: fertilità media % e fecondità media (± dev.st) per la popolazione di Portofino
Entrambi i parametri considerati presentano variazioni casuali tra i diversi livelli di ramificazione.
I risultati per la popolazione di Cap de Creus sono riportati in Fig.34 e sono il risultato di 34 individui femminili campionati.
Fig. 34: fertilità media % e fecondità media (± dev.st) per la popolazione di Cap de Creus
Per la popolazione di Cap de Creus invece si può notare un andamento molto variabile tra le ramificazioni dei parametri considerati, in particolare in corrispondenza del numero di ramificazioni 2, 8 e 14 a causa di assenza di campioni per tali classi.
Per quanto concerne la struttura di popolazione i risultati mostrano come la densità sia estremamente differente tra le due aree geografiche, con rapporto di 4:1 per la popolazione di Portofino. Tale risultato potrebbe imputarsi all’effetto del prelievo, che a Cap de Creus, ridurrebbe la densità delle colonie.
Per quanto concerne la distribuzione in classi di diametro si può notare un maggiore valore di reclutamento per la popolazione di Portofino, circa di cinque volte, ma nonostante questo l’andamento della distribuzione in classi è abbastanza simile tra le due aree. Questo risultato differisce da quelli presenti in letteratura (Tsounis et al. 2008) in cui le classi di taglia più abbondanti sono la 5 e la 6 nell’area marina protetta (Isole Medes) mentre nell’area in cui la pesca è permessa (Cap de Creus) le classi più abbondanti sono la 3 e la 4. Per quanto riguarda le classi di altezza, invece, a Cap de Creus le colonie di taglia inferiore ai 20 mm sono totalmente assenti, contrariamente a quanto accade a Portofino.
I dati relativi al numero di reclute e i risultati delle distribuzioni in classi di altezza indicano una potenziale futura mancanza di colonie giovanili ed uno scarso tasso di reclutamento. Questo fenomeno potrebbe inibire la dinamica di restoration di tutta la popolazione soggetta a pesca (sia regolamentata che di frodo). Al fine quindi di prevenzione, oltre alla creazione di modelli sulla base dei dati qui presentati, è necessario anche e soprattutto un approccio cautelativo di protezione.
La distribuzione in classi di peso evidenzia come, in entrambe le popolazioni, la classe più rappresentata sia compresa tra 1 e 1.5 g, ovvero colonie di scarso valore economico, soprattutto se comparate con i valori osservati per le colonie di corallo rosso di popolazioni profonde. Inoltre va aggiunto che spesso le colonie superficiali presentano camolature (perforazioni al 48%) causate da spugne (Corriero et al. 1997), che ne riducono ulteriormente il valore economico.
In entrambe le popolazioni è stata trovata una buona relazione tra diametro e numero di ramificazioni indicando quest’ultimo come buon descrittore della crescita. I dati relativi all’età delle colonie permetteranno di stabilire se il numero di ramificazioni possa essere anche un buon descrittore dell’età. Tale descrittore sarebbe di alto interesse applicativo in studi di stock assessment, in cui, utilizzando apparecchiature ROV (Remote Operative Vehicle), sarebbe possibile ottenere dati morfologici su vasta scala geografica e batimetrica e da questi desumere la struttura di età delle popolazioni investigate.
Le popolazioni di corallo rosso superficiale sono un esempio di risorsa marina sovrasfruttata e questo in parte perché non sono mai stati applicati criteri oggettivi e razionali di gestione della risorsa.
Tuttavia, per una specie come il corallo rosso, caratterizzata da tassi di riproduzione alquanto elevati e da una ampia distribuzione batimetrica e geografica, il rischio di estinzione non è reale. Ciò che si rischia invece è l’estinzione economica, vale a dire che non ci siano più popolazioni aventi colonie sufficientemente grandi da permettere lo sfruttamento commerciale (Santangelo et al. 2007). E’quindi utile regolamentare adeguatamente la pesca di questo cnidario e creare una rete di protezione dei popolamenti costieri costituiti da individui di piccola taglia, caratterizzati da una elevata densità e da una riproduzione regolare (Santangelo et al. 1993). Per attuare ciò è indispensabile la conoscenza dei parametri demografici delle popolazioni sfruttate.
Abbiati M., Santangelo G. 1989 : a record on Corallium rubrum (L 1758) associated fauna : Balssia gasti. ANI. SOC. TOSC. SCI. NAT. Mem.serie B. 96: 237-241.
Abbiati M., Buffoni G., Caforio G., Di Cola G., Santangelo G. ,1993.
Harvesting, predation and competition effects on a red coral population. Neth. J. Sea. Res. 30: 219-228.
Abel E.F., 1970. Uber den Tentakelapparat der Edelkoralle Corallium rubrum un seine Funktion beim Beutefangverhalten. Oecologia. 4: 133-142.
Allemand D, Bénazet-Tambutté S (1996) Dynamics of calcification in the
Mediterranean red coral, Corallium rubrum (Linnaeus) (Cnidaria, Octocorallia). J. Exp. Zool. 276:270–278.
Arntz W.E., Gili G.M., Reise K., 1999. Unjustifiably ignored: Reflections on the role of benthos in marine ecosistems. In: Gray JS et al. (eds).
Barletta G., Marchetti R., e Vighi M. 1968 – Ricerche sul corallo rosso: IV) Ulteriori osservazioni sulla distribuzione del corallo rosso nel Tirreno. Ist.
Lomb. (Rend. Sc.) B 102: 119-144.
Bavestrello G.,Cattaneo-Vietti R., Cerrano C. and Pronzato R., 1997 Studio morfologico degli scleriti di Corallium rubrum provenienti da diverse popolazioni mediterranee. Eds Cicogna, Bavestrello, Cattaneo.
Beissinger S.R. and McCullough D.R. 2002. Population viability analysis:
Population viability analysis. The University of Chicago Press, Chicago, USA.
Bertuccelli M., 1999 Dinamica della formazione del popolamento a coralligeno su substrati artificiali. Tesi di Laurea. Università degli studi di Pisa.
Bertuglia S.B., Vaio F. (2003) – Non linearità, caos, complessità. Le dinamiche dei sistemi naturali e sociali. Bollati Boringhieri. Bramanti L. Magagnini G. De Maio L. Santangelo G. 2005 Recruitment, early survival and growth of the Mediterranean red coral Corallium rubrum (L 1758), a 4-year study. Journal of Experimental Marine Biology and Ecology 314 (2005) 69– 78.
Bramanti 2009: Mathemathical modeling for conservation and management of gorgonians corals: youngs and old, could they coexist? Ecological modeling. Article in press.
Caley M.J., Carr M.H., Hyson M.A., Hues T.P., Jones G.P. and Menge B.A., 1996. Recruitment and the local dynamics of open marine populations.
Ann. Rev. Ecol. Syst. 27: 477 500.
Carpine C. & Grasshoff M. 1975. Les Gorgonaires de la Mèditerranée. Bull. Inst. Océanogr. Monaco, 71 (1430) : 1-140.
Cattaneo-Vietti R., Bavestrello G., & Senes L.1993 Il popolamento a corallo rosso del promontorio di Portofino (Mar Ligure) Da Il corallo rosso in