www.elsevier.es/patologia
Patologí
a
RE V IST A E SP A Ñ O L A DE
REVISIÓN
Actualización
de
las
recomendaciones
para
la
determinación
de
biomarcadores
en
el
carcinoma
de
pulmón
avanzado
de
célula
no
peque˜
na.
Consenso
Nacional
de
la
Sociedad
Espa˜
nola
de
Anatomía
Patológica
y
de
la
Sociedad
Espa˜
nola
de
Oncología
Médica
Fernando
López-Ríos
a,∗,
Javier
de
Castro
b,
Ángel
Concha
c,
Pilar
Garrido
d,
Javier
Gómez-Román
e,
Dolores
Isla
f,
José
Ramírez
g,
Luis
Paz-Ares
h,
Julián
Sanz
iy
Enriqueta
Felip
jaServiciodeAnatomíaPatológica-LaboratoriodeDianasTerapéuticas,HospitalUniversitarioSanchinarro,Madrid,Espa˜na bServiciodeOncologíaMédica,HospitalUniversitarioLaPaz,Madrid,Espa˜na
cServiciodeAnatomíaPatológica,ComplejoHospitalarioUniversitarioACoru˜na,ACoru˜na,Espa˜na dServiciodeOncologíaMédica,HospitalUniversitarioRamónyCajal,Madrid,Espa˜na
eServiciodeAnatomíaPatológica,HospitalUniversitarioMarquésdeValdecilla,UniversidaddeCantabria,IDIVAL,Santander,
Espa˜na
fServiciodeOncologíaMédica,HospitalClínicoLozanoBlesa,Zaragoza,Espa˜na
gServiciodeAnatomíaPatológica,HospitalClínic,IDIBAPS,CIBERES,UniversidaddeBarcelona,Barcelona,Espa˜na
hServiciodeOncologíaMédica,InstitutodeBiomedicinadeSevilla-IBIS,HospitalUniversitarioVirgendelRocío,Universidad
deSevilla,CSIC,Sevilla,Espa˜na
iServiciodeAnatomíaPatológica,FacultaddeMedicina,UniversidadComplutensedeMadrid,InstitutodeInvestigaciónSanitaria
delHospitalClínicoSanCarlos(IdISSC),Madrid,Espa˜na
jServiciodeOncologíaMédica,HospitalUniversitariValld’Hebron,Barcelona,Espa˜na
Recibidoel1deoctubrede2014;aceptadoel24deoctubrede2014 DisponibleenInternetel11dediciembrede2014
PALABRASCLAVE
Receptortirosina quinasadellinfoma anaplásico; Biomarcadores; Cáncerdepulmón;
Resumen Enela˜no2011seinicióunproyectoconjuntoentrelaSociedadEspa˜nolade Onco-logía Médica(SEOM)y la SociedadEspa˜nolade AnatomíaPatológica(SEAP)para establecer unas recomendaciones basadas en la evidencia actual con respecto a la determinación de biomarcadoresenpacientesconcarcinomadepulmónde célulanopeque˜na(CPCNP) avan-zado.Lamayoríadeestasrecomendacionessiguensiendoválidas;sinembargo,existennuevas evidenciasquehacennecesarialaactualizacióndealgunosaspectos.Enconcreto,semodifica
∗Autorparacorrespondencia.
Correoelectrónico:[email protected](F.López-Ríos). http://dx.doi.org/10.1016/j.patol.2014.10.005
Receptordelfactor decrecimiento epidérmico
la recomendacióndequébiomarcadoreshayqueanalizaryenquépacientes,ysedefineel manejoóptimodelamuestratumoralasícomolascaracterísticasdelmaterialmínimonecesario para ladeterminacióndebiomarcadores.Además,serevisanlastécnicasadecuadas parala determinacióndelasmutacionesdeEGFRyelreordenamientodeALK,yseconsensúaenqué situacionessedebellevaracabounare-biopsia.
©2014SEAPySEC.PublicadoporElsevierEspaña,S.L.U.Todoslosderechosreservados.
KEYWORDS Anaplasticlymphoma receptortyrosine kinase; Biomarkers; Lungcancer; Epidermalgrowth factorreceptor
Updatedguidelinesforbiomarkertestinginadvancednon-small-celllungcancer. AnationalconsensusoftheSpanishSocietyofPathologyandtheSpanishSociety ofMedicalOncology
Abstract In2011theSpanishSocietyofMedicalOncology(SEOM)andtheSpanishSocietyof Pathology(SEAP)startedajointprojecttoestablishguidelinesonbiomarkertestinginpatients withadvancednon-small-celllungcancer(NSCLC)basedonthecurrentevidence.Mostofthese guidelinesarestillvalid,butnewevidencerequiressomeaspectstobeupdated.Specifically,the recommendationaboutwhichbiomarkerstotestinwhichpatientsisbeingamendedandthe bestwaytomanagetumoursamplesandminimumrequirementsforbiomarkertestmaterial aredefined.SuitabletechniquesfortestingforEGFRmutationsandALKrearrangementarealso reviewed,andaconsensusisreachedonwhichsituationswarrantre-biopsy.
©2014SEAPySEC.PublishedbyElsevierEspaña,S.L.U.Allrightsreserved.
Introducción
Elcáncerdepulmónconstituyelaprimeracausademuerte porcáncer,porloquerepresentaunimportanteproblema sanitario. El hábito tabáquico es el principal responsable de cáncer de pulmón, y solo el 10-15% de estos tumores sediagnosticanenpacientesnofumadores.Paradecidirel tratamientodelospacientescon carcinomadepulmónno microcíticoo decélulasnopeque˜nas (CPCNP)y enferme-dadmetastásicaesnecesarioconocerelsubtipohistológico y en la mayoría de los casos el resultado del análisis de biomarcadores.Esporelloqueenela˜no2011seinicióun proyectoconjuntoentrelaSociedadEspa˜noladeOncología Médica (SEOM) yla Sociedad Espa˜nola deAnatomía Pato-lógica (SEAP) con el fin de definir unas recomendaciones conjuntas para el análisis de biomarcadores en pacien-tes con CPCNP y enfermedad avanzada a nivel nacional. En este primer consenso SEOM/SEAP participaron 5 pató-logos y 5 oncólogos médicos con dedicación a patología torácica, que revisaron toda la bibliografía disponible y trasunconsensorealizaronunaseriederecomendaciones1.
La mayoría de las recomendaciones del primer consenso SEOM/SEAP sobre biomarcadores en CPCNP siguen siendo válidas en la actualidad. Sin embargo, la publicación de nuevasevidencias,sobretodoencuantoalvalorpredictivo de ladeterminación de la quinasadel linfomaanaplásico
(ALK),hallevadoalaelaboracióndeestesegundoconsenso SEOM/SEAP.
En este segundo consenso SEOM/SEAP han participado los mismos autores. La metodología ha consistido en una primera reunión presencial en la que se definieron las recomendacionesdelprimer consensoque precisabanuna revisión y se formularon una serie de preguntas que se consideraron de interés.Posteriormente serevisó toda la
literaturadisponible ysecontestarontodaslas preguntas, incluyendo recomendacionesy referencias a cada unade ellas. Finalmente, en una segunda reunión presencial se debatióyaprobóestedocumento.
¿Qué
aspectos
siguen
siendo
válidos
del
consenso
anterior?
Enelprimerconsensolasrecomendacionessedividieronen aquellasrelacionadasconaspectosclínicos,lasrelacionadas conaspectosanatomopatológicosymoleculares,ylas que incluíanaspectoscomunesclínicosyrelativosalos biomar-cadorespredictivos:
• Sobre las recomendaciones del primer consenso que
analizabanaspectosclínicossiguesiendoválidala reco-mendación de determinar la mutacióndel receptordel factordecrecimientoepidérmico(EGFR)enlospacientes conCPCNPyenfermedadavanzadasipresentanun carci-nomanoescamoso,yentodoslospacientesnofumadores independientemente de la histología. Sin embargo, se consideróquelarecomendaciónsobreladeterminación deALKprecisabaunaactualización.
• Lamayoríadelasrecomendacionesdelprimerconsenso sobreaspectosanatomopatológicossiguenteniendouna vigenciatotalenlaactualidad.Desdelapublicacióndel primer consenso, la SEAP está implementando un pro-grama decontrol decalidad sobrela determinaciónde
ALKyotrorelativoalasnuevastecnologíasde secuencia-ciónmasiva.
• Encuantoalasrecomendacionessobreaspectoscomunes clinicopatológicos,siguensiendoválidaslasquese refie-renalaoptimizacióndelaobtencióndelasmuestras,la
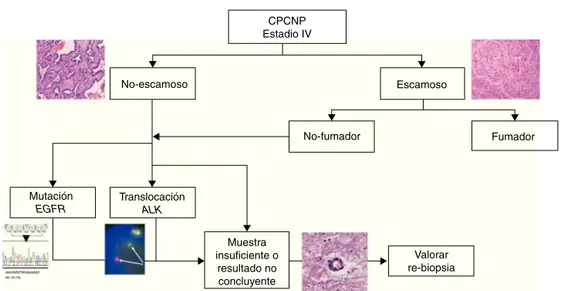
CPCNP Estadio IV No-escamoso No-fumador Fumador Valorar re-biopsia Muestra insuficiente o resultado no concluyente Escamoso Mutación EGFR Translocación ALK
Figura1 AlgoritmodiagnósticoparalospacientesconCPCNPavanzado.
ALK:quinasadellinfomaanaplásico;CPCNP:carcinomadepulmóndecélulanopeque˜na;EGFR:receptordelfactordecrecimiento epidérmico.
preparacióndelas mismas, lainformaciónnecesaria en losinformesylostiemposderespuestaaceptables (reco-mendación de tener los resultados en menos de 7días laborablesdesdelarecepcióndelamuestra).
Asimismo, en este segundo consenso SEOM/SEAP se
actualiza la recomendación acerca de qué otros biomar-cadoreshay queanalizar yenquépacientes,sedefine el óptimomanejodelamuestratumoralylascaracterísticas delmaterialmínimonecesario,serevisanlastécnicas ade-cuadasparaladeterminacióndelasmutacionesdeEGFRy losreordenamientosdeALKyseconsensúaenqué situacio-nessedeberealizarunare-biopsia.Finalmente,seanalizan aspectosquepuedentenerunagranrelevanciaenunfuturo inmediato,como son las determinaciones moleculares en sangreylautilizacióndetécnicasdesecuenciaciónmasiva.
¿Qué
biomarcadores
hay
que
analizar
y
en
qué
pacientes?
Enpacientes con CPCNP avanzado, la selección de trata-mientobasadoenlosmarcadoresmolecularespredictivosde eficaciahamodificadosustancialmenteelenfoqueclínicoy laslíneasdeinvestigacióndelosúltimosa˜nos.
EGFR
En nuestro medio, las mutaciones están presentes en el 10-16%delospacientesconCPCNPavanzado2.Lasmás
fre-cuentes (85-90%) son las deleciones en el exón 19 y las mutacionespuntualesenel exón21.Enlaactualidad dis-ponemosde3fármacos(gefitinib,erlotinibyafatinib)que handemostradoclarobeneficioenensayosfaseiii aleatori-zadoseneste contexto3-5.Por tanto, las principalesguías
clínicasrecomiendanlaprescripcióndeunodeelloscomo tratamiento de primera línea en pacientes avanzados6,7.
Duranteuntiempoexistióunciertodebatesobreel«perfil clínico»delospacientesenlosquesedeberíaanalizarla
presenciadeestasmutaciones.Hoyendíaexistesuficiente evidencia pararecomendarestadeterminaciónen pacien-tesconCPCNPnoescamosoestadioivindependientemente delhábitotabáquico,yenlosnofumadores independiente-mentedelahistología(fig.1).
ReordenamientosdeALK
ALK es un receptor tirosina quinasa que fue identificado porprimeravezcomopartedelatranslocaciónt(2;5) aso-ciada alamayoría deloslinfomasanaplásicos.Secalcula que el 2-7%de lospacientescon CPCNP tienen reordena-mientosdeALK8,principalmentetranslocaciones,siendode
nuevomásfrecuenteenpacientesconescasaonula histo-ria detabaquismo.Estospacientes tiendenaser jóvenes, ynohaydiferenciasdegénero.Setrataensumayoríade adenocarcinomas,confrecuenciaasociadosadeterminadas característicasmorfológicas,porejemplocélulas«enanillo desello»opatróncribiforme9.LosreordenamientosdeALK
nosuelencoexistirconlasmutacionesdeEGFR10.
Existendiferentesinhibidores deALKendesarrollo clí-nico, si bien enEuropa demomento solo está autorizado crizotinib.Estefármacooral,conactividadfrenteaALK, c-METyROS1,demostróbeneficiosignificativoentérminosde supervivencialibredeprogresión(SLP)frentea quimiotera-pia,pemetrexedodocetaxel,enunestudiofaseiiillevado acaboen347pacientesconcáncerdepulmónlocalmente avanzadoometastásicoALK-positivopreviamentetratados conquimioterapiabasadaenplatino11.LasmedianasdeSLP
fueron7,7mesesparalospacientestratadosconcrizotinib y3,0mesespara lospacientes tratadoscon quimioterapia (hazard ratio[HR]: 0,49; p<0,001). La tasa de respuesta objetiva(RO)tambiénfuesuperiorparalospacientes tra-tados con crizotinib (65% vs. 20%; p<0,001). Los efectos adversosmásfrecuentesfueronalteracionesvisuales, ele-vacióndetransaminasas,náuseasyvómitos.
Recientementesehancomunicadolosresultadosdeun estudio faseiii realizado en 343 pacientes con cáncer de pulmónnoescamosoavanzadoALK-positivoypreviamente
no tratados, que fueron aleatorizados a recibircrizotinib 250mg 2 veces al día o quimioterapia (pemetrexed con cisplatinoocarboplatino)12.Esteestudiodemostróla
supe-rioridaddecrizotinibencomparaciónconquimioterapiaen relación a la SLP (10,9 meses vs. 7,0 meses; HR: 0,454; p<0,0001). Asimismo, la tasa de RO también fue supe-riorenlospacientestratados concrizotinib (74%vs. 45%; p<0,0001).
Por último, también disponemos de los resultados de unestudiofaseiqueevaluólaactividad deceritinib,otro fármaco inhibidordela tirosinaquinasa(ITK) parael
tra-tamiento de pacientes con CPCNP avanzado anaplásico
ALK-positivo13.Enesteestudio14,255pacientesfueron
tra-tadoscon 750mg/día de este fármaco. El efecto adverso másfrecuente fue diarrea (84%). Encuanto a losefectos adversos grado 3-4, losmás frecuentes incluyeron eleva-ción de las enzimas hepáticas alanina aminotransferasa (ALT)(21%)yaspartatoaminotransferasa(AST)(8%).Eneste mismoensayoclínicoseevaluólaactividaddeceritiniben 121pacientespreviamentetratadosconcrizotinib.Enellos, seobtieneunaSLPde6,9mesesyunatasadeROdel55,4%. EstatasadeROsemantuvoconindependenciadelnúmero delíneaspreviasdetratamientosrecibidas(1-3).Asimismo, enesteestudiotambiénseanalizalaevoluciónde59 pacien-tes ALK-positivo no tratados previamente. En ellos no se alcanzólamedianadeSLP,ylatasadeROfuedel69,5%.
El estudio dereordenamientosde ALKestaría indicado en pacientes con CPCNP no escamosoestadioiv, indepen-dientemente delhábito tabáquico, yenlosnofumadores independientementedeltipomorfológico(fig.1).Esdecir, tendríalasmismasindicacionesqueelestudiodelas muta-cionesdeEGFR.
¿Cuál
es
el
tipo
de
muestra
óptima
y
cómo
se
debe
gestionar?
¿Se
debe
hacer
un
análisis
simultáneo
o
secuencial?
Lamuestratumoralsueleserunmaterialmuyescasosobre elquehayquedefinir2objetivos.Elprimeroincluyeobtener undiagnósticoanatomopatológicocertero,yelsegundo,la preservacióndesuficientematerialparaelposteriorestudio debiomarcadores. El tejidoobtenido porcirugía, bronco-scopiao biopsiapor punciónes igualdeválido, yaqueel hechodemayorrelevanciaeslacantidaddecélulas tumo-ralespresentesenlamuestra.Lacitologíaseconsideraútil siseobtieneunbloquecelularsuficiente,yaquelosestudios sobreextensionessoloresultanefectivosencentrosdealta especialización.Esfundamentalrevisartodaslasmuestras tumoralesdeunpacientealahoradedecidirsobrecuálse vanarealizar(orepetir)lasdeterminaciones7.
El patólogoha deutilizar lamínimacantidad detejido para la tipificación del tumor y, como recomendación general(quepuedesermodificadaenfuncióndelas nece-sidades de cada caso), limitarse al uso de un máximo de 2 marcadores inmunohistoquímicos, enlos casossin clara diferenciación morfológica. El primer marcador necesario enel momentoactualesel TTF-1,quetiene unrangode sensibilidadqueoscilaentreel 75-85%yunaespecificidad del90-95%paralosadenocarcinomas,siendolapositividad paracarcinomasescamososinapreciable(0%)15.Elsegundo
marcadoraconsejadoesp40,dada sumayorespecificidad
frenteap63,quesigueresultandoútil.Noobstante,hayque
insistir que p63 marca hasta un 18% de los
adenocarcinomas15. No se recomienda la realización
de técnicas histoquímicas adicionales. Una vez realizado eldiagnósticodeCPCNPnoescamosoenestadioavanzado, sedeberealizarelestudiodebiomarcadores.
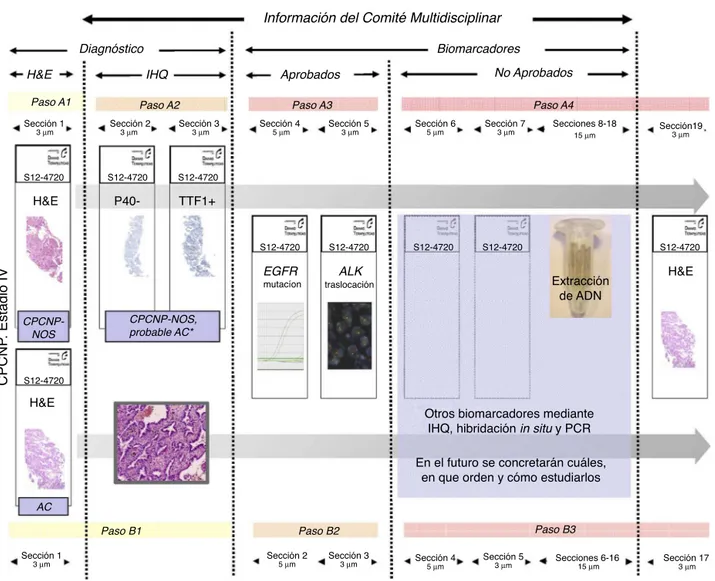
Esportodoelloqueelmaterialparafinado,seadebiopsia obloquecelular,hadeseguirunprocedimiento(protocolo) de aprovechamiento tisular que permita no solo el diag-nósticoanatomopatológico,sinotambiénlarealizaciónde múltiplesbiomarcadorespredictivos.Paraevitarlapérdida detejidocadavezquesecolocaelbloquedetejidoenel micrótomoconvienerecordar2premisas:a)cuantasmenos vecessepongaelbloquedeparafinaenelmicrótomo,más seaprovecha el tejido, y b)el orden en que se jerarqui-cenlosbiomarcadoresesimportante,yaqueeltejidoseva agotando16,17.Lasecuenciadepasosqueproponemos
reali-zareslasiguiente:unaseccióninicialte˜nida (hematoxilina-eosina[H&E])paraobtenerelprimerdiagnóstico,que per-mitaprogramar(solosiladiferenciaciónglandularo esca-mosanoesevidente)2cortesparalarealizacióndelas prue-basinmunohistoquímicas,unaseriedecortesparala extrac-cióndeácidodesoxirribonucleico(ADN)(elnúmeroyel gro-sordelosmismosdependerádelprotocolodeextracciónde ADNdellaboratorio,aunqueconvieneresaltarqueyaexiste laposibilidadrealdehacerlosestudiosmutacionalesa par-tirdeunasolasecciónde5micras),yporúltimo1-2cortes pararealizarlastécnicasdedeterminacióndeALK(fig.2). Un temaendiscusión essi la determinaciónde ambos biomarcadoreshaderealizarsesimultáneamenteodeforma secuencial.Aunqueloidealseríahacerlosdeforma simul-tánea,estonoesposibleentodosloscasos.Portanto,una formapragmáticadeahorrartejidoytiempoesplanificarla realizaciónsimultánea,aunquelasdeterminacionesse reali-cendeformasecuencial.Estoquieredecirquelassecciones parael estudiotantodeEGFR comodeALKserealizanal mismotiempo, aunqueel estudiodeunodelos biomarca-doresloactivemossoloenelcasodequeelotrohayasido negativo.
¿Qué
mutaciones
de
EGFR
se
deben
determinar
y
con
qué
técnicas?
MutacionesdeEGFRadeterminar
Engeneral,existeacuerdoconlaopinióndelconsensodel
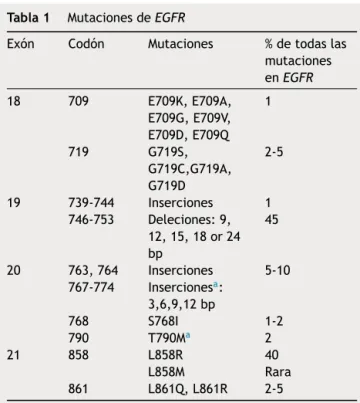
CollegeofAmericanPathologists,InternationalAssociation fortheStudyofLungCanceryAssociationforMolecular Pat-hologyencuantoaquelaspruebasdemutacionesclínicas deEGFRdebensercapacesdedetectartodaslas mutacio-nesindividualesquehansidoinformadasconunafrecuencia dealmenosun1%delosadenocarcinomasdepulmón muta-dosenEGFR18,19. Larealización depruebas paradetectar
solamentelas2mutacionesprincipalesyanoseconsidera aceptable(tabla 1). Sedeben analizar las mutacionesde losexones18-21deldominiotirosinaquinasadeEGFR.Dos tiposde mutacionescomponen el 90% detodaslas muta-cionesactivadoras deEGFR, las delecionesen el exón19 (rodeando loscodones746-750) y lamutación en el exón 21 (L858R).Las mutaciones puntuales enlos exones 18 y
Información del Comité Multidisciplinar Diagnóstico Biomarcadores H&E H&E H&E H&E P40-S12-4720 S12-4720 S12-4720 S12-4720 S12-4720 S12-4720 S12-4720 S12-4720 S12-4720 TTF1+
IHQ Aprobados No Aprobados
Paso A1
Paso B1 Paso B2 Paso B3
Paso A2 Paso A3 Paso A4
Sección 1
Sección 1
Sección 2 Sección 3 Sección 4 Sección 5 Sección 6 Sección 7 Secciones 8-18 Sección19
Secciones 6-16
3 µm Sección 25 µm Sección 33 µm Sección 45 µm Sección 53 µm Sección 173 µm
3 µm 3 µm 3 µm 5 µm 3 µm 5 µm 3 µm 15 µm 3 µm 15 µm CPCNP-NOS CPCNP-NOS, probable AC* AC CPCNP . Estadio IV Extracción de ADN EGFR ALK mutacíon traslocación
Otros biomarcadores mediante IHQ, hibridación in situ y PCR
En el futuro se concretarán cuáles, en que orden y cómo estudiarlos
Figura2 ProtocoloparaelestudiodemúltiplesbiomarcadoresenmuestrasdepacientesconCPCNPavanzado.
Larutasuperior(A)esparacasosquerequieranIHQ clasificatoria.Larutainferior(B)seaplicaríaenmuestrasendondenoes necesarioestepaso,alobjetivarseclaramentediferenciaciónglandularconlaH&E.
AC:adenocarcinoma;ADN:ácidodesoxirribonucleico;ALK:quinasadellinfomaanaplásico;CPCNP:carcinomadepulmóndecélula nopeque˜na;EGFR:receptordelfactordecrecimientoepidérmico;H&E:hematoxilina-eosina;IHQ:inmunohistoquímica;NOS:(de tipo)noespecificado;PCR:reacciónencadenadelapolimerasa.
ModificadodeCondeetal.16.
20(principalmenteT790M) ylasinsercionesenelexón20 sumanotro2-5%y5-10%,respectivamente.
Aunqueexisteunatendenciacrecientehacialaextensiva caracterización molecular de los tumores, se recomienda informardelasmutacionespocohabitualesdeforma sepa-rada,conuncomentarioacercadesupococlaraoincierta significaciónclínica. Algunas publicacionesrecientes pue-denayudaraentenderel significadoclínicodealgunasde estasmutacionesraras20,21.
TécnicasparadeterminarlasmutacionesenEGFR
Se pueden distinguir métodos de detección sistemática, que detectan todas las mutaciones en los exones 18-21, incluyendolasvariantesnuevasylosmétodos«diana»,que detectanmutacionesespecíficas.Aunqueesteesunentorno muycambiante,sepuedenhaceralgunasrecomendaciones prácticas.Si esposible, loideal esutilizar unmétodode
mayor sensibilidadque la secuenciación directa,como la reacciónencadenadelapolimerasa(PCR)entiemporeal (las recientesrecomendaciones del National Institute for Healthand CareExcellence[NICE] seleccionan 2 métodos concretos).Lasecuenciacióndirectasolodeberíarealizarse sitenemosalmenosun50%decélulastumorales.Encuanto a los informes de laboratorio, deben especificar siempre quémutacioneshansidodetectadassistemáticamenteyqué sensibilidadtienenlosmétodosdedetecciónutilizados.
¿Con
qué
técnicas
se
debe
determinar
ALK
?
Enlaactualidadexistenfundamentalmente3técnicasque permiten detectar el reordenamiento del gen ALK en las muestrasclínicas.Setratadelainmunohistoquímica,dela hibridación in situfluorescente(FISH)y laPCR con retro-transcripción (RT-PCR). La única prueba aprobada por la
Tabla1 MutacionesdeEGFR
Exón Codón Mutaciones %detodaslas mutaciones enEGFR 18 709 E709K,E709A, E709G,E709V, E709D,E709Q 1 719 G719S, G719C,G719A, G719D 2-5 19 739-744 Inserciones 1 746-753 Deleciones:9, 12,15,18or24 bp 45 20 763,764 Inserciones 5-10 767-774 Insercionesa: 3,6,9,12bp 768 S768I 1-2 790 T790Ma 2 21 858 L858R 40 L858M Rara 861 L861Q,L861R 2-5
EGFR:receptordelfactordecrecimientoepidérmico.
a Mutacionesasociadasconresistenciaainhibidoresdela
tiro-sinaquinasa(ITK).
conla sondacomercial Vysis® ALK Break-ApartFISHProbe Kit(AbbottMolecular,Inc.),querecibiólaaprobacióncomo pruebaacompa˜nantedelfármacocrizotinib22.Eneste
sen-tido es interesante resaltar que un escáner de FISH ha recibidorecientementeaprobaciónporlaFDAparala inter-pretacióndelasondadeALKmencionadaanteriormente23.
Porotrolado,existenalteracionesenelnúmerodecopias delgenALKquenoparecenrelacionadasconlabuena res-puesta al fármaco específico, si bien es preciso estudiar enprofundidadloscasosconunincrementoenelnúmero de copias para no perder posibles casos de presentación atípica24,25.
La aparición de clones con una sensibilidad apropiada parasuuso medianteinmunohistoquímica,como losD5F3 y5A4,yelusodetécnicasdeamplificaciónparaintensificar lase˜nalinmunohistoquímicaabasedepolímeros,ha provo-cadoquesepropongasuusocomométododecribadoprevio alaconfirmaciónconelmétodoFISH19,26.Lamayorpartede
las seriespublicadasmuestranunaconcordancia muy ele-vadaentrelastécnicasFISHeinmunohistoquímica22,27-29,si
bienexistenfalsospositivosynegativosconambas metodo-logías.Probablementeelriesgomayoresquelasensibilidad disminuya,porlo queesmuyimportante:a)intentar con-trolar los parámetros pre-analíticos, que afectan sobre todo a la inmunohistoquímica, y b)ser conscientes de la dificultad interpretativa de FISH (es sensato verificar los resultadosencasosdepatronesinusuales).Comoregla prác-tica,recomendamosrealizar2métodosdeestudiodelgen
ALKcuandoexistanincertidumbresdecualquiernaturaleza sobre el resultado de ladeterminación. En nuestra expe-riencia lasmáshabituales hansido:unadudosa respuesta al tratamiento de un caso informado como positivo, las determinacionesenloscarcinomasescamosos,unatinción inmunohistoquímicanoclaramentegranularylaspolisomías
ymonosomíasenelestudiodeFISH.Encuantoalatécnica moleculardeRT-PCR,sibienpuedemostrarunasensibilidad yunaespecificidadadecuadas,noestárecomendadaporel colegioestadounidensedepatólogos19.
¿En
qué
situaciones
se
debe
re-biopsiar
al
paciente?
Larealización deuna nueva toma de material del tumor secontemplahabitualmenteen2situaciones:a)cuandose estárealizandoeldiagnósticoinicialdelmismo,yb)en cier-tascircunstancias cuandoseproduceunaprogresióndela enfermedad.Enamboscasos,suobjetivoeslaorientación hacialamejoropcióndetratamiento.
Realizacióndeunare-biopsiaaliniciodel diagnóstico
Ladecisiónderealizarunare-biopsiadebefundamentarse en3 pilares quedarán una estimación delbeneficio real: a)las características clínicas del paciente; b)losaspectos anatomopatológicos del tumor, y c)los riesgos de la re-biopsia.Desdeel puntodevista delaindicación, sedebe valorarsila re-biopsiavaaser imprescindibleparatomar lamejordecisiónterapéutica.Conrespectoalosriesgosde esteprocedimiento,habráqueestimarladificultadtécnica desurealizaciónconsupotencialmorbilidadylademoraen eliniciodeltratamientoquepuedeimplicar.Portodoello, seráfundamentalinformar adecuadamentealpacientede losprosycontrasdelanuevatomadematerialtumoral,y lasrazonesyobjetivosquellevanaesadecisión.Contodas estasconsideraciones,serecomiendahacerunare-biopsia deltumorcuandoexistenalgunasdelassiguientes circuns-tancias:a)siemprequeelresultadodelanálisismolecularno hayasidoinformativoonosedispongadematerialtumoral suficienteparasurealización,ylas características clínico-patológicasdelpacienteydeltumororientenalaposible presenciadeunadianaterapéutica;ejemplosdeello pue-denser pacientes que nuncahayan sido fumadores o con edadinferioralapresentaciónhabitualdelaenfermedad, ocaracterísticaspatológicassugestivas,comolapresencia decélulasenanillo desello30 o unpatrónmicropapilar31,
yb)cuando exista discrepancia entreel perfil clínicodel paciente y el resultado anatomopatológico obtenido. Así, cuando el diagnóstico sea de un carcinoma de tipo esca-mosoodecélulaspeque˜nasenunpacientequenuncahaya sidofumador o de edad muy joven, habría querevisar el estudioanatomopatológicoovalorar,encualquiercaso,la realizacióndelosestudiosmolecularesestablecidosparalos tumoresdehistologíanoescamosa.Deigualmodo,cuando eldiagnóstico inicialsea compatibleconuncarcinoma no microcíticodetiponoespecificado(NOS)puedehacerseeste mismoplanteamiento.
Realizacióndere-biopsiaantelaprogresióndela enfermedad
Encaso deprogresión dela enfermedad,puederealizarse unare-biopsia en2 situaciones: a)cuando ha habido una evoluciónanormaldelaenfermedadysequiereconfirmar
eldiagnósticoinicial,yb)cuandosequiererealizarunnuevo estudiomolecularqueorienteeltratamientoaseguir32.Se
recomiendasolicitarlarealizacióndeestudiosmoleculares enlasre-biopsiasparaencontrarmutacionestrasla resisten-ciaadquiridaaITK-EGFRs33.LamutaciónT790M enel gen EGFReslamáscomún(50-70%)yexistenfármacoscon efi-caciaprobadafrenteaestamutacióncomocomoAZD9291y CO-168634,35.Enloscasosenqueexisteunreordenamiento
de ALK y que progresan a un inhibidor, la biopsia podría determinarlacausadelaprogresión,aunquetodavíanose hadefinidoeltratamientoaseguirenestasituación36.
¿Qué
otros
biomarcadores
tienen
interés
hoy
en
día?
EnCPCNPestánsiendoinvestigadosotrosbiomarcadorespor supotencialinteréscomopredictoresdelaeficaciaa deter-minadosfármacosenelcontextodeensayosclínicos,pero demomentonohayevidenciacientíficaparasu recomenda-ciónenlaprácticaclínica19,37,38.
MutacióndeKRAS
KRASesungen queaparecemutadoenalrededordel20% detodosloscasosdeCPCNP,especialmenteen adenocarci-nomasyenpacientesfumadores.Eslamutaciónoncogénica másfrecuenteysuvalorpronósticonohasidodemostrado claramente. En la actualidad se encuentran en investiga-cióndiferentesfármacos,destacandoespecialmentelosque actúanennivelesinferioresdelavía dese˜nalizaciónRAS, comolosinhibidores deMEK1/2,cuyaeficaciatambiénse estáevaluando,ylosinhibidoresdelavía dese˜nalización PI3K/AKT/mTOR39.
AlteracióndeMET
METesunreceptortirosinaquinasaactivadoporsuligando específiconatural, el factor de crecimientohepatocitario
(HGFR) situado en el cromosoma 7q21-q31. El gen MET
puedeestar mutadoraramente enCPCNP (1%),o amplifi-cado(3-7%).También seha descritola sobreexpresióndel receptor(25-75%),condicionandounpeorpronóstico.Estas alteracionesaparecenencualquier histología deCPCNP y sonindependientesdelapresenciademutacionesdeKRAS
oEGFR.Entreel10-20%delospacientescontumoresEGFR
mutadosadquierenresistenciaalosITK-EGFRsatravésdela amplificacióndeMET.Seencuentraneninvestigación algu-nos inhibidores de MET, anticuerpos monoclonales o ITK, administradosencombinación conotras terapiasdirigidas oquimioterapia,oenmonoterapia.
TranslocacióndeROS1
ROS1 es ungen que codificaun receptortirosina quinasa que aparece translocado en el 1-2% delos pacientes con CPCNP,sobretodoennofumadores,enpacientescon ade-nocarcinoma,jóvenesysinmutacionesenlosgenesEGFR, KRAS,BRAF,HER2oreordenamientodeALK40.Crizotinibha
demostradoactividadenestospacientes41.
MutacióndeBRAF
BRAF es un gen que codifica una proteína con actividad serina-treonina quinasa, que se encuentra en la vía de se˜nalización de MAPK a nivel inferior de RAS. Su muta-ción está presente en el 1-3% de los CPCNP, en más de la mitad de los casos es una mutación V600E, y aparece sobretodo enadenocarcinomasyenpacientes fumadores yexfumadores42.Estánsiendoinvestigadosdiferentes
inhi-bidoresdeBRAFquehanpresentadoactividadenestudios iniciales,considerándoseasimismolaestrategiadesu aso-ciaciónainhibidoresdeMEK,especialmenteparapacientes conmutaciónnoV600E.
TranslocacióndeRET
ElgenRETcodificaelreceptortirosinaquinasa,ysu reor-denamiento aparece con unaincidencia de 1,4-2% en los CPCNP.Sedetectafundamentalmenteenadenocarcinomas, pacientes nofumadores yjóvenes y enausencia de otras alteraciones genéticas (EGFR, KRAS, BRAF,HER2 o trans-locaciónALK)43.Enlaactualidadestánsiendoinvestigados
diferentesinhibidoresdeRET,lamayoríadeloscualesson agentesfrenteamúltiplesquinasas.
MutacióndeHER2
HER2esunaproteínatirosina quinasademembranadela familiaERBB,sesobreexpresaenel20%delosCPCNP,pero solosehandescritomutacionesoamplificacióndelgenenun 2-4%deloscasos.Lamutaciónseobservaespecialmenteen lasmujeres,enlospacientesnofumadores,enlos adenocar-cinomasyenlospacientesderazaasiática.Generalmente se trata de la inserción en el exón 20 y es mutuamente excluyenteconlasmutacionesdeEGFRoKRAS44.En
estu-dios iniciales, especialmente los agentesITK irreversibles deHER2yEGFRhandemostradoactividadenpacientescon CPCNP,yseestáevaluandosuasociaciónconotrasterapias dirigidascomolosinhibidoresdemTOR,debidoala asocia-ciónentrelamutacióndeHER2ylaactivaciónpreferencial delavíaAKT/mTOR.
Otrospotencialesbiomarcadores
Otros potenciales biomarcadores de interés, particular-mente en carcinomasescamosos, son las mutaciones o la amplificación de PI3KCA, la amplificación de FGFR1, la expresióndePD-L1olasmutacionesdeDDR2.
¿Qué
otras
técnicas
tienen
interés
hoy
en
día?
Anteelretoquesenospresentasobrelanecesidadde deter-minarmúltiplesbiomarcadoresparaoptimizarlaeficaciade lasnuevasterapias,losavances técnicosrecientescon sis-temasdenuevageneraciónquepermitenlasecuenciación masivadegenesenunasolapruebasuponenunabuena opor-tunidadparaabordarestenuevoescenario.Hayquerecalcar que estos son estudios de docenas de genes y miles de mutaciones(coloquialmentereferida como«secuenciación
secuenciaciónexómicaogenómicacompleta.Estas tecno-logías son muy robustas para el estudio de mutaciones, pero pueden presentarproblemas de sensibilidady espe-cificidadparaestudiar insercioneso peque˜nasdeleciones. Engeneralesmuyrecomendable,oinclusoimprescindible enmuchasdeterminaciones, disponerde tejidonormal(o sangre)acompa˜nante.Aunquetécnicamenteesfactibleel estudio de translocaciones, no está claro su rendimiento y robustez en muestras que han sido fijadasen formol e incluidas enparafina. Una buenaopción seríarealizar las determinaciones más prevalentes y/o realmente impres-cindibles por losmétodos convencionales yreservar estos abordajesmásmasivosparaloscasospan-negativos,como
por ejemplo EGFR, ALK, KRAS, RET, ROS1, BRAF y HER2
negativos. Es interesante resaltar que las amplificaciones tratables (estos es, MET o HER2) ocurren típicamente en estos adenocarcinomas de pulmón«oncogén-negativos»45.
Por tanto, es imprescindible asegurarnos en este último subgrupodequelasamplificacionesestánadecuadamente estudiadasmediantesecuenciaciónmasivaoFISH.
¿Cuál
es
el
material
mínimo
necesario
para
la
determinación
de
biomarcadores?
Lacantidad mínima de célulasneoplásicasque debe
con-tener una muestra para el diagnóstico de cáncer de
pulmóny larealización de estudios moleculareses varia-ble, pues depende de muchos factores, como son: a)el tipo de método diagnóstico a utilizar; b)la presencia de elementosestromales-inflamatoriosabundantes; c)la exis-tencia de necrosis, hemorragia o fibrosis extensa; d)la calidaddeltejido,lapreservaciónantigénicao la integri-dad del ADN/ácido ribonucleico (ARN), y e)la existencia dealteracionesgenómicascomoaneuploidías,polisomíasy amplificaciones.Segúnloscasos,esrelevantedisponer de unnúmeroabsolutode célulastumoralesrepresentativas, o bien que la proporción de las mismas alcance un valor determinado.Paraestudioscitogenéticosserecomiendaun mínimode100célulastumorales,por cuestionestécnicas, en tanto que para estudios moleculares esnecesario dis-poner de al menos un 30% de células tumorales (para la determinaciónmediantesecuenciacióndirecta)oun5%de célulastumorales(paraladeterminaciónmediantePCRen tiemporeal).Existetecnologíaquepermitedetectar muta-cionescuandolapoblacióntumoralsuponeun10%oincluso menos aún (1-0,1%). Aunque hay que tener cuidado con estos métodos untrasensibles, pues se pueden dar arte-factos y aportar falsos positivos con mayor frecuencia19.
Se asume que, con las tecnologías disponibles, son sufi-cientescantidadesde250-500ngdeADN/ARNpararealizar los estudios moleculares que exploren diferentes genes simultáneamente46.
Es crucial que las instituciones establezcan las
estrategias necesarias para optimizar los estudios de biomarcadores47,yquecadalaboratoriodeterminesu
pro-pioumbraldesensibilidadanalítica,olímitededetección, para validar sus procedimientos. Para los casos de bajo rendimiento sedebevalorar laposibilidad derealizaruna nueva biopsia19. Si el estudio resultante es negativo y el
porcentajetumoral está cercadel límite dedetección de nuestrametodología,esmássensatoqueeldiagnósticosea
«no concluyente», para dar la oportunidad de repetir la determinaciónsitienelugarunare-biopsia,comoyaseha descritoenapartadosanteriores.
¿Cuáles
son
las
aplicaciones
de
la
biopsia
líquida?
El perfil molecular de interés de los tumores sólidos se obtiene en la actualidad, como se ha comentado previa-mente,apartir deespecímenesquirúrgicos odebiopsias. Sinembargo,esteúltimoprocedimientonosiemprepuede llevarse a cabo de forma rutinaria debido a su carácter invasivo.Adicionalmente,lainformaciónobtenidaapartir deunasolabiopsiaproporcionaunainstantáneaespacialy temporalmentelimitada deun tumor ypodría noreflejar suheterogeneidad. Comoalternativaa la muestratisular, hayuncrecienteinterésenelestudiodebiopsiaslíquidaso muestrassanguíneasdelpaciente,mediantela caracteriza-ciónmoleculardecélulastumoralescirculantes(CTC)yel escrutiniodelADNlibrecirculante(cfDNA)enelsuero48,49.
ElestudiodelasCTCencáncerdepulmónhasidomenos exhaustivo que en otros tipos tumorales50. Su recuento
pudieratenerutilidadpronósticayenlamonitorizacióndela respuestaatratamientos.Enlosúltimosa˜noshanvistolaluz algunostrabajosmostrandolaposibilidaddecaracterización genéticaycitogenéticadeCTCcapturadascontecnologías sofisticadascomolosfiltrosmicrofluídicos(«CTC-Chip»).En unestudiorealizadoenelMassachusettsGeneralHospitalse mostróunasensibilidaddel95%enladetecciónde mutacio-nesactivadorasdeEGFRutilizandoScorpionAmplification RefractoryMutationSystem(SARMS)en20pacientes,delos cuales11presentabanasimismolamutaciónderesistencia T790M51.
LautilidadpotencialdelanálisisdelcfDNAséricoincluye la detección precoz, la monitorización de la respuesta al tratamiento y la detección de recidiva, así como par-ticularmente la determinación de anomalías moleculares condicionantesdeltratamientodirigidoadianas molecula-resyelanálisisdelaevolucióngenotípicadeltumortrasla presiónterapéutica4,49.Enesteúltimosentido,la
sensibili-daddependedelestadioydelacargatumoral,asícomode factorestécnicos.Lasensibilidadparaladeterminaciónde alteracionesconcretascomolasmutacionesdeEGFRoKRAS
enCPCNP con tecnologías avanzadas (PCR digital, beads, emulsions,amplificationand magnetics[BEAMing]y next-generationsequencing[NGS])esinferioral0,01%,demodo quepudieranidentificarsealteracionesgenéticasdeinterés en≥90%delospacientesconenfermedadenestadioiv4,52. En el momento actual, la caracterización de biopsias líquidashadeconsiderarseesencialmenteenelcontextode lainvestigación.Pudieracontemplarseexcepcionalmentela utilidaddeestosprocedimientos,particularmentela iden-tificacióndemutacionesdeEGFRencfDNA,enelcasode tipificaciónmolecularincompletadeunCPCNPavanzadoy dificultadtécnicaocontraindicaciónmédicaparael mues-treoconvencional.
Conclusiones
Esyaunarealidad que enlos pacientescon CPCNP avan-zadoesnecesarianosololainformaciónanatomopatológica
sinotambiénelresultadodebiomarcadorespredictivos.Hoy endíaexistesuficienteevidenciapararecomendarel estu-diodelasmutacionesdeEGFRydelatranslocacióndeALK
en pacientes con CPCNP no escamoso estadioiv indepen-dientementedel hábitotabáquico, y enlosnofumadores independientementedelahistología.Aunqueloidealsería hacerlos2biomarcadoresdeformasimultánea,estonoes posibleentodos loscasos. Por tanto, unaforma pragmá-ticadeahorrar tejidoytiempoesplanificarlarealización simultáneaaunquelasdeterminacionesserealicendeforma secuencial.Losavances tecnológicosyapermitentrabajar conprotocolosdepriorizacióndelamuestraparaconseguir estosobjetivos, siempreencuadrados dentrode controles decalidadycursosdeformación.Realizartodoelproceso deanálisismorfológicoypatológicodelamuestraydelos marcadorespredictivosconrapidezycalidadsoloesfactible conuntrabajomultidisciplinareficaz.
Responsabilidades
éticas
Proteccióndepersonasyanimales.Los autoresdeclaran queparaestainvestigaciónnosehanrealizado experimen-tosensereshumanosnienanimales.
Confidencialidaddelosdatos.Losautoresdeclaranqueen esteartículonoaparecendatosdepacientes.
Derechoalaprivacidadyconsentimientoinformado.Los autoresdeclaranqueenesteartículonoaparecendatosde pacientes.
Financiación
LaSEOM yla SEAP agradecen el apoyofinancierode este proyecto mediante becas sin restricción de AstraZeneca, BoehringerIngelheim,Lilly,Novartis,PfizeryRoche.
Conflicto
de
intereses
Losautoresdeclaranque,enelmomentodelaredaccióny revisióndeltexto,desconocíanelnombredeloslaboratorios quehanapoyadoeconómicamenteesteproyecto,porloque esteapoyonohainfluidoenelcontenido de este artículo.
Agradecimientos
Los autores agradecen la asistencia editorial deAna Mar-tín,deHealthCo(Madrid,Espa˜na),eneldesarrollodeeste manuscrito.F.López-RíosagradeceaB.AnguloyE.Conde sucontribuciónalasterapiasdirigidasenelcarcinomade pulmón.
Bibliografía
1.GarridoP,deCastroJ,ConchaA,FelipE,IslaD,Lopez-RiosF, etal.Guidelinesforbiomarkertestinginadvanced non-small-celllungcancer.AnationalconsensusoftheSpanishSocietyof MedicalOncology(SEOM)andtheSpanishSocietyofPathology (SEAP).ClinTranslOncol.2012;145:338---49.
2.RosellR,MoranT,QueraltC,PortaR,CardenalF,CampsC,etal. Screeningforepidermal growthfactor receptormutations in lungcancer.NEnglJMed.2009;361:958---67.
3.Mok TS, Wu YL, Thongprasert S, YangCH, Chu DT, Saijo N, etal.Gefitiniborcarboplatin-paclitaxelinpulmonary adeno-carcinoma.NEnglJMed.2009;361:947---57.
4.Rosell R, CarcerenyE, GervaisR, VergnenegreA, Massuti B, FelipE,etal.Erlotinibversusstandardchemotherapyas first-line treatment for European patients with advanced EGFR mutation-positivenon-small-celllungcancer(EURTAC):A mul-ticentre,open-label,randomisedphase3trial.LancetOncol. 2012;133:239---46.
5.SequistLV,YangJC, YamamotoN,O’ByrneK,HirshV,MokT, etal.PhaseIIIstudyofafatiniborcisplatinpluspemetrexed inpatients withmetastatic lungadenocarcinoma withEGFR mutations.JClinOncol.2013;31:3327---34.
6.CampsC,FelipE,Garcia-CampeloR,TrigoJM,GarridoP.SEOM clinicalguidelinesforthetreatmentofnon-smallcelllung can-cer(NSCLC)2013.ClinTranslOncol.2013;15:977---84.
7.Kerr KM, Bubendorf L, Edelman MJ, Marchetti A, Mok T, NovelloS,etal.PanelMembers:PanelMembers.SecondESMO consensus conference on lung cancer: pathology and mole-cular biomarkers for non-small-cell lung cancer. Ann Oncol. 2014;25:1681---90.
8.ShawAT,YeapBY,Mino-KenudsonM,DigumarthySR,CostaDB, HeistRS,etal.Clinicalfeaturesandoutcomeofpatientswith non-small-celllungcancerwhoharborEML4-ALK.JClinOncol. 2009;27:4247---53.
9.Fan L, Feng Y, Wan H, Shi G, Niu W. Clinicopatholo-gical and demographical characteristics of non-small cell lung cancer patients with ALK rearrangements: a syste-matic review and meta-analysis. PLoS One. 2014 [con-sultado Jul 2014]. Disponible en: http://www.plosone.org/ article/info%3Adoi%2F10.1371%2Fjournal.pone.0100866 10.Kris MG, Johnson BE, Berry LD, Kwiatkowski DJ, Iafrate
AJ, Wistuba II, et al. Using multiplexed assays of oncoge-nic drivers in lung cancers to select targeted drugs. JAMA. 2014;311:1998---2006.
11.ShawAT,KimDW,NakagawaK,SetoT,CrinoL,AhnMJ,etal. CrizotinibversuschemotherapyinadvancedALK-positivelung cancer.NEnglJMed.2013;368:2385---94.
12.Mok T, Kim DW, Wu YL, Solomon BJ, Nakagawa K, Mekhail T, et al. First-line crizotinib versus pemetrexed-cisplatin or pemetrexed-carboplatininpatients(pts)withadvanced ALK-positive non-squamous non-small cell lung cancer (NSCLC): Results of a phase III study (PROFILE 1014). J Clin Oncol. 2014;32(5s)(suppl;abstr8002).
13.ShawAT,KimDW,MehraR,Tan DS,FelipE,ChowLQ,et al. CeritinibinALK-rearrangednon-small-celllungcancer.NEnglJ Med.2014;370:1189---97.
14.Kim D-W, Mehra R, Tan DS-W, Felip E, Chow LQM, Camidge DR, et al. Ceritinib in advanced anaplastic lymphoma kinase (ALK)-rearranged (ALK+) non-small cell lung cancer (NSCLC):ResultsoftheASCEND-1trial.ASCOMeetingAbstract 2014;3215suppl:8003.
15.NonakaD.AstudyofDeltaNp63expression inlungnon-small cellcarcinomas.AmJSurgPathol.2012;36:895---9.
16.Conde E, Angulo B, Izquierdo E, Paz-Ares L, Belda-Iniesta C, Hidalgo M, et al. Lung adenocarcinoma in the era of targetedtherapies:Histologicalclassification,sample prioriti-zation,andpredictivebiomarkers.ClinTranslOncol.2013;15: 503---8.
17.Lopez-Rios F, Conde E, Angulo B, Martinez R, McGready C, O’HaraG,etal.Aprospectiveprotocolforsimultaneous geno-mictestinginpatientswithnon-smallcelllungcancer.JThorac Oncol.2013;8:S1074.
18.EGFR-TK mutation testing in adults with locally advanced or metastatic non-small-cell lung cancer. NICE diagnostics
guidance 9 [consultado May 2014]. Disponible en: http:// guidance.nice.org.uk/nicemedia/live/14251/64893/64893.pdf 19.LindemanNI,CaglePT,BeasleyMB,ChitaleDA,DacicS, Giac-coneG,etal.Moleculartestingguidelineforselectionoflung cancerpatientsforEGFRandALKtyrosinekinaseinhibitors: Gui-delinefromtheCollegeofAmericanPathologists,International Associationfor theStudyofLungCancer,andAssociationfor MolecularPathology.ArchPatholLabMed.2013;137:828---60. 20.ArcilaME,NafaK,ChaftJE,RekhtmanN,LauC,RevaBA,etal.
EGFRexon 20insertion mutations in lung adenocarcinomas: Prevalence, molecular heterogeneity, and clinicopathologic characteristics.MolCancerTher.2013;12:220---9.
21.HeM,CapellettiM,NafaK,YunCH,ArcilaME,MillerVA,etal. EGFRexon19insertions:AnewfamilyofsensitizingEGFR muta-tionsinlungadenocarcinoma.ClinCancerRes.2012;18:1790---7. 22.HutarewG,Hauser-KronbergerC,StrasserF,LlenosIC,Dietze O.ImmunohistochemistryasascreeningtoolforALK rearrange-mentinNSCLC:evaluationoffivedifferentALKantibodyclones andALKFISH.Histopathology.2014;65:398---407.
23.FDA clears BioView DuetTM system for automated ALK FISH
scanning of lung cancer tissue specimens [consultado Jun 2014]Disponibleen:http://www.bioview.co.il/htmls/page70. aspx?c0=12677&bsp=12624
24.CamidgeDR,SkokanM,KiatsimkulP,HelfrichB,LuX,BaronAE, etal.NativeandrearrangedALKcopynumberandrearranged cellcountinnon-smallcelllungcancer:implicationsfor ALK inhibitortherapy.Cancer.2013;119:3968---75.
25.SalidoM, PijuanL, Martinez-Aviles L, GalvanAB, Canadas I, RoviraA,et al.IncreasedALKgenecopynumberand ampli-ficationare frequentinnon-smallcell lungcancer.JThorac Oncol.2011;61:21---7.
26.Thunnissen E, Bubendorf L, Dietel M, Elmberger G, Kerr K, Lopez-RiosF,et al.EML4-ALKtestinginnon-smallcell carci-nomasofthelung:Areviewwithrecommendations.Virchows Arch.2012;46:245---57.
27.SelingerCI,RogersTM,RussellPA,O’TooleS,YipP,WrightGM, etal.TestingforALKrearrangementinlungadenocarcinoma: Amulticentercomparisonofimmunohistochemistryand fluo-rescentinsituhybridization.ModPathol.2013;26:1545---53. 28.WynesMW,ShollLM,Dietel M,SchuuringE,Tsao MS,Yatabe
Y,et al. Aninternationalinterpretationstudyusing the ALK IHCantibodyD5F3andasensitivedetectionkitdemonstrates highconcordancebetweenALKIHCandALKFISHandbetween evaluators.JThoracOncol.2014;95:631---8.
29.ZwaenepoelK,VanDongen A,LambinS, WeynC,PauwelsP. DetectionofALKexpressioninnon-small-celllungcancerwith ALKgenerearrangements-comparisonofmultiple immunohis-tochemicalmethods.Histopathology.2014;65:539---48. 30.NishinoM,KlepeisVE,YeapBY,BergethonK,Morales-Oyarvide
V,Dias-SantagataD,etal.Histologicandcytomorphologic fea-tures of ALK-rearranged lung adenocarcinomas. Mod Pathol. 2012;25:1462---72.
31.MotoiN,SzokeJ,RielyGJ,SeshanVE,KrisMG,RuschVW,etal. Lungadenocarcinoma: modification of the2004 WHO mixed subtypetoincludethemajorhistologicsubtypesuggests corre-lationsbetweenpapillaryandmicropapillaryadenocarcinoma subtypes,EGFRmutationsandgeneexpressionanalysis.AmJ SurgPathol.2008;32:810---27.
32.ArcilaME,OxnardGR,NafaK,RielyGJ,SolomonSB,Zakowski MF,etal.Rebiopsyoflungcancerpatientswithacquired resis-tancetoEGFRinhibitorsandenhanceddetectionoftheT790M mutationusingalockednucleicacid-basedassay.ClinCancer Res.2011;17:1169---80.
33.HataA,KatakamiN,YoshiokaH,TakeshitaJ,TanakaK,NanjoS, etal.Rebiopsyofnon-smallcelllungcancerpatientswith acqui-redresistance to epidermal growth factor receptor-tyrosine kinaseinhibitor:ComparisonbetweenT790Mmutation-positive andmutation-negativepopulations.Cancer.2013;119:4325---32.
34.JannePA,RamalingamSS,YangJC-H,AhnM-J,KimD-W,Kim S-W,etal.Clinicalactivityofthemutant-selectiveEGFR inhi-bitorAZD9291 inpatients (pts)withEGFRinhibitor-resistant non-small cell lung cancer (NSCLC). ASCO Meeting Abstract 2014;3215suppl:8009.
35.Sequist LV,SoriaJ-C,GadgeelSM,WakeleeHA,CamidgeDR, Varga A, et al. First-in-human evaluation of CO-1686, an irreversible,highlyselectivetyrosinekinaseinhibitorof muta-tionsofEGFR(activatingandT790M).ASCOMeetingAbstract 2014;3215 suppl:8010.
36.SasakiT,KoivunenJ,OginoA,YanagitaM,NikiforowS,Zheng W, et al. A novel ALK secondary mutationand EGFR signa-ling cause resistance to ALK kinase inhibitors. Cancer Res. 2011;71:6051---60.
37.Meador CB, Micheel CM, Levy MA, Lovly CM, Horn L, War-nerJL, etal. Beyondhistology: translatingtumor genotypes into clinicallyeffective targeted therapies.ClinCancer Res. 2014;20:2264---75.
38.OxnardGR,BinderA,JannePA.Newtargetableoncogenesin non-small-celllungcancer.JClinOncol.2013;31:1097---104. 39.RobertsPJ,StinchcombeTE.KRASmutation:Shouldwetestfor
it,anddoesitmatter.JClinOncol.2013;31:1112---21. 40.BergethonK,ShawAT,OuSH,KatayamaR,LovlyCM,McDonald
NT,etal.ROS1rearrangementsdefineauniquemolecularclass oflungcancers.JClinOncol.2012;30:863---70.
41.OuS-HI,BangY-J,CamidgeDR,RielyGJ,SalgiaR,ShapiroG, etal.Efficacyandsafetyofcrizotinibinpatientswith advan-cedROS1-rearrangednon-smallcelllungcancer(NSCLC).ASCO MeetingAbstract2013;3115suppl:8032.
42.PaikPK,ArcilaME,FaraM,SimaCS,MillerVA,KrisMG,etal. Clinicalcharacteristicsofpatientswithlungadenocarcinomas harboringBRAFmutations.JClinOncol.2011;29:2046---51. 43.LipsonD,Capelletti M,Yelensky R,OttoG, Parker A, Jarosz
M,etal.IdentificationofnewALKandRETgenefusionsfrom colorectalandlungcancerbiopsies.NatMed.2012;18:382---4. 44.ArcilaME,ChaftJE,NafaK,Roy-ChowdhuriS,LauC,Zaidinski
M,etal.Prevalence,clinicopathologicassociations,and mole-cularspectrumofERBB2(HER2)tyrosinekinasemutationsin lungadenocarcinomas.ClinCancerRes.2012;18:4910---8. 45.Comprehensive molecular profiling of lung adenocarcinoma.
Nature.2014;511:543---50.
46.Lira ME,ChoiYL,Lim SM,Deng S,HuangD,Ozeck M,etal. Asingle-tubemultiplexedassayfordetectingALK,ROS1,and RETfusionsinlungcancer.JMolDiagn.2014;16:229---43. 47.Travis WD, Brambilla E, Noguchi M, Nicholson AG,
Geisin-ger K, Yatabe Y, et al. Diagnosis of lung cancer in small biopsiesand cytology: Implicationsofthe2011 International Associationfor theStudyofLung Cancer/AmericanThoracic Society/EuropeanRespiratorySocietyclassification.ArchPathol LabMed.2013;137:668---84.
48.DiazLAJr,BardelliA.Liquidbiopsies:Genotypingcirculating tumorDNA.JClinOncol.2014;32:579---86.
49.EspositoA,BardelliA,CriscitielloC,ColomboN,GelaoL, Fuma-galliL,etal.Monitoringtumor-derivedcell-freeDNAinpatients withsolidtumors:Clinicalperspectivesandresearch opportu-nities.CancerTreatRev.2014;40:648---55.
50.O’Flaherty JD, Gray S, Richard D, Fennell D, O’Leary JJ, BlackhallFH,etal.Circulatingtumourcells,theirrolein metas-tasis and their clinical utility in lung cancer. Lung Cancer. 2012;76:19---25.
51.Maheswaran S, Sequist LV, Nagrath S, Ulkus L, Brannigan B, ColluraCV,etal.DetectionofmutationsinEGFRincirculating lung-cancercells.NEnglJMed.2008;359:366---77.
52.TaniguchiK,UchidaJ,NishinoK,KumagaiT,OkuyamaT,Okami J,etal.QuantitativedetectionofEGFRmutationsin circula-tingtumorDNAderivedfromlungadenocarcinomas.ClinCancer Res.2011;17:7808---15.