“Impiego di un adiuvante Th1 di origine batterica per la modulazione della risposta Th2 in vivo: studio in un modello di trichinellosi sperimentale”
Testo completo
(2) Le decisioni sono soltanto l’inizio di qualcosa. Quando si prende una decisione, in realtà si comincia a scivolare in una forte corrente che ti porta verso un luogo mai neppure sognato al momento di decidere.. Paulo Coelho, “L’Alchimista”. 2.
(3) INDICE RIASSUNTO. 1. ABSTRACT. .....5. INTRODUZIONE. ....9. 1. Adiuvanti e loro principali impieghi. 9. 2. Helicobacter pylori neutrophil activating protein . 2.1 HP-NAP. 13. .. ..13. 2.2 HP-NAP come adiuvante pro-Th1... 3. Helicobacter pylori.... ... ... 22. ... ..28. 3.1 Storia di H. pylori. ..28. 3.2 Biologia di H. pylori. .. 3.3 Fattori di virulenza. .... 34. 3.4 H. pylori e la risposta immunologica. ..40. 3.5 Trasmissione. .....41. 3.6 Diffusione. ...42. 4. Trichinella spp.. ...44. 4.1 Storia del parassita Trichinella spp. 4.2 Il ciclo vitale. 29. .. ... ..44 .. 4.3 Tassonomia del genere Trichinella. 45 .50. . 52. 4.3.1 Clade incapsulato 4.3.2 Clade non incapsulato. ...........56. .. 4.4 Epidemiologia. .. .58. 4.5 Biologia di Trichinella spp.. .. .59 . 61. 4.5.1 La morfologia della femmina adulta di Trichinella..... ... . 62. ........................................ . 63. 4.5.2 La morfologia della femmina adulta di Trichinella....... 4.5.3 La morfologia della larva........ 4.6 La cellula nutrice. .. .. .64. 4.6.1 Formazione della nurse cell. 65. 4.6.2 De-differenziazione della cellula muscolare. .68. 4.6.3 Re-differenziazione in nurse cell. 69. 4.6.4 Formazione della capsula di collagene. 70 ...72. 4.6.5 Angiogenesi. I.
(4) 5. Risposta immune dell’ospite. .. .. 73. 5.1 La risposta immunitaria. .73. 5.2 Risposta immune dell’ospite all’infezione da Trichinella. .88. 5.2.1 Antigeni di Trichinella. ..88. ... .. ..89. 5.2.2 Gli antigeni somatici 5.2.3 Gli antigeni di superficie. .. .89. .. 89. 5.2.2 Le proteine escrete/secrete (E/S). 5.3 Risposta immunitaria a livello intestinale durante la trichinellosi. .......................................................................................90 5.4 Risposta immunitaria all’infezione da T. spiralis a livello8888 muscolare. 6. Metalloproteasi di matrice. .. .. ..93. .. ..99. 6.1 Le MMPs... ..99. 6.2 Le gelatinasi. 109. SCOPO DELLA TESI. 115. MATERIALI E METODI. 117. RISULTATI DISCUSSIONE. .130 ...157. CONSIDERAZIONI CONCLUSIVE. .163. RIFERIMENTI BIBLIOGRAFICI. ..167. II.
(5) RIASSUNTO Nell’infezione da Trichinella spiralis le difese dell’ospite si basano sull’aumento degli eosinofili e delle immunoglobuline di classe E, analogamente a quanto riscontrato per le malattie Th2 mediate, come asma e rinite allergica. Oggi tali malattie di natura allergica vengono curate mediante un approccio alternativo all’immunosoppressione utilizzando il mutuo antagonismo tra citochine Th2 e Th1. Per questo motivo si ricercano molecole adiuvanti della risposta Th1 per contro-regolare l’esacerbato fenotipo Th2 in risposta agli allergeni. Tra le molecole pro-Th1, la proteina di origine batterica Helicobacter pylori neutrophil activating protein (HP-NAP) si è dimostrata capace di stimolare le cellule dell’immunità verso un fenotipo Th1, agendo in vitro anche su cellule già improntate ad un fenotipo Th2. Scopo della presente tesi di dottorato è verificare l’efficacia della molecola HP-NAP in un modello animale sperimentale di risposta Th2 come quello rappresentato dall’infezione di T. spiralis, alternativo al classico modello murino di asma indotto dall’ovalbumina. Questo approccio della sperimentazione consente di valutare gli aspetti parassitologici oltre che immunologici dell’effetto della molecola adiuvante. Dopo aver valutato l’andamento dei parametri Th2 (eosinofilia e livelli di IgE totali) nel modello murino durante la trichinellosi, è stato deciso di somministrare per via intraperitoneale al 10° e 28° giorno dall’inizio dell’infezione sperimentale 10 µg della molecola HP-NAP, clonata ed espressa nel batterio Gram positivo Bacillus subtilis per evitare contaminazioni da. 1.
(6) lipopolisaccaride batterico nella preparazione. Questi due data points segnano rispettivamente la fase precedente il picco di eosinofilia e il periodo in cui le IgE si stabilizzano durante la trichinellosi sperimentale murina. La raccolta di sangue periferico dagli animali appartenenti ai diversi gruppi sperimentali (infetti trattati con HP-NAP e controlli infetti) ha permesso di monitorare l’andamento della risposta immunitaria attraverso la conta leucocitaria, il dosaggio di IgE totali e parassita-specifiche e la determinazione di pattern citochinici. Inoltre le cellule della milza degli animali infetti e di quelli trattati sono state utilizzate in un sistema ex vivo per confermare l’immunomodulazione e per studiare il target cellulare e il rispettivo recettore coinvolto nella trasmissione del segnale di HPNAP nelle cellule dell’immunità. In aggiunta, sono stati effettuati esperimenti in vivo in presenza dell’anticorpo specifico per la molecola recettoriale a cui HPNAP si lega per bloccare l’azione di questa molecola di origine batterica. Per quanto riguarda gli aspetti parassitologici, gli animali sono stati oggetto di analisi istologiche ed immunoistochimiche a livello muscolare oltre alla valutazione del carico parassitario, mediante digestione cloridro-peptica delle carcasse degli animali. Le metodologie d’analisi usate durante la sperimentazione hanno dimostrato la capacità di HP-NAP di immunomodulare la risposta Th2, abbassando significativamente il picco di eosinofili e i livelli di IgE totali e specifiche dell’infezione elmintica. L’azione di HP-NAP è risultata fortemente efficace nell’aumentare i livelli di IFN-γ ed IL-12 e diminuire quelli di IL-4 e IL-5 sia negli animali infetti da T. spiralis e trattati con HP-NAP, sia nel sistema ex-vivo derivato dalla milza di questi topi, a confronto con gli animali infetti e non trattati. Inoltre è stato confermato che HP-NAP agisce su cellule dell’immunità innata. 2.
(7) mediante il recettore TLR2, attivando in esse un’espressione citochinica diversa da quella indotta da PAM3, anch’esso agonista del TLR2. Una volta accertato lo shifting immunologico operato da HP-NAP è stata valutata l’interazione ospiteparassita con particolare attenzione alla fase muscolare di Trichinella, in cui il parassita si incista nella cellula muscolare striata scheletrica dell’ospite inducendo la formazione della nurse cell, interamente deputata a nutrire e proteggere l’elminta stesso. L’analisi istologica ha evidenziato, grazie all’ausilio di un software dedicato, un aumentato infiltrato infiammatorio circostante il complesso nurse cellparassita nei topi trattati con HP-NAP, accompagnato da elevati livelli plasmatici di metalloproteasi 9 attiva, considerata un marker della migrazione leucocitaria transendoteliale. Colorazioni istologiche appropriate hanno fatto emergere anche una minore presenza di eosinofili nell’infiammazione muscolare pericapsulare, confermando la riduzione di questi polimorfonucleati sia a livello periferico che tissutale. L’immunoistochimica con l’impiego dell’anticorpo anti-arginasi 1, marker dell’attivazione macrofagica in senso alternativo, evidenzia una maggiore produzione di questo enzima nell’infiltrato infiammatorio muscolare dei topi infetti in confronto ai topi trattati. Sorprendentemente il carico parassitario degli animali trattati è risultato tre volte maggiore degli animali di controllo, sebbene la dose infettante sia stata la stessa. E’ opportuno però sottolineare che la prima somministrazione dell’adiuvante pro-Th1 HP-NAP è avvenuta durante la fase intestinale del parassita, durante la quale i sistemi Th2 sono responsabili di promuovere la rapida espulsione dell’agente infettivo dalla mucosa intestinale. Inoltre le correlazioni inverse tra il carico parassitario e i parametri Th2. 3.
(8) (eosinofili, IgE totali e specifiche) emerse dai nostri studi suggeriscono l’importanza di tale tipo di risposta immune nel contrastare l’infezione. Il dualismo del nostro disegno sperimentale lascia osservare i risultati ottenuti da due differenti punti di vista. La molecola di origine batterica, HP-NAP, conferma nel modello sperimentale di infezione elmintica il suo potenziale immunologico, risultando in grado di deviare la risposta immunitaria all’agente infettivo. La prospettiva parassitologica vede invece il rapporto ospite-parassita sotto una nuova luce secondo cui la risposta immunitaria Th2 acquisisce un valore ospite-protettivo appannaggio della difesa dell’ospite contro la massiva infezione di Trichinella nel muscolo.. 4.
(9) ABSTRACT. During Trichinella spiralis infection host defense is based on eosinophilia and increased IgE levels, as observed in Th2 mediated diseases like asthma and allergic rhinitis. Nowadays allergic diseases are treated with an alternative approach to the usual immunesuppressive method, using the mutual antagonism between Th1 and Th2 cytokines. For this reason the research has investigated new Th1 adjuvant molecules able to contrast the exacerbated Th2 responses to allergens. In particular among a large panel of pro-Th1 adjuvants, the protein of bacterial origin Helicobacter pylori neutrophil activating protein (HP-NAP) can induce immunity cells to activate towards a Th1 phenotype, also acting in vitro on Th2 polarized cells. The aim of the present PhD thesis was to verify the immunological efficacy of HP-NAP in the experimental mouse model of T. spiralis infection, characterized by a Th2 immune response, which represents an alternative to the classical approach of ovalbumin-induced asthma. This experimental study offers not only the possibility to evaluate the immunological effects of the bacterial adjuvant, but also to assess parasitological issue in the immunomodulated hostparasite relationship. After a preliminary study a dosage of 10 µg of HP-NAP was chosen to be administered intraperitoneally at 10th and 28th day after experimental infection in correspondence with eosinophilia peak and plasma IgE level plateau in our mouse model of T. spiralis infection, respectively. HP-NAP used was cloned and espressed in the Gram positive Bacillus subtilis to avoid endotoxin contamination.. 5.
(10) Peripheral blood collection from different experimental groups (infected animals treated with HP-NAP or with PBS) allowed us to study the immune response along the infection using leukocyte count, total and parasite specific IgE level and cytokine profile determination. In addition, splenocytes from treated and control animals were used in an ex vivo system to confirm HP-NAP immunomodulation and identify cellular target and the respective receptor involved in HP-NAP signaling pathway on immunity cells. Further, in vivo experiments were performed using our bacterial adjuvant in addition to the antibody blocking the toll-like receptor 2 (TLR2) which is responsible for HPNAP signal transmission. For the evaluation of parasitological aspects, animals were examined by histological, histochemical and immunohistochemistry analysis at muscle level and their carcasses were digested in a chloride pepsin solution for parasitological burden assessment. Results obtained from our experimental work showed HP-NAP ability to immunomodulate the Th2 response, reducing significantly eosinophils peak and total and parasite IgE levels during the helminthic infection. HP-NAP action resulted strongly active in increasing IFN-γ and IL-12 levels and diminishing IL-4 and IL-5 levels both in animals treated with HP-NAP and in ex-vivo system derived from treated infected mouse spleens compared to cells from infected animal controls. Besides, the ex-vivo experiments confirmed HP-NAP action on innate immunity cells through HP-NAP/TLR2 binding, able to stimulate a cytokine profile expression different from that of another TLR2 agonist such as PAM3. All these data show that HP-NAP, acting through the TLR2, is capable also in vivo to shift the immune response to a Th1 phenotype.. 6.
(11) After having studied the effects of HP-NAP in immunological response, we aimed to understand the host-parasite relation focusing on Trichinella muscle phase, during which the parasite enters the striated skeletal muscle cell inducing the nurse cell formation, devoted to nourishing and to protection of the helminth. Histological analysis evidenced by means of an appropriate software an increased inflammation infiltrate surrounding nurse cell-parasite complex in HPNAP treated animals, in addition to elevated active matrix metalloproteinase 9 (MMP-9) plasma levels, considered a leukocyte transendothelial migration marker. Histochemical staining revealed a reduction in eosinophil number in muscular pericapsular inflammation in HP-NAP treated animals, confirming the decrease of these polymorphonucleate cells at blood level. This suggests that the decrease in the blood induced by HP-NAP is not due to an increased extravasation of eosinophils but rather to the reduced IL-5 plasma levels observed in HP-NAP treated animals. Immunohistochemistry with an anti-arginase 1 antibody, an enzyme which is considered a marker of alternative macrophage activation, showed a decreased staining of this enzyme in muscle inflammatory infiltrate of treated infected animals. Surprisingly, parasite burden of HP-NAP treated animals is thrice times that of control animal. It is important underline that the first HP-NAP administration when intestinal parasite phase is not yet ended in the mouse strains used (BALB/c) shifted host immunity to a Th1 response, which might have delayed worm expulsion, increasing the number of migrant larvae produced. Besides inverse correlation between parasite burden and Th2 parameters (eosinophils, total and specific IgE) suggests the importance of this type of host immune response against parasite infection.. 7.
(12) Our experimental design offers a dualistic point of view. In experimental helminthic infection the molecule of bacterial origin confirms its immunological potential,. shifting. host. immune. response. to. Trichinella. infection.. Immunomodulation of parasite infection provides new information on hostparasite relationship: in our model the Th2 immune response acquires an host protective value in favor of host defense versus massive Trichinella infection in muscle.. 8.
(13) INTRODUZIONE. 1.. Adiuvanti e loro principali impieghi Gli Adiuvanti (dal latino "adjuvare" = aiutare) sono delle sostanze che. amplificano la risposta immunitaria umorale e/o cellulo-mediata verso un antigene e per questo utilizzati nella formulazione dei vaccini insieme all’antigene vaccinico e ad eventuali conservanti, che bloccano la decomposizione o la moltiplicazione dei costituenti biologici vivi o attenuati del vaccino. Gli adiuvanti inducono una risposta immune più rapida, più potente e più duratura contro l’antigene co-somministrato. Inoltre possono facilitare la somministrazione di ridotte quantità di antigene, riducendo i costi di produzione del vaccino. I requisiti che un composto deve avere per essere utilizzato come adiuvante sono: • essere sicuro; • suscitare immunità protettiva, anche contro deboli immunogeni; • non essere pirogeno; • essere efficace in neonati e bambini; • creare una preparazione stabile con l’antigene; • essere biodegradabile; • non essere immunogenico.. Esistono diversi tipi di adiuvanti; nella maggior parte dei vaccini ad uso umano si utilizzano da diverse decine di anni i sali colloidali dell’alluminio, come. 9.
(14) l’idrossido di alluminio e il fosfato di alluminio, e il calcio fosfato, la cui efficacia e la provata sicurezza li rendono particolarmente adatti per la preparazione di vaccini utilizzati in età pediatrica come il vaccino anti difterico e quello antitetanico, oltre ad essere usato nel vaccino contro l’epatite A e B e il papilloma virus (Aprile & Wardlaw, 1966; Scolnick, 1984). Il principale meccanismo d’azione di questi adiuvanti minerali è la formazione di sistemi deposito nel sito di iniezione, con lento rilascio dell’antigene. I sali di alluminio sono anche in grado di attivare il complemento, portando ad una risposta infiammatoria locale e al conseguente richiamo di cellule immunocompetenti nel sito d’azione. I derivati dell’alluminio presentano anche qualche svantaggio: • stimolano solo la risposta umorale (Bomford, 1980); • non possono essere liofilizzati; • hanno scarso potere adiuvante quando combinati ad alcuni antigeni.. Altri tipi di adiuvanti si basano su emulsioni oleose, che devono la loro efficacia alla formazione di sistemi deposito e, in alcuni casi, ad una diretta attività immunostimolatoria. Alcune emulsioni oleose possono causare effetti collaterali come infiammazione, febbre, dolore acuto, ipersensibilizzazione oltre ad essere potenzialmente cancerogeni. Il più noto è l'adiuvante di Freund, emerso dagli studi sulla tubercolosi. E’costituito da un’emulsione di acqua e oli minerali (essenzialmente paraffina) nella quale viene miscelato l'antigene. Esistono due tipi di adiuvante di Freund: il completo e l’incompleto che si differenziano per l’aggiunta di Mycobacterium tuberculosis ucciso al calore. La tossicità dell’adiuvante di Freund non lo rende però adatto ai trials clinici dei vaccini (Hui et al., 1991; Stewart-Tull, 2010). Le emulsioni oleose approvate per l’uso umano. 10.
(15) sono. MF59,. un’emulsione. dello. squalene,. in. grado. di. aumentare. l’immunogenicità dei vaccini anti-influenzali stagionali e pre-pandemici, mantenendo un profilo accettabile di tollerabilità e sicurezza. Recentemente è stata approvata l’emulsione oleosa AS03 come componente del vaccino prepandemico del virus H5N1 e del vaccino pandemico H1N1 del 2009.. Altri tipi di adiuvanti sono costituiti da alcuni microrganismi, come varie specie di Mycobacterium, Corynebacterium parvum, C. granulosum e Bordetella pertussis, dimostratisi buoni adiuvanti. Essi possono però essere troppo tossici, per cui si preferisce ricorrere all’uso di loro frammenti. Tra i composti più utilizzati troviamo l’endotossina, il lipide A e i suoi derivati (Coler et al., 2011), dipeptide muramile, tealosio dimicolato. Oltre alle sostanze immunostimolatorie citate sopra altri composti presentano attività adiuvante. Tra le più importanti troviamo le saponine (una famiglia di glicosidi largamente distribuite nelle piante) e i liposomi (la cui attività dipende dalla composizione, dal numero di strati e dalla carica) che risultano essere ottimi adiuvanti sia per antigeni proteici che per carboidrati stimolando una risposta sia da parte delle cellule B che da parte delle cellule T. Recentemente i complessi immunostimolatori (ISCOM), il monofosforil lipide A e le formulazioni adiuvanti Syntex (SAFs), che contengono treonil derivati e il muramil dipeptide, sono stati presi in considerazione per l’uso nei vaccini umani. Per ultimo, l'associazione di antigeni vaccinali, adiuvanti convenzionali o meno, ed alcune citochine come l’ IL -2 o l'interferone, sono in fase di studio per il loro potenziale di stimolazione antigenica (Zhang et al., 2011) In generale, queste sostanze agiscono fondamentalmente favorendo la concentrazione e la presentazione degli antigeni al sistema immunitario, mediante. 11.
(16) il sequestro degli antigeni vaccinali e la successiva liberazione in modo lento e prolungato. Inoltre alcuni adiuvanti possono indurre il rilascio di interleuchine e citochine, favorendo la chemiotassi delle cellule dell’immunità. E’ il caso della molecola in studio, HP-NAP, che è capace di stimolare la produzione di IL-12, attraverso il legame al TLR2 delle cellule APC. Ancora, l’uso di adiuvanti può indurre una modificazione dell’antigene, aumentandone l’immunogenicità intrinseca.Tali modificazioni includono: •. polimerizzazione di antigeni proteici (es: tossoidi del tetano e della. difterite); • coniugazione di proteine a polisaccaridi; • formazione di cationi sugli antigeni proteici.. La natura chimica degli adiuvanti, la loro modalità d’azione e le rispettive reazioni avverse sono altamente variabili (Rodrigues et al., 2010). Secondo Gupta et al. (1993) alcuni effetti collaterali degli adiuvanti sono ascrivibili ad una stimolazione non intenzionale del sistema immunitario mentre altri effetti, meno probabili, possono riflettere una generale reazione farmacologica avversa. La scelta di uno di questi adiuvanti riflette un compromesso tra il loro potere adiuvante ed un livello accettabilmente basso di reazioni avverse all’uso.. 12.
(17) 2. Helicobacter pylori neutrophil activating protein 2.1 HP-NAP Helicobacter pylori neutrophil activating protein, (HP-NAP), è uno dei maggiori fattori di virulenza, al di fuori dell’isola di patogenicità cag (cytotoxin associated gene), del batterio Gram negativo H. pylori.. Diversi ceppi di H. pylori hanno il gene napA, codificante la proteina HPNAP, sottolineando la conservazione nell’evoluzione di tale proteina e quindi la sua importanza nella crescita e sopravvivenza del batterio. L’espressione genica di napA porta alla traduzione di una proteina di 144 amminoacidi, HP-NAP, che non possiede alcuna sequenza leader indicando che il peptide non viene esportato fuori dalla cellula. La sequenza nucleotidica immediatamente a monte di napA è ricca in basi A+T, similmente alla sequenza a monte della open reading frame della ferritina di Helicobacter pylori, suggerendo una possibile omologia con i promoters che regolano l’uptake del Ferro (Fur) (Evans et al., 1995).. HP-NAP, insieme alle ferritine batteriche, si accumula nella fase stazionaria di crescita: si trova nel citoplasma del batterio e viene rilasciato per lo più a seguito della sua lisi nel mezzo extracellulare dove si lega alla superficie batterica e funge da ponte mediando il legame alla mucina, proteina altamente glicosilata componente della barriera mucosa dello stomaco, e ai glicosfingolipidi di membrana dei neutrofili.. E’ stata isolata per la prima volta a seguito di tecniche cromatografiche dall’estratto acquoso di H. pylori (Evans et al., 1995). 13.
(18) Il confronto amminoacidico in banca dati ha indicato un’alta similarità con la famiglia delle DNA protecting proteins (Dps) e delle ferritine batteriche, riscontrando omologie con una Dps di E. coli, una ferritina di Listeria innocua, e due Dps like di Bacillus anthracis. La predizione strutturale della proteina e l’analisi spettroscopica rivelano una maggiore omologia con la famiglia delle Dps rispetto a quella delle batterioferritine (Tonello et al., 1999): dall’analisi di microscopia elettronica il monomero di HP-NAP presenta una struttura ad anelli esagonali di 9-10 nm di diametro a 12 subunità con un buco centrale simile alle Dps e differente dalla struttura esagonale di 12 nm di diametro con 24 subunità della ferritina. Nonostante la divergenza strutturale dell’HP-NAP con le ferritine, la molecola di Helicobacter pylori è resistente alla denaturazione termica e chimica al pari delle ferritine stesse: al dicroismo circolare l’ellitticità non varia significativamente a temperature superiori ad 80° C, e solo ad una dose 4 molare di cloruro di guanidinio il contenuto in α elica si abbassa (Tonello et al., 1999). Ogni monomero di HP-NAP presenta 4 motivi ad α eliche, similmente alle Dps, che si oligomerizzano in dodecameri di 90 Amstrong con 32 simmetrie (Zanotti et al., 2002). Ogni subunità del dodecamero ha forti interazioni con le subunità vicine: almeno venti legami ad idrogeno sono presenti per monomero (Zanotti et al., 2002). La superficie interna di HP-NAP ha una forte carica negativa, caratteristica comune alle ferritine e alle Dps, dovuta alla funzione di iron storage (Zanotti et al., 2002). Invece diverse cariche positive sulla superficie ne conferiscono un carattere basico, che ad esempio per le chemochine gioca un ruolo nell’attivazione dei neutrofili (Zanotti et al., 2002). HP-NAP ha una forma molto simile a quella di una palla sferica con una cavità interna contenente ferro: ogni dodecamero è capace di legare fino a 500 atomi di Ferro, nutriente essenziale. 14.
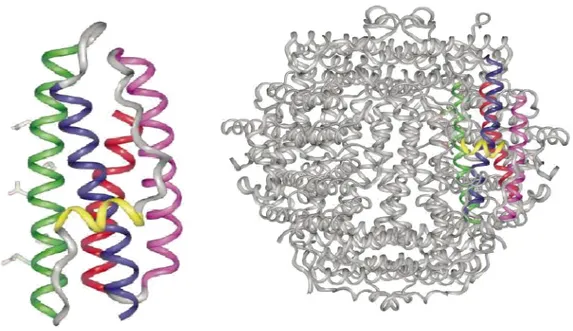
(19) per la crescita batterica (ogni monomero lega 40 atomi di Ferro) (Tonello et al., 1999). Inoltre l’importanza di questo metallo risiede anche nel suo indispensabile ruolo nella stabilizzazione iniziale dei dimeri molecolari che andranno a formare l’intero dodecamero HP-NAP (Ceci et al., 2007).. Figura 3.1: A sinistra è illustrato il monomero della proteina HP-NAP che oligomerizza a dodecamero come raffigurato a destra. Il centro ferrossidasico della proteina, che catalizza l’ossidazione del Fe 2+ a Fe. 3+. , presenta delle differenze con la ferritina di cavallo per la sostituzione di. alcuni amminoacidi nel motivo ripetuto ed inoltre perchè non ha il gruppo eme, mentre ha delle omologie con le batterioferritine dello stesso Helicobacter pylori, Escherichia coli ma anche Schistosoma mansoni (Evans et al., 1995). Sebbene in vitro sia stata osservata un’attività ferrossidasica della proteina (Zanotti et al., 2002), la sintesi di HP-NAP non è però regolata dalla mancanza di ferro o dal suo incremento, né dalla presenza di rame, zinco e nichel nel mezzo (Dundon et al., 2001). Neanche il pH e lo stress ossidativo influenzano la sintesi di HP-NAP 15.
(20) (Dundon et al., 2001). Inoltre il clonaggio e l’espressione della proteina in Escherichia coli non permette di conferire all’enterobatterio resistenza ai metalli quali rame, zinco e nichel, a differenza delle batterioferritine (Dundon et al., 2001). Per questo si esclude un ruolo primario di HP-NAP come metal-binding protein. Considerando che HP-NAP è anche un membro delle Dps si è valutata la possibilità che leghi e protegga il DNA in condizioni di stress. Pur non possedendo residui ammino-terminali carichi positivamente, come i restanti membri della classe Dps, più molecole di HP-NAP si aggregano e si legano al DNA in modo aspecifico a pH 6,5-7 (Ceci et al., 2007). A pH 7,5-8 HP-NAP è sempre capace di legare il DNA ma secondo una conformazione non aggregante: singoli dodecameri si distribuiscono casualmente lungo l’elica del DNA. A pH 8,5 HP-NAP non si lega al DNA. L’aggiunta di ferro durante questi esperimenti non ha alterato la capacità della proteina di legare il DNA, aggiungendo così la protezione dai radicali idrossili che dipende dal centro ferrossidasico ed è indipendente dal pH (Ceci et al., 2007). La protezione fisica da eventuali nucleasi mediante il complesso HP-NAP/DNA a pH debolmente acidi fa emergere una nuova sfaccettatura nel poliedrismo dell’HP-NAP: questa molecola non solo promuove l’infiammazione e il conseguente stress ossidativo ma allo stesso tempo protegge il DNA batterico in ambienti debolmente acidi, come l’ambiente gastrico durante la digestione, unendo così in un’unica molecola l’istinto di sopravvivenza del batterio alla protezione dall’ospite.. Tra le varie sostanze ad attività chemiotattica del batterio, distinti in cellbound, cell free, naturalmente rilasciati nel brodo di coltura o a seguito di sonicazione o estrazione, anche HP-NAP presenta questa caratteristica. E’ infatti. 16.
(21) in grado di attraversare l’endotelio a seguito di internalizzazione mediante endocitosi (Polenghi et al., 2007) ed entrare in contatto con le cellule del sangue, aumentando l’espressione sulla membrana dei neutrofili di molecole di adesione leucocitaria CD11/CD18 (beta 2 integrina), le quali mediano funzioni cruciali nei fenomeni di chemiotassi ed adesione all’endotelio (Evans et al., 1995). Infatti nell’esperimento di Blissert et al. (2005), in cui è stato accuratamente riprodotta la migrazione transendoteliale dei neutrofili mediante due camere separate da un monolayer di cellule umane endoteliali, la deplezione di HP-NAP dalla cultura di Helicobacter pylori ha ridotto la transmigrazione dei neutrofili attraverso la barriera endoteliale. I dati sono stati confermati anche dall’uso del mezzo di coltura filtrato dal ceppo batterico mutante per HP-NAP. Tra le variazioni indotte da HP-NAP sui neutrofili si annoverano anche le variazioni dell’espressione dell’antigene 24Ag (Polenghi et al., 2007). Inoltre è stato anche appurato che HPNAP non induce attivazione endoteliale. L’aumento dell’integrina beta 2 è stata osservata oltre che nei neutrofili anche in monociti attivati da HP-NAP mediante analisi al FACS (Fluorescence Activated Cell Sorting) (Satin et al., 2000). A questa up-regulation si accompagna anche l’aumento sulla membrana della nicotinamide-adenina-dinucleotide-fosfato-ossidasi (NADPH-ossidasi), risultante nella formazione di radicali visualizzabili con lo sviluppo di colorazione NBT (nitroblu di tetrazolio) (Evans et al., 1995). Questo enzima, che catalizza la riduzione dell’ossigeno molecolare a ione superossido, si compone di 4 subunità: due localizzate nella membrana cellulare a formare il complesso citocromo b 558 (p 22 e la gp 91 phox), e le altre due nel citoplasma (p47 e la p67). Dopo stimolazione con HP-NAP, nei neutrofili si attiva la NADPH ossidasi: le subunità citosoliche traslocano alla membrana dove si assemblano a formare il complesso. 17.
(22) enzimatico capace di svolgere la piena attività ossidasica (Satin et al., 2000). La capacità di attivare i neutrofili promuovendo l’attività NAPDH ossidasica è stata ulteriormente validata da esperimenti su neutrofili di pazienti con malattia granulomatosa cronica, in cui si osserva la mancata attività in queste cellule dopo stimolazione con HP-NAP, ottenendo gli stessi risultati con neutrofili normali usando difenilen-iodonio (DPI), usato come inibitore di NADPH ossidasi (Satin et al., 2000). Ulteriore inibizione dell’attività neutrofilica si riscontra in presenza della tossina della pertosse, le proteine fosfatasi tipo 1 (PP1) e la wortmannina, gettando le basi per studi volti alla scoperta dei meccanismi molecolari a monte dell’attivazione dell’enzima NADPH ossidasi. Infatti attraverso questi inbitori è stato possibile evidenziare il ruolo di una proteina G, sensibile alla tossina della pertosse, in grado di mediare la trasmissione del segnale HP-NAP ai neutrofili attivando una cascata di segnali che culminano nell’aumento di calcio intracitoplasmatico, coinvolgendo la fosfatidilinositolo 3 chinasi (PI3K), inibita dalla wortmannina, e la tirosin chinasi Src, sensibile al PP1, che è implicata nell’attivazione della NADPH ossidasi (Satin et al., 2000). A questo pathway intracellulare, che porta al burst ossidativo e alla chemiotassi dei neutrofili umani stimolati da HP-NAP, si aggiunge l’azione delle chinasi regolate da segnali extracellulari (ERK) e dalla MAP chinasi p38-mentre la chinasi c-Jun non sembra attivarsi (Nishioka et al., 2003). La conseguente produzione di specie reattive dell’ossigeno sui neutrofili ma anche sui monociti attivati dura per ben 30-40 minuti (Satin et al., 2000). Proprio questi esperimenti hanno permesso di denominare questa molecola di Helicobacter pylori “Neutrophil activating protein”.. 18.
(23) L’attivazione dei neutrofili da parte di HP-NAP è indipendente dall’LPS o da formyl-Met-Leu-Phe (fMLP), peptide sintetico che mima l’attività di peptidi di origine batterica come metionina ammino terminale formilata (Evans et al., 1995). Altri autori, invece, riconoscono anche un ruolo indiretto di HP-NAP nell’attivazione neutrofilica: la molecola batterica sembrerebbe in grado di promuovere l’adesione tra SabA, l’adesina batterica legante l’acido sialico, e i carboidrati dell’epitelio gastrico dell’ospite creando così l’interazione chiave per l’attivazione dei neutrofili secondo quanto accertato dalla tecnica della chemiluminescenza luminolo-amplificata (Petersson et al., 2006). Ulteriori studi attribuiscono ad HP-NAP un ulteriore effetto sui neutrofili: favorirebbe, infatti, la secrezione in queste cellule di mieloperossidasi, fattore patofisiologico dello stress ossidativo ad azione pro-infiammatoria, che può contribuire direttamente al danno tissutale (Wang et al., 2008). Questi dati sono stati confermati anche in vivo dal riscontro di alti livelli di ROS (Reactive Oxigen Species) e mieloperossidasi nelle biopsie umane di pazienti affetti da H. pylori (Wang et al., 2008).. Recenti studi hanno inoltre dimostrato che HP-NAP è in grado di prolungare la sopravvivenza dei monociti attraverso la stimolazione ed il rilascio di IL-1β da queste stesse cellule: in presenza di HP-NAP i monociti sono protetti dall’apoptosi, processo che naturalmente li porterebbe a morte entro 5 giorni, aumentandone l’espressione di geni anti-apoptotici come MCL-1, A1, Bcl-2 e BCL-XL (Cappon et al., 2010). L’aumento di soppravvivenza si riscontra in presenza di HP-NAP anche per i neutrofili, ma solo in presenza dei monociti, ipotizzando un ruolo indiretto della proteina sui neutrofili. Tali evidenze. 19.
(24) supporterebbero a maggior ragione un ruolo attivo di HP-NAP nel mantenere uno stato infiammatorio cronico che caratterizza l’infezione del batterio in vivo.. HP-NAP gioca un ruolo nel turnover della fibrina mediata dai monociti. In generale una volta attivati, i monociti esprimono la proteina transmembrana da 47 kDa detta Tissue factor (TF) che favorisce la cascata proteasica che porta alla deposizione di fibrina. In più i monociti possono regolare la fibrinolisi secernendo u-PA ed esprimendo specifici recettori per u-PA e plasminogeno che portano alla formazione della plasmina sulla superficie cellulare che può degradare la fibrina e le componenti della matrice extracellulare. In questo ambito HP-NAP è capace di spostare questo equilibrio stimolando le cellule mononucleate a sintetizzare TF e PAI-2 senza alterare la produzione di u-PA, favorendo la formazione di fibrina e la sua persistenza (Montemurro et al., 2001). Tutto ciò favorirebbe la colonizzazione batterica, impedendo la ricostruzione del tessuto (attuata dalla rimozione della fibrina e dei detriti), e allo stesso tempo la persistenza della fibrina potrebbe ostacolare il movimento dei fagociti verso il batterio. L’insieme di queste attività potrebbe spiegare l’aumento del rischio ischemico associato all’infezione da Helicobacter pylori.. HP-NAP è inoltre capace di indurre il rilascio di β-esosoaminidasi (idrolasi lisosomiali degradanti glicoproteine e glicolipidi) ed IL-6 nei mastociti peritoneali di ratto, coinvolgendo così altre cellule dell’immunità nel ventaglio delle sue attività (Montemurro et al., 2002).. 20.
(25) HP-NAP è uno dei maggiori antigeni immunogenici di Helicobacter pylori. Infatti ben il 60% dei pazienti affetti da H. pylori presentano anticorpi specifici anti HP-NAP; percentuale alta considerando che CagA è riconosciuta nel 74% dei pazienti (Satin et al., 2000). E’ stato per questo candidato come possibile vaccino contro l’infezione da questo batterio. A prova di questo, alcuni topi sono stati vaccinati per via orale con la proteina ricombinante HP-NAP clonata ed espressa in Bacillus subtilis. Alla successiva infezione sperimentale con il batterio, i topi sono risultati protetti per l’80%, non riscontrando alcuna traccia di colonizzazione nello stomaco, ed inoltre si è riscontrata la presenza di anticorpi specifici contro la proteina nel plasma dei topi vaccinati (Satin et al., 2000). A questo riguardo il gene codificante per HP-NAP è stato espresso nel ceppo vaccinico di Salmonella typhi murium SL 326 arrivando a rappresentare ben il 37.5% delle proteine totali batteriche (Jiao et al., 2003). Successivi studi hanno riproposto il vaccino a DNA di HP-NAP in S. typhi murium vivo attenuato (che nell’uomo ha buona persistenza ed immunogenicità) ottenendo una buona risposta anticorpale in topi immunizzati (Sun et al., 2006). Entrambe queste ricerche pongono le basi per ulteriori sviluppi in progetti di vaccini orali a DNA in vettori batterici, presentandosi come valida alternativa ai vaccini proteici, che prevedono una laboriosa purificazione, ed inoltre permettono una maggiore protezione degli antigeni immunogenici alla degradazione e denaturazione nello stomaco. Intanto si profila un impiego di HP-NAP come antigene diagnostico per l’infezione da H. pylori: usando la molecola ricombinante come antigene in un sistema ELISA (Enzyme-linked immunosorbent assay) è emersa un’alta sieropositività nei pazienti con cancro gastrico e disturbi gastro-intestinali (97.7%. 21.
(26) e 85.7% rispettivamente), il tutto accreditato da un’alta sensibilità e specificità del test (Long et al., 2009).. 2.2 HP-NAP come adiuvante pro-Th1 Un ruolo di HP-NAP che si può definire parallelo alle molteplici attività descritte sinora è quello di agente immunomodulante del sistema immunitario innato. HP-NAP ha infatti un ruolo dualistico: uno nell’ambito delle interazioni cellulari, l’altro come molecola immunomodulante. HP-NAP si è sorprendentemente dimostrata capace di influenzare, dirigere e modificare la risposta immune dei monociti e neutrofili (Amedei et al., 2006). Infatti queste cellule stimolate in coltura dalla proteina ricombinante HP-NAP, espressa nel batterio gram positivo Bacillus subtilis per evitare la contaminazione da LPS, mostrano un’up-regulation nell’espressione di IL-12 e IL-23. Da esperimenti di reverse transcriptase real time PCR i neutrofili presentano il picco d’espressione della subunità pesante β di 40 kDa (p40), che controlla il legame al recettore, a 6 ore di stimolazione, mostrando valori sempre superiori rispetto all’altra subunità, l’α di 35 kDa (p35), interleuchina 12-specifica, che, anche se presente a 6 ore, raggiunge il suo picco a 12 ore. L’eterodimero p70 dell’IL-12, risultante dal legame mediante ponte disolfuro tra le subunità p35 e p40, raggiunge il suo massimo valore a 12 ore di stimolazione secondo le misure del metodo ELISA nel surnatante di coltura dei neutrofili in coltura con HP-NAP. La subunità p40 oltre a legarsi alla p35 per formare l’IL-12, si può assemblare alla subunità p19 dando vita all’IL-23: il messagero p19, infatti, va incontro ad upregulation a seguito della stimolazione con HP-NAP. Lo stesso quadro si riscontra. 22.
(27) nella stimolazione dei monociti: IL-12 p35 ha un picco a soli 30 minuti, p40 fra 8 e 12 ore mentre IL-23 p19 a 2 ore; in accordo con l’accumulo di IL-12 nel supernatante di coltura. Quindi a seguito di un monitoraggio di 24 ore, i neutrofili e i monociti umani stimolati da HP-NAP creano un milieu citochinico ricco di IL12 e IL-23, citochine capaci di indirizzare l’immunità verso una risposta Th1. Altri studi hanno anche evidenziato nei neutrofili un aumento di espressione di chemochine come CXCL8, CCL3 e CCL4, a seguito di stimolazione con HP-NAP (Polenghi et al., 2007). E’ stato inoltre osservato che HP-NAP in coltura con i monociti ne prolunga la sopravvivenza per poi indurvi la differenziazione in cellule dendritiche (DCs) mature, con marcato aumento d’espressione di molecole di superficie come HLA-DR, CD80 e CD86. E proprio queste DCs a sole 24 ore di stimolazione con HP-NAP producono l’IL-12 p70 nel surnatante (Amedei et al., 2006).. Essendo HP-NAP in grado di interagire con le cellule dell’immunità innata si è valutata l’ipotesi che potesse interagire con i Toll like receptors (TLRs). Utilizzando la linea cellulare HEK 293 (Human embryonic kidney), priva dei recettori TLRs ma provvista dell’intera macchina di trasduzione del segnale degli stessi, si è evidenziato che solo le cellule trasfettate con il TLR-2, a differenza degli altri TLRs, “sentivano” lo stimolo di HP-NAP attraverso l’attivazione del costrutto NFkB reporter (Amedei et al., 2006). Per verificare che solo HP-NAP fosse capace di indurre la stimolazione di IL-12 sulle cellule dell’immunità innata, gli altri TLR2 agonisti (PAM2 e PAM3), lipopeptidi sintetici triacilati, sono stati messi in coltura con i monociti. Sebbene PAM2 e PAM3 inducano la produzione. 23.
(28) di TNF-α, IL-6 e IL-8 al pari di HP-NAP, solo ed unicamente la molecola di origine batterica è in grado di stimolare la produzione di IL-12, in un rapporto dose-dipendente, nei monociti (Amedei et al., 2006). Ulteriore conferma dell’effetto di HP-NAP è stato ottenuto mediante immunodeplezione della molecola, uso di anticorpi anti HP-NAP e ceppo mutante per HP-NAP di Helicobacter pylori: in tutte queste condizioni mancava la produzione di IL-12 e delle altre citochine, mentre in presenza del batterio mutante la sintesi di TNF-α, IL-6 e IL-8 persisteva (Amedei et al., 2006). Esperimento molto importante nell’ambito dell’immunomodulazione da HP-NAP è stato quello in cui sono stati studiati gli effetti sui PBMCs (Peripheral Blood Mononuclear Cell) provenienti da individui atopici e da persone reattive alla tossina tetanica (Amedei et al., 2006). Cloni di cellule T, reattivi al tossoide tetanico e condizionati in coltura con la tossina in presenza di APCs autologhe irradiate, presentano una maggiore risposta Th1 in presenza di HP-NAP piuttosto che in sua assenza sulla base della produzione di IFN-γ misurata mediante ELISPOT (Enzyme-linked immunosorbent spot). Anche cloni di cellule T di individui. allergici. stimolati. in. coltura. con. l’allergene. della. polvere. Dermatophagoides pteronyssinus in presenza di terreno, HP-NAP, PAM2 o PAM3 hanno mostrato con il saggio ELISPOT un significativo aumento di cellule T producenti IFN-γ solo in presenza di HP-NAP. L’influenza di HP-NAP su cellule già programmate verso un pattern citochinico Th2 è stata ulteriormente confermata dalla produzione di alti livelli di IFN-γ riscontrabili nel surnatante di cloni allergene-specifici stimolati da HP-NAP, accompagnato da un’analisi alla citofluorimetria di flusso che ha mostrato un 38% di risposta Th1, 33% Th0, e solo un 29% Th2, similmente a quanto riscontrato con stimolazione con IL-12, e. 24.
(29) in contrasto con i cloni di controllo dove una prevalente risposta Th2 (89%) sovrasta una nulla risposta Th1 (0%) e una bassa risposta (11%) Th0. La stessa attivazione Th1 si è riscontrata negli stessi cloni allergene-specifici dopo stimolazione con il batterio wild-type H. pylori mentre è risultata assente nel mutante nullo per la codifica della proteina HP-NAP. Emerge dunque una proprietà aggiuntiva di HP-NAP per cui la molecola non è solo capace di promuovere una risposta Th1 ma è anche in grado di modellare, “intonare” o meglio “cucire” questo profilo su cellule già indirizzate verso un altro pattern citochinico. A completare il quadro immunologico, l’attività citotossica caratterizzante l’attivazione Th1 ma anche Th0 è stata valutata nei cloni reattivi all’allergene in presenza ed in assenza di HP-NAP: nei cloni stimolati con la molecola si evidenzia l’attività citotossica e la produzione di TNFα differentemente a quanto avviene in mancanza di stimolazione (Amedei et al., 2006). Il chiaro indirizzamento Th1 dimostrato in vitro da HP-NAP ha ricevuto una correlazione anche in vivo. Infatti cloni di cellule T, HP-NAP reattivi, isolati da biopsie gastriche di pazienti affetti da Helicobacter pylori presentano una completa attivazione Th1 di queste cellule, a cui si associa un’ up-regulation di IL-12p40, IL-12p35, TNFα e IFN-γ (Amedei et al., 2006).. Alla luce di questi risultati HP-NAP assume un ruolo cruciale nel regolare l’immunità innata e conseguentemente l’immunità adattativa dell’ospite, giocando un’importante parte durante l’infezione di Helicobacter pylori, dove non solo promuove il persistere dell’infiammazione ma diventa anche protagonista nel direzionare la risposta immune. Questa peculiarità, scissa dal suo specifico. 25.
(30) contesto in vivo, acquista un notevole potenziale immunologico allargando il suo utilizzo ad alcune malattie caratterizzate da un’estrema polarizzazione della risposta immunologica in senso Th2. Ad esempio l’asma è un’esacerbazione della risposta immune, in particolar modo Th2, agli allergeni. Mentre individui atopici rispondono all’esposizione di allergeni ambientali con bassa produzione di IFNγ, e scarso rilascio di IL-4 dalle cellule dell’immunità, gli individui asmatici manifestano una forte infiammazione delle vie aeree caratterizzata da infiltrazioni di linfociti attivati, Th2 ed eosinofili, che causano danno all’epitelio bronchiale, iperplasia delle ghiandole mucose e deposizione di collagene nell’area della membrana basale degli epiteli. E’ possibile riprodurre l’asma bronchiale nei topi tramite immunizzazione verso ovalbumina (OVA) e successivo challenge con aereosol della stessa. Avvalendosi di questo modello in vivo si può valutare l’effetto di HP-NAP come immunomodulante sulla patologia asmatica. A questo scopo la molecola batterica ricombinante è stata somministrata per via intraperitoneale ad un gruppo sperimentale di topi allo stesso tempo dell’ immunizzazione con OVA. A seguito di 5 challenge con l’aerosol OVA, è stato valutato il lavaggio bronco-alveolare (BAL) dei topi: mentre i roditori di controllo, non sensibilizzati con OVA, presentavano un BAL esiguo e per lo più composto da macrofagi, i topi sensibilizzati avevano un BAL a prevalenza eosinofilica (Codolo et al., 2008). Pur non presentando differenze nel numero di macrofagi, linfociti e neutrofili circolanti, i topi sensibilizzati con OVA e trattati con HP-NAP presentavano meno eosinofili nel BAL e bassi livelli di IgE nel plasma. In questi stessi topi il dosaggio di IL-12 è risultato essere significativamente più alto rispetto ai topi sensibilizzati mentre i livelli di IL-4, IL-5 e GM-CSF nel BAL erano marcatamente più bassi (Codolo et al., 2008). Gli. 26.
(31) stessi risultati sono stati ottenuti dalla somministrazione di HP-NAP per via intranasale conseguentemente all’immunizzazione con OVA ed in corrispondenza del giorno precedente e immediatamente successivo all’inizio del challenge (Codolo et al., 2008). Dunque le capacità di HP-NAP non si smentiscono in vivo, rafforzando di più il potere immunologico di questa molecola.. 27.
(32) 3. Helicobacter pylori 3.1 Storia di H. pylori Sebbene esistessero varie referenze in letteratura riguardanti la presenza di un batterio spiraliforme nella mucosa gastrica, solo nel 1983, a seguito del suo isolamento e coltura, è iniziato lo studio approfondito di Helicobacter pylori: ad oggi questo batterio è riconosciuto come causa più comune di gastrite cronica e di ulcera peptica, sia gastrica che duodenale, ed è classificato dall’Organizzazione mondiale della Sanità come carcinogeno di prima classe perchè coinvolto eziologicamente nella formazione dell’adenocarcinoma gastrico e dei maltomi. Il merito di avere indirizzato le ricerche nella giusta direzione è stato degli australiani Barry Marshall e Robin Warren, insigniti del premio Nobel per la medicina nel 2005, a cui va inoltre riconosciuto il merito di aver contribuito a sfatare la concezione che l'ambiente fortemente acido dello stomaco (grazie all'acido cloridrico e agli enzimi idrolitici al suo interno) fosse un ambiente "sterile" e praticamente inattaccabile dai batteri. Originariamente il batterio è stato incluso nel genere Campylobacter ma a seguito dell’analisi dell’rRNA 16S sono emerse delle differenze tali da dover coniare un nuovo genere di batteri gram-negativi microaerobici all’interno della suddivisione epsilon dei Proteobatteri. Questo nuovo genere, chiamato Helicobacter, comprende circa venti specie isolate in gran parte da animali e in parte dall’uomo, tra cui Helicobacter pylori: dal nome di genere si intuisce la caratteristica conformazione a spirale mentre con il nome di specie si identifica il sito dove più frequentemente viene isolato.. 28.
(33) 3.2 Biologia di H. pylori H. pylori occupa una particolare nicchia ecologica quale la superficie apicale delle cellule epiteliali dello stomaco, immerso nella barriera chimica e fisica di muco che copre e protegge la mucosa dall’ulcerazione dovuta ai succhi gastrici. All’inizio il batterio riesce a penetrare la barriera di muco in virtù del motore flagellare che dà vita al cosiddetto movimento a “cavaturacciolo”, che combinato all’azione di enzimi idrolitici consente al batterio di raggiungere la membrana apicale cellulare e di aderirvi per mezzo di adesine quali BabA (Blood group Antigen Binding Adhesin), dalla struttura antigenica simile a quella degli antigeni del gruppo sanguigno di Lewis, che funzionano da veri e propri “cavalli di troia” per il sistema immune dell’ospite. Varie altre proteine di H. pylori contribuiscono, in cooperazione con quella sopra citata, a stabilire un'interazione molto forte con le cellule dell'ospite provocando un profondo riarrangiamento della membrana plasmatica alle cellule sottostanti, la quale via via si estende fino ad unirsi alla superficie del batterio (Segal et al., 1996).. Inizialmente la colonizzazione batterica si instaura a livello antrale, porzione terminale dello stomaco adiacente al piloro, dove la minore acidità rispetto a quella del corpo e del fondo consente un maggiore adattamento del batterio. Qui, infatti, sono assenti le cellule parietali, fonte della secrezione cloridrica, mentre sono presenti sia le cellule G secernenti gastrina, l’ormone in grado di stimolare le cellule parietali gastriche del corpo-fondo a secernere HCl, che le cellule D produttrici di somatostatina, ormone che controbilancia la secrezione acida dello stomaco secondo un meccanismo di feed-back: maggiore è il pH (e quindi minore è l’acidità) a livello dell’antro, tanto più risulta elevata la. 29.
(34) secrezione di gastrina e minore quella di somatostatina. Nel corso dell’infezione, H. pylori promuove la secrezione acida dello stomaco attraverso vari meccanismi. Probabilmente l’infiltrato infiammatorio correlato all’infezione da H. pylori diminuisce la densità cellulare delle cellule D a somatostatina interferendo quindi con la secrezione idrogenionica. In aggiunta, la produzione di urea e di ammonio ad opera dell’ureasi del batterio potrebbe innescare un meccanismo di relativa ipoacidità causando un’ulteriore sovrastimolazione acida. Il gradiente di pH nel muco, colloide altamente impermeabile, può acidificarsi invece solo a seguito di condizioni patologiche tali da assottigliare il mucus layer.. H. pylori è un batterio Gram negativo, della lunghezza di 2,5-5 µm e larghezza di 0.5 µm, dalla forma elicoidale o spiraliforme (1,5 giri) e mobile per la presenza ad un polo di 2-7 flagelli capsulati, con estremità rigonfiata a bulbo. In condizioni ostili assume forma coccoide, che gli conferisce proprietà di resistenza, sia nello stomaco che nell’ambiente. Tale batterio sopravvive discretamente nell’intestino tanto da poter essere ritrovato vivo nelle feci. Si replica assai lentamente se si confronta con Escherichia coli (che si replica in 20-30 minuti) e Staphylococcus aureus (in 1 o 2 ore): H. pylori si divide in 12- 24 ore.. Per quanto concerne le caratteristiche metaboliche questi batteri sono non fermentanti, crescono in atmosfera umida a bassa tensione di ossigeno (microaerofilia 5% O2; 15% CO2; 80% N2); sono ossidasi e catalasi positivi, producono ureasi, proteasi acida, emolisina, lipasi e fosfolipasi.. 30.
(35) Fig.2.1: il batterio Gram negativo H. pylori. La longevità dell’infezione da H. pylori suggerisce che il batterio sia capace di superare i vari tipi di stress che incontra nella mucosa gastrica, come il basso pH e l’assenza di metalli essenziali come il ferrro e il nickel. Il motivo di tale resistenza è principalmente attribuito ad alcune proprietà del batterio: la motilità flagellare consente l’insediamento del batterio nel mucus layer al riparo dall’acidità gastrica che viene ulteriormente controbilanciata dall’attività enzimatica dell’ureasi, mentre i nutrienti e i metalli essenziali attraversano il muco, diventato più permeabile per azione di altre idrolasi e mucinasi batteriche (Montecucco & Rappuoli, 2001). Esperimenti in vivo su animali infettati con H. pylori, Helicobacter mustelae e Helicobacter felis hanno dimostrato che la motilità flagellare è essenziale a queste specie per colonizzare la mucosa gastrica. I flagelli delle specie di Helicobacter sono composti da due flagelline copolimerizzate, FlaA e FlaB. Le altre proteine strutturali dei flagelli sono omologhe a quelle ritrovate nella famiglia delle Enterobacteriaceae, mentre il network regolatorio della. 31.
(36) mobilità dei geni flagellari manca dell’operone flhCD e degli altri fattori regolatori ed è affidato ad un sistema regolatorio che vede RpoN come fattore sigma centrale. H. pylori ha una mobilità direzionata (tassi) verso urea, amminoacidi e bicarbonato mentre si allontana dai bassi pH. Recentemente è stato dimostrato da diversi sistemi in vivo che la chemiotassi insieme alla mobilità sono dei recquisiti essenziali per la colonizzazione batterica. In particolar modo questo è valido per H. pylori e H. felis che vivono in uno strato di muco molto sottile, molto vicino all’epitelio gastrico, perchè guidati dal gradiente di pH., che sembra rappresentare il più importante stimolo per l’orientamento del batterio nel guadagnare una posizione ottimale nella barriera di muco.. L'enzima ureasi rappresenta il 15% del contenuto proteico del citoplasma di H. pylori. Quando il pH esterno è minore di 6.5, un canale specifico permette l’ingresso dell’urea, presente abbondantemente nello stomaco, all’interno del citoplasma, dove l’enzima ureasi converte l’urea in bicarbonato ed ammonio, che sono alcali forti e neutralizzano l'acido cloridrico: si crea quindi una piccola "nuvola" di prodotti chimici che neutralizzano il periplasma, mantenendo il potenziale di membrana, e bilanciano l'acidità intorno al batterio proteggendolo (Weeks et al., 2000). La produzione di ammoniaca causa anche alterazioni cellulari quali il rigonfiamento di compartimenti cellulari, l’alterazione del trasporto vescicolare di membrana, l’inibizione della sintesi proteica, della produzione di ATP e del ciclo cellulare. L’ammoniaca potrebbe inoltre reagire con i metaboliti dell’enzima mieloperossidasi dei granulociti neutrofili per formare. sostanze. cancerogene,. che. aumenterebbero. la. possibilità. di. trasformazione delle cellule gastriche nella forma neoplastica. Inoltre, l’ureasi. 32.
(37) potrebbe essere coinvolta direttamente nel reclutamento degli stessi neutrofili e dei monociti, nonchè nella stimolazione della produzione di citochine proinfiammatorie (Robinson et al., 2007). Il ruolo fisiologico dell’ureasi ha una valenza anche “nutrizionale”: la degradazione dell’urea libera ioni ammonio che rappresentano una fonte di azoto assimilabile dal batterio. L’enzima è codificato da sette geni, due dei quali, UreA e UreB, codificano per le rispettive subunità dell’enzima, mentre gli altri trascrivono proteine accessorie necessarie per l’inserzione dello ione Ni2+ all’interno dell’enzima (Zhu et al., 2002). Da un punto di vista strutturale questo enzima è un dodecamero, composto da 6 subunità UreA (26,5 KDa) e 6 subunità UreB (60,4 kDa), formanti nel complesso un anello avente un diametro di 13 nm. L’attività ureasica è mediata dal canale UreI che rapidamente permette l’entrata dell’urea verso l’ureasi citoplasmatica e l’anidrasi carbonica alfa, ancorate alla membrana periplasmatica (l'anidrasi carbonica è un enzima che catalizza la rapida interconversione di anidride carbonica e acqua in acido carbonico, protoni e ioni bicarbonato). L’anidrasi carbonica ha un ruolo essenziale nell’infezione, infatti batteri mutanti, privi di esso, non sono assolutamente in grado di colonizzare lo stomaco (Segal et al., 1992). “L’acclimatazione” acida di questo batterio è favorita dalla regolazione del gene dell’anidrasi carbonica da parte del regolatore della risposta acida, ArsRS, capace di rispondere all’abbassamento periplasmico di pH con l’up-regulation del gene (Wen et al., 2007). La reazione di idrolisi dell'urea viene utilizzata anche nella diagnosi di infezione da H. pylori: è infatti alla base dell' "Urea Breath Test", uno dei test più sensibili ed affidabili oggi disponibili.. 33.
(38) A differenza degli altri batteri, l’LPS di H. pylori è meno immunoattivo, probabilmente per la bassa fosforilazione e l’inedito pattern di acilazione del lipide A, responsabile dell’interazione con i recettori del sistema immune. A complicare la patogenicità di questo batterio si aggiungono le modificazioni nel pathway biosintetico che rimodellano il lipide A aiutando ancor di più il batterio a rimanere nella mucosa gastrica (Mobley et al., 2001). Inoltre le variazioni molecolari dell’LPS si possono ripercuotere anche sulle sue proprietà strutturali (come il legame alla laminina e l’induzione del pepsinogeno), influenzando la virulenza dei vari ceppi di H. pylori. In aggiunta le catene O dell’LPS degli isolati provenienti da infezioni asintomatiche mimano gli antigeni di Lewis e dei gruppi sanguigni, confondendo ulteriormente il sistema immune. Importante componente della membrana esterna di H. pylori sono le OMPs (outer membrane proteins) molte delle quali funzionano da adesine come BabA, SabA and OipA: in alcuni ceppi batterici i loro geni vengono espressi in precise fasi riflettendo un adattamento del batterio alla mucosa gastrica.. 3.3 Fattori di virulenza Alcuni dei fattori di virulenza di H. pylori si trovano nell’isola di patogenicità di 40 Kb detta cag (cytotoxin associated gene) pathogenicity island (PAI) e sono importanti per la colonizzazione epiteliale e la produzione di IL-8 e ciclossigenasi (Montemurro et al., 2001). Altri fattori di virulenza, invece, si trovano al di fuori di cag, come ad esempio Vacuolating citotoxin e Helicobacter pylori neutrophil activating protein (HP-NAP).. 34.
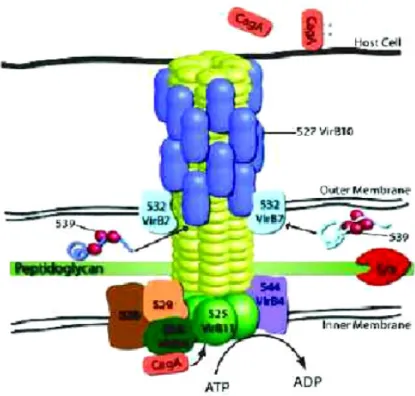
(39) L’isola di patogenicità di Helicobacter pylori (cag-PAI) è un frammento di DNA lungo circa 40 Kb, contenente 27 geni putativi. Nei diversi ceppi di H. pylori tale sequenza può essere presente, assente o non funzionale. cag-PAI presenta un diverso contenuto in C + G rispetto al resto del genoma, pertanto si suppone che essa sia stata acquisita per trasferimento genico orizzontale da un microrganismo sconosciuto (presumibilmente estinto) e integrata a livello delle ultime 31 pb del gene codificante l’enzima glutammato racemasi (Tomb et al., 1997). I 27 geni della cag-PAI codificano per altrettante proteine putative, alcune delle quali presentano una omologia di sequenza con alcune proteine di Agrobacterium tumefaciens che codificano per il sistema di secrezione di tipo IV (Bourzac et al., 2005). I sistemi di secrezione di tipo IV (T4SS) sono delle strutture, presenti in alcuni batteri patogeni, che hanno la funzione di trasportare molecole (fattori di infettività) attraverso la membrana plasmatica (Cascales & Christie, 2003). Questi sistemi rientrano in una grande superfamiglia che comprende i sistemi di coniugazione, che mediano il trasferimento di DNA tra cellule appartenenti a specie anche molto diverse (funghi, cellule animali e vegetali), i sistemi di assunzione e rilascio di DNA indipendenti dall'instaurarsi di un contatto con la cellula bersaglio (sistemi per l'acquisizione delle caratteristiche di competenza del batterio, sistemi per il rilascio di DNA quali il plasmide F tipo Tra presente nell'isola genetica di Neisseria gonorrhoeae) e i sistemi in grado di traslocare macromolecole effettrici (proteine o DNA), dopo che il batterio è riuscito a stabilire un contatto stabile con la cellula ospite. Tra i batteri in grado di esprimere il sistema tipo VI, oltre a Helicobacter pylori, primeggiano Agrobacterium tumefaciens, Legionella pneumophila e Brucella spp. Tra i membri del T4SS di H. pylori (Odenbreit et al., 2000), la. 35.
(40) proteina antigenicamente variabile e strutturalmente stabile all’acidità CagY riveste il ponte di connessione e la proteina CagL media il contatto con la cellula epiteliale. Questo sistema inietta nel citoplasma della cellula infetta la proteina CagA. Quest’ultima viene attivata con la fosforilazione dei residui di tirosina: la sua funzione non è ancora nota, ma si ritiene possa legarsi a proteine aventi domini SH2 (Src-Homology region 2), determinando un segnale specifico che promuove la riorganizzazione del citoscheletro e di alcuni elementi della membrana apicale. CagA è inoltre polimorfica: nei diversi ceppi di H. pylori presenta un numero variabile e delle diverse tipologie di “activating tyrosine phosphorylation motifs” (TPMs), che inducono diversi effetti sul “signaling” cellulare (Higashi et al., 2002). In particolare il D-type TPM ritrovato nei ceppi dell’Est Asia si lega fortemente al Src homology 2 domain-containing tyrosine phosphatase 2 (SHP-2) stimolando dei marcati effetti cellulari (Higashi et al., 2002). Ciò spiegherebbe in parte l’alta proporzione di disturbi associati ad H. pylori nel Giappone e in alcune zone della Cina. Quindi l’isola di patogenicità permette a H. pylori di sovvertire i processi cellulari eucariotici inserendo i suoi prodotti nelle cellule epiteliali dell’ospite e inducendo oltre agli effetti locali anche la trascrizione e secrezione di interleuchina-8 (IL-8) da parte delle cellule dello stomaco. Inoltre CagA è altamente immunogenico: induce forti risposte infiammatorie locali ed una specifica risposta anticorpale nei pazienti infetti, il cui elevato titolo è associato alla presenza di ulcera gastrica e peptica (Satin et al., 2000).. 36.
(41) Figura 2.2: Modello ipotetico dell’isola di patogenicità cag di H. pylori basato sull’omologia con le proteine Vir di A. tumefaciens (Bourzac et al., 2005). Un altro fattore di virulenza di H. pylori è rappresentato dalla tossina VacA (vacuolating cytotoxin A): è un oligomero di circa 90 kDa con una regione N-terminale (37 KDa) ricca in foglietti β e amminoacidi idrofobici, e una regione C-terminale (58 KDa) data da due domini separati da un frammento variabile in sequenza e molto flessibile. VacA funge da un lato da antigene verso cui la risposta immunitaria dell'ospite è diretta, dall’altro da importante fattore di virulenza conferendo un notevole vantaggio competitivo ai ceppi wild-type che lo possiedono, rispetto ai mutanti che ne sono privi o non lo secernono nella forma maggiormente attiva. Parte della proteina viene rilasciata nel mezzo, ma il 40-60% resta associata alla membrana esterna del batterio. VacA viene fortemente attivata da brevi esposizioni a pH acidi per poi essere maggiormente resistente alla pepsina e ai bassi pH (de Bernard et al., 1995). Inoltre l’attacco della proteina alla 37.
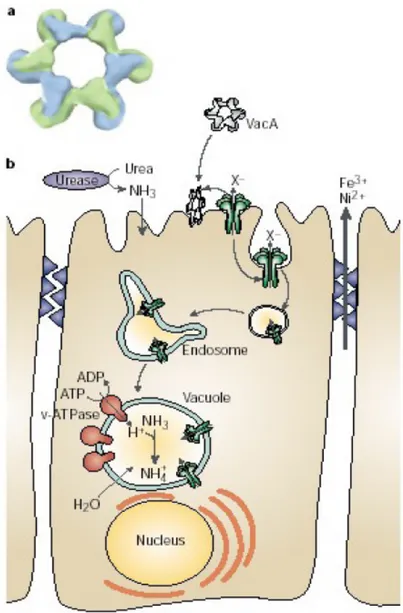
(42) membrana cellulare è indotto dall'ambiente fortemente acido, che permette l'esposizione di siti idrofobici e la sua inserzione nel doppio strato fosfolipidico. La proteina secreta sotto forma di monomero si lega tra la porzione apicale delle cellule gastriche e lo strato di muco che le ricopre inserendosi nel plasmalemma via interazioni idrofobiche proteina-lipide, dove oligomerizza in rosette dalla tipica forma a fiore costituita da 6-7 subunità. L’inserzione porta alla formazione di canali anionici selettivi a bassa conduttanza che formano un vero e proprio poro nella membrana cellulare, tramite il quale vengono rilasciati dal citosol della cellula epiteliale essudati costituiti da ioni organici, urea e bicarbonato, allo scopo di garantire la crescita del batterio. I canali costituiti da VacA vengono lentamente internalizzati per endocitosi negli endosomi, dove instaurano un aumento della permeabilità agli ioni mediato da una pompa protonica con attività ATPasica. Accoppiando la produzione di ammoniaca da parte dell'ureasi batterica, all'interno dell'endosoma si accumulano ioni NH4+, che a loro volta determinano l'entrata di acqua e la crescita dei vacuoli. Così l’effetto iniziale di VacA si ripercuote sull’attività degli endosomi interferendo quindi con la presentazione dell’antigene ed aiutando il batterio ad adottare una strategia evasiva sulle cellule della mucosa. I vacuoli si originano principalmente nella regione perinucleare, aumentano progressivamente di numero e dimensioni, e causano la degenerazione della cellula in 24-48 ore. Inoltre VacA può alterare le giunzioni cellula-cellula ed alterarne la resistenza elettrica trans-epiteliale con concomitante aumento del flusso di ferro, nichel e piccoli metaboliti (zuccheri) dalla mucosa al batterio (Montecucco & de Bernard, 2003).. 38.
(43) Figura 2.3: In alto (a) è rappresentato l’oligomero di VacA (struttura a rosette) mentre in basso (b) è illustrato un modello del meccanismo di induzione dei danni cellulari da parte di VacA (Montecucco & Rappuoli, 2001). In base alla presenza o assenza del gene cagA, localizzato nel locus cag, in cellule epiteliali infette ad attività vacuolizzante ed esprimenti VacA, i diversi ceppi di H. pylori sono stati raggruppati in due grandi famiglie: i ceppi di tipo I, risultanti dalla combinazione positiva dei due geni ed associati a gravi disturbi gastroduodenali, e ceppi tipo II che presentano un’attenuata virulenza per la presenza del solo gene cagA (Xiang et al., 1995). 39.
(44) 3.4 H. pylori e la risposta immunologica Sebbene alcuni ceppi di H. pylori siano più patogenici di altri, la patologia gastrica che ne consegue dipende in parte anche dalla risposta immune dell’ospite (D’Elios et al., 2000). La risposta immunitaria all’infezione da H. pylori si caratterizza per una forte infiltrazione a livello della mucosa gastrica sostenuta da linfociti, neutrofili, monociti e plasmacellule, richiamati in gran numero dall’IL-8 secreta dall’epitelio gastrico e dai macrofagi attivati. Inoltre le cellule presentanti gli antigeni (APCs) rilasciano citochine quali IL-1, IL-6, TNF-α e IL12, la cui concentrazione locale influenza fortemente lo sviluppo di una risposta cellulare T verso un fenotipo Th1, caratterizzata da alti livelli di IFN-γ, IL-12 e TNF-α (D’Elios et al., 2005). Questo tipo di risposta è infatti predominante in pazienti infetti e con gravi disturbi gastroduodenali mentre è stemperata dalla combinazione con le citochine Th2 (fenotipo Th0) nei pazienti infetti ma senza complicazioni gastriche. Ciò suggerirebbe un ruolo esacerbato della risposta immune dell’ospite in senso Th1 verso gli antigeni del batterio tale da causare ulcere peptiche. Anche i Tregs sono stati ritrovati nella mucosa gastrica di pazienti infetti da H. pylori, accompagnati da alti livelli di citochine immunosoppressive come IL-10 e TGF-β (Lundgren et al., 2003). Ad esempio topi IL-10 -/- sviluppano un’intensa gastrite locale a seguito dell’infezione con H. felis e successiva eliminazione dell’infezione associata a una forte risposta umorale (un titolo anticorpale di antiureasi cinque volte maggiore nei topi IL-10-/- rispetto ai topi wild-type) e cellulare (linfociti splenici CD4+ isolati dai topi IL-10-/- infetti stimolati dall’ureasi batterica producono livelli di IFN- γ 150 volte maggiori rispetto ai wild-type) sottolineando. 40.
(45) l’importanza dell’IL-10 nel controllare l’infiammazione ed interferire con la persistenza del batterio (Velin et al., 2008). Il quadro dell’infezione da H. pylori è ulteriormente aggravato dalla barriera di muco gastrico che intrappola le varie componenti dell’immunità ed impedisce loro di raggiungere agevolmente il batterio, provocando però un forte danno alla mucosa gastrica.. 3.5 Trasmissione La diffusione diretta interumana dell'infezione da H. pylori può essere oroorale e oro-fecale (Axon, 1995; Stone, 1999). Altre possibili vie di contagio sono il contatto con acque o con strumenti endoscopici contaminati, ma non esistono ancora dati definitivi al riguardo. La diffusione oro-orale è data dal reflusso gastrico: il batterio può raggiungere la cavità orale ed in particolare la placca dentaria, dove attraverso la saliva può essere veicolato al nuovo ospite. In uno studio, diversi soggetti hanno presentato una positività in alcuni siti orali, quali le tasche periodontali ed il dorso della lingua; H. pylori è stato anche ricercato sotto le unghie della mano dominante, dove è stato trovato nel 58% dei casi. La diffusione oro-fecale è invece sostenuta dal continuo turnover della mucosa gastrica; la ripetuta eliminazione del batterio nell'intestino e la capacità di sopravvivenza del batterio nelle feci, da dove è eliminato nell'ambiente, rende l'acqua e il cibo contaminabile. Infatti una ricerca condotta nella popolazione di Lima (Perù) ha dimostrato che esiste una diversa prevalenza di infezione in rapporto alla fonte di approvvigionamento idrico. Inoltre un’indagine sierologia. 41.
(46) condotta in Cile su una popolazione sotto i 35 anni di età ha dimostrato che l’infezione correla non solo con il livello socio economico ma anche con il consumo di verdura cruda. La propagazione oro-fecale potrebbe ricorrere direttamente anche da persone infette o che vivono in condizioni di sovraffollamento o in condizioni sanitarie scadenti. E' possibile anche la trasmissione sessuale: poiché H. pylori è presente nelle feci, l'infezione può essere trasmessa durante rapporti sessuali oro-anali con un individuo infetto.. 3.6 Diffusione Nei numerosi studi su gruppi di pazienti sottoposti a gastroscopia per sintomatologia dispeptica la prevalenza di infezione gastrica da H. pylori è risultata compresa fra il 60 ed il 90% dei casi. Nella popolazione normale l’infezione si conferma in misura elevata; mediamente nelle regioni a maggiore sviluppo è presente nel 50% circa dei casi. Altra caratteristica dell’infezione è l’aumento della prevalenza con l’aumento dell’età: nel mondo occidentale H. pylori infetta circa il 20 % delle persone al di sotto dei 40 anni e circa il 50 % di quelle di più di 60 anni mentre è raro nei bambini. In linea di massima, nelle regioni più sviluppate la prevalenza è inferiore al 10% entro il primo decennio di vita e aumenta progressivamente fino a superare il 50% dopo il cinquantesimo anno. Da numerosi studi è emerso che l’infezione una volta contratta, tende a mantenersi indefinitamente. Nelle regioni meno sviluppate da un punto di vista igienico ed economico, la prevalenza è più elevata; ad esempio, in India oltre l’80% delle persone sono già infette al ventesimo anno d’età. In Gambia interessa. 42.
(47) il 15% dei bambini entro i 20 mesi e il 46% fra i 40 ed i 60 mesi; in Nigeria addirittura il 58% entro i dodici mesi. Sono state inoltre osservate variazioni della prevalenza in relazione a diverse aree geografiche della stessa regione. In Perù, dove la prevalenza dell’infezione in generale è superiore all’80%, la popolazione della Sierra o della giungla ha un tasso di infezione significativamente più alta rispetto alla popolazione costiera. Uno studio su 1727 abitanti della Cina meridionale ha dimostrato una prevalenza generale del 44,2 %, significativamente più alta nelle città rispetto alle aree rurali.. Accanto a fattori ambientali, i fattori legati all’ospite di tipo costituzionale o legati alle abitudini di vita possono giocare un ruolo importante nella probabilità di contrarre l’infezione da H. pylori. Nella popolazione di Houston, a parità di livello socioeconomico, la prevalenza rimane sensibilmente maggiore nella persone di colore che nei bianchi. È quindi ipotizzabile l’influenza di fattori genetici razziali.. 43.
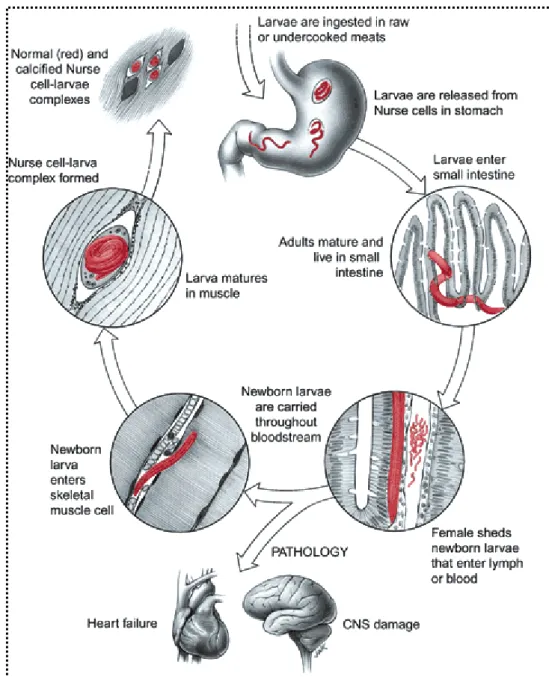
(48) 4. Trichinella spp.. 4.1 Storia del parassita Trichinella spp. La storia del parassita Trichinella inizia nel Febbraio del 1835 quando il giovane medico James Paget nota durante la dissezione di un cadavere un diaframma “sabbioso”. Questa scoperta passa subito sotto gli occhi di Richard Owen che disegna le prime immagini e scrive alcune righe a riguardo, presentandole successivamente alla Royal Society e dando al parassita il nome iniziale di Trichina spiralis. La scoperta del ciclo vitale del parassita arriva nella seconda metà del 1800 da Rudolf Virchow, insieme a Rudolf Leukart e Friedrich Zenker. Grazie a diversi esperimenti i tre ricercatori riuscirono a tracciare le diverse fasi del ciclo vitale di Trichinella spiralis: i vermi adulti nell’intestino e le larve, generate dall’accoppiamento, capaci di disseminarsi ai muscoli. Tra il 1860 e il 1880 in Germania vi furono un numero molto elevato di casi di trichinellosi: 513 morti su 8491 malati; la più importante epidemia si ebbe nel 1865 nel villaggio di Hedersleden, dove su 2100 abitanti se ne ammalarono 337 e 101 morirono. Si cominciò allora ad attuare in tutta la Germania una campagna di profilassi contro questo parassita promossa da Virchow il quale dimostrò che la cottura della carne infetta a 137° F per 10 minuti evitava l’infezione. La trichinellosi ha cambiato alcune vicende della storia umana, come la scoperta del Polo Nord che sarebbe avvenuta prima se un’intera spedizione, guidata da Salomon August Andrée, non fosse stata annientata dalla malattia causata dall'ingestione di carne cruda di orso polare.. 44.
Figura
Outline
Documenti correlati
Die Bundesregierung und die Länder unterstützen die Erarbeitung und Aktualisierung der Wissensbasis zum Gewässerschutz mit Blick auf die Anwendung von Pflanzenschutzmitteln und
Ja vielu atļauj lietot Eiropas Savienībā, tās dokumentācijas izvērtēšanā ir piedalījušās visas dalībvalstis un Eiropas pārtikas nekaitīguma iestāde
e) Directiva 91/676/CEE a Consiliului din 12 decembrie 1991 privind protecția apelor împotriva poluării cu nitrați proveniți din surse agricole, transpusă în
(d) to provide to customers, orally or in written, the necessary information a regards plant protection products use, health and environmental risks and
The Sustainable Use Directive requires that the general public be informed of the risks arising from the use of plant protection products, their effect on human health and
The aim of this Plan is to promote the well-targeted and cost-efficient use of plant protection products, to ensure food safety and sustainable agricultural development, to
- optimising PP products´ use without limiting the scope of agricultural production and quality of plant products; connecting milestones and deadline measures to ensure they are
Commission, in conjunction with Member States, containing guidelines on the observation and study of the impact of pesticide use on human health and the environment. For the