Indice
1 Introduzione ... 1 1.1 Flavonoidi ... 1 1.1.1 Aspetti generali ... 1 1.1.2 Attività ... 3 1.1.3 Bersaglio molecolare ... 6 1.1.4 Apigenina ... 8 1.1.5 (+/-) Naringenina ... 11 1.1.6 Luteolina... 14 1.2 I canali K+ ... 15 1.2.1 I canali KCa ... 17 1.2.2 Canali BK... 192 Scopo della tesi ... 25
3 Materiali e metodi ... 26
3.1 Materiali utilizzati per la sperimentazione in vitro ... 26
3.1.1 Colture cellulari ... 26
3.1.2 Sostanze utilizzate ... 28
3.1.3 Soluzioni delle sostanze utilizzate ... 29
3.2 Protocollo sperimentale ... 31
3.2.1 Scongelamento ... 31
3.2.2 Piastratura ... 32
4 Risultati e discussione ... 39
4.1 Risultati sperimentali ottenuti ... 39
4.1.1 Premessa ... 39 4.1.2 Naringenina ... 41 4.1.3 Luteolina... 44 4.1.4 Apigenina ... 47 4.2 Conclusioni ... 50 Bibliografia ... 52
Capitolo 1
Introduzione
1.1 Flavonoidi
1.1.1 Aspetti generali
I flavonoidi sono un gruppo di metaboliti secondari molto presenti in natura (Koes et al., 1994); sono pigmenti vegetali, facilmente reperibili nei fiori nei frutti e nelle foglie di numerose specie vegetali compresi legumi e cereali. Sono le sostanze responsabili dei colori più vivaci delle piante: dal giallo all’arancione, dal rosso al porpora. Questi composti polifenolici sono inoltre responsabili di molti meccanismi fisiologici come lo sviluppo del fiore, l’impollinazione e la protezione contro i raggi UV e gli agenti patogeni (Grotewold , 2006; Taylor e Grotewold, 2005; Bieza e Lois, 2001; Li et al., 1993; Treutter, 2006).
I flavonoidi sono normalmente contenuti nella nostra alimentazione standard; si ritrovano negli agrumi, nei piselli, nella soia, nel vino, nel cacao, nel tè, nei broccoli, nelle mele ed in molti altri alimenti di origine naturale (Bobe et al., 2008).
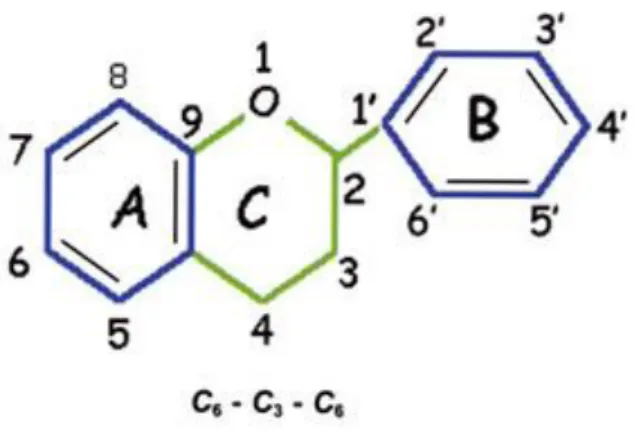
In natura si calcola che esistano oltre 5˙000 tipi di flavonoidi, i quali sono stati classificati in 10 sottogruppi in base alla loro struttura chimica (Kocic et al., 2013). Essi sono composti polifenolici costituiti da due anelli aromatici con sei atomi di carbonio nell’anello, collegati da un etere ciclico (Figura 1.1). Sono classificati in sottogruppi in base alla struttura e alle modifiche dell’anello centrale (C) (Groenenboom et al., 2013).
Figura 1.1: Struttura flavonoide.
I sei principali sottogruppi di flavonoidi presenti nei cibi sono: flavoni (sedano, prezzemolo), flavonoli (mele, piselli), antocianidine (mirtilli, cavolo rosso), catechine (the verde, cacao), flavanoni (arance, pompelmo, limoni) e isoflavoni (soia) (Kocic et al., 2013). Questi sottogruppi si differenziano fra di loro in base ai diversi sostituenti (ossidrili o metili), al grado di insaturazione e al tipo di zucchero a cui si possono attaccare (Woodman e Chan, 2004).
Tutte queste sostanze si possono trovare libere, sottoforma di agliconi, oppure di glucosidi (quercitrina), di dimeri o polimeri (procianidine) oppure ancora esterificate in strutture più complesse. Nella maggior parte dei casi, nella stessa pianta si trovano contemporaneamente vari tipi di flavonoidi, in relazione alla specie botanica, alla parte della pianta utilizzata e alla tecnica estrattiva; per esempio la buccia e il succo di molte piante appartenenti al genere Citrus differiscono per il contenuto di flavonoidi. Molti di essi sono presenti negli alimenti in concentrazione assai variabile e si può stimare che con la nostra alimentazione si assumano mediamente dai 100mg ad oltre 1000mg/die, in relazione alle abitudini alimentari e con differenze relative al tipo di nutrizione delle diverse aree geografiche (l’America ha un utilizzo maggiore rispetto all’Asia e all’Europa) ( Kumpulainen e Salonen , 1999; Skibola e Smith, 2000).
1.1.2 Attività
I flavonoidi sono stati molto studiati negli ultimi anni perché sembrano avere delle proprietà interessanti a livello di numerose
funzioni cellulari. Essi hanno capacità antiallergiche,
antinfiammatorie, antivirali e antiulcera.
E’ ormai nota la loro caratteristica di inibire l’aggregazione piastrinica (Seigneur et al., 1990; Andriambeloson et al., 1998) e la loro capacità di ridurre i danni causati da ischemia e riperfusione (Chan et al., 2003; Huk et al., 1998; Shutenko et al., 1999; Wang et al, 2004).
Inoltre in passato è stato ipotizzato un ruolo protettivo di tali sostanze sulla prevenzione della oncogenesi, in particolare a livello del colon grazie al loro effetto antiossidante e antinfiammatorio (Kanadaswami et al., 2005).
Sempre grazie alle loro proprietà antiossidanti i flavonoidi sono in grado di ritardare la comparsa dell’aterogenesi attraverso la riduzione delle reazioni di perossidazione e la diminuzione della tendenza alle trombosi (Rice-Evans et al., 1997; Aviram e Fuhrman, 1998; Stanley e Mazier, 1999). Inoltre molti flavonoidi, e loro derivati (quercetina, rutina, diosmina) sono ampiamente usati in prodotti farmaceutici per le loro proprietà vasoprotettive (vedi in preparazioni commerciali come Venoruton, a base di oxerutina, o Daflon 500, a base principalmente di diosmina) (Gohel e Davies, 2009).
In questa tesi però, l’interesse sarà principalmente rivolto agli effetti benefici dei flavonoidi a livello del sistema cardiovascolare dell’uomo.
A questo riguardo è stato osservato che probabilmente, grazie alle proprietà antiossidanti (Rice-Evans et al., 1997; Aviram e Fuhrman, 1998) e vasodilatanti dei flavonoidi (Duarte et al., 1993; Fitzpatrick et al., 1993; Herrera et al., 1996), una dieta ricca di tali composti potrebbe portare ad una riduzione dell’incidenza di malattie cardiovascolari (Hertog et al., 1993; Knekt et al., 1996) come l’ipertensione. Tale patologia, presente in un terzo della popolazione occidentale, è scarsamente controllata (Mancia et al., 2002) e molte volte non adeguatamente trattata (Romero, 2007).
Una serie di studi hanno dimostrato che il consumo di frutta, verdura, vino e tè, quindi alimenti contenenti flavonoidi, può esercitare una protezione nei confronti di accidenti vascolari quali l’ictus, per i quali l’ipertensione è il principale fattore di rischio. Quindi abbassando la pressione sanguigna attraverso un maggiore consumo alimentare di antiossidanti nella dieta, si può diminuire il tasso di danno d’organo, il quale risulta secondario all’ipertensione (Moline et al., 2000).
I flavonoidi vengono descritti come composti vasodilatatori (Duarte et al., 1993; Fitzpatrick et al., 1993; Herrera et al., 1996), questa caratteristica può derivare però da diversi meccanismi d’azione. Per esempio l’apigenina, un flavone con proprietà vasodilatanti, mostra sia un meccanismo d’azione endotelio-dipendente, dovuto al rilascio endoteliale di ossido nitrico (NO), sia un’attività endotelio-indipendente probabilmente mediata dalla proteina chinasi c (Zhang et al., 2002). Anche la crisina, un altro flavone simile all’apigenina, possiede effetto vasodilatatorio sia tramite meccanismo endotelio-dipendente che endotelio inendotelio-dipendente (quindi inendotelio-dipendente dalla presenza di endotelio integro) (Duarte et al., 1993; Herrera et al., 1996). Duarte et al. ha anche messo a confronto l’effetto vasodilatatorio con le strutture chimiche dei vari sottogruppi di flavonoidi e ha constatato che i flavonoli hanno maggiore effetto vasodilatatorio dei flavoni che sono a loro volta più potenti dei flavanoli (Duarte et al., 1993). Tuttavia nei successivi studi si è dedotto che la maggiore potenza dei flavonoli rispetto ai flavoni sia reale solo per coloro che possiedono anche sostituenti sull’anello A o sull’anello B, perché, se essi hanno solo un ossidrile nell’anello C in 3,
hanno la stessa potenza di un flavone non sostituito. Inoltre negli stessi studi è stato possibile comprendere che: il gruppo catecolico (nell’anello B posizione 3’ 4’), a differenza di quanto era stato detto in precedenza, non è fondamentale per la proprietà antiossidante e per l’attività vasodilatatoria, anche se ha maggiore potenza rispetto al solo gruppo OH in 3 nell’anello C, al contrario la presenza di un gruppo ossidrilico nella posizione 3 dell’anello C assieme ad altri
sostituenti ossidrilici aumentano notevolmente l’attività
vasodilatatoria e la proprietà antiossidante, ed infine per quanto riguarda l’attività vasodilatatoria questa è molto più potente nei composti con il gruppo OH in 3ˈ rispetto a quelli con il gruppo OH in 4ˈ (Woodman et al., 2005).
1.1.3 Bersaglio molecolare
Uno dei principali bersagli molecolari dei flavonoidi a livello vascolare è rappresentato dai canali BK, un sottogruppo dei canali per il potassio, calcio dipendenti.
L’azione di questi canali del K+, calcio e voltaggio-attivati influisce in maniera consistente sulla regolazione del tono della muscolatura liscia vascolare (Calderone et al., 2004).
I canali BK possono essere attivati sia da un aumento della concentrazione del calcio citosolico, sia da una depolarizzazione di membrana (Lattore e Brauchi, 2006). Quando i canali BK sono aperti si ha un’iperpolarizzazione di membrana e chiusura dei canali del
calcio voltaggio attivati (VOCCs), determinando così un’opposizione al ruolo di vasocostrizione mediato da quest’ultimi. Quindi l’attivazione dei canali BK voltaggio e/o calcio dipendente limita la depolarizzazione di membrana e la conseguente vasocostrizione, secondo un meccanismo di feedback negativo (Marijic et al., 2001). Inoltre è stato osservato che le arterie coronarie di esseri umani e di ratti anziani mostrano un’espressione dei canali BK ridotta della metà e una riduzione significativa della loro modulazione fisiologica (Marijic et al., 2001). Quindi un’attivazione dei restanti canali BK con specifici farmaci potrebbe essere un possibile approccio terapeutico per migliorare la capacità vasodilatatoria, là dove sia compromessa, e per trattare alcune malattie cardiovascolari (Calderone et al., 2004).
Per quanto riguarda i flavonoidi, è stato dimostrato che apigenina e altri composti simili (BK-openers) sono in grado di aprire i canali BK espressi in ovociti di Xenopus laevis, e la porzione farmacoforica comune di questi flavonoidi è simile a quella presente in NS004 e NS1619, composti a struttura arilbenzimidazolonica, noti attivatori dei canali BK ottenuti per via sintetica (Li et al., 1997).
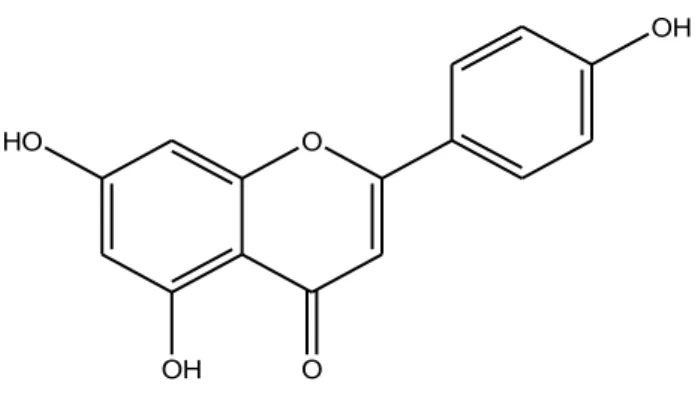
1.1.4 Apigenina
O HO
OH O
OH
Figura 1.2: Struttura Apigenina.
L’apigenina (4’,5,7-triidrossiflavone) (Figura 1.2) è un flavone; in natura esiste come dimero, isolato dalle gemme e fiori di Hypericum perforatum, ed esibisce effetti neuroprotettivi dovuti al miglioramento del metabolismo mitocondriale e al ridotto uptake di Ca2+ (Silva et al., 2008; Cheung ZH et al., 2008). E’ abbondantemente presente nella frutta come il pompelmo e le arance, nelle verdure come il prezzemolo e le cipolle. Una delle fonti più comuni di apigenina è la tisana di camomilla preparata dai fiori secchi di Matricaria chamomilla (McKay e Blumberg, 2006).
Questo flavonoide è presente negli alimenti come glicoside, viene poi scisso nel lume gastrointestinale per essere assorbito e distribuito come aglicone. Per questo motivo nell’epitelio del tratto gastrointestinale sono presenti concentrazioni più elevate di apigenina rispetto ad altri tessuti. Pertanto gli studiosi hanno rivolto la propria attenzione sulla possibile attività dell’apigenina contro i tumori gastrointestinali (Lefort e Blay, 2013).
Le sue altre attività includono inoltre effetti ipotensivi (Ji, 1999), antiinfiammatori (Gerritsen et al., 1995), antispasmodici (Capasso et al., 1991) ed antidiarroci (Di Carlo et al., 1993).
Diversi studi indicano una sua attività anche sul sistema cardiovascolare confermata dal fatto che in vivo, nei mammiferi, è stata osservata una riduzione della pressione sanguigna (Ji, 1999).
Il sito d’azione dell’apigenina non è ancora del tutto chiaro, perché è un vasodilatatore che ha sia un meccanismo d’azione dipendente, dovuto al rilascio di ossido nitrico, sia endotelio-indipendente mediato dalla proteina chinasi C (Zhang et al., 2002). Infatti essa provoca un rilasciamento concentrazione-dipendente negli anelli dell’aorta contratti con fenilefrina sia in presenza di endotelio che in assenza di endotelio (Zhang et al., 2002).
La rimozione parziale, ma significativa, dell’endotelio sembra ridurre in modo significativo il rilasciamento e questo potrebbe essere dovuto a effetti particolari dell’apigenina sui fattori rilascianti derivati dall’endotelio come NO.
Questa ipotesi è confermata dal fatto che gli effetti dell’acetilcolina, che provoca un vasorilasciamento endotelio-dipendente attraverso la via dell’NO, vengono potenziati negli anelli di aorta, con endotelio, incubati per 30 minuti con l’apigenina (Furchgott e Zawadzki, 1980).
Altri esperimenti hanno permesso di osservare l’attività dell’apigenina in presenza di NG-Nitro-L-Arginine Methyl Ester (L-NAME) (inibitore dell’ossido nitrico sintetasi) e di blu di metilene
(inibitore della guanilato ciclasi) (Mayer et al., 1993; Kawada et al., 1994). Nei preparati con l’endotelio trattati con fenilefrina 0,3µM il blu di metilene abbatte la risposta dell’apigenina e l’L-NAME la riduce. Nel caso in cui non è presente l’endotelio, questi inibitori non influenzano l’attività dell’apigenina.
Zhang et al., (2002) hanno provato che il rilasciamento endotelio-dipendente indotto dall’apigenina è legato alla produzione di cGMP. In condizioni fisiologiche l’NO, prodotto ad opera dell’NO sintetasi, diffonde dall’endotelio alle cellule della muscolatura liscia dove si lega alla guanilato ciclasi. Questo enzima catalizza la trasformazione del GMP in cGMP, responsabile delle reazioni che portano al rilasciamento muscolare.
Concentrazioni di apigenina 10µM provocano un aumento di tre volte della concentrazione di cGMP nell’aorta di ratto con endotelio intatto, la rimozione dell’endotelio e il pre-trattamento con L-NAME (100µM) riducono tale effetto.
Gli effetti positivi dell’apigenina sul sistema cardiovascolare sembrano legati anche alla sua capacità di inibire la proliferazione delle cellule della muscolatura liscia coinvolta nella formazione di placche aterosclerotiche (Ross, 1993); infatti è stato dimostrato che l’apigenina riduce in modo significativo l’incorporazione di *3H] timidina nel DNA (Zhang et al., 2002).
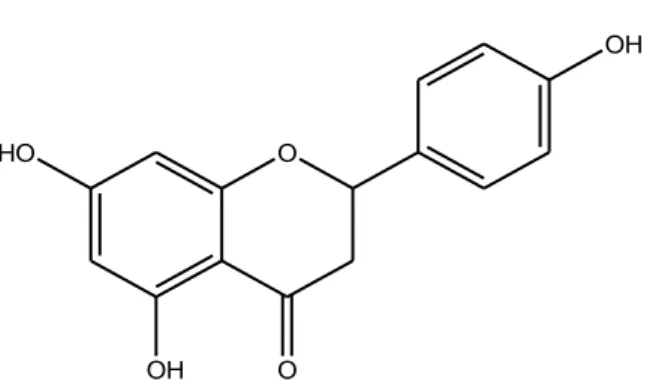
1.1.5 (+/-) Naringenina
O HO
OH O
OH
Figura 1.3: Struttura Naringenina.
La naringenina (Figura 1.3) è un flavanone abbondante in molte piante del genere Citrus, responsabile del sapore amaro del pompelmo. Ha dimostrato di possedere attività antiossidante, cardioprotettiva anti-ischemica, antinfiammatorie, antitumorali e di abbassare i livelli di lipidi e di colesterolo (Rice-Evans et al., 1996; Lee et al., 1996; Santos et al., 1999; Franke et al., 2005; Kanno et al., 2005; Testai et al., 2013).
Sono stati anche studiati gli effetti della naringenina sulle funzioni vascolari in vitro confrontando le sue azioni meccaniche ed elettrofisiologiche usando anelli di aorta di ratto privati di endotelio ed è stato osservato che rilassa in modo concentrazione-dipendente gli anelli precontratti con KCl 20mM o con l’agonista fisiologico noradrenalina. Inoltre è stato visto che il vasorilasciamento indotto dalla (+/-) naringenina è antagonizzato dalla presenza di 10mM di tetraetilammonio (bloccante di vari tipi di canali al K+), 200nM di iberiotossina (bloccante selettivo dei canali BK), 3mM di 4-amminopiridina (bloccante dei canali K+ voltaggio-dipendente) e KCl
60mM (concentrazione elevata che induce una marcata depolarizzazione), invece la glibenclamide non produce un significativo antagonismo, in quanto i canali K+ ATP-sensibili non sono coinvolti in questo meccanismo. Anche la naringina [(+/-) naringenina 7-β-neoesperidoside] ha mostrato di avere proprietà vasorilascianti ma la sua potenza e la sua efficacia sono molto più ridotte rispetto alla (+/-) naringenina (Saponara et al., 2006). Ciò ha confermato l’ipotesi che il glicoside riduce il profilo farmacologico di molti flavonoidi; infatti era stato visto, in precedenza, che anche i flavonoidi glicosilati dell’ apigenina e esperetina (rhoifolina e hesperidina) hanno dimostrato di avere proprietà vasorilascianti significativamente inferiori rispetto ai loro corrispondenti agliconi (Calderone et al., 2004).
Studi precedenti su anelli di aorta intatti hanno mostrato che l’effetto vasorilasciante della (+/-) naringenina, è in parte mediata dal rilascio di ossido nitrico dall’endotelio (Ajay et al., 2003), nello stesso studio è stato osservato però, che un’alta concentrazione di K+ provoca una notevole riduzione dell’effetto vasorilasciante della (+/-) naringenina. Il rilascio di ossido nitrico dall’endotelio è determinato dall’attivazione farmacologica dei canali BK endoteliali (Kuhlmann et al., 2004); d’altro canto è noto che l’ossido nitrico a sua volta va ad attivare i canali BK delle SMCs vascolari (Bolotina et al., 1994). Se ne deduce che per valutare l’attivazione dei canali BK da parte di naringenina in modo più semplice e diretto è preferibile usare modelli che escludano con certezza l’influenza della presenza di
Per studiare l’azione elettrofisiologica della (+/-) naringenina, sono stati usati miociti di arteria caudale di ratto e, con la tecnica del patch-clamp, è stato visto che il flavonoide aumenta in modo concentrazione-dipendente le correnti dei canali BK, e questa stimolazione è sensibile all’iberiotossina e completamente reversibile dopo rimozione della sostanza per lavaggio (Saponara et al., 2006).
In particolare la (+/-) naringenina velocizza la cinetica di attivazione delle correnti del canale, spostando la curva di attivazione voltaggio-dipendente verso potenziali più negativi e diminuendone la pendenza di attivazione. Quindi la (+/-) naringenina va ad alterare la sensibilità al voltaggio del meccanismo di attivazione del canale, in modo indipendente dal Ca2+ intracellulare. Infatti anche quando l’EGTA nella soluzione interna è stata sostituita dal BAPTA, chelante rapido lo ione Ca2+, la (+/-) naringenina ha continuato a stimolare pienamente la corrente BK. Quindi è probabile che la stimolazione dei canali BK da parte della (+/-) naringenina possa derivare da un effetto diretto sulla proteina. Ad ogni modo, sono necessari ulteriori esperimenti per chiarire il coinvolgimento dei canali KCa e il
meccanismo, diretto o indiretto, attraverso il quale la (+/-) naringenina attiva questi canali (Saponara et al., 2006).
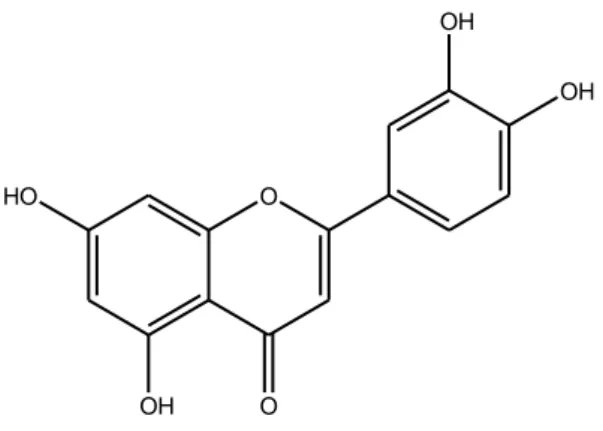
1.1.6 Luteolina
O HO OH O OH OHFigura 1.4: Struttura Luteolina.
La luteolina (3’,4’,5,7-tetraidrossiflavone) (Figura 1.4) appartiene al sottogruppo dei flavoni; é estratta dal sedano, dalla foglia di Perilla, dalla camomilla e dal pepe verde (Kim et al., 2003).
Gli ultimi studi condotti su esseri umani e su modelli animali hanno rilevato i diversi effetti benefici della luteolina come la protezione cardiovascolare e le proprietà antiossidanti e antinfiammatorie (Lopez-Lazaro, 2009; Park et al., 2007; Seelinger et al., 2008). Inoltre la luteolina ha dimostrato di attenuare l’apoptosi a seguito di danno da ischemia e riperfusione nei cardiomiociti di ratto adulto (Qi et al., 2011); in diversi studi sperimentali, è stata anche osservata una potente attività antitumorale che, anche a basso dosaggio, riesce ad avere un effetto marcato, arrestando il ciclo cellulare e portando così alla morte le cellule maligne (Horinaka et al., 2005; Ju et al., 2007). Sono stati fatti anche studi riguardanti gli effetti vasoattivi della luteolina e il suo meccanismo d’azione sull’aorta toracica di ratto. La luteolina provoca un rilasciamento, concentrazione-dipendente, sia
con endotelio integro, sia in assenza di endotelio, negli anelli dell’aorta precontratti con fenilefrina (PE, 10-6 mol/L) o con un livello elevato di K+ (6·10-2 mol/L). La luteolina porta quindi ad uno spostamento della curva concentrazione-risposta della fenilefrina, verso destra e verso il basso. E’ stato inoltre osservato che l’effetto vasorilasciante della luteolina non è influenzato da L-NAME (inibitore della biosintesi di NO) e dal propranololo (Beta-bloccante) ed è invece antagonizzato dalla presenza di BaCl2 e tetraetilammonio
(bloccanti non selettivi dei canali del K+), 5-idrossidecanoato (bloccante dei canali KATP mitocondriali) e 4-amminopiridina
(bloccante di diversi sottotipi di canali del K+ voltaggio-dipendenti). Infine è stato riscontrato che in soluzioni prive di Ca2+ o di K+, o contenenti concentrazioni crescenti di Ca2+, la luteolina riduce le contrazioni indotte dalla PE. Quindi, da questo studio sembra emergere che la luteolina provochi, nell’aorta toracica di ratto, il rilassamento endotelio-indipendente, ed il meccanismo d’azione consiste nell’inibizione dei canali del Ca2+ del sarcolemma, l’inibizione del rilascio delle riserve di Ca2+ intracellulari e l’attivazione dei canali del K+ (Jiang et al., 2005).
1.2 I canali K
+I canali del K+ sono proteine integrali di membrana che svolgono un ruolo fondamentale nel controllo del tono della muscolatura liscia e
di altre importanti funzioni cellulari come l’eccitabilità neuronale e cardiaca o il rilascio di neurotrasmettitori. Si trovano nelle cellule eccitabili e non e sono selettivi per gli ioni potassio la cui velocità di conduzione è di 10 6-10 8 ioni/sec. In particolare il ruolo di questi canali nella regolazione del tono della muscolatura liscia vascolare è legato alla distribuzione asimmetrica del K+ all’interno e all’esterno della cellula. L’uscita di K+ dalla cellula e la conseguente iperpolarizzazione della membrana provoca l’inibizione dell’ingresso di Ca2+ attraverso i canali VOC (voltage-operated channels) e la riduzione della sua mobilitazione dai depositi intracellulari, eventi indispensabili per ottenere il rilasciamento della muscolatura (Calderone e Martinotti, 2000).
Vari studi hanno dimostrato che le cellule muscolari lisce esprimono diversi canali del potassio a seconda del tessuto, della specie, della fisiopatologia, dell’età. Nelle cellule muscolari lisce vascolari sono stati descritti quattro classi principali di canali del K+:
I canali del potassio inward rectifier (Kir) che permettono anche il passaggio dello ione più rapidamente verso l’interno che verso l’esterno e che quindi normalizzano il potenziale di membrana in seguito alla ripolarizzazione (Quayle et al., 1997). I canali del potassio sensibili all’ATP (KATP), derivanti dalla
combinazione della proteina canale Kir con la proteina recettore delle solfaniluree (SUR), inibiti da aumenti intracellulari di ATP e quindi molto influenti in condizioni di stress metabolico (Quayle et al., 1997).
I canali del potassio voltaggio-dipendenti (Kv), che, essendo
direttamente attivati dalla depolarizzazione, smorzano l’eccitazione delle cellule basali contribuendo in modo rilevante alla regolazione del tono vascolare (Jackson, 2000). I canali al potassio sensibili al calcio (KCa), in particolar modo
quelli ad alta conduttanza (BK), bersaglio dei flavonoidi, che sembrano avere un ruolo cruciale nel tamponare le risposte depolarizzanti e quindi contrastare la vasocostrizione (Kharkhun et al., 2000; Michelakis et al., 1997; Nelson e Quayle, 1995; Sobey, 2001).
Grazie alla loro influenza sulla ripolarizzazione delle cellule muscolari lisce vascolari, cambiamenti nell’espressione o nell’attività di questi canali spesso sono causa di una variazione del potenziale di membrana a riposo e quindi di un anomalo tono vascolare. Si ritiene quindi che alterazioni a carico dei canali del K+ contribuiscano a determinare condizioni fisiopatologiche caratterizzate dallo sviluppo di iperreattività vascolare, come ipertensione, aterosclerosi e diabete (England et al., 1993; Peng et al., 1999; Jackson, 2000; Sobey, 2001). Dato che i canali del K+ sono coinvolti nelle patologie vascolari, rappresentano potenziali bersagli di nuovi agenti terapeutici per il ripristino dei normali livelli di reattività vascolare.
1.2.1 I canali K
CaI canali per il potassio Ca2+ dipendenti rappresentano un’importante famiglia di canali ionici che partecipano alla regolazione del tono vascolare attraverso un meccanismo di controllo a feedback.
L’incremento della concentrazione intracellulare di ioni calcio liberi seguito dall’attivazione di una proteina chinasi calcio-calmodulina-dipendente rappresenta il primo degli eventi biochimici che porteranno alla contrazione della cellula muscolare. Infatti l’aumento della concentrazione di ioni calcio è direttamente responsabile della contrazione muscolare, ma è anche l’elemento indispensabile per attivare i meccanismi di regolazione a feedback che coinvolgono i canali al potassio.
L’attivazione dei canali del potassio Ca2+-dipendenti provoca un’efflusso di ioni potassio con conseguente iperpolarizzazione della membrana, inattivazione dei canali del calcio voltaggio-dipendenti, riduzione della concentrazione di calcio libero ed infine rilasciamento muscolare (Calderone e Martinotti, 2000).
I canali KCa si possono dividere in tre sottotipi, classificati a seconda
della conduttanza di ogni singolo canale:
SK (small conductance, 2-25 pS), codificato dai geni SK 1-3; IK (intermediate conductance, 25-100 pS), codificato dal
gene SK 4;
BK (big conductance, 100-300 pS), codificato dal gene Slo. Probabilmente il canale BK è il più studiato dei tre e data la sua alta conduttanza per lo ione K+, è sicuramente quello maggiormente in grado di avere una forte influenza sul potenziale di membrana (Calderone, 2002).
1.2.2 Canali BK
Figura 1.5: Struttura canali BK.
I canali BK (Figura 1.5) sono distribuiti ubiquitariamente fra i tessuti, sono espressi sia nelle cellule eccitabili sia in quelle non eccitabili, svolgendo un ruolo di controllo in numerose funzioni cellulari. In modo particolare sono stati studiati nelle cellule muscolari lisce (SMCs) vascolari, dove contribuiscono al controllo del tono vasale (Calderone, 2002).
I canali BK possono essere attivati da un aumento della concentrazione di calcio (attivazione calcio-dipendente), ma anche da un meccanismo voltaggio-dipendente, quindi la presenza di questi due meccanismi limita la depolarizzazione di membrana e la conseguente vasocostrizione, secondo un meccanismo di feedback negativo, promuovendo un forte flusso verso l’esterno di ioni K+ e portando ad un’iperpolarizzazione di membrana (Calderone, 2002).
Tutto ciò può essere considerato come un approccio terapeutico per migliorare la capacità vasodilatatoria, là dove sia compromessa, e per trattare alcune malattie cardiovascolari (Saponara et al., 2006).
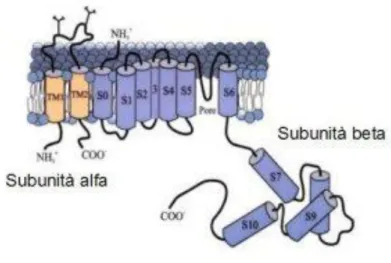
I canali BK derivano dall’associazione di due tipi di proteine: la subunità α e la subunità β (subunità accessoria). Il poro funzionale del canale è formato dall’assemblaggio di quattro subunità α (Toro et al., 1998), ciascuna composta da undici domini.
Per quanto riguarda la subunità α, si ritiene che sette domini siano transmembrana (S0-S6), costituenti il “core” del canale, mentre gli altri quattro domini siano citoplasmatici (S7-S10), a comporre la regione “coda”. Tutti questi elementi sono stati messi in relazione con le caratteristiche funzionali dei canali ed è stato possibile individuare le regioni responsabili della loro sensibilità al voltaggio e della loro selettività. Il segmento transmembrana S4 contiene diversi amminoacidi caricati positivamente, e probabilmente rappresenta il sensore del voltaggio, mentre nella “coda” citoplasmatica abbiamo il sensore intrinseco del Ca2+ intracellulare in quanto quest’ultimo, se presente, va a legarsi a un “EF hand motif”, un loop congiungente le α-eliche E e F situate a questo livello (Schreiber e Salkoff, 1997). La subunità β è composta da due segmenti transmembrana, con un lungo loop extracellulare e le porzioni N-terminali e C-terminali sul lato citoplasmatico. L’interazione tra queste due subunità avviene tramite la porzione N-terminale extracellulare e il primo dominio transmembrana (S0) della subunità α, conferendo così un aumento della sensibilità del canale nei confronti del voltaggio e del Ca2+
intracellulare (Jiang et al., 1999; Knaus et al., 1994; McCobb et al., 1995; Meera et al., 1996).
La trascrizione del canale BK subisce un’ampia gamma di splicing, producendo varie isoforme della proteina canale che differiscono per la sensibilità nei confronti del Ca2+ e del voltaggio, per la loro regolazione e proprietà (Lagrutta et al., 1994; Tian et al., 2001; Zarei et al., 2001).
Sfruttando queste isoforme, il canale BK può modulare l’efflusso di ioni K+, così da mantenere il potenziale di membrana delle SMCs a livelli ottimali fornendo così, un adeguato tono vascolare. Ad esempio per quanto riguarda la subunità β attualmente sono state identificate otto isoforme, e ciascuna influenza le proprietà fenotipiche del canale in modo diverso (Knaus et al., 1994; Uebele et al., 2000; Xia et al., 1999).
Sono stati fatti diversi studi sul ruolo fisiologico dei canali BK nelle cellule eccitabili, specialmente sul sistema nervoso (Gribkoff et al., 1997; Robitaille et al., 1993; Gola e Crest, 1993), dove tali canali hanno un ruolo chiave nella modulazione del rilascio del neurotrasmettitore, e sulla muscolatura liscia (Volk et al., 1991; Perez e Toro, 1994; Kume et al., 1995; Vogalis, 2000; Tanaka et al., 2002) dove tali canali sono fondamentali nella modulazione del tono della muscolatura vascolare, nell’uretra, nel tratto bronchi-trachea e nel tratto gastro-intestinale. Per tutti questi motivi sono stati studiati dei composti che avessero delle proprietà attivanti sui canali BK (BK-openers) così da modulare varie patologie come l’ipertensione, gli
spasmi coronarici, l’asma, l’incontinenza urinaria, l’ansia (Nardi et al., 2003).
I composti di riferimento, come attivatori dei canali BK sono due molecole a struttura benzimidazolonica NS1619 (Figura 1.6) e NS004 (figura 1.7) (Olesen e Watjen, 1992; Olesen et al., 1994).
N H N O F F F HO F F F Figura 1.6: Struttura NS1619 N H N HO Cl O F F F Figura 1.7: Struttura NS004.
Oltre all’elevato numero di composti di sintesi vanno ricordate anche le sostanze naturali che sembrano svolgere la stessa attività di attivazione dei canali BK come il Desmodium adscendens, estratto di una pianta africana utilizzato nella medicina popolare nel trattamento di stati associati a disfunzioni della muscolatura liscia come l’asma o la dismenorrea (Nardi et al., 2003); oppure il magnololo, isolato dalla corteccia di Magnolia officinalis, noto per le sue proprietà antiallergiche e antiasmatiche (Nardi et al., 2003). Ma soprattutto diversi flavonoidi, infatti in molti casi la loro azione vasorilasciante è giustificata dall’attivazione dei canali BK (Calderone et al., 2004). Per esempio è stato visto che apigenina e kaempferol vanno ad attivare i canali BK espressi in ovociti di Xenopus laevis e la porzione farmacoforica comune di questi flavonoidi è simile a quella presente in NS004 (Li et al., 1997), inoltre anche naringenina (Calderone et al., 2001) come luteolina o esperetina mostrano un effetto vasorilasciante, sensibile al tetraetilammonio e iberiotossina (due importanti inibitori dei canali del K+ in generale e dei canali BK in particolare, rispettivamente), sulla muscolatura liscia dell’aorta di ratto, mentre altri flavonoidi come il 5-metossiflavone o il 7-idrossiflavone danno una risposta vasorilasciante insensibile all’iberiotossina (quindi BK-indipendenti). Questi dati fanno dedurre che la presenza di un gruppo ossidrilico in 5, nella struttura del flavonoide, che caratterizza naringenina, luteolina ed esperetina, è requisito fondamentale per far si che il composto sia un attivatore dei canali BK (Calderone et al., 2002)
Parlando invece di inibitori dei canali BK, i più utilizzati a livello sperimentale sono i composti precedentemente citati: lo ione tetraetilammonio (TEA), che però non è selettivo per i canali BK perché riesce a bloccare anche i canali Kv (Calderone e Martinotti,
2000) e l’iberiotossina, sostanza isolata dal veleno dello scorpione Buthus tamulus, il primo esempio di inibitore ad alta affinità per i canali BK, e probabilmente una delle sostanze più usate. Altri inibitori dei canali BK sono rappresentati da sostanze appartenenti ad una famiglia di micotossine tremorgeniche isolate da funghi appartenenti al genere Penicillium, Aspergillus e Claviceps. Questo gruppo include la paxillina, il verruculogen e il penitrem. Altri inibitori sono la chinina e la chinidina; quest’ ultime sono abbastanza selettivi dei canali BK e IK, ma influenzano anche in modo significativo le correnti di calcio e di sodio ed inattivano altri sottotipi di canali del potassio, per questi motivi il loro uso a livello sperimentale è limitato (Armando-Hardy et al., 1975; Burgess et al., 1981; Cook, 1990).
Capitolo 2
Scopo della tesi
Lo scopo di questa tesi è stato quello di effettuare uno studio in vitro sull’azione iperpolarizzante di alcuni flavonoidi, per esaminare la loro possibile attività sui canali vascolari del potassio, in particolare sui canali BK, valutandone le potenzialità per una possibile attività terapeutica. Fino ad oggi su queste sostanze sono stati effettuati studi su modelli animali (in particolare i modelli murini). Tali studi hanno dimostrato l’azione dei flavonoidi sui canali del potassio (soprattutto sui canali BK). E’ però insufficiente effettuare solo studi su modelli animali per capire se una sostanza ha potenziali applicazioni terapeutiche sull’uomo, poiché il ratto e l’uomo sono distanti filogeneticamente quanto basta per prevedere possibili differenze farmacologiche a livello delle proteine canale. Sono quindi stati necessari studi in vitro su cellule umane per essere certi dell’azione dei flavonoidi sui canali del potassio.
Per fare ciò è stata utilizzata una tecnica di misurazione elettrofisiologica indiretta che permette di registrare le variazioni del potenziale di membrana di cellule muscolari lisce vascolari di aorta umana (HASMC); in particolare sono state studiate sostanze come luteolina, apigenina e naringenina.
Capitolo 3
Materiali e metodi
3.1 Materiali utilizzati per la sperimentazione in
vitro
3.1.1 Colture cellulari
Per la sperimentazione sono state utilizzate cellule di muscolatura liscia di aorta umana (Human Aortic Smooth Muscle Cells, HASMC, Invitrogen). Le cellule, prima dell’effettiva coltura in incubatore, vengono conservate in un dewar, contenente azoto liquido a -196°c, all’interno di appositi criotubi contenenti il mezzo di coltura e il dimetilsolfossido (DMSO) al 10 %. Il mezzo di coltura rappresenta un ambiente sierologico in cui le cellule sono quiescenti mentre il DMSO agisce da criopreservante impedendo la formazione di cristalli di ghiaccio nella sospensione cellulare. Le cellule, una volta effettuata la procedura di scongelamento vengono centrifugate (così da rimuovere ogni traccia residua di DMSO che a temperatura ambiente potrebbe danneggiare le strutture cellulari), risospese nel loro
mezzo di coltura all’interno di fiasche T75, e spostate all’interno dell’incubatore.
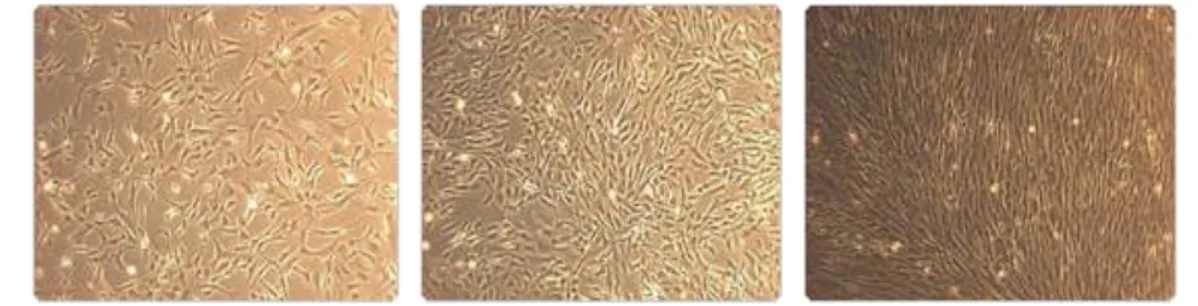
Per la coltura delle HASMC è stato impiegato come mezzo di crescita il Medium 231 (Cascade Biologics, Invitrogen). Tale mezzo contiene vari aminoacidi, vitamine, minerali, sali inorganici e altri composti essenziali che sono necessari alla crescita delle cellule ma non sufficienti. Infatti il mezzo è stato addizionato di un fattore di crescita per le cellule muscolari lisce chiamato SMGS (Smooth Muscle Growth Supplement, Invitrogen), contenente ormoni, estratti di tessuti, siero fetale bovino (FBS), insulina e altri fattori che garantiscono alle cellule il supporto proteico necessario per la crescita. Inoltre è stata eseguita un’aggiunta all’1% di una soluzione di penicillina/streptomicina per ridurre così il più possibile il pericolo di una contaminazione di natura batterica o fungina. Il mezzo di coltura così ottenuto deve essere conservato in frigorifero e soltanto al momento del suo utilizzo deve essere riscaldato a bagnomaria (fino a raggiungere una temperatura di 37°c). Osservate al microscopio le HASMC presentano una morfologia variabile in base ai tempi di replicazione: nelle prime fasi, le cellule hanno una forma lievemente allungata e sono disposte in maniera non ordinata, mentre una volta raggiunto un elevato grado di confluenza, queste si estendono in lunghezza e si dispongono nella tipica struttura muscolare (Figura 3.1).
Figura 3.1: HASMC rispettivamente al quinto, settimo e nono giorno di crescita
3.1.2 Sostanze utilizzate
Nel corso dell’esperimento sono state utilizzate le seguenti sostanze:
DiBAC4(3) (Sigma-Aldrich)
DMSO (Carlo Erba)
NS1619 (Sigma-Aldrich) Luteolina (Extrasynthese) Apigenina (Extrasynthese) Naringenina (Extrasynthese) TEA (Sigma-Aldrich) Iberiotossina (Sigma-Aldrich) Glibenclamide (Sigma-Aldrich) XE -991 dihydrocloride (Tocris)
Durante le varie procedure sperimentali è stata usata una soluzione tampone, un Buffer (denominato Standard) formato dalle sostanze riportate in tabella 3.1:
SOLUTO CONC. PM g/L HEPES 20mM 238,30 4,776 NaCl 120mM 58,44 7,013 KCl 2mM 74,56 0,419 CaCl2 · 2H2O 2mM 147,82 0,296 MgCl2 · 6H2O 1mM 203,31 0,203 Glucosio 5mM 198,17 0,991 Tabella 3.1: Composizione del Buffer Standard.
Queste sostanze vengono disciolte tutte in acqua bidistillata, dopodichè viene portato il pH della soluzione a 7,4 (pH fisiologico) a temperatura ambiente.
3.1.3 Soluzioni delle sostanze utilizzate
La sonda DiBAC4(3) è stata solubilizzata in DMSO così da ottenere una
soluzione madre di 500µM, aliquotata e stoccata in congelatore. Successivamente è stata diluita nel Buffer Standard per avere una concentrazione finale di 2,5µM.
Il composto NS1619 è stato solubilizzato in DMSO per ottenere una soluzione madre di 2mM, successivamente diluita nel Buffer Standard per ottenere la concentrazione finale 10µM.
Il composto naringenina è stato solubilizzato in DMSO in modo da ottenere una madre 20mM, successivamente diluito in Buffer Standard a dare concentrazioni finali di 100µM, 30µM, 10µM e 3µM.
Il composto luteolina è stato solubilizzato in DMSO in modo da ottenere una soluzione madre di 2·10-1M e stoccato in congelatore per essere poi diluito in Buffer Standard, andando così ad avere concentrazioni finali di 1µM, 3µM, 10µM, 30µM, 100µM, 300µM e 1mM.
Il composto apigenina è stato solubilizzato in DMSO in modo da ottenere una soluzione madre di 2·10-1M e stoccato in congelatore per essere poi diluito in Buffer Standard, andando così ad avere concentrazioni finali di 1µM, 3µM, 10µM, 30µM, 100µM, 300µM e 1mM.
Il composto iberiotossina è stato solubilizzato in acqua bi-distillata al fine di ottenere una madre 20µM e stoccato in congelatore per poi essere ulteriormente diluito in Buffer Standard a dare la soluzione finale di 100nM.
Il composto tetraetilammonio (TEA) è stato solubilizzato in Buffer Standard in modo da ottenere una concentrazione finale di 10mM. Il composto glibenclamide è stato solubilizzato in DMSO al fine di ottenere una madre 200mM e successivamente diluito in Buffer Standard per ottenere una concentrazione finale pari a 10µM.
Il composto XE 991 è stato solubilizzato in H2O bidistillata in modo da
ottenere una soluzione madre di 2mM, aliquotata e stoccata in congelatore. Successivamente è stata diluita nel buffer di riferimento per ottenere una concentrazione finale di 10µM.
3.2 Protocollo sperimentale
Questa tipologia di esperimento si sviluppa in più giorni, in quanto diviso in tre fasi: scongelamento delle cellule, piastratura delle stesse e misurazione delle variazioni di fluorescenza. Tutte le operazioni vengono eseguite sotto una cappa a flusso laminare previamente sterilizzata tramite raggi UV e, dove possibile, utilizzando strumenti monouso sterili e apirogeni.
3.2.1 Scongelamento
Lo scongelamento è una procedura che deve avvenire molto velocemente in quanto bisogna evitare che il DMSO, previamente miscelato al mezzo di coltura col fine di agire da criopreservante, a temperatura ambiente danneggi le strutture cellulari. Queste, contenute nel criotubo, vengono prelevate dal dewar, riempito di azoto liquido, e immerse nel bagnomaria per far si che la sospensione cellulare si scongeli rapidamente. Avvenuto lo scongelamento si trasferisce il contenuto del criotubo in una falcon (tubo graduato con tappo a vite) e si addizionano, gradualmente, pochi ml di mezzo di
crescita, precedentemente riscaldato a 37 °C, agitando
continuamente in modo da far equilibrare le cellule con il nuovo mezzo. A questo punto si centrifuga la sospensione per cinque minuti a 1100 rpm, dopodichè si aspira con una pompa da vuoto il sovranatante (che contiene DMSO, dannoso per le cellule) e si risospende il pellet così ottenuto con circa 10ml di mezzo di coltura. Si otterrà così una nuova sospensione che verrà trasferita in una
fiasca T75 e inserita nell’incubatore ad una temperatura di 37°C, una percentuale di circa 5% di CO2 e il restante 95% di aria.
Nei giorni seguenti giornalmente viene aspirato il mezzo vecchio e sostituito con quello nuovo, effettuando lavaggi con PBS (Phospate Buffered Saline, Sigma-Aldrich) ovvero una soluzione salina che aiuta ad asportare eventuali cellule morte o residui. Questa procedura va ripetuta fino a quando le cellule non sono a confluenza, cioè non hanno ricoperto tutta la superficie di adesione della fiasca.
3.2.2 Piastratura
La piastratura è la procedura attraverso la quale le cellule, una volta giunte a confluenza, vengono staccate dalla piastra, contate ed infine seminate nei pozzetti di una piastra così da essere sottoposti a trattamenti farmacologici differenziati. Per questo protocollo sperimentale viene utilizzata un tipo di piastra adatta alla lettura spettrofotometrica, ovvero una multi-well nera da 96 pozzetti. Il fondo trasparente è rivestito da un sottile strato di poli-L-lisina che facilita l’adesione cellulare; inoltre poiché le HASMC hanno difficoltà ad aderire, prima di immettere le cellule, ogni pozzetto viene pre-trattato con 100µL di gelatina (Gelatin from porcine skin, Type A, Sigma-Aldrich) all’1%, successivamente aspirati, prima della piastratura, tramite la pompa da vuoto. Questa procedura porta alla formazione di una pellicola sul fondo della piastra (coating) che favorisce notevolmente l’adesione cellulare.
con lo scopo di lavare le cellule, rimuovendo eventuali corpi apoptotici e detriti cellulari. Durante l’aspirazione del mezzo bisogna avere molta attenzione a non urtare il fondo della fiasca, perché la forza di suzione della pompa a vuoto potrebbe risucchiare le cellule stesse. In seguito viene aspirato il PBS e vengono immessi 3ml di Tripsina + EDTA(Sigma-Aldrich). A questo punto la piastra viene depositata, per qualche minuto, all’interno dell’incubatore, dove l’enzima si trova alla temperatura ottimale per esercitare la sua azione idrolitica sulle cellule, consentendo il distacco delle stesse dal fondo. Una volta avvenuto il distacco (verificato attraverso una rapida osservazione al microscopio), l’attività della Tripsina-EDTA viene neutralizzata attraverso l’immissione nella fiasca di un eccesso di mezzo di coltura, previamente riscaldato, in genere circa 7ml, così da neutralizzare l’enzima con le proteine contenute nel fattore di crescita. La sospensione così ottenuta viene recuperata e trasferita in una falcon da 15ml. Dal momento che il protocollo richiede di piastrare 72˙000 cellule in ogni pozzetto, bisogna procedere con la conta cellulare, immettendo circa 15µl di sospensione nella camera di Burker (Figura 3.2). Utilizzando il microscopio si contano le cellule presenti nel quadrante e sapendo che in ogni mm2 ci sono 0,1µl di sospensione, possiamo risalire al numero di cellule totali e quindi al volume di sospensione che dobbiamo prelevare per ottenere gli ml contenenti il numero di cellule desiderato da seminare nei pozzetti.
Figura 3.2: Camera di Burker e visualizzazione dei quadranti all'interno dei quali vengono contate le cellule.
Una volta effettuata la piastratura, si ripone la piastra nell’incubatore e la sospensione cellulare non impiegata per l’esperimento viene diluita in circa 10ml di mezzo e rinfiascata, così che le cellule non utilizzate possano replicarsi ed essere sfruttate, una volta giunte nuovamente a confluenza , per un successivo esperimento.
3.2.3 Esperimento
L’esperimento vero e proprio inizia 24 ore dopo la piastratura, così che le cellule possano aderire correttamente al fondo dei pozzetti ed arrivare a confluenza. Il primo passo consiste nell’aspirare il mezzo di coltura dai pozzetti, in modo che questo non interferisca con la lettura spettrofotometrica. Durante questa operazione bisogna porre molta attenzione a non aspirare via le cellule stesse: per questo motivo si preferisce l’utilizzo di una pipetta Gilson al posto della pompa da vuoto, la cui forza di suzione è troppo elevata. Successivamente in ogni pozzetto vengono deposti 180µl di una soluzione costituita dal buffer di riferimento e dalla sonda
fluorescente bis (1,3-acido dibarbiturico)-trimetin oxonolo DiBac4(3),
alla concentrazione di 2,5µM.
Questa sonda appartiene alla famiglia dei Bis-oxonoli anionici i quali sono in grado di distribuirsi ai due lati della membrana cellulare secondo il gradiente elettrico transmembranale e si legano alle proteine intracellulari esibendo un’incrementata fluorescenza. Data la sua natura anionica, la sonda emetterà una maggiore fluorescenza con l’aumento del potenziale di membrana, come accade durante la depolarizzazione, in quanto la sonda tenderà a penetrare maggiormente all’interno della cellula; al contrario, esprimerà una fluorescenza minore nel caso in cui si abbia un’iperpolarizzazione (determinata ad esempio da un attivatore dei canali del potassio) del potenziale di membrana, che porta la sonda a fuoriuscire dalla cellula (Figura 3.3).
Depolarizzazione
Iperpolarizzazione
Iperpolarizzazione
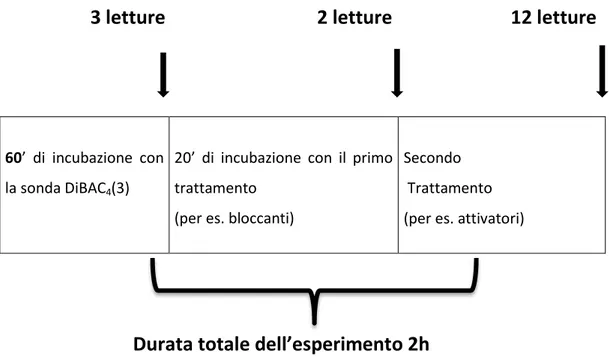
Una volta immessa nel pozzetto alla concentrazione di 2,5µM, la sonda viene lasciata 1 h in incubazione con le cellule. Al termine di
DiBAC4(3)
tale periodo vengono effettuate le prime tre letture spettrofluorimetriche, attraverso un lettore multipiastra (Espire, Perkin Elmer); lo strumento esegue una lettura ogni 2 minuti e mezzo, alla lunghezza d’onda della fluoresceina (488nm/520nm) così da misurare la fluorescenza basale. Dopodichè, ove richiesto dalla procedura sperimentale, alcuni pozzetti vengono incubati con dei bloccanti del canale del potassio per un periodo di 20 minuti, negli ultimi cinque dei quali vengono effettuate due nuove letture, in modo da rilevare l’effetto esclusivo dei bloccanti sul potenziale di membrana. L’ultima fase prevede il trattamento con potenziali attivatori dei canali del potassio e con le sostanze di riferimento. Si procede infine alle ultime 12 letture spettrofluorimetriche, alla medesima lunghezza d’onda, per un periodo di circa 35 minuti (Figura
3.4). 3 letture 2 letture 12 letture
Durata totale dell’esperimento 2h
Figura 3.4: rappresentazione schematica dell'esperimento.
60’ di incubazione con
la sonda DiBAC4(3)
20’ di incubazione con il primo trattamento
(per es. bloccanti)
Secondo
Trattamento (per es. attivatori)
Come sostanza di riferimento è stata utilizzata:
NS1619 alla concentrazione di 10µM, attivatore selettivo dei canali BK.
Come bloccanti dei canali del potassio sono stati utilizzati:
Iberiotossina alla concentrazione di 100nM, bloccante del canale BK;
TEA alla concentrazione di 10mM, bloccante non selettivo dei canali del K+;
Glibenclamide alla concentrazione di 10µM, bloccante dei canali KATP ;
XE 991 alla concentrazione di 10µM, bloccante dei canali KV7.
3.3 Analisi dei dati delle colture cellulari
I diversi valori del potenziale di membrana sono stati espressi come variazioni di fluorescenza, calcolata con la seguente formula:
ΔF = Ft – F0
dove F0 è la fluorescenza basale prima dell’aggiunta dell’agente
iperpolarizzante in esame e Ft è la fluorescenza al tempo t dopo
l’aggiunta dell’agente iperpolarizzante in esame.
La variazione di fluorescenza è stata calcolata rispetto ai valori basali.
Il dato è stato espresso come percentuale rispetto alla massima diminuzione di fluorescenza indotta dall’agente iperpolarizzante di riferimento (NS1619 10µM).
L’analisi dei dati è stata elaborata mediante l’impiego del software Graph Pad Prism 5.0.
Le curve concentrazione-risposta relative all’effetto iperpolarizzante indotto dai vari flavonoidi sono state analizzate attraverso l’equazione di Hill. Il parametro di potenza relativa è stato espresso come pEC50 calcolato come logaritmo negativo della concentrazione
molare del flavonoide, in grado di evocare il 50% della risposta. L’analisi statistica è stata condotta mediante test statistico ANOVA a due vie e post test di Dunnet. Un valore di P<0,05 è stato considerato come limite di significatività.
Capitolo 4
Risultati e discussione
4.1 Risultati sperimentali ottenuti
4.1.1 Premessa
L’azione benefica dei flavonoidi a livello cardiovascolare è ormai nota, ed è stato ipotizzato che una dieta ricca di tali composti potrebbe portare ad una significativa riduzione dell’incidenza di malattie cardiovascolari (Hertog et al., 1993; Knekt et al., 1996). Questo effetto benefico viene frequentemente attribuito all’azione antiossidante dei flavonoidi, azione ampiamente riportata in letteratura, sia come dato sperimentale che come dato clinico, ma probabilmente sopravvalutata. Infatti, in primo luogo non tutti gli effetti dei flavonoidi sono giustificabili con la sola azione antiossidante; secondariamente ogni flavonoide, anche se possiede l’effetto antiossidante (essendo tutti chiaramente polifenoli), esibisce effetti farmacologici specifici, peculiari, differenti. Pertanto questa difformità nel comportamento farmacologico fa ipotizzare che a monte degli effetti osservati ci siano anche dei meccanismi
farmacodinamici più specifici rispetto alla generica azione antiossidante. Studi precedenti avevano anche consentito di correlare alcuni requisiti strutturali dei flavonoidi con specifici effetti, in particolare era stato osservato che flavonoidi 5-idrossi sostituiti mostravano attività vasodilatatoria riconducibile ad azione attivante sui canali del K+ (Calderone et al., 2004). Più recentemente lo stesso tipo di relazione struttura-attività (ovvero l’importanza dell’ossidrile in posizione 5) si è rivelata requisito essenziale anche per l’azione cardioprotettiva su modelli sperimentali di ischemia e riperfusione miocardica, anche in questo caso probabilmente riconducibile all’attivazione dei canali del K+ anche se, nel caso della cardioprotezione, sono presumibilmente i canali espressi a livello mitocondriale (Testai et al., 2013A).
Tra i vari flavonoidi 5-idrossi sostituiti, naringenina è stata oggetto di studi più approfonditi, sempre però su modelli sperimentali murini, a livello mitocondriale cardiaco e della muscolatura liscia vascolare. Tali studi hanno chiaramente e inequivocabilmente dimostrato che questo flavanone è un attivatore dei canali del K+, del tipo BK, a livello sia vascolare che mitocondriale cardiaco, responsabile, almeno in buona parte, dell’azione vasodilatatoria e dell’azione cardioprotettiva (Testai et al., 2013B).
Nell’ottica di effettuare una sperimentazione farmacologica traslazionale, quindi di trasferire i dati ottenuti a livello della muscolatura liscia vascolare del roditore ad una reale prospettiva farmacologica nell’uomo, la naringenina è stata selezionata per
valutarne gli effetti su cellule HASMC, cioè su una linea di cellule muscolari lisce vascolari umane.
4.1.2 Naringenina
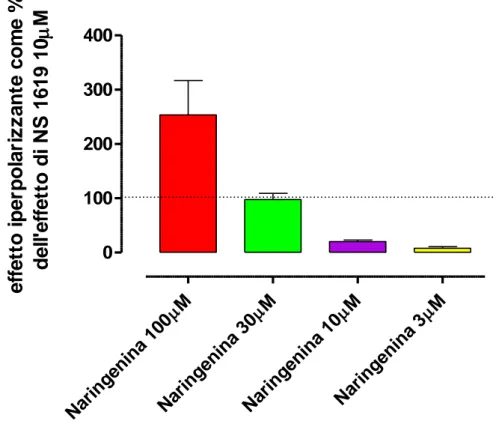
Il flavanone naringenina ha indotto effetti iperpolarizzanti, concentrazione-dipendente, sulla membrana delle cellule HASMC e, alla massima concentrazione testata, 100µM, ha mostrato un’efficacia addirittura superiore (Emax 254±64) a quella prodotta dal BK attivatore sintetico di riferimento NS 1619, alla concentrazione di 10µM (Figura 4.1) M Nar inge nina 100 M Nar inge nina 30 M Nar inge nina 10 M Nar inge nina 3 0 100 200 300 400 e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i NS 1 6 1 9 1 0 M
Figura 4.1: Effetto iperpolarizzante indotto da concentrazioni crescenti di naringenina, espresso come percentuale della risposta iperpolarizzante indotta dal farmaco di riferimento NS 1619 10µM.
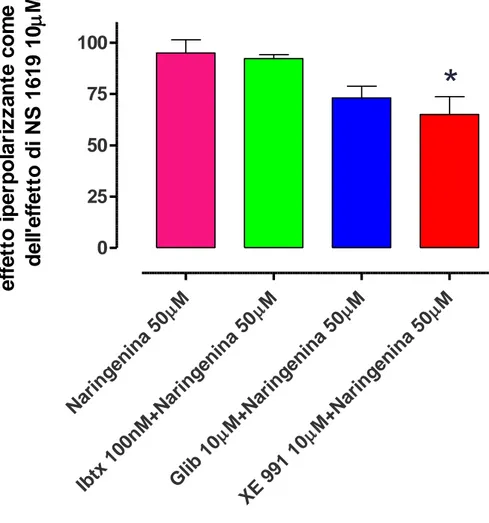
Diversamente da quanto osservato in modelli murini, il bloccante selettivo dei canali BK, iberiotossina, non ha prodotto una inibizione significativa dell’effetto iperpolarizzante indotto da naringenina 50µM (95±6) (Figura 4.2). Alla luce di questo fatto, l’indagine si è spostata su altre famiglie di canali del potassio quali per esempio i KATP, attraverso l’utilizzo del bloccante selettivo glibenclamide, il
quale ha prodotto una riduzione dell’effetto iperpolarizzante indotto dalla naringenina (73±6) (Figura 4.2 e Figura 4.3), che è risultato ai limiti della significatività (P= 0,06). Infine è stato investigato il coinvolgimento della famiglia dei canali del potassio voltaggio-dipendenti KV7; ciò che è emerso è che il bloccante selettivo XE 991 è
risultato in grado di inibire in maniera significativa (65±9, P<0,05) l’azione iperpolarizzante di naringenina, indicando un chiaro coinvolgimento dei KV7 nell’effetto osservato (Figura 4.2 e Figura
4.3).
I risultati ottenuti hanno confermato che, anche sulla muscolatura vascolare umana, naringenina è attivatore dei canali del K+, e quindi è ragionevole aspettarsi che sia un vasodilatatore; tuttavia diversamente da quanto osservato nei modelli murini il canale BK non ha un ruolo predominante sull’iperpolarizzazione. E’ sembrato quindi interessante procedere con la valutazione di altri flavonoidi 5-idrossi sostituiti, per altro tra quelli più ampiamente presenti nei vegetali anche di comune utilizzo alimentare come apigenina e luteolina.
M Nar inge nina 50 M Ibtx 100 nM +Nar inge nina 50 M M+N arin geni na 5 0 Glib 10 M M+N arin geni na 5 0 XE 9 91 1 0 0 25 50 75 100
*
e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i NS 1 6 1 9 1 0 MFigura 4.2:Riduzione dell'effetto iperpolarizzante di naringenina 50µM da parte del bloccante selettivo dei canali BK iberiotossina 100nM, del bloccante selettivo dei canali KATP glibenclamide 10µM e del bloccante selettivo dei canali Kv7 XE991
10µM, espressa come percentuale rispetto all’effetto iperpolarizzante indotto da NS 1619 10µM. La significatività dei dati è stata valutata tramite test statistico t di Student rispetto alla naringenina 50µM.
5 10 15 20 25 30 35 -0.25 -0.20 -0.15 -0.10 -0.05 0.00 Naringenina 50M Glib 10M+Naringenina 50M XE 991 10M+Naringenina 50M min (F t-F 0 )/ F 0
Figura 4.3: Variazione nel tempo della fluorescenza della sonda DiBAC 4(3) al variare del potenziale di membrana delle cellule HASMC in seguito a somministrazione di naringenina e di naringenina in presenza di glibenclamide 10µM o di XE 991 10µM. Tale variazione è stata osservata nel tempo fino al trentacinquesimo minuto.
4.1.3 Luteolina
Il flavonoide luteolina ha iperpolarizzato le cellule HASMC a concentrazioni minori rispetto alla naringenina (Figura 4.4) e quindi con indici di potenza superiori (pEC50 4,94±0,04) (Figura 4.5), sebbene
la luteolina abbia indotto un’iperpolarizzazione solo parziale (Emax
40±7).
L’utilizzo di iberiotossina (Figura 4.6) non ha minimamente influenzato gli effetti iperpolarizzanti di luteolina, portando così ad escludere un significativo coinvolgimento dei canali BK nella risposta iperpolarizzante. L’indagine si è dunque spostata su altre tipologie di canali del K+, note per rivestire un ruolo fondamentale nel controllo
del potenziale nella membrana delle cellule muscolari lisce vascolari umane; in particolare sono stati utilizzati i bloccanti quali il TEA (bloccante non selettivo di diversi tipi di canali voltaggio-dipendenti), la glibenclamide (solfanilurea bloccante dei canali KATP) e XE 991
(bloccante dei canali KV7). Nessuno di questi tre bloccanti ha tuttavia
influenzato in modo significativo gli effetti di luteolina (Figura 4.6).
-6 -5 -4 -3 -2 -50 0 50 100 150 NAR API LUT Log[flavonoide] e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i N S 1 6 1 9 1 0 M Figura 4.4:Curve sigmoidi concentrazione-risposta di naringenina, apigenina e luteolina.
Possiamo pertanto concludere che questo flavonoide è certamente in grado di alterare il potenziale di membrana, portandolo verso valori iperpolarizzanti (stabilizzando così la membrana delle cellule muscolari umane e probabilmente avendo anch’esso, come naringenina, un’azione vasodilatatoria), tuttavia nessuno tra i principali meccanismi esaminati gioca un ruolo predominante, pertanto, contrariamente a quanto in precedenza osservato su modelli sperimentali murini (Calderone et al., 2004), nelle cellule muscolari lisce umane luteolina o non è un attivatore dei canali del
K+, per lo meno di quelli valutati in questo studio, oppure pur mantenendo un’azione farmacologica su uno o più dei canali esaminati è comunque in grado di attivare altri meccanismi iperpolarizzanti predominanti che rendono quindi marginale il ruolo dei canali KATP, BK e KV7.
M Lute olin a 1 M Lute olin a 3 M Lute olin a 10 M Lute olin a 30 M Lute olin a 10 0 M Lute olin a 30 0 -5 15 35 55 e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i NS 1 6 1 9 1 0 M
Figura 4.5: Effetto iperpolarizzante indotto da concentrazioni crescenti di luteolina, espresso come percentuale della risposta iperpolarizzante indotta dal farmaco di riferimento NS 1619 10µM.
M Lute olin a 30 M TEA 10m M+L uteo lina 30 M M+ L uteo lina 30 Gli b 10 M Ibtx 100 nM +Lut eolin a 3 0 M M+ L uteo lina 30 XE 9 91 1 0 0 20 40 60 80 e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i NS 1 6 1 9 1 0 M
Figura 4.6: Assenza di significativa riduzione dell’effetto iperpolarizzante della luteolina 30µM da parte del bloccante XE 991 10µM, iberiotossina 100nM, glibenclamide 10µM e TEA 10mM, espressa come percentuale rispetto all’effetto iperpolarizzante indotto da NS 1619 10µM.
4.1.4 Apigenina
Il flavonoide apigenina è, strutturalmente, uno stretto analogo della naringenina, ed è caratterizzato, come unica differenza, dalla presenza di un’insaturazione in posizione 2-3 del sistema biciclico (Figura 4.7).
. O HO OH O OH O OH HO OH O A B
Figura 4.7: Differenza strutturale tra naringenina (A) e apigenina (B).
Anche l’apigenina ha indotto effetti iperpolarizzanti concentrazione-dipendenti (Figura 4.8) con livelli di efficacia paragonabili al BK attivatore sintetico NS 1619 10µM (Emax 95±9), ma con livelli di
potenza significativamente inferiori rispetto a quelli esibiti dagli altri due flavonoidi (pEC50 3,79±0,06) (Figura 4.4).
M Api geni na 1 M Api geni na 3 M Api geni na 1 0 M Api geni na 3 0 M Api geni na 1 00 M Api geni na 3 00 Api geni na 1 mM -10 40 90 140 e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i NS 1 6 1 9 1 0 M
Figura 4.8: Effetto iperpolarizzante indotto da concentrazioni crescenti di apigenina, espresso come percentuale della risposta iperpolarizzante indotta dal farmaco di riferimento NS 1619 10µM.
La caratterizzazione del meccanismo farmacodinamico attraverso l’impiego di bloccanti di canali ionici, ha consentito di evidenziare che, anche nel caso di apigenina, il coinvolgimento dei canali BK sembra essere assente o comunque di secondaria importanza in quanto gli effetti iperpolarizzanti dell’apigenina non sono stati minimamente alterati da iberiotossina ne’ da TEA (Figura 4.9). Viceversa la solfanilurea, glibenclamide, ha significativamente inibito l’azione di apigenina (Figura 4.9 e Figura 4.10), suggerendo quindi che l’attivazione del canale KATP possa realmente rappresentare il
meccanismo predominante nell’effetto iperpolarizzante di questo flavonoide. M Api geni na 3 00 M TEA 10m M+A pige nina 300 M Ibtx 100 nM +Api geni na 3 00 M+A pige nina 300 mM Glib 10 0 20 40 60 80 100
**
e ff e tt o i p e rp o la ri z z a n te c o m e % d e ll 'e ff e tt o d i NS 1 6 1 9 1 0 MFigura 4.9: Effetto iperpolarizzante di apigenina 300µM in presenza o in assenza del bloccante non selettivo di diversi tipi di canali voltaggio-dipendenti TEA
10mM, del bloccante selettivo dei canali BK iberiotossina 100nM e riduzione dell’effetto iperppolarizzante da parte del bloccante selettivo dei canali KATP
glibenclamide 10µM, espressa come percentuale rispetto all’effetto iperpolarizzante indotto da NS 1619 10µM. La significatività dei dati è stata valutata tramite test statistico t Student rispetto all’apigenina 300µM.
5 10 15 20 25 30 35 -0.4 -0.3 -0.2 -0.1 0.0 Apigenina 300M Glib 10M+Apigenina 300M min (F t-F 0 )/ F 0
Figura 4.10: Variazione nel tempo della fluorescenza della sonda DiBAC 4(3) al variare del potenziale di membrana delle cellule HASMC in seguito a
somministrazione di apigenina e di apigenina in presenza di glibenclamide 10µM. Tale variazione è stata osservata nel tempo fino al trentacinquesimo minuto.
4.2 Conclusioni
In conclusione tutti i 5-idrossi flavonoidi che sono stati esaminati in questo studio hanno prodotto effetti iperpolarizzanti sulle HASMC, suggerendo che la stabilizzazione della muscolatura liscia vascolare, con i relativi effetti vasodilatatori/anti-vasocostrittori, possa