Dipartimento di Medicina Clinica e Sperimentale Direttore Prof. Mario Petrini
Dipartimento di Patologia Chirurgica, Medica, Molecolare e dell'Area Critica Direttore Prof. Paolo Miccoli
Dipartimento di Ricerca Traslazionale e delle Nuove Tecnologie in Medicina e Chirurgia
Direttore Prof. Giulio Guido
CORSO DI LAUREA SPECIALISTICA IN PSICOLOGIA CLINICA E
DELLA SALUTE
“Profilo neuropsicologico dei soggetti con diagnosi di
Parkinson’s Disease-Mild Cognitive Impairment
(PD-MCI)”
RELATORE
CHIAR.MO PROF. MARCO TIMPANO
SPORTIELLO
CORRELATORE
CHIAR.MO DOTT. DAVIDE MARIA
CAMMISULI
CANDIDATO
DOTT.SSA EMANUELA CASTRO
1
2 SOMMARIO
PARTE I
1 IL MILD COGNITIVE IMPAIRMENT (MCI) ... 5
1.1 IL DETERIORAMENTO DEMENZIALE E LA DIAGNOSI DI DEMENZA ... 5
1.2 LA DEFINIZIONE DI MILD COGNITIVE IMPAIRMENT ... 19
1.3 EPIDEMIOLOGIA,TASSIE FATTORI DI RISCHIO PER LA CONVERSIONE IN DEMENZA ... 25
1.4 LA DIAGNOSI DI MILD COGNITIVE IMPAIRMENT E L’ASSESTMENT NEUROPSICOLOGICO ... 33
1.5 TERAPIA FARMACOLOGICA E NON FARMACOLOGICA IN SOGGETTI CON MCI ... 44
1.6 OLTRE IL MILD COGNITIVE IMPAIRMENT ... 47
1.7 CONCLUSIONI ... 51
2 IL MILD COGNITIVE IMPAIRMENT NELLA MALATTIA DI PARKINSON (PD-MCI) ...53
2.1 BREVI CENNI SULLA MALATTIA DI PARKINSON ... 53
2.1.1 La Demenza nella Malattia di Parkinson (PD-D)... 57
2.2 IL MILD COGNITIVE IMPAIRMENT NELLA MALATTIA DI PARKINSON (PD-MCI) ... 63
2.2.1 Epidemiologia, tassi e fattori di rischio per la conversione in demenza ... 63
2.2.2 Profilo neuropsicologico dei pazienti Parkinson non dementi ... 71
2.2.3 La diagnosi di PD-MCI e l’assessment neuropsicologico ... 79
2.2.4 Caratteristiche Neuropatologiche, Correlati Neurochimici e Biomarkers della Malattia di Parkinson. ………92
2.2.5 Sintomi psichiatrici in soggetti PD-MCI ... 98
2.2.6 Terapia farmacologica e non farmacologica in soggetti con PD-MCI ... 100
2.2.7 Conclusioni ... 103
3 STUDIO SPERIMENTALE ... 105
3.1 SCOPO DEL LAVORO ... 105
3.2 METODO ... 108
3.2.1 Campione ... 108
3.2.2 Strumenti di assessment ... 110
3.3 ANALISI STATISTICHE ... 118
3.4 RISULTATI ... 121
3.4.1 Statistiche sul campione di n°. 54 soggetti PD-MCI ... 121
3.4.2 Statistiche sui 3 campioni di confronto ... 126
3.5 DISCUSSIONE E CONCLUSIONI ... 133
4 APPENDICI ... 138
3 RIASSUNTO
La malattia di Parkinson (MP) è una patologia degenerativa del SNC caratterizzata dalla triade sintomatologica di tremore, rigidità e bradicinesia. Dal punto di vista anatomopatologico, la MP è causata dalla degenerazione della pars compacta della sostanza nera mesencefalica ventrale. Le stime di prevalenza nella popolazione totale sono pari allo 0,3%, salendo fino all’1% se si considera selettivamente la fascia della popolazione sopra i 60 anni (Costa, 2009). L’incidenza della malattia è praticamente assente prima dei 40 anni, crescendo esponenzialmente col progredire dell’età (ibidem). La probabilità di sviluppare demenza conseguente a MP è stimata intorno al 40% (Emre, 2003; Aarsland et al., 2005). L’incidenza annua di Parkinson’s Dementia (PDD) in soggetti con MP è circa del 3% per individui al di sotto dei 60 anni e del 15 % per la fascia ultra-ottantenne (Mayeux et al., 1990; Karder et al., 1995).
Oltre ai sintomi motori, nei pazienti con MP sono stati riscontrati lievi e selettive alterazioni cognitive, che hanno recentemente condotto clinici e ricercatori a valutare la presenza di Mild Cognitive Impairment nella MP (Janvin et al., 2006; Mamikonyan et al., 2009). Tuttavia, gli esigui studi fin qui prodotti evidenziano un’alta eterogeneità dei risultati dipendente dalla difformità dei criteri diagnostici utilizzati, dalle procedure di valutazione e dai setting clinici in cui sono condotte le ricerche. Proprio per questo la stima di frequenza di PD-MCI varia negli studi presenti in letteratura, aggirandosi in ogni modo su valori elevati: dal 19% al 25% (Dalrymple-Alford et al., 2011; Hoops et al., 2009; Aarsland et al., 2009; Cavines et al., 2007; Janvin et al., 2006).
Nel 2012, Litvan e collaboratori hanno pubblicato specifici criteri per la diagnosi di PD-MCI propedeutici per la risoluzione del problema dell’eterogeneità di questa classe diagnostica (Litvan et al., 2012).
In accordo con quanto espresso dalla Movement Disorder Task Force (Litvan et al., 2011), la definizione dell’entità nosologica PD-MCI si rende quindi necessaria al fine di:
- Identificare le caratteristiche cliniche degli stadi primari di danneggiamento cognitivo nel PD; - Mettere in evidenza i markers neuropsicologici capaci di descrivere la tipologia di soggetti
PD-MCI a più altro rischio di conversione in Parkinson’s Dementia (PDD);
- Valutare eventuali effetti del PD-MCI sulla qualità di vita e sull’autonomia del paziente;
Sulla base di tali premesse, il progetto di ricerca esposto nella tesi tenta di contribuire al processo di validazione della categoria PD-MCI ponendosi l’obiettivo di:
1. Descrivere in maniera accurata il profilo neuropsicologico dei soggetti PD-MCI; 2. Stimare la proporzione di ciascuna sottotipologia PD-MCI;
3. Confrontare le prestazioni ottenute da un sottogruppo di soggetti PD-MCI con quelle di soggetti MCI e di un campione di controllo, al fine di rilevare la presenza di specifici indici di malfunzionamento che caratterizzano in maniera peculiare i PD-MCI.
4 A questo scopo, sono stati valutati presso il Laboratorio di Neuropsicologia Clinica (Psicologia Ospedaliera, USL n. 5 Pisa) 54 soggetti con diagnosi di PD-MCI. Un sottogruppo di soggetti PD-MCI (N.= 20) è stato confrontato con un gruppo di 20 soggetti diagnosticati come MCI (sottotipo misto) e una terza popolazione di 20 soggetti che consisteva di un gruppo di controllo. La valutazione neurocognitiva dei pazienti ha compreso: uno screening generale delle funzioni cognitive attraverso il Milan Overall Dementia Assessment (Brazzelli et al., 1994); la valutazione delle autonomie attraverso il Activities of Daily Living (Katz, 1970) e l’ Instrumental Activities of Daily Living (Lawton e Brody, 1969); una batteria di test neuropsicologici per ciascun dominio cognitivo. In particolare, sono stati somministrati: per la valutazione neurocognitiva della memoria la Batteria di Memoria (Spinnler e Tognoni,1987) comprensiva di 4 sub-test (Test di apprendimento di coppie di parole, Digit Span, Span di Corsi, Memoria di Prosa, Apprendimento Supra-span di Corsi) e il Test di Memoria Comportamentale Rivermead (Brazzelli et al., 1993);per la valutazione dell’attenzione le Matrici Attentive (Spinnler e Tognoni, 1987) e lo Stroop Color Word Interference Test (Golden, 1978); per la valutazione del linguaggio il Boston Naming Test (Goodglass et al., 1983) e il Test di Fluenza Verbale per Categorie (Novelli et al., 1986); per le prassie costruttive il Test dell’Aprassia Costruttiva (Arrigoni e De Renzi, 1964); per le gnosie visive lo Street’s Completion Test (Spinnler e Tognoni, 1987);per le funzioni esecutive il Frontal Assessment Battery (Apollonio et al., 2005), le Matrici Attentive (Spinnler e Tognoni, 1987), lo Stroop Color Word Interference Test (Golden, 1978), il Test di Fluenza Verbale per Categorie (Novelli et al., 1986) e il Brixton Test (Shallice, 1982). Ai soggetti PD-MCI sono stati somministrati inoltre test specifici per la valutazione dei soggetti affetti da Malattia di Parkinson quali: la “Hoehn and Yahr Scale” (Hoehn e Yahr, 1967) e la “Unified Parkinson’s Disease rating scale” (MDS) e la “39-item PD Questionnaire”(Peto, 1998); );per la valutazione del quoziente intellettivo premorboso il “Brief Intelligence Test” (Sartori, 1997);per la valutazione dei sintomi psichiatrici la “Geriatric Depression Scale” (Yesavage, 2000);e il Neuropsychiatric Inventory” (Cummings, 1994).
5
PARTE I
1 IL MILD COGNITIVE IMPAIRMENT (MCI)
1.1 IL DETERIORAMENTO DEMENZIALE E LA DIAGNOSI DI DEMENZA
Il termine “demenza” è entrato in ambito medico nel 20 d.C., indicando una generica alterazione del comportamento e dell’intelletto (Trabucchi, 2000). Il quadro clinico così come oggi lo intendiamo è stato introdotto più di due secoli fa (Pinel, 1809; Esquirol, 1814), ma tarda ancora a raggiungere una caratterizzazione precisa, come è avvenuto per altre classi diagnostiche. In breve, Spinnler (1985) descrive il deterioramento demenziale (DD) con questi termini:
- Una complessa modificazione comportamentale, di tipo quasi esclusivamente riduttivo, in cui si assommano ed interagiscono molteplici difetti di natura neuropsicologica, dando così luogo all’incompetenza cognitiva;
- La caratteristica fondamentale di ogni deterioramento demenziale è quella di avere un andamento evolutivo sistematicamente peggiorativo.
Per poter porre diagnosi, è necessario innanzi tutto poter disporre di criteri diagnostici chiari e condivisi dalla comunità scientifica. La diagnosi di demenza si basa essenzialmente sui criteri del DSM IV TR (Diagnostic and Statistical Manual of Mental Disorders Text Revised) (APA, 2000) e su quelli dell’ICD-10 (International Statistical Classification of Diseases and Related Health Problems, 10th Revision) (WHO, 1992).
Quest’ultima classificazione presenta la seguente ripartizione:
F00-F09 Disturbi mentali organici F00 Demenza di Alzheimer F01 Demenza vascolare
F02 Demenza presente in altre patologie classificate altrove F02.0 Demenza nella Malattia di Pick
F02.1 Demenza nella Malattia di Creutzfeldt-Jakob F02.2 Demenza nella Malattia di Huntington F02.3 Demenza nella Malattia di Parkinson
6
F02.4 Demenza nella HIV
F02.8 Demenza in altre patologie non classificate altrove F03 Demenza non specificata
Le linee guida comprendono, per la demenza di tipo Alzheimer:
- La presenza di demenza come accuratamente descritta nel manuale - Insidioso sviluppo del deterioramento.
- Assenza di evidenze cliniche circa la presenza di patologie cerebrali o sistemiche che possano indurre demenza (ipotiroidismo, deficienza di vitamina B12, ematoma subdurale, etc.)
- Assenza di segni neurologici che possano suggerire un danno focale come emiparesi, perdita sensoriale, difetti visivi o altro che occorrano presto nella malattia (essi infatti possono svilupparsi successivamente)
Questi invece sono i criteri diagnostici del DSM-IV per la Demenza Tipo Alzheimer:
A. Sviluppo di deficit cognitivi multipli, manifestati da entrambe le condizioni seguenti: a. Deficit della memoria (compromissione della capacità di apprendere nuove
informazioni o di ricordare informazioni già acquisite) b. Una (o più) delle seguenti alterazioni cognitive:
i. Afasia (alterazione del linguaggio)
ii. Aprassia (compromissione della capacità di eseguire attività motorie nonostante l’integrità della funzione motoria)
iii. Agnosia (incapacità di riconoscere o di identificare oggetti nonostante l’integrità della funzione sensoriale)
iv. Disturbo delle funzioni esecutive (cioè, pianificare, organizzare, ordinare in sequenza, astrarre).
B. Ciascuno dei deficit cognitivi dei Criteri A1 e A2 causa una compromissione significativa del funzionamento sociale o lavorativo, e rappresenta un significativo declino rispetto ad un precedente livello di funzionamento.
C. Il decorso è caratterizzato da insorgenza graduale e declino continuo delle facoltà cognitive.
D. I deficit cognitivi dei Criteri A1 e A2 non sono dovuti ad alcuno dei seguenti fattori: a. Altre condizioni del sistema nervoso centrale che causano deficit progressivi della
7
Parkinson, malattia di Huntington, ematoma sottodurale, idrocefalo normoteso, tumore cerebrale)
b. Affezioni sistemiche che sono riconosciute come causa di demenza (per es., ipotiroidismo, deficienza di vitamina B12 o acido folico, deficienza di niacina, ipercalcemia, neuro-sifilide, infezione HIV)
c. Affezioni indotte da sostanze.
E. I deficit non si presentano esclusivamente durante il decorso di un delirium.
F. Il disturbo non risulta meglio giustificato da un altro disturbo dell’Asse I (per es., Disturbo Depressivo Maggiore, Schizofrenia).
Codici basati sul tipo di insorgenza e di caratteristica dominante:
Con Insorgenza Precoce: se l’insorgenza è all’età di 65 anni o prima. F00.01 Con Deliri: se i deliri sono la caratteristica dominante.
F00.03 Con Umore Depresso: se l’umore depresso (inclusi i quadri che soddisfino pienamente i criteri sintomatologici per un Episodio Depressivo Maggiore è la caratteristica dominante. Una diagnosi separata di Disturbo dell’Umore Dovuto a una Condizione Medica Generale non viene data.
F00.00 Non Complicato: se nessuno dei sottotipi sopra riportati predomina nel quadro clinico attuale.
Con Insorgenza Tardiva: se l’insorgenza è dopo i 65 anni di età. F00.11 Con Deliri: se i deliri sono la caratteristica dominante.
F00.13 Con Umore Depresso: se l’umore depresso (inclusi i quadri che soddisfano pienamente i criteri sintomatologici per un Episodio Depressivo Maggiore) è la caratteristica dominante. Una diagnosi separata di Disturbo dell’Umore Dovuto a una Condizione Medica Generale non viene data.
F00.10 Non Complicato: se nessuno dei sottotipi sopra riportati predomina nel quadro clinico attuale.
Specificare se:
Con Alterazioni Comportamentali.
Nella recente pubblicazione della quinta edizione del “Manuale Diagnostico e Statistico dei Disturbi Mentali (DSM V) (APA, 2013) la diagnosi di Disturbo Neurocognitivo Maggiore (così viene rinominata il deterioramento demenziale) rimane sostanzialmente invariata. Viene richiesta infatti la presenza di un declino significativo rispetto a precedente livello di funzionamento in uno o più domini cognitivi (accertato attraverso l’osservazione di un clinico, del soggetto o di terzi e constatato dall’utilizzo di test standardizzati); il deficit deve interferire con le attività della
8
vita quotidiana e non presentarsi esclusivamente in concomitanza di un delirium o di altri disturbi mentali. Tuttavia, nel DSM V sono presenti sottocategorie diagnostiche specifiche in base alla eziologia. Il Disturbo Neurocognitivo Maggiore può essere specificato se dovuto a patologia Alzheimer, degenerazione Frontotemporale, disturbo da Corpi di Lewy, disturbo vascolare, trauma cranico, uso di sostanze, HIV, Malattia di Parkinson, Malattia di Huntington, malattia dei prioni o altre condizioni mediche.
Questi criteri sono ritenuti internazionalmente validi, dato che riescono ad identificare clinicamente pazienti il cui esame post-mortem confermerà diagnosi di Malattia di Alzheimer (Knopman et al., 2001). Tuttavia, non è presente all’interno di questi criteri una precisa operazionalizzazione.
Secondo il National Institute of Neurologic and Communicative Disorders and Stroke (NINCDS) e l’Alzheimer’s Disease and Related Disorders Association (ADRDA), la diagnosi di Malattia di Alzheimer deve essere posta attraverso test psicologici e neuropsicologici. Tuttavia non vengono fornite indicazioni precise circa i cut-off da rispettare (McKhann et al., 1984). Una volta che la diagnosi di demenza è stata posta, è buona norma specificarne la determinazione clinica e l’eziologia, per individuarne e personalizzare trattamento e prognosi. Per la Malattia di Alzheimer, si considera un probabile processo degenerativo, di natura diversa a seconda della tipologia di deterioramento cognitivo, come presumibile eziologia. Questa può essere valutata attraverso una accurata anamnesi, che specifichi modalità d’insorgenza, progressione dei sintomi, variabilità dei deficit cognitivi. Oltre a ciò, test di laboratorio e reperti di imaging contribuiscono alla diagnosi differenziale.
9 Figura 1; Criteri diagnostici NINCDS-ADRDA, 1984 (Pinelli, 2003).
10 Figura 2; Criteri Diagnostici NINCDS-ADRDA riveduti, 2007 (Dubois, 2007).
11
Gli originali criteri del 1984 sono molto meno fini rispetto alla nuova proposta del 2007, in quanto le tecniche per monitorare le caratteristiche del disturbo e i cambiamenti cerebrali fisiologici del paziente AD sono stati resi molto più fini. Sono state inoltre rese maggiormente accurate le procedure di diagnosi differenziale ed i criteri di esclusione verso atre forme di disturbo, fino a riuscire ad individuare i sintomi nucleari dell’AD. Vengono inoltre prese in considerazione misure oggettive della memoria episodica attraverso prove di richiamo, e vengono specificati criteri di supporto alla diagnosi frutto delle nuove conoscenze in ambito di
neuroimaging e biologia molecolare.
La demenza rappresenta una condizione di invalidità che interessa un numero sempre maggiore di persone, a causa dell’aumento dell’età media della popolazione e della contemporanea diminuzione delle nascite. Questa tendenza coinvolge sia i paesi industrializzati sia quelli in via di sviluppo, con un incremento del numero di anziani previsto nel 2030 di oltre il 180% (Morris JC,1996).
Come sottolineato dal criterio B del DSM-IV Text Revision (APA, 2000), le sindromi demenziali causano un importante peggioramento della qualità della vita, limitando notevolmente l’autonomia della persona nella propria quotidianità e diminuendone le aspettative di vita. Attualmente, viene utilizzato il DALY, (Disability-Adjustd Life Year) unità di misura stabilita dall’Organizzazione Mondiale della Sanità, come indice della riduzione della vita, espressa in anni, a causa di disabilità e morte prematura. I quadri demenziali configurano il 2,4% dei 575,4 milioni di DALY perduti mondialmente a causa di malattie non trasmissibili. Nel dettaglio, rappresentano l’8,7 % dei 161,2 milioni di DALY perduti per malattie non trasmissibili nella popolazione ultrasessantenne (Trabucchi, 2000).
12
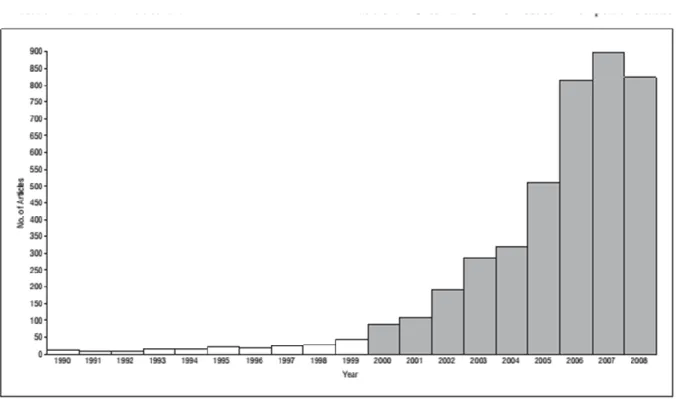
Gli studi epidemiologici che hanno seguito l’incremento della quantità di persone affette da demenza nel corso degli anni sono moltissimi. Riportare i dati forniti dagli studi epidemiologici riveste d’altronde un’importanza fondamentale. Riconoscere il peso dell’incidenza e della prevalenza di un disturbo, ed esaminarne il carico di disabilità ad esso associato nei diversi livelli di gravità, rappresenta la base per la costruzione di validi programmi di assistenza sanitaria e per l’avanzare delle ipotesi di ricerca medica, nei riguardi dei fattori di rischio, dell’eziologia e della patogenesi del disturbo. Il tutto risulta indispensabile per una corretta prevenzione, diagnosi e trattamento della patologia.
Per quanto riguarda gli studi sulla prevalenza della Malattia di Alzheimer, i dati riportano un rapido aumento, tale che negli ultrasessantacinquenni la percentuale risulta pari al 14-19% (rispetto al 3-4% dei paesi in via di sviluppo) della popolazione, mentre gli ultraottantenni pari al 2% della stessa (Pinelli, 2003). Si prevede che nei paesi industrializzati entro il 2025 gli ultra sessantacinquenni costituiranno circa un quarto della popolazione (ibidem).
La Malattia di Alzheimer rappresenta quindi la forma di demenza più comune (dal 50% all’80% del totale), seguita dalle demenze vascolari (10-20%). Molto frequenti risultano inoltre le demenze miste (Delay, Brion, 1962): si tratta di quadri di deterioramento demenziale in cui una forma eziologica si accompagna ad un’altra. In questo senso, le forme miste in cui alla Malattia di Alzheimer si aggiungono quadri vascolari risultano essere le più frequenti (Aguglia, 2006).
13
Altro dato interessante riguarda il rapporto maschi/femmine: i quadri di deterioramento demenziale risultano, presi nella loro totalità, maggiormente rappresentati dalle donne, con una prevalenza di queste in tutte le fasce di età considerate, stimata circa 1:3 (ibidem).
Secondo i dati riportati dallo studio ILSA (Italian Longitudinal Study on Aging) (Maggi et al., 1994) nel nostro Paese la demenza raggiunge il 5,3% degli uomini ultrasessantacinquenni e il 7,2% delle donne della stessa età. Su 5.462 persone eleggibili per lo studio ILSA, per 3.645 (66,7%) è stato completato lo screening per la demenza, vale a dire la seconda parte della valutazione diagnostica prevista nello studio. La popolazione ILSA ha un’età compresa tra i 65 e gli 84. Lo studio ILSA presenta, inoltre, un’elevata percentuale di persone per le quali non è stata specificata la tipologia di demenza. Infatti, mentre la prevalenza per tutte le demenze è abbastanza in linea con quella osservata in Europa (circa il 6%), quella di Alzheimer è circa la metà (2,5% vs 4,4%). Per quanto riguarda l’incidenza della DA, l’unico studio disponibile in Italia è stato effettuato sulla popolazione identificata nello studio ILSA (Di Carlo et al., 2002). Per stimare l’incidenza, è stata rivalutata nel 1995 la coorte di 3.208 persone sane al 1992-93. Sono stati così identificati 67 casi incidenti di Demenza di Alzheimer, secondo i criteri clinici fissati dal NINCDS-ADRDA, pari a un tasso grezzo di 7,0 casi per 1.000 anni-persona (IC 95% 5,3-8,7). La stima è più elevata nelle donne (9,3; IC 95% 6,5-12,2) che negli uomini (5,0; IC 95% 3,0-6,9).
I fattori di rischio della demenza sono oggetto di studio accurato da diversi anni, e secondo lo stato dell’arte l’età rappresenta il fattore di rischio più importante, come già si nota dagli studi di prevalenza ed incidenza sopra riportati (Trabucchi,2000).
Altri fattori rilevanti includono la storia familiare: il rischio di sviluppo Malattia di Alzheimer aumenta da 3 a 4 volte nei soggetti con un familiare di primo grado affetto da tale patologia. Questo fatto può essere spiegato sia dalla comune esposizione a fattori genetici che a fattori di rischio ambientali che con questi possono interagire. Per quanto riguarda i fattori genetici (primi fra tutti, la ben nota associazione tra la presenza del genotipo E4 sul cromosoma 19 dell’Apolipoproteina E (Apo E) e lo sviluppo di Malattia di Alzheimer.
Un altro fattore di rischio importante riguarda la presenza di sindrome di Down tra i familiari, fatto anche questo connesso ad alterazioni genetiche.
Altri possibili fattori di rischio riguardano l’associazione tra trauma cranico e sviluppo di demenza, probabilmente a causa dell’accelerazione nella produzione di beta-amiloide.
Allo stesso modo potrebbe agire l’associazione tra sviluppo di Malattia di Alzheimer e infarto del miocardio. Certo è che i fattori di rischio per ictus cerebri sono anche i più direttamente associati alla demenza vascolare.
14
Anche l’esposizione ambientale od occupazionale a particolari sostanze, come l’alluminio, agisce da probabile fattore di rischio per lo sviluppo di un quadro demenziale (Trabucchi, 2000). Non si può non citare, inoltre, l’associazione tra demenza e disturbo depressivo, la cui reciproca interazione tarda ancora ad essere chiarita (Kramer 1992; Lobo et al. ,1995; Jorm et al. ,2000). Infine, il livello di istruzione, i farmaci anti-infiammatori e l’assunzione di estrogeni sono stati indicati come possibili fattori protettivi sullo sviluppo di demenza (Trabucchi,2000).
Fino agli anni Cinquanta il concetto di invecchiamento e quello di deterioramento erano fortemente vicini. La visione predominante considerava la terza età come un fenomeno naturalmente regressivo culminante nel decesso dell’individuo. Vennero poi progressivamente raccolte informazioni che misero in evidenza come diverse fasce di età correlavano con diverse modificazioni cognitive e che non tutte le abilità considerate si comportavano allo stesso modo (Chattat,2007).
Il processo di invecchiamento risulta quindi come un processo di cambiamento che comprende tutto l’individuo, sistema nervoso centrale e processi cognitivi compresi. Questo cambiamento include anche processi di riduzione e perdita, non necessariamente risultanti in un quadro demenziale.
Le importanti acquisizioni sulla capacità di plasticità del Sistema Nervoso adulto possono consentire all’anziano di mantenere la propria capacità di adattamento strutturale e funzionale.
L’approccio clinico al paziente con sospetto deterioramento cognitivo segue diversi passi: bisogna innanzi tutto valutare se è presente una forma dementigena e successivamente accertarne l’eziologia.
La prima parte della valutazione si basa fondamentalmente su una diagnosi clinica, vale a dire fortemente influenzata dalla raccolta dei dati anamnestici e dall’esame obbiettivo. In questa fase viene valutata la storia clinica del soggetto, il suo stato mentale, quello medico e neurologico, quello funzionale ed infine quello psichiatrico. Pochi esami strumentali sono considerati indispensabili (Corey-Bloom et al., 1995). Spesso, il percorso diagnostico inizia a causa dei familiari del paziente, che si rendono conto di alterazioni del rendimento cognitivo o del comportamento del paziente che differiscono rispetto a quanto era in precedenza (Trabucchi, 2000). Per poter accertare la presenza di un effettivo cambiamento rispetto al precedente funzionamento cognitivo, si dovrebbero utilizzare valutazioni dello stato mentale precedenti, raramente disponibili. Quindi, questa valutazione si basa spesso e in gran parte sulla raccolta della storia clinica. Come specifica Karlinsy (1986), la presenza di un effettivo cambiamento rispetto al precedente funzionamento cognitivo non richiede che il paziente abbia raggiunto un
15
normale sviluppo intellettivo, ma che sia presente un declino rispetto a quanto si era giunto: la demenza infatti, spesso complica i quadri di Ritardo Mentale, come nel caso della Sindrome di Down.
Come abbiamo visto, per porre diagnosi di demenza, inoltre, secondo i criteri diagnostici attualmente in uso (DSM IV) (APA, 1994), è necessaria la primaria presenza di un disturbo mnesico. Questo primo punto risulta già in sé problematico, in quanto non tutte le forme di demenza esordiscono con un puro interessamento mnesico. È questo il caso della Demenza Fronto-Temporale (esordio frontale) e delle forme di deficit cognitivo isolato come nell’Afasia Primaria Progressiva (Bianchetti et al., 19996).
Tuttavia, tutte queste forme finiscono comunque per progredire ed ottenere un interessamento di vari settori cognitivi, rendendo possibile la diagnosi di demenza, che richiede, oltre al deficit mnesico, uno o più deficit cognitivi (DSM IV) (APA, 1994).
Per quanto riguarda l’accertamento dell’efficienza dell’autonomia del paziente nelle attività della vita quotidiana, è bene ricordare l’influenza esercitata in tal senso dal livello di attività premorboso, che differisce da soggetto a soggetto, così come risultano importanti da valutare le eventuali condizioni mediche e psichiatriche, che possono rendere più complicata la valutazione dalla perdita dell’autonomia del paziente dovuta solamente ai deficit neurocognitivi (Trabucchi, 2000).
Figura 4; Criteri diagnostici della demenza per il DSM IV
Una volta posta la diagnosi di demenza, è necessario accertarne l’eziologia. Spesso purtroppo, questa rimane una diagnosi di probabilità (Geldmacher et al., 1997). Le conclusioni circa la natura e la sede del danno non sono infatti competenza dello psicologo clinico e del neuropsicologo, poiché richiedono l’integrazione di diversi tipi di informazioni, delle quali quelle provenienti dall’esame neuropsicologico costituiscono solo una parte. E’ quindi solo
16
possibile indicare la compatibilità dei disturbi osservati con una patologia o un danno noto o probabile (Bianchi, 2008).
Per affrontare questa fase, sono necessari gli esiti degli esami di laboratorio e i dati provenienti dai dati di imaging. Inoltre, possono essere affiancati i risultati dei test neuropsicologici di approfondimento, del neuro-imaging funzionale, dell’EEG etc. (Corey-Bloom et al., 1995).
La valutazione del paziente demente inizia con la raccolta delle informazioni anamnestiche. L'anamnesi (“ana-mnesi”: riportare alla mente fatti e conoscenze) consiste nella raccolta di tutte le informazioni mediche e psicologiche, recenti e passate, del paziente, cioè la raccolta della sua storia clinica. Tutte queste informazioni infatti possono essere possibili co-fattori o variabili d'influenza del disturbo neuropsicologico attuale.
L'anamnesi è così strutturata:
- Anamnesi personale - Anamnesi sociale - Anamnesi fisiologica
- Anamnesi patologica recente e remota - Anamnesi familiare e gentilizio
Devono essere raccolti gli esiti dei vari esami medici eseguiti, l’esito degli esami di neuro-immagine, la presenza di malattie internistiche, endocrine o cardiovascolare e di deficit sensoriali.
Devono inoltre essere raccolti tutti i dati personali e anagrafici del paziente, e valutare la presenza di una storia familiare positiva per la presenza di demenza, disturbi psichiatrici o vascolari. Deve essere valutata la presenza di disturbi alla nascita o nei primi anni di vita, come i Disturbi dell’Apprendimento.
Molto importante per definire l’eziologia delle demenze è stabilire il tipo di esordio dei sintomi (graduale ed insidioso, a gradini o acuto), la successione temporale di questi, come si sono evoluti nel tempo, se sono accompagnati da sintomi extra-cognitivi come depressione o alterazioni del comportamento.
Una volta fatto questo, il clinico dovrebbe essere in grado di formulare un’ipotesi preliminare che verrà confutata o confermata dai successivi risultati dell’esame neuropsicologico (Bianchi, 2008).
A questo punto infatti, possono essere somministrati dei test tarati, che permettono di classificare la prestazione del paziente tramite una scala numerica o un sistema di categorie (Cronbach,
17
1970). Viene cioè quantificata la prestazione del soggetto rispetto al test, riuscendo a stabilire come si colloca il soggetto rispetto a dei valori normativi che permettono di stabilire se la prestazione risulta sopra o sotto la norma. E’ inoltre possibile, attraverso la valutazione della prestazione del paziente attraverso indici numerici, porre a confronto gruppi di pazienti o la prestazione dello stesso soggetto nel tempo.
Ogni test psicometrico che il clinico decide di utilizzare viene scelto tenendo in considerazione cosa questo intende misurare, il costrutto alla base del test, la sua affidabilità e la sua validità. Inoltre, in neuropsicologia clinica, i test si suddividono in test di screening e test di approfondimento. Attraverso i primi, è possibile valutare la presenza di un decadimento cognitivo generalizzato, mentre con i secondi, utili soprattutto nelle forme dubbie o atipiche, vengono definite le aree maggiormente compromesse e i punti di forza e di debolezza del soggetto. Questo risulta particolarmente utile nella diagnosi differenziale tra le varie forme di demenza e nell’impostazione riabilitativa di tipo restitutivo e compensatorio (Cronin-Golomb, 1993). Inoltre, nel caso delle demenze, si procede con la stadiazione clinica della stessa, vale a dire il grado di compromissione del soggetto.
I test vengono dunque somministrati e corretti per età e scolarità, in modo da completarne lo
scoring. A questo punto, è possibile interpretare il risultato dei test. Per svolgere correttamente
questo passo è necessario conoscere i processi cognitivi messi in atto durante l’esecuzione del test, mettere in relazione i vari punteggi tra loro ed integrarli con i dati provenienti dall’osservazione clinica (Bianchi, 2008). La parte finale della valutazione neuropsicologica del paziente demente consiste nella formulazione della diagnosi neuropsicologica, vale a dire la descrizione dello stato cognitivo del paziente: nello specifico, la presenza o meno di deterioramento demenziale.
Il processo diagnostico e valutativo non costituiscono la fine del rapporto tra clinico e paziente demente, in quanto una volta stabilita la diagnosi di demenza, è necessario sottoporre il paziente a periodici controlli. Nel caso la diagnosi sia dubbia, è bene rivedere il paziente entro breve tempo, mentre in caso contrario, solitamente viene e programmato un follow-up entro i 6 mesi successivi. Il follow-up del paziente permette di seguire l’evoluzione dei sintomi nel tempo, in modo da impostare e rivedere volta per volta la terapia più adeguata per il soggetto. Devono essere ottimizzate le funzioni cognitive e lo stato funzionale del paziente, controllate le alterazioni comportamentali che si presentano al progredire del disturbo, le patologie concorrenti e le complicanze. Deve essere inoltre fornito un adeguato livello di cure, che comprende trattamenti sia farmacologici che non. Infine, particolare attenzione deve essere data al fornire un adeguato supporto alla famiglia del paziente e al suo caregiver, attraverso materiale informativo, supporto socio-assistenziale e consulenze di tipo psicologico.
18
Prima che qualsiasi tipologia di demenza si istauri, passano diversi anni. Questa lunga fase preclinica ci offre un’opportunità unica per intervenire terapeuticamente. Quello che è necessario capire, è come l’emergere dei sintomi si leghi alla eziopatologia dementigena. Attualmente, il “National Istitute on Aging and the Alzheimer’s Association” ha formato un gruppo di lavoro internazionale per riassumere tutti i dati provenienti da studi epidemiologici, neuropsicologici e sui biomarker in modo da riuscire ad individuare i fattori predittivi migliori per il rischio di progressione da un livello cognitivo indenne a quello della demenza. Il concetto di stadio preclinico della demenza ha importanti conseguenze per l’efficacia del trattamento: l’intento è quello di creare terapie capaci di ritardare, ridurre il rischio o prevenire in toto lo sviluppo della demenza. Attualmente, uno dei settori maggiori di studio è quello del “Mild Cognitive Impairment”, la frontiera o stato di transizione tra l'invecchiamento normale e la demenza.
19 1.2 LA DEFINIZIONE DI MILD COGNITIVE IMPAIRMENT
Se la diagnosi di demenza necessita come abbiamo visto di precisi criteri che definiscono il livello di gravità necessario a porre diagnosi, e se la demenza è considerata una malattia degenerativa, è possibile allora postulare l’esistenza di una fase pre-clinica nella quale il danno biologico non si esprime palesemente a livello clinico.
Questa condizione è oggetto di studio da diversi anni ed è stata denominata in molteplici modo nel corso del tempo: “Normal Senility” (Bleuler, 1924), “Normal Senescent Decline” (Dörken & Kral,1951), “Mild Senescent Memory Decline” (Kral, 1958). Tutti questi termini fanno intuire come il paradigma teorico a monte di tali denominazioni fosse una considerazione del deterioramento demenziale come normale conseguenza dell’invecchiamento.
“Benign Senescent Forgetfulness”, (Kral, 1962) è il primo termine che ha tentato di porre una distinzione tra l’invecchiamento normale e patologico. Kral & Wigdor (1961) hanno studiato a lungo la popolazione anziana, nei suoi aspetti di personalità, capacità di giudizio, memoria, sintomatologia psichiatrica. In accordo con quanto riportato da Heinik (Heinik et al., 2006; 2010), essi individuarono un sottogruppo della popolazione con caratteristiche che ritroveremo nella definizione di MCI (Petersen et al. ,1995; Petersen, 2004), vale a dire soggetti con:
- Autonomia funzionale ben preservata - Normale livello di intelligenza
- Rendimento deficitario ai test di memoria
- Rendimento deficitario ai test percettivi ed organizzativi - Nessun segno franco di sindrome amnestica
Nel 1980, la American Psychiatric Association (APA) propone una revisione importante del concetto di deterioramento senile, sostituendola alla vecchia dizione di psicosi senile (Roth, 1955). Sebbene l’Autore avesse classificato le psicosi senili dividendole in due radici eziologiche, la prima psichiatrica e la seconda neurologica, entrambe comprendevano un declino cognitivo e personologico tale da richiedere l’ospedalizzazione del paziente. La nuova classe diagnostica del 1980, “Demenza Degenerativa Primaria”, focalizza l’attenzione sul declino delle funzioni cognitive e sulla compromissione delle attività sociali dell’anziano.
Nel 1982, Reisberg et al., pubblica la “Global Deterioration Scale” (GDS), appositamente costruita per la valutazione della Demenza Degenerativa Primaria. Questa scala infatti è stata costruita in modo da identificarne le principali fasi cliniche:
20
- Una prima fase caratterizzata da deficit mnestici soggettivamente ed oggettivamente riportati
- Una fase intermedia dove i deficit del soggetto diventano evidenti anche ad un osservatore esterno
- Una fase terminale in cui il paziente non è più autosufficiente
Quattro anni prima, l’Organizzazione Mondiale della Sanità, nella sua nona revisione della “Classificazione Mondiale delle Malattie” (WHO, 1978) aveva formulato la categoria diagnostica di “declino cognitivo lieve che non raggiunge la condizione di demenza”. In questa classificazione, la demenza senile era rintracciabile, nel testo, sotto la dizione “Stati Psicotici Organici”: alterazione delle funzioni cognitive, sociali, emozionali e personologiche caratterizzano il quadro della demenza nella senescenza.
In quegli anni, si andava definendo l’idea di uno stato cognitivo intermedio tra la franca demenza e lo stato di normalità cognitiva. Nel 1982, Gurland aveva proposto una classificazione della demenza basata sull’utilizzo di due strumenti di misurazione: la “Coprensive Assesment and
Referral Evalutation” (Gurland et al., 1977) e la “Geriatric Mental State Examination”
(Copeland et al., 1976).
Attraverso questi strumenti, era possibile graduare la severità della demenza. Con “Limited
Dementia” (Gurland et al., 1982) veniva incluso un quadro di:
- Impairment mnesico soggettivamente riportato - Necessità di ausili mnesici esterni
- Vuoti di memoria importanti presenti meno di una volta al mese - Presenza di pochi errori nei test cognitivi
Sempre nel 1982, viene pubblicata la prima versione della CDR (“Clinical DemenzaRating
Scale”) (Hughes et al., 1982). In maniera analoga, con un punteggio di 0.5 veniva identificata la
“Questionable Dementia”, caratterizzata dalle seguenti:
- Impairment mnesico di media entità - Pieno orientamento
- Lieve o dubbio deficit nelle funzionalità quotidiane - Interessi quotidiani e hobby mantenuti
21
La definizione di uno stato di decadimento cognitivo lieve attraverso la valutazione quantitativa di una scala di misura per la demenza è stata seguita anche da Reisberg e Flicker (Flicker & Reisberg et al., 1982). Essi sono stati i primi ad utilizzare il termine “Mild Cognitive Impairment” (MCI) per descrivere individui che ottenevano un punteggio di 3 alla “Global
Deterioration Scale” (GDS).
Per porre diagnosi di MCI, era necessario osservare almeno 2 dei seguenti sintomi:
- Disorientamento spaziale - Difficoltà sul posto di lavoro - Anomie
- Difficoltà nell’apprendimento di nuovi nomi - Perdita di oggetti di valore
- Oggettive difficoltà di concentrazione
L’importanza dell’approccio di questi autori sta nell’aver creato una vera e propria batteria capace di eseguire un esame del paziente MCI e valutarne la diagnosi.
Questa includeva: test per la memoria immediata e differita uditivo-verbale e spaziale, test per il linguaggio, la formazioni di concetti, le funzioni visuo-percettive, la velocità psico-motoria. In molti di questi test, i pazienti MCI risultavano maggiormente compromessi rispetto ai controlli. Un altro termine molto vicino a quello di MCI è “Age-Associated Memory Impairment” (Crook, Bartus, et al., 1986). Secondo i criteri diagnostici presentati dagli autori, la diagnosi si pone in presenza di un quadro di disturbo di memoria lieve nell’anziano, obbiettivabile dai test di memoria standardizzati e dal soggetto stesso, il quale riesce comunque a mantenere la propria autonomia nella vita quotidiana e risulta privo di altri sintomi neuropsicologici, di deficit intellettivi o sindromi demenziali che possano causare tali disturbi.
Roth, nel 1986, all’interno del “Cambridge Mental Disorders in Elderly Examination” (CANDEX), una intervista psichiatrica usata per studi di prevalenza ed incidenza della demenza, graduò la demenza attraverso quattro fasi (minima, lieve, moderata, severa). Il termine “Demenza Minima” denota un quadro di lieve danneggiamento mnesico e dell’orientamento, accompagnato da screzi nel problem solving e nella funzionalità quotidiana.
Il “Hughes Hall Study of the Elderly” sostenuto a Cambridge attraverso il CANDEX, identificò 44 soggetti con Minima Demenza. Dopo un anno, 29 di loro presentavano un oggettivo declino cognitivo, (O'Connor et al., 1990). Dopo 2 anni, 12 di loro incontravano i criteri per la demenza (O'Connor et al., 1991; Cooper et al., 1996).
22
Nel 1987, l’American Psychology Association pubblica il DSM IIIR, al cui interno è rintracciabili i criteri diagnostici per il Mild Cognitive Impairment.
Secondo il criterio A, per porre diagnosi è necessario un deficit di memoria (a breve e a lungo termine). Devono inoltre essere presenti almeno un deficit a livello di pensiero astratto, capacità di giudizio, funzioni corticali superiori come aprassia, agnosia, o afasia, e cambiamenti della personalità (criterio B). I criteri A e B devono interferire con le attività della vita quotidiane (Criterio C) e non presentarsi unicamente nel corso di un delirio (Criterio D). Infine, il criterio E richiede l’evidenza di specifici fattori organici ed esclude disordini mentali non organici. Se venivano soddisfatti i criteri A e non il B, si pone diagnosi di MCI di I tipo. Invece, se venivano soddisfatti i criteri A e B, ma non il C, si pone diagnosi di MCI di II tipo.
Più recentemente, Levy (1994) ha proposto la definizione di “Age Associated Cognitive
Decline”, incluso nel DSM IV (APA, 1994) per indicare un “declino nelle funzioni cognitive
identificato in modo obbiettivo conseguente al processo di invecchiamento, non attribuibile a malattia mentale o neurologica”. La diagnosi viene posta senza criteri di esclusione per età, in modo da estendere il campo al declino cognitivo presente in tutte le ultime decadi della età adulta. Questo declino deve essere confermato da un soggetto diverso dal paziente, deve avere un esordio graduale ed essere presente da più di 6 mesi. Inoltre, il deficit deve essere obbiettivato attraverso deficit nei test neuropsicologici che lo pongono ad almeno 1 DS sotto la media per età e scolarità, escludendo quindi la diagnosi di demenza.
Nel 1997, il “Canadian Study of Health and Aging” utilizzò il termine “Cognitive Impairment no
Dementia”
(CIND), per indicare uno stato intermedio di funzionamento cognitivo, non sufficientemente grave per porre diagnosi di demenza (Teng and Chui, 1978).
La prevalenza del disturbo è stata stimata come pari al 16,8% (Elby et al., 1995) e il deficit maggiormente evidente riguarderebbe il dominio cognitivo della memoria (Graham et al., 1997) e la performance ai test di screening come il “Mini Mental State Examination” (Folstein et al., 1975).
Attualmente, la diagnosi di “Cognitive Impairment no-Dementia” viene utilizzata nella pratica clinica per categorizzare tutti quei deficit cognitivi lievi che si interpongono tra la normale senescenza e il deterioramento cognitivo. In sintesi, la categoria d MCI che esamineremo più avanti risulterebbe essere come una tipologia di CIND ad impegno uni- o multi-dominio (Cammisuli, 2009).
Con questo percorso storico, si è esaminata come la definizione di uno stato cognitivo dove il deterioramento demenziale non appare conclamato, ma dove il soggetto interessato non risulta
23
avere una performance eguagliabile a quella di un soggetto a lui pari per età e scolarità si sia evoluta nel tempo.
Non sarà difficile notare come l’eterogeneità nella definizione di questa classe diagnostica sia estremamente ampia. Questo ovviamente rappresenta un problema nell’assicurare una chiara comunicazione tra specialisti, clinici e ricercatori interessati all’argomento.
Il costrutto di MCI ha permesso di fare chiarezza nella eterogeneità della terminologia presente intorno alla caratterizzazione del deficit cognitivo nell’anziano.
Il “Mild Cognitive Impairment” viene descritto nel “International Classification of Diseases 9th
Revision Clinical Modification” (ICD-9-CM) (WHO, 1978) come un disturbo caratterizzato da
deficit di memoria lamentati dal paziente e oggettivamente obbiettivati, in presenza di preservata capacità nelle attività di vita quotidiane e nelle altre funzioni cognitive, ovviamente esclusa la memoria. La diagnosi si pone in esclusione di eventi quali traumi, malnutrizione, denutrizione, infarto.
Inoltre, ne “International Classification of Diseases 9th Revision Clinical Modification” (ICD-9-CM) (WHO, 2002) sono presenti le categorie di “Mild Memory Disturbance” (disturbo specifico non psicotico, dovuto a danno organico ) e “Memory Loss” ( perdita di memoria di tipo sia anterogrado che retrogrado, dovuto a cause psicogene o organiche, e perdita di memoria a breve termine dovuta a fattori sempre sia organici che psicologici).
Per L’Organizzazione Mondiale della Sanità, (10th Revision of the International Classification
of Mental and Behavioural Disorders, 1990) si può porre diagnosi di Mild Cognitive
Impairment se è presente un deficit di memoria e delle funzioni intellettive (criterio A) senza che queste compromettano, come nella demenza, il funzionamento della vita quotidiana come è previsto per la demenza. Inoltre, deve essere assente turbe di coscienza (Criterio A) e deterioramento del controllo emozionale, del comportamento sociale o della motivazione (criterio B). Per soddisfare il Criterio E, le disfunzioni elencate nel criterio A devono essere presenti da almeno 6 mesi. Inoltre, vengono specificati 3 tipi di Mild Cognitive Impairment, il primo con solo deficit mnesici, il secondo a multiplo dominio, e il terzo tipo che soddisfa anche il criterio C.
Nel 2007, la definizione di “Mild Cognitive Disorder” viene ribadita dalla “World Health
Organization” in the “International Statistical Classification of Diseases and Related Health Problems 10th Revision Version for 2007”. Per citarla con le sue parole: «a disorder characterized by impairment of memory, learning difficulties and reduce ability to concentrate on a task for more than brief periods. There is often a marked feeling of mental fatigue when
24 mental tasks are attempted, and new learnig is found to be subjectively difficult even when objectively successful. None of these symptoms is so severe for a dementia or delirium diagnosis. The diagnosis of Mild Cognitive Disorder should be made only in association with a specified physical disorder. The cognitive disorder may precede, accompany, or follow a wide variety of infections and physical disorders, both cerebral and systemic, but direct evidence of cerebral involvement is not necessarily present. It can be differentiated from post-encephalitic syndrome and post-concussional syndrome by its different aetiology, its more restricted range of generally milder symptoms, and usually shorter duration».
Per concludere, nonostante la grossa mole di termini utilizzati per descrivere uno stato di impairment mnesico non dovuto all’età e non sufficientemente grave da porre diagnosi, la ricerca si è recentemente orientata verso l’utilizzo del termine “Mild Cognitive Impairment”.
25 1.3 EPIDEMIOLOGIA,TASSIE FATTORI DI RISCHIO PER LA CONVERSIONE IN DEMENZA
Nel 2008 un rilevante studio della Mayo Clinic (Rochester, MN) sull’invecchiamento (Mayo
Clinic Study of Aging) è stato progettato arruolando 3000 persone tra i 70 e gli 89 anni
selezionati per campionamento casuale e diagnosticati come MCI o cognitivamente normali. La prevalenza del MCI è riportata nel 15% del campione analizzato, con una percentuale doppia di aMCI rispetto ai naMCI (Roberts et al., 2008).
Figura 6; Studi di prevalenza sull’MCI (Cammisuli et al., 2009)
Molti studi sono stati fatti a questo proposito nel corso degli anni, e nonostante la variabilità dei criteri diagnostici, è possibile riscontrare un certo grado di accordo circa i dati sulla prevalenza del MCI, che si aggira sul 14-18%, per gli individui dai 70 anni in su (Busse et al., 2006; Ganguli et al., 2004; Unverzagt et al., 2001; Hänninen et al., 2002; Palmer et al., 2008; Das et al., 2007; Di Carlo et al., 2007; Fischer et al.,2007; Manly et al., 2008; Plassman et al., 2008; Roberts et al., 2008). Recentemente, lo studio maggiormente ampio che ha utilizzato i criteri estesi della Clinica Mayo riporta una prevalenza media dell’MCI intorno al 18,9%, percentuale quasi tripla rispetto a quella riportata dalle review basate sulla popolazione degli MCI di tipo amnesico (Petersen et al., 2014).
26 Figura 7; Studi di prevalenza sul’MCI (Petersen et al., 2013)
Come nel caso della demenza, anche il MCI riporta un incremento in termini di prevalenza all’aumentare dell’età dei soggetti e al diminuire del loro livello di scolarità. Tuttavia, differentemente dalla demenza, il tasso di incidenza per il MCI risulta più elevato nella popolazione maschile rispetto alla femminile (Roberts et al., 2008). Secondo i dati riportati da Petersen (2013) l’incidenza media usando i criteri espansi per l’MCI si aggira intorno al 47,9 (range 21,5-71,3) ogni 1000 persone all’anno, che è più del triplo del valore di 15,2 (range 8,5-25,9) ogni 1000 persone all’anno derivato dagli studi sulla popolazione di MCI di tipo amnesico.
La presa di coscienza di come questo stato sia fortemente predittivo di successivo sviluppo di deterioramento cognitivo ha causato una numerosa mole di studi intorno al concetto di uno stato di deterioramento posto come transizione tra il normale invecchiamento e la demenza (specialmente di tipo Alzheimer). Secondo la New York University, il tasso di conversione in demenza nel campione di soggetti studiati supera il 70% nel corso di soli due anni di follow-up (Flicker et al.,1991). Secondo Alzheimer’s Disease Patient Registry in Seattle, meno del 50% dei pazienti MCI studiati evolve a demenza nel corso dei 5 anni successivi (Bowen et al., 1997). Studi recenti riportano un tasso di progressione verso la demenza per i soggetti MCI pari ad un
range che varia dal 10% al 15% (Petersen et al., 1999; Gauthier et al., 2006). Un tasso così
27
aumentare o diminuire la variabilità, primo tra tutti sicuramente i criteri di selezione dei pazienti, le metodologie utilizzate per testarne le prestazioni, la lunghezza del follow-up. Busse e colleghi riportano, in uno studio con soggetti valutati con i criteri pubblicati da Petersen nel 2003, una percentuale che si aggira intorno al 7,2%-10,2% (Busse et al., 2006). Nonostante possano sembrare dati contrastanti e non univoci, è bene ricordare che tutti questi tassi di progressione superano quelli d’incidenza annua nella popolazione per quanto riguarda la Malattia di Alzheimer, che si aggira intorno all’1%-2%.
Se è vero che molti pazienti con Mild Cognitive Impairment progrediscono in Malattia di Alzheimer, alcuni autori si sono chiesti se questa fase di transizione non corrispondesse semplicemente ad uno stato in cui la malattia neuropatologicamente presente non si esprimesse a pieno (Morris et al,. 1992). Tuttavia, vari studi (Grundman et al., 1996; Petersen et al., 1995;Petersen et al., 1996) hanno fatto notare come non tutta la popolazione di MCI si traducesse in futuri pazienti dementi. Proprio per questo motivo, si rendeva necessaria una attenta caratterizzazione del disturbo, ed una pubblicazione univoca dei criteri diagnostici.
Nello studio di Summers (2012) il 12,3% dei soggetti valutati longitudinalmente nel corso di 20 mesi progrediva in demenza, il 62,9% rimaneva stabile e il 24,7% ritornava ad un livello cognitivamente indenne. Questo pattern evolutivo, secondo lo studio, poteva essere predetto dal livello di impairment in alcuni domini cognitivi quali la memoria episodica visiva, quella verbale, la memoria a breve termine, la working memory e il livello di processazione attentiva. Secondo i dati di Brodat (2013) similmente, il tasso di riconversione in cognitivamente indenne del 28,2%.
Altri dati sull’instabilità diagnostica dell’MCi derivano dallo studio di Timapno e collaboratori (2013). Gli autori hanno seguito longitudinalmente 196 pazienti diagnosticati come MCI alla baseline. Di questi, il 31% dei soggetti che sviluppano demenza nei 22 mesi successivi vengono classificati come MCI di tipo amnestico. Il dato interessante riguarda il 50% di questi soggetti aMCI che nel giro dei 22 mesi hanno disconfermato la diagnosi tramutandola in MCI di tipo amnestico a dominio multiplo. Di questi, il 12,5% convertirà successivamente in demenza nei 14 mesi successivi. Gli autori suggeriscono che l’evoluzione delle sottocategorie dell’MCI non seguano rigidamente la progressione indicata da Petersen (2009) e che le categorie di MCI amnestico a dominio singolo e multiplo non debbano essere considerate come entità discrete ma come stadi progressivi antecedenti alla franca progressione in demenza.
L’insieme di questi dati mostrano l’elevato grado di instabilità della diagnosi e la necessità di ulteriori approfondimenti.
28 Figura 8; Tassi di progressione verso la demenza dall’MCI (Petersen 2009)
Quello che pare essere fondamentale quindi, è lavorare sulla ricerca di biomarker utilizzabili per identificare i soggetti a rischio di sviluppare demenza.
Il lavoro che Petersen ha compiuto in questo senso nel corso degli anni rimane il punto di riferimento fondamentale quando si parla di MCI. Secondo l’autore, come si mostra in figura, non solo il MCI si mostra come uno stato di decadimento cognitivo utile ad identificare i soggetti che evolveranno in Malattia di Alzheimer, ma anche come uno stato di interposizione tra i normali cambiamenti cognitivi dell’invecchiamento e i primissimi screzi della demenza. Questi 3 stati condividono, come si nota dalla figura, dei momenti di sovrapposizione dovuti alla difficoltà nel distinguere i vari stati cognitivi. Attualmente (Petersen et al., 2013) è possibile sostenere come sia identificabile una fase di intervallo tra il funzionamento cognitivo normale e quello tipico della demenza e come oggi più che nel passato, l’individuazione di questo intervallo possa portare a fattori prognostici positivi. Inoltre, come già detto, non tutti gli individui che esibiscono questo deficit cognitivo evolveranno in demenza, ma molti di loro avranno sviluppato il disturbo su una base differente da quella neurodegenerativa, come la depressione, l’ansia, l’uso di sostanze. L’individuazione di queste diverse eziologie è oggi più facile, e sicuramente utile alla programmazione di adeguate linee di trattamento.
29 Figura 9; Ipotetico cambiamento nelle funzioni cognitive man mano che progredisce lo sviluppo dell’AD (Petersen, 2009)
Figura 10; Continuum cognitivo che mostra la sovrapposizione tra invecchiamento normale, MCI e AD (Petersen 2009)
Il lavoro alla clinica Mayo ha anche permesso di valutare una serie di misurazioni nel tentativo di individuare predittori di una più rapida progressione in demenza. Gli studi sull’apolipoproteina E4 si mostrano in questo senso come i più fecondi (Petersen et al., 1995) insieme a quelli riguardanti il volume ippocampale (Jack et al., 2003, Killiany et al., 2000). E’ noto da tempo che l’ApoE4 rappresenta un fattore di rischio per lo sviluppo della Malattia di Alzheimer (Corder et al., 1993). Diversi studi hanno inoltre mostrato come la presenza dell’Apolipoproteina ᵋ4 sia un fattore di rischio per lo sviluppo di MCI, come riportato in “Alzheimer’s Disease Cooperative Study/MCI Treatment Trial” e nel “Religious Order Study” (Aggarwal et al., 2005; Petersen et al., 2005). Tuttavia, una forte base genetica del MCI non è
30
supportata dagli studi di concordanza tra gemelli mono- e di-zigotici, che non mostrano differenza significative nel livello di concordanza (Caracciolo et al., 2012).
Per quanto riguarda gli studi circa l’associazione tra volume ippocampale nei pazienti MCI e sviluppo di demenza, i risultati appaiono similmente significativi (Jak et al., 2007; Farrer et al., 1997).
Oltre alla misurazione del volume ippocampale, altre indici utili riguardano il volume ventricolare, le misure della formazione entorinale e, in generale, l’intero volume cerebrale (Fox et al., 1999). Secondo gli studi longitudinali, il tasso anno di atrofia ippocampale, di quella corticale e dell’espansione ventricolare risultano essere buoni predittori in soggetti MCI dello sviluppo di Malattia di Alzheimer (Leung et al., 2013).
Ulteriormente alle misurazione provenienti dai dati di MRI strutturale, altri strumenti come la SPECT o la Tensor Diffusion Imaging possono distinguere tra pazienti MCI, pazienti con Malattia di Alzheimer e soggetti controllo, e possono essere affiancati ad altre procedure clinico-diagnostiche per valutare la progressione dei soggetti MCI in demenza (Kantarci et al., 2007). Un'altra modalità di imaging funzionale recentemente sfruttata negli studi sull’MCI è la 18 FDG PET (fludeoxyglucose F 18–positron emission tomography). Secondo gli studi, così come è possibile trovare un tipico ipometabolismo a livello delle regioni temporo-parietali e cingolate posteriori nei pazienti con Malattia di Alzheimer, lo stesso dato è riscontrabile nei pazienti MCI e risulta essere indice di progressione verso la demenza (Jagust et al., 2009, Herholz et al., 2010 ). Gli studi hanno indicato un incremento di beta amiloide nella corteccia frontale laterale, nella corteccia cingolata posteriore e nelle regioni parietali mediali e posteriori oltre al lobo temporale laterale (Koivunen et al., 2008). Sia i dati provenienti dalla MRI che dalla PET sono considerati da Jack (Jack et al., 2013) markers di degenerazione inseriti in un modello di evoluzione temporale. In particolare, la presenza di amiloide sarebbe in grado di evidenziare segni di anomalie prima dei marker tipici della neurodegenerazione e fino a 10-20 anni prima del presentarsi dei primi sintomi clinici.
Un ulteriore biomarker per la progressione in demenza risulta essere dato dallo studio del liquido cerebrospinale (CSF), vale a dire la concentrazione di sostanze quali la beta-amiloide peptide 1-42 (Aβ₁ ₄₂) o ancora la proteina tau o la tau fosforilata. I pazienti con MCI che presentano lo steso profilo dei pazienti con Malattia di Alzheimer, vale a dire una bassa concentrazione di Aβ₁ ₄₂ ed una elevata di proteina tau totale o fosforilata, od un alterato rapporto tra le due sostanze, hanno maggiori probabilità di progredire in Malattia di Alzheimer (Shaw et al., 2007; Hansson et al., 2006).
Alcune ricerche hanno puntato l’attenzione verso un presunto deficit colinergico centrale, presente soprattutto nell’aMCI, ed imputabile alla perdita di neuroni del nucleo basale di
31
Meynert (Mintzer et al., 200; Mufson et al., 2000). Altri studi hanno però mostrato una
up-regulation dell’attività dell’acetiltrasferasi nella corteccia frontale e nell’ippocampo (DeKosky et
al., 2002). Questo pattern potrebbe riflettere un meccanismo compensatorio dovuto al reclutamento di network attentivi e mnesici, come mostrano i dati di risonanza magnetica funzionale.
Recentemente, sono stati utilizzati i criteri del NIA-AA in una popolazione di soggetti cognitivamente indenni. Il 43% dei soggetti non raggiungeva i criteri per Prodromo di Malattia di Alzheimer, e ottenevano risultati negativi nell’individuazione dei marker; il 31% veniva classificato come in una fase preclinica e il 23% come sospetta patologia non-AD (Jack et al., 2012). La stessa popolazione, sottoposta a studio dalla Mayo Clinic Study on Aging, è stata classificata per il 14% come negativa ai biomarker, per il 14% positiva alla presenza di beta amiloide, per il 29% positiva alla presenza di danno neuronale e per il 43% positiva alla presenza di entrambi i biomarker. La progressione in demenza era predetta essenzialmente dalla presenza di danno neuronale o di entrambi i biomarker insieme (Petersen et al., 2013).
Molto importanti sarebbero inoltre i contributi delle malattie cerebrovascolari, che spesso si accavallano a quelle neurodegenerative (O’Brien et al., 2003). L’attenzione verso le lesioni della sostanza bianca e la presenza di piccoli infarti lacunari si sta incrementando, come vedremo parlando di vascular CIND.1 Attualmente, mentre negli studi cross-sectional si è dimostrata spesso una correlazione tra presenza di MCI in soggetti con disturbi vascolare come infarti o patologie cardiache, la maggior parte degli studi prospettici non ha confermato tale dato (Petersen et al., 2013).
Un pattern simile è stato trovato per la correlazione con il diabete (ibidem). Probabilmente, parte di tali discordanze può esser spiegata dal fatto che molti di questi soggetti hanno un rischio elevato di morte o di conversione in demenza, e non vengono individuati perciò come MCI nel follow-up.
Ancora, sono stati indicati come fattori di rischio la presenza di comorbidità psichiatriche, in particolare la depressione, mentre come fattori protettivi la presenza di un buon livello di attivazione cognitiva, fisica e sociale (ibidem).
Infine, alla luce di quanto esposto da Petersen et al. (2008), alcuni fattori clinici si sono mostrati utili nel predire la progressione a demenza, uno su tutti, la severità del disturbo mnestico. I pazienti con deficit più consistenti nel dominio cognitivo della memoria sembrano evolvere più velocemente in Malattia di Alzheimer. Lo studio di Amieva e coll. (2008) ha permesso di dimostrare come il declino nelle prestazioni di memoria semantica e formazione di concetti fosse
32
predittivo di demenza già 12 anni prima che questa diventasse conclamata; 3 anni prima seguiva un declino cognitivo più globale, soprattutto concentrato sulla presenza di problemi di memoria e sintomi depressivi, fino alla insufficiente autonomia nelle attività della vita quotidiana. Altri studi hanno replicato tali risultati (Kawasa et al., 2003; Elias et al., 2000). Altre ricerche hanno analizzato i risultati degli studi neuropsicologici e dei biomarkers assieme, asserendo che la performance ai test di memoria di richiamo differito e l’indice di controllo mentale si mostravano come i migliori predittori e che l’apolipoproteina E4 era un indicatore affidabile solo quando combinato a questa misurazione (Tierney et al., 1996).
Ancora, i pazienti a tipologia MCI multiple-domain sembrano essere maggiormente a rischio. Hunderfund e colleghi (2006) hanno sostenuto che questa tipologia di pazienti MCI presenta un rischio di mortalità più elevato degli altri. Risultati simili vengono riportati da Summer e coll. (2012) e Brodaty e coll. (2012). Inoltre, in accordo con i dati riportati da Petersen (2008) tra le sottocategorie del MCI, quella amnesica multiplo dominio con deficit della memoria episodica e dei domini frontali (pianificazione e sensibilità all’interferenza) è maggiormente a rischio di sviluppare demenza (Timpano Sportiello e Cammisuli, 2010; 2011; Cammisuli, 2013).
Questi dati aprono quindi una finestra di lavoro enorme circa le possibilità di intervento precoce: è stato calcolato che le terapie preventive possono ridurre di 5 anni l’insorgenza della Malattia di Alzheimer e che l’impatto della malattia può essere ridotto anche di un mezzo (Brookmeyer et al., 1998). Vi è largo consenso da parte della comunità scientifica nel ritenere che queste terapie possano essere maggiormente efficaci se somministrate tanto prima che la demenza diventi sintomatica (DeKosky et al., 2003).
33 1.4 LA DIAGNOSI DI MILD COGNITIVE IMPAIRMENT E L’ASSESTMENT NEUROPSICOLOGICO
I criteri inizialmente riportati da Petersen (1995) per quanto riguarda la diagnosi di MCI sono i seguenti:
- Lamentele circa le proprie performance mnestiche - Normale funzionamento quotidiano
- Anormale funzionamento mnestico rispetto all’età - Assenza di demenza
Con questi criteri è stato impostato uno studio che comprendeva un campione di 75 soggetti, seguiti longitudinalmente per 5 anni. Secondo lo studio, questi soggetti riportavano un declino nelle funzioni mnestiche di 1.5-2.0 DS rispetto agli individui di pari età e scolarità. Contrariamente, le misure di funzionamento globale come i risultati del “Mini Mental State
Examination” (Folstein et al., 1975), del “DemenzaRating Scale” (Mattis, 1988), o della
“Wechsler Adult Intelligence Scale Revised” (Wechsler, 1981) non differivano significativamente. Questo studio ha permesso di dimostrare dunque la validità dell’uso della categoria diagnostica del MCI per identificare soggetti ad alto rischio di declino cognitivo. Dopo di esso, nel 1999, Petersen e collaboratori hanno pubblicato la prima ricerca volta alla caratterizzazione clinica della categoria del MCI. Una volta che ne era stata accertata l’utilità sul piano clinico, era infatti necessario fornire criteri precisi e standardizzati per poter porre diagnosi. Lo studio comprendeva un campione di 76 soggetti MCI, 243 pazienti controlli e 106 soggetti con diagnosi di Malattia di Alzheimer. Secondo i risultati, i soggetti MCI mostravano una peggiore performance dei soggetti sani nei test di memoria, e questa performance risultava simile a quella dei pazienti con demenza lieve. Tuttavia, i pazienti con demenza lieve erano, contrariamente agli MCI maggiormente deficitari anche in altri domini cognitivi. A conclusione del lavoro, sono stati formulati i nuovi criteri per la diagnosi di MCI:
- Lamentele circa la propria prestazione mnestica, preferibilmente corroborate da un informatore attendibile
- Impairment mnestico documentato rispetto ai propri valori di riferimento - Prestazioni extra-mnestiche essenzialmente preservate
- Preservata capacità nella funzionalità quotidiana - Assenza di demenza