U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
A
A
'
'
D
D
E
E
G
G
L
L
I
I
S
S
T
T
U
U
D
D
I
I
D
D
I
I
P
P
I
I
S
S
A
A
D
IPARTIMENTO DIM
EDICINAC
LINICA ES
PERIMENTALETESI DI SPECIALIZZAZIONE
Rapporto tra cattiva qualità del sonno e
ipertensione arteriosa resistente
Candidata: Relatore:
IRENE DEL FRATE Chiar.mo Prof. STEFANO TADDEI
2 INDICE
RIASSUNTO pag. 3
INTRODUZIONE pag. 5
SCOPO DELLO TESI pag. 37
MATERIALI E METODI pag. 39
RISULTATI pag. 53
DISCUSSIONE pag. 63
CONCLUSIONI pag. 69
RINGRAZIAMENTI pag. 70
3
RIASSUNTO
L’insonnia e la breve durata del sonno sono state associate ad una maggiore incidenza e prevalenza di ipertensione arteriosa. Tuttavia, il rapporto tra la perdita di sonno e l'ipertensione resistente è ancora indeterminato.
In questo studio sono stati arruolati 270 pazienti consecutivi alla loro prima visita presso l’Ambulatorio del Centro Ipertensione dell’Ospedale Santa Chiara di Pisa.
L’ipertensione resistente è stata definita in presenza di valori di pressione arteriosa (PA) maggiore di 140/90 mmHg con 3 o più farmaci antipertensivi, o di PA controllata con 4 o più farmaci, compreso un diuretico.
La scarsa qualità del sonno è stata definita, utilizzando il Pittsburgh Sleep Quality Index, con uno score maggiore di 5; i sintomi depressivi con score maggiore di 10 del Beck Depression Inventory, e l'ansia di tratto con un Y2 maggiore di 40 del State / Trait Anxiety Inventory. Sono stati esclusi i pazienti che riferivano apnee notturne, russamento, o sindrome delle gambe senza riposo.
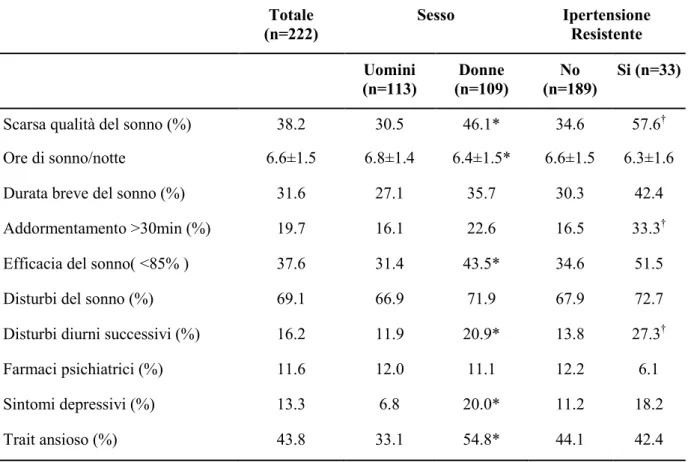
I dati completi erano disponibili per 222 pazienti (uomini 50,9%, età 56,6 ± 12,5 anni, ipertensione resistente 14,9%). In questa popolazione abbiamo riscontrato una prevalenza di scarsa qualità del sonno del 38,2%. I pazienti con ipertensione resistente presentavano una maggiore prevalenza di cattiva qualità del sonno, difficoltà all’addormentamento e ridotta efficienza del
4
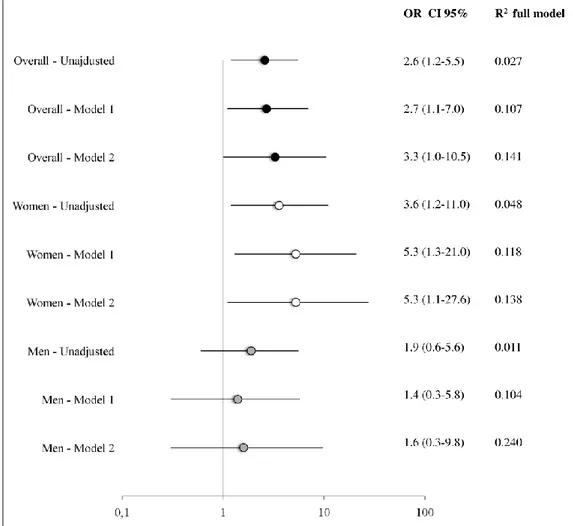
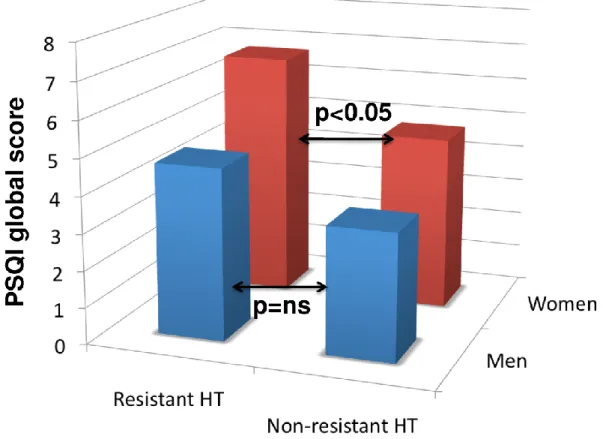
sonno, ma non di breve durata del sonno, sintomi depressivi o ansia. In particolare, la prevalenza della cattiva qualità del sonno è risultata aumentata nelle donne con ipertensione arteriosa resistente (40,2% vs 70,6%, p = 0.02), ma non negli uomini (29,2% vs 43,8%, p = 0,24). Nelle donne, la cattiva qualità del sonno era un predittore indipendente di ipertensione resistente, anche dopo aggiustamento per comorbidità cardiovascolari e psichiatriche (OR 5.3, CI 1,1-27,6). Al contrario negli uomini, l’età, il diabete e l’obesità erano le sole variabili associate con ipertensione resistente.
In conclusione, la cattiva qualità del sonno è significativamente associata con ipertensione resistente nelle donne, suggerendo un nuovo bersaglio terapeutico in questa popolazione.
5
INTRODUZIONE
L’ipertensione resistente
Definizione
Secondo le Linee Guida ESH/ESC e AHA (American Heart Association), l’ipertensione è definita resistente quando un piano terapeutico includente stile di vita adeguato e la prescrizione di almeno tre farmaci antiipertensivi (di cui almeno uno è un diuretico) in adeguate dosi, ed effettivamente assunti dal paziente, non permette l’abbassamento dei valori pressori sistolici e diastolici al di sotto della soglia prefissata per quel tipo di paziente [1]. Non possono pertanto essere considerati pazienti ipertesi resistenti coloro ai quali è stata diagnosticata un’ipertensione senza che questi abbiano modificato il loro stile di vita o abbiano ricevuto un trattamento adeguato, nonostante livelli pressori al di sopra di 140/90 mmHg. Il concetto di ipertensione resistente non va pertanto confuso con quello di ipertensione non controllata, che si verifica nel caso in cui i pazienti abbiano valori pressori maggiori di 140/90 mmHg [2].
Prevalenza
L’ipertensione resistente è un problema clinico comune. Occorre un’anamnesi accurata, con la quale il medico deve indagare circa la durata, la severità e la
6
progressione dell’ipertensione, in quali circostanze e in quali condizioni questa viene misurata (importante chiedere al paziente se la misurazione della PA è avvenuta in condizioni di benessere soggettivo), l’aderenza alla terapia, le reazioni avverse alle terapie attuate e tutti i trattamenti intrapresi dal paziente, tra i quali potrebbero esserci quelli che interferiscono con il controllo della pressione arteriosa, primi fra tutti, soprattutto per il loro largo uso, i farmaci antinfiammatori non steroidei (FANS) e i contraccettivi orali. Per ultima, ma non meno importante, tra i fattori che concorrono ad un mancato controllo pressorio, c’è la scarsa aderenza alla terapia [3]. Un’ulteriore causa di ipertensione resistente da non tralasciare è un trattamento farmacologico inadeguato, con dosaggio inadeguato, o una terapia combinata non razionale. Un trattamento inadeguato può derivare dalla scarsa compliance del paziente ma anche dall’inerzia terapeutica, cioè il mancato incremento della terapia da parte del medico in presenza di PA non controllata.
Secondo lo studio di Framingham, la prevalenza di una PA non controllata è maggiore nei soggetti anziani, negli obesi, e nei pazienti con IVS [4]. La presenza di tali fattori contribuisce ad una minore risposta alla terapia anche con più farmaci antiipertensivi [5,6]. Per quanto riguarda la prevalenza dell’ipertensione resistente, abbiamo pochi studi a riguardo. Secondo un recente studio compiuto in Spagna su 68045 pazienti, il 12% dei pazienti trattati soddisfa i criteri della definizione di ipertensione resistente [7], tale percentuale aumenta fino 19,4% se si considerano i pazienti che si rivolgono ai centri di
7
riferimento specialistici per l’ipertensione [8]. Lo stesso studio NHANES afferma che l’ipertensione resistente è frequente nei pazienti più anziani, negli obesi, nei neri non ispanici e nei diabetici, con albuminuria, funzione renale ridotta, scompenso cardiaco, pregressi eventi cardiovascolari [7]. Tale associazione si ritrova anche in uno studio retrospettivo compiuto su 21470 pazienti, dove mostra come l’ipertensione resistente sia più frequente in un’età più avanzata, nel sesso femminile, nel paziente obeso, diabetico e nefropatico [9].
Cause di pseudoipertensione resistente - Misurazione inadeguata
Prima di parlare di ipertensione resistente bisogna innanzitutto escludere molti fattori che producono falsi positivi. Uno dei più importanti, se non il più importante, è rappresentato dalla inadeguata misurazione della pressione arteriosa, caratterizzata da letture singole, posizioni errate, uso di bracciali troppo stretti o troppo larghi. Altri fattori sono l’aterosclerosi dei vasi arteriosi, che non possono essere pienamente compressi e determinano una sovrastima della pressione arteriosa, e l’ipertensione da camice bianco.
- Scarsa compliance alla terapia
La scarsa compliance ai farmaci è la causa principale della pseudoipertensione. La compliance diminuisce con l’aumentare del numero di compresse da assumere: con più di 2 compresse, c’è il 22% di diminuzione della compliance
8
a distanza di 6 anni [10]. In 10aa di follow-up meno del 40% dei pazienti continuano ad intraprendere in maniera adeguata il trattamento prescritto [11]. Una migliore compliance può essere data dalla prescrizione di farmaci di combinazione fissa con il minor numero di effetti collaterali, e occorre inoltre discutere col paziente riguardo alla rilevanza di tali effetti, prendere in considerazione la storia clinica del paziente e le patologie concomitanti [3,12] - Ipertensione clinica isolata
L’ipertensione clinica isolata deve essere sospettata in quei pazienti i cui valori pressori sono persistentemente più elevati rispetto a quelli rilevati a domicilio, con segni e sintomi di overtreatment, e nei pazienti senza segni di danno d’organo. Questi pazienti hanno minor rischio di danno d’organo e minor rischio di malattie cardiovascolari rispetto a quelli con ipertensione resistente vera [13]. La presenza di un’ipertensione clinica isolata deve essere evidenziata mediante il monitoraggio pressorio ambulatoriale, l’ABPM, in modo da distinguere tali pazienti ipertesi da coloro che presentino un’ipertensione resistente propriamente detta [14]. I pazienti con ipertensione resistente vera infatti hanno un aumento del rischio di eventi cardiovascolari di 3 volte rispetto ai pazienti con pseudoipertensione resistente [15]. In circa un terzo dei pazienti con ipertensione resistente diagnosticata con la sola misurazione clinica della PA, questa diagnosi non viene confermata dall’ABPM [14]. Pertanto per tutti i pazienti con ipertensione resistente è indicato il monitoraggio pressorio nelle 24 ore. Nei pazienti con ipertensione resistente, il riscontro di PA delle 24 ore
9
aumentata è un predittore migliore di morbidità e mortalità cardiovascolare di quanto non lo sia il riscontro di PA aumentata misurata in studio medico [16]. In uno studio compiuto in Spagna su 8295 pazienti in trattamento a cui era stata fatta diagnosi di ipertensione resistente sulla base dei valori pressori misurati in ambiente ambulatoriale, quelli con ipertensione resistente vera confermata con l’ABPM erano il 62,5%; in tale gruppo c’era un’alta incidenza di danno d’organo, e in particolare di IVS, funzione renale ridotta e microalbuminuria [7].
Stile di vita e ipertensione resistente
- Obesità e sovrappeso
Il sovrappeso e l’obesità sono associati a un’ipertensione resistente più severa e questi possono rappresentare la sola causa presente di quest’ultima e la necessità di un maggior numero di farmaci [6,17]. I meccanismi implicati sono un aumento dell’attività del sistema nervoso autonomo, un aumentato riassorbimento di sodio, un’aumentata attivazione del SRAA [18] e una ridotta attivazione del sistema dei peptidi natriuretici (ANP e BNP). Tali sistemi antagonisti agiscono sul bilancio del sodio e del potassio, sul volume sanguigno, sulla pressione arteriosa, e sul rimodellamento cardiovascolare. L’alterazione del SRAA e l’aumento dell’apporto sodico, contribuiscono alla resistenza ai farmaci anche indipendentemente dall’BMI [19]. Il sistema nervoso simpatico (SNS) aumenta in modo diretto la secrezione di renina, e
10
come in un circolo vizioso, l’angiotensina II stimola a sua volta l’attività del SNS. L’aumentata attività del sistema nervoso autonomo, presente anche nei soggetti sovrappeso normotesi, va incontro a riduzione con la perdita di peso [20]. L’aumento dei livelli plasmatici di angiotensina nei soggetti in sovrappeso e obesi è legata anche al fatto che questa viene prodotta anche dal tessuto adiposo. Importante è soprattutto la circonferenza addominale: una sua riduzione, indipendentemente dalla riduzione dell’BMI, comporta una riduzione dei livelli di angiotensina e conseguentemente di PA [19]. La perdita di peso deve essere perciò incoraggiata, poiché, una perdita di 10 kg comporta la diminuzione di una media di 6 mmHg di PA sistolica e 4,6 mmHg di PA diastolica [21]. E’ importante l’esercizio fisico; meta-analisi in pazienti normotesi e ipertesi rilevano riduzioni pressorie medie di 4 mmHg di PA sistolica e di 3 mmHg di PA diastolica con esercizio fisico regolare [22]. Occorre incoraggiare quindi il paziente a svolgere un minimo di attività fisica di 30 minuti giornalieri [23].
- Consumo di alcol
Un consumo eccessivo di alcol, può essere causa di ipertensione resistente. Uno studio su adulti cinesi ha dimostrato che un consumo di 30 o più drinks a settimana determina un incremento del rischio di ipertensione [24]. Con la cessazione dell’assunzione di alcol la PA sistolica nelle 24 ore si è ridotta di 7,2 mmHg e la PA diastolica nelle 24 ore di 6,6 mmHg, con riduzione della
11
prevalenza dell’ipertensione dal 42% al 12% dopo un mese di completa astinenza [25].
I pazienti ipertesi devono pertanto limitare il loro consumo alcolico con non più di 20-30 gr/die negli uomini e 10-20 gr nelle donne [3,12].
-Assunzione di sale
Un’eccessiva assunzione di sodio contribuisce allo sviluppo dell’ipertensione resistente, anche mediante una diminuzione dell’effetto dei farmaci anti-ipertensivi [26], specialmente gli ACE inibitori. Questi effetti sono più pronunciati nei pazienti sodio-sensibili, come gli anziani, gli afroamericani e i pazienti con malattie croniche renali [27]. In un’analisi condotta su pazienti con ipertensione resistente, l’escrezione urinaria di sodio nelle 24 ore eccede di 10 gr al giorno [28]. Una dieta iposodica, con meno di 100 mEq /die, comporta in media una diminuzione da 5 a 10 mmHg di PA sistolica e 2 a 6 mmHg di PA diastolica [29].
Trattamento farmacologico che interferisce con il controllo della PA
Le cause farmaco-correlate di ipertensione vanno ricercate con una buona anamnesi farmacologica, poiché alcuni farmaci possono interferire con il buon controllo pressorio. Tra questi i più utilizzati sono i FANS, inclusi gli inibitori delle COX2, che sono in grado di determinare un aumento medio di PA di 5 mmHg e determinano inoltre un’inibizione della produzione di prostaglandine E2 e I2 con ritenzione idrosalina, soprattutto nei soggetti più anziani, diabetici e
12
con malattie croniche renali [30]. I FANS sono in grado di diminuire l’efficacia dell’azione dei farmaci antiipertensivi come gli ACE inibitori, i sartani, i β-bloccanti [31]. Altri farmaci utilizzati, soprattutto nei pazienti asmatici e reumatologici, che possono contribuire a un mancato controllo della PA, sono i glucocorticoidi, sia con effetto mineralcorticoide che senza attività mineralcorticoide [31]. In una buona anamnesi non può mancare la domanda sull’uso di contraccettivi orali nelle donne in età fertile [32], e la terapia ormonale sostitutiva nelle donne in post menopausa [33]; occorre inoltre escludere l’utilizzo di pillole dietetiche amfetaminosimili, farmaci antidepressivi antagonisti delle monoaminoossidasi, decongestionanti nasali, preparazioni contenenti efedrina [31] e infine di liquirizia, che sopprime il metabolismo del cortisolo, con aumento dello stimolo dei recettori per i mineralcorticoidi [34].
Fattori genetici
Tra i fattori genetici implicati, uno studio finlandese dimostra la presenza di mutazioni nel canale del sodio (ENaC), che può determinare una rara forma di ipertensione monogenica, la sindrome di Liddle. Rispetto ai controlli, nei pazienti con ipertensione resistente si ha una maggiore prevalenza delle varianti geniche del ENaC [35], gene che codifica per il trasportatore del sodio a livello dei dotti collettori, la cui funzione è stimolata dall’aldosterone; un’aumentata conduttanza di tale recettore porta ad una forma di pseudoiperaldosteronismo,
13
come avviene con l’assunzione di liquirizia, in quanto i livelli di aldosterone sono normali [36]. Tali varianti sono associate con un’aumentata escrezione del potassio urinario. Un altro gene coinvolto è quello che codifica per CYP3A5, che codifica per 11-β-idrossisteroidodeidrogenasi. L’allele CYP3A5*1 è stato associato nei pazienti afroamericani con l’ipertensione resistente [37]
Trattamento farmacologico dell’ipertensione resistente
Per quanto riguarda il trattamento farmacologico dell’ipertensione resistente, occorre ricordare che molte classi di farmaci sono caratterizzate da una curva dose-risposta, dove una maggiore dose corrisponde ad un maggiore incremento di pressione arteriosa. Questo è il caso dei diuretici, degli α e β-bloccanti, calcio antagonisti e alcuni sartani. In questi casi è necessario perciò un aumento di dose per raggiungere il maggior effetto antipertensivo voluto. Al contrario, gli ACE inibitori e i sartani non seguono tale curva, e con l’aumento della dose, non aumenta l’effetto, ma solo la durata d’azione. Nel trattamento con ACE inibitori occorrono perciò piene dosi, per evitare una durata d’azione troppo breve, e coprire così le 24 ore [38]. Molti studi dimostrano che si ha beneficio combinando due agenti di differenti classi in un modo razionale. Se questi hanno differenti e complementari meccanismi d’azione con effetto sinergico, i meccanismi complementari d’azione dei componenti minimizza i loro effetti collaterali individuali, con favorevole profilo di tolleranza [39]. L’evidenza supporta l’uso dei farmaci diuretici, di potenza sufficiente a controllare il
14
volume plasmatico, che quando aumentato potrebbe contribuire alla resistenza ai farmaci [40-43]. Nei pazienti con filtrato glomerulare < 30 ml/min occorre la somministrazione di diuretici dell’ansa [31]. L’idroclorotiazide, il più usato tra i farmaci tiazidici, è utilizzato nel 55% dei pazienti con ipertensione resistente e si trova in commercio in numerose associazioni fisse, ma non risulta efficace come il clortalidone [44]. Alcuni studi hanno mostrato l’efficacia degli antagonisti dell’aldosterone, come lo spironolattone o l’eplerenone, nei pazienti con ipertensione resistente [40,45,46].
Combinazioni efficaci sono rappresentate da diuretico tiazidico e ACE inibitori, diuretico tiazidico e sartani, ACE inibitori e calcio antagonisti, sartani e calcio-antagonisti, β-bloccanti e calcio antagonisti non diidropiridinici. Ci sono pochi dati sull’efficacia delle combinazioni di 3 o più farmaci, ma l’associazione ACE inibitori o sartani, calcio antagonisti e diuretici tiazidici è efficace e generalmente ben tollerata e questa tripla terapia può essere attuata, per una migliore compliance, con 2 compresse con l’uso di combinazioni a dose fissa [3,12]. Un ulteriore beneficio antiipertensivo è dato dagli α 1antagonisti. I farmaci ad azione centrale sono efficaci, ma hanno un’incidenza maggiore di effetti avversi [31]. Le combinazioni naturalmente devono essere intraprese prendendo in considerazione benefici, effetti avversi, malattie concomitanti, come diabete, malattie renali croniche e limitazioni economiche [3,12]. Altre combinazioni di farmaci non hanno invece un effetto ipotensivo additivo in quanto agiscono con meccanismo simile, queste sono rappresentate
15
dall’associazione di diuretici e calcio antagonisti (entrambi con effetto natriuretico), β-bloccanti e ACE inibitori e/o sartani (inibiscono il SRRA) [31]. E’ necessario inquadrare le cause dell’ipertensione resistente per una migliore prevenzione e un trattamento efficace. In un recente studio NHANES solo il 53% dei pazienti con ipertensione arteriosa in trattamento hanno una PA controllata [47]. Tale percentuale scendeva al 48% nello studio Framingham, e al 40% per i pazienti con più di 75 anni [4]. La percentuale scende ancora nel caso in cui i pazienti siano affetti da insufficienza renale cronica o diabete: il 37% dei primi raggiunge il target dei 130/80 mmHg di PA [48] e solo il 25% dei secondi quello dei 130/85 mmHg di PA [47]. Non è conosciuta la percentuale dell’aumento della sopravvivenza per i pazienti con ipertensione resistente in cui si riesce ad ottenere un controllo della PA. Studi pionieristici hanno dimostrato una riduzione del 96% degli eventi cardiovascolari in 18 mesi di terapia con tripla terapia rispetto a quelli trattati con placebo [49].
Ipertensione resistente e malattie cardiovascolari
L’ipertensione resistente può direttamente determinare un aumento del rischio cardiovascolare così come la malattia cardiovascolare può rendere più difficile il controllo pressorio. L’ipertensione resistente è infatti correlata a danno cardiaco e vascolare. Importanti sono lo studio con ECG e con ecocardiogramma. Pazienti con strain sono più frequentemente uomini, con indice di massa corporea più basso, danno d’organo, aumentata creatininemia,
16
microalbuminuria nelle 24 ore, e allungamento QT rispetto a quelli senza strain. In pazienti con ipertensione resistente, la presenza dello strain è associato ad un aumento dello spessore della parete [50].
Ipertensione resistente e nefropatia
Nei pazienti con patologie renali, la ritenzione salina è la più frequente causa di ipertensione resistente. Circa un quarto degli ipertesi presenta un qualche grado di danno renale da nefrosclerosi o da malattie renali intrinseche, e da questo deriva una ridotta capacità di escrezione di sodio. In condizioni fisiologiche, con la riduzione della pressione arteriosa, il rene risponde con l’incremento di ritenzione salina e l’espansione di volume intravascolare data dall’attivazione del SRRA. Normali livelli plasmatici di renina sono inappropriatamente elevati in relazione ai livelli di sodio intracorporei nei soggetti con malattia renale [36]. Si ha inoltre in questi pazienti un’aumentata attivazione del sistema nervoso autonomo; l’attivazione dei due sistemi contribuisce all’insorgenza dell’ipertensione resistente [51].
Tra i fattori iatrogeni coinvolti nei pazienti con malattie renali ci sono l’eritropoietina, che può determinare ipertensione e conferisce una particolare suscettibilità degli organi all’azione di quest’ultima. Altri farmaci che contribuiscono al ridotto controllo della PA sono la ciclosporina, tacrolimus, gli steroidi, gli ioni bivalenti, la vitamina D, gli agenti simpatico mimetici e i FANS [31].
17
Occorre ricordare che la maggior causa di insufficienza renale negli adulti è rappresentata dalla nefropatia diabetica [36]. Si riscontra in questo caso una glomerulosclerosi associata a microalbuminuria. In aggiunta all’iperglicemia, l’ipertensione e l’attivazione del SRAA, sono implicati nella nefropatia diabetica.
Cause di ipertensione arteriosa secondaria
Tra i pazienti con ipertensione resistente occorre sempre sospettare un’ipertensione secondaria [52]. Oltre all’anamnesi e all’esame obiettivo, le cause secondarie dell’ipertensione devono essere ricercate mediante indagini diagnostiche strumentali, che includono l’ecografia, la polisonnografia e i dosaggi di aldosterone e renina plasmatica come esami di primo livello, o la TC, il cateterismo venoso, e altri dosaggi ormonali e degli elettroliti come esami di secondo livello, nel caso in cui quelli di primo livello non siano stati dirimenti per la diagnosi [3]. E’ importante porre attenzione ad escludere la sindrome delle apnee ostruttive del sonno, che può riguardare fino al 60% dei pazienti con ipertensione resistente ed è spesso sottodiagnosticata [52]. Insieme all’iperaldosteronismo primario, rappresenta una delle maggiori cause si ipertensione secondaria nei pazienti con ipertensione resistente [52,53].
Infatti l’incidenza dell’iperaldosteronismo nei pazienti con ipertensione resistente può raggiungere il 20-23% [54,55].
18
Nuove strategie terapeutiche non farmacologiche dell’ipertensione resistente
- Baroreflex Activation Therapy (BAT)
Esistono strategie terapeutiche alternative alla terapia farmacologica, rappresentate dall’attivazione dei barocettori con miglioramento del controllo pressorio di 35/16 mmHg [56]. Il riflesso barocettivo, su cui vanno ad agire le nuove strategie terapeutiche, è fondamentale per proteggere gli organi dall’ipoperfusione, ed è in grado di modulare la frequenza e la gittata cardiaca. Il meccanismo non era chiaro fino al 1923, quando si scoprì che era legato alla distensione delle pareti della carotide. La distensione del seno carotideo attiva neuroni afferenti che arrivano al nucleo del tratto solitario con il nervo glossofaringeo. Il segnale efferente mediato dal nervo vago, porta alla riduzione della forza di contrazione del cuore con la riduzione della frequenza, delle resistenze periferiche , con modulazione del rilascio di renina e l’aumento della refrattarietà del ventricolo [57].
Esistono dispositivi in grado di stimolare direttamente i barocettori attraverso un sistema di elettrodi (BAT) con attivazione del riflesso barocettivo. Attraverso il BAT, mediante la stimolazione dei barocettori, si ha l’attivazione del parasimpatico, l’inibizione del simpatico, la modulazione del sistema neurormonale e della funzione cardiaca, renale, e delle resistenze periferiche con conseguente riduzione dei livelli pressori [58]. Il dispositivo viene impiantato nella regione pettorale come un pacemaker. C’è inoltre la possibilità di ricarica a livello sottocutaneo, programmabile con programmi simili a quelli
19
per pacemaker, con possibilità di variazioni nel corso della giornata , in base ai bisogni del paziente. Il BAT è ora approvato in Europa come opzione terapeutica per i pazienti con ipertensione resistente.
- Denervazione renale
Un’altra strategia terapeutica che rispetto alla precedente è caratterizzata da una minore invasività, è rappresentata dalla denervazione renale, con ablazione sotto guida fluoroscopica mediante radiofrequenze, dell’innervazione simpatica di entrambi i reni di pazienti affetti da ipertensione resistente. Inibendo tale attivazione simpatico mediata sul rene, si può così ottenere una riduzione della pressione arteriosa. Tale procedura si è mostrata efficace: i dati riferiti dal programma Symplicity HTN1, riferiscono che i pazienti dello studio hanno raggiunto una riduzione media di -32 mmHg di PA sistolica e -14 mmHg di PA diastolica mmHg a 24 mesi, rispetto al basale, dopo il trattamento [59].
L’ipertensione arteriosa ed i disturbi del sonno
Nel mondo la prevalenza di ipertensione arteriosa è aumentata negli ultimi dieci anni e si prevede che aumenterà ulteriormente di circa il 60% nel 2025 [60]. L'ipertensione rappresenta un onere economico significativo sul sistema sanitario [61,62], e continua ad essere la malattia cardiovascolare più diffusa nel mondo, contribuendo in modo sostanziale alla morbilità e mortalità cardiovascolare [60,62]. Contemporaneamente è destinata ad aumentare anche la prevalenza dell'insonnia [63-65], il disturbo del sonno più comune nella
20
popolazione generale [66,67]. L’insonnia cronica, un disturbo della qualità del sonno definito come la difficoltà ad iniziare o a mantenere il sonno, o ad avere un sonno ristoratore, ed accompagnato da conseguenze diurne per un periodo di almeno 4 settimane, è considerato una emergenza di salute pubblica [64,68], che colpisce il 10-15% della popolazione e che costa miliardi di dollari l'anno [64,68]. Inoltre, la durata media del sonno nella popolazione generale si è ridotta costantemente [64,69,70], a causa di esigenze di stile di vita moderno [64,70,71]. I dati dimostrano che nei paesi occidentali le persone dormono in media solo 6.8 ore al giorno (corrispondenti a 1.5 ore in meno rispetto ad un secolo fa) [72].
Molte evidenze sperimentali suggeriscono che la crescente prevalenza di ipertensione e dei disturbi del sonno potrebbero essere collegati. Infatti, sia la breve durata del sonno [73-81] che l'insonnia [73,79,80,82-86] sono stati associati ad un aumento dell'incidenza di ipertensione. E' stato proposto che i meccanismi fisiopatologici alla base dell’associazione tra la breve durata del sonno, l’insonnia e l’ipertensione potrebbero essere correlati all’inappropriata eccitazione fisiologica dovuta ad una alterazione delle funzioni del sistema di stress [71,87,88]. Il sonno ha importanti funzioni omeostatiche, compresi gli effetti soppressivi sul sistema dello stress [71,89], mentre le condizioni di perdita del sonno e l’insonnia sono legate alla attivazione del sistema nervoso simpatico e dei processi pro-infiammatori [71,89-92].
21
Secondo recenti ipotesi, le condizioni di perdita o diminuzione del sonno, così come il peggioramento della qualità del sonno tipicamente osservato nell’insonnia, indipendentemente dalla loro origine, possono costituire un fattore di stress neurobiologico e fisiologico [71,89-92]. Le alterazioni del sonno potrebbero compromettere l'adattamento allo stress attraverso l’allostasi e contribuire al carico allostatico, compromettendo così il recupero dallo stress e aumentando la pressione sanguigna (PA) [71,89-93].
Tuttavia, la relazione tra disturbi del sonno e ipertensione è complessa. Molti disturbi del sonno diversi dall’insonnia, come la sindrome delle apnee ostruttive e la sindrome delle gambe senza riposo sono stati correlati all'ipertensione, come già altrove dimostrato [77,94-96]. Inoltre, i fattori di rischio cardiovascolare ed altre condizioni, quali il genere, l'età, il peso corporeo, il consumo di alcol e la depressione, potrebbero contribuire sia all’insonnia che all’ipertensione, rendendo difficile svelare una relazione di causa-effetto tra queste due patologie, indipendentemente dai comuni fattori di rischio.
Perdita di sonno e ipertensione: evidenze sperimentali e cliniche
- Deprivazione del sonno sperimentale e pressione arteriosa
Diversi studi hanno provato che la deprivazione sperimentale del sonno porta a un aumento della PA, valutando la deprivazione del sonno della prima parte della notte [97], della seconda metà della notte [98], di tutta la notte
[93,99-22
102], per 36 ore [103] e per 40 ore [104] in individui sani normotesi; tutti questi studi hanno mostrato un aumento significativo della pressione arteriosa.
La deprivazione parziale del sonno può indurre un aumento della pressione arteriosa anche in soggetti pre-ipertesi o ipertesi [105] .
Lusardi et al. [97] ha valutato l'effetto della deprivazione parziale del sonno (prima parte della notte) sulla pressione arteriosa in adulti sani riscontrando un significativo aumento della pressione sistolica durante la mattina dopo il sonno di recupero.
La deprivazione selettiva del sonno ad onde lente in soggetti sani ha significativamente attenuato il fisiologico calo notturno della pressione arteriosa notturna [105].
Uno studio condotto da Robillard et al. [102] ha dimostrato che una notte di totale deprivazione del sonno induce un aumento significativo della pressione arteriosa negli anziani ma non nei soggetti giovani.
Meno frequente è lo studio della relazione che intercorre, in soggetti adulti sani, tra la deprivazione totale del sonno, le condizioni di stress e la pressione arteriosa. Pagani et al. [101] ha rilevato che, in assenza di stress significativo, una notte di totale deprivazione del sonno non porta a un aumento della pressione arteriosa. Recentemente uno studio, che ha combinato una notte di totale deprivazione del sonno con uno stress psicologico acuto, ha dimostrato che la deprivazione del sonno è in grado di amplificare l’aumento della PA sistolica legato allo stress psicologico [93].
23
Infine, è stato dimostrato che la PA, in soggetti con ipertensione arteriosa lieve/moderata, è significativamente aumentata le mattina successiva alla parziale deprivazione del sonno [106]. Secondo gli studi osservazionali, il dipping nottuno della pressione arteriosa potrebbe dipendere dalla profondità del sonno [107].
In sintesi, la perdita di sonno a causa di parziale e totale deprivazione sperimentale del sonno, potrebbe indurre incrementi sostenuti di PA sia in soggetti normotesi che nei pre-ipertesi e negli ipertesi; sia negli adulti anziani che nei giovani; sia nei maschi che nelle femmine. Inoltre, la deprivazione del sonno potrebbe amplificare gli aumenti della pressione arteriosa dovuta allo stress psicologico. Questi risultati suggeriscono che il debito di sonno potrebbe giocare un ruolo causale nell'ipertensione. Sono necessarie ulteriori ricerche per i soggetti anziani, e per indagare la relazione tra la deprivazione del sonno e lo stress.
- Durata del sonno e ipertensione
E’ stato ipotizzato che, in un terzo o più degli adulti sani, si verifichi una significativa riduzione del sonno [108]. Negli ultimi 30 anni, nella popolazione generale dei paesi occidentali, la durata del sonno è diminuita [69,70,108-110] e un numero sempre maggiore di soggetti ha una perdita di sonno regolare a causa dello stile di vita moderno e di una maggiore pressione lavorativa [71]. Nel corso dell'ultimo secolo, il tempo medio giornaliero trascorso dormendo è diminuito di 1,5-2 ore per notte [109]; inoltre la percentuale della popolazione
24
che dorme meno di 6 ore a notte durante la settimana è quasi raddoppiato negli ultimi dieci anni, aumentando dal 12% al 20% [70,110]. La ripetuta restrizione del sonno può avere molte ripercussioni, ancora in gran parte sconosciute, per la salute e il benessere. La risposta somatica alla restrizione del sonno potrebbe includere anche l'ipertensione [73,86,89,111].
Al momento sono stati pubblicati 15 studi clinici che hanno indagato il rapporto tra perdita di sonno e ipertensione arteriosa. In questi studi clinici, la dimensione del campione variava da 578 a 10308 soggetti; 8 studi sono stati condotti negli adulti, 4 negli anziani e 2 in una popolazione con ampia fascia di età. Il disegno dello studio era longitudinale in 6 studi e trasversale negli studi rimanenti, sebbene gli studi longitudinali spesso includevano anche una analisi trasversale dei dati di riferimento.
Gli studi trasversali condotti negli adulti hanno mostrato relazioni significative tra la durata del sonno e la pressione arteriosa nelle analisi statistiche corrette per i fattori confondenti [74-76,112]. Ad esempio, nello “Sleep Heart Health
Study” (SHHS), sia una durata breve del sonno (meno di 5 ore) che lunga (più
di 9 ore) sono state associate a una maggiore prevalenza di ipertensione rispetto al dormire 7-8 ore per notte [74]. Il rapporto tra durata del sonno e l’ipertensione persisteva anche dopo aggiustamenti per i fattori confondenti [74].
Tuttavia, esistono alcuni risultati contrastanti: 4 studi non hanno evidenziato alcuna relazione, considerando l’aggiustamento per fattori confondenti, tra la
25
breve durata del sonno e un’aumentata PA per soggetti di età inferiore ai 60 anni [77,113-115]. Tuttavia, due di questi studi definiscono la PA elevata secondo i criteri della sindrome metabolica invece della soglia classica utilizzata per la diagnosi di ipertensione [114,115]; un altro di questi studi considera la PA analizzata solo come una variabile continua [113]: pertanto non è possibile paragonarlo con gli altri studi.
Allo stesso modo, gli studi effettuati su coorti di anziani, o che analizzavano separatamente i gruppi di età e quindi fornivano dati per il gruppo di over 60, hanno quasi sempre mostrato risultati negativi [73,116-119]: ad esempio, nello studio Rotterdam, eseguito su 5058 partecipanti di età compresa tra 58-98 anni (dopo l’aggiustamento per età, sesso, indice di massa corporea, fumo, sintomi depressivi, uso di farmaci per il sonno, diabete mellito, infarto del miocardio e ictus) non si evidenziava alcuna associazione significativa tra la durata del sonno e l’ipertensione [116]. Questa mancanza di associazione negli anziani potrebbe essere correlata a vari motivi, tra cui il survival bias, i cambiamenti età-correlati nella qualità del sonno, il possibile sonno compensatorio durante il giorno, ed infine, ma non di minor importanza, la rigidità delle grandi arterie come uno dei possibili meccanismi di ipertensione arteriosa.
Altri fattori chiave che influenzano il rapporto tra durata del sonno e l'ipertensione sono il sesso e l'obesità. Nell’analisi trasversale dello studio Whitehall II, il dormire meno di 5 ore per notte è stato associato ad una maggiore prevalenza di ipertensione rispetto al dormire 7 ore, per le donne
26
(odds ratio: 1.72; intervalli di confidenza al 95%, CI: 1,07-2,75 nel modello integralmente corretto), ma non per gli uomini [75]. Risultati simili sono stati trovati in un’analisi trasversale condotta sulla popolazione del “Western New
York Health Study”: in particolare, l'associazione sembra essere più forte in
pre-menopausa piuttosto che nel post-pre-menopausa [112]. Questi studi trasversali suggeriscono che la deprivazione del sonno potrebbe produrre effetti cardiovascolari negativi, attraverso l'ipertensione, in un meccanismo sesso-dipendente. In uno studio di popolazione trasversale, l'“Health Study
Hordaland” (HHS), si è dimostrato un aumento della pressione diastolica in
coloro che dormono meno di 5 ore [113]. Vale la pena di notare che quando il BMI è inserito nel modello, solo il BMI e il sesso sono ritenuti statisticamente significativi, suggerendo che l'obesità potrebbe svolgere da collegamento tra durata del sonno e l’ipertensione [113].
Gli studi longitudinali forniscono una forte evidenza sulla relazione tra durata del sonno e ipertensione.
La prima relazione è stata derivata dal “National Health and Nutrition
Examination Survey” (NHANES) [73]. L'analisi condotta su 4810 soggetti
adulti ha mostrato che per le persone che affermavano di dormire meno di 5 ore per notte è aumentata l'incidenza di ipertensione [73]. Questa relazione è stata significativa anche dopo la correzione per potenziali fattori di confondimento, come l'obesità e il diabete e altre condizioni chiaramente associate con la breve durata del sonno e predisposizione all’ipertensione [73]. Una successiva analisi
27
sulla stessa coorte ha confermato questo risultato, suggerendo inoltre che il rapporto tra la depressione e l'incidenza dell'ipertensione è principalmente determinato dalla comorbidità con l'insonnia e la ridotta durata del sonno [120]. Al contrario, nel corso del follow-up di 5 anni dello studio Whitehall II, il dormire 6 ore per notte, e 5 ore o meno, era significativamente associato con una maggiore incidenza di ipertensione nelle donne, rispetto a coloro che dormivano 7 ore [75]. Tuttavia, questa correlazione è stata notevolmente ridotta dopo aver tenuto conto dei fattori di rischio cardiovascolari e comorbidità psichiatrica (odds ratio: 1,42, IC 95%: 0,94-2,16; odds ratio: 1,31, IC 95%: 0,65-2,63, rispettivamente) [75].
Nel Chicago Coronary Artery Risk Development in Young Adults Study (CARDIA) la breve durata del sonno prediceva in modo significativo l’incidenza di ipertensione nell'arco di cinque anni, sia in soggetti bianchi, sia nei soggetti afro-americani adulti, anche aggiustando per i fattori confondenti, tra cui il russamento e la sonnolenza diurna [77]. Il rapporto tra durata del sonno e la PA diastolica, in particolare, è rimasta significativa anche dopo aggiustamento completo [77].
Uno studio condotto da Lopez Garcia et al. [118] ha trovato la non associazione tra durata del sonno e ipertensione in soggetti anziani di età superiore a 60 anni, prima o dopo l'aggiustamento per i fattori confondenti.
Dall’altro lato, nello studio “Outcomes of Sleep Disorders in Older Men Study” [119], il solo che utilizza la registrazione dell’EEG per i disturbi del sonno, è
28
stata mostrata una relazione tra la percentuale di sonno a onde lente (SWS) e un aumento della PA. Dopo aggiustamento per età, razza ed indice di massa corporea, l’unico indice di sonno a rimanere associato all’incidenza dell’ipertensione è proprio la percentuale di sonno ad onde lente (SWS).
La percentuale di tempo in SWS è risultato inversamente associato con l’incidenza di ipertensione, indipendentemente dalla durata del sonno e dalla sua frammentazione, e dai disturbi respiratori nel sonno. Così, la deprivazione selettiva del sonno ad onde lente può contribuire all’aumento della pressione arteriosa negli uomini anziani [119].
In sintesi, i dati disponibili provenienti da 16 indagini indipendenti supportano l'ipotesi che la perdita di sonno a causa della sua restrizione potrebbe provocare un aumento della pressione arteriosa: l'esposizione a una breve durata del sonno potrebbe comportare lo sviluppo e il mantenimento dell'ipertensione. In particolare questa associazione può variare in base al sesso, l'età e il tipo di fase di sonno che è stato perso: il rischio di sviluppare ipertensione è più elevato per le donne, gli adulti di età inferiore ai 60 anni, e in presenza di privazione del sonno ad onde lente.
Insonnia e ipertensione: evidenze sperimentali e cliniche
L’insonnia, ovvero la difficoltà di iniziare e mantenere il sonno, accompagnata da una qualche forma di disabilità durante il giorno, è il disturbo del sonno più frequente nella popolazione generale nei paesi occidentali industrializzati, con
29
una prevalenza che varia da 5% al 35% [65,66,121] . L’insonnia cronica è considerata una emergenza sanitaria, che colpisce il 10-15% della popolazione e che costa miliardi di dollari l'anno [68]. La prova che l'ipertensione è più frequente nei pazienti con insonnia che nei pazienti con un sonno normale è stata dimostrata in diversi studi negli ultimi 10 anni [73,77,80,82,84,122,123,124]. Alcuni di questi studi hanno valutato se l'insonnia sia un fattore di rischio per l'ipertensione.
Vgontzas et al. [78] ha esaminato l'effetto dell’insonnia e della durata del sonno sull'ipertensione in uno studio trasversale di popolazione. L’insonnia era definita come una dichiarata difficoltà ad addormentarsi, a mantenere il sonno, o ad avere un risveglio precoce, accompagnata da un’oggettiva breve durata del sonno rilevata per mezzo della polisonnografia. L’insonnia era indipendentemente associata ad un rischio significativamente più alto di ipertensione, dopo aggiustamento per i fattori confondenti (età, razza , sesso, indice di massa corporea, diabete, fumo, consumo di alcol, depressione, disturbi respiratori del sonno, peso). In questo studio gli autori hanno concluso che l'insonnia con breve durata del sonno è associata ad un aumentato rischio di ipertensione.
Bansil et al. [80] ha esaminato in uno studio trasversale l'effetto dell’ insonnia e della durata del sonno sull'ipertensione, con un campione basato sulla popolazione ricavata dal National Health and Nutrition Examination Survey (NHANES). Dopo aggiustamento per caratteristiche demografiche e
30
comorbilità, i disturbi del sonno (compresi insonnia, sindrome delle apnee del sonno e sindrome delle gambe senza riposo) sono stati associati con una maggiore prevalenza di ipertensione solo nel caso in cui veniva dichiarata una durata del sonno inferiore a 7 ore [80].
In uno studio prospettico, Suka et al. [82] ha valutato l'effetto dell’insonnia sullo sviluppo dell’ipertensione in una popolazione di uomini giapponesi di mezza età, durante un follow up di quattro anni. L'incidenza di ipertensione nei soggetti con difficoltà ad iniziare il sonno e con difficoltà a mantenere il sonno è risultata significativamente più elevata di quella dei soggetti che non hanno tali disturbi. Dopo aggiustamento per i potenziali fattori confondenti (età, indice di massa corporea, fumo, consumo di alcool, stress lavorativo), sia la difficoltà ad iniziare che a mantenere il sonno sono risultati significativamente associati ad un aumento della ipertensione incidente nel corso del tempo.
Nei partecipanti allo studio “Atherosclerosis Risk in Communities (ARIC)”, che hanno difficoltà ad addormentarsi e problemi di continuità del sonno,è stato riportato un leggero aumento del rischio di ipertensione incidente a sei anni di follow-up, dopo aggiustamento per fattori confondenti (età, sesso , assunzione di alcool, reddito, fumo, diabete, malattie cardiache, stato menopausale, depressione, livello di istruzione, indice di massa corporea, sintomi respiratori, funzione polmonare). Il riconoscimento di tre disturbi del sonno, includendo anche un risveglio stanco e affaticato, ha predetto l’incidenza di malattie cardiovascolari, ma non di ipertensione [83].
31
Questi dati non sono stati confermati nei soggetti di età avanzata. Infatti nel Cardiovascular Health Study, basato su un campione di 1419 anziani normotesi al basale, si mostra che la difficoltà ad addormentarsi, da sola o in combinazione con altri disturbi del sonno, non permette di prevedere l'ipertensione [123].
E' importante considerare l'influenza del tipo di sonno sull’andamento circadiano della pressione arteriosa per chiarire la relazione tra ipertensione e insonnia. Dal momento che la mancanza del dipping fisiologico della pressione arteriosa è associato, nei pazienti ipertesi, ad una prognosi cardiovascolare peggiore [125], alcuni studi hanno sostenuto che l'insonnia potrebbe essere responsabile di questo fenomeno. Nonostante la rilevanza clinica e scientifica di questo problema, pochi studi hanno effettuato nei pazienti insonni, il monitoraggio ambulatoriale delle 24 ore.
Lanfranchi et al. nel 2009 [84] ha esaminato 13 soggetti sani con PA normale ma con insonnia cronica primaria e 13 soggetti della stessa età e sesso ma non affetti da insonnia. Invece in un altro studio, il cui campione erano soggetti con ipertensione essenziale, con o senza insonnia, ma con lo stesso profilo circadiano nelle 24 ore, la gravità dell'insonnia era correlabile alla caduta notturna della PA [126]. I soggetti con insonnia avevano, durante la notte, una più alta pressione sistolica e diastolica e, durante il giorno, una PA diastolica paragonabile a soggetti non affetti da insonnia. Uno studio basato su 186
32
soggetti adulti ha dimostrato che maggiore è la differenza tra la PA notturna e diurna, più scarsa è la qualità del sonno [125].
In sintesi la perdita di sonno dovuta a insonnia persistente sembra essere associata ad un aumento del rischio di ipertensione nei soggetti di mezza età, anche dopo aver considerato gli altri fattori di rischio dell’ipertensione. L'effetto potrebbe probabilmente essere più importante quando i disturbi del sonno sono associati con una breve durata del sonno; possono variare in base all'età, in quanto questo rapporto non è confermato in età avanzata. Inoltre, l'insonnia potrebbe alterare il fisiologico dipping notturno della PA . Tuttavia, ulteriori studi sono ancora necessari per chiarire l'influenza sull’ipertensione dei fattori confondenti e del grado di insonnia.
Alterazioni del sonno e ipertensione: potenziali meccanismi fisiopatologici
I possibili meccanismi alla base della relazione tra deprivazione del sonno, breve durata del sonno, insonnia e ipertensione potrebbero essere comuni a tutte queste differenti alterazioni del sonno. Poiché il sonno ha importanti funzioni omeostatiche, compresi gli effetti soppressivi sul sistema di stress [71,89] e sul sistema pro-infiammatorio [91,127], sia la perdita di sonno che l’insonnia sono stati associati con alterazioni della funzione del sistema di stress, del sistema di attivazione simpatico e delle vie pro-infiammatorie [71,87-92].
33
Studi sul sonno, negli esseri umani e nei roditori, hanno dimostrato che la perdita di sonno a causa della privazione sperimentale del sonno è associata a lievi e temporanei aumenti nella attività dei principali sistemi di stress neuroendocrini, ovvero il sistema nervoso autonomo simpatico-surrenale e dell'asse ipotalamo-ipofisi-surrene (HPA) [71]. Una maggiore attività simpatica durante la notte e la mattina seguente è stata descritta sia in soggetti normotesi [103] che nei pazienti ipertesi [105]. La deprivazione sperimentale del sonno durante il sonno REM e NREM ha determinato una eccitazione notturna del sistema nervoso simpatico, che porta ad un andamento non-dipping della PA ed ad un aumento della PA durante il giorno [105]. Studi sperimentali hanno mostrato che la deprivazione del sonno ad onde lente (SWS) potrebbe svolgere un ruolo importante nella soppressione notturna dei livelli fisiologici di catecolamine e dei livelli dell’ormone della crescita, così come le loro interazioni con l'asse HPA. La riduzione del sonno NREM-SWS può indurre un aumento delle catecolamine notturne e contribuire così a malattie cardiovascolari [105]. L'aumento dell'attività simpatica dopo deprivazione sperimentale del sonno è stata dimostrata anche attraverso registrazioni neurali dirette in volontari sani [100]. Al contrario, non è stata rilevata, in volontari sani dopo una notte di privazione del sonno, nessuna differenza dei parametri non invasivi di regolazione autonomica cardiaca, come la variabilità della frequenza cardiaca e la sensibilità baroriflessa [101].
34
La perdita di sonno dovuta alla breve durata del sonno, si tradurrebbe in più lunghe esposizioni alla elevata attività del sistema nervoso simpatico e ai fattori di stress fisici e psicologici durante lo stato di veglia [89,90]. Solitamente l'attivazione dei sistemi sopra menzionati ritorna rapidamente allo stato basale durante il successivo sonno di recupero. Pertanto, in presenza di insufficiente sonno di recupero, i sistemi di stress possono mostrare una modesta attivazione ricorrente durante il giorno successivo [71]. Di conseguenza, la restrizione del sonno può non soltanto riguardare l'attività basale di sistemi neuroendocrini, ma anche la reattività di questi sistemi alle nuove sfide e fattori di stress. Una cronica riduzione del sonno è mediata dall’attivazione ripetuta dei sistemi di stress e ne potrebbe alterare la regolamentazione, portando a cambiamenti nella risposta basale ad uno stress successivo [71].
La prolungata perdita di sonno può agire come un fattore di stress cronico. La risposta allo stress attiva un segnale bidirezionale tra il cervello (in particolare tra l’ippocampo, amigdala, e le aree della corteccia prefrontale) e i sistemi autonomico, cardiovascolare e immunitario attraverso meccanismi nervosi ed endocrini. I processi allodinamici che possono essere adattivi a breve termine (allostasi) potrebbero diventare disadattivi a lungo termine (carico allostatico). Di conseguenza, l’allostasi ed il carico allostatico, attivati dalla restrizione cronica di sonno, possono influenzare la vulnerabilità delle condizioni di salute legate allo stress mentale/somatico, tra cui le malattie cardiovascolari e l'ipertensione. Di conseguenza, i meccanismi di stress e la breve durata del
35
sonno cronicizzata possono portare a una deregolamentazione di lungo periodo dell’allostasi, e promuovere, in condizioni di stress e di carico allostatico, meccanismi di stress cronico disadattivo [89,90].
Si è dimostrato che l’insonnia persistente è associata a una attivazione dei sistemi di stress. La fisiopatologia dell’insonnia cronica ed i suoi relativi effetti sull'asse HPA, così come l'ipervigilanza [87,88], sono ad oggi considerati come probabili percorsi prefereziali attraverso i quali l'insonnia e l'ipertensione possono essere collegate. Le attuali teorie eziologiche sullo sviluppo e il mantenimento dell’insonnia si concentrano sul ruolo dell’ipereccitazione notturna e diurna, (per esempio una iperattività cognitiva, emotiva e fisiologica) [88,128]. Un’attivazione simpatica cronica, in relazione con alti livelli di eccitazione cardiovascolare, è stata recentemente rilevata nelle persone con insonnia cronica [129,130]. Inoltre, tutte queste condizioni di perdita del sonno potrebbero attivare processi infiammatori, che sono in grado di indurre disfunzione endoteliale ed avviare l'attivazione della placca, rappresentando così un altro meccanismo favorente eventi cardiovascolari oltre allo sviluppo dell'ipertensione [104,131,136]. Sebbene i meccanismi fisiologici alla base dei rapporti tra la perdita di sonno e queste risposte immunitarie ed infiammatorie rimangano in gran parte sconosciuti, lo stress vascolare neuroendocrino e autonomico ed i cambiamenti ormonali SWS correlati sono probabilmente coinvolti [105]. La comunicazione bidirezionale tra il cervello e il sistema
36
immunitario sembra essere effettuata mediante una complessa rete di citochine e mediante il sistema autonomo ed endocrino [137].
In sintesi, il sonno e le sue funzioni omeostatiche potrebbero avere un effetto soppressivo sull’attività basale del sistema autonomo e neuroendocrino e del sistema pro-infiammatorio. Così, la perdita di sonno dovuta alla deprivazione sperimentale del sonno, specialmente durante il sonno SWS, potrebbe aumentare l'attività di questi sistemi di stress verso i livelli osservati durante la veglia normale. Inoltre, la perdita di sonno dovuta alla prolungata restrizione del sonno e all'insonnia potrebbe essere considerata uno stimolo stressante cronico che potrebbe ledere l’allostasi. In questa prospettiva l’aumento di PA o l’ipertensione potrebbero essere considerate come una risposta “somatica” a condizioni stressanti croniche, come la perdita di sonno che potrebbe compromettere la risposta neuroendocrina allo stress. Inoltre l'attivazione dell’infiammazione sistemica aumenta il rischio cardiovascolare favorendo la progressione del processo aterosclerotico.
37
SCOPO DELLA TESI
Le prove che esista una relazione tra i disturbi del sonno e le malattie cardiovascolari sono sempre maggiori. In particolare i disturbi del sonno sono collegati attraverso diversi meccanismi fisiopatologici a fattori di rischio cardiovascolari quali l’ipertensione, il diabete e l’obesità, aumentando così l'incidenza di eventi cardiovascolari [79,138]. Questo rapporto è stato ben definito per la sindrome delle apnee ostruttive [139], ma è stato anche suggerito per altri disturbi del sonno, come la breve durata del sonno e l’insonnia [79]. Infatti, sia l’insonnia che la breve durata del sonno sono stati associati con un’aumentata prevalenza e incidenza di ipertensione [73,140,141] e di eventi cardiovascolari [142].
In uno studio trasversale di popolazione, l’insonnia così come la breve durata del sonno erano indipendentemente associate con una maggiore prevalenza di ipertensione, che è ulteriormente aumentata in presenza di entrambe le condizioni [141].
Studi prospettici hanno anche fornito evidenze di aumentata incidenza di ipertensione nei soggetti con insonnia e /o breve durata del sonno [73,140], anche se la correlazione è stata ridotta o non significativa dopo aver preso in considerazione i fattori confondenti [143].
La relazione causale è complicata dall’evidenza che un certo numero di fattori di rischio cardiovascolare e di malattie psichiatriche potrebbero contribuire sia
38
all'insonnia che all’ipertensione [144,145], rendendo difficile determinare l’esistenza di un rapporto causa-effetto autonomo tra queste due condizioni. Inoltre la relazione sembra essere genere-specifica, essendo più rilevante nelle donne che negli uomini [75].
Il ruolo dell'insonnia sulla gravità dell’ipertensione è meno consolidato. In particolare, la condizione di ipertensione resistente è di interesse, poiché identifica una percentuale non trascurabile di pazienti con una forma più grave di ipertensione, con un elevato rischio cardiovascolare e una peggior prognosi [40].
Così abbiamo ipotizzato che l'insonnia e/o la breve durata del sonno potrebbero contribuire non solo allo sviluppo di ipertensione, ma anche esercitare una grande influenza sulla gravità dell’ipertensione, essendo associate all’ipertensione resistente. Di conseguenza, lo scopo dello studio è stato quello di valutare la prevalenza e le caratteristiche di una scarsa qualità del sonno in una popolazione di pazienti che accedono per la prima volta ad un ambulatorio specialistico per la cura dell’ipertensione arteriosa, valutando se l’ipertensione resistente sia associata alla scarsa qualità del sonno e/o alla breve durata del sonno. Inoltre è stato valutato anche il ruolo del genere (maschio/femmina), delle comorbidità cardiovascolari e psichiatriche sul rapporto tra ipertensione resistente e disturbi del sonno.
39
MATERIALI E METODI :
Pazienti
Sono stati arruolati 270 pazienti consecutivi che accedevano alla prima visita ambulatoriale presso il Centro Ipertensione dell'Azienda Ospedaliero-Universitaria di Pisa (UO Medicina Interna 1 Ospedaliero-Universitaria).
I criteri di inclusione sono stati: - età maggiore di 18 anni; - consenso informato scritto;
- diagnosi di ipertensione arteriosa essenziale secondo le attuali linee guida [3]. I criteri di esclusione sono stati:
- ipertensione secondaria nota o sospetta (secondo il giudizio clinico) tra cui l'ipertensione indotta da farmaci; ipertensione in gravidanza; precedente diagnosi di sindrome delle apnee ostruttive o sindrome delle gambe senza riposo;
- insufficienza cardiaca cronica grave o insufficienza epatica grave; - insufficienza renale cronica terminale;
- malattia neoplastica in corso.
Sulla base di questi criteri di inclusione/esclusione, sono stati screenati 436 pazienti ed inclusi nello studio 270 pazienti (tasso di accettazione del 61,9%). Inoltre, dopo l'arruolamento, i pazienti con un punteggio di 1 o più all’item
40
numero 10 del Pittsburgh Sleep Quality Index sono stati esclusi dall'analisi. Tale quesito include sintomi, auto-riferiti o riportati dal compagno di stanza, compatibili con la sindrome delle apnee ostruttive del sonno o sindrome delle gambe senza riposo, comprende anche il russamento.
Lo studio è conforme alla Dichiarazione di Helsinki ed è stato approvato dal Comitato Etico Locale. Tutti i pazienti hanno fornito il consenso informato prima di entrare nello studio.
Misurazione della pressione arteriosa e definizione di ipertensione arteriosa resistente
La pressione arteriosa è stata misurata da un medico esperto a livello brachiale, in posizione seduta; i pazienti erano rimasti a riposo per almeno 10 minuti in tranquille condizioni ambientali. La misurazione della pressione arteriosa è stata ripetuta per almeno tre volte a intervalli di 2 minuti utilizzando un dispositivo automatico oscillometrico (OMRON-705IT, Omron Corporation, Kyoto, Giappone). La media della pressione arteriosa è stata quindi calcolata sulle ultime due misurazioni.
Sulla base di queste misurazioni, l’ipertensione arteriosa resistente è stata definita come PA ambulatoriale maggiore di 140/90 mmHg con tre o più farmaci antipertensivi, o PA controllata con quattro o più farmaci, tra cui un diuretico, secondo le attuali linee guida [3,40].
41
Valutazione degli altri fattori di rischio
E’ stata eseguita una attenta anamnesi che ha preso in considerazione i fattori di rischi cardiovascolari (vedi sotto) ed un esame obiettivo completo.
Inoltre dopo l'arruolamento, i pazienti sono stati invitati a venire in ambulatorio ipertensione dopo un digiuno notturno. E’ stato prelevato un campione di sangue per gli esami di routine (profilo lipidico, glicemia a digiuno, creatininemia, esame delle urine), analizzato secondo le procedure di laboratorio standard.
Analizziamo ora i singoli fattori presi in considerazione.
Attivita’ fisica
I dati relativi all’esercizio fisico sono stati valutati tramite raccolta anamnestica. L’abituale attività fisica è stata definita come almeno 1 ora/settimana di camminata veloce o lo svolgimento di attività sportive
Fumo
E’ stato chiesto ai pazienti se fumavano sigarette, il numero di sigarette/die ed eventuale sospensione.
Diabete
Oltre alla raccolta anamnestica di familiarità positiva per diabete mellito, sono stati valutati i risultati di esami ematochimici di routine, quali glicemia e, se necessario, emoglobina glicata. Sulla base di tali esami sono stati definiti diabetici i pazienti con valori di glicemia a digiuno (di almeno 8 ore) ≥ 126 mg/dl o inferiori se in trattamento con antidiabetici orali od insulina, o
42
per valori di emoglobina glicata > 6.5%, secondo le Linee Guida dell’American Diabetes Association del 2012 [146].
Dislipidemia
I risultati degli esami ematochimici di routine per i valori di colesterolo totale, HDL e LDL, e trigliceridemia, insieme alle informazioni riguardanti l’uso di statine sono stati raccolti ed analizzati per la valutazione del profilo di rischio del paziente.
L’ipercolesterolemia è stata definita secondo criteri dell’ATP III [147] o in presenza di trattamento ipolipidemizzante in atto.
Obesita’
L’esame obiettivo ha permesso la raccolta dei parametri altezza e peso dei pazienti. Per la valutazione del fattore di rischio obesità è stato utilizzato il parametro body mass index (BMI) ottenuto tramite la formula matematica: BMI = peso/(altezza in m)2 e sono stati considerati sovrappeso pazienti con BMI ≥ 25 ed obesi pazienti con BMI ≥ 30. Il BMI è stato utilizzato anche come parametro indicativo per la prescrizione di una dieta con adeguato ed individualizzato contenuto di calorie, nonché come parametro aggiuntivo per la valutazione dell’aderenza al regime dietetico.
Insufficienza renale cronica
Il GFR è stato stimato utilizzando la formula MDRD. L’insufficienza renale cronica è stata definita come velocità di filtrazione glomerulare inferiore a 60 ml/min/1,73 m2.
43
Questionari
Sono stati somministrati ai pazienti i seguenti questionari :
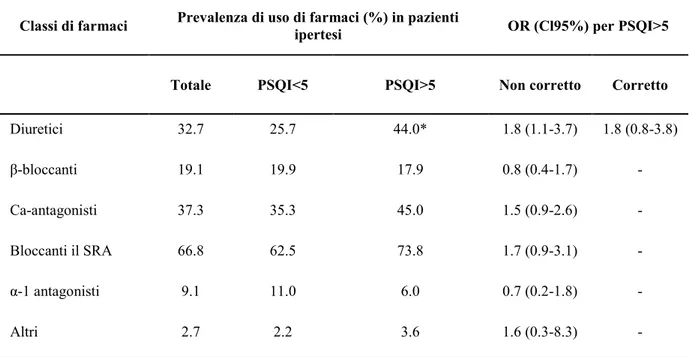
- Pittsburgh Sleep Quality Index (PSQI): è un questionario per auto-valutazione, composto da diciannove domande e ampiamente usato in psichiatria e psicologia; valuta la qualità del sonno nel corso del mese precedente in modo standardizzato, valido e affidabile [148]. Le diciannove domande sono raggruppate in sette gruppi, ad ognuno dei quali è associato un punteggio. Ciascun gruppo esplora un aspetto diverso del sonno: la qualità del sonno soggettivo, la difficoltà all’addormentamento, la durata del sonno, l’efficacia del sonno, i disturbi del sonno, l’uso di farmaci per dormire, e i disturbi durante il giorno. La somma dei sette punteggi ottenuti determina il punteggio globale PSQI, che è stato utilizzato per definire la scarsa qualità del sonno quando è maggiore di 5. Sulla base del gruppo di domande relative alla durata del sonno, la breve durata del sonno è stata definita come un sonno di durata <6 ore/notte. Sono stati analizzati i seguenti dati derivati dal PSQI: la difficoltà all’addormentamento (tempo di addormentamento maggiore di 30 minuti), la ridotta efficacia del sonno (inferiore all’85%), i disturbi del sonno (disturbi della componente del sonno con score maggiore di uno), disturbi durante il giorno a causa della sonnolenza (punteggio dei disturbi diurni maggiore di 1).
47
- Beck Depression Inventory (BDI): al fine di tener conto della frequente comorbilità tra i disturbi del sonno e la depressione, è stato anche somministrato il test BDI. Il BDI è un questionario di autovalutazione di ventuno domande a risposta multipla, uno degli strumenti più utilizzati per misurare la gravità della depressione.
L’assunto di base è che il numero, la frequenza e l’intensità dei sintomi siano direttamente correlati con la profondità della depressione. La teoria interpretativa è che i disturbi depressivi siano la conseguenza di una strutturazione cognitiva che induce il soggetto a vedere se stesso ed il suo futuro in una luce negativa. Questo quadro teorico ha ovviamente indotto una prevalenza di items riguardanti gli aspetti cognitivi della depressione (in specie: sentimento di non valere nulla oppure sensi di colpa eccessivi o inappropriati); nell’insieme, il questionario copre con due o più items sei dei nove criteri diagnostici del DSM-III: non viene considerato il criterio “agitazione o ritardo motorio” e i disturbi del sonno sono menzionati solo in un item.
La presenza di sintomi depressivi è stata definita con un punteggio BDI maggiore di dieci [149,150].
50
- State-Trait Anxiety Inventory (STAI)-Y2: al fine di tener conto della frequente comorbidità dei disturbi del sonno con l'ansia, lo stato ansioso è stato valutato mediante STAI-Y2, definendolo con un punteggio maggiore di 40 [151].
51
Terapia farmacologica
Particolare attenzione è stata posta sui dati riguardanti: la presenza di terapia farmacologica o il numero ed il tipo di farmaci antiipertensivi assunti (fondamentali per la definizione stessa di ipertensione arteriosa resistente), ed i farmaci psichiatrici assunti.
Analisi statistica
L'analisi statistica è stata effettuata utilizzando il programma NCSS 2008 (NCSS: Kaysville, Utah, Stati Uniti d'America).
Per i dati distribuiti secondo una curva gaussiana, i risultati sono stati espressi come media ± SD; mentre per i dati non normalmente distribuiti è stato utilizzata la mediana ed il range tra il primo e terzo quartile. Le differenze tra le medie tra i gruppi sono state analizzate mediante ANOVA per le variabili distribuite normalmente, o per variabili non normalmente distribuite mediante lo Z test Kruskal-Wallis; le variabili categoriche sono state analizzate invece mediante χ2 test.
I risultati dei questionari e i fattori di rischio cardiovascolare sono stati espressi come variabili binarie discrete, al fine di creare una regressione logistica multipla, comprendendo l’ipertensione resistente come variabile dipendente. Abbiamo analizzato l'effetto di età, sesso, e di un gruppo di comorbidità cardiovascolari (precedenti eventi cardovascolari, diabete, obesità) e
52
psichiatriche (breve durata del sonno, uso di farmaci psichiatrici, sintomi depressivi, stato di ansia), scelte in base alle associazioni significative con l’ipertensione resistente nella nostra popolazione e in letteratura. L’insufficienza renale cronica non è stata inserita nello studio, malgrado una associazione significativa con l’ipertensione resistente, per alta collinearità con il diabete mellito. L'analisi è stata poi stratificata per genere.
53
RISULTATI
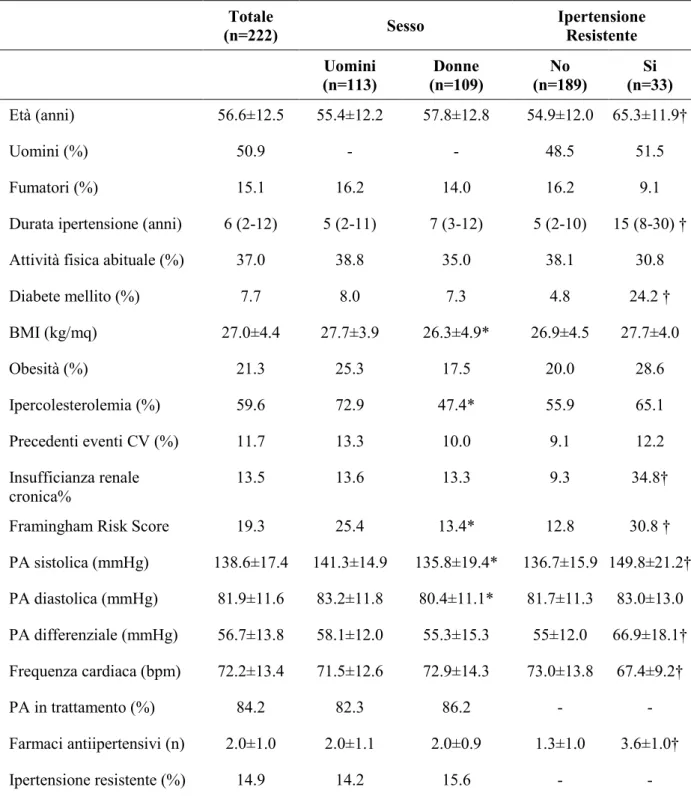
Tra i 270 pazienti arruolati, sono stati esclusi quelli con dati incompleti (n = 13) e coloro che auto-dichiaravano (o veniva riportato dal compagno di stanza) apnee del sonno, russamento e sindrome delle gambe senza riposo (n = 35). L’analisi finale è stata quindi eseguita su 222 pazienti. Le caratteristiche cliniche della popolazione in studio sono riportati in Tabella 1.
La popolazione dello studio ha mostrato:
- una mediana della durata dell’ipertensione pari a 6 anni;
- 84,2% era sottoposta a terapia farmacologica, trattati con un numero medio di 2 farmaci;
- il 14,9% aveva l’ipertensione resistente, senza differenze di genere.
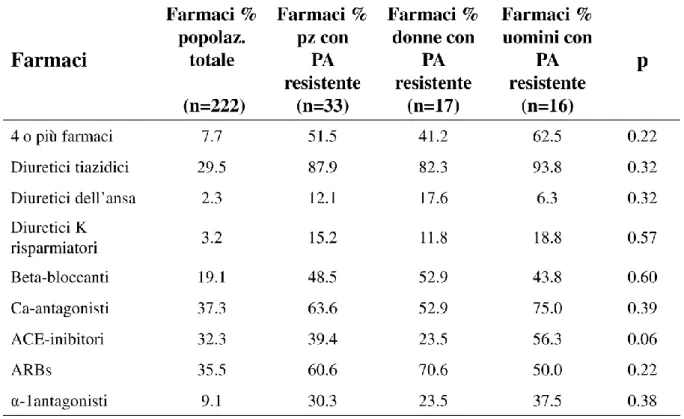
Non sono emerse differenze di genere per i fattori di rischio cardiovascolare e per la prevalenza della malattia cardiovascolare, ad eccezione di un più alto indice di massa corporea e una maggiore prevalenza di ipercolesterolemia nei maschi, che hanno anche mostrato valori di pressione arteriosa più elevati (Tabella 1).
Tra le donne ipertese, era in post-menopausa il 73,5% del campione complessivo e il 100% delle donne con ipertensione.