UNIVERSITA’ DI PISA
Scuola di Dottorato di Ricerca in Neuroscienze e Scienze Endocrinometaboliche
Programma di “Esplorazione molecolare, metabolica e funzionale del sistema nervoso e degli organi di senso”
Tesi di Dottorato
(Settore Scientifico Disciplinare: MED/26 - NEUROLOGIA)
Mild cognitive impairment su base vascolare e transizione a
demenza: aspetti clinico-neuropsicologici e di neuroimaging
avanzato con task cognitivo
Relatore:
Dott. Giovanni Orlandi
Candidato:
Dott. Alberto Chiti
1
INDICE
RIASSUNTO……….PAG. 2
INTRODUZIONE……….PAG. 4 1. Demenza e declino cognitivo su base vascolare: introduzione
1.A. Fattori di rischio e di protezione; 1.B. Inquadramento diagnostico (1.B.1. Evoluzione della terminologia; 1.B.2. Criteri clinici
per la diagnosi di VCI; 1.B.3. Eterogeneità della VaD; 1.B.4. Mild VCI (VaMCI); 1.B.5. Possibile reversibilità del VaMCI; 1.B.6. Inquadramento nosografico)
2. La malattia dei piccoli vasi (small vessel disease, SVD)
2.A. SVD: classificazione; 2.B. SVD: principali aspetti anatomo-patologici e patogenetici; 2.C. SVD: neuroimaging (2.C.1. Piccoli
infarti sottocorticali recenti; 2.C.2. Lacune di presunta origine vascolare; 2.C.3. Iperintensità della sostanza bianca di presunta origine vascolare; 2.C.4. Spazi perivascolari; 2.C.5. Microsanguinamenti cerebrali; 2.C.6. Altre lesioni emorragiche; 2.C.7. Atrofia cerebrale); 2.D. SVD: correlati clinici
3. Lo studio LADIS (Leukoariosis And DISability).
3.A. Studio LADIS - outcome: WMC e disabilità; 3.B. Studio LADIS - outcome: WMC e declino cognitivo; 3.C. Studio LADIS - outcome: WMC e depressione; 3.D. Studio LADIS - outcome: WMC, disturbi della deambulazione e urinari; 3.E. Studio LADIS: limiti e prospettive
4. Lo studio VMCI Tuscany (Vascular Mild Cognitive Impairment in Tuscany)
5. Metodiche di risonanza magnetica funzionale (fMRI) in pazienti con mild cognitive impairment e demenza di Alzheimer
5.A. fMRI con task cognitivo (memoria episodica) in pazienti con AD e MCI; 5.B. “Default mode network” (DMN) in pazienti con AD e MCI; 5.C. fMRI e valutazione di effetti farmacologici; 5.D. fMRI in portatori asintomatici di apolipoproteina E ε4; 5.E. fMRI nella differenziazione tra MCI/AD e MCI/demenza non AD; 5.F. fMRI nei disturbi cognitivi: punti di forza, criticità, prospettive
SCOPO DELLO STUDIO………..PAG. 54
MATERIALI E METODI………..PAG. 55 A. Popolazione target dello studio; B. Protocollo di studio RM; C. Gruppi di confronto (al baseline); D. Descrizione dei gruppi considerati (al baseline); E. Transizione a demenza e rischio di ictus nella popolazione target (VMCI); F. Analisi statistica
RISULTATI……….PAG. 64 A. VMCI: valutazione delle caratteristiche cliniche; B. VMCI vs NVMCI: valutazione delle caratteristiche neuropsicologiche; C. VMCI vs NVMCI vs NE: fMRI con task cognitivo (encoding e retrieval); D. VMCI: rischio di ictus e transizione a demenza a 1 e 2 anni
DISCUSSIONE………...………….PAG. 72
BIBLIOGRAFIA……….PAG. 78
2 RIASSUNTO
Introduzione: i pazienti con “mild cognitive impairment” su base vascolare sottocorticale (VMCI) sono a rischio di ictus e transizione a demenza. L’accurata caratterizzazione dei casi con VMCI potrebbe avere rilevanti implicazioni prognostiche e terapeutiche.
Scopo dello studio: valutare le caratteristiche clinico-neuropsicologiche e di neuroimaging avanzato (MRI 3Tesla con fMRI con task di memoria) di pazienti con VMCI; è stato inoltre valutato il rischio di ictus e di transizione a demenza ad un follow-up di 1 e 2 anni.
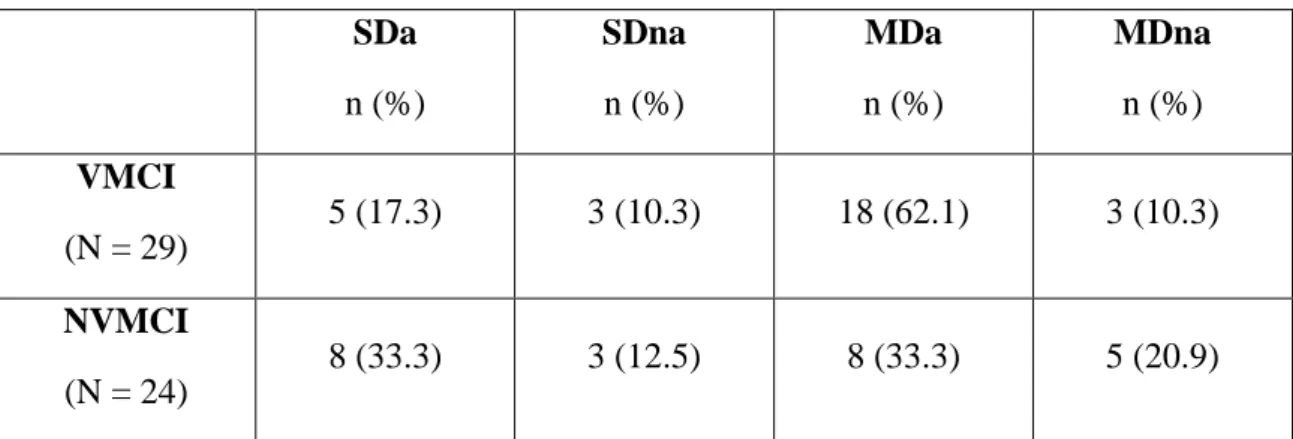
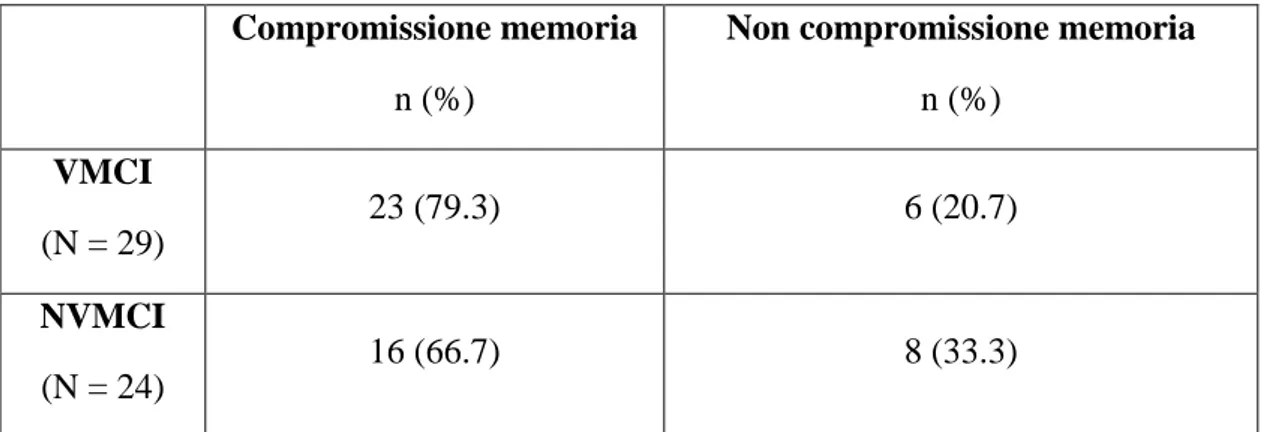
Materiali e metodi: sono stati considerati 29 pazienti con VMCI (con impegno vascolare definito da leucoaraiosi di grado moderato-grave secondo la scala di Fazekas modificata; età media 75.4 anni, range 65-84, 48.3% maschi). Ai fini della caratterizzazione neuropsicologica (compromissione singolo dominio vs multidominio, amnesica vs non-amnesica), tale gruppo è stato confrontato con 24 pazienti con “mild cognitive impairment” privi di significativo impegno vascolare (NVMCI: 24 pazienti, età media 75.2 anni, range 69-88, 45.8% maschi). Per la valutazione fMRI, sono stati confrontati pazienti con VMCI, NVMCI e soggetti di controllo (normal elderly, NE).
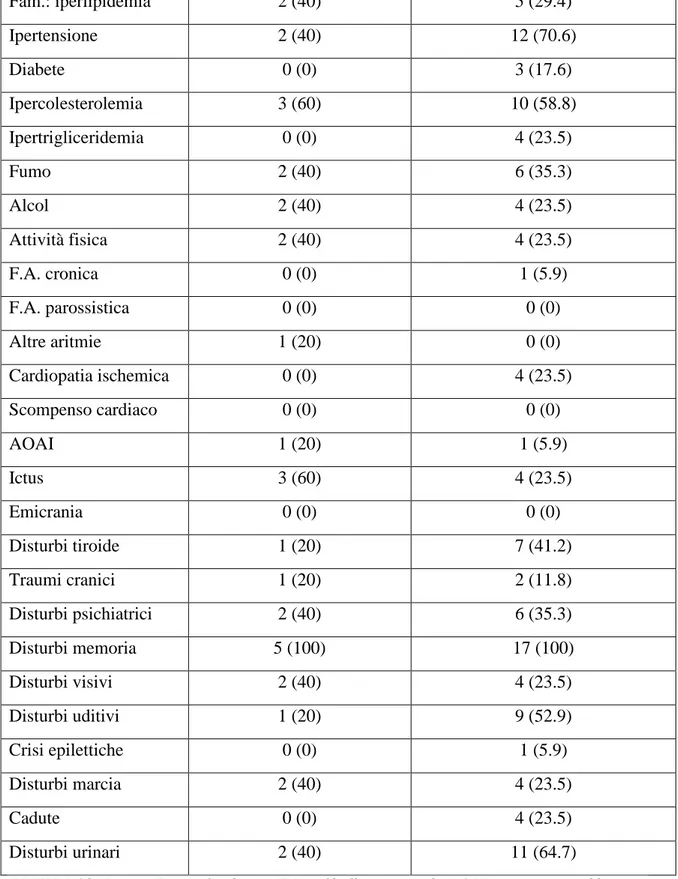
Risultati: i fattori di rischio maggiormente rappresentati nei pazienti con VMCI sono stati sedentarietà (79.3%) e ipertensione arteriosa (62.1%); circa un terzo dei casi aveva sofferto di ictus, mentre tutti lamentavano disturbi della memoria. Pazienti con VMCI e NVMCI hanno presentato analogo profilo cognitivo. I pazienti con VMCI hanno presentato un pattern di attivazione fMRI profondamente modificato rispetto a NVMCI e NE: nell’encoding, era presente un’attivazione additiva parieto-occipitale bilaterale
3 (rispetto ai NE), ma una minor attivazione anteriore e controlaterale (rispetto a NVMCI e NE); nel retrieval, era invece presente un’ estesa riduzione dell’attivazione rispetto ai NE, senza significative differenze rispetto ai casi con NVMCI. Al follow-up, ictus e demenza si sono verificati in 1 caso (3.4%) e 6 casi (20.7%), rispettivamente, in assenza di significative differenze (cliniche, neuropsicologiche e neuroradiologiche) al baseline tra i pazienti che hanno raggiunto l’endpoint e quelli che non lo hanno raggiunto.
Discussione: il presente studio supporta l’importanza di una dettagliata caratterizzazione e follow-up di pazienti con VMCI per migliorarne la gestione nella pratica clinica, e, ai fini di ricerca, per chiarire i meccanismi fisiopatologici sottesi alla malattia, realizzare score prognostici ed individuare potenziali target terapeutici.
4 INTRODUZIONE
1. Demenza e declino cognitivo su base vascolare: introduzione
La frequenza con cui si manifesta un quadro di deterioramento cognitivo conclamato cronico, definibile come demenza, aumenta con l’aumentare dell’età della popolazione, raggiungendo i massimi livelli nelle fasce di età più elevate. È stato calcolato che nei soggetti ultracentenari si può arrivare a valori di prevalenza di demenza superiori al 50%. [Thomassen et al., Ravaglia et al. 1999]. Dal punto di vista eziologico, le forme vascolari sono abitualmente considerate seconde rispetto a quelle degenerative primarie, per prevalenza ed incidenza, almeno nelle nazioni occidentali. [Fratiglioni et al., Lobo et al.] Nei paesi orientali, invece, sembrano essere almeno frequenti quanto le degenerative. [Ikeda et al.] Anche gli afro-americani avrebbero tassi più elevati di demenza vascolare o mista rispetto ai bianchi, in cui invece prevalgono le forme degenerative. [Pytel et al.]. Dati di epidemiologia descrittiva certi si possono ottenere solo con studi metodologicamente accurati su campioni sufficientemente rappresentativi della popolazione generale. Essi tuttavia comportano qualche difficoltà nella classificazione eziologica, trattando una forma morbosa in cui anche in serie cliniche studiate strumentalmente in maniera esaustiva o, perfino, in casistiche analizzate con esame istopatologico dell’encefalo, esiste un margine non trascurabile di incertezza nosografica. [Erkinjuntti et al. 1988, Zaccai et al.] La malattia cerebrovascolare può poi frequentemente associarsi a decadimento cognitivo di grado lieve ancora non definibile come demenza. Questa condizione, presente in circa il 5% della popolazione ultrasessantacinquenne, [Prencipe et al. 2003] può essere indicata anche con l’acronimo VCIND (vascular cognitive impairment not dementia), qualora se ne voglia sottolineare la possibile origine cerebrovascolare. Nello studio ACCORD una causa vascolare è stata
5 dimostrata nel 18% dei casi di CIND (cognitive impairment not dementia). [Feldman et al.] La percentuale di forme dovute a malattia vascolare oscilla quindi da studio a studio, anche in relazione all’esistenza di forme ad eziologia mista o di incerta classificazione. In Europa si calcola che circa il 20%-25% di forme di demenza siano di origine vascolare. I tassi epidemiologici variano poi in relazione alla struttura della popolazione; particolarmente alti in Italia ove le fasce di età più avanzate sono particolarmente rappresentate.
Alcuni studi di popolazione effettuati in diverse località italiane [Rocca et al. 1990; Prencipe et al. 1996; The Italian Longitudinal Study on Aging Working Group; Ferini-Strambi et al.; Ravaglia et al. 2002] consentono di affermare che la prevalenza di demenza globalmente considerata varia, nei soggetti anziani, tra il 5% ed il 10%: le fasce d’età considerate non coincidono perfettamente per cui i dati non sono completamente paragonabili. Lo studio ILSA, essendo multicentrico ed avendo coinvolto un campione rappresentativo della reale popolazione nazionale anziana, dà tassi affidabili di prevalenza di demenza del 6,4% nei soggetti di età compresa tra 65 e 84 anni compiuti, con un significativo maggior tasso (7.2%) nelle donne rispetto agli uomini (5.3%). La proporzione di forme vascolari va da un minimo del 22% circa dello studio ILSA stesso, ad un massimo del 45% dello studio di Conselice. Un studio inglese sulla popolazione di Islington fornisce risultati paragonabili allo studio ILSA, con valori di demenza vascolare pari al 21.9% dei casi. [Stevens et al.]. Sulla base dei dati ILSA si può calcolare, quindi, che siano affetti da demenza circa 680·000 italiani; di questi circa 150·000 sarebbero casi di origine vascolare.
Il numero di nuovi casi che vanno incontro a demenza ogni anno è funzione della struttura anagrafica della popolazione. I tassi di incidenza di demenza nei soggetti di età superiore a 60 anni sono pari a circa l’1%, anche se i diversi studi non danno risultati molto omogenei. [Fratiglioni et al.]. Per quanto riguarda l’Italia, ancora lo studio ILSA
6 fornisce i dati più affidabili e meglio generalizzabili all’intera popolazione nazionale. La proporzione di forma vascolare risulta pari al 27%, più alta quindi rispetto ai valori di prevalenza. Ciò è legato al fatto che lo studio di incidenza, effettuato su soggetti già inclusi nello studio nella fase iniziale dell’indagine (fase trasversale, di “prevalenza”) sono andati incontro all’insorgenza della malattia in tempi più recenti, in cui la diagnostica per immagini era più diffusamente applicata nella diagnosi differenziale eziologica delle demenze. È, infatti, la quota di forme non classificate che decresce sensibilmente nello studio di incidenza, rispetto allo studio di prevalenza. Una metanalisi su dati europei [Fratiglioni et al.] ed uno studio effettuato a Rochester [Lobo et al.], pervengono a valori di incidenza analoghi. Sulla base dei dati ILSA si può calcolare che ogni anno si ammalino di demenza 150·000 nuovi soggetti; di questi, circa 40·000 sono dovuti a malattia cerebrovascolare e, quindi, potenzialmente prevenibili. [Di Carlo et al. 2002] L’età riveste ancora un ruolo fondamentale: l’incidenza passa da valori tra 0.10% e 0.15% per anno nei soggetti di età tra 65 e 74 anni, a valori superiori all’1% annuo negli ultraottantenni. Tra i soggetti che presentano un ictus acuto e ne sopravvivono, una quota sensibile va incontro a decadimento mentale classificabile come demenza vascolare (demenza post-ictus propriamente detta, ovvero post-stroke
dementia). Alla dimissione, o a tre mesi dall’esordio dell’ictus, una quota oscillante tra
il 4% ed il 9% dei malati può definirsi demente. [Szatmari et al., Tham et al., Madurerira et al., van Kooten et al., Lin et al.] A più lungo termine, la prevalenza cresce al 15% circa ad un anno, nello studio condotto a Singapore, o anche al 23% circa in un gruppo di soggetti con infarto lacunare seguiti per 4 anni.[Loeb et al.] A distanza di 4 anni da un ictus acuto, è stato osservato che, dopo aver escluso i soggetti con demenza “precoce” post-ictus, un ulteriore 21.5% sviluppava demenza nei 4 anni successivi. [Altieri et al.] È interessante notare che, mentre l’incidenza di nuovi casi è costante nei 4 anni, il pattern cognitivo passa da una forma predominante di demenza degenerativa
7 con malattia cerebrovascolare nei primi due anni, ad una di demenza vascolare negli anni successivi. La presenza di demenza è inoltre un fattore ad alto impatto negativo sulla prognosi a distanza. Lo sviluppo di deterioramento cognitivo di qualsiasi tipo è significativamente associato ad aumento della mortalità, ma è soprattutto la demenza vascolare che aumenta la probabilità di decesso sia in confronto alla popolazione generale (RR=2.7: IC95% 1.9-3.9), sia in confronto a soggetti con demenza di tipo Alzheimer (RR=1.4: IC95% 1.2-1.7). [Knopman et al.]
1.A. Fattori di rischio e di protezione.
Le cause vascolari di disturbo cognitivo possono essere comuni ed evitabili. [Gorelick et al. 1993] Di certo vi è una significativa affinità nel determinismo del rischio dell’ictus e della demenza vascolare: i pazienti ad alto rischio di ictus lo sono anche per la demenza post-ictus; [Skoog et al. 1993; Yoshitake et al.; Kokmen et al.] di per sé l’ictus aumenta tale rischio di ben nove volte. [Amar et al.] Ma l’interesse generale è stato risollecitato in questo ambito dai progressi realizzati nella prevenzione dell’ictus e dai dati sempre più numerosi riguardanti sia la demenza Alzheimer che quella vascolare. [Gorelick 1995; Gorelick et al. 1997] È opinione diffusa che i fattori di rischio cardiovascolari modificabili, ivi includendo l’ipertensione, l’uso-abuso di alcol, il fumo di sigarette ed alcune abitudini alimentari, giochino un importante ruolo quale target di prevenzione delle cause vascolari di decadimento cognitivo. [Gorelick et al. 1993]. D’altra parte, in assenza di una sicura ed efficace terapia, soltanto la prevenzione dei fattori di rischio vascolari appare la soluzione più razionale ed efficace per ridurre la morbosità e la mortalità correlate alla demenza. Ne consegue che, aumentando l’incidenza di demenza vascolare con l’incremento di incidenza dell’ictus, la prevenzione dello stesso possa avere una ricaduta di efficacia sul decremento di incidenza di demenza vascolare. [Nyenhuis et al.]. Il ruolo dell’ipertensione arteriosa e
8 la persistenza di elevati valori sfigmici protratti prima dell’insorgenza della demenza vascolare, nonché l’indicazione al trattamento o la non indicazione dello stesso in funzione di un’efficacia o addirittura di un effetto di precipitazione di malattia sono concetti ormai da tempo convalidati. [Lindsay et al.; Skoog et al. 1996]. Lo studio Rotterdam del 1993 relativamente ai grandi anziani evidenzierebbe come valori più alti di pressione arteriosa possono essere utili a mantenere un buon flusso cerebrale in pazienti anziani con lesioni aterosclerotiche [Breteler et al.], mentre i dati di Di Carlo relativi agli anziani ipertesi di età inferiore a 75 anni [Di Carlo et al. 2000] sembrano sottolineare come un adeguato trattamento pressorio possa essere importante, in questa fascia di età, per evitare danni cognitivi a distanza. Nello studio SYST-EUR, [Forette et al.] il trattamento dell’ipertensione determina una riduzione dell’incidenza di demenza del 50% (da 7.7 a 3.8 per 1·000 pazienti/anno). Nello studio Honolulu-Asia il riscontro di elevati valori pressori nell’età media era associato ad un peggioramento cognitivo nell’età più avanzata. [Launer et al.; Peila et al.]. Il declino cognitivo era proporzionale al grado di ipertensione sistolica (per ogni 10 mm Hg di incremento di sistolica si eleva del 7% il rischio di “media” compromissione delle funzioni cognitive e del 5% quello di “elevata” compromissione). Oltre all’ipertensione, altri sono i fattori di ”rischio” per declino cognitivo: essi sono età, sesso, razza-etnia, aspetti genetici, livello culturale-educazionale, fumo di sigaretta, infarto miocardico, diabete, ipercolesterolemia, consumo eccessivo di alcol, obesità, inattività fisica, iperomocisteinemia, ipoperfusione cerebrale imputabile ad eventi emodinamici. La presenza di diabete risulterebbe associata a maggior prevalenza di demenza, verosimilmente più di tipo vascolare che degenerativo, anche se gli studi in proposito spesso sono carenti nella accurata suddivisione delle diverse forme eziologiche di decadimento cognitivo. [Biessels et al.] L’età avanzata ed il sesso maschile sono stati ritenuti fattori di rischio per la demenza vascolare la quale, tra i grandi anziani, prevale nei pazienti di sesso femminile.[Rocca et
9 al. 1991] Nello studio di coorte Zutphen Elderly Study viene riportato l’effetto dell’abitudine al fumo ed all’alcol sulla cognitività e la correlazione positiva tra consumi medio-alti ed incidenza di turbe cognitive. [Launer et al. 1996]. Viceversa, ancorché basato su una casistica molto limitata, uno studio condotto nell’area di Bordeaux suggerisce che moderate quantità di alcol potrebbero avere un ruolo protettivo, determinando così una più bassa incidenza di demenza. [Orgogozo et al.] Un ruolo importante ha la demenza da ipoperfusione indotta da patologie cardiache come la fibrillazione atriale parossistica, l’infarto acuto del miocardio, lo scompenso cardiaco congestizio, da interventi cardiochirurgici (by pass aorto-coronarico) o da interventi chirurgici in anestesia generale, insieme a crisi epilettiche, broncopneumopatie, ipotensione ortostatica grave, idiopatica e/o iatrogena. [Moroney et al; Sulkava et al.] Per alcuni altri fattori di rischio vi è minore evidenza; si tratta di condizioni non relative a rischio vascolare e tuttavia con evidenze dementogeniche su possibile base vascolare come l’eccessivo uso di ASA in età evolutiva, lo stress psicologico in età pediatrica, un’occupazione lavorativa come operaio, un’esposizione cronica a pesticidi, erbicidi, plastica o gomma liquida. [Mortel et al.; Persson et al; Davignon et al.] Un ruolo comune a demenza di Alzheimer e demenza vascolare nell’ambito dei fattori di rischio vascolari è stato riferito allo stress ossidativo da radicali liberi, riscontrabile in entrambe le patologie. Anche la genetica è in qualche modo chiamata in causa, come meglio evidenziato in altri capitoli: un ruolo importante può essere attribuito al polimorfismo dell’APOE, che rappresenta una chiave di lettura, se non un anello di congiunzione, tra le due realtà patologiche: l’allele e4 dell’apo-E è associato a ipercolesterolemia, aumento delle LDL e dell’apolipoproteinemia con evidenti ricadute aterogenetiche. Esso è significativamente presente anche in pazienti affetti da patologie degenerative demenziali rispetto a quelli sani di pari età che ne sono sprovvisti. [Davignon et al.; Corder et al.] È stato riscontrato, inoltre, un aumento della concentrazione e dell’attività
10 a livello cerebrale di ACE in pazienti con malattia di Alzheimer ma anche con demenza vascolare. [Arregui et al.] Tra i marker di attività di alcuni particolari fattori di rischio devono essere considerati quelli dell’infiammazione (PCR, ICAM-1, fosfolipasi A2 associata alle lipoproteine, interleuchine, e NitrOssido Sintetasi [NO], elevato numero di globuli bianchi), relativi alla presenza di agenti infettivi. Infine, un ruolo particolare nell’evoluzione peggiorativa della forma “lacunare” di demenza vascolare sembra essere svolto proprio dal recidivare degli episodi infartuali di tipo lacunare. La prevenzione secondaria delle recidive diviene quindi rilevante anche nel rallentare l’evoluzione verso la demenza. [Aharon-Peretz et al.]
Trattamenti con estrogeni e con antinfiammatori non steroidei sembrano in grado di migliorare la cognitività o prevenire la demenza. Gli estrogeni possono promuovere l’attività colinergica e serotoninergica cerebrale mantenendo l’integrità dei circuiti neuronali e prevenendo l’ischemia. [Szklo et al.; Yaffe et al.] Il possibile ruolo protettivo degli antinfiammatori nei confronti della demenza vascolare deve essere ancora verificato. [Stewart et al.] Infine, in merito al ruolo del livello di istruzione, un recente lavoro [Di Carlo et al. 2000] evidenzia come la educational protection dovuta a maggior sinaptogenesi determini una caduta del rischio di difettualità cognitiva, così come il trattamento della pressione arteriosa come fattore di rischio vascolare migliori la disabilità anche cognitiva.
1.B. Inquadramento diagnostico
Pur se teoricamente di semplice inquadramento, in quanto decadimento cognitivo legato ad una patologia cerebrovascolare, la demenza vascolare configura quadri clinici e fisiopatologici molto eterogenei tra loro. L’impiego di criteri diagnostici non uniformi, l’assenza di verifica anatomopatologica, l’inadeguatezza delle popolazioni studiate e l’intrinseca eterogeneità clinica della patologia cerebrovascolare concorrono a rendere
11 complesso l’approccio clinico a questa patologia. Un rilevante contributo al chiarimento del contributo vascolare a decadimento cognitivo e demenza è stato fornito dall’American Heart Association / American Stroke Association nel 2011 [Gorelick et al. 2011]
1.B.1. Evoluzione della terminologia. La terminologia utilizzata per caratterizzare la
sindrome cognitiva associata a fattori di rischio cerebrovascolari e alle sue manifestazioni ha subito una notevole evoluzione, specie per la descrizione della demenza. Circa quarant’anni fa, il termine “demenza multi-infartuale” (MID) [Hachinski et al., 1974] è stato impiegato per identificare pazienti che sviluppavano demenza dopo multipli ictus, anche se il termine era anche usato per pazinti con un singolo insulto vascolare. Più recentemente, è stato introdotto il termine “demenza vascolare”(VaD) , indipendentemente dalla patogenesi della lesione vascolare, ischemica o emorragica, oppure infarti singoli o multipli [Roman et al. 1999; Chui et al. 1992; Erkinjuntti et al. 2000]. Disturbi cerebrovascolari possono anche causare lievi deficit cognitivi che possono interessare molteplici funzioni congitive, e a tale riguardo è stato proposto il temine “Vascular mild cognitive impairment” (VaMCI) [O’Brien et al. 2003; Sachdev et al.], che rappresenta l’equivalente “vascolare” del termine “mild cognitive impairment” (MCI), comunemente usato per identificare soggetti nella transizione tra “normalità” e malattia di Alzheimer (AD). [Petersen et al. 1999]. Per estensione, il termine “vascular cognitive impairment” (VCI) si riferisce all’intero spettro di disturbi cognitivi associati a malattie cerebrovascolari, dalla franca demenza a deficit cognitivi lievi. In altri termini, VCI è una sindrome caratterizzata dalla presenza di ictus (clinicamente evidente) o lesioni vascolari subcliniche e compromissione di almeno un dominio cognitivo. La forma più grave di VCI è la VaD.
12
1.B.2. Criteri clinici per la diagnosi di VCI. Individuare criteri diagnostici per la VaD è
particolarmente importante non solo ai fini diagnostici nella pratica clinica ma anche per valutare prevalenza ed incidenza in studi di popolazione, determinare fattori di rischio e reclutare coorti omogenee in trials farmacologici. Il DSM (Diagnostic and Statistical Manual of Mental Disorders) [American Psychiatric Association, 1994 e 2000] ed il sistema ICD (International Classification of Diseases) [World Health Organization 1993] forniscono criteri utili per fini amministrativi e di registro, ma in alcuni casi c’è bassa accuratezza quando questi criteri vengono utilizzati a fini diagnostici. I criteri NINDS–AIREN [Roman et al. 1999] e dei Centri di diagnosi e trattamento della Malattia di Alzheimer dello Stato della California [Chui et al. 1992] per la VaD sono stati usati nella ricerca come strumenti diagnostici per includere segni e sintomi specifici di tale sindrome vascolare. Più recentemente, sono stati proposti criteri per la VaD sottocorticale [Erkinjunnti eet al. 2000]. Ad oggi, tutti i criteri diagnostici per caratterizzare sindromi cognitive associate a malattie cerebrovascolari dovrebbero essere basati su due fattori:
1. Dimostrazione della presenza di un disturbo cognitivo (demenza o VaMCI) attraverso test neuropsicologici
2. Anamnesi positiva per ictus (clinicamente evidente) o presenza di disturbo cerebrovascolare al neuroimaging che suggerisca un link tra il disturbo cognitivo e quello vascolare.
Tuttavia c’è stata una notevole variabilità nell’interpretazione di questi due aspetti fondamentali. Gorelick et al. (2011) hanno proposto un approccio pratico alla classificazione di demenza e VaMCI e hanno suggerito di usare il termine VCI per tutte le forme di disturbo cognitivo associato a malattia cerebrovascolare, indipendentemente dalla patogenesi (cardioembolica, aterosclerotica, ischemica, emorragica, o genetica).
13 Vi è stata inoltre la necessità di superare la disomogeneità nella definizione di demenza, che aveva comportato perdita di affidabilità in studi di confronto sulla VaD [Lopez et al. 1994]. I criteri basati su deficit della memoria, traslati da quelli tradizionalmente impiegati per la AD, non sembrano adatti per la VaD, in cui strutture correlate alla memoria (ad es. lobo temporale mesiale e talamo) potrebbero essere conservate, con relativa conservazione delle funzioni mnesiche [Benson et al,; Damasio et al.]. Pertanto, un deficit della memoria non dovrebbe essere considerato un requisito essenziale per VCI o VaD [Lopez et al. 2005]. La seconda caratteristica clinica critica della VaD consiste nel determinare la relazione tra disturbi cerebrovascolari e sintomi cognitivi. Per una appropriata diagnosi di VaD, è essenziale identificare la presenza di infarti corticali o sottocorticali o altre lesioni mediante neuroimaging, e queste dovrebbero essere associate con la sintomatologia clinica. Può essere rilevante considerare anche l’origine della patologia vascolare o cardiaca che sottende la malattia cerebrovascolare associata a VCI per fornire relazioni clinico-patologiche più specifiche. Alcuni Autori suggeriscono che i sintomi dovrebbero apparire entro tre mesi dall’ictus [Tatemichi et al], tuttavia si tratta di un criterio arbitrario, ed i sintomi potrebbero svilupparsi anche dopo questa finestra temporale. Inoltre, ci sono pazienti che non hanno un ictus clinicamente evidente, mentre una grave malattia cerebrovascolare viene evidenziata dal neuroimaging [Esiri et al.; Hulette et al.]. Infine, la presenza di alterazioni della sostanza bianca (white matter lesions, WMLs) o leucoaraiosi (diradamento delle sostanza bianca secondario a malattia dei piccoli vasi) è critica per la disgnosi di CADASIL (cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy) [Chabriat et al.], una forma genetica di VaD che interessa pazienti relativamente giovani. E’ da segnalare che WMLs sono spesso evidenti in pazienti anziani ed in quelli con AD [Kuller et al.]. WMLs, in presenza o meno di infarti, sono inoltre associate a
14 deficit cognitivi e disturbi neuropsichiatrici in pazienti con malattie autoimmuni (quali lupus erythematosus sistemico, malattia di Sjogren) [Harboe et al.; Ainiala et al.]
1.B.3. Eterogeneità della VaD. VaD può coesistere con molteplici malattie cerebrali e
sistemiche che possono incidere sullo stato cognitivo dell’anziano, in particolare AD. Pertanto è spesso difficile determinare se il declino cognitivo è solamente una conseguenza di fattori vascolari o di AD [Chui et al. 2006]. Svariati studi hanno mostrato che in pazienti con AD e malattia cerebrovascolare, è richiesto un minor carico patologico correlato ad AD per esprimere una sindrome dementigena [Snowdon et al.; Petrovitch et al.]. Questo effetto sinergico tra AD e malattia cerebrovascolare può spiegare perché pazienti con atrofia del lobo temporale mesiale, presumibilmente attribuibile a AD (ma potenzialmente anche esitale ad insulti vascolari), presentano un aumentato rischio di demenza dopo un ictus se confrontati con pazienti senza atrofia [Cordoliani-Mackowiak et al.; Schenider et al. 2003]. Si tratta dell’aspetto più difficile della caratterizzazione clinica della VaD, poichè la sindrome clinica correlata a AD può manifestarsi dopo un ictus, oppure pazienti con sintomi di AD possono essere colpiti da ictus durante il corso della malattia. Gorelick et al. (2011) hanno proposto di usare il termine “probabile” per caratterizzare le forme “più pure” di VaD, ed il termine “possibile” quando la certezza della diagnosi è meno forte o la sindrome vascolare è associata con altri processi patologici in grado di causare deficit cognitivi. Un rilevante contributo al chiarimento della relazione dinamica tra AD e VaD potrebbe derivare, ad esempio, da studi che impieghino specifici ligandi per la sostanza amiloide.
1.B.4. Mild VCI (VaMCI). Il termine “MCI amnesico” è stato impiegato per identificare
15 forme amnesiche [Petersen et al. 1999], successivi studi hanno rilevato che tali soggetti presentavano deficit in multipli domini cognitivi [Manly et al, Lopez et al. 2006], Pertanto, l’attuale nomenclatura per MCI è molto più ampia ed include MCI amnesici (singolo dominio), MCI amnesici con interessamento di multipli domini cognitivi, MCI nonamnesici (singolo dominio), MCI non amnesici con interessamento di multipli domini cognitivi [Petersen et al. 2004]. Poiché studi epidemiologici hanno rilevato deficit nelle funzioni esecutive in pazienti con patologia vascolare sottocorticale [Breteler et al.], è stato inizialmente suggerito che VaMCI dovrebbe essere caratterizzato da tale deficit, mentre la memoria potrebbe essere normale [O’Brien et al. 2003]. Tuttavia, studi successivi hanno mostrato che i casi con VaMCI possono presentare una più ampio spettro di compromissione cognitiva che può includere anche deficit mnesici [Sachdev et al.]. Tali definizioni sono principalmente applicate nella ricerca ma possono fornire un utile schema classificativo per la valutazione iniziale e longitudinale dei pazienti anche nella pratica clinica.
1.B.5. Possibile reversibilità del VaMCI. Svariati studi hanno mostrato che pazienti con
MCI possono tornare ad un normale stato cognitivo. Si tratta di casi con multipli processi patologici che possono migliorare spontaneamente o con specifici trattamenti, quali depressione, insufficienza cardiaca, o malattie autoimmuni [Hanly et al., Petri et al., Selnes et al.]. Lesioni cerebrovascolari (con o senza ictus clinicamente evidente) possono essere associate a depressione [Steffens et al.; Ballard et al.]. Tale aspetto è di grande rilievo in quanto depressione o sintomi depressivi possono significativamente influenzare le attività della vita quotidiana e la performance cognitiva dei pazienti, anche se possono migliorare con terapia specifica e, conseguentemente, anche lo stato cognitivo può migliorare. Ciò significa che può esistere una componente di “reversibilità” nel VaMCI. Un altro aspetto del VaMCI da considerare è il recupero
16 post-stroke: i pazienti valutati subito dopo l’ictus possono presentare una compromissione cognitiva che, in alcuni casi, può migliorare quale parte del processo di recupero post-ictus.
1.B.6. Inquadramento nosografico. Da un punto di vista nosografico può essere utile
tenere in mente la “tradizionale” differenziazione della demenza vascolare nei seguenti sottotipi:
1. demenza multinfartuale;
2. demenza da singoli infarti strategici;
3. demenza da malattia dei piccoli vasi cerebrali; 4. demenza da ipoperfusione;
5. demenza emorragica;
È evidente come possano esistere forme derivanti dalla combinazione di due o più dei quadri sopra elencati.
La demenza multinfartuale è causata dalla presenza di infarti cerebrali multipli territoriali [Hachinski et al.]. L’esordio è spesso acuto con il classico decorso “a gradini”, caratterizzato da peggioramenti seguiti da fasi di stabilizzazione. Le lesioni sono spesso estese con interessamento delle aree corticali, e deficit delle funzioni cognitive ad esse connesse. Molto spesso sono presenti segni e sintomi focali.
Le demenze da malattia dei piccoli vasi cerebrali comprendono diverse entità caratterizzate da infarti di tipo lacunare e lesioni della sostanza bianca sottocorticale. Il quadro clinico è più subdolo, possono mancare eventi clinici di tipo ictale e la compromissione delle funzioni cognitive interessa soprattutto le funzioni esecutive ed il rallentamento psicomotorio. Possono non essere evidenti segni focali mentre spesso vi è una compromissione della marcia. Reputato il più frequente e quello più omogeneo dal
17 punto di vista fisiopatologico, il gruppo delle demenze vascolari sottocorticali è stato proposto quale patologia su cui concentrare gli sforzi terapeutici nel campo più generale della demenza vascolare. Le alterazioni della sostanza bianca, più o meno associate all’altro tipo di lesione vascolare sottocorticale causata da malattia dei piccoli vasi (gli infarti lacunari), costituiscono uno dei due correlati radiologici essenziali per la diagnosi di demenza vascolare sottocorticale [Erkinjuntti et al. 2000]. Alla malattia dei piccoli vasi viene dedicato il successivo capitolo.
La demenza da singoli infarti strategici è rara ed è causata da infarti localizzati in aree cerebrali cruciali per le funzioni cognitive. Ognuna delle seguenti localizzazioni corticali è stata associata a deterioramento cognitivo:
• infarti del giro angolare sinistro; [Benson et al.]
• infarti del giro angolare di destra ed infarti della regione temporale; [Ott et al.] • infarti frontali mesiali.[Alexander et al.; Sawada et al.]
Per quanto riguarda le aree sottocorticali sono stati associati a demenza gli infarti nelle seguenti sedi:
• talamo; [Graff-Radford et al.; Barth et al.]
• ginocchio della capsula interna di sinistra; [Pullicino et al.] • nucleo caudato. [Bathia et al.; Wenchiang et al].
La demenza “ipoperfusionale” [Desmond et al.] può essere conseguente ad una prolungata condizione di ischemia cerebrale globale secondaria ad arresto cardiaco o a grave e protratta ipotensione. Alcune regioni cerebrali (come la sostanza bianca periventricolare, i gangli della base e l’ippocampo), sono particolarmente predisposte allo sviluppo di lesioni ischemiche da ipoperfusione. Sono soprattutto i soggetti anziani, con ipotensione ortostatica o scompenso cardiaco congestizio, o che vanno incontro ad interventi per l’applicazione di protesi articolari (anca, ginocchio) o al by-pass aorto-coronarico (specie in presenza di by-pass cardiopolmonare onpump) che possono andare
18 incontro a fenomeni di ipoperfusione che li espongono al rischio di sviluppo di demenza. [Roman 2004; Sedrakyan et al.].
Le demenze emorragiche comprendono quelle “secondarie” ad ematomi cronici subdurali, sequele di emorragie subaracnoidee, ed ematomi cerebrali. L’angiopatia amiloide età-correlata può essere causa di emorragie cerebrali multiple e quindi portare a demenza. Esistono poi peculiari forme di amiloidosi cerebrale geneticamente trasmesse quali la HCHWA-D (Hereditary cerebral hemorrhage with amyloidosis
Dutch type) che è una rara malattia autosomica dominante caratterizzata da ictus
emorragici e demenza. [Haan et al.] Una forma simile ad esordio più precoce è la HCHWA-I (Hereditary cerebral hemorrhage with amyloidosis Iceland type). [Levy et al.].
Da un punto di vista pratico si preferisce distinguere la demenza vascolare in due forme, di cui una a prevalente coinvolgimento corticale ed una a prevalente coinvolgimento sottocorticale.
Le demenze vascolari di tipo corticale si presentano con esordio acuto e andamento tipicamente a gradini con periodi di stabilizzazione, a volte di apparente miglioramento, cui seguono improvvisi peggioramenti. I deficit neurologici sono indicativi del territorio colpito. Nel corso della malattia il 60% dei pazienti presenta sintomi depressivi, l’8%-10% crisi epilettiche.
Le demenze da alterazione dei piccoli vasi cerebrali si manifestano con un quadro clinico di tipo sottocorticale. Solo in un terzo dei casi l’esordio è acuto, mentre nei rimanenti casi esso è subacuto, e nella metà dei pazienti l’andamento non ha il caratteristico andamento progressivo a gradini. [Babikian et al.] Sindrome pseudobulbare, segni extrapiramidali, disturbi della deambulazione e incontinenza urinaria sono caratteristiche frequenti all’esame neurologico in tali pazienti. Tra le più
19 comuni alterazioni cognitive e comportamentali predominano la diminuzione delle attività e degli interessi, l’apatia e l’inerzia. Comune è anche il riscontro di un quadro depressivo.
2. La malattia dei piccoli vasi (small vessel disease, SVD).
Il termine SVD riguarda tutti i processi patologici che interessano i piccoli vasi dell’encefalo, non solo piccole arterie e arteriole ma anche capillari e piccole vene. Tuttavia, fino a pochi anni fa persino nei principali Centri internazionali di Neuropatologia vi era una concordanza di meno del 50% su tale definizione [Pantoni et al. 2006]. Spesso il termine SVD è riferito alla sola componente “arteriosa”, tuttavia non va trascurata la quota “venosa”, quale la cosiddetta “collagenosi venosa”, associata alla presenza di leucoariosi [Moody et al]. Per quanto riguarda i piccoli vasi arteriosi, la differenza tra piccole arterie ed arteriole consiste nella perdita di una lamina elastica continua. Possono originare da un sistema superficiale (dai vasi subaracnoidei, quali terminali di arterie di medio calibro, che a loro volta derivano da arterie più grandi) oppure da un sistema più profondo alla base dell’encefalo (quali arterie perforanti, direttamente da grosse arterie). I due sistemi convergono l’uno verso l’altro, dopo aver oltrepassata strati corticali e nuclei grigi profondi, rispettivamente, tendendo a fondersi nelle aree più profonde della sostanza bianca sottocorticale, dove si crea una area spartiacque [Pantoni et al. 1997]. Il pattern di ramificazione arteriosa è “a pioppo” piuttosto che “a quercia” [Challa et al.]. Le arteriole hanno uno strato muscolare liscio e sono circondate da spazi perivascolari delineati da membrane piali. A quest’ultimo livello, due strati circondano le arteriole dei gangli dell base, mentre un solo strato avvolge le arteriole perforanti superficiali. [Lecrux et al.; Hawkins et al.]. L’endotelio capillare forma la barriera ematoencefalica ed è strettamente correlato ai neuroni attraverso periciti, microglia e astrociti. L’endotelio si continua nelle arteriole, ma a
20 livello arteriolare le giunzioni strette delle cellule endoteliali sono meno serrate che a livello capillare [Simpson et al. 2010]. Pertanto, le pareti arteriolari sono meno protette dalle conseguenze dell’insufficienza endoteliale rispetto ai capillari, ed i tessuti intorno alle arteriole dei gangli della base sono più protetti rispetto a quelli che circondano le arteriole superficiali perforanti [Wardlaw et al, 2013a].
A differenza dei grandi vasi, i piccolo vasi non possono essere correntemente visualizzati in vivo; quindi le lesioni parenchimali ritenute causate da alterazioni dei piccolo vasi sono state assunte come marcatore di SVD, e SVD è diventato sinonimo di lesioni parenchimali. È da sottolineare infine che il termine SVD non descrive solo la componente ischemica del processo patologico (cioè WML e infarti lacunari), ma fa rifermento anche ad alterazioni di tipo emorragico (emorragie e microsanguinamenti).
2.A. SVD: classificazione.
In senso lato, “malattie dei piccoli vasi” sono principalmente disordini sistemici che interessano vari organi e sedi. In alcuni casi, l’encefalo può essere il target principale della malattia, con lesioni e conseguenze cliniche confinate all’encefalo stesso. In altri casi, l’encefalo può non essere interessato per nulla. Ci sono differenti tipi di SVD [Pantoni, 2010]:
- Tipo 1 (arteriolosclerosi, o SVD correlata all’età e a fattori di rischio vascolari) - Tipo 2 (angiopatia amiloide cerebrale sporadica o ereditaria)
- Tipo 3 (SVD ereditaria o genetica distinta dall’angiopatia amiloide cerebrale) - Tipo 4 (SVD infiammatoria e immuno-mediata)
- Tipo 5 (collagenosi venosa)
- Tipo 6 (altri tipi di SVD, quali l’angiopatia post-attinica )
I tipi prevalenti di SVD sono il tipo 1 e il tipo 2. Dal punto di vista nosografico, il gruppo di SVD ereditario è in crescita [Hara et al.]; tra queste, la CADASIL (cerebral
21 autosomal dominant arteriopathy with subcortical ischaemic strokes and leukoencephalopathy) e la malattia di Fabry sono le più frequenti [Dichgans 2007], rappresentando potenziali modelli patogenetici il cui studio potrebbe migliorare anche la comprensione della malattia dei piccoli vasi sporadica. SVD di tipo infiammatorio e mediato immunologicamente sono un gruppo di malattie rare ed eterogenee caratterizzate dalla presenza di cellule infiammatorie nella parete vasale (vasculite) e generalmente sono parte di una malattia sistemica [Jennette et al.]. La collagenosi venosa interessa vene e venule in stretta prossimità dei ventricoli laterali [Moody et al.]; tali vasi hanno un incrementato spessore parietale (determinato principalmente dall’accumulo di collageno) che ne determina riduzione luminale e, talvolta, occlusione. L’angiopatia post-attinica, un potenziale effetto collaterale della radioterapia che si verifica con una latenza di mesi o anni, interessa soprattutto i piccoli vasi della sostanza bianca, che presentano necrosi fibrinoide, ispessimento parietale causato dalla deposizione di materiale ialino, stenosi luminale e occlusione trombotica. Ne risulta una diffusa leucoencefalopatia con degenerazione delle guaine mieliniche, talora così grave da determinare uno stato di necrosi coagulativa. [Dropcho et al.] Nello stesso gruppo “miscellaneo” di SVD sono incluse alterazioni non-amiliodee riscontrate nei capillari e nelle membrane basali dei pazienti con malattia di Alzheimer. [Zipser et al.]
2.B. SVD: principali aspetti anatomo-patologici e patogenetici.
Come detto, i tipi principali di SVD sono rappresentati dai primi due tipi (arteriolosclerosi e angiopatia amiloide cerebrale).
L’arteriolosclerosi è anche nota come SVD correlata all’età e a fattori di rischio vascolari. E’ caratterizzata principalmente da perdita di cellule muscolari lisce della tonaca media, depositi di materiale fibro-ialino, restringimento luminale e ispessimento parietale. Si tratta di una malattia comune e sistemica che interessa anche rene e retina
22 ed è fortemente associata a invecchiamento, diabete mellito e soprattutto ipertensione arteriosa, venendo anche denominata SVD ipertensiva [Furuta et al.]. Altre possibili caratteristiche patologiche di questa microangiopatia includono manifestazioni distali di aterosclerosi (microateroma) e la presenza di elongazioni e dilatazioni vascolari (microaneurismi).
L’angiopatia amiloide cerebrale (CAA) è caratterizzata dal progressive accumulo di proteina amiloide (congofila, βA4 immuno-reattiva) nelle pareti di arterie di piccolo e medio calibro e arteriole prevalentemente localizzate nello spazio leptomeningeo, nella corteccia e, in minor misura, in capillari e vene. Nelle forme più gravi, i vasi si dilatano e si rompono, con frammentazione parietale focale e stravaso ematico, in presenza o meno di dilatazione microaneurismatica, e talora presentano occlusione luminale [Vonsattel et al.]. Caratteristiche istologiche piuttosto specifiche sono rappresentate dalla birifrangenza verde alla luce polarizzata con colorazione rosso Congo e la fluorescenza alla luce ultravioletta quando viene utlizzata la colorazione con tioflavina S. Un altro aspetto tipico alla microscopia ottica è l’immagine a “doppio binario” dato dall’interruzione della lamina elastica interna causato dalla deposizione di materiale ialino nella parete vascolare. La CAA è una delle caratteristiche anatomo-patologiche essenziali della malattia di Alzheimer, in cui è quasi invariabilmente presente [Haglund et al.]. La CAA può verificarsi anche in rare malattie geneticamente trasmesse [Coria et al.] e in altre malattie come la sindrome di Down; è inoltre molto frequente nella popolazione generale anziana, come rilevato in sede autoptica, e la sua frequenza aumenta con l’età raggiungendo il 50% in individui nella nona decade [McCarron et al.]. La CAA è associata a emorragie lobari, frequentemente ricorrenti [Smith EE et al. 2006], e alla presenza di micro sanguinamenti rilevati mediante MRI [Koennecke], WML e microinfarti [Imaoka et al.; Kimberly et al.]
23 I meccanismi patogenetici che legano la SVD al danno parenchimale sono eterogenei e non completamente noti, anche per la scarsa disponibilità di modelli sperimentali animali in grado di riflettere adeguatamente la patologia umana [Hainsworth].
Le alterazioni dei piccoli vasi possono portare sia a conseguenze ischemiche (WML e infarti lacunari) che emorragiche (emorragie maggiori e microsanguinamenti) [Pantoni 2010]. La ragione per cui la rottura di alcuni vasi porta ad emorragie maggiori mentre quella di altri conduce soltanto a microemorragie non è noto. Nella CAA, il motivo potrebbe risiedere nello spessore parietale, con pareti più spesse associate a più microemorragie [Greenberg et al. 2009a]. L’etiopatogenesi delle lesioni di natura ischemica, quali WML, non è univoca [Pantoni 2002]. Si ritiene che la restrizione del lume vasale conduca ad uno stato di ipoperfusione cronica della sostanza bianca, che alla fine risulta nella degenerazione di fibre mieliniche quale conseguenza della morte selettiva degli oligodendrociti. Tale meccanismo, supportato da modelli sperimentali animali [Petito et al.], è verosimilmente una forma di infarto incompleto o necrosi selettiva [Brun et al.], in modo simile a quanto descritto per i neuroni [Garcia et al.]. In alternativa, può verificarsi l’occlusione acuta di un piccolo vaso, con conseguente ischemica acuta e necrosi completa, realizzandosi un infarto lacunare. Accanto a questa “ipotesi lacunare”, già proposta circa cinquant’anni fa da Fisher [Fisher 1964] ma non ancora adeguatamente dimostrata [Millikan et al.], sono stati proposti altri meccanismi quali danno della barriera emato-encefalica [Wardlaw et al. 2003], infiammazione locale subclinica [Tomimoto et al; Rosenberg; Simpson et al. 2007] e apoptosi degli oligodendrociti [Brown et al.].
2.C. SVD: neuroimaging.
Lo studio multimodale con risonanza magnetica permette di indagare in modo estensivo ed accurato vari aspetti della SVD. Alcuni elementi essenziali (piccoli infarti
24 sottocorticali recenti; lacune di presunta origine vascolare; iperintensità della sostanza bianca di presunta origine vascolare; spazi perivascolari; microsanguinamenti cerebrali; altre lesioni emorragiche cerebrali; atrofia cerebrale) sono stati oggetto di una recente revisione da parte del gruppo di esperti STRIVE al fine di proporre una terminologia comune, da utilizzare non solo in ambito di ricerca ma anche nella pratica clinica, e verranno successivamente descritti singolarmente [Wardlaw et al., 2013b per il gruppo STRIVE: STandards for ReportIng Vascular changes on nEuroimaging]. Metodiche di imaging avanzato (ad alto campo e/o con sequenze quali tensore di diffusione – DTI, e trasferimento di magnetizzazione – MTR), consentono di valutare caratteristiche emergenti quali microinfarti [Smith EE et al. 2012; Brundel et al.], alterata integrità della sostanza bianca, alterazioni delle connessioni assonali [O’Sullivan et al.; Bastin et al.], aumento del contenuto idrico cerebrale [McClullich et al.], alterata mielinizzazione [Bastin et al.], ispessimento focale secondario della sostanza grigia corticale [Duering et al.].
2.C.1. Piccoli infarti sottocorticali recenti. Piccoli infarti sottocorticali recenti
clinicamente evidenti, comunemente chiamati ictus lacunari o sindromi lacunari, sono la causa di circa il 25% di tutti gli ictus ischemici. Occasionalmente, tali infarti vengono identificati incidentalmente al neuroimaging [Kang et al.; Chowdhury et al.] e vengono denominati infarti cerebrali silenti. Al contrario, per ragioni al momento non note, in circa il 30% dei pazienti una sindrome lacunare non si accompagna ad un infarto sottocorticale visibile al neuroimaging con MRI convenzionale [Doubal et al. 2011], indicando l’incompleta sensibilità di tale metodica. Inoltre, alcuni studi hanno mostrato che piccoli infarti sottocorticali possono avere evoluzioni diverse, diventando una cavità lacunare o un’iperintensità priva di evidente cavitazione nelle sequenza pesate in T2, o ancora possono comparire senza lasciare conseguenze visibili con MRI convenzionale.
25 Si stima che la percentuale di tali infarti che evolve in lacune cavitate oscilli dal 28% [Potter et al.] al 94% [Moreau et al.]. Pochi dati da studi di correlazione anatomopatologica suggeriscono che l’insorgenza di tali infarti è associata all’occlusione di piccole arterie, tuttavia l’esatta patogenesi non è stata completamente chiarita. La sede di insorgenza è il territorio di perfusione di una piccola arteria o arteriola penetrante. Studi MRI suggeriscono che il diametro di piccolo infarti sottocorticali recenti può superare 15 mm nelle sezioni assiali (usualmente considerato come il limite per le lacune di presunta origine vascolare) nella fase acuta, potendo raggiungere 20 mm. Il diametro della lesione può essere perfino superiore a 20 mm se considerato sul piano coronale o sagittale.
Definizione STRIVE: il termine “piccolo infarto sottocorticale recente” si riferisce all’evidenza al neuroimaging di un infarto recente nel territorio di un’arteriola perforante, con caratteristiche di imaging o sintomi clinici suggestivi di una lesione verificatasi nelle settimane immediatamente precedenti. Il termine “recente” è impiegato al posto di “acuto” poiché fa riferimento alle prime settimane della lesione e non solo alla fase iperacuta. Il termine “piccolo” indica una lesione con diametro massimo inferiore a 20 mm sul piano assiale, anche se alcune lesioni che rappresentano un infarto nel territorio di un singolo vaso possono avere un diametri superiore sul piano coronale. [Koch et al.]. Ulteriori indagini sono necessarie per definire con esattezza limiti superiori. Lesioni nei gangli della base e nella capsula interna che sono più ampi di 20 mm e sembrano dovute all’infarto simultaneo nel territorio di più arterie penetranti non dovrebbero essere classificate come piccoli infarti sottocorticali, ma come infarti striato capsulari, un sottotipo distinto di infarto da causa atero / embolica [Donnan et al.]. Analogamente, gli infarti dell’arteria coroidea anteriore sono etiologicamente distinti, identificabili dalla loro localizzazione (nella testa del nucleo caudato) e morfologia (nella maggior parte dei casi “a virgola”), e pertanto non dovrebbero essere classificati
26 come piccoli infarti sottocorticali. A differenza delle lacune di presunta origine vascolare, non viene stabilito un limite inferiore di dimensioni in quanto sequenze pesate in diffusione (DWI) consentono di differenziarli da spazi per vascolari.
2.C.2. Lacune di presunta origine vascolare. Al riguardo Fisher scriveva [Fisher 1991]:
“Storicamente, la caratteristica originale della SVD era la lacuna (buco), termine derivato dal francese per indicare una piccola cavità riempita di fluido che si riteneva contraddistinguere la fase di guarigione di un piccolo infarto cerebrale profondo. Il termine è stato adottato in inglese. Per un processo di evoluzione medico-linguistica, la fase precavitaria è diventata l’infarto lacunare, l’entità clinica ad essa associata l’ictus lacunare e le caratteristiche neurologiche sono diventate la sindrome lacunare”. Le lacune sono di frequente riscontro al neuroimaging di anziani asintomatici e sono associate ad un aumentato rischio di ictus, compromissione della deambulazione e demenza [Vermeer et al. 2007; Santos et al.; Choi et al.; Snowdon et al.]. La causa della maggior parte delle lacune presumibilmente consiste in piccoli infarti sottocorticali, sintomatici o silenti; tuttavia, alcune lacune potrebbero derivare da piccole emorragie profonde [Franke et al.].
Definizione STRIVE: la lacuna di presunta origine vascolare è una cavità rotonda od ovoidale, sottocorticale, riempita di fluido (con un segnale simile al liquido cefalorachidiano), di diametro variabile tra 3 e 15 mm, congrua con un pregresso piccolo infarto profondo o emorragia nel territorio di un’arteriola perforante. Nelle sequenza FLAIR (fluid-attenuated inversion recovery), la lacune di presunta origine vascolare generalmente presentano un’ipointensità centrale (simile a quella del liquido cefalorachidiano) circondate con una stria periferica iperintenso; tuttavia tale stria non è sempre presente, mentre può anche circondare spazi perivascolari quando attraversano un’area di iperintensità della sostanza bianca. In alcuni casi, la cavità fluida centrale non
27 è soppressa nelle sequenza FLAIR e la lesione può apparire completamente iperintensa, nonostante un segnale simile al liquido cefalorachidiano in sequenze T1 e T2 pesate [Moreau et al.]. Le lacune di presunta origine vascolare dovrebbero essere distinte dagli spazi perivascolari; anche gli studi anatomopatologici non hanno mostrato un cut-off dimensionale assoluto, lesioni di diametro inferiore a 3 mm sono più probabilmente spazi perivascolari piuttosto che lacune, e tale criterio, consistente con precedenti studi [Vermeer et al 2003; Longstreth et al.], è raccomandato per discriminare le due alterazioni. E’ stato scelto scelto un diametro massimo di 15 mm per le lacune di presunta origine vascolare (diverso quindi da quello di 20 mm impiegato per i piccoli infarti sottocorticali recenti), poiché vecchi infarti sono generalmente più piccoli rispetto a quelli recenti a causa della perdita tissutale e dell’effetto ex-vacuo nelle vecchie lesioni, oltre al rigonfiamento presente nelle lesioni recenti. Tuttavia tale limite dimensionale non è supportato da una forte evidenza, cosicché sono necessari ulteriori studi al riguardo.
2.C.3. Iperintensità della sostanza bianca di presunta origine vascolare. Le lesioni della
sostanza bianca caratterizzate da iperintensità (bilaterali e nella maggior parte dei casi simmetriche) nelle sequenza T2-pesate in RM sono di comune riscontro in soggetti anziani. Anche se fortemente associate malattie cerebrovascolari e fattori di rischio cerebrovascolari [Debette et al.], la patogenesi di tali alterazioni non è stata completamente chiarita e potrebbe essere multifattoriale [Gouw et al.]. Come verrà più ampiamente illustrato in paragrafi successivi, tali alterazioni sono associate a sintomi neurologici e congitivi e difficoltà fisiche quali disturbi della marcia. [de Laat, et al., Windham et al., Saini et al., Haley et al., Inzitari et al. 2009]. Iperintensità possono anche essere rilevate in strutture grigie sottocorticali quali i nuclei della base, e talvolta sono state analizzate insieme alle iperintensità della sostanza bianca. Iperintensità
28 possono anche essere presenti nel tronco encefalico. Alcuni Autori hanno differenziato le iperintensità della sostanza bianca in periventricolari e profonde, suggerendo un loro diversità dal punto di vista di patogenesi, fattori di rischio e conseguenze cliniche (argomento ancora dibattuto). Molti Autori hanno tuttavia incluso tutte le iperintenisità della sostanza bianca nella loro analisi.
Definizione STRIVE: le iperintensità della sostanza bianca di presunta origine vascolare sono iperintense nelle sequenze T2-pesate e possono apparire iso- o ipointense (anche se non così ipointense come il liquido cefalorachidiano) nelle sequenze pesate in T1, a seconda dei parametri della sequenza e della gravità delle alterazioni patologiche. I membri del gruppo STRIVE hanno riportato opinioni divergenti in merito alla possibilità di classificare routinariamente iperintensità della sostanza girigia o del tronco encefalico quali iperintensità della sostanza bianca, come effettuato in alcuni precedenti studi. E’ stato raggiunto un consensus finale sull’opportunità di non includere iperintensità della sostanza grigia sottocorticale e del tronco encefalico nella categoria delle iperintensità della sostanza bianca di presunta origine vascolare a meno che non si esplicitamente specificato; è stato proposto il termine generale di “iperintensità sottocorticali” per raggruppare ogni iperintensità non corticale, includendo quelle nella sostanza bianca, nella sostanza grigia profonda e nel tronco encefalico. Quando viene usata la tomografia computerizzata (TC), i termini “ipoattenuazione” o “ipodensità” della sostanza bianca possono essere impiegati dato il loro aspetto tomodensitometrico [Hachinski et al. 1987]
2.C.4. Spazi perivascolari. Gli spazi perivascolari sono estensioni degli spazi liquorali
periencefalici e circondano arterie, arteriole, vene e venule decorrendo dalla superficie dell’encefalo all’interno e attraverso il parenchima cerebrale e possono essere seguiti da strati leptomeningei [Pollock et al]. Tali spazi sono comunemente microscopici e non
29 visibili con neuroimaging convenzionale; tuttavia, spazi perivascolari dilatati diventano progressivamente evidenti con l’aumentare dell’età del paziente, specie quando localizzati alla base dell’encefalo [Groeschel et al.]. La dilatazione generale degli spazi perivascolari è associata ad altre caratteristiche morfologiche di SVD quali iperintensità della sostanza bianca [Doubal et al. 2010] e lacune [Kwee at al.], ma non atrofia [Zhu et al.]. La potenziale rilevanza clinica di multipli spazi perivascolari dilatati rimane controversa, pertanto al momento tale alterazione non dovrebbe essere definita come “lesione”; tuttavia, alcuni studi hanno associato spazi perivascolari più prominenti con una peggior funzione cognitiva [MacLullich et al.].
Definizione STRIVE: gli spazi perivascolari sono definiti come spazi riempiti di liquido che seguono il tipico decorso di un vaso mentre si approfonda nella sostanza grigia o bianca. Tali spazi hanno caratteristiche di segnale simili al liquido cefalorachidiano in tutte le sequenze; poiché seguono il decorso di vasi penetranti, hanno forma lineare quando visualizzati parallelamente al decorso del vaso, e rotonda od ovoidale, con un diametro generalmente inferiore a 3 mm, quando visualizzati perpendicolarmente a tale decorso. Con metodiche ad alta risoluzione, un vaso centrale può essere occasionalmente osservato al centro di uno spazio perivascolare, elemento che contribuisce a differenziare gli spazi perivascolari dalle lacune. Gli spazi perivascolari sono generalmente più prominenti nelle porzione inferiore dei gangli della base, e possono anche essere osservati decorrere in senso cetripeto attraverso la sostanza bianca emisferica e il tronco encefalico; più raramente sono osservabili a livello cerebellare. Tali spazi possono presentare dilatazioni focali e possono risultare particolarmente dilatati (fino a 10-20 mm, perfino con effetto massa) nella porzione inferiore dei ganli della base. Gli spazi perivascolari devono essere differenziati dalle lacune di presunta origine vascolare: a differenza delle lacune, il loro diametro è usualmente non superiore a 3 mm come confermato a livello anatomo-patologico [Braffman et al; Bokura et al.] e
30 non presentano una rima iperintensa intorno a spazi riempiti di liquido nelle sequenze pesate in T2 e FLAIR, a meno che non attraversino aree di iperintensità della sostanza bianca.[Awad et al.]
2.C.5. Microsanguinamenti cerebrali Microsanguinamenti cerebrali sono piccole lesioni
ipointense visibili in sequenze RM sensibili per sostanze paramagnetiche quali T2* ad eco di gradiente (GRE) o sequenze “susceptibility-weighted”, e sono più frequentemente localizzate alla giunzione cortico-sottocorticale e nella sostanza bianca o grigia negli emisferi cerebrali, nel tronco encefalico e nel cervelletto. I risultati di alcuni studi [Gouw et al; Shoamanesh et al.; De Reuck et al.] suggeriscono che le le lesioni visibili in RM corrispondono a macrofagi carichi di emosiderina nei tessuti perivascolari, verosimilmente a seguito di stravaso ematico globuli rossi [Shoamanesh et al.; Fazekas et al.; Dichgans et al 2002; Tatsumi et al]. I microsanguinamenti sono associati a SVD e malattia di Alzheimer [Cordonnier et al; Vernooij et al]. La presenza o l’assenza di microsanguinamenti strettamente lobari è stata inclusa nei criteri di ricerca per l’angiopatia amiloide [Knudsen et al.]. Originariamente ritenuti markers asintomatici di SVD, crescenti evidenze hanno mostrato l’associazione tra microsanguinamenti e compromissione cognitiva, anche se i meccanismi di tale associazione (in particolare, la potenzialità dei microsanguinamenti di danneggiare l’encefalo e provocarne disfunzione) non sono completamente chiariti. Sono stati recentemente pubblicate raccomandazioni per l’imaging e al refertazione dei microsanguinamenti [Greenberg et al. 2009b] e nello specifico contesto clinico della malattia di Alzheimer [Sperling et al. 2011a]. E’ da segnalare a questo proposito che il termine emorragia-anomalia all’imaging correlata all’amiloide (Amyloid-related imaging abnormalities–haemorrhage - ARIA-H) descrive i microsanguinamenti nell’ambito della malattia di Alzheimer o delle immunoterapie per beta-amiloide.
31 Definizione STRIVE: microsanguinamenti cerebrali sono visualizzati come piccolo aree (generalmente di 2-5 mm di diametro, ma possono arrivare fino a 10 mm) di vuoto di segnale con associato effetto “blooming” nelle sequenze T2* pesate alla RM o impiegando altre sequenze sensibili ad effetti di suscettibilità [Cordonnier et al; Greenberg et al. 2009b], mentre non sono generalmente rilevabili in TC o in sequenze FLAIR T1 o T2-pesate. Nelle sequenze T2* appaiono aree ben definite, caratterizzate da basso segnale, di forma rotonda o ovalare. Poiché l’artefatto di “blooming”, e quindi le dimensioni visualizzate, dipendono dall’intensità del campo magnetico e dalla sequenza, non viene raccomandato un criterio assoluto per le dimensioni. Quando vengono impiegate sequenze GRE con campi magnetici di 1,5 o 3 T, i micro sanguinamenti hanno generalmente diametro di 2-5 mm, ma possono arrivare fino a 10 mm. Ipointensità di diametro inferiore a 2 mm,potenzialmente attribuibili a perdita di segnale di un singolo voxel, in apparecchi a 1,5 T potrebbero essere artefatti. La valutazione dei microsanguinamenti potrebbe essere migliorata mediante metodi quantitativi innovativi quali il mapping quantitativo di suscettibilità, che necessità tuttavia di ulteriore validazione. E’ da sottolineare infine che svariate lesioni (o strutture normali) possono mimare microsanguinamenti cerebrali, quali calcificazioni, vasi normali visualizzati in sezione trasversale, depositi di ferro da altre cause, metastasi con componenti emorragiche (come ad esempio in quelle da melanoma) e danno assonale diffuso (a seguito di trauma cranico) [Greenberg et al. 2009b]. La diagnosi differenziale con emorragie parenchimali profonde di vecchia data è possibile poiché, in generale, queste ultime sono più ampie, irregolari, con una cavità cistica, e sono inoltre visibili in sequenze T1-pesate, T2-pesate e FLAIR.
2.C.6. Altre lesioni emorragiche. In aggiunta ai microsanguinamenti, le prinicipali
32 corticale superficiale. L’emorragia parenchimale potrebbe essere una espressione di SVD [Lammie et al.] oppure secondaria ad altre cause quali malformazioni vascolari. Sono state recentemente pubblicate Linee Guida per la diagnosi e la gestione dell’emorragia parenchimale [Broderick et al.]. Nell’ambito della SVD, in attesa di chiarire in dettaglio il contributo di diverse patologie vascolari all’emorragia parenchimale, è opportuno quanto meno distinguere l’emorragia parenchimale lobare, che può essere causata dall’angiopatia amiloide, da quella non lobare, che è generalmente dovuta ad una vasculopatia delle arteriole perforanti [Qureshi et al.; Jackson et al.]. A tale riguardo, la concordanza inter-osservatore sul sito di origine dell’emorragia parenchimale appare buona, anche se non perfetta [Bhattathiri et al.]. In pazienti con emorragia parenchimale lobare, i criteri di Boston [Knudsen et al.] possono essere un valido strumento per valutare la probabilità di una sottostante angiopatia amiloide.
Il termine siderosi superficiale corticale viene impiegato per l’evidenza al neuroimaging di segni di cataboliti ematici nella corteccia superficiale sotto la pia madre. Tale condizione può essere l’esito di un sanguinamento subaracnoideo o il risultato di un sanguinamento corticale molto superficiale causato da malformazioni vascolari, angiopatia amiloide cerebrale [Linn et al.], difetti durali spinali, o idiopatico [Linn et al; Kumar et al.]. Le sequenze T2* o altre sequenze sensibili a cataboliti ematici mostrano la siderosi corticale superficiale come un’ipointensità lineare sulla corteccia, ma tale alterazione può essere mimata dalla trasformazione emorragica corticale petecchiale di un infarto. Secondo recenti criteri di ricerca per angiopatia amiloide cerebrale [Linn et al.], la siderosi corticale superficiale viene considerata una manifestazione emorragica dell’angiopatia amiloide, equivalente all’emorragia parenchimale lobare. In tale ambito, viene sottolineata l’opportunità di descrivere la localizzazione della siderosi (in particolare, il numero dei solchi coinvolti e quali lobi siano interessati).
33
2.C.7. Atrofia cerebrale. L’atrofia cerebrale può essere generale or focale (interessando
solo particolari lobi o specifiche aree cerebrali quali l’ippocampo), simmetrica o asimmetrica, o tessuto-selettiva (interessando certi tipi tissutali quali la sostanza bianca) e si riscontra in molte malattie. Le alterazioni patologiche dell’atrofia sono eterogenee e non necessariamente indicative di perdita neuronale [Jack et al., Walters et al., Duning et al.]. L’atrofia cerebrale si verifica anche con il normale processo di invecchiamento, tuttavia la sua entità presenta notevoli variazioni tra un individuo e l’altro. Nel contesto delle malattie cerebrovascolari e della demenza, i substrati neuropatologici dell’atrofia includono perdita neuronale [Bobinski et al.], ispessimento corticale, modificazioni sottocorticali quali diradamento e diminuzione volumetrica della sostanza bianca, arteriolosclerosi, collagenosi venosa e alterazioni neurodegenerative secondarie [Jagust et al.; Black et al.]. Molti studi di imaging riportano un’associazione tra la presenza e l’entità di SVD e atrofia cerebrale, includendo atrofia globale, del corpo calloso, centrale (incremento delle dimensioni ventricolari e atrofia dei gangli della base), mesencefalica, ippocampale, e ispessimento corticale focale in regioni cerebrali connesse a infarti sottocorticali [Appelman et al.; Aribisala et al.]. Pertanto, la valutazione dell’atrofia dovrebbe essere considerata in studi sulla SVD, e viceversa, potendo entrambi contribuire al quadro cognitivo [Mungas et al.; Levy-Cooperman et al.; Carmichaeal et al.]
Definizione STRIVE: nel contesto di SVD, l’atrofia cerebrale al neuroimaging viene definite come una riduzione del volume cerebrale non correlata a specifiche lesioni focali macroscopiche quali trauma o infarto. La perdita tissutale viene desunta dalla dilatazione periferica (sulcale) e centrale (ventricolare) degli spazi liquorali in rapporto ad altre misure quali il volume intracranico. Tuttavia, idealmente, tale assunzione dovrebbe essere formalmente confermata da studi longitudinali. La perdita tissutale da distinte lesioni focali, quali infarti corticali, è di comune riscontro al neuroimaging e