UNIVERSITA’ DEGLI STUDI DI PISA
F
ACOLTÀ DIM
EDICINA EC
HIRURGIAScuola di Specializzazione In
Malattie dell’Apparato Respiratorio
Tesi di Specializzazione
Follow-up perfusorio nei pazienti con
embolia polmonare acuta
Candidato Relatori
Dott.ssa Liliana Villari Prof. Antonio Palla
Dott. Alessandro Celi
2
INDICE
RIASSUNTO………..3
INTRODUZIONE………..6
SCOPO DELLA TESI………..68
MATERIALI E METODI………69 RISULTATI………...72 DISCUSSIONE………..82 CONCLUSIONI………85 BIBLIOGRAFIA………...86
RIASSUNTO
Scopo della presente tesi è stato quello di valutare l’evoluzione della perfusione polmonare e il ruolo dell’estensione dei difetti perfusori residui nel rischio di recidive emboliche in pazienti con diagnosi di embolia polmonare acuta sintomatica.
Mediante un’analisi retrospettiva è stata presa in esame una casistica di pazienti con diagnosi di embolia polmonare acuta sintomatica dall’aprile 2005 al maggio 2010 e in cui fosse disponibile un follow-up scintigrafico di almeno sei mesi, valutati presso la Medicina Nucleare della U.O. Pneumologia e Fisiopatologia Universitaria I dell’Azienda Ospedaliera-Universitaria Pisana. In tutti i pazienti è stata eseguita una lettura in doppio degli esami scintigrafici ai vari tempi e la concordanza tra le due letture è stata analizzata tramite il test kappa. L’eventuale presenza di recidive emboliche è stata diagnosticata sulla base della comparsa di difetti segmentali di perfusione non presenti al controllo precedente.
Nel periodo considerato sono state diagnosticate 374 embolie polmonari sintomatiche di cui 52 (13,90%) mediante angio-TC spirale non seguita da scintigrafia da perfusione, 73 (19,52%) mediante scintigrafia polmonare da perfusione concordante con la probabilità clinica e 249 (66,58%) mediante una combinazione TC-scintigrafia. Di queste, 120 sono state escluse per
4
mancanza di follow-up scintigrafico ad almeno sei mesi dalla diagnosi e 2 pazienti per resezione chirurgica polmonare.
L’analisi si riferisce a 252 pazienti (91 maschi) di età 69 + 15 anni (media+DS) in terapia anticoagulante. L’indice kappa per la concordanza delle letture è stato compreso tra 0,84 e 0,98 ai vari controlli. Il numero dei segmenti non perfusi alla diagnosi ha confermato una distribuzione gaussiana con una media di segmenti non perfusi pari a 5,8. Dopo 6 mesi di terapia, il 50 % dei pazienti non ha più evidenziato difetti di perfusione o solo difetti minimi. Durante il follow-up si sono verificate 16 recidive in tempi successivi ad un mese e, nella maggior parte dei casi, dopo 6 mesi. Se dalla nostra casistica escludiamo i 16 pazienti con recidiva, è possibile osservare che mentre tra il numero dei segmenti non perfusi al basale e a sei mesi vi è una differenza statisticamente significativa (5,8 + 2,8 vs 2,1 + 2; p< 0,0001) non vi è alcuna differenza significativa tra 6 mesi e 12 mesi (1,7 + 1,8) (N.S.; ANOVA).
Il 50% dei soggetti ha presentato difetti residui in numero ≥ 2; dal confronto tra il numero di segmenti non perfusi al basale e il numero di segmenti non perfusi al controllo ad un anno è stato dimostrato che più è altro il numero dei segmenti non perfusi alla diagnosi e maggiore è la possibilità di presentare a 12 mesi difetti perfusori residui ≥ 2.
Inoltre, anche l’età media dei soggetti è risultata significativamente più alta nei pazienti che presentano a 12 mesi difetti perfusori residui ≥ 2.
Dal confronto tra l’ultimo controllo disponibile per i pazienti con recidiva e il controllo a 6 mesi per i soggetti che non hanno recidivato, non sono emerse differenze statisticamente significative in merito al numero dei segmenti non perfusi.
Infine è stato osservato che è possibile individuare un livello di gravità al momento della diagnosi, caratterizzato da un numero di segmenti non perfusi maggiore di 8, al di sopra del quale non aumenta il numero di segmenti non perfusi al controllo ad un anno.
In conclusione a sei mesi dall’evento acuto si osserva una netta significativa riduzione del numero dei segmenti non perfusi che non cambia successivamente in modo significativo. La persistenza di difetti di perfusione non è predittiva per lo sviluppo di recidive emboliche tardive.
6
INTRODUZIONE
L’embolia polmonare è caratterizzata da una ostruzione acuta, cronica o ricorrente di uno o più vasi arteriosi polmonari determinata, generalmente, da coaguli ematici mobili (emboli) derivanti dalla mobilizzazione o frammentazione di coaguli ematici fissi (trombi) situati a livello del sistema venoso profondo dell’organismo (tromboembolia) o, più raramente, da fenomeni di trombosi locale, cardiaca o polmonare autoctona.
Inoltre, nelle embolie non trombotiche, i vasi polmonari possono essere occlusi da materiale estraneo alla normale composizione del sangue quale aria, grasso, frammenti tumorali, liquido amniotico, talco e cemento per artroplastica.
La tromboembolia polmonare è una emergenza medica: è conseguenza della formazione e successivo distacco di un trombo localizzato nelle vene profonde, in genere degli arti inferiori (90%).
I fattori trombofilici che favoriscono il processo emocoagulativo, già individuati da Virchow nel 1859, sono la stasi venosa, l’ipercoagulabilità e le alterazioni della parete vasale.
La stasi venosa viene considerata un fattore che contribuisce al determinismo della malattia, piuttosto che come causa iniziale di trombosi; condizioni che determinano stasi venosa sono lo scompenso cardiaco congestizio, le fratture
ossee, l’anestesia, gli stati post-operatori, la permanenza con le ginocchia piegate (lunghi viaggi in posizione seduta).
Le alterazioni della parete vasale, più importanti sul versante arterioso quali causa di trombosi, possono prodursi a seguito di traumatismi contusivi, fratturativi e non, che interessino gli arti inferiori.
Per quanto riguarda l’ipercoagulabilità, questa può avere cause ereditarie (deficit di fattori del sistema coagulativo) o acquisite (neoplasie, sindrome degli anticorpi antifosfolipidi, trombocitemia essenziale, etc.).
Il distacco del materiale trombotico può realizzarsi essenzialmente per un processo di lisi irregolare ma, in alcuni casi, anche per rottura meccanica. In questo secondo caso, infatti, la porzione libera del trombo, che raggiunge un vaso canalizzato di maggiori dimensioni, può essere frammentata dalla corrente ematica o da stress meccanici di varia natura. Successivamente il frammento embolico, trasportato dal sangue, si arresta per incompatibilità di calibro in un ramo arterioso polmonare. L’ostruzione arteriosa polmonare, insieme al rilascio di fattori vasoattivi da parte delle piastrine, determina un incremento della resistenza vascolare polmonare. Il risultante aumento dello spazio morto alveolare e la redistribuzione del flusso sanguigno compromette gli scambi gassosi, con conseguente ipossiemia, iperventilazione e alcalosi respiratoria. Si realizza, inoltre, riduzione dei volumi polmonari per diminuizione della sintesi del surfactante alveolare e per la ridotta distensibilità della gabbia toracica conseguente alla frequente concomitanza
8
polmonare si può instaurare una condizione di ipertensione polmonare. Quest’ultima è di solito di grado relativamente modesto, con valori generalmente non superiori a circa 40 mmHg, in soggetti con apparato cardiopolmonare integro. Tuttavia, quando l’ostruzione interessa il 70-80 % del circolo polmonare, ad essa consegue una drastica riduzione della portata cardiaca e, conseguentemente, della pressione arteriosa sistemica, fino allo shock cardiogeno (1).
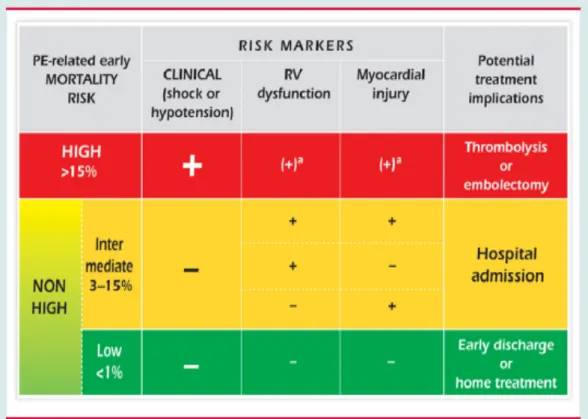
Secondo le ultime linee guida l’embolia polmonare può essere distinta, in base al rischio di mortalità precoce, in alto rischio e in non ad alto rischio. La prima è caratterizzata da shock e/o ipotensione oppure da comparsa di disfunzione ventricolare destra o da danno miocardico ed è un emergenza medica. Il secondo gruppo è ulteriormente suddiviso in “a rischio intermedio”, se presente disfunzione ventricolare destra e/o danno miocardico, e “a basso rischio” se queste due condizioni sono assenti (figura 1) (2).
Figura 1: stratificazione dl rischio in accordo al tasso di mortalità precoce atteso correlato ad embolia polmonare.
EPIDEMIOLOGIA E FATTORI PREDISPONENTI
Dal punto di vista epidemiologico l’embolia polmonare si colloca al terzo posto fra le malattie cardiovascolari acute, dopo l’infarto del miocardio e l’ictus cerebrale (3).Studi su larga scala mostrano un’incidenza globale annua di 60-70 nuovi casi su 100.000 persone (4). Di questi, circa la metà sviluppa
10
degenza, mentre i restanti casi sono equamente divisi fra forme idiopatiche e casi con fattori di rischio noti (5).
Negli Stati Uniti l’incidenza supera l’1 per 1.000 casi all’anno con un tasso di mortalità superiore al 15% entro i primi 3 mesi dalla diagnosi (6).
Nell’area pisana è stata stimata un’incidenza di 100 casi per 100.000 abitanti, con tasso di mortalità a un mese dalla diagnosi dell’11.4%. Questa elevata percentuale è fortemente condizionata dall’elevato tasso di mortalità, pari al 25.2%, che ancora oggi grava sui casi di tromboembolia non tempestivamente diagnosticati, ma che si riduce significativamente fino al 9.2% qualora i tempi diagnostici e terapeutici vengano maggiormente contenuti (7).
Tuttavia, diversi studi, hanno documentato una significativa sottostima, sul piano clinico, della patologia tromboembolica, che sarebbe effettivamente diagnosticata soltanto nel 25% dei casi sottoposti a riscontri necroscopici (8,9). Per quanto riguarda il rischio di recidive di embolia, esso è considerevole, specialmente nelle prime 4-6 settimane (9,10,11), ed è molto superiore senza la terapia anticoagulante: infatti, con un adeguato trattamento anticoagulante, l’incidenza delle recidive, mortali e non, si riduce a meno dell’8% (12).
Tra le possibili complicanze della terapia con anticoagulante orale a lungo termine, l’emorragia è quella più comune, con una incidenza che oscilla tra l’1% e l’8% dei casi trattati (13).
I distretti più frequentemente interessati sono le vie urinarie, il tratto gastroenterico o lo spazio retroperitoneale. Non di rado possono anche aversi sanguinamenti a carico della mucosa nasale e orale. Ancora maggiore è il rischio emorragico con la terapia fibrinolitica, che viene praticata in acuto nelle embolie massive. Potenzialmente letali possono poi risultare i sanguinamenti intracranici (circa l’1% del totale) e quelli retroperitoneali che, tuttavia, si manifestano quasi esclusivamente dopo manovre invasive.
Per quanto riguarda l’eziologia, l’embolia polmonare può essere distinta in idiopatica (40% dei casi) e secondaria (60% dei casi) in relazione rispettivamente all’assenza o alla presenza di fattori predisponesti. I principali fattori predisponenti primari e secondari sono riportati nella tabella I.
12
Tabella I. Fattori predisonenti per le tromboembolie venose. (Modificata1)
A.Primari
Deficit di antitrombina III Deficit di proteina C Disfibrinogenemia congenita Fattore V di Leiden Trombomodulina Deficit di plasminogeno Iperomocisteinemia Displasminogenemia Anticorpi anticardiolipina Deficit di proteina S Eccesso di inibitore Deficit di fattore XII dell’attivatore del plasminogeno
Mutazione 20210° della protrombina
B.Secondari
Traumi/Fratture Chirurgia
Ictus Immobilizzazione Età avanzata Neoplasie/chemioterapia
Cateteri venosi centrali Obesità
Insufficienza venosa cronica Scompenso di cuore Fumo Lunghi viaggi Gravidanza/puerperio Contraccettivi orali Morbo di Crohn Lupus anticoagulant
Sindrome nefrosica Superfici protesiche Iperviscosità ematica
(policitemia, macroglobulinemia di Waldenstrom) Anomalie piastiniche
La predisposizione congenita alla trombosi è considerata una condizione rara anche se la sua vera prevalenza è sconosciuta. Essa dovrebbe esser considerata seriamente in pazienti ben definiti, con storia familiare positiva, che hanno manifestato una trombosi prima dei 40 anni e trombosi venosa profonda o embolie polmonari ricorrenti(1). I più comuni difetti genetici identificati sono: il deficit di antitrombina III, di proteina C, di proteina S, mutazione G20210A della protrombina, fattore V di Leiden (soprattutto in omozigosi), anticorpi antifosfolipidi, lupus anticoagulant, iperomocisteinemia (14,15). Come dimostrato da uno studio prospettico effettuato su 177 pazienti con sospetta embolia polmonare da Giuntini e collaboratori l’età svolge un ruolo importante: l’età media dei pazienti era di circa 60 anni.
L’incidenza di trombosi venosa profonda e di embolia polmonare aumenta con l’età, ma questa relazione può essere il risultato della maggior presenza in età più avanzate di altre malattie, che costituiscono il vero fattore di rischio per la malattia venosa tromboembolica (1), dello stato di ipercoagulabilità, che le persone meno giovani tendono ad avere già in condizioni basali, della tendenza alla stasi venosa per insufficienza vascolare cronica ed infine della scarsa attività fisica (16,17).
Complicanze tromboemboliche sono state riportate nel 30-60% dei pazienti con ictus, nel 5-35% dei soggetti con infarto acuto del miocardio, e in oltre il 12% dei malati con scompenso cardiaco congestizio (1).
14
Per quanto riguarda l’immobilizzazione va ricordato che anche quella di breve durata (una settimana) può predisporre alla malattia venosa tromboembolica (VTE) (1).
L’uso diffuso della profilassi nella chirurgia ortopedica e in quella generale ha notevolmente ridotto l’incidenza di VTE post-chirurgica (1).
La VTE associata con i viaggi è un problema d’attualità, è probabile che lunghi viaggi in aereo siano associati con un aumento del rischio di 2-4 volte (4).
I contraccettivi orali aumentano di tre volte il rischio delle trombosi venose profonde, risultati più recenti hanno fornito prove convincenti che coloro che usano contraccettivi di terza generazione presentano un rischio ancora più elevato (1).
Altri fattori di rischio sono l’obesità, l’ipertensione ed il fumo (18).
Non va poi dimenticato lo stato gravidico. Tre studi, effettuati su un numero elevato di pazienti, hanno fatto rilevare 1-2 embolie polmonari su 7.000 gravidanze, per lo più insorte post-partum, soprattutto in caso di taglio cesareo e preeclampsia (19,20,21).
L’associazione tra trombosi venosa profonda e cancro manifesto è ben documentata ed osservazioni recenti suggeriscono che i soggetti con embolia cosiddetta idiopatica successivamente manifestano nel 10% dei casi una neoplasia maligna (22).
In ordine alla relazione con la patologia tumorale, tale legame non stupisce se si considerano i numerosi fattori procoagulanti che le cellule neoplastiche sono in grado di sintetizzare.
Inoltre la chemioterapia e l’immobilizzazione prolungata, imposte dalla patologia tumorale, contribuiscono ad aumentare tale rischio (22).
Un episodio di tromboembolismo venoso, soprattutto in soggetti senza altri fattori di rischio e/o con episodi ricorrenti, può costituire il primo segnale di una patologia neoplastica in atto che, secondo recenti esperienze, ottiene la conferma clinica ordinariamente entro 6-12 mesi dall’embolismo (23).
FISIOPATOLOGIA
Il verificarsi di un’embolia polmonare acuta conduce a complesse e multifattoriali modificazioni delle funzioni respiratorie e cardiovascolari (Tab. II e III).
16
Tabella II. Conseguenze emodinamiche dell’embolia polmonare (Modificata 1)
A. MODIFICAZIONI DELL’EMODINAMICA POLMONARE
Ipertensione precapillare Ridotto letto vascolare Broncocostrizione
Vasocostrizione arteriolare
Sviluppo di vasi collaterali Anastomosi arteriose broncopolmonari
Shunt polmonari artero-venosi
Modificazioni del flusso Ridistribuzione del flusso sanguigno Ripresa del flusso (lisi, ecc.)
B. MODIFICAZIONI DEL CIRCOLO SISTEMICO E DELLA FUNZIONE
CARDIACA
Ipotensione arteriosa
Tachicardia
Sovraccarico e dilatazione del ventricolo destro Aumento della pressione venosa centrale
Modificazioni geometriche del ventricolo sinistro
C. MODIFICAZIONI DEL CIRCOLO CORONARICO
Ridotto gradiente pressorio Ipotensione aortica transcoronarico Ipertensione atriale destra Flusso ridotto per unità miocardia
Tabella III. Conseguenze respiratorie dell’embolia polmonare (Modificata 1) A. MODIFICAZIONI DELLA DINAMICA RESPIRATORIA
Iperventilazione Ipertensione polmonare Ridotta compliance Atelettasie
Aumentate resistenze Ipocapnia locale delle vie aeree Mediatori chimici
B. MODIFICAZIONI DELLA VENTILAZIONE ALVEOLARE
Iperventilazione alveolare (ipocapnia, alcalosi) o ipoventilazione alveolare relativa
C. MODIFICAZIONI DELLA MECCANICA RESPIRATORIA
Ridotta compliance dinamica Diminuzione del surfactante Atelettasie
Broncocostrizione
D. MODIFICAZIONI DELLA CAPACITA’ DI DIFFUSIONE
Ridotto volume del sangue capillare Ridotta permeabilità di membrana
E. MODIFICAZIONI DEL RAPPORTO VENTILAZIONE/PERFUSIONE
Le conseguenze emodinamiche dell’embolia polmonare acuta, in termini di pressione arteriosa polmonare e sistemica, pressione dell’atrio destro, gettata cardiaca, resistenze ed impedenza vascolare polmonare ed anche di flusso coronario sono il prodotto sia del grado di embolizzazione sia della presenza o dell’assenza di una preesistente patologia cardiopolmonare.
18
Nell’embolia polmonare con compromissione emodinamica, l’aumento del postcarico del ventricolo destro determina un incremento di lavoro e di consumo di ossigeno. L’indice cardiaco diminuisce nonostante la pressione arteriosa sistemica rimanga adeguata, il precarico del ventricolo destro sia immodificato o aumentato e la contrattilità permanga inalterata. A mano a mano che la pressione arteriosa sistemica cala e quella del ventricolo destro aumenta, diminuisce il gradiente pressorio tra l’aorta e il ventricolo destro. L’ischemia miocardica non costituisce l’unica ragione della riduzione della gettata del ventricolo sinistro, che dipende anche dall’inestensibilità del pericardio a fronte della dilatazione del ventricolo destro e dello spostamento verso sinistra del setto interventricolare. L’aumentato postcarico del ventricolo destro secondario all’ostruzione del letto vascolare polmonare determina il deterioramento della funzione ventricolare destra associato alla diminuzione del precarico del ventricolo sinistro. Questo, in combinazione con l’alterata geometria del setto inerventricolare, causa la riduzione dell’indice cardiaco. Probabilmente questa sequenza di eventi è più drammatica nell’embolia polmonare acuta, dal momento che il ventricolo destro non è ipertrofico e quindi meno capace di sostenere l’iniziale aumento del postcarico.
Nell’embolia polmonare acuta l’ipossia può essere secondaria a: a) discrepanza tra ventilazione e perfusione; b) shunt intrapolmonari o intracardiaci dovuti o all’apertura di anastomosi artero-venose polmonari
preesistenrti o alla presenza di un forame ovale pervio; c) ridotta saturazione del sangue venoso misto, secondaria ad una diminuita gettata cardiaca; d) alterata componente di diffusione.
Nella gran parte dei casi questi meccanismi interagiscono e il loro contributo dipende anche dall’eventuale patologia cardiopolmonare sottostante (3). Un’embolia senza infarto polmonare è generalmente la regola, l’infarto infatti si verifica in meno del 10% dei casi (24). L’emorragia alveolare secondaria ad ostruzione delle arterie polmonari distali con normale afflusso di sangue lungo le arterie bronchiali si risolve senza infarto polmonare nella maggior parte dei soggetti ad eccezione di coloro con cardiopatia preesistente in cui la situazione può evolvere in infarto (3).
SOSPETTO CLINICO: PRIMA E FONDAMENTALE TAPPA DELL’ITER DIAGNOSTICO
La formulazione del sospetto clinico è il fondamento su cui si basa l’iter diagnostico.
L’aspecificità e la variabilità della sintomatologia di esordio della tromboembolia non devono rappresentare un ostacolo alla formulazione di un pronto sospetto clinico, a sua volta indispensabile per una tempestiva ipotesi diagnostica che, come documentato dai dati epidemiologici, è il fattore decisivo sul piano prognostico.
20
Va considerato, per quanto riguarda l’aspecificità della sintomatologia, che diverse patologie dell’apparato cardiopolmonare, quali l’infarto miocardio acuto, lo pneumotorace, la dissecazione aortica, possono manifestarsi con quadri sintomatologici assai simili.
Inoltre, la variabilità del quadro clinico è fortemente condizionata dalla diversa gravità dell’impegno vascolare polmonare e dalle condizioni cardiocircolatorie e respiratorie del paziente.
Una volta sollevato il sospetto clinico, questo potrà essere rafforzato o escluso tramite esami strumentali di tipo non invasivo.
Il sospetto clinico è fondato su un’approfondita anamnesi e su un accurato esame obiettivo, attraverso i quali rilevare le condizioni predisponenti, i sintomi e i segni della malattia.
SINTOMI E SEGNI
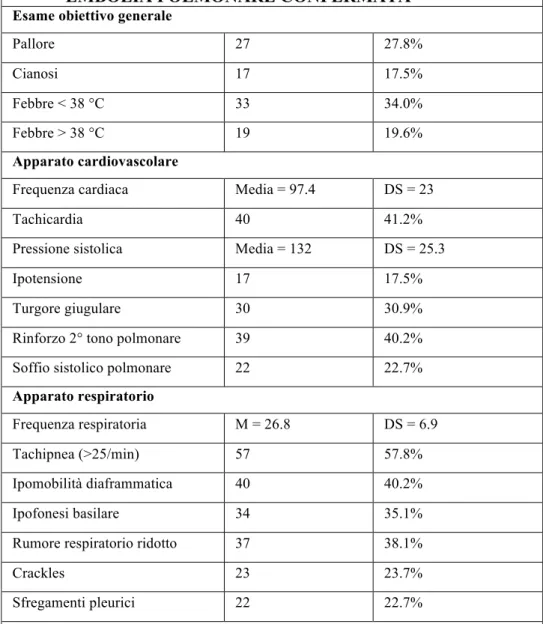
Riguardo ai sintomi e ai segni di embolia polmonare, numerosi studi hanno evidenziato che la dispnea , il dolore toracico e la tachipnea sono i reperti di più frequente riscontro all’anamnesi e all’esame obiettivo di pazienti affetti da questa patologia (tab. IV e tab. V).
Tab.IV MANIFESTAZIONI CLINICHE IN 97 PAZIENTI CONSECUTIVI CON EMBOLIA POLMONARE CONFERMATA
Dolore toracico 63 64.9%
Dolore toracico pleuritico 27 27.8%
Oppressione retrosternale 4 4.7% Dispnea 77 79.4% Dispnea improvvisa 57 58.8% Dispnea ingravescente 20 20.6% Tosse 38 39.2% Emottisi 13 13.4% Sincope 11 11.3% Sudorazione 40 41.2%
Da Palla A, Giuntini C. Guida alla diagnosi e terapia dell’embolia polmonare 24.( Modificata)
In particolare, in uno studio effettuato da Giuntini e collaboratori, è emerso che la dispnea e il dolore toracico sono molto comuni nei soggetti con
22
improvvisa e il dolore toracico di tipo pleurico sono i sintomi più comuni in caso di embolia confermata (59% e 28% rispettivamente) (16).
Quindi anche il dolore di tipo pleurico deve essere considerato, sebbene non costantemente presente, tra i possibili sintomi di embolia polmonare.
All’esame obiettivo condotto da Stein su 215 pazienti senza preesistenti patologie cardiorespiratorie la tachipnea era presente nell’85% dei casi, mentre la tachicardia e l’accentuazione della componente polmonare del secondo tono insieme con la febbre comparivano singolarmente in circa la metà dei pazienti (26).
Per contro, nella casistica di Giuntini, la febbre e la tachipnea sono presenti in circa la metà dei casi, mentre la tachicardia nel 40% dei pazienti (Tab. V). In linea generale, si può dire che la dispnea, la sincope e la cianosi sono elementi di sospetto nelle forme di embolia polmonare di maggior gravità con ostruzioni superiori al 50 % del circolo arterioso polmonare. In questo caso l’esame obiettivo potrà aggiuntivamente evidenziare anche segni di insufficienza acuta del ventricolo destro, quali distensione dei vasi venosi del collo e ritmo di galoppo all’auscultazione cardiaca.
Viceversa il dolore di tipo pleurico e l’emottisi sono spesso conseguenza di embolia polmonare di minore gravità con ostruzioni inferiori al 50% del circolo arterioso polmonare derivanti dall’embolizzazione di segmenti arteriosi distali in prossimità della pleura.
Tab. V SEGNI FISICI IN 97 PAZIENTI CONSECUTIVI CON EMBOLIA POLMONARE CONFERMATA
Esame obiettivo generale
Pallore 27 27.8%
Cianosi 17 17.5%
Febbre < 38 °C 33 34.0%
Febbre > 38 °C 19 19.6%
Apparato cardiovascolare
Frequenza cardiaca Media = 97.4 DS = 23
Tachicardia 40 41.2%
Pressione sistolica Media = 132 DS = 25.3
Ipotensione 17 17.5%
Turgore giugulare 30 30.9%
Rinforzo 2° tono polmonare 39 40.2%
Soffio sistolico polmonare 22 22.7%
Apparato respiratorio
Frequenza respiratoria M = 26.8 DS = 6.9
Tachipnea (>25/min) 57 57.8%
Ipomobilità diaframmatica 40 40.2%
Ipofonesi basilare 34 35.1%
Rumore respiratorio ridotto 37 38.1%
Crackles 23 23.7%
Sfregamenti pleurici 22 22.7%
Da Palla A, Giuntini C. Guida alla diagnosi e alla terapia dell’embolia polmonare (modificata)(25).
Nonostante l’embolia polmonare e la trombosi venosa profonda siano due condizioni strettamente associate, quest’ultima si rileva clinicamente solo in circa 1/3 dei casi.
L’indagine clinica riveste scarsa importanza allo scopo di sospettare la presenza di trombosi venosa profonda: infatti sintomi e segni clinici (Tab. VI) relativi a questa affezione sono presenti solo nel 50% dei casi (27,28). D’altro
24
in assenza di occlusione completa del circolo venoso prossimale o di un’infezione vascolare associata, la trombosi venosa profonda può non determinare alcun sintomo.
Tab. VI SINTOMI E SEGNI SUGGESTIVI DI TROMBOSI
VENOSA PROFONDA.
Dolore spontaneo
Segno di Bauer Dolore provocato
Segno di Homan Edema con o senza fovea
Calore Arrossamento
Circoli venosi collaterali superficiali Phlegmasia alba dolens
Phlegmasia cerulea dolens
Da Palla A, Giuntini C. Guida alla diagnosi e alla terapia dell’embolia polmonare.( Modificata)(29).
Per di più, si tratta di manifestazioni cliniche aspecifiche, che possono evidenziarsi anche a causa di altre patologie (Tab. VII). Ne deriva, quindi, che la diagnosi di trombosi venosa profonda deve necessariamente essere di tipo strumentale.
Tab.VII PRINCIPALI PATOLOGIE CHE MIMANO IL
QUADRO CLINICO DI TROMBOSI VENOSA
PROFONDA
Affezioni muscolo-tendinee ( es.: traumi, ematomi, tendiniti) Affezioni neurologiche (es.: sciatalgie)
Affezioni osteoarticolari (es.: fratture, osteoartriti, sinoviti) Affezioni del circolo linfatico (es.: linfangiti, linfedemi)
Affezioni del circolo arterioso (es.: arteriopatie obliteranti acute, fistole arterovenose)
Affezioni del circolo venoso (es.: flebiti superficiali, sindromi postflebitiche)
Affezioni dei tessuti molli (es.: celluliti, panniculiti) Rotture di cisti poplitee (di Baker)
Da Palla A, Giuntini C. Guida alla diagnosi e alla terapia dell’embolia polmonare. (Modificata)(29).
INDAGINI STRUMENTALI E DI LABORATORIO NELL’EMBOLIA POLMONARE
Una volta che il sospetto clinico di embolia polmonare è stato sollevato, è possibile rafforzarlo o escluderlo del tutto attraverso indagini non invasive e facilmente disponibili come la radiografia del torace, l'elettrocardiogramma, l'emogasanalisi e l’ecocardiografia: con esse si giunge, per così dire, ad un secondo livello di sospetto clinico di embolia polmonare (Tab. VIII e IX).
26 Tab. VIII ESAMI STRUMENTALI Radiografia del torace
Elettrocardiogramma Emogasanalisi
Scintigrafia polmonare da perfusione TC spirale
Angiografia polmonare Ecocardiografia
Ecocolordoppler venoso
ESAMI STRUMENTALI
RADIOGRAFIA DEL TORACE IN DUE PROIEZIONI
Sebbene questa indagine non permetta la diagnosi definitiva di embolia polmonare, essa è comunque di grande utilità per le seguenti motivazioni:
Tab.IX INDAGINI DI LABORATORIO Dosaggio D-dimero
- possibilità di escludere o di evidenziare patologie diverse dall'embolia polmonare, che ne possano simulare la sintomatologia, quali uno pneumotorace, una frattura costale, un tumore endotoracico, una polmonite, un aneurisma dell'aorta (30);
- valutazione dell'evoluzione della patologia sotto terapia anticoagulante tramite correlazione tra segni radiografici, reperti emogasanalitici e scintigrafici (31);
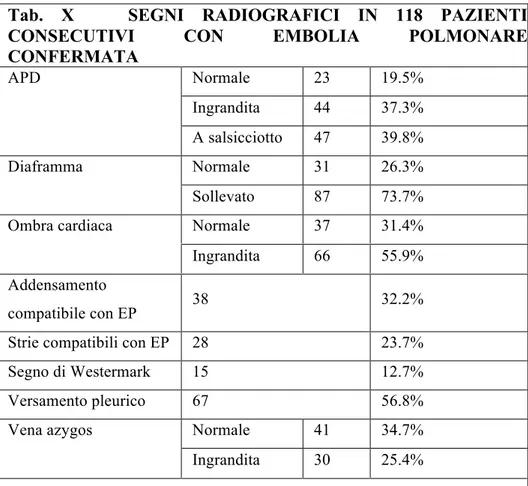
- rafforzamento del sospetto clinico attraverso l'evidenziazione di segni suggestivi di embolia polmonare (EP) purché inquadrati in un contesto clinico adeguato (Tab. X).
Tab. X SEGNI RADIOGRAFICI IN 118 PAZIENTI
CONSECUTIVI CON EMBOLIA POLMONARE
CONFERMATA Normale 23 19.5% Ingrandita 44 37.3% APD A salsicciotto 47 39.8% Normale 31 26.3% Diaframma Sollevato 87 73.7% Normale 37 31.4% Ombra cardiaca Ingrandita 66 55.9% Addensamento compatibile con EP 38 32.2% Strie compatibili con EP 28 23.7% Segno di Westermark 15 12.7% Versamento pleurico 67 56.8% Normale 41 34.7% Vena azygos
Ingrandita 30 25.4%
28
Le modificazioni dell'arteria polmonare discendente (APD) sono espressione dell'occlusione vascolare acuta con esclusione di una parte del letto vascolare dal flusso sanguigno, con conseguente aumento delle resistenze e della pressione in arteria polmonare. Si può sviluppare, quindi, sia un aumento delle dimensioni che una modificazione di forma dell'APD con aspetto a "salsicciotto", segno quest'ultimo di notevole gravità in quanto indice di incuneamento di emboli di grosso calibro nelle sezioni prossimali dell'albero arterioso polmonare (33,34).
L'innalzamento di uno, o più frequentemente, di entrambi gli emidiaframmi sembra essere legato in parte al deficit di surfactante, per la riduzione della perfusione, in parte al dolore toracico, che impedisce una inspirazione profonda. Importante è notare come questo segno si manifesti e scompaia precocemente in corso di EP, generalmente in maniera parallela all'insorgere ed allo scomparire della dispnea e del dolore toracico.
Inoltre esso rappresenta un segno particolarmente suggestivo di EP se associato a strie di atelettasia sovradiaframmatiche o addensamenti tipo infarto polmonare (35,36,37,38).
Un ulteriore reperto è rappresentato dall’ingrandimento dell'ombra cardiaca che interessa prevalentemente le sezioni di destra, anche se non sono rari i casi in cui viene coinvolto il cuore in toto (39). E' comunque un segno di difficile valutazione che richiede un attento confronto con una indagine
radiografica precedente.
Più significativo è, per contro, l'addensamento tipo infarto polmonare. Si tratta di un segno di notevole importanza non solo diagnostica, ma, secondo alcuni autori, anche un buon indice di gravità dell'ostruzione vascolare. Nella valutazione della compatibilità di questo segno con il quadro di EP, bisogna tenere conto di diverse variabili come l'aspetto, la densità, le dimensioni, il numero e la sede dell'addensamento.
In merito all'aspetto si possono distinguere:
- addensamento a forma di tronco di cono con base rivolta verso la superficie pleurica ed apice verso l'ilo polmonare;
- addensamento posto nel seno costo-frenico con superficie maggiore convessa rivolta verso l'ilo (gobba di Hampton),
- addensamento sovradiaframmatico rotondeggiante a contorni sfumati. Il primo aspetto è estremamente raro rispetto agli altri due che sono di più frequente riscontro.
La densità delle opacità è di solito omogenea e dai contorni sfumati.
Inoltre, nelle aree infartuate il broncogramma aereo è estremamente raro, a differenza delle patologie di origine infettiva.
Le dimensioni dell’addensamento possono variare tra i 2 ed i 5 cm.
Per quanto concerne, invece, il numero delle opacità, queste di solito sono multiple.
30
Quindi, riassumendo, l'addensamento tipo infarto polmonare si presenta come una opacità omogenea, dai contorni sfumati con localizzazione nei lobi polmonari inferiori in sede sovradiaframmatica.
Le strie di atelettasia si presentano invece come delle opacità lamellari in genere bilaterali e a sede sovradiaframmatica. Esse sarebbero il risultato della formazione di tappi di muco in bronchi di piccolo calibro o in bronchioli, in seguito alla ridotta ventilazione polmonare, secondaria a diminuita escursione del diaframma; oppure, deriverebbero da modificazioni della tensione alveolare di superficie conseguente alla ridotta produzione di surfactante, in seguito al mancato apporto ematico nella zona a valle dell'embolo.
Infine, un segno particolarmente suggestivo di EP, anche se poco frequente, è il segno di Westermark. E' indice di una riduzione della trama vascolare a valle dell'ostruzione, strettamente correlato alla gravità dell'ostruzione, che si presenta come una zona di iperdiafania (40).
ELETTROCARDIOGRAMMA
Questa indagine evidenzia segni che, per quanto aspecifici, possono essere utili nella diagnosi di EP se inquadrati in un contesto clinico compatibile. Il segno elettrocardiografico più suggestivo è il complesso S1Q3T3 (segno di Mc Gynn & White), indice di sovraccarico ventricolare destro che, sfortunatamente, è però il meno frequente (41) (Tab. XI ).
Tab.XI SEGNI ELETTROCARDIOGRAFICI IN 145 PAZIENTI CONSECUTIVI CON EP CONFERMATA
Aritmia 24 (16.5%)
Tachicardia (>100/min) 64 (44.1%)
Blocco A-V 1° grado 3 (2.0%)
Blocco Branca Destro 19 (13.1%)
P Polmonare 8 (5.5%)
Slivellamento P-R 38 (26.2%)
Deviazione assiale destra 4 (2.7%) Deviazione assiale sinistra 20 (13.7%)
Rotazione oraria 25 (17.2%)
QRS a bassi voltaggi 4 (2.7%)
Onda R" in aVR 52 (35.8%)
Ipertrofia ventricolare destra 8 (5.5%)
R/S inV2<Vl 17 (11.7%) S impastata in VI-V2 54 (37.2%) S1Q3T3 23 (15.8%) S1S2S3 8 (5.5%) Pseudoinfarto 21 (14.4%) Sottoslivellamento S-T 73 (50.3%) OndaT invertita in V1-V2 34 (23.4%) OndaT invertita in D2,D3,aVF 24 (17.1%) Inversione diffusa onda T 15 (10.2%)
Da Palla A. Giuntini C. Guida alla diagnosi e alla terapia dell'embolia polmonare (25).
Al contrario la tachicardia, la depressione del tratto S-T e l’inversione dell’onda T nelle derivazioni precordiali destre, sono i segni che si riscontrano con maggiore frequenza.
Inoltre, gli ultimi due sono quelli associati ad una maggiore gravità della patologia, in quanto più frequenti in pazienti che evidenziano un maggior danno alla scintigrafia da perfusione(42).
Nell’esperienza di Ferrari e coll., condotta su 80 pazienti, tale aspetto elettrocardiografico è stato infatti correlato ad una pressione arteriosa
32
polmonare (PAP) superiore a 30mmHg e a un indice di Miller superiore al 50%,rispettivamente nell’81 e nel 90% dei pazienti (43). Si ricorda che l’indice di Miller è uno score angiografico derivato dalla stima delle dimensioni del difetto di riempimento arterioso polmonare (44).
E' stato anche suggerito da alcuni autori che questi due segni siano dipendenti dall'ipossigenazione del miocardio, poiché presenti anche in corso di ischemia o infarto miocardico acuto. Gli stessi autori ipotizzano che alla base di questi effetti vi sia il rilascio da parte del tessuto polmonare di istamina, mentre altri suggeriscono un possibile ruolo delle catecolamine (45).
Qualunque ne sia la causa, tali anomalie elettrocardiografiche sono molto frequenti e suggeriscono la presenza di embolia polmonare se inquadrate in un contesto clinico coerente con la patologia.
Inoltre la depressione del tratto S-T e l'inversione dell'onda T nelle derivazioni precordiali di destra sono i segni più caratteristici nei casi senza patologia respiratoria preesistente; queste anomalie, specie nelle fasi iniziali, possono creare problemi di diagnosi differenziale nei confronti dell'infarto miocardico inferiore o anterosettale (46,47).
Nei pazienti con patologia cardiorespiratoria di base sono poi frequenti le aritmie sopraventricolari come le extrasistolie e la fibrillazione atriale (48). La comparsa di blocco della branca destra è un segno prezioso ma generalmente fugace.
cardiogeno e/o arresto cardiaco, l'elettrocardiogramma documenta con notevole frequenza una dissociazione elettro-meccanica, consistente nella persistenza di una attività elettrica cardiaca organizzata, ma senza polsi carotidei e femorali palpabili (49).
Importante è ricordare come la sensibilità dell'elettrocardiogramma nella diagnosi di embolia polmonare sia tanto maggiore quanto più precocemente viene registrato il tracciato; la sensibilità aumenta, inoltre, se si considerano segni altrimenti non valutabili come i movimenti di rotazione del complesso QRS individuabili in elettrocardiogrammi seriati (50). Ne deriva che la disponibilità di un tracciato precedente aumenta di molto l'utilità diagnostica di questa metodica. Infatti, secondo l'esperienza di Giuntini e collaboratori, la maggioranza dei pazienti dispone di un tracciato elettrocardiografico eseguito in precedenza che, pertanto, dovrebbe essere sempre richiesto.
In conclusione, l'embolia polmonare deve essere sospettata in tutti quei pazienti in cui i segni elettrocardiografici descritti, anche quelli indicativi di ischemia miocardica in pazienti senza angina pectoris o infarto del miocardio, compaiono per la prima volta o rimangono senza una plausibile spiegazione.
ECOCARDIOGRAFIA
II ruolo di questa indagine nell'iter diagnostico dell'embolia polmonare può essere schematizzato in tre punti fondamentali:
34
-- identificazione di trombi nelle arterie polmonari o nelle cavità cardiache di destra.
- valutazione di tipo morfologico-funzionale delle sezioni cardiache di destra - stima della pressione in arteria polmonare
Per quanto riguarda la valutazione delle sezioni cardiache destre, l’ecocardiogramma è in grado di identificare segni di scompenso cardiaco destro, derivante dall'aumento del post-carico in seguito all'ostruzione da parte di grossi emboli di buona parte del circolo polmonare. Essi sono rappresentati da: appiattimento o spostamento verso sinistra del setto interventricolare, ipocinesia del ventricolo destro e dilatazione delle sezioni cardiache di destra.
Questi segni, se inseriti nel contesto di un adeguato quadro clinico, divengono fortemente indicativi di embolia polmonare.
In condizioni di dilatazione del ventricolo destro, associando la tecnica doppler all'ecografia, è possibile, evidenziare aumenti di pressione nell'arteria polmonare, consentendo anche una diagnosi differenziale con patologie primitivamente cardiache (infarto miocardico destro) o con ipertensione polmonare cronica (51,52,53,54). Bisogna però considerare che queste modificazioni sono apprezzabili solo in condizioni di notevole sovraccarico pressorio destro, ovvero quando emboli di grosse dimensioni occludano più del 50% del letto vascolare polmonare (cuore polmonare acuto).
polmonare o nelle sezioni cardiache di destra. Questo reperto permette di fare diagnosi in assenza di ulteriori indagini, anche se tale evenienza è raramente riscontrata.
Analogamente, l’ecocardiografia permette di diagnosticare trombi nelle cavità cardiache destre o i cosiddetti trombi "in transito", cioè provenienti dalle vene degli arti inferiori e diretti verso le arterie polmonari; essi si presentano in genere allungati e sottili e devono essere trattati in maniera molto pronta e, se necessario, aggressiva (utilizzo di farmaci fìbrinolitici fino alla dissoluzione completa del trombo stesso), per evitare che determinino temibili embolie massive (55,56,57).
La via transesofagea è stata usata nella rianimazione cardiopolmonare (58) e ha una migliore sensibilità nella visualizzazione degli emboli nelle cavità cardiache destre e nelle porzioni prossimali delle arterie polmonari, ma non offre altri vantaggi significativi ed ha il limite di essere un’indagine invasiva (58).
In conclusione, l’ecocardiografia è un’indagine specifica ma scarsamente sensibile che non permette di escludere, quando risulti negativa, la presenza di embolia polmonare.
Tuttavia, questa tecnica, grazie alle sue caratteristiche di non invasività e di pronta disponibilità, può essere utilizzata nella diagnosi differenziale fra l’EP ed altre condizioni patologiche cardiopolmonari e, nei casi di embolia polmonare, per stabilirne la gravità e le ripercussioni sulla funzione
36
evidenziata con l’ecocardiografia nei pazienti con embolia polmonare, è di grande utilità clinica nella valutazione della severità della malattia e della prognosi a lungo termine(56,59,60,61,62).
EMOGASANALISI
Anche i dati emogasanalitici, nonostante la loro aspecifìcità, possono essere utili per rinforzare o escludere il sospetto di embolia polmonare.
Le principali alterazioni riscontrate sono costituite da: abbassamento della tensione arteriosa di 02 (ipossiemia), aumento del pH (alcalosi respiratoria) e
riduzione della tensione arteriosa di C02 (ipocapnia) (31,63,64) (Tab.XII).
Tab.XII VALORI EMOGASANALITICI IN 97 PAZIENTI COSECUTIVI CON EP CONFERMATA
Valori Media Deviazione Standard
PH 7.44 0.05
PaO2 (mmHg) 66.0 13.7
PaO2 std (mmHg) 53.7 16.4
PaCO2 (mmHg) 32.7 4.7
Da Palla A, Giuntini C. Guida alla diagnosi e alla terapia dell’embolia polmonare.( Modificata (25).
Per valutare meglio l'effettiva compromissione dello scambio di ossigeno nell'embolia polmonare, è necessario prendere in considerazione il valore
della Pa02 standard, ossia la tensione di ossigeno che si avrebbe se la tensione di anidride carbonica fosse di 40 mmHg (valore normale). Questo permette di correggere gli effetti dell'iperventilazione presente nei pazienti con embolia polmonare, ottenendo valori di Pa02 inferiori a quelli che si rilevano senza prendere in considerazione il compenso ventilatorio (65).
La Pa02 standard, ha, nell'embolia polmonare, lo stesso significato della differenza alveolo-arteriosa di ossigeno [D(A-a)02], e risulta inferiore a 80 mmHg in oltre il 90% dei pazienti con embolia polmonare, inferiore a 60 mmHg in oltre il 50% dei pazienti ed inferiore a 40 mmHg in circa il 15% dei pazienti (66).
Poiché l'embolizzazione di una parte più o meno estesa dell'albero arterioso polmonare determina in ogni caso un aumento dello spazio morto, si ha un aumento della differenza arterio-alveolare di C02 [D(a-A)C02], benché la PaC02 sia ridotta a causa dell'iperventilazione (67,68,69). Tuttavia, anche l'aumento del gradiente D(a-A)C02, proposto da alcuni autori come
diagnostico di embolia polmonare, non si è dimostrato specifico di questa patologia; anzi lo spazio morto aumenta meno di quanto ci si potrebbe aspettare sulla base del numero di segmenti embolizzati (70).
Questo aumento limitato può essere spiegato sia con la redistribuzione della ventilazione verso le regioni polmonari perfuse, che con l'occlusione non completa dei vasi polmonari embolizzati (71).
38
una espirazione corrispondente al 15% della capacità polmonare totale (72,73). Questo indice presenta alcune caratteristiche interessanti, ma non è stato ancora sufficientemente sperimentato.
In definitiva, è possibile configurare un quadro emogasanalitico caratteristico di embolia polmonare, ma non è possibile individuare alterazioni specifiche di questa malattia. Infatti, né la riduzione della Pa02 standard, né l'aumento della D(a-A)C02 sono specifiche di embolia polmonare, in quanto alterate in altre
patologie acute quali l'infarto miocardico, l'asma cardiaco e l’ARDS.
Non va inoltre dimenticata l’estrema importanza che l’emogasanalisi ha nel valutare, assieme alla scintigrafia da perfusione, l’evoluzione della malattia embolica in funzione del trattamento anticoagulante (31).
SCINTIGRAFIA POLMONARE DA PERFUSIONE
La scintigrafia polmonare consiste in una tecnica non invasiva, di basso costo e largamente disponibile, effettuata tramite l'iniezione endovenosa di macroaggregati di albumina o microsfere marcate con Tc-99m (74,75); queste particelle vanno ad incunearsi nei vasi arteriolari e precapillari polmonari in maniera proporzionale al flusso ematico, fornendo, in questa maniera, un mappa del circolo polmonare (76,77,78).
La quantità di radiofarmaco utilizzata è di circa 60.000 particelle marcate, che occludono transitoriamente 1 su 1.500 arteriole polmonari. Per marcare le
particelle viene utilizzata una dose di 2-4 mCi di Tc-99m. Sul piano tecnico è importante evitare la formazione di coaguli all'interno della siringa in quanto questi potrebbero incorporare gli aggregati radioattivi; il tracciante viene iniettato attraverso una vena antecubitale del braccio, con paziente in posizione seduta, in maniera da riprodurre il gradiente pressorio gravitazionale del circolo polmonare. L'iniezione in una vena centrale, in particolare attraverso cateteri in arteria polmonare, dovrebbe essere evitata, per la possibilità di una distribuzione disomogenea del tracciante (79).
L'utilizzo della scintigrafìa polmonare da perfusione come metodica diagnostica d'urgenza, indipendentemente dalla tecnica usata, presenta caratteristiche di sicurezza, semplicità e rapidità di esecuzione, così come dimostrato da ormai numerose esperienze cliniche. Moser e coll., in una ricerca condotta su 300 pazienti (80), non hanno osservato alcuna forma di tossicità acuta. Quindi, né la microembolizzazione né il potenziale antigenico delle proteine iniettate riducono la sicurezza di tale esame. L'esposizione alle radiazioni, ai massimi livelli di dosaggio utilizzati, non rappresenta una fonte di rischio poiché corrisponde approssimativamente a quattro radiografie del torace (80). La rapidità della tecnica è variabile a seconda dello strumento utilizzato: dai 45 minuti dello scanner lineare, ai 15 minuti della gamma camera planare, che è la tecnica attualmente utilizzata.
L’immagine che si ottiene in condizioni di normalità è rappresentato da una distribuzione omogenea del radiofarmaco secondo un gradiente apice-base
40 quelle superiori ed anteriori.
I criteri che si prendono in considerazione nella diagnosi di embolia polmonare sono fondamentalmente due:
- identificazione di difetti di perfusione che riproducono uno o più segmenti polmonari (difetti di tipo segmentale) oppure una parte di essi (difetti di tipo sub-segmentale);
- inversione del gradiente apice-base (flusso maggiore nelle regioni superiori e anteriori del polmone rispetto a quelle inferiori e posteriori, dove normalmente prevale) con sviluppo di zone iperperfuse (77,81,82).
Gli emboli polmonari, spesso multipli e bilaterali, possono determinare difetti di perfusione di tipo subsegmentale, segmentale o lobare (83). Si definiscono piccoli difetti di perfusione, detti "a morso di topo", quelli che interessano meno del 25% di un segmento polmonare; difetti moderati o subsegmentali, quelli che interessano il 25-75% del segmento; infine i grandi difetti, spesso chiamati segmentali, coinvolgono più del 75% di un segmento. Le dimensioni del difetto di perfusione vengono valutate in base all'area di una regione di ridotta perfusione. Non è infatti necessario che la perfusione sia completamente assente nella sede del difetto: si presume che un embolo che occlude parzialmente un vaso possa dar luogo ad un difetto con perfusione ridotta, ma non assente. Difetti periferici possono essere identificati quando gli emboli sono piccoli, mentre emboli di grosse dimensioni, localizzati in sede centrale, possono interrompere completamente la perfusione di più
segmenti, lobi o addirittura di un intero polmone. Tale classificazione, messa a punto nello studio PIOPED, risulta tuttavia complicata e poco attuabile nella pratica clinica.
In base agli studi del PISA-PED (84,85), prendendo in considerazione i due criteri suddetti (difetti perfusori e inversione gradiente apice-base), è possibile proporre la seguente classificazione:
- quadro normale nessun difetto di perfusione;
- quadro quasi normale difetti non segmentali o che trovano una spiegazione nel quadro radiografico (cardiomegalia, ingrandimento aorta, ili, mediastino; sollevamento del diaframma; obliterazione dei seni costo frenici; etc.);
- quadro anormale compatibile con embolia polmonare difetti perfusori cuneiformi di qualunque dimensione, singoli o multipli; iperperfusione di aree cuneiformi singole o multiple dovute allo spostamento di sangue polmonare dalle regioni non perfuse;
- quadro anormale non compatibile con embolia polmonare difetti multipli o singoli senza aspetto segmentario (cuneiforme); assenza di aree cuneiformi di perfusione forzata (84,85).
L'uso della gamma camera è la tecnica oggi più utilizzata e permette di ottenere otto proiezioni diverse in tempi brevi (15 minuti). Le proiezioni utilizzate sono l'antero-posteriore, la postero-anteriore, la laterale destra, la laterale sinistra, la obliqua posteriore destra e la obliqua posteriore sinistra (45
42
da Mack ed altri nel 1969 (86), ma solo nella metà degli anni '70 sono state introdotte nella pratica clinica grazie all'utilizzo della moderna gamma camera (87,88). Le immagini oblique posteriori, destra e sinistra, permettono una migliore visualizzazione dei segmenti posteriore e laterale dei lobi inferiori, evitando artefatti dovuti al fenomeno dello "shine-through" del polmone controlaterale, frequente nelle proiezioni laterali. Le proiezioni oblique anteriori permettono invece una migliore visualizzazione della lingula (obliqua-anteriore sinistra) e del lobo medio (obliqua-anteriore destra).
In conclusione, la scintigrafia polmonare da perfusione ha un'alta sensibilità ma una specificità variabile, talora non soddisfacente (89,90,91). Infatti, mentre una scintigrafia normale può escludere la diagnosi di embolia polmonare, una significativa minoranza di scintigrafie ad alta probabilità risultano essere falsi positivi (92).
Inoltre un risultato indeterminato è molto comune nei pazienti con malattie cardiopolmonari coesistenti, come la BPCO, e nell’età avanzata (93).
Un modo per aumentare la specificità della scintigrafia polmonare da perfusione è quello di interpretarla sulla base dei dati clinici e strumentali; questo consente di ridurre il numero di falsi positivi che si possono ottenere con questo esame (94,95,85).
SCINTIGRAFIA POLMONARE DA VENTILAZIONE
L'utilizzo della scintigrafia da ventilazione in associazione a quella da perfusione, allo scopo di aumentarne la specificità di indagine, poggia sul principio che la prima dovrebbe risultare normale nelle aree non perfuse, in modo che il "mismatch" V/Q risulti diagnostico. Tuttavia, una tale condizione si verifica, come ampiamente dimostrato dagli studi PIOPED , soltanto nel 13% dei casi. Inoltre, la normalità della ventilazione non è attesa sulla base di studi fisiopatologici (77).
Bisogna considerare infatti che, in alcuni pazienti con embolia polmonare, sono presenti alcune complicanze, come un versamento pleurico o un infarto polmonare, che alterano sia la perfusione che la ventilazione, allo stesso modo in cui lo fanno patologie diverse dall'embolia polmonare come una broncopneumopatia cronica ostruttiva (96,97). In linea generale, le scarse variazioni dello spazio morto alveolare, osservate in corso di embolia polmonare acuta, fanno ritenere che il cosiddetto "mismatch" V/Q sia di scarso rilievo e non certamente tale da consentire la diagnosi (77).
Dal punto di vista tecnico la scintigrafia polmonare da ventilazione si ottiene mediante una singola inalazione da parte del paziente di un gas radioattivo, come lo Xenon 133 o 127, seguita da 20 secondi di apnea e, successivamente, da 45 secondi di respirazione a volume corrente dello stesso gas radioattivo (98). Dopo 3-5 minuti, il paziente raggiunge la fase di equilibrio, seguita da una fase di eliminazione (wash-out), durante la quale egli respira aria
44
dell'ambiente. A questo punto si acquisiscono con gamma camera planare le ulteriori immagini che, in presenza di difetti di ventilazione, possono mostrare aree di ritenzione del gas radioattivo.
I gas radioattivi sono poco maneggevoli e la scintigrafia da ventilazione è di difficile applicazione nei pazienti seriamente compromessi.
Aggiuntivamente è stato osservato che lo studio della ventilazione, non solo non aggiunge specificità alla perfusione nella grande maggioranza dei pazienti, ma può anche determinare una diminuzione della sensibilità della sola scintigrafia da perfusione.
In conclusione, la scintigrafia polmonare da ventilazione trova scarsa applicazione nella diagnosi di embolia polmonare.
TOMOGRAFIA COMPUTERIZZATA SPIRALE
All’inizio degli anni ’90 l’introduzione della tecnologia TC spirale ha notevolmente modificato la possibilità di visualizzazione non invasiva delle arterie polmonari fornendo una visione diretta delle anormalità vascolari e la dimostrazione di eventuali depositi trombotici endoluminali (99).
Nella gran parte dei centri la TC spirale monodetettore viene eseguita con un singolo passaggio del contrasto attraverso il torace (1). Circa il 90% dei pazienti sottoposti ad indagine per un sospetto di embolia polmonare, possono
trattenere il respiro sufficientemente a lungo per mantenere l’acquisizione dei dati durante un singolo atto respiratorio, mentre nei restanti si utilizza una respirazione superficiale. Il volume di polmone analizzato dovrebbe essere sufficientemente ampio da includere i vasi sottosegmentari. Per questo motivo le scansioni topografiche dovrebbero includere un volume polmonare compreso tra la sommità dell’arco aortico e la cupola del diaframma. In gran parte dei centri viene preferita una scansione in senso cranio-caudale. Comunemente, l’acquisizione delle immagini è eseguita con 120 KV, 210-250 mAs, uno spessore degli strati di 3 mm, una velocità di scorrimento del lettino di 5 mm/s, ed un indice di ricostruzione di 2 mm. Il ritardo di scansione ovvero l’intervallo di tempo tra l’iniezione del contrasto e l’acquisizione dei dati dipende dallo stato clinico del paziente. In gran parte di essi, un ritardo di scansione di 15 secondi (s) è sufficiente per permettere un’opacizzazione ottimale dei vasi. Nella maggior parte dei centri si preferiscono agenti di contrasto non ionici e la somministrazione di essi richiede l’utilizzo di un iniettore potente. La TC spirale permette la visualizzazione diretta dell’embolo/i all’interno delle arterie polmonari come aree di minor riempimento dell’interno del vaso, in parte o completamente circondate da sangue opacizzato, o come difetti completi di riempimento che lasciano la porzione distale del vaso totalmente non opacizzato. Errori di interpretazione dell’arteriogamma con TC spirale possono essere secondari ad artefatti dovuti ai movimenti del respiro, che spesso producono aree di
46
vaso. D’altro canto, anche un tessuto perivascolare protrudente può essere confuso con materiale tromboembolico intravascolare e perciò simulare un’embolia polmonare. La TC spirale monodetettore fornisce risultati eccellenti nella localizzazione di emboli situati nelle arterie principali, lobari e segmentarie. Quando l’embolizzazione è limitata ai distretti sottosegmentari o più periferici, la sensibilità della TC spirale sembra essere minore (1). Recentemente, l’avvento della TC multidetettore sembra incrementare la capacità diagnostica di questa metodica permettendo una migliore identificazione dei trombi periferici. Per quanto riguarda la capacità di riconoscere emboli a livello subsegmentario la TC spirale multidetettore supera nettamente la monodetettore, riuscendo ad individuare trombi endoluminali sino alla IV-V ed anche VI diramazione arteriosa polmonare (100).
La TC spirale multidetettore presenta un maggior numero di detettori, una maggiore velocità di rotazione del gantry (0,5-0,4 s) e la possibilità di utilizzare collimazioni più sottili (1,25 mm-1 mm-0,75 mm). Il numero di canali (detettori) ed il tempo di rotazione del gantry determinano il numero di strati che possono essere acquisiti nell’unità di tempo: una TC monodetettore con un tempo di rotazione del gantry di circa 1 secondo può acquisire uno strato/s, mentre una TC multidetettore a sedici canali con un tempo di rotazione di 0,4 secondi riesce ad acquisirne 38 strati/s. La possibilità di poter effettuare numerose acquisizioni al secondo consente di usare collimazioni
più sottili (un mm e anche meno) permettendo una risoluzione d’immagine di tipo isotropico (voxel cuboidali) rispetto a quella anisotropica dei sistemi a singolo detettore (voxel a parallelepipedo), a tutto vantaggio di una maggior risoluzione spaziale, con aumento del dettaglio anatomico. La maggior rapidità di scansione consente inoltre una maggior copertura anatomica in tempi minori (101).
L’accuratezza diagnostica della TC spirale nell’embolia polmonare è stata argomento di dibattito. Inizialmente sono state riportate per la TC spirale nella valutazione dell’embolia polmonare una sensibilità e una specificità molto vicine al 100%, rispetto all’angiografia polmonare considerata il gold standard. Studi più recenti hanno aggiunto ulteriori informazioni e ridimensionato l’accuratezza dello strumento allargando lo spettro della sensibilità e della specificità con la prima stimata tra il 53 e l’89% e la seconda tra il 78 e il 100% (1). In uno studio prospettivo multicentrico effettuato da M. J. L. Van Strijen, W. De Monye, G. J. Kieft et al. (102) in cui sono stati studiati 627 pazienti consecutivi con sospetto clinico di embolia polmonare, la TC spirale monodetettore ha riportato una sensibilità e una specificità di 69% e 84% rispettivamente. Inoltre, la sensibilità della TC spirale è stata dell’86% per embolie polmonari segmentali o più ampie e del 21% nel gruppo di pazienti con embolie polmonari sottosegmentarie. La sensibilità globale della TC spirale per l’embolia è risultata essere troppo bassa per approvare il suo utilizzo come unico test per escludere la presenza
48
scintigrafia polmonare da perfusione anormale la TC spirale non è abbastanza sensibile da essere usata come unico test per escludere la presenza di embolia. Non è quindi possibile utilizzare tale metodica d’indagine come test diagnostico principale nella diagnosi dell’embolia polmonare (102).
ANGIOGRAFIA POLMONARE
L'angiografia polmonare o pneumoangiografia rappresenta il "gold standard" nella diagnostica dell'embolia polmonare (103), tanto che viene presa come punto di riferimento per valutare le altre tecniche di immagine.
Ciò nonostante, anche questa tecnica presenta qualche limite: oltre alla sua invasività, è stato notato che, nella valutazione degli emboli subsegmentali, c’è disaccordo fra gli osservatori fino ad un terzo dei casi (104); inoltre, studi su modelli animali, in cui è stata simulata questa condizione clinica, hanno documentato una sensibilità e un valore predittivo positivo solo di 87-88% in confronto all’esame necroscopico (105).
Inizialmente la sua applicazione era limitata alla valutazione di pazienti con ipertensione polmonare e cuore polmonare, ma, successivamente, a partire dal 1963, è stata utilizzata con maggior frequenza nella diagnosi dell'embolia polmonare (106, 107).
periferica o attraverso un catetere posizionato in atrio destro. Attualmente, l'iniezione del mezzo di contrasto attraverso un catetere centrale in arteria polmonare, anche se più invasiva rispetto alla vecchia procedura, permette una visualizzazione più precisa dell'anatomia vascolare del polmone in quanto riduce la diluizione del mezzo di contrasto stesso (108,109,110). Ovviamente, questo tipo di esame presenta dei limiti legati alla possibilità di complicanze come: reazione febbrile, broncospasmo, shock anafilattico dopo iniezione del mezzo di contrasto, fibrillazione atriale, perforazione cardiaca, shock cardiogeno in pazienti con ipertensione polmonare (108). Si tratta comunque di complicanze rare e quasi sempre superabili con la semplice terapia medica e che risultano mortali eccezionalmente (0.3%). Il limite più importante di questa tecnica, che la rende utilizzabile soltanto in un numero ristretto di casi, è rappresentato dalla scarsa disponibilità, l'elevato costo delle attrezzature ed una certa indaginosità di esecuzione (111). Fra i diversi tipi di cateteri viene utilizzato il pig-tail (112,113). La metodica prevede la disinfezione e l'anestesia locale nella sede di inserzione del catetere (regione antecubitale per la vena brachiale o inguinale destra per la vena femorale) con successivo posizionamento di una guida, all'interno della quale è fatto scorrere il catetere che viene fatto avanzare fino all'atrio di destra. Dopo la misurazione delle pressioni nelle sezioni cardiache di destra e nell'arteria polmonare si procede all'iniezione del mezzo di contrasto (iodato non ionico). La quantità del mezzo di contrasto iniettata può essere modificata in rapporto alla sezione dei
50
delle immagini viene effettuata tramite radiogrammi scattati in rapida successione, invitando il paziente a trattenere il respiro, in proiezione antero-posteriore e, quando possibile, in latero-laterale. I radiogrammi vengono scattati secondo una sequenza prestabilita: 4 radiogrammi al secondo per i primi tre secondi, 2 al secondo per i successivi quattro secondi, uno al secondo per i successivi 10 secondi. Tutto questo favorisce la visualizzazione di entrambe le fasi del circolo polmonare (arteriosa e venosa) (111).Durante la fase arteriosa l'embolo viene visualizzato come brusca interruzione di un ramo arterioso o come difetto di riempimento intraluminale. Un difetto di riempimento intraluminale osservabile in più di una proiezione costituisce l'aspetto più attendibile per la diagnosi di embolia polmonare (114). Se i reperti sono negativi, nonostante il fondato sospetto di embolia polmonare, sono giustificate ulteriori iniezioni superselettive e proiezioni appropriate (115,116).
L'indicazione principale all'esecuzione di una pneumoangiografia per la diagnosi di embolia polmonare è rappresentata da tutti i casi in cui la diagnosi clinico-scintigrafica risulti equivoca o a probabilità non definita o, più precisamente, quando la probabilità clinica di embolia polmonare non sia concordante con quella della scintigrafia perfusionale (85). Nel complesso i casi che richiedono una pneumoangiografia per la diagnosi definitiva di embolia polmonare corrispondono a non più del 15%.
svolgere la angiografia selettiva e la embolectomia con catetere, attuabile già in sala di emodinamica dopo angiografia.
Esistono delle controindicazioni all’esecuzione dell’angiografia polmonare che sono diminuite nel corso degli anni, attualmente non esistono controindicazioni assolute, ma debbono esserne segnalate alcune relative. Esse includono: l’allergia ai mezzi di contrasto contenenti iodio, una funzione renale compromessa, il blocco di branca sinistro, lo scompenso cardiaco congestizio grave e una trombocitopenia importante. L’ipertensione polmonare grave (pressione arteriosa polmonare media >40 mmHg) aumenta il rischio di complicanze; tuttavia riducendo la quantità di contrasto ed aumentandone l’incremento lineare, si rimane entro limiti ragionevoli. Alcuni studi hanno segnalato la sicurezza dell’angiografia polmonare in ampi gruppi di malati con ipertensione polmonare preesistente. Sebbene queste controindicazioni siano relative, esse contribuiscono alla decisione di non eseguire un’angiografia polmonare. Le condizioni generali del paziente, in ogni caso, sono il fattore decisionale più determinante, come è stato dimostrato in due studi in cui l’angiografia non è stata eseguita nel 10-20% dei soggetti, già in lista per l’esame (1).
52
STRATEGIE DIAGNOSTICHE NELL’EMBOLIA POLMONARE
Non esiste al momento attuale un’unica metodica d’indagine, strumentale o non, che abbia un’accuratezza tale da permettere di giungere ad una diagnosi certa di embolia polmonare, per questo motivo nella strategia diagnostica di tale patologia è necessaria un’integrazione tra dati clinici e dati strumentali. A questo proposito sono riportati in letteratura tre modelli di predizione clinica che permetono di stabilire la probabilità di malattia nei pazienti con sospetto clinico di embolia polmonare: il modello di Wells et al. (Hamilton, Canada), il modello di Miniati et al. (Pisa, Italia) e quello di Wicki et al. (Ginevra, Svizzera) (117,118,119). In ciascuno dei tre modelli , la probabilità clinica viene classificata come bassa, intermedia e alta sulla base della presenza o assenza di alcuni parametri.
Per quanto riguarda il modello canadese vengono presi in esame i seguenti parametri:
1. segni e sintomi di trombosi venosa profonda
2. embolia polmonare ugualmente probabile o più probabile rispetto ad una diagnosi alternativa
3. frequenza cardiaca > 100 bpm
4. immobilizzazione o interventi chirurgici
5. pregressa embolia polmonare o pregressa trombosi venosa profonda 6. emottisi
A ciascun parametro viene assegnato un punteggio, il valore numerico ricavato dalla somma di tali punteggi consente di stabilire la probabilità clinica di embolia polmonare (Tab. XIII e Tab. XIV).
Tabella XIII Parametri clinici secondo il modello Canadese
PARAMETRI PUNTEGGIO
Segni e sintomi di embolia polmonare 3 Embolia polmonare ugualmente o più probabile 3 rispetto ad una diagnosi alternativa
Frequenza cardiaca >100 bpm 1.5 Immobilizzazione o interventi chirurgici 1.5 Pregressa embolia polmonare o trombosi venosa profonda 1.5 Emottisi 1 Neoplasie 1
Tabella XIV Probabilità clinica pre-test secondo il modello Canadese
PROBABILITA’ CLINICA BASSA < 2
INTERMEDIA 2 - 6 A LTA > 6
54
.
Nel modello svizzero vengono presi in esame i seguenti parametri e anche in questo caso viene assegnato loro un punteggio (Tab.XV e Tab. XVI):
1. interventi chirurgici recenti 2. pregressa embolia polmonare 3. età avanzata 4. ipocapnia 5. ipossiemia 6. tachicardia 7. strie di atelectasia 8. elevazione emidiaframmatica
Tabella XV Parametri clinici secondo il modello Svizzero
PARAMETRI PUNTEGGIO
Interventi chirurgici recenti 2 Pregressa embolia polmonare o trombosi venosa profonda 2 Età avanzata 2 Ipocapnia 2 Ipossiemia 2 Tachicardia 2 Strie di atelectasia 2 Elevazione emidiaframmatica 2