Master Universitario di II livello Cardiologia Interventistica Cardiovascolare e Strutturale
Anno Accademico
2018/2019
Impianto di valvola transcatetere su
anello chirurgico mitralico per via
transettale con sistema di assistenza
ventricolare.
Autore: Dott. Gabriele Giuliani
Tutor Scientifico Prof. Claudio Passino
Tutor Aziendale – Azienda Osp/Univ. Careggi, Firenze Dott. Francesco Meucci
Indice dei contenuti
Lista delle tabelle e delle figure 2
Introduzione 5
Capitolo 1 - TMRV: Tecnica e materiali 6
1.1 Il sizing ed il planning procedurale 6
1.2 Accesso 8
1.3 Tipi di valvola 8
1.4 Aspetti procedurali 9
1.5 Terapia antitrombotica a lungo termine 10
Capitolo 2 - TMVR: Outcome procedurali ed a lungo termine 11
Capitolo 3 - Caso clinico 13
3.1 Anamnesi 13 3.2 Planning procedurale 13 3.3 Intervento 14 3.4 Follow up 16 Capitolo 4 - Conclusioni 17 Bibliografia 19
Lista delle tabelle e delle figure
Tabella 1. Caratteristiche basali dei pazienti nel registro TMVR31
Tutti (n = 521) ViV (n = 322) ViR (n = 141) ViMAC (n = 58) p-value Età (anni) 72.6 ± 11.9 72.6 ± 12.9 71.7 ± 9.7 74.7 ± 10.8 0.28 Femmine 282 (54.1) 189 (58.7) 52 (36.9) 41 (70.7) <0.001 NYHA III o IV 461 (88.5) 282 (87.6) 126 (89.4) 53 (91.4) 0.66 NYHA IV 167 (32.1) 104 (32.3) 36 (25.5) 27 (46.6) 0.015 STS score (%) 9.0 ± 7.0 9.2 ± 7.2 8.1 ± 6.4 10.1 ± 6.9 0.12 Diabete mellito 124 (23.8) 75 (23.3) 30 (21.3) 19 (32.8) 0.21 Creatinina (mmol/L) 137 ± 114 130 ± 113 145 ± 104 158 ± 139 0.16 Ipertensione 368 (70.6) 224 (69.6) 97 (68.8) 47 (81.0) 0.18 Vasculopatia periferica 59 (11.3) 37 (11.5) 15 (10.6) 7 (12.1) 0.95 Precedente ictus/tia 82 (15.7) 57 (17.7) 17 (12.1) 8 (13.8) 0.28 BPCO 156 (29.9) 92 (28.6) 38 (27.0) 26 (44.8) 0.03 Precedente PCI 94 (18.0) 50 (15.5) 32 (22.7) 12 (20.7) 0.16 Precedente CABG 173 (33.2) 93 (28.9) 69 (48.9) 11 (19.0) <0.001
Precedente infarto miocardico 82 (15.7) 39 (12.1) 36 (25.5) 7 (12.1) 0.001
Reperti ecocardiografici
FEVS (%) 52.6 ± 13.7 55.3 ± 11.5 44.3 ± 15.7 57.7 ± 10.7 <0.001
Gradiente medio mitralico (mmHg) 10.9 ± 5.9 12.1 ± 5.9 7.1 ± 4.8 11.8 ± 4.8 <0.001
Meccanismo di disfunzione
Rigurgito 238 (45.7) 118 (36.6) 109 (77.3) 11 (19.0) <0.001
Stenosi 173 (33.2) 131 (40.7) 9 (6.4) 33 (56.9)
Combinato 110 (21.1) 73 (22.7) 23 (16.3) 14 (24.1)
Tabella 2. Outcome procedurali e clinici nel registro TMVR31
Tutti (n = 521) ViV (n = 322) ViR (n = 141) ViMAC (n = 58) p-value Conversione a chirurgia 12 (2.3) 3 (0.9) 4 (2.8) 5 (8.6) 0.004d Embolizzazione device 9 (1.7) 3 (0.9) 2 (1.4) 4 (6.9) 0.01d
Perforazione del ventricolo sinistro 4 (0.8) 4 (1.2) 0 (0.0) 0 (0.0) 0.58
Impianto di seconda valvola 28 (5.4) 8 (2.5) 17 (12.1) 3 (5.2) <0.001
Ostruzione del TEVS 37 (7.1) 7 (2.2) 7 (5.0) 23 (39.7) <0.001
Successo procedurale 454 (87.1) 304 (94.4) 114 (80.9) 36 (62.1) <0.001
Reintervento 73 (14.0) 35 (10.9) 25 (17.7) 13 (22.4) 0.02
Chiusura di leak paravalvolare 18 (3.5) 7 (2.2) 11 (7.8) 0 (0.0) 0.006
Alcolizzazione del setto IV 10 (1.9) 2 (0.6) 1 (0.7) 7 (12.1) <0.001
Successo del device 402 (77.2) 273 (84.8) 98 (69.5) 31 (53.4) <0.001
Reperti ecocardiografici post-procedurali
FE (%) 51.4 ± 13.7 53.3 ± 12.5 44.4±14.7 58.0 ± 11.5 <0.001
Gradiende medio (mmHg) 6.1 ± 2.9 5.9 ± 2.8 6.7 ± 3.1 5.4 ± 3.1 0.019
Area Valvolare Mitralica (cm2) 2.2 ± 1.0 2.2 ± 1.2 2.0 ± 0.6 2.6 ± 1.1 0.10
Stenosi mitralica 7 (1.3) 3 (0.9) 4 (2.8) 0 (0.0) 0.24
IM > modertata dopo procedura 52 (10.0) 18 (5.6) 26 (18.4) 8 (13.8) <0.001
IM > modertata a 30 giorni 31 (6.6) 10 (3.3) 16 (12.6) 5 (13.2) <0.001 Outcome a 30 giorni All-cause mortality 54 (10.4) 20 (6.2) 14 (9.9) 20 (34.5) <0.001 Stroke 9 (1.9) 7 (2.3) 0 (0.0) 2 (3.9) 0.10 Sanguinamenti Maggiori 20 (4.2) 14 (4.6) 5 (3.9) 1 (1.8) 0.81 Fatali o critici 18 (3.7) 7 (2.3) 9 (6.7) 2 (4.5) 0.07
Complicanze vascolari maggiori 14 (2.8) 5 (1.6) 5 (3.8) 4 (8.0) 0.019
Danno acuto renale (grado 2 o 3) 34 (7.0) 14 (4.6) 13 (9.7) 7 (15.3) 0.006
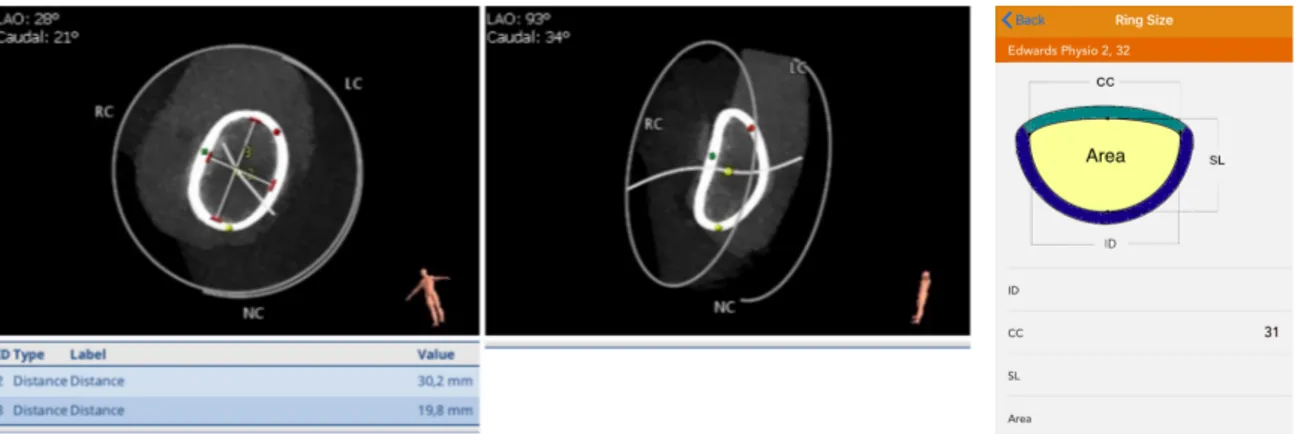
Tabella 3. Misule Misure Carpentier-Edwards Physio II 32
Dimensioni fornite dal produttore Misure TC
Diametro interno (mm) 30.9 S-ID maggiore 30.2 Diametro esterno (mm) 37.1 S-ID minore 19.8 Diametro interno della banda (mm) 32
Area (mm2) 504
Figura 1. TC cuore, rapporti anatomici
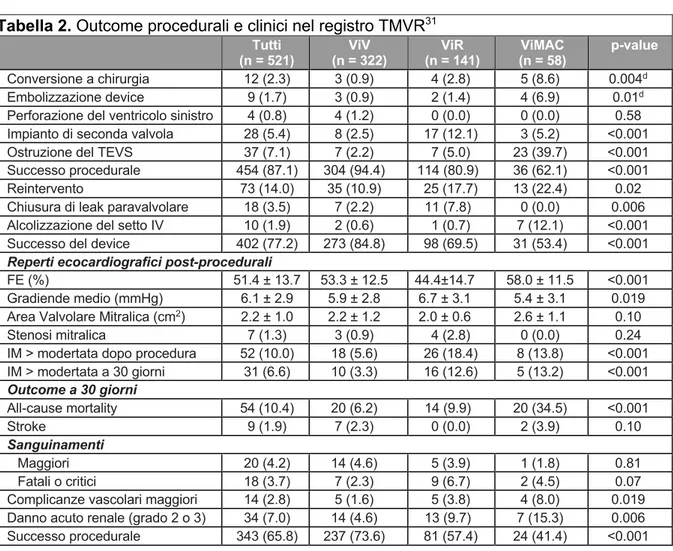
Figura 2. Valutazione strutturale e dimensioni dell’anello Carpentier-Edwards Physio II n 32 mendiante
1
2
3
4
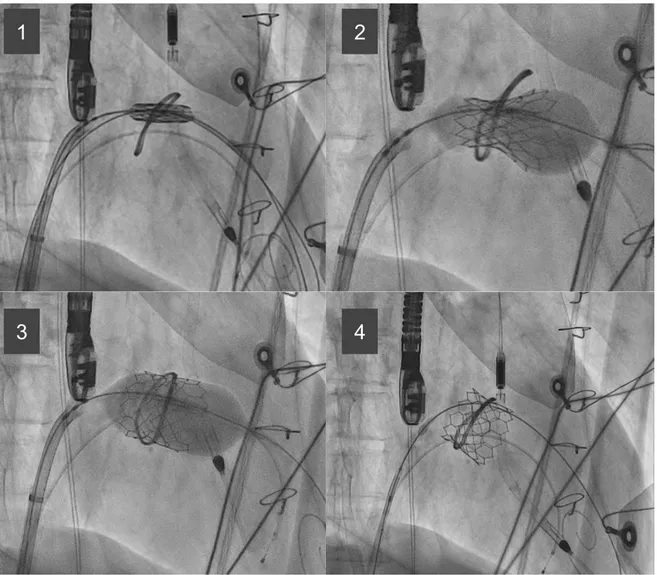
Figura 4. Rilascio valvola Edwards Sapien 3 su anello mitralico
Introduzione
Le malattie della valvola mitralica hanno una prevalenza elevata nella popolazione adulta1 e l’intervento chirurgico di sostituzione o riparazione costituisce il gold standard
del trattamento. Come conseguenza dell’utilizzo sempre più frequente delle valvole biologiche a scapito di quelle meccaniche, e della loro intrinseca deteriorabilità, la durabilità di questi interventi è limitata nel tempo. La degenerazione della bioprotesi infatti è gravata da un tasso di ricorrenza di insufficienza mitralica significativa a 2 anni del 25% e di disfunzione valvolare (stenosi, insufficienza o entrambe) del 44% a 15 anni.2 Fino al 35% dei pazienti sottoposti ad intervento sulla mitrale richiede un
re-intervento (redo) nei primi 10 anni. Tuttavia, in considerazione dell’elevata età media, della presenza di comorbidità e/o fragilità ed i rischi intrinseci al redo la mortalità intraospedaliera può arrivare al 12%.3,4 Oltre ai pazienti con bioprotesi degenerate
anche i pazienti con disfunzione mitralica e severe calcificazioni dell’annulus (mitral annulus calcifications, MAC) sono considerati candidati poco idonei alla chirurgia per fattori anatomici e per l’elevata mortalità intraoperatoria.5
Il recente sviluppo delle terapie transcatetere e la descrizione di nuove tecniche che hanno permesso l’utilizzo delle valvole, inizialmente disegnate per il trattamento della stenosi aortica nativa, nel trattamento delle protesi biologiche degenerate e nella posizione mitralica, costituiscono un’alternativa particolarmente appetibile in questi sottogruppi di pazienti a rischio chirurgico elevato. Negli ultimi anni sono quindi state elaborate procedure, per l’impianto di valvola transcatetere in posizione mitralica (Transcatheter Mitral Valve Replacement, TMVR) nel caso di protesi valvolari degenerate (valve-in-vale, ViV), anuloplastiche con anello fallite (valve-in-ring, ViR) o presenza di severe calcificazioni dell’anello (valve-in-mitral annular calcification, ViMAC).
Nel 2009 Cheung et al.6 hanno descritto il primo caso nell’uomo di impianto
transcatetere di ViV e nel 2011 de Weger et al.7 il primo caso nell’uomo di ViR. Le
esperienze iniziali sono state effettuate per via transapicale. Successivi studi hanno confermato la fattibilità, la sicurezza e l’efficacia di tali procedure contribuendo nella continua evoluzione della tecnica con l’introduzione dell’approccio transettale. Ad oggi centinaia di pazienti con protesi mitraliche biologiche degenerate sono stati trattati in tutto il mondo con l’utilizzo off-label di protesi aortiche transcatetere.
Capitolo 1 - TMRV: Tecnica e materiali
1.1 Il sizing ed il planning procedurale
La valutazione del tipo e dimensioni della protesi transcatetere da impiantare all’interno di una bioprotesi degenerata o di un anello è di fondamentale importanza. Innanzitutto, è necessario ottenere tutte le informazioni riguardo al tipo di protesi e di intervento che sono stati effettuati. Oltre a conoscere esattamente la struttura e le caratteristiche fisiche della bioprotesi devono essere presi in considerazione dei parametri standard della valvola:
- Stent internal diameter (S-ID): indica il diametro interno della struttura metallica della valvola, inclusi gli strati di materiale sovrapposto.
- True internal diameter (T-ID): si riferisce al diametro interno tenendo conto anche dello spessore dei lembi e delle suture all’interno della struttura
- Computed-tomography internal diameter (CT-ID): include anche ogni ulteriore tessuto (panno o calcificazione) accumulato durante il processo di degenerazione della valvola.
Dal momento che i valori riportati sull’etichetta delle valvole chirurgiche non sono standardizzate in quanto non sempre indicative della stessa misura, non possono comunque bastare nella scelta del device.
L’utilizzo integrato delle diverse tecniche di imaging aiuta nella scelta. L’ecocardiogramma transesofageo, oltre a fornire informazioni sulla severità del difetto valvolare può aiutare a capire il meccanismo del difetto incluso, nel caso di un anello, la presenza di leak perianulare coesistente mentre la TAC con mezzo di contrasto è insostituibile nel confermare la struttura, la forma e le dimensioni del device e per guidare la procedura.8
Un certo grado di sovradimensionamento - oversizing - rispetto al diametro interno misurato della protesi è essenziale per garantire l’ancoraggio e la stabilità della valvola dopo il rilascio. Il grado di oversizing non deve comunque essere eccessivo (minimo 1 mm ma generalmente non più di 2-3 mm) per evitare l’incompleta espansione della valvola. Inoltre, nel caso della Edwards Sapien3 (Edwards Lifescience, Irvine, California, US), può essere preso in considerazione un certo grado di sovraespansione - overexpansion - incrementando di pochi ml il volume del pallone per rendere ancora più preciso il sizing. In caso di ulteriore dubbio inoltre, in corso di
procedura, si può confermare il sizing con il pallone con eventuale utilizzo di un test di trazione per confermare l’ancoraggio e valutare la solidità del materiale accumulato all’interno della protesi.
Come guida alla selezione del device può essere utile l’utilizzo della app dedicata “ViV Mitral” (B.V. Mitral Valve in Valve Mitral app, http://www.ubqo.com/vivmitral).9
L’impianto comporta un rischio intrinseco di ostruzione del tratto d’efflusso del ventricolo sinistro (TEVS) per il dislocamento del lembo mitralico anteriore o del lembo protesico. Tale rischio deve essere attentamente valutato durante il planning in quanto non presenta molte opzioni di correzione e può risultare fatale. Ci sono diversi predittori di ostruzione del TEVS tra cui l’ipertrofia del setto, una cavità ventricolare piccola, le bioprotesi con i lembi in pericardio bovino, un angolo aorto-mitralico (l’angolo formato all’intersezione delle linee che passano lungo il diametro intercommissurale dell’anulus mitralico ed il centro dell’anulus aortico) < 135° ed una lunghezza del lembo anteriore mitralico > 30 mm10.
Durante il planning si può individuare e misurare il nuovo tratto di efflusso (neoTEVS), ovvero il tratto d’efflusso residuo tenendo conto dell’ingombro del device e del lembo mitralico anteriore. Esistono software di ricostruzione tridimensionale in grado di simulare il posizionamento della valvola, in modo da visualizzare l’eventuale risultato e misurare direttamente l’area del neo-TESV.11 Studi preliminari suggeriscono che
un’area del neo-TEVS >250 mm2 sia associata ad un basso rischio di ostruzione.10,12
Infine, mentre la selezione della protesi per una ViV è abbastanza semplice, nel caso di un ViR ci sono aspetti peculiari da prendere in considerazione. Ci sono molti tipi di anelli chirurgici in commercio, classificati in termini di flessibilità, geometria e completezza circonferenziale. La TAC è cruciale per analizzare e confermare le caratteristiche strutturali dell’anello. La presenza di un anello completo o incompleto in particolare è un aspetto importante da considerare e la rigidità può comportare un incrementato rischio di leak paravalvolare postprocedurale legato all’incompleto sealing, aspetto che si può minimizzare con un lieve, ulteriore, oversiszing della valvola. Infine, riguardo alla geometria, non c’è consenso sul prendere a riferimento il diametro maggiore, la distanza intercommissurale o l’area, analogamente a ciò che avviene per l’aorta.
1.2 Accesso
Gli interventi di TMVR sono stati inizialmente concepiti utilizzando l’accesso retrogrado per via transapicale. Tale accesso, sebbene garantisca un ottimo controllo del device è tuttavia associato con complicanze maggiori tra cui sanguinamenti in più di un quarto dei pazienti e comporta comunque lunga degenza di minimo una settimana.13-15
L’approccio anterogrado è stato inizialmente effettuato attraverso la via transettale e transatriale da Webb et al.16 ma le difficoltà legate ad ottenere una coassialità della
valvola transcatetere e la bioprotesi hanno fatto ritenere l’approccio transettale come quello migliore. L’approccio transettale è stato sviluppato inizialmente con l’utilizzo di un loop attraverso un introduttore apicale o di tipo veno-arterioso con esternalizzazione a livello dell’arteria femorale.17-19 Purtroppo anche con l’utilizzo di
device di chiusura, la necessità di un accesso transapicale esponeva sempre al rischio di emotorace.20 Nel 2015 Coylewright et al.21 hanno descritto in una serie di casi una
tecnica di impianto mediante singolo accesso transvenoso-transettale, con lo scopo di semplificare la procedura, minimizzare il rischio ed accelerare il recupero del paziente. Recentemente l’approccio transvenoso-transettale, considerato a minor rischio di complicanze e preferito dai pazienti per la minore invasività, sebbene tecnicamente più complesso, ha progressivamente superato quello apicale ed ha mostrato anche un vantaggio in termini di mortalità a 1 anno.22
1.3 Tipi di valvola
Sin dalla pubblicazione del Valve-in-Valve International Data (VIVID) registry23, che
ha mostrato gli ottimi risultati delle procedure valve-in-valve in posizione aortica (sopravvivenza ad un anno 83.2%) l’FDA ha approvato l’estensione di tale indicazione per la valvola balloon-expandable Sapien XT (Edwards Lifescience, Irvine, California, US), e per la autoespandibile CoreValve System (Medtronic, Minneapolis, Minnesota, US).
Anche in posizione mitralica si sono cominciate ad utilizzare le valvole comunemente utilizzate per l’aorta in particolare le Edwards Sapien e le Lotus ma anche Melody (Medtronic, Minneapolis, Minnesota, US), Tiara (Neovasc Inc, Richmond, Canada), Tendyne (Abbott, Abbott Park, IL) e Direct Flow Medical transcatheter valve system (DFM) (Direct Flow Medical Inc, Santa Rosa, CA).
La valvola Sapien 3 (S3) (Edwards Lifesciences, Irvine, CA, USA) è l’ultima valvola approvata per tale indicazione e, grazie alle sue specifiche caratteristiche il suo utilizzo è stato esteso nel 2017 anche per l’utilizzo in protesi biologiche mitraliche degenerate. La presenza della gonnella esterna e la sua capacità di overspansione24 possono
essere caratteristiche ideali per ottenere il sizing ottimale sia in posizione aortica che mitralica.
1.4 Aspetti procedurali
In caso di impianto anterogrado per via transettale la valvola deve essere montata sul pallone al contrario rispetto al convenzionale impianto aortico. Prima dell’impianto è opportuno fare un controllo dell’orientamento (linea verde verso l’atrio).
La puntura transettale, guidata da transesofageo, deve essere effettuata in sede posteriore ed superior per avere un accesso diretto alla valvola mitralica ed una ottimale manovrabilità del device.
C’è da tenere presente che la pressione di chiusura della valvola è la pressione sistolica ventricolare (e non la diastolica aortica, come nel caso dell’impianto in posizione aortica) per cui un ancoraggio forte risulta ancor più fondamentale.
Nel caso dell’impianto su anello, a differenza della valvola che è circolare, la protesi deve essere rilasciata in un corpo asimmetrico per renderlo circolare. Nonostante la teorica limitazione legata alla asimmetricità, alla dimensione e deformabilità dell’anello alcuni lavori hanno dimostrato la fattibilità dell’impianto di valvole transcatetere all’interno di anelli mitralici chirurgici.25
È molto importante inoltre valutare la posizione. In caso di posizionamento troppo basso aumenta il rischio di ostruzione del TEVS ed inoltre questa posizione può indurre malfunzionamento della nuova valvola per mancanza di adeguata contro-pressione, impedendo la chiusura dei lembi con conseguente rigurgito centrale.10 In
caso di posizionamento alto (con ⅔ della protesi all’interno dell’atrio) può invece incrementare il rischio di leak paravalvolare in quanto la gonna di pericardio non aderisce correttamente all’intera superficie dell’anello ed inoltre durante il rilascio ci può essere rischio di embolizzazione durante la sistole ventricolare. Posizionando la valvola al centro dell’anello mitralico, con eguale proporzione di valvola dentro il ventricolo sinistro e dentro l’atrio sinistro il rischio di flaring dei lembi è quasi eliminato ed è molto ridotto il rischio di ostruzione. In questo modo la gonna di pericardio
permette una copertura sufficiente della superficie dell’anello riducendo il rischio di leak paravalvolare.
Nei casi in cui l’anatomia comporti una probabilità significativa di occlusione del TEVS sono state descritte tecniche per ridurre il rischio di tale evento. L’alcolizzazione del setto nei pazienti con ipertrofia settale ha dimostrato di ridurre il rischio di ostruzione del TEVS.26 La lacerazione intenzionale del lembo mitralico anteriore (Laceration of
the anterior mitral valve leaflet to prevent left ventricular outflow tract obstruction - LAMPOON) è una tecnica descritta da Babaliaros et al.27,28 che consiste nel rompere
il lembo mitralica anteriore tirando una guida elettrificata fatta passare attraverso la base del lembo all’interno di due cateteri per via retrograda, verso la punta. La traslocazione del lembo mitralico anteriore con pallone (Balloon assisted translocation of the mitral anterior leaflet - BATMAN)29 è invece una tecnica per via transapicale in
cui si utilizza il pallone per lacerare il lembo.
In questa procedura, come in tutti i casi di valve-in-valve in cui esiste un chiaro marker radiopaco non è necessario l’utilizzo di mezzo di contrasto e la procedura pùò essere effettuato solo con fluoroscopia stando attenti ad ottenere una immagine coplanare della protesi. Nel caso della Sapien 3 c’è da prendere in considerazione l’accorciamento che avviene soprattutto sul versante atriale ed in maniera direttamente proporzionale all’overespansione eventualmente realizzata.
1.5 Terapia antitrombotica a lungo termine
La trombosi su valvola protesica mitralica è un evento multifattoriale che dipende da fattori anatomici, procedurali e farmacologici.30 Si può manifestare in modo subclinico
o manifesto da 24 ore a 2 anni dopo l’impianto ma con incidenza massima nei primi mesi. Esiste quindi la necessità di far seguire all’impianto una terapia antitrombotica. Non esistono indicazioni sul tipo e la durata di terapia. In un registro una trombosi clinica si è manifestata in 10 pazienti del gruppo ViV, in nove dei quali l’intervento era stato fatto su una valvola con lembi porcini, ed un paziente nel gruppo ViR. Ad un anno di follow-up l’incidenza cumulativa di trombosi era significativamente più alta nei pazienti senza terapia anticoagulante rispetto a quelli in terapia anticoagulante.31 Tali
dati suggeriscono l’utilizzo di una terapia anticoagulante almeno nei primi mesi dopo l’intervento, di individualizzare successivamente durante il follow-up.
Capitolo 2 - TMVR: Outcome procedurali ed a lungo termine
Nel 2018 sono stati pubblicati i dati di 66 report che descrivevano 172 pazienti sottoposti a ViV e 35 articoli che descrivevano 73 pazienti sottoposti a ViR. In più della metà dei casi (55.2%) è stato utilizzato accesso transapicale, mentre nel 37.7% dei pazienti è stato utilizzato l’accesso transettale.Sin dai primi report il successo procedurale secondo MVARC è stato più elevato nel ViV (97.1%) rispetto al ViR.
Una importante coorte dei primi pazienti sottoposti ad intervento di ViV è costituita da da 33 pazienti con un follow-up mediano di 723 giorni32. I pazienti avevano un’età
media di 81 ± 6 anni e un Society of Thoracic Surgeons (STS) score medio di 12.2 ± 6.9 %. Anche in questo caso l’accesso è stato transapicale in tutti i casi, il successo procedurale elevato e la mortalità è stata del 9.6 % con un tasso di sanguinamenti maggiori Valve Academic Research Consortium (VARC)-2 del 26.1%. Il follow up a 4.4 anni ha mostrato una sopravvivenza <40%, attribuibile soprattutto all’età avanzata e le elevate comorbidità della popolazione.33 In questa serie inoltre il tasso di trombosi
su valvola era del 6,5%.
Successivamente all’introduzione dell’approccio transettale è stata confermata la fattibilità dell’intervento anche per via anterograda, sebbene con qualche difficoltà tecnica in più. Inizialmente è stato necessario il contemporaneo accesso apicale per esternalizzazione della cui come rail esterno per facilitare l’impianto della valvola. In un report con la valvola MelodyTM (Medtronic, Minneapolis, Minnesota, US) in nove pazienti, due hanno richiesto una toracotomia per emotorace.34 In altre due serie,
rispettivamente di 17 e 4 pazienti, si è dimostrata la fattibilità dell’intervento evitando l’accesso apicale con un successo procedurale dell’82%.21,35L’ultima serie descrive
l’outcome di 48 pazienti in un singolo centro che conta di interventi non solo su bioprotesi degenerate me anche su anello mitralico severamente calcifico (MAC).36 In
questo lavoro gli autori enfatizzano la sicurezza legata all’utilizzo di guide in nitinolo pre-formate, riportando un successo procedurale del 100%, tempi procedurali più corti e meno sanguinamenti maggiori.
Il TMVR registry è ad oggi il più grande registro internazionale, multicentrico, osservazionale che ha raccolto i dati pazienti sottoposti a ViV, ViR e ViMAC in 40 centri Europei e Nordamericani da 2009 al 201831. Gli interventi sono stati effettuati
Sapien XT, and Sapien 3 (Edwards Lifesciences, Irvine, California), Melody (Medtronic, Minneapolis, Minnesota), Lotus (Boston Scientific, Natick, Massachusetts) e Direct Flow (Direct Flow Medical, Santa Rosa, California). Le caratteristiche basali dei pazienti sono mostrati in tabella 1. Nel gruppo ViR c’era un tasso più elevato di insufficienza mitralica, malattia coronaria e una frazione d’eiezione più bassa rispetto agli altri, il che potrebbe riflettere la diversa eziologia dell’insufficienza mitralica, su base ischemica, e quindi la progressione anche dopo la correzione del difetto.
La maggioranza dei pazienti è stata trattata per via transapicale (59.5%) con la valvola Sapien (90.0%).
Il successo procedurale è stato ottenuto nel 87.1% dei pazienti, con un migliore performance nei pazienti sottoposti a ViV, rispetto a ViR e ViMAC (94.4% vs. 80.9% vs. 62.1%; P < 0.001). Le complicanze procedurali sono state molto diverse nei tre gruppi.
La FE post-procedurale è rimasta più bassa nei pazienti ViR e l’insufficienza mitralica moderato-severa dopo l’intervento era più frequente nel ViR rispetto ai gruppi ViMAC e ViV (18.4% vs. 13.8% vs. 5.6%; P < 0.001) e tale differenza permaneva al controllo a 30 giorni, anche dopo chiusura degli eventuali leak paravalvolari. All’interno del gruppo TMVR l’incidenza di insufficienza mitralica moderato-severa residua era maggiore in casi di anelli flessibili, rispetto a quelli semirigidi.
Gli outcome procedurali e clinici sono elencati in tabella 2.
Per quanto riguarda la mortalità a medio-lungo termine mentre, il gruppo ViV ha mostrato ottime performance (mortalità a 30 giorni 6,2%), confermandosi una valida alternativa rispetto al re-do chirurgico, il gruppo ViR ha mostrato una mortalità incrementata sia nel breve che nel medio-lungo periodo. Ciò è probabilmente legato alla maggiore frequenza di complicanze procedurali o alla gravità della malattia sottostante (più frequenti CABG, pregresso infarto miocardico e ridotta FE). Mentre il tasso di mortalità a breve termine (9,9% a 30 giorni) è sovrapponibile a quello di altri studi con pazienti sottoposti a ViR ed a pazienti sottoposti a chirurgia l’elevata mortalità ad 1 anno (30,6%) deve essere interpretata in modo ponderato ma può suggerire un ruolo dell’insufficienza mitralica residua.
Capitolo 3 - Caso clinico
3.1 Anamnesi
Viene presentato caso del Sig. G.A. di anni 72 giunto alla nostra osservazione per episodio di insufficienza respiratoria acuta.
Il paziente presentava una storia di BPCO severa con quadro enfisematoso ed una insufficienza sistolica moderata del ventricolo sinistro conseguente ad una sospetta miocardite in corso di infezione respiratoria. Nel 2017, per il riscontro di una insufficienza mitralica severa da rottura di una corda tendinea, era stato sottoposto ad intervento di plastica mitralica mediante resezione quadrangolare del lembo mitralico posteriore in corrispondenza di P1 ed annuloplastica con anello completo (Carpentier-Edwards Physio II n 32 - (Carpentier-Edwards Lifescience). Pochi mesi dopo l’intervento il paziente lamentava nuovo progressivo peggioramento della dispnea. Ad un controllo cardiologico di routine era emersa un fallimento dell’anuloplastica con recidiva di insufficienza mitralica severa ed una dilatazione del ventricolo sinistro con ulteriore peggioramento della funzione sistolica (FE 20%). In considerazione dell’elevato rischio chirurgico (STS score 13,2%) ed in accordo con la preferenza il paziente era stato inizialmente gestito con la sola terapia medica.
Per il progressivo peggioramento del quadro il paziente è giunto in DEA con insufficienza respiratoria ipossico/ipercapnica. Dopo inquadramento diagnostico è emerso un quadro di riacutizzazione di BPCO complicato da scompenso cardiaco congestizio. Per il persistere di precarie condizioni cliniche il paziente è stato intubato e trasferito in rianimazione. Dopo stabilizzazione mediante terapia medica con antibiotici e diuretici e progressivo divezzamento dall’assistenza respiratoria è stato rivalutato per confermare il vizio valvolare e programmare l’eventuale correzione del difetto mitralico per via percutanea.
3.2 Planning procedurale
Il planning procedurale è stato effettuato attraverso sistemi di imaging multipli.
L’anello del paziente era un Carpentier-Edwards Physio II, un anello rigido, completo, a forma di sella e quindi a rischio di rigurgito paravalvolare.
Non sono emersi evidenti leak perianulari. L’auricola sinistra è risultata libera da materiale trombotico.
La TC cuore ha mostrato arterie coronarie prive di stenosi, un aspetto dilatato del ventricolo sinistro, assenza di formazioni trombotiche in atrio sinistro con auricola libera. L’angolo aorto-mitralico misurava 130° (figura 1).
Integrando i risultati delle metodiche la fattibilità di una riparazione percutanea edge-to-edge risultava estremametnte complessa mentre l’anatomia era ottimale per un intervento di ViR.
È stata effettuata una analisi dettagliata dell’anatomia dell’anello protesico con confronto dei diametri interni tra le misure fornite dal produttore e le immagini TC. Le misure dell’anello protesico (Carpentier-Edwards Physio II n 32) fornite dall’azienda sono state confrontate con quelle misurate alla TC (tabella 3, figura 2).
Sulla base delle misure effettuate è stata scelta una valvola Sapien 3 n 29 (Edwards Lifesciences, Irvine, California, US). Tra i vantaggi di questa scelta è stata considerata la possibilità di utilizzare il sistema di rilascio Commander (Edwards Lifesciences, Irvine, California, US) che permette di orientare la protesi in atrio sinistro, che risulta fondamentale dell’approccio transettale.
Dopo discussione del caso in Heart Team e con i familiari è stato deciso di procedere all’intervento per via transettale.
3.3 Intervento
La procedura è stata effettuata in sedazione generale con posizionamento di tubo orotracheale e sonda transesofagea per il monitoraggio ecografico. È stata effettuata puntura transettale ecogiudata con con catetere Mullins e ago BRK1 (Abbott Vascular, Illinois, US). La puntura è stata effettuata in posizione posteriore alta (altezza 4,2 cm), per garantire un’ottimale manovrabilità ed ottenere migliore coassialità con l’anello mitralico. Posizionato pacemaker temporaneo in ventricolo destro.
In considerazione dell’elevato rischio procedurale legato alla severa disfunzione del ventricolo sinistro è stato scelto di posizionare elettivamente sistema di assistenza ventricolare mediante pompa microassiale Impella CP (Abiomed Europe GmbH, Aachen, Germany) tramite accesso femorale sinistro 14F con preimpianto di due Proglide (Abbott, Illinois, U.S.). L’accesso arterioso è stato effettuato dopo la puntura
transettale per minimizzare il rischio emorragico (figura 3). Dopo adeguata eparinizzazione la pompa è stata impostata con assistenza a 2,5 Lt/min.
Con l’utilizzo di un catetere mammario è stata attraversata la valvola mitralica orientando una guida idrofilica. La fossa ovale è stata pre-dilatata con palloncino 14/40 mm (figura 3). Successivamente l’introduttore è stato avanzato sul catetere fino al ventricolo sinistro. È stato rimosso il catetere e sono state avanzate due guide Safari Small (Boston Scientific, Marlborough, Massachusetts, US) in ventricolo sinistro per ottenere una maggiore stabilità e supporto durante il passaggio del setto interatriale. La valvola Sapien3 n 29 (Edwards Lifesciences, Irvine, California, U.S.) è stata montata in direzione opposta con la gonna verso l’atrio sinistro ed è stata introdotta con il marker “E” rivolto verso il basso in modo che la rotazione oraria del delivery facesse flettere la punta del catetere verso sinistra. Una volta in posizione mitralica la valvola è stata rilasciata in corso di pacing a 180 bpm. Il rilascio è avvenuto correttamente (figura 4).
Al controllo angiografico evidenza di lieve leak paravalvolare per cui è stata effettuata post-dilatazione con il pallone del delivery sovradimensionato con aggiunta di 1 ml. Durante le due fasi di pacing ventricolare ad alta frequenza la portata della pompa è stata massimizzata (funzione Boost) in modo da assistere il circolo in maniera ottimale. L’emodinamica del paziente si è mantenuta stabile durante tutte le fasi della procedura.
Al controllo fluoroscopico ed ecografico finale si evidenziava protesi correttamente posizionata, senza rigurgito significativo; non significativo DIA residuo.
A fine procedura il paziente è stato estubato e rapidamente divezzato dall’assistenza al circolo tanto che è stato possibile rimuovere sistema di assistenza prima dell’uscita dalla sala.
Il decorso post-intervento è stato regolare e non ha presentato complicanze di rilievo. In considerazione del rischio trombotico intrinseco delle protesi in posizione mitralica, per analogia con la prassi chirurgica, in assenza di dati sperimentali a supporto, è deciso di mantenere la terapia anticoagulante con warfarin (target INR 2,5-3,5) per 3 mesi e successivamente mantenere terapia antiaggregante con ASA 100 mg a lungo termine
3.4 Follow up
Nel successivo decorso il paziente è stato bene. È stato ritrasferito all’ospedale di provenienza dove ha iniziato una riabilitazione motoria.
Al follow-up a 10 settimane il paziente è rimasto clinicamente stabile con NYHA II, ha ripreso vita moderatamente attiva, non ha avuto ricoveri per scompenso ed ha significativamente ridotto il dosaggio del diuretico.
Al controllo ecocardiografico persisteva severa disfunzione del ventricolo sinistro (FE 20%), insufficienza mitralica lieve e pressione polmonare sistolica di 45 mmHg. In considerazione della persistenza della disfunzione del ventricolo sinistro è stato programmato impianto di defibrillatore.
Capitolo 4 - Conclusioni
L’intervento di TMVR costituisce una alternativa alla chirurgia nei pazienti affetti da degenerazione di protesi mitralica, fallimento di anuloplastica o valvulopatia in pazienti con anello mitralico calcifico.
Dagli studi osservazionali effettuati l’impianto di valvola mitralica transcatetere permette di ottenere eccellenti risultati in pazienti con bioprotesi mitraliche degenerate mentre i pazienti sottoposti a ViR o ViMAC sono sottoposti ad un maggiore tasso di complicanze e di mortalità a breve ed a lungo termine.
Il planning preprocedurale risulta di enorme importanza in questo tipo di intervento. Tutte le informazioni riguardanti il precedente intervento chirurgico, il tipo di anello utilizzato e la sottostante malattia mitralica insieme ad un approccio di immaging integrato risultano cruciale nella comprensione del meccanismo dell’insufficienza della bioprotesi, nel sizing e nel planning procedurale. Uno degli aspetti da tenere in considerazione è il rischio di occlusione del TEVS, che è un evento potenzialmente fatale, per cui sono state elaborate tecniche di modifica del lembo mitralico anteriore in modo da ridurne l’incidenza.
Recentemente l’approccio transvenoso transettale è emerso come una alternativa meno invasiva rispetto all’accesso transapicale e sebbene più difficoltoso tecnicamente sembra essere preferito dai pazienti. Inoltre dati preliminari di alcuni registri sembrano suggerire un più significativo miglioramento della FE e un vantaggio in termini di mortalità.
Il nostro paziente presentava un elevato rischio chirurgico ed era portatore di un anello semirigido, candidato a ViR. Nei registri i pazienti sottoposti a ViR si sono confermati una popolazione a particolare rischio, perché presentano una frazione d’eiezione basale mediamente più bassa. Questo riflette la diversa eziologia del difetto mitralico di base. Nel nostro caso, considerate le condizioni cliniche, soprattutto la severa riduzione della funzione sistolica, abbiamo ritenuto il paziente ad elevato rischio di instabilità emodinamica durante la procedura e abbiamo optato per un impianto elettivo periprocedurale di assistenza ventricolare mediante pompa Impella CP. Questo device è stato scelto per l’assenza di patologia aortica e quindi la possibilità di assistere direttamente la funzione ventricolare, consentendo un adeguato supporto emodinamico durante manovre invasive che possono comportare la riduzione o la
presenza dell’assistenza ha permesso di mantenere una buona portata cardiaca anche nei momenti più critici della procedura. Subito dopo la procedura il paziente è stato svezzato dall’assistenza emodinamica e respiratoria.
In assenza di indicazioni specifiche ma considerano la più alta frequenza di trombosi in pazienti che non effettuavano l’anticoagulante è stato deciso di iniziare terapia con warfarin per almeno tre mesi.
ll follow-up ad un mese ha confermato i risultati attesi dell’intervento con un miglioramento della sintomatologia e una riduzione della dose del diuretico.
Bibliografia
1. Iung, B. “A Prospective Survey of Patients with Valvular Heart Disease in Europe: The Euro Heart Survey on Valvular Heart Disease.” European Heart Journal, vol. 24, no. 13, 2003, pp. 1231–1243.
2. Mauri L, Foster E, Glower DD, et al. 4-year results of a randomized controlled trial of percutaneous repair versus surgery for mitral regurgitation. J Am Coll Cardiol 2013;62:317–28.
3. Vohra HA, Whistance RN, Roubelakis A, et al. Outcome after redo-mitral valve replacement in adult patients: a 10-year single-centre experience. Interact Cardiovasc Thorac Surg. 2012;14:575–579
4. Bourguignon T, Bouquiaux-Stablo A-L, Loardi C, et al. Very late outcomes for mitral valve replacement with the Carpentier-Edwards pericardial bioprosthesis: 25-year follow-up of 450 implantations. J Thorac Cardiovasc Surg. 2014;148: 2004–2011 5. Papadopoulos N, Dietrich M, Christodoulou T, Moritz A, Doss M. Midterm survival
after decalcification of the mitral annulus. Ann Thorac Surg 2009;87: 1143–1147 6. Cheung A,Webb JG, Wong DR, et al. Transapical transcatheter mitral
valve-in-valve implantation in a human. Ann Thorac Surg. 2009;87: E18–E20
7. de Weger A, Ewe SH, Delgado V, et al. First-in-man implantation of a trans-catheter aortic valve in a mitral annuloplasty ring: novel treatment modality for failed mitral valve repair. Eur J Cardiothorac Surg. 2011;39: 1054–1056
8. Faggioni L, Gabelloni M, Accogli S, et al. Preprocedural planning of transcatheter mitral valve interventions bymultidetector CT: What the radiologist needs to know. European Journal of Radiology Open Volume 5, 2018, Pages 131-140
9. Bapat V. Valve-in-valve apps: why and how they were developed and how to use them. EuroIntervention. 2014;10 suppl U:U44–U51
10. Bapat V, Pirone F, Kapetanakis S, et al. Factors influencing left ventricular outflow tract obstruction following a mitral valve-in-valve or valve-in-ring procedure,part 1. Catheter Cardiovasc Interv 2015:86: 747–60.
11. Kohli K, Wei ZA, Yoganathan AP, et al. Transcatheter Mitral Valve Planning and the Neo-LVOT: Utilization of Virtual Simulation Models and 3D Printing. Curr Treat Options Cardiovasc Med. 2018 Oct 26;20(12):99
12. Khan JM, Rogers T, Babaliaros VC, et al. Predicting Left Ventricular Outflow Tract Obstruction Despite Anterior Mitral Leaflet Resection: The “Skirt NeoLVOT”. JACC Cardiovasc Imaging 2018;11:1356-9
13. Cheung AW, Gurvitch R, Ye J, et al. Trans- catheter transapical mitral valve-in-valve implantations for a failed bioprosthesis: a case series. J Thorac Cardiovasc Surg 2011;141:711–5
14. Seiffert M, Conradi L, Baldus S, et al. Trans- catheter mitral valve-in-valve implantation in patients with degenerated bioprostheses. J Am Coll Cardiol 2012;5:341–9
15. Wilbring M, Alexiou K, Tugtekin SM, et al. Trans- apical transcatheter valve-in-valve implantation for deteriorated mitral valve-in-valve bioprostheses. Ann Thorac Surg 2013;95:111–7
16. Webb JG, Wood DA, Ye J, et al. Transcatheter valve-in-valve implantation for failed bioprosthetic heart valves. Circulation 2010;121: 1848–57
17. Kliger C, Angulo R, Maranan L, et al. Percutaneous complete repair of failed mitral valve prosthesis: simultaneous closure of mitral paravalvular leaks and transcatheter mitral valve implantation—single-centre experience. EuroIntervention 2015;10:1336–45
18. Descoutures F, Himbert D, Maisano F, et al. Transcatheter valve-in-ring implantation after failure of surgical mitral repair. Eur J Cardiothorac Surg 2013;44:e8–15
19. Cullen MW, Cabalka AK, Alli OO, et al. Transvenous, antegrade Melody valve-in-valve implantation for bioprosthetic mitral and tricuspid valve-in-valve dysfunction: a case series in Coylewright et al. 857 Transseptal Mitral Valve Replacement children and adults. J Am Coll Cardiol 2013;6: 598–605
20. Pitta SR, Cabalka AK, Rihal CS. Complications associated with left ventricular puncture. Catheter Cardiovasc Interv 2010;76:993–7
21. Megan Coylewright, MD, MPH,* Allison K. Cabalka, MD,y Joseph A. Malouf, MD et al. Percutaneous Mitral Valve Replacement Using a Transvenous, Transseptal Approach. J Am Coll Cardiol Intv 2015;8:850–7
22. Maxwell, Yael L. “Transseptal Transcatheter Mitral Valve-in-Valve Ups Survival in
High-Risk Patients.” TCTMD.com, TCTMD.com, 27 Sept. 2019,
www.tctmd.com/news/transseptal-transcatheter-mitral-valve-valve-ups-survival-high-risk-patients
23. Dvir D, Webb JG, Bleiziffer S, Pasic M, Waksman R, Kodali S, Barbanti M, Latib A, Schaefer U, Rodes-Cabau J, Treede H, Piazza N, Hildick-Smith D, Himbert D, Walther T, Hengstenberg C, Nissen H, Bekeredjian R, Presbitero P, Ferrari E, Segev A, de Weger A, Windecker S, Moat NE, Napodano M, Wilbring M, Cerillo AG, Brecker S, Tchetche D, Lefevre T, De Marco F, Fiorina C, Petronio AS, Teles RC, Testa L, Laborde JC, Leon MB, Kornowski R; Valve-in-Valve IDRI. Transcatheter aortic valve implantation in failed bioprosthetic surgical valves. JAMA. 2014;312:162–170
24. Shivaraju A, Kodali S, Thilo C, Ott I, Schunkert H, von Scheidt W, Leon MB, Kastrati A, Kasel AM. Overexpansion of the SAPIEN 3 transcatheter heart valve: a feasibility study. JACC Cardiovasc Interv. 2015;8:2041–2043
25. Wang DD, Eng MH, Greenbaum AB, et al. Validating a prediction modeling tool for left ventricular outflow tract (LVOT) obstruction after transcatheter mitral valve replacement (TMVR). Catheterization and Cardiovascular Interventions 2018;92:379-87.
26. Guerrero M, Wang DD, O’Neill W. Percutaneous alcohol septal ablation to acutely reduce left ventricular outflow tract obstruction induced by transcatheter mitral valve replacement. Catheter Cardiovasc Interv 2016;88:e191–97.
27. Babaliaros VC, Greenbaum AB, Khan JM, et al. Intentional Percutaneous Laceration of the Anterior Mitral Leaflet to Prevent Outflow Obstruction During Transcatheter Mitral Valve Replacement: First-in-Human Experience. JACC Cardiovasc Interv 2017;10:798-809
28. Khan JM, Rogers T, Schenke WH, et al. Intentional laceration of the anterior mitral valve leaflet to prevent left ventricular outflow tract obstruction during transcatheter mitral valve replacement. JACC Cardiovasc Interv 2016;9:1835–43
29. Helmy T, Hui DS, Smart S, et al. Balloon assisted translocation of the mitral anterior leaflet to prevent left ventricular outflow obstruction (BATMAN): A novel technique for patients undergoing transcatheter mitral valve replacement. Catheter Cardiovasc Interv. 2019 Sep 13. doi: 10.1002/ccd.28496. [Epub ahead of print] 30. Dangas GD, Weitz JI, Giustino G, Makkar R, Mehran R. Prosthetic heart valve
thrombosis. J Am Coll Cardiol 2016;68:2670–2689
31. Sung-Han Yoon, Brian K. Whisenant, Sabine Bleiziffer, et al. Outcomes of transcatheter mitral valve replacement for degenerated bioprostheses, failed
annuloplasty rings, and mitral annular calcification. European Heart Journal (2019) 40, 441–451
32. Cheung A, Webb JG, Barbanti M, et al. 5-year experience with transcatheter transapical mitral valve-in-valve implantation for bioprosthetic valve dysfunction. J Am Coll Cardiol 2013;61:1759–66.
33. Ye J, Cheung A, Yamashita M, et al. Transcatheter aortic and mitral valve-in-valve implantation for failed surgical bioprosthetic valves: an 8-year single-center experience. JACC Cardiovasc Interv 2015;8:1735–44.
34. Cullen MW, Cabalka AK, Alli OO, et al. Transvenous, antegrade Melody valve-in-valve implantation for bioprosthetic mitral and tricuspid valve-in-valve dysfunction: a case series in children and adults. JACC Cardiovasc Interv 2013;6:598–605.
35. Bouleti C, Fassa AA, Himbert D, et al. Transfemoral implantation of transcatheter heart valves after deterioration of mitral bioprosthesis or previous ring annuloplasty. JACC Cardiovasc Interv 2015;8:83–91.
36. Eleid MF, Cabalka AK, Williams MR, et al. Percutaneous transvenous transseptal transcatheter valve implantation in failed bioprosthetic mitral valves, ring annuloplasty, and severe mitral annular calcification. JACC Cardiovasc Interv 2016;9:1161–74.