INDICE
INTRODUZIONE pag. 2
L’ESOFAGO DI BARRETT COME FATTORE DI RISCHIO PER L’AC ESOFAGEO.
pag. 7
EPIDEMIOLOGIA pag. 11
EZIOPATOGENESI pag. 11
Alterazione dei meccanismi di mucosa pag. 11
Ernia jatale pag. 11
Tipologia del reflusso pag. 15
PATOGENESI pag. 18
DIAGNOSI pag. 20
Endoscopia pag. 21
Giunzione squamo-colonnare pag. 21
Giunzione esofago-gastrica pag. 21
Impronta dello jato pag. 22
Classificazione di Praga per l’Esofago di Barrett pag. 22
Adeguato campionamento bioptico pag. 23
IPOTESI MOLECOLARI SULL’EVOLUZIONE DELL’ESOFAGO DI BARRETT
pag. 24
GLUTATIONE S-TRANSFERASI OMEGA (GST-ΩΩΩΩ) pag. 34
Considerazioni generali su GST-Omega pag. 34
Caratteristiche funzionali della classe GST-Omega pag. 37
STUDIO CLINICO pag. 41
SCOPO DELLA TESI pag. 42
MATERIALI E METODI pag. 43
Pazienti pag. 43
Clonazione e sequenziamento del cDNA di GST-O umano pag. 45 Espressione di GST-O1 nelle cellule batteriche e purificazione
della proteina ricombinante
pag. 46
Preparazione del siero policlonale pag. 47
Estrazione di RNA e RT-PCR pag. 47
Elettroforesi con gel di sodio e dodecilsulfato-poliacrilamide e immunoblotting pag. 48 Statistica pag. 48 RISULTATI pag. 49 DISCUSSIONE pag. 51 BIBLIOGRAFIA pag. 53
INTRODUZIONE
L’adenocarcinoma esofageo (AC) è una neoplasia che si riscontra a livello del terzo distale dell’esofago ed è caratterizzata da una prognosi infausta al momento della diagnosi in quanto, al momento dell’insorgenza della sintomatologia, il paziente si trova in uno stadio già avanzato di malattia.
Questa neoplasia esordisce con una disfagia ingravescente che solitamente è segno di un interessamento dell’intero spessore della parete esofagea.
Quando viene diagnosticato un AC a seguito di tale sintomatologia non è già più possibile effettuare una cura radicale e la sopravvivenza a 5 anni è ridotta al 10% [1].
Il paziente presenta anche un marcato calo ponderale ed alla disfagia possono accompagnarsi anche odinofagia, dolore toracico retrosternale e sintomi respiratori dovuti a rigurgito e/o polmonite ab ingestis.
L’AC inoltre infiltra rapidamente le strutture contigue causando disfonia per infiltrazione del nervo laringeo ricorrente, l’infiltrazione della trachea può creare pericolose fistole tracheo-esofagee mentre l’infiltrazione dell’aorta può causare emorragie anche fatali.
La lesione precancerosa per eccellenza dell’adenocarcinoma esofageo è la metaplasia di tipo intestinale che si sviluppa a livello della giunzione squamo-colonnare dell’esofago nota con il nome di Esofago di Barrett.
Fattori di rischio dell’adenocarcinoma esofageo
L’AC è una neoplasia che epidemiologicamente non contempla una larga diffusione. Basti pensare ai dati riguardanti l’incidenza di cancro dell’esofago negli USA nel 2001 i quali riportano 13.200 nuovi casi di
tumore esofageo (considerando che nel computo complessivo rientrano anche i dati riferiti al carcinoma squamoso) e confrontarli con i dati riguardanti l’incidenza di altre importanti neoplasie quali il cancro colorettale, il cancro del polmone e il tumore della mammella: questi riconoscono rispettivamente un’incidenza di 135.400, 169.500 e 193.700 nuovi casi negli USA, sempre nel 2001, [2] numeri ben più significativi.
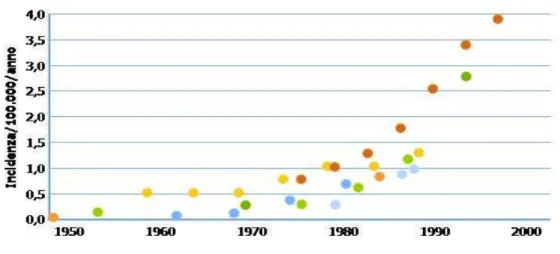
Tuttavia ciò che porta alla ribalta l’importanza del problema “AC esofageo” è il preoccupante aumento del suo tasso d’incidenza annuo il quale ha cominciato a crescere a partire dagli anni ’70 fino ad aumentare del 350% verso la metà degli anni ’90 (rilievi epidemiologici provenienti dagli USA: incidenza annuale di AC esofageo tra il 1974 e 1976: 0,7/100.000 per anno; tra il 1992 e 1994 : 3,2/100.000 per anno; mentre la stima del 2001 è 3,7/100.000 per anno. [3,4])
Rilievi simili si osservano anche in altri paesi occidentali quali Danimarca, Gran Bretagna, Svizzera e Norvegia. [5-7]
Figura 1: incidenza dell’adenocarcinoma dell’esofago dal 1950
al 2000 (confronto studi USA-Europa)
Sebbene numerosi studi epidemiologici abbiano individuato una varietà di fattori di rischio per lo sviluppo di AC la reale ragione dell’aumento dell’incidenza di questo tumore nella popolazione rimane sconosciuta.
Tra i fattori di rischio sono stati presi in considerazione la malattia da reflusso gastroesofageo (MRGE, in particolare la durata, la frequenza e la severità dei sintomi da reflusso hanno un rapporto direttamente proporzionale col rischio d’insorgenza del tumore), l’obesità, le abitudini alimentari (dieta povera di frutta e verdura fresche), l’abitudine al fumo, il sesso maschile, la razza caucasica e l’esofago di Barrett.
Mentre, al contrario, pare che l’infezione da Helicobacter pylori (H.
pylori), specialmente dei ceppi che esprimono la proteina CagA, possa
proteggere contro lo sviluppo di AC esofageo, anche se tali dati sono ancora contraddittori.
Tra tutti questi fattori quelli realmente accertati per il momento risultano essere la razza, il sesso, la MRGE e, in particolare, l’esofago di Barrett (EB), quest’ultimo posto chiaramente in associazione con l’AC esofageo tanto che alcuni studi lo considerano come lesione precancerosa anche in seguito al parallelo, emerso da dati di studi biomolecolari, tra metaplasia di Barrett e metaplasia vaginale. [8]
Figura 2: incidenza di AC in pazienti con Esofago di Barrett
(casistica USA).
Inoltre si può affermare che l’aumento di incidenza di AC esofageo nelle ultime tre decadi in Paesi occidentali probabilmente riflette il franco
aumento dell’incidenza della metaplasia di Barrett avvenuta nel solito tempo e nei soliti luoghi. [9]
Bisogna chiarire che la lesione che caratterizza l’EB è provocata da insulti esterni che vanno a danneggiare ripetutamente le cellule della mucosa esofagea, perciò chi presenta un EB è spesso passato attraverso una lunga storia di MRGE, con lunga esposizione all’azione di succhi gastrici e acidi biliari.
Non tutti coloro che presentano MRGE, però, sviluppano un EB e le ragioni sono ancora poco chiare.
Un’ultima notazione sull’aumento significativo dell’incidenza di AC è da riferirsi ad un probabile “artefatto” dovuto ad un cambiamento dei criteri per la classificazione “topografica” dei tumori esofagei: una volta, infatti, i tumori della giunzione esofago-gastrica erano classificati come tumori dello stomaco, oggi invece questi vengono considerati tumori esofagei. Se così fosse però, bisognerebbe aspettarsi accanto all’incremento dei tumori esofagei una concomitante diminuzione dell’incidenza sia dei tumori della giunzione esofago gastrica che dei tumori del cardias, che peraltro presenta invece un’incidenza aumentata. [6,10]
Comunque al di là di tutte le ipotesi finora menzionate si vuole porre attenzione alla possibilità di una diagnosi precoce dell’AC esofageo date le povere prospettive prognostiche al momento della diagnosi di malattia conclamata.
Per il malato non esistono ancora valutazioni effettive che testimonino la reale efficacia di un trattamento terapeutico effettuato in fase precoce, sebbene si sia comunque dimostrato che lesioni identificate durante programmi di sorveglianza endoscopica hanno una prognosi migliore.
Per questo motivo è emerso un rinnovato interesse da parte della ricerca per capire più a fondo le modificazioni biomolecolari che spiegherebbero l’evoluzione dall’ EB, attraverso un percorso di
carcinogenesi che si sviluppa attraverso gradi sempre più severi di displasia, all’AC esofageo per attuare di conseguenza strategie di prevenzione nei confronti dell’EB. [11]
L’ESOFAGO DI BARRETT COME FATTORE DI RISCHIO PER L’AC ESOFAGEO
.
L’esofago di Barrett (EB) è una metaplasia caratterizzata dalla sostituzione a livello della porzione terminale dell’esofago del normale epitelio squamoso stratificato con epitelio colonnare di tipo intestinale specializzato contenente “globet cells”. [12]
La definizione di EB è ad oggi molto dibattuta. Tale denominazione deriva dalla descrizione fatta nel 1950 dal chirurgo inglese Norman Barrett di lesioni ulcero-infiammatorie dell’esofago distale da lui erroneamente considerate come insorte su mucosa gastrica attirata in torace a causa di un esofago “corto” congenito. L’aspetto istologico dell’EB venne chiarito solo più tardi nel 1976 da Paull che descrisse 3 differenti tipi istologici di metaplasia. Per anni si è ritenuto EB qualsiasi tipo di metaplasia colonnare (includendo anche la metaplasia di tipo gastrico cardiale e quella di tipo gastrico fundico) con lunghezza all’endoscopia superiore a 3 cm.
Attualmente si considera EB un’ alterazione endoscopicamente visibile della giunzione squamocolonnare di qualunque lunghezza. La diagnosi deve essere confermata istologicamente dalla presenza di epitelio intestinale specializzato con goblet cells. E’ in uso nella pratica clinica utilizzare la definizione di Long Segment Barrett Esophagus (LSBE) se la metaplasia ha lunghezza superiore a 3 cm e di Short Segment Barrett Esophagus (SSBE) se è inferiore a 3 cm [13].
Tale lesione, strettamente correlata alla malattia da reflusso gastro-esofageo, è oggi oggetto importante di studio in quanto è ritenuta la lesione precancerosa dell’adenocarcinoma (AC) dell’esofago. [14]
EPIDEMIOLOGIA
La frequenza dell’EB varia a seconda delle aree considerate e degli autori. E’ probabile che tali differenze siano attribuibili al tipo di popolazione esaminata, al tipo di studio (prospettico o retrospettivo) e alla possibile non uniformità nella definizione della patologia stessa sia per quanto riguarda l’estensione che per l’aspetto endoscopico della lesione.
La prevalenza, secondo i più importanti studi riportati in letteratura, varia fra 0,2 ed il 2%. [15-17]
Uno studio autoptico condotto da Cameron alla Mayo Clinic (Olmsted County), aveva riscontrato EB in 7/733 casi consecutivi dimostrando che la presenza della patologia era circa 20 volte superiore a quella osservata nella stessa area geografica e nello stesso periodo all’esame endoscopico in soggetti con sintomi da reflusso. Questi dati suggeriscono che EB è largamente sottodiagnosticato: per ogni caso scoperto ne esistono almeno 20 non riconosciuti nella popolazione [16].
Il rapporto maschi/femmine è 2:1 e può essere anche superiore nell’adolescenza. [17,18] La distribuzione per età mostra che in pazienti sottoposti ad endoscopia la prevalenza dell’EB aumenta con l’età anche se l’età media della diagnosi si aggira attorno ai 40 anni. [19]
L’unico studio italiano sulla prevalenza dell’EB è quello condotto dal GOSPE (Gruppo Operativo per lo Studio delle Precancerosi Esofagee) che ha esaminato nel periodo fra il 1987 ed il 1989 circa 14898 pazienti con sintomi riconducibili al tratto digestivo superiore, dimostrando un tasso di prevalenza globale di EB (di 3 o più cm) dello 0,7% [17] (Tabella 1).
La differenza fra la prevalenza clinica e quella autoptica non è ancora del tutto chiarita, anche se è ipotizzabile la possibilità di errori al campionamento bioptico durante l’esame ed è in parte imputabile alla presenza di un numero elevato di pazienti asintomatici tra i portatori di EB (circa il 30%).
Tabella 1: prevalenza dell’EB in pazienti sottoposti ad endoscopia
AUTORE
N° pazienti
RGE EB Prevalenza sulla popolazione (%) Prevalenza su RGE (%) Ovaska 1989 12499 134 32 0,2 23,8 GOSPE 1991 14848 8908 111 0,7 1,2 Cameron 1992 513 11 377 0,7 ---- Lieberman 1997 2641 701 77 2,9 10,9
Una differenza statisticamente significativa è stata osservata, infatti, fra i pazienti con EB che presentavano bruciore (8/100) rispetto ai soggetti con altro tipo di sintomatologia (0,3/100) [19].
Importante è anche l’influenza dei fattori genetici nell’insorgenza dell’ EB. Sono state riportate in letteratura oltre 10 famiglie con EB e/o adenocarcinoma esofageo. [20,21] Una predisposizione autosomica dominante potrebbe causare la malattia da reflusso. [22] La prevalenza dei sintomi da reflusso nei familiari dei pazienti con EB è 2,2-4,8 volte maggiore rispetto ai controlli. Inoltre i parenti sintomatici di pazienti con EB hanno una probabilità doppia di avere la metaplasia rispetto ad altri soggetti con reflusso.
Cameron e collaboratori hanno recentemente riportato che l’aumento di concordanza per il reflusso nei gemelli monozigoti, rispetto a quelli dizigoti, indica la presenza di fattori genetici, più che l’influenza di fattori ambientali condivisi. In questo gruppo l’ereditarietà era responsabile del 31% del rischio di malattia da reflusso. [23]
Uno studio caso-controllo in pazienti con EB, esofagite e controlli sani ha evidenziato un aumento di rischio per EB nei soggetti con sintomi da reflusso di lunga durata (da più di 13 anni), ernia jatale ed elevato consumo di superalcolici.
L’importanza della diagnosi di EB ha assunto maggiore rilevanza in base all’osservazione delle potenzialità evolutive in senso neoplastico della patologia, la cui incidenza è notevolmente aumentata negli ultimi 40 anni nei paesi occidentali. In Italia si stima che vengano annualmente diagnosticati circa 2000 nuovi casi di tumori dell’esofago fra cui 350-600 sono AC.
Gli studi istologici dei pazienti con EB suggeriscono la presenza di una progressione di malattia dalla metaplasia specializzata a displasia di grado progressivamente maggiore fino allo sviluppo di adenocarcinomi a livello della giunzione esofago-gastrica (GEG).
L’unico studio italiano che ha valutato l’incidenza dell’adenocarcinoma nell’EB è ancora del GOSPE che tra il novembre del 1987 e il giugno del 1995 ha arruolato 344 pazienti con EB, di cui 187 hanno seguito un periodo di follow-up di almeno 36 mesi; i risultati hanno evidenziato un incidenza di adenocarcinoma esofageo di 1/187 pazienti-anno [24] (Tabella 2).
I pazienti con EB hanno un rischio di sviluppare AC esofageo 30-125 volte superiore rispetto alla popolazione generale. [25,26]
L’AC esofageo è associato al reflusso cronico gastro-esofageo (aumento del rischio di 8 volte nei pazienti con sintomi da reflusso e di 43 volte nei soggetti con malattia da reflusso severa di durata superiore ai 20 anni).
Nelle ultime tre decadi è stato osservato un aumento reale dell’AC esofageo. L’importanza clinica della diagnosi precoce in questa neoplasia risiede nel fatto che essa è gravata da un’elevatissima mortalità: solo il 3% dei pazienti sopravvive a 5 anni dalla diagnosi rispetto, per esempio al carcinoma dello stomaco o del colon, che pur essendo in proporzione più frequenti hanno rispettivamente una percentuale di sopravvivenza a 5 anni superiore al 30% e al 50%.
EZIOPATOGENESI
Alterazione dei meccanismi di difesa
L’EB è una condizione acquisita associata direttamente alla presenza di una continua esposizione dell’epitelio esofageo a noxae lesive che nel tempo prevalgono sui meccanismi di difesa dell’esofago causando le modificazioni dell’epitelio.
Il più importante fattore di rischio per lo sviluppo di EB sembra essere rappresentato dalla malattia da reflusso gastro-esofageo (MRGE) [27].
Comunque, rimane tutt’ora non chiarito il motivo del perché solo alcuni pazienti affetti da malattia da reflusso gastro-esofageo sviluppano esofago di Barrett ed altri no.
Studi effettuati su animali dimostrano che l’escissione della mucosa esofagea e la conseguente esposizione a stimoli acidi e/o di acido e bile assieme (reflusso misto) favoriscono la riepitelizzazione dell’esofago con epitelio di tipo colonnare; nel caso invece in cui non sia stato applicato lo stesso tipo di stimolazione, l’epitelio esofageo riepitelizza con mucosa di tipo squamoso [28,29].
Ernia jatale
L’importanza dell’ernia jatale nella malattia da reflusso gastroesofageo (MRGE) è indubbia. La prevalenza dell’ernia nella popolazione generale cresce sensibilmente con l’età, tanto che oltre i 50 anni circa il 70% della popolazione ne è portatore. In passato si riteneva che il suo ruolo nella MRGE fosse solo marginale.
Studi recenti hanno dimostrato il ruolo esercitato dall’anello crurale diaframmatico sulla competenza della giunzione gastro-esofagea.
cruciale nella MRGE.
Il reflusso gastro-esofageo si realizza con due meccanismi principali: a)in presenza dei rilasciamenti transitori dello sfintere esofageo inferiore (SEI), che sono preceduti da periodi di normale pressione del SEI;
b)durante bruschi e intensi aumenti della pressione addominale che superino la capacità di contenimento di un SEI ipoteso.
Studi recenti di fisiologia hanno proposto “l’ipotesi dei due sfinteri” secondo la quale sia le fibre muscolari lisce del SEI che il diaframma crurale che lo circonda esercitano una sinergica azione di contenimento sul reflusso [30,31].
Secondo questa ipotesi, se l’ernia jatale altera la funzione dello sfintere diaframmatico e se quest’ultimo è importante nel ridurre il numero dei reflussi, la presenza dell’ernia potrebbe aumentare la suscettibilità individuale al reflusso. Nei pazienti con ernia jatale, a prescindere dal fatto che essi abbiano o meno un SEI ipoteso, si osserva un incremento del numero degli episodi di reflusso in risposta a manovre stressanti quali tosse, manovra di Valsalva, compressione addominale o manovra di Muller [31].
Il periodo di tempo durante il quale la mucosa rimane a contatto con il reflusso acido (tempo di clearance) nei soggetti con MRGE è 3-4 volte più lungo. Una causa di tale ritardo è rappresentata dal rallentato svuotamento dell’esofago e l’ernia jatale gioca sicuramente un ruolo nel modificare tale meccanismo di difesa. Mittal e coll. hanno osservato che in questi pazienti con ernia jatale la clearance esofagea è nettamente ritardata a causa di un ulteriore reflusso in esofago dell’acido rimasto intrappolato dentro l’ernia. Studi successivi hanno dimostrato che in presenza di ernie più voluminose si osservava una alterazione più significativa dello svuotamento esofageo. Questo sottotipo di pazienti presentava un cospicuo e precoce flusso
retrogrado di acido a partenza dall’ernia che svolgeva la funzione di “reservoir” [32].
Molte ipotesi sono state formulate per spiegare l’insorgenza e lo sviluppo di reflusso su ernia iatale:
− l’ernia jatale favorisce gli episodi di reflusso gastro-esofageo aumentando il tempo di contatto con la mucosa esofagea e quindi l’insorgenza di erosioni e di esofagite;
− l’ernia jatale è il fattore predittivo più importante, nei pazienti con esofagite sintomatica, della presenza di reflusso;
− l’incompetenza del LES non è da considerarsi il fattore primario nello sviluppo di GERD.
Esistono alcune ipotesi relative alla genesi dell’ernia iatale: 1)Teoria congenita
2)Teoria del trauma acuto 3)Teoria del trauma cronico
La teoria congenita si basa sull’evidenza che alcune strutture della barriera anti-reflusso (legamento freno-esofageo, fibre muscolari del LES, brachiesofago congenito, ecc) non si sarebbero sviluppate adeguatamente (sia nei nati pretermine sia a causa di uno sviluppo intrauterino anomalo). Tale ipotesi è sostenuta dall’esistenza di sviluppo di sintomi MRGE-correlati o vomito nei bambini dopo il decimo mese di vita. Tale situazione conduce allo sviluppo di ernia jatale e il vomito spesso risulta uno dei fattori che più facilmente inducono allo sviluppo dell’ernia [33].
La seconda ipotesi riguarda la possibilità dello sviluppo di ernia jatale in seguito a traumi toracici o addominali importanti, come quelli conseguenti a incidenti stradali (traumi contro volante auto o manubrio della moto) o a sforzi addominali violenti (palestra, lottatori wrestling, arti marziali, boxe) o a posizioni antifisiologiche (ginnastica artistica). Non è
dimostrabile la situazione prima del trauma, ma in tutti i pazienti è documentata la presenza di ernia jatale ed esofagite in seguito all’evento acuto.
La terza ipotesi si basa sulla possibilità che sforzi di minor entità ma quotidiani determinino un progressivo aumento della pressione intra-addominale sufficiente a favorire l’erniazione del fondo dello stomaco in cavità toracica. Tali sforzi possono essere correlati allo sforzo evacuatorio, allo scarso apporto di fibre con la dieta, alla ridotta assunzione di liquidi, alla ridotta attività fisica in favore della posizione seduta. Molti autori, da Burkitt a Fedail, hanno dimostrato nei loro lavori l’aumento della pressione endoaddominale in seguito alle situazioni sopra descritte, soprattutto nei paesi industrializzati. Questa condizione è associata a MRGE nel 90% dei casi.
Un altro elemento fondamentale, sia a livello anatomico che fisiopatologico, è lo sfintere esofageo inferiore. Il suo ruolo nella malattia da reflusso gastro-esofageo e nello sviluppo dell’Esofago di Barrett non è ad oggi chiaramente definito. Recentemente un gruppo di ricercatori di Santiago ha ipotizzato che il SEI vada incontro ad una progressiva distensione e dilatazione, osservata clinicamente e obbiettivamente documentata nei pazienti con MRGE ed Esofago di Barrett.
La dilatazione del cardias sarebbe l’espressione anatomica di un cambiamento irreversibile dell’architettura e del riarrangiamento delle fibre muscolari che costituiscono il SEI, per cui la sua funzione risulta compromessa. Questa modificazione implica anche il cambiamento dell’angolo di His che diviene più ottuso. Quindi si alterano, con meccanismo a catena, tutti i sistemi di contenimento del SEI.
L’ipotensione del SEI è solo un momento finale nella patogenesi sia della MRGE che dell’esofago di Barrett. Infatti solo una minoranza dei pazienti affetti da MRGE ha una pressione del SEI inferiore a 10 mmHg.
La maggior parte dei pazienti presenta una situazione caratterizzata da aumento dei rilasciamenti transitori del SEI. Alla base dello sviluppo di questi rilasciamenti transitori ci sarebbe, secondo alcuni autori, l’aumentata distensione gastrica, attraverso un arco riflesso vago-vagale attivato da recettori di tensione della parete gastrica. Contemporaneamente alle contrazioni gastriche il SEI mostra delle contrazioni nella fase III del Complesso Motorio Migrante.
Molti autori hanno dimostrato che il tono dello sfintere esofageo inferiore si riduce con il peggiorare delle lesioni dell’esofago, e che tali alterazioni (riduzione della pressione del SEI e onde peristaltiche post deglutitorie > 50%) sono molto più pronunciate nell’esofago distale [34].
Tipologia del reflusso
Come è già stato sottolineato, i pazienti con EB hanno una frequenza maggiore di esposizione patologica al reflusso acido rispetto ai controlli normali e a quelli con esofagite non complicata.
Sono aumentati sia il numero totale di reflussi che quelli di durata superiore a 5 minuti. La percentuale di tempo durante il quale il pH esofageo si mantiene al di sotto di 4 nei pazienti con EB è significativamente superiore rispetto ai controlli normali e a quelli con esofagite non complicata, mentre soltanto nei pazienti gastroresecati tali valori si avvicinano [35].
La lunghezza della metaplasia si correla direttamente ed in modo statisticamente significativo con la percentuale totale di esposizione al reflusso acido [36].
Studi eseguiti con pentagastrina hanno dimostrato nei pazienti con EB una secrezione superiore sia rispetto ai controlli che ai soggetti con esofagite non complicata [35,37-39].
In tempi molto recenti, l’individuazione del cosiddetto “nocturnal acid
breakthrough” (NAB) in pazienti che assumevano inibitori di pompa
protonica (IPP) [40,41] e la dimostrazione che pazienti con EB hanno più frequentemente reflusso in coincidenza con il NAB [42], hanno indotto alcuni ricercatori a modificare l’approccio terapeutico [43].
Studi eseguiti mediante il dosaggio di “villina” per studiare la differenziazione cellulare e la misurazione del PCNA (Proliferative Cell Nuclear Antigen) hanno condotto alle seguenti conclusioni:
a)l’epitelio di Barrett esposto all’acido in modo intermittente può andare incontro a proliferazione cellulare ed evolvere in senso displastico;
b)la soppressione del reflusso acido deve essere praticamente costante [44].
Molti studi hanno anche dimostrato la presenza di reflusso alcalino e la possibilità di utilizzare uno spettrofotometro portatile ha confermato la presenza di bilirubina nell’esofago di pazienti con EB [36].
La bile, il succo pancreatico e le secrezioni pancreatiche contengono delle sostanze potenzialmente tossiche. La pepsina viene secreta nel succo gastrico come un precursore inattivo, il pepsinogeno. La conversione in pepsina avviene spontaneamente ad un pH compreso fra 2 e 6. E’ molto attiva in soluzione acida, inattiva in soluzione alcalina.
La Tripsina viene secreta dal pancreas in forma inattiva e trasformata nella sua forma attiva da parte di enterochinasi ad un pH compreso tra 7 e 9.
Gli acidi biliari sono una classe di anioni organici che sono il costituente più attivo della bile. La loro funzione principale è di emulsionare gli acidi grassi. Si dividono in primari (ac. colico e chenodesossicolico), secondari (ac. desossicolico e litocolico) e terziari (ac.ursodesossicolico). Tutte queste sostanze lesive per l’esofago sono contenute nel materiale refluito.
Infatti sebbene l’acido sia considerato il principale imputato del danno esofageo, negli ultimi anni è stata posta particolare attenzione agli effetti del succo duodenale sulla mucosa esofagea. Molte evidenze, derivate da studi sulla perfusione esofagea, hanno dimostrato che fra le sostanze più implicate ci sono gli acidi biliari, senza mettere in secondo piano il ruolo potenziale giocato da tripsina e pepsina.
Il ruolo degli acidi biliari è differente a seconda del pH e del loro stato di coniugazione. Gli acidi biliari non coniugati (ac. desossicolico), che causano i danni maggiori, precipitano ad un pH minore di 4, pertanto in ambiente acido non hanno alcun potere lesivo. Gli acidi biliari coniugati risultano ancora solubili ad un pH di 2. Tali dati sono stati confermati anche in studi di perfusione esofagea.
Uno studio molto dettagliato è stato effettuato da Nehra e coll. che hanno eseguito lo studio pH-metrico associato con l’aspirazione del refluito (poi ultracentrifugato e studiato mediante spettrofotometria) in un gruppo di pazienti con differenti gradi di esofagite (lieve, moderata, severa, EB).
Nei pazienti con EB è stata osservata una maggior concentrazione di acidi biliari misti in presenza di un reflusso prevalentemente acido. Il ruolo degli acidi biliari non coniugati può essere potenziato dalla presenza di un pH più elevato. Un pH compreso fra 4 e 7 è considerato come una “danger zone”, dove la maggior parte degli acidi biliari esistono nelle due forme contemporaneamente, ionizzati e non-ionizzati. Gli acidi biliari non ionizzati tendono a diffondere attraverso la mucosa in modo più efficace, creando i danni maggiori. Le conclusioni di questo studio sono che in una buona percentuale di pazienti affetti da MRGE con reflusso “misto” istituire una terapia di soppressione acida può non essere sufficiente e che gli acidi biliari possono giocare un ruolo fondamentale nella trasformazione delle modificazioni in senso metaplastico nei pazienti con EB.
gastroesofageo e duodeno-gastrico, tenuti a lungo in terapia con IPP, hanno condotto alla conclusione che la terapia con IPP standard non è sufficiente per garantire una copertura nelle 24 ore nei confronti del reflusso gastro-esofageo, soprattutto se si tratta di reflusso misto, per la presenza di un numero elevato di breakthrough notturni; questo non significa che la soppressione acida non sia efficace, ma che va monitorata (pH-metria) e corretta ad personam per esempio aggiungendo anti-H2, per ottenere un controllo adeguato della secrezione acida nelle 24 ore ed un pH esofageo costantemente > 4.
PATOGENESI
Per quel che riguarda la patogenesi dello sviluppo di metaplasia di Barrett sono state formulate varie teorie e attualmente sono due quelle più accreditate:
1.La prima, più datata, è stata formulata da Bremner nel 1970 [33] e afferma che la sostituzione dell’epitelio squamoso danneggiato avviene ad opera di cellule staminali totipotenti ed in grado di differenziarsi in cellule colonnari. Un importante supporto a questa teoria proviene dall’osservazione fatta al microscopio da Sawhney il quale ha dimostrato la presenza nell’EB di una distintive
cell al confine tra epitelio normale ed epitelio metaplastico. Questa
cellula mostra entrambi i caratteri di una cellula squamosa e di una cellula colonnare e potrebbe quindi rappresentare lo stadio intermedio di differenziazione della cellula staminale totipotente o, al contrario, potrebbe anche essere indice della regressione dell’epitelio metaplastico [34]. Alla luce di ciò si deduce che soggetti aventi una
lunga storia di reflusso gastroesofageo dovrebbero presentare una metaplasia più estesa ed infatti questa affermazione è confermata da uno studio italiano del GOSPE che ha analizzato 589 pazienti con MRGE: in questo studio i pazienti con EB di tipo intestinale sono proprio quelli più anziani e presentano un’estensione maggiore della metaplasia.
2.La seconda ipotesi risale invece al 1990 ed è stata formulata da Cameron [35]. Secondo questa teoria la progressione verso l’EB sarebbe un evento più rapido che si realizza da un minimo di pochi mesi ad un massimo di uno o due anni, a prescindere dall’età del paziente e dall’entità e persistenza del reflusso. Viene maggiormente preso in considerazione, in questa teoria, il ruolo del reflusso alcalino rispetto a quello acido [36] anche sulla base di misurazioni pHmetriche effettuate sui pazienti. Queste infatti dimostrano una prevalenza delle componenti bilio-pancreatiche le quali potrebbero avere un’azione dannosa più diretta nei confronti delle proteine cellulari del DNA causando così morte cellulare (ulcerazione) o danni genotossici gravi (displasia ed adenocarcinoma).
DIAGNOSI
Non esiste una sintomatologia propria dell’EB; la malattia si associa alla malattia da reflusso gastro-esofageo e i sintomi tipici o atipici sono quelli a esso correlati (Tabella 2).
Tabella 2: spettro clinico della malattia da reflusso gastroesofageo
Un terzo dei pazienti è asintomatico o paucisintomatico e solo una minore percentuale di soggetti sintomatici si sottopone ad accertamenti strumentali, per cui la frequenza di diagnosi dell’EB sottostima grandemente la prevalenza della malattia. La diagnosi ha assunto maggiore rilevanza da quando è emersa la possibilità che possa trattarsi di una condizione con potenzialità evolutive in senso neoplastico, con sviluppo di adenocarcinoma esofageo.
Le linee guida dell’American College of Gastroenterology [45] raccomandano di eseguire una endoscopia a “pazienti con sintomi da reflusso gastroesofageo, specie se di lunga durata, e soprattutto se al di sopra dei 50 anni”.
Endoscopia:
Consente una corretta diagnosi di EB grazie alla possibilità di eseguire biopsie mirate sul tratto di mucosa ectopica ogni qualvolta la giunzione squamo-colonnare sia posizionata cranialmente rispetto alla giunzione muscolare esofago-gastrica.
La diagnosi risulta chiaramente istologica con conferma della presenza di mucosa di tipo colonnare microscopicamente evidenziabile.
Nel 2006 è stata introdotta un nuova classificazione endoscopica dell’esofago di Barrett definita Classificazione di Praga [46] (stilata da International Working Group for the Classification of Oesophagitis), tale classificazione prevede i seguenti punti di repere endoscopici:
Linea di giunzione squamo-colonnare (SCJ) linea Z:
Questa linea, posizionata orizzontalmente nell’esofago a circa 35-45 cm dall’arcata dentaria a seconda dell’altezza del paziente, ha normalmente un aspetto circonferenziale ed un andamento solo lievemente irregolare (a zig-zag da cui il nome) e separa nettamente la mucosa liscia di colore grigio-perla, o rosa, dell’epitelio pavimentoso stratificato esofageo rispetto a quella vellutata e color rosso salmone dell’epitelio colonnare del cardias gastrico.
Giunzione esofago-gastrica:
Questa linea di demarcazione immaginaria, pur cruciale nel sospetto diagnostico di EB, è assai più difficile a stabilirsi. La definizione endoscopica corrente la identifica nel “livello più prossimale delle pliche gastriche”. Tale valutazione endoscopica va eseguita comunque in condizioni di minima insufflazione dell’esofago distale.
Impronta dello jato diaframmatico:
Si identifica come l’impronta data dal diaframma sul lume esofageo, o sullo stomaco prossimale, apprezzabile in quanto variabile con gli atti del respiro. Nel paziente senza ernia jatale coincide con la giunzione esofago-gastrica. Nel caso di ernia jatale diaframmatica (dislocazione di 2 o più cm della giunzione esofago-gastrica in torace), invece, l’estremità distale dell’ernia è riconoscibile per la formazione di una convergenza (“rosetta”) di pliche mucose gastriche. In inspirazione profonda si apprezzerà una contrazione del diaframma a livello della rosetta.
Classificazione di Praga per l’Esofago di Barrett: La Praga Classification prevede l’individuazione di:
o “C” definito come estensione circonferenziale più prossimale della metaplasia
o “M” definito come lunghezza massimale della metaplasia Figura 3: esempio Classificazione di Praga [46]
Adeguato campionamento bioptico:
Per i LSBE si possono applicare i requisiti condivisi per il campionamento bioptico relativi alla sorveglianza, cioè una biopsia nei 4 quadranti ogni 2 cm. Nel caso di SSBE si deve provvedere a fare il numero di biopsie sufficienti a rappresentare l’area mucosa presumibilmente metaplasica.
Alcuni autori consigliano l’uso di pinze Jumbo per migliorare l’accuratezza diagnostica, ma quest’ultime richiedono l’uso di strumenti con ampio canale operatore e risultano spesso inadatte o incompatibili con l’utilizzo di strumenti per la prima diagnosi o per lo screening.
Ovviamente è sconsigliato eseguire biopsie in presenza di concomitanti erosioni, ulcere o comunque di reperti di flogosi in atto, a causa dell’elevata presenza di falsi negativi. In questo caso è utile impostare la terapia per la malattia concomitante (esofagite o ulcera esofagea) e rimandare il campionamento al successivo controllo endoscopico.
Una corretta diagnosi endoscopica deve essere completata con un referto particolarmente descrittivo al fine di migliorare l’accuratezza diagnostica anche dall’anatomopatologo.
Sul referto endoscopico devono essere indicati (le distanze sono espresse in cm dall’arcata dentaria):
- livello della sede di biopsia
- segnalazione di biopsie effettuate in sede di esofagite “visibile” - numero dei livelli ai quali sono state ottenute le biopsie
IPOTESI MOLECOLARI SULL’EVOLUZIONE DELL’ESOFAGO DI BARRETT
L’esofago di Barrett è da anni stimolo per la ricerca molecolare in quanto presenta alcune peculiarità: è l’unica lesione pre-neoplastica dell’AC, presente in circa il 10-12% [13] dei pazienti con malattia da reflusso gastroesofageo cronica che si sottopongono ad endoscopia digestiva ed al contempo i dati della letteratura ci presentano un rischio di sviluppo di neoplasia nei portatori di EB pari circa allo 0,4-0,5%.[14]
L’importanza della metaplasia nell’EB sta nel fatto che essa rappresenta il primo gradino della successione metaplasia-displasia-adenocarcinoma [47].
Purtroppo esistono ancora molte incertezze al riguardo: ad esempio ancora non si sa come mai la cellula progenitrice dopo il danno epiteliale si differenzi in senso colonnare in alcuni pazienti e non in altri [2].
Inoltre il tipo cellulare da cui prende origine la metaplasia intestinale rimane ancora sostanzialmente sconosciuto: si potrebbe trattare di cellule ghiandolari dell’esofago, mucosa gastrica eterotopica oppure di un’anormale differenziazione di una cellula staminale primitiva [48]. La presenza di un epitelio pluristratificato nel contesto di un EB, in cui si ritrovino le caratteristiche istologiche e cellulari di entrambi i tipi di epitelio (squamoso e colonnare) risulta essere un’ulteriore prova a sostegno della tesi secondo cui una cellula staminale totipotente sia alla base dell’origine dell’epitelio di Barrett [49].
Più precisamente Jankowski e coll. in un articolo pubblicato su Lancet del dicembre 2000 dichiara di aver ragione di credere che la metaplasia e la displasia prendano origine da una cellula staminale della stessa mucosa esofagea o dell’adiacente tessuto ghiandolare.
Le cellule staminali vengono indotte alla differenziazione da un insulto cronico alla mucosa e il passaggio da metaplasia a displasia viene segnato da una serie di alterazioni genetiche. Oltre alle cellule staminali altre cellule dell’apparato gastrointestinale (aventi un turn over di 3-10 giorni) sembrano giocare un ruolo nello sviluppo del cancro.
Per quanto riguarda la localizzazione si sa che le cellule staminali nell’esofago normale si trovano nel compartimento basale del normale epitelio squamoso, specialmente sulla sommità delle papille, ma Jankowski dichiara che non esistono studi che identifichino la localizzazione delle cellule staminali nell’epitelio metaplastico.
Ad ora esistono tre teorie per quel che riguarda l’ipotetico tessuto di origine della metaplasia di Barrett: la prima è quella che prevede un danno diretto delle cellule staminali poste sulle papille a seguito dell’infiammazione dell’epitelio squamoso. Ciò porterebbe a cambiamenti fenotipici e/o metaplastici da cui prendono origine le cellule staminali di Barrett.
La seconda teoria prevede una colonizzazione da parte delle cellule della giunzione esofago-gastrica della zona cardiale e dell’esofago distale in risposta ad agenti nocivi endoluminali. Anche queste cellule, come riporta Sampliner nei suoi studi [50], possiedono la caratteristica di essere totipotenti e possono per questo differenziarsi in cellule colonnari a livello dell’esofago e in cellule squamose a livello del cardias in risposta ad un insulto esofageo.
L’attenzione posta sulle cellule della giunzione esofago-gastrica fa notare come esistano significative somiglianze tra questa zona di transizione ed altre in altre parti del corpo (ad esempio la zona di transizione dal canale anale, della cervice uterina e della ghiandola
prostatica) dove avvengono a loro volta vari processi metaplastici in seguito ad insulti lesivi generalmente esogeni.
Una terza teoria si riferisce ad una localizzazione diversa della cellula staminale, la quale si considera situata a livello della parete delle ghiandole esofagee: quando poi occorre un danno dell’epitelio squamoso questa cellula si attiva selettivamente per colonizzare una circoscritta zona di esofago danneggiata, in risposta ad un meccanismo base di riparazione tissutale previsto nell’ambito del tratto gastrointestinale e cioè il “confinamento cellulare” della lesione ulcerativa [51].
Un altro fattore importante per lo sviluppo della metaplasia oltre l’iniziazione è il mantenimento dell’espansione clonale. Normalmente il numero delle cellule staminali viene mantenuto costante e la produzione di nuove cellule non altera l’equilibrio omeostatico esistente, ma lo studio della biologia delle cellule staminali nell’intestino ha mostrato che qualsiasi anormalità nella divisione delle cellule staminali provoca alterazioni nell’organizzazione, nella struttura e nella funzione ghiandolare [52] ed ora vediamo il perché.
Di solito dalla divisione di un cellula staminale residuano due cellule: un’altra cellula staminale e una cellula cosiddetta “di transizione” che può subire una serie finita di ulteriori divisioni, ma, in presenza di determinate circostanze come irritazione e/o ulcerazione mucosa, la cellula staminale può dividersi per originare due cellule staminali invece di una: in questo modo aumenta il potenziale proliferativo dell’epitelio.
Questo fenomeno può portare, secondo Schmidt e coll. [51], alla biforcazione della ghiandola che si trova nella mucosa se la cellula staminale interessata si trova nella parete della ghiandola stessa; al contrario la produzione (sempre a seguito di un insulto infiammatorio o ulcerativo) di due cellule “di transizione” provoca un’iperplasia
ghiandolare, seguita poi dall’atrofia della ghiandola. Solo la produzione di una cellula staminale e di una di transizione mantiene l’omeostasi ghiandolare.
Figura 4: ruolo delle cellule staminali nel controllo del fenotipo
ghiandolare [11]
In ultimo queste ghiandole che si sono biforcate si dividono ancora assieme a ghiandole adiacenti identiche producendo così un ampio gruppo contiguo di cellule epiteliali con un genotipo comune come avviene anche nella colonizzazione del colon da parte di foci di cripte aberranti. Questo processo ha in genere un decorso abbastanza lento, ma per quanto riguarda la metaplasia di Barrett una volta che essa è iniziata tende a colonizzare rapidamente la mucosa [53] e questa rapida colonizzazione appare simile a quella osservata in altri tessuti caratterizzati da infiammazione epiteliale come nella colite ulcerosa.
S’è visto che la biforcazione ghiandolare e la metaplasia di Barrett appaiono nell’esofago di individui precedentemente sani che abbiano subito un’”iniziazione” da parte di chemioterapia e radioterapia della durata di alcuni mesi [54,55].
La cellula staminale metaplastica, infatti, può rispondere allo stimolo esogeno ed è sensibile al danno del DNA al quale seguono i meccanismi apoptotici mediati dalla p53. Nel momento in cui, però, si crea uno squilibrio tra il numero di divisioni cellulari ed il numero di morti cellulari noi abbiamo la progressione della lesione.
Inoltre bisogna sottolineare che mutazioni geniche a carico della p53 e di p16, le quali riducono la possibilità di mettere in atto il meccanismo apoptotico, oppure la perdita di eterozigosi del gene della poliposi adenomatosa colica (APC gene), o situazioni di aneuploidia, sono fattori importanti che concorrono allo sviluppo del cancro.
Figura 5: tappe della progressione neoplastica su epitelio di Barrett [56]
Per quanto riguarda gli agenti lesivi esogeni di cui si è detto finora, si può affermare che questi si identificano soprattutto nell’azione di citochine
proinfiammatorie e del reflusso gastroesofageo composto di succhi gastrici e duodenali (bile e succhi pancreatici).
Studi eseguiti in vitro hanno dimostrato che l’esposizione intermittente agli acidi causa alterazioni epiteliali nel senso di una selezione di ceppi cellulari poco differenziati ma aventi alto potenziale proliferativo [57]. Questo fenomeno si verifica anche in coloro che assumono inibitori di pompa protonica come terapia medica contro il reflusso e questa è un’ulteriore dimostrazione clinica del fatto che la terapia antiacida può risolvere la sintomatologia da MRGE ma non risulta efficace nei confronti dello sviluppo della metaplasia di Barrett.
Per questo motivo è stata posta attenzione sul ruolo degli acidi biliari nell’origine di questa metaplasia e successivamente del carcinoma associato.
Innanzitutto, con l’ausilio di adeguati spettrofotometri portatili è stato visto che il reperto di succhi duodenali contenenti acidi biliari è un reperto molto più comune rispetto a quanto indagato in altre ricerche [58].
Secondariamente Garewall e coll. [59] hanno mostrato che gli acidi biliari coniugati potrebbero incrementare il danno lesivo alla mucosa, sia da soli che in combinazione con altri acidi, fenomeno osservato sia in vitro che in vivo.
In ultimo è molto significativo ricordare che la progressione neoplastica della metaplasia di Barrett è stata riportata in molti pazienti che hanno un reflusso biliare senza nessun reflusso acido patologico [60]. E’ proprio la prolungata esposizione esofagea agli acidi biliari che determina il peggiore effetto del danno alla mucosa: ovvero la comparsa della metaplasia di Barrett, inoltre la durata dell’esposizione risulta correlata in maniera direttamente proporzionale all’estensione della metaplasia stessa. [61] E’ stato anche osservato che la persistenza in altri distretti gastrointestinali di acidi biliari è implicata nello sviluppo di metaplasia
contenente “goblet cells” a livello dell’epitelio di stomaco, duodeno, intestino e dotti biliari. [62]
Una potente terapia medica antiacida potrebbe incrementare gli effetti degli acidi biliari non coniugati sia direttamente aumentando la trasformazione degli acidi biliari o la flora batterica, sia indirettamente potenziando la loro attività [59,60].
Evidenze sperimentali in animali hanno mostrato che la soppressione acida può favorire la proliferazione clonale in individui con reflusso biliare. Il meccanismo di questa progressione cellulare indotta dagli acidi biliari è complesso e implica l’induzione dell’espressione di cicloossigenasi 2 (COX-2), importante per la sopravvivenza della cellula [63].
Inoltre Jankowski ha osservato che la stimolazione in vitro di cellule da parte di acidi desossicolici causa apoptosi in quelle cellule che esprimono il fenotipo originario di p53, mentre le cellule che posseggono mutazioni a livello della p53 sono resistenti alla morte indotta dall’acido biliare.
Tutto ciò suggerisce come in realtà gli acidi biliari abbiano, nello sviluppo della metaplasia di Barrett, un ruolo ben maggiore rispetto a quello che veniva loro attribuito fino a poco tempo fa.
A questo punto è necessario fare menzione, come si è accennato all’inizio di questo paragrafo, anche del danno provocato alla mucosa da parte dell’infiltrato infiammatorio cronico (a carattere cellulare) che persiste nei pazienti con metaplasia di Barrett: infatti questo fenomeno rappresenta il motivo per cui la metaplasia di Barrett una volta che si è instaurata non regredisce, ma anzi può continuare a progredire, nonostante si rimuovano le cause esterne della sua iniziazione.
L’infiltrato infiammatorio rappresenta una caratteristica comune dl reflusso gastroesofageo, che si verifica come effetto del danno alla mucosa esofagea da parte dei succhi acidi e biliari. L’infiltrato si localizza soprattutto nel contesto delle aree della mucosa basale ricche di cellule
staminali [64,65]. Questo infiltrato è inizialmente composto da cellule infiammatorie della fase acuta. Successivamente aumenta il numero di linfociti T, specialmente nelle aree in cui si sviluppano foci metaplastici [65]. Una volta che la MRGE viene corretta con una buona terapia acido-soppressiva, la metaplasia non regredisce totalmente e persiste un moderato infiltrato infiammatorio [66]. Per quel che riguarda la persistenza di questo infiltrato e della stessa metaplasia potrebbero avere un ruolo importante i linfociti T, i quali permangono in associazione a zone di residua metaplasia dopo ablazione endoscopica, mentre sono assenti nelle isole di neoepitelio squamoso [66].
La stretta associazione tra linfociti e displasia può suggerire che i linfociti siano necessari per la progressione neoplastica. L’infiltrato cellulare infiammatorio nell’esofagite e nell’EB può infatti contribuire al danno del DNA tramite la produzione di specie reattive dell’ossigeno
Queste ultime sono state identificate in grande quantità nel contesto della mucosa gastroesofagea ulcerata [67] e sono responsabili dell’induzione di citochine proinfiammatorie che a loro volta modulano l’estensione e il fenotipo cellulare dell’infiltrato infiammatorio.
I radicali liberi possono poi indurre la formazione di fattori di crescita o di sopravvivenza cellulare o agire essi stessi come tali [68].
L’infiltrato infiammatorio può inoltre indurre un’aumentata espressione di FAS-ligando sulle cellule metaplastiche e questo le protegge dall’azione del sistema immunitario [69].
Le citochine si rendono d’altra parte responsabili del danno alla matrice interstiziale regolando l’attività di enzimi della degradazione come le metalloproteasi e ciò aumenta la capacità invasiva delle cellule maligne che possono proliferare più agevolmente nei tessuti circostanti.
A questo punto si possono individuare due fondamentali passaggi nella creazione della metaplasia di Barrett:
1.Mutazione genica per instabilità cromosomica o dei microsatelliti, la quale porta a disfunzione della p53 nella displasia severa.
2.Promozione e propagazione dei cloni metaplastici da parte di un infiltrato cellulare infiammatorio.
Harrison descrive i diversi tipi di citochine prodotte nell’infiltrato tra cui ritroviamo TGFβ, IL-1β, IFNγ e TNFα. Quest’ultima nell’intestino murino regola la proliferazione cellulare ed è stato visto che topi knock-out per il gene codificante il TNFα sono protetti dal danno epiteliale e conseguentemente dal cancro indotto da fattori ambientali.
I ricercatori hanno poi dimostrato che il polimorfismo del cluster di geni dell’IL-1β è associato ad un maggior rischio di cancro gastrico.
L’analisi del tumore esofageo ha mostrato come lo stadio tumorale e l’invasività siano associati ad una ridotta espressione di E-caderina (proteina di membrana che promuove l’adesione cellulare e agisce come fattore di soppressione tumorale) [70].
L’importanza del ruolo dell’E-caderina è ulteriormente supportato da studi su famiglie in cui esistono più casi di carcinoma esofageo: nei membri di queste famiglie esistono mutazioni a carico del gene codificante E-caderina e tali mutazioni portano ad una ridotta o assente espressione di tale proteina sulla membrana cellulare [71] la E-caderina si associa con un’altra proteina citoplasmatica multifunzionale che è la β-catenina e si lega con essa tramite complessi di adesione cellulare.
Nelle cellule metaplastiche la produzione aumentata di TGFα stimola un’iperfosforilazione della β-catenina tramite un’aumentata attività della tirosinkinasi e ciò porta ad una trasformazione cellulare ed ad una sopravvivenza dei cloni cellulari anormali.
Queste cellule sono facilitate nella loro sopravvivenza anche a causa di un’aumentata espressione di molecole come COX-2 e la ciclina D1 [72,73]. Tali molecole sono implicate anche nel processo infiammatorio cronico e nella crescita delle cellule epiteliali oltre che nella sopravvivenza cellulare.
L’inibizione di COX-2 da parte di farmaci COX-2-inibitori, infatti, permette una riduzione della proliferazione cellulare e un aumento dell’apoptosi delle cellule del carcinoma esofageo e delle linee cellulari coinvolte nell’angiogenesi (si ricorda che la COX-2 è stimolata nella sua espressione dall’esposizione delle cellule epiteliali agli acidi biliari).
Figura 6: ipotesi delle modificazioni molecolari nell’ambito della cellula staminale esofagea [56]
Da quanto esposto finora si evince che il processo di cancerogenesi riferito al tumore dell’esofago è sicuramente un processo multistadio e questo giustifica il tempo che solitamente intercorre dall’iniziale azione dei fattori promoventi (che abbiamo visto essere soprattutto legati alla MRGE e alla composizione e durata del reflusso stesso) fino all’acquisizione, da parte della mucosa, di un fenotipo francamente displastico.
Le aberrazioni cellulari che avvengono secondo successive alterazioni nel contesto di quella che abbiamo definito “metaplasia di Barrett” sono
dovute ad una stretta interazione tra fattori genetici (ad esempio: mutazione di p53, di p16, perdita di eterozigosità di APC etc.) e fattori ambientali (processo infiammatorio cronico con produzione di citochine e radicali liberi) che definiscono precisamente i vari stadi di tale cancerogenesi.
Per questo motivo è importante indagare più a fondo le basi molecolari e gli alterati comportamenti biochimici e biomolecolari che si determinano dopo l’innesco del danno iniziale, sia per individuare una terapia mirata che possa interrompere questo processo una volta che sia iniziato, sia per individuare, grazie alle indagini genetiche, le persone a rischio di sviluppo di tumore esofageo.
Figura 7: modificazioni molecolari nella progressione da metaplasia
GLUTATIONE S-TRANSFERASI OMEGA (GST-ΩΩΩΩ) Considerazioni generali su GST-Omega
GST-Omega (GST-Ω) individua una proteina scoperta di recente dal Prof. Casini presso l’Istituto di Patologia Generale dell’Università di Pisa [74] e definita [75] facente parte di una superfamiglia di glutatione transferasi (GST).
Le GST fanno parte degli enzimi del metabolismo di fase II ed esse, utilizzando il glutatione, contribuiscono alla biotrasformazione di molti composti esogeni ed endogeni (cancerogeni, farmaci e prodotti dello stress ossidativi) [76].
GST-Ω in particolare è stata purificata dal gruppo di Casini insieme ad un altro enzima (poi identificato come 3α-idrossisteroido-deidrogenasi) [77] ed entrambi dimostravano avere una spiccata attività reduttasica dell’acido deidroascorbico (DHA), forma ossidata dell’acido ascorbico o vitamina C.
GST-Ω utilizza come cofattore, nella reazione enzimatica che catalizza, glutatione ridotto (GSH), ecco perché è stata ascritta alla famiglia delle GST. Questa però si divide a sua volta in due superfamiglie: una comprendente proteine legate alle membrane cellulari e una comprendente proteine localizzate a livello del citoplasma cellulare [78].
Queste ultime a localizzazione citosolica sono talmente polimorfe nella loro sequenza nucleotidica che sono state suddivise in classi denominate
Alpha, Mu, Pi, Sigma, Theta, Zeta a cui è stata aggiunta la classe Omega.
La localizzazione di GST-Ω a livello citosolico infatti è stata dimostrata, nel ratto, tramite metodiche di immunoblotting, immunotitolazione e immunocitochimica. In particolare, poi, la tecnica di immunoblotting ha permesso di evidenziare la distribuzione dell’enzima in
vari organi e apparati dimostrando così la sua ubiquità sebbene con una prevalenza di concentrazione nel fegato, nella mucosa intestinale, nel rene e nell’encefalo [75]. Inoltre nell’ambito di rene, mucosa intestinale ed encefalo l’immunocitochimica ha permesso di porre in evidenza la distribuzione zonale della stessa proteina ovvero la sua prevalente localizzazione nell’ambito delle diverse componenti cellulari.
Nell’intestino, ad esempio, GST-Ω sembra essere rappresentata soprattutto nelle cellule cilindriche e mucipare dei dotti ghiandolari mentre non è evidenziabile nelle varie tonache mesenchimali, nel rene, invece, le cellule del glomerulo ne sono completamente prive mentre GST-Ω si trova a livello del tubulo contorto prossimale e, in misura inferiore, nel distale.
A livello del sistema nervoso centrale GST-Ω ha una larga distribuzione in quanto si trova in alta concentrazione nel cervelletto, nello striato, nell’ippocampo e nel tessuto periventricolare [79], inoltre studi successivi [80] hanno dimostrato che l’enzima è presente anche in elementi non neuronali come le cellule endoteliali e gli astrociti perivascolari. Particolarmente interessante è stato evidenziare nei neuroni la presenza dell’enzima non solo nel citoplasma ma anche nell’interno del nucleo dove si trova in stretta associazione con la cromatina. Tale localizzazione suggerisce un probabile ruolo protettivo della GST-Ω nei confronti del danno ossidativi sul DNA neuronale, data l’attività DHA-reduttasica della GST-Ω stessa. [81-84]
La funzione di protezione del DNA cellulare tramite l’attività detossificante di riduzione dei prodotti ossidativi viene appoggiata anche da studi precedenti a quelli di Fornai ovvero studi effettuati da Kodym su una DHA-reduttasi murina nel 1998-1999. Tale DHA-reduttasi murina è stata studiata in una linea cellulare di linfoma di topo in seguito all’acquisizione di resistenza nei confronti delle radiazioni ionizzanti e si è visto che in condizioni stressanti quali l’applicazione di uno shock termico questa
proteina è in grado di migrare dal citosol al nucleo della cellula per proteggerla da eventuali danni ossidativi.
Questo comportamento ha fatto inoltre pensare che la DHA-reduttasi murina appartenesse al gruppo delle Heat Shock Proteins , confermando quindi non solo il suo ruolo protettivo ma anche inducendo a pensare ad una sua possibile funzione “tutrice” nell’assemblaggio delle proteine di nuova sintesi e nel riassemblaggio di quelle denaturate.
Le sequenze aminoacidica e nucleotidica della DHA-reduttasi murina hanno mostrato avere un’alta omologia con le rispettive sequenze della DHA-reduttasi di ratto ed entrambe hanno mostrato di possedere, a loro volta, un’alta omologia con un’altra sequenza aminoacidica e nucleotidica, ovvero quella appartenente ad una proteina umana (la cui sequenza è stata depositata in banca dati dallo stesso Kodym nel 1998) della quale si è appurata la sua attività DHA-reduttasica.[85]
Queste tre proteine sono state poi accomunate definitivamente nel 2000 [76] quando si è potuto ascriverle definitivamente ad una nuova famiglia di glutatione transferasi, contrassegnata –appunto- con la lettera omega.
Caratteristiche funzionali della classe GST-Omega
Le GST in generale si trovano in altissima concentrazione nell’ambito di neoplasie e alcuni autori ritengono che proprio questa sovraespressione potrebbe rappresentare il motivo della resistenza dimostrata dal tessuto neoplastico nei confronti di alcuni farmaci antitumorali. Questa ipotesi trova fondamento in uno studio di Petrini et al. [86] in cui l’uso dell’acido etacrinico (EA) ha potenziato l’effetto tossico del clorambucile nelle cellule
di carcinoma del colon in vitro ed in vivo, in quanto l’EA perde la capacità di legarsi al sito di legame del GSH, cofattore delle GST.
Tuttavia la funzione delle GST non si circoscrive alla sola detossificazione delle sostanze cancerogene durante la carcinogenesi o alla deplezione dei farmaci antineoplastici in fase clinica: le funzioni delle diverse sottoclassi della superfamiglia delle GST sono varie in base alla diversa specificità di substrato su cui agiscono e possono avere carattere enzimatico (ad esempio: funzioni coniuganti) ma anche non enzimatico (ad esempio: funzione di trasporto). Ciò chiaramente dipende dalla sequenza nucleotidica specifica che caratterizza ciascuna classe.
Come già esposto la peculiarità della classe omega delle GST è la loro funzione DHA-reduttasica, inoltre, pur avendo le GST-Ω una notevole omologia strutturale con le altre GST, non possiedono la capacità di catalizzare la coniugazione del GSH con composti elettrofili [76] ma hanno attività tiol-transferasica.
L’assenza della capacità di coniugazione del GSH è spiegabile studiando la struttura aminoacidica della GST-Ω la quale manca dei residui di tirosina nel sito catalitico: nelle altre GST, infatti, è proprio la tirosina a mediare il legame con il glutatione.
Ovviamente nelle cellule che sovraesprimono GST-Ω si verifica un accumulo di acido ascorbico a testimonianza della funzione enzimatica DHA-reduttasica.
Altri studi hanno comunque permesso di capire più a fondo le proprietà funzionali della classe GST-Ω individuando, così, specifiche attività nell’ambito di numerose funzioni cellulari:
1.Le GST-Ω intervengono nella processazione post-trascrizionale della interleuchina β (IL β) indotta da ATP [87] fenomeno responsabile dell’attivazione delle caspasi, di
modificazioni indotte nel trasporto degli ioni e nell’induzione della morte cellulare. Particolari farmaci inibitori del rilascio delle citochine (CRID) espletano la loro funzione proprio legandosi alla GST-Ω e, nel caso essa sia portatrice di un’alterazione nella sequenza nucleotidica a livello della cisteina 32, viene inibito il legame con i CRID rendendo tali farmaci inattivi. La cisteina 32 è infatti cruciale per la funzione dell’enzima.
2.Boutet et al. hanno evidenziato una sovraespressione di GST-Ω in alcuni organismi marini esposti cronicamente agli idrocarburi policiclici aromatici e loro analoghi. La funzione delle GST-Ω, infatti, sarebbe proprio quella di impedire la formazione di addotti tiolici tra GSH e cisteina delle proteine determinati dai radicali liberi del’ossigeno indotti dal danno tossico esogeno. L’inibizione della formazione di questi addotti permette, da parte delle GST-Ω, il ripristino della funzione degli enzimi.[88]
3.Board et al. nel 2004 hanno dimostrato che le GST-Ω modulano i recettori della rianodina presente sui canali rilascianti il calcio. Ciò può significare che la GST-Ω in qualche modo potrebbe intervenire nella contrazione del muscolo scheletrico, del muscolo cardiaco e in tutti gli altri processi calcio-dipendenti come la funzione cardiovascolare, la respirazione, l’attività neuronale e l’immunità.[89]
4.La GST-Ω partecipa alla metabolizzazione dell’arsenico, tossico implicato nella genesi di alcune forme di cancro, di malattie cardiache e nel diabete. Se un individuo viene esposto all’arseniato parte di esso viene ridotto ad arsenito (specie più reattiva rispetto al suo precursore). L’arsenito viene poi metilato a monometilarsonato, a sua volta ridotto ad acido monometilarsenoso da un enzima GSH dipendente la cui sequenza è risultata identica a quella della GST-Ω.
Inoltre tale enzima risulta coinvolto anche nella riduzione dell’acido dimetilarsinico ad acido dimetilarsenoso. Tale attività delle GST-Ω acquista importanza soprattutto in relazione al fatto che composti di arsenico vengono utilizzati nella terapia di alcune leucemie.
Whitbread et al. nel 2003 hanno identificato un nuovo componente della classe omega delle GST: la GST-Ω2, la quale –come la GST-Ω1- si trova sul cromosoma 10q24.3.[90] La GST-Ω1 e la GST-Ω2 sono accomunate dalla presenza del residuo funzionale di cisteina in posizione 32 e da una omologia di sequenza nucleotidica del 64%. Anche GST-Ω2 pare essere ubiquitaria sebbene una sua maggiore concentrazione si abbia nel fegato, nel rene, nel muscolo scheletrico, nella prostata e particolarmente nel testicolo.
SCOPO DELLA TESI
Alla luce di quanto esposto finora i meccanismi di evoluzione neoplastica che conducono la metaplasia di Barrett allo sviluppo dell’AC attraverso gradi diversi di displasia rimangono tuttavia oscuri sebbene molte siano le teorie formulate a proposito.
Recentemente ha catturato l’attenzione la presenza di una particolare proteina denominata GST-Omega (GST-Ω) presente nel contesto delle cellule della mucosa esofagea e dell’epitelio di Barrett.
Lo scopo di questa tesi si fonda proprio sulla dimostrazione della localizzazione di tale proteina in siti cellulari diversi nelle cellule della mucosa esofagea di 45 pazienti a seconda che essi presentassero: EB, displasia di grado lieve, displasia di grado severo.
MATERIALI E METODI
Pazienti
Fra novembre 2005 e marzo 2006, sono stati arruolati 45 pazienti affetti da EB istologicamente dimostrato.
Tutti i pazienti sono stati valutati mediante una anamnesi dettagliata che includeva lo stato di salute generale e la presenza o l’assenza di sintomi tipici, atipici o sintomi extraesofagei correlabili a MRGE. A tale proposito ai pazienti fu chiesto di indicare su un apposito questionario il sintomo predominante (intendendo come predominante il sintomo unico o quello percepito per il periodo di tempo maggiore durante le 24 ore).
Tutte le endoscopie sono state eseguite da 2 endoscopisti più esperti ed eseguite con endoscopi standard.
Il BE fu definito come una risalita craniale della giunzione squamocolonnare visibile all’endoscopia confermato mediante la presenza di metaplasia intestinale all’esame istologico. La giunzione gastroesofagea (GEG) è stata definita il livello al quale l’esofago tubulare si continua con lo stomaco sacculare. In pazienti con ernia jatale la GEG veniva definita come il margine prossimale delle pliche gastriche. La giunzione squamo-colonnare (SCJ) è stato definito come il punto dove il normale epitelio squamoso si continua con la mucosa color rosso di tipo colonnare.
La lunghezza dell’EB è stata misurata a partire dalla GEG fino alla sua estensione più prossimale. Le biopsie sono state eseguite sui 4 quadranti ogni 2 cm di mucosa ectopica per tutta la lunghezza della metaplasia colonnare utilizzando pinze bioptiche standard.
In tutti i casi è stato ottenuto un agreement fra gli operatori sia sulla presenza della metaplasia di Barrett che sul grado di esofagite. La presenza di esofagite è stata valutata e classificata in 4 gradi (da A a D) in accordo con la Los Angeles Classification. [91]
E’ stata definita Long Segment Barrett’s Esophagus (LSBE) la metaplasia di lunghezza superiore a 3 cm, è stata definita invece Short Segment Barrett’s Esophagus (SSBE) la metaplasia di lunghezza inferiore a 3 cm.
Tutti i pazienti sono stati inoltre sottoposti a biopsie gastriche, a livello dell’antro, 2 sulla piccola curvatura e 2 sulla grande curvatura, per la ricerca di H. pylori.
I pazienti positivi sono stati sottoposti al protocollo di eradicazione come da indicazione della Consensus Conference di Maastrict 2.[92]
Tutte le biopsie sono state fissate in formalina ed incluse in paraffina. Tutte le biopsie sono state colorate con ematossilina-eosina, con Alcian-Blue/Periodical Acid Shiff e valutata dagli stessi anatomopatologi. Per ridurre la variabilità inter- ed intra-osservatore tutti i preparati istologici sono stati valutati due volte dagli stessi anatomopatologi. Per gli eventi in disagreement fra le due letture un ulteriore patologo è stato coinvolto per la diagnosi finale.
In accordo con i criteri di Sampliner [13] l’esofago di Barrett è stato classificato come la presenza di metaplasia intestinale specializzata con la presenza di cellule caliciformi. La presenza di displasia è stata valutata seguendo i criteri di Rydell [93] in tre differenti classi: negativo, indeterminato e positivo. In caso di positività è stata prevista la sottoclassificazione in due sottogruppi Low-Grade Dysplasia (LGD) e High-Grade Dysplasia (HGD). LGD è definita come la presenza di atipie nucleari che coinvolgono la superficie mucosa, la presenza di stratificazione nucleare alla base delle cripte con l’architettura delle stesse preservata; la HGD è indicata invece come la presenza di marcata atipia nucleare con distorsione dell’architettura delle cripte, e stratificazione dei nuclei estesa alla superficie luminale.




![Figura 5: tappe della progressione neoplastica su epitelio di Barrett [56]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7245876.80166/28.892.150.796.707.956/figura-tappe-progressione-neoplastica-epitelio-barrett.webp)
![Figura 6: ipotesi delle modificazioni molecolari nell’ambito della cellula staminale esofagea [56]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7245876.80166/33.892.320.652.577.825/figura-ipotesi-modificazioni-molecolari-ambito-cellula-staminale-esofagea.webp)

