UNIVERSITÀ DEGLI STUDI DI CATANIA
FACOLTÀ DI AGRARIA
DOTTORATO IN SCIENZE DELLE PRODUZIONI ANIMALI
DIPARTIMENTO DI SCIENZE AGRONOMICHE, AGROCHIMICHE E DELLE PRODUZIONI ANIMALI
SEZIONE: SCIENZE DELLE PRODUZIONI ANIMALI
VALERIA ANDRONICO
EFFETTO DELL’ORARIO DI PASCOLAMENTO SULLA
COMPONENTE AROMATICA DELLA CARNE
Tutor
Prof. Luisa Biondi
Il Segreto in una Formula 5l=2p=3v+2c=+d1s=RC
INDICE
PARTE GENERALE
1. Introduzione pag. 1
1.1. Qualità della carne pag. 1
1.1.1. Parametri della qualità della carne pag. 4
1.2. Il Colore pag. 9
2. Il Flavour pag. 12
2.1. Formazione del flavour: ruolo della cottura pag. 14
2.2. Formazione del flavour: ruolo dei fattori intrinseci ed
alimentazione animale pag. 18
3. Scatòlo ed Indolo pag. 25
3.1. Biosintesi dei composti indolici e influenza sulla qualità
della carne pag. 27
3.2. Fattori che influiscono sull’accumulo dei composti indolici pag. 30
3.3. Strategie per ridurne l’accumulo pag. 35
3.3.1. La castrazione pag. 35
3.3.2. Selezione Genetica pag. 37
3.3.3. L’alimentazione pag. 37
4. Variazione della composizione del pascolo ed effetti sull’ingestione pag. 44
PARTE SPERIMENTALE
5. Scopo del lavoro pag. 49
6.1. Animali e diete pag. 52
6.2. Macellazione e campionamento pag. 54
6.3. Analisi chimiche pag. 55
6.3.1. Pascolo pag. 55
6.3.2. Liquido ruminale pag. 55
6.3.3. Grasso perirenale pag. 56
6.3.4. Muscolo pag. 59
6.3.4.1. SMart Nose pag. 60
6.4. Analisi statistica pag. 62
7. Risultati pag. 65
7.1. Performance di crescita in vivo e post mortem pag. 65
7.2. Composizione chimica del pascolo pag. 66
7.3. Liquido ruminale pag. 68
7.4. Indolo e scatolo nel grasso perirenale pag. 72
7.5. SMart Nose pag. 74
8. Discussione pag. 77
8.1. Performance in vivo e post mortem pag. 78
8.2. Composizione chimica del pascolo pag. 79
8.3. Liquido ruminale pag. 80
8.4. Indolo e scatolo nel grasso perirenale pag. 84
8.5. SMart Nose pag. 89
9. Conclusioni e prospettive pag. 92
1
1.
Introduzione
1.1. Qualità della carne
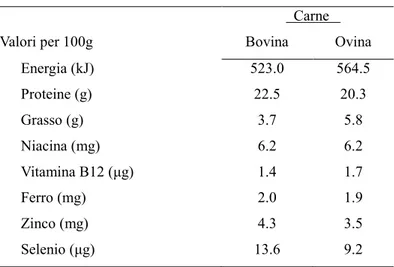
La carne rappresenta un alimento estremamente importante nella dieta della popolazione mondiale. Per secoli, la carne è stata considerata un cibo nobile che contribuiva alla forza, alla salute e alla longevità dell’essere umano. Essa rappresenta, infatti, un’importante fonte di proteine ad elevato valore biologico, ferro, zinco, fosforo e vitamine del gruppo B (tiamina, riboflavina e cobalamina) (Tab. 1).
Tabella 1 - Comparazione di alcuni nutrienti contenuti nella carne bovina ed ovina.
Fonte: Vandendriessche (2008) Carne Valori per 100g Bovina Ovina
Energia (kJ) 523.0 564.5 Proteine (g) 22.5 20.3 Grasso (g) 3.7 5.8 Niacina (mg) 6.2 6.2 Vitamina B12 (μg) 1.4 1.7 Ferro (mg) 2.0 1.9 Zinco (mg) 4.3 3.5 Selenio (μg) 13.6 9.2
L’attenzione e la considerazione nei confronti di questo prodotto, e più in generale nei confronti dei prodotti di origine animale, è, però, molto mutata nel corso dei tempi. In Italia, in concomitanza con la crescita economica che ha caratterizzato il secondo dopoguerra, il consumo di carne è cresciuto in modo esponenziale (Fig. 1) assurgendo a vero e proprio simbolo del benessere di quel periodo. Tale incremento è bruscamente rallentato alla fine degli anni ‘90 a
2 seguito di una serie di problemi igienico-sanitari legati all’allevamento degli animali (encefalopatia spongiforme bovina, febbre catarrale, scrapie, ecc), per poi riprendere a crescere. Scandali come quello della “mucca pazza”, se da una parte hanno minato la fiducia dei consumatori nei confronti dell’industria dei prodotti di origine animale, dall’altra li hanno resi più critici ed interessati alle dinamiche della filiera agroalimentare. Inoltre, la disponibilità di nuove conoscenze relative agli effetti dei comportamenti alimentari sulla salute umana che dimostrano, con sempre maggiore evidenza, la correlazione tra l’eccessivo consumo di carne e l’insorgenza di una serie di disturbi clinici (malattie cardiovascolari (Xiaosong, 2007), obesità (Liseeau et al., 2004), osteoporosi e diabete (Aggett et al. 2005), cancro del colon (Norat et al., 2005), ha spostato l’attenzione dalla quantità alla qualità della carne consumata nonché cambiato i parametri su cui si basa la valutazione della qualità della carne.
3
Figura 1 – Consumo procapite di alimenti di origine animale in Italia – Fonte ISTAT 2009
La norma ISO 9000 del 2000 definisce la qualità di un prodotto, sistema o processo, come la sua capacità di soddisfare le richieste implicite ed esplicite del cliente (consumatore). Nei prodotti alimentari si identificano diversi aspetti classici della qualità, generalmente raggruppati in aspetti igienico-sanitari, nutrizionali edonistici e tecnologici (Grunert, 2006). Alcuni di essi, come la sicurezza igienico-sanitaria di un alimento, ovvero la sua incapacità di provocare danno, malattia o morte all’individuo che lo assume, sono imprescindibili e garantiti dalla legge, quindi non risultano determinanti per le scelte del consumatore al momento dell’acquisto. Parametri come l’apporto calorico, la
4 percentuale di grasso nonché le sua composizione, l’aspetto, l’aroma, la facilità e/o velocità di cottura sono, invece, in grado di generare differenze fortemente caratterizzanti fra un prodotto e un altro e di condizionare profondamente le scelte di acquisto (Bernues et al., 2012). Negli ultimi anni, il consumatore ha posto l’attenzione anche su aspetti diversi da quelli classici. Oggi si dà, infatti, sempre più importanza ad aspetti etici, quali ad esempio il rispetto del benessere animale e dell’ambiente (Sepùlveda et al., 2011, Martìn-Cerezo et al., 2005) o anche la valorizzazione dei prodotti del territorio (Luykx et al., 2008).
1.1.1. Parametri della qualità della carne Il grasso e la sua composizione
Il grasso contenuto nella carne rappresenta uno dei principali fattori da tenere in considerazione quando si valuta la qualità di questo prodotto. D’Amicis e Turrini (2002) e Bernabéu e Tendero (2005) riportano che, nel corso degli ultimi anni, questo parametro ha riscosso un sempre maggiore interesse da parte del consumatore. È, infatti, noto che la quantità del grasso ingerito tramite il consumo di carne rappresenta un rischio per la salute umana. Il World Cancer Research Fund/American Institute for Cancer Research (2007) ha osservato come in Nord America, dove si consuma la più elevata quantità di carne procapite, ci sia una netta correlazione tra un eccessivo consumo di carne, obesità, malattie cardiovascolari e cancro. Anche la qualità del grasso ingerito gioca un ruolo fondamentale nello sviluppo di queste patologie. Gli acidi grassi saturi (SFA), specificamente l’acido miristico (C14:0) e palmitico (C16:0), sono contenuti in concentrazioni più elevate nel grasso della carne dei ruminanti e sono anche quelli
5 per cui è stato dimostrato un ruolo nell’eziologia delle malattie dell’apparato circolatorio, tipiche della società occidentale (McAfee et al., 2010; Micha et al., 2010). Al contrario, il consumo di acidi grassi mono- (MUFA) e polinsaturi (PUFA), in particolare quelli della serie ω-3, è stato associato a una riduzione dei livelli di colesterolo, della pressione arteriosa e del diabete di tipo II (McAfee et al., 2010; Molendi-Coste et al., 2011). In considerazione di questo, la FAO (2010) afferma che solo il 10% dell’energia totale assunta con la dieta dovrebbe provenire dagli acidi grassi saturi.
Negli ultimi decenni è stata effettuata un’enorme quantità di studi per implementare strategie volte a ridurre l’accumulo di SFA a favore dei PUFA nel grasso della carne. Una parte degli acidi grassi contenuti nella carne è di origine endogena, un’altra parte proviene direttamente dall’alimentazione (Fig. 2) e può essere modificata dal regime alimentare cui sono sottoposti gli animali.
6 È stato osservato che una dieta ricca di PUFA basata sull’erba verde (Popova et al., 2007; Nuernberg et al., 2008) o provenienti da semi oleosi (Jenkins et al., 2008) è in grado di aumentare il tenore di PUFA nel grasso della carne. Infatti, oltre ad essere assorbiti e depositati nel grasso muscolare in maggiore quantità, essi producono anche un feed-back negativo sulla biosintesi de novo degli acidi grassi saturi. Tuttavia, nei ruminanti l’incremento del trasferimento dei PUFA dalla dieta al grasso del muscolo non è lineare come nei monogastrici (Jenkins et al., 2008) a causa della bioidrogenazione ruminale, processo per mezzo del quale, i PUFA, tossici per la microflora ruminale, vengono detossificati mediante una progressiva desaturazione dei doppi legami operata dagli enzimi batterici (Kemp e Lander, 1984). Il principale prodotto della bioidrogenazione ruminale è l’acido stearico (C18:0) (Harfoot e Hazelwood, 1997), un acido grasso saturo che contribuisce ad aumentare la percentuale di SFA nel grasso. Per aumentare l’efficienza di trasferimento dei PUFA dalla dieta al grasso è necessario proteggerli dall’attacco dei batteri ruminali. La somministrazione di alimenti ricchi di tannini condensati, molecole capaci di formare legami molto stabili con le proteine, si è dimostrato un mezzo efficace per inibire l’attività degli enzimi microbici a livello ruminale in vitro (Vasta et al., 2009a) e in vivo (Vasta et al., 2009b). Durante il processo di bioidrogenazione vengono prodotti una serie di intermedi molto importanti per gli effetti che hanno sulla saluta umana; di particolare interesse è l’acido linoleico coniugato (cis-9, trans-11 CLA). Questo acido grasso è l’unico per cui sia stata dimostrata l’attività anticarcinogenica, e pertanto gli alimenti che lo contengono possono essere definiti alimenti funzionali (Enser et al., 2001). Il CLA viene prodotto sia nel rumine durante la
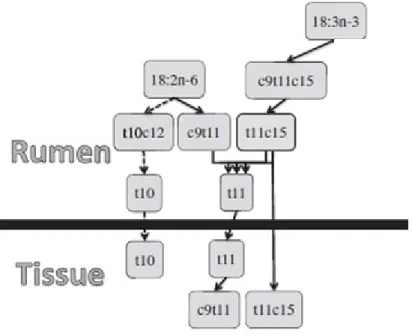
7 bioidrogenazione ruminale a partire dall’acido linoleico e linolenico, sia a livello endogeno nella ghiandola mammaria e nel tessuto muscolare per opera dell’enzima 9-desaturasi a partire dall’acido trans-vaccenico (C18:1 trans) precedentemente formatosi nel rumine (Fig. 3). Come per gli altri PUFA, la sua presenza nella carne è positivamente correlata alla presenza dei suoi precursori polinsaturi (acido linoleico e linolenico) nella dieta e negativamente correlata ai fattori che inibiscono la bioidrogenazione ruminale.
Figura 3 - Origine dell'acido linoleico coniugato (c9 t11). Fonte Chilliard et al., 2007
La tenerezza
Sebbene essa non possa essere valutata al momento dell’acquisto ma solo al momento del consumo, la tenerezza rappresenta un altro fattore molto importante nel determinare la qualità della carne. Essa viene definita come lo sforzo al taglio misurato in kg/cm2 (Warner et al., 2010). Essenzialmente, la tenerezza dipende dai
8 processi glicolitici post-mortem, dalle modalità di accorciamento del sarcomero durante il rigor mortis, dalla quantità e dalla solubilità del tessuto connettivo, dai processi proteolitici che si istaurano dopo la morte dell’animale a carico della componente fibrillare del muscolo e dalla quantità del grasso di infiltrazione (Koohmaraie & Geesink, 2006; Hocquette et al., 2010).
I processi metabolici delle cellule muscolari continuano per un certo periodo anche dopo la morte dell’animale; il catabolismo del glicogeno è uno dei processi più importanti nel determinare la tenerezza delle carni (Thompson et al., 2006). Infatti, l’utilizzo del glicogeno come fonte di energia per la respirazione cellulare determina un abbassamento del pH a seguito dell’accumulo di acido lattico e per la liberazione di ioni H+ dall’ATP. L’ambiente acido che ne deriva determina il rilascio degli iono Ca++ dal reticolo endoplasmatico e l’instaurarsi del rigor
mortis (Thompson et al., 2006).
Hwang et al. (2003) studiando l’effetto dell’abbassamento di temperatura della carcassa sulla tenerezza della carne, hanno osservato che un abbassamento troppo rapido della temperatura dopo la morte dell’animale determina una repentina contrazione delle fibre muscolari e al contempo una glicolisi troppo lenta, causando vere e proprie contratture che contribuiscono a ridurre la tenerezza della carne; anche un abbassamento troppo lento della temperatura determina l’indurimento della carne. Infatti, in questo caso, la glicolisi, consuma troppo rapidamente il glicogeno contenuto nel muscolo andando a inficiare il proseguimento dei processi di frollatura. Le variazioni di pH e la concentrazione di ioni Ca++ sono responsabili anche dell’attivazione del sistema calpaine-calpastatine, enzimi proteolitici in grado di risolvere il rigor mortis e denaturare le
9 proteine mio fibrillari e sarcoplasmatiche favorendo l’intenerimento della carne (Weaver et al., 2008). Gli enzimi proteolitici non hanno, però nessun effetto sul tessuto connettivo, la cui quantità dipende essenzialmente dall’età dell’animale, dall’alimentazione e dal sistema di allevamento (Knee et al., 2007).
La quantità di glicogeno è quindi determinante per i processi di frollatura della carne; fattori come lo stress che precedono la macellazione, la tipologia di allevamento e il tipo di alimentazione influiscono sulla quantità di glicogeno nel muscolo. È noto, infatti, che un elevato stress poco prima della macellazione determina un elevato consumo di glicogeno nel muscolo, causando un insufficiente calo del pH e una ridotta attività degli enzimi proteolitici (Channon et al., 2000). È dimostrato che il sistema di allevamento e l’alimentazione influiscono sulla tenerezza delle carni (Knee et al., 2007); l’alimentazione influisce anche sullo stato di ingrassamento degli animali e di conseguenza sulla quantità di grassi di infiltrazione presente nel muscolo. Hocquette et al. (2010) riportano che il grasso di infiltrazione aumenta la tenerezza e la succosità della carne grazie alla sua azione di seperazione fisica delle fibre di collagene.
1.2. Il colore
A fronte della molteplicità di aspetti qualitativi da valutare nel prodotto carne, al momento dell’acquisto, lo strumento più importante, se non l’unico, di cui dispone il consumatore per scegliere un prodotto piuttosto che un altro è la vista. Da più di 40 anni, infatti, il colore è ritenuto in assoluto l’attributo più importante di un alimento e della carne in particolare; infatti, un prodotto, il cui colore sia inaccettabile per il consumatore, non verrà acquistato e ogni suo altro attributo
10 perderà importanza (Clydesdale, 1978). Anche studi più recenti confermano che il colore della carne riveste un ruolo fondamentale nelle preferenze espresse dal consumatore (Liu et al., 1995; Smith et al., 2000; Bernues et al., 2012)
Il colore della carne è dovuto ai pigmenti presenti nel muscolo e principalmente alla mioglobina (Fox, 1987). Esso può variare dal rosso-rosa al rosso-mattone spento in funzione dello stato chimico in cui si trova la mioglobina; l’intensità del colore è, invece, direttamente proporzionale alla concentrazione del pigmento nel muscolo. Lo stato chimico della mioglobina dipende dal ferro presente nel suo gruppo eme, il quale è deputato a consentire gli scambi gassosi (ossigeno - anidride carbonica) nel muscolo. In condizioni fisiologiche, cinque dei sei potenziali siti di legame del ferro sono occupati, mentre il sesto rimane disponibile per il legame reversibile con l’ossigeno (Mancini e Hunt, 2005). In funzione dello stato di ossidazione dell’atomo di ferro e della pressione parziale di ossigeno, la mioglobina può trovarsi in tre diverse forme: deossimioglobina (rosso-rosa), ossimioglobina (rosso-ciliegia) e metamioglobina (rosso-mattone spento). La prima, che conferisce alla carne un color rosso-rosa tipico della carne appena tagliata, si ha quando il ferro si trova nello stato ferroso (Fe++) e non vi è presenza di ossigeno nel sesto sito di legame; l’ossimioglobina determina il color rosso-ciliegia tanto apprezzato dal consumatore e si origina quando, in presenza di un’adeguata pressione di ossigeno, questo si lega al ferro del gruppo eme mantenendo però lo stato di ossidazione ferroso; l’ulteriore ossidazione del ferro ne determina la transizione a stato ferrico (Fe+++), responsabile del colore rosso mattone spento (Fig. 4). Quindi, il colore rosso brillante è indice di una carne
11 fresca dove i processi ossidativi non si sono ancora istaurati o sono solo nella loro fase iniziale.
Figura 4 - Effetto dell'ossidazione sul colore della carne
Se lo stato di ossidazione della mioglobina influisce sul cambiamento di colore durante la fase di stoccaggio del prodotto, il regime alimentare cui sono stati sottoposti gli animali contribuisce a determinare il colore iniziale della carne nonché l’andamento dei processi ossidativi. Un’alimentazione basata sul pascolo verde rende le carni più scure rispetto ai concentrati (Realini et al., 2004) e influisce positivamente sulla stabilità del colore (Luciano et al., 2009). La maggiore stabilità del colore deriverebbe dall’elevata quantità di antiossidanti, quali la vitamina E, acidi grassi polinsaturi, ecc, forniti con la dieta, che sarebbero in grado di proteggere più a lungo la mioglobina dai processi ossidativi (Luciano et al., 2011).
12
2. Il Flavour
In ordine di importanza, il flavour viene immediatamente dopo il colore nel determinare le scelte del consumatore (Bernues et al., 2012). Sebbene sia stato dimostrato che nelle carni rosse, il colore e il flavour sono negativamente correlate all’avanzare dei processi ossidativi (Greene, 1969) e che, in particolare, i prodotti dell’ossidazione della porzione lipidica possono dare origine ai cosiddetti off-flavours, è altrettanto vero che aromi e sapori indesiderabili possono essere presenti in una carne freschissima.
Il flavour viene definito come la caratteristica sensoriale data da un cibo, o da un'altra sostanza, derivante dalla combinazione di odore, sapore e dalla sensazione che esso dà in bocca (Farmer, 1994). Le sostanze chimiche responsabili del sapore stimolano specifici recettori posti sulla lingua (Fig. 5) dando vita ai cinque sapori: aspro, dolce, amaro, salto e umami (Maughan e Martini, 2012). Tuttavia, il senso del gusto da solo non è in grado di far percepire tutti gli aromi della carne. Nel caso specifico della carne, i composti volatili che si formano con la cottura e che vengono percepiti dall’epitelio olfattorio durante la masticazione contribuiscono alla percezione del suo tipico flavour (McCabe et al., 2007). Essi sono considerati i maggiori responsabili della formazione del flavour poiché l’olfatto è circa 10 mila volte più sensibile del gusto (Oddy et al., 2001).
13
Figura 5 - Senso del gusto. Fonte: Morini 2012.
Come per gli aspetti qualitativi brevemente riportati nei paragrafi precedenti, anche per il flavour della carne esiste una vasta letteratura che ha investigato i meccanismi e i fattori che ne influenzano la formazione (Elmore e Mottram, 2006), i gusti dei diversi consumatori nel mondo (Bernues et al., 2012) e il modo per avvicinare il sapore della carne alle richieste dei consumatori (Calkins e Hodgen, 2007; Young et al., 2006). Ford e Park (1980) distinguevano il flavour della carne dei ruminanti in tre categorie: normale, sgradevole (off-flavours) ed estraneo. La stessa classificazione è stata utilizzata anche in lavori più recenti da Jenschke et al. (2006) e Hodgen et al. (2006). Il sapore normale è associato al prodotto e può essere genericamente descritto come sapore di carne e a questo possono affiancarsi degli aromi tipici dovuti alla specie (Maughan e Martini, 2012) o alla razza (Utrilla et al., 2010) o al sesso (Resconi et al.,2009). Gli off-flavour si originano, invece, durante la conservazione o come risultato del deterioramento del prodotto, in particolare dall’irrancidimento della porzione
14 lipidica (Hoquette et al., 2010). Infine, i flavour estranei possono derivare da sostanze assunte con la dieta e/o derivanti dal metabolismo animale e che vengono depositate nel grasso e nei muscoli; il termine “estraneo” non è legato a un’accezione negativa del termine, ma al fatto che esso non dipende da fattori intrinseci (specie, razza, età, sesso, ecc.), ma da fattori estrinseci quali il sistema di allevamento e l’alimentazione (Vaste e Priolo, 2006). Pertanto, un flavour estraneo può allo stesso modo rappresentare sia una caratteristica normale o, comunque, accettabile per certi consumatori, sia un aroma troppo intenso o non accettabile per altri consumatori (Prescott et al., 2001). È, infatti, ben noto che l’aroma della carne viene giudicato in maniera diversa a secondo degli usi, delle tradizioni e della cultura popolare. Lo stesso flavour apprezzato o esaltato in una certa zona del mondo, può essere percepito come sgradevole e rifiutato in un’altra parte del mondo. Un esempio tipico è dato dai consumatori australiani i quali, essendo abituati a mangiare ovini allevati al pascolo, risultano meno sensibili al “sapore di pascolo” rispetto a quelli statunitensi, che consumano abitualmente ovini alimentati con concentrati (Singh et al., 2011).
2.1. Formazione del flavour: ruolo della cottura
Se si esclude un leggero odore simile a quello del sangue, la carne cruda è quasi priva di aroma. In essa, però, sono presenti i precursori necessari a sviluppare il tipico aroma. Questi composti possono essere raggruppati in due grandi categorie: lipidi e sostanze idrosolubili. L’aumento della temperatura dovuta alla cottura produce effetti differenti su queste due classi di molecole. I lipidi vengono degradati a composti più semplici; le sostanze idrosolubili, in
15 particolare gli zuccheri riducenti, a causa della riduzione della disponibilità di acqua entrano in contatto con il gruppo amminico degli aminoacidi dei composti proteici, e l’elevata temperatura catalizza la formazione dei prodotti della reazione di Maillard. Più di 1000 composti volatili (alcuni riportati in tabella 2) tra cui idrocarburi, aldeidi, chetoni alcoli, furani, composti pirrolici, piridine, pirazine tiazoli composti sulfurei e molti altri derivano da queste reazioni e sono responsabili del tipico aroma di carne (Calkins e Hodgen, 2007).
Tabella 2 - Composti volatili nella carne - Fonte Calkins e Hodgen 2007.
Compound name Aromatic taste
Benzaldehyde Pleasant, distinct Benzene Seafood, green, onion Butenal Goaty
n-Caprioc acid Sweet and pungent odor, orange peel, lemon, resin 3-Carene Roasted
Cyclobutanol Mint, acetone
2, 4-Decadienal Powerful, waxy, aldehydic, orange, citrus peel Decanal Tallow, orange
2-Decenal Cooked beef 2, 3-Dimethyloxirane Ammonia 2-Pentylfuran Nut, fat
2, 4-Heptadienal Oily, fatty, rancid, unpleasant, penetrating fruity odor in liquid 5-Methyl 2-heptanamine Fragrant, woody, oily, green, fatty, winey, sap, herb
1-Heptanol Fruity, spicy, cinnamon, penetrating fruity odor in liquid 2-Heptanone Cloves, menthol, eugenol
6-Methyl 2-heptanone Soapy, fatty, almond, fishy, unpleasant Ethyl-2-methyl 1,
3-hexadiene
Fatty-green, grassy, strong green, tallow, fat, Hexanal Faint peculiar odor
Hexane Woody, cut grass, chemical-winey, fatty, fruity, weak metallic Hexanol Resin, flower, green
2-Ethyl 1-hexanol Green, sharp, leafy, fruity, unripe banana 3-Methylbutanal Cooling sensation, wintergreen, gaultheria
16
Methyl salicylate Fat, wax, green, watermelon, geranium, pungent 2, 4-Nonadienal Floral, citrus, fatty, grassy, waxy, green
Nonanal Hot milk, soap, green, fruity, floral 2-Nonanone Cardboardy, orris, fat, cucumber, paper 2-Nonenal Oil
Octanal Penetrating aromatic odor, fatty, citrus, oily, walnut, chemical, metal
1-Octanol Herb, butter, resin, gasoline 2-Methyl 3-octanone Green, nut, fat
2-Octenal Fruity, old apples
Pentanal Very slight warmed-over flavor, oxidized Pentane Mild odor, fusel oil, fruit, balsamic 1-Pentanol Mild
Propanol Penetrating odor, sweet smell Tridecane Sweet, strong, spicy
Già da circa 50 anni si sa che dalla porzione magra della carne si originano quei composti che conferiscono tratti di aroma comune a tutte le carni, invece dalla porzione lipidica si sprigionano i composti responsabili dell’aroma specie-specifico (Hornstein e Crowe, 1960; Kramlich e Pearson, 1960; Macy et al., 1964; Wasserman e Gray, 1965: citati da Schreuers et al., 2008)
I principali composti idrosolubili precursori di sostanze aromatiche sono zuccheri liberi e fosfatati, zuccheri legati ai nucleotidi, amino acidi, peptidi e a basso poeso molecolare. Durante la cottura è stata osservata la contemporanea diminuzione di carboidrati e amino acidi come conseguenza della su citata reazione di Maillard. La reazione prende avvio per condensazione (legame con conseguente eliminazione di una molecola d’acqua) tra il gruppo carbonilico di uno zucchero riducente e un composto contenente un gruppo amminico (amino acido); successivamente, la glicosilammina formatasi si riarrangia (riarrangiamento di Amadori) e si disidrata dando vita a prodotti in grado di continuare a reagire con
17 altre molecole reattive (aldeidi, chetoni, ammine, amino acidi, ecc) originando una molteplicità di sostanze aromatiche tra cui amino chetoni, amino alcol e composti bicarbonilici. Quando questi ultimi reagiscono con la cisteina, alla reazione di Maillard si associa quella di Streker che porta alla formazione di solfuro di idrogeno, ammoniaca e acetaldeide. Tutte queste molecole costituiscono gli intermedi della formazione di importanti classi di aromi quali i furani, le pirazine, i pirroli, tiazoli ed altri composti aromatici. I composti sulfurei, derivati dalla cisteina, sembrano avere una grande importanza nella formazione dell’aroma della carne. Questo è confermato dal fatto che durante la reazione di Maillard, nel muscolo si ha una notevole diminuzione del contenuto di ribosio e cisteina (Fay et al., 2005).
Per quel che riguarda la componente lipidica, idrocarburi alifatici, aldeidi, chetoni, alcol e acidi carbossilici, sono alcuni dei composti di derivazione lipidica responsabili del flavour della carne cotta. Oltre agli idrocarburi alifatici, anche quelli aromatici (eterociclici e non) forniscono un notevole contributo nel caratterizzare l’aroma della carne. Normalmente questi composti sono il risultato dell’ossidazione che avviene a carico dei lipidi durante la conservazione e conferiscono alla carne un cattivo aroma di rancido Gatellier et al., (2005). Durante i processi di cottura, questi processi avvengono molto rapidamente e contribuiscono allo sviluppo di un aroma privo di off-flavours. Gli acidi grassi polinsaturi sono più suscettibili all’ossidazione rispetto a quelli saturi, a causa della minore energia necessaria per rompere i doppi legami (Elmor et al., 2002).Il livello di insaturazione dei fosfolipidi strutturali che costituiscono la membrana cellulare è più elevato rispetto a quello degli acidi grassi che costituiscono i
18 trigliceridi. Per questo motivo anche l’aroma delle carni più magre, dove il contenuto di grasso intramuscolare è molto basso, e cotte senza il grasso sottocutaneo, è ricco di composti volatili derivati dai lipidi. Il valore soglia oltre il quale l’aroma di queste sostanze può essere rilevato è generalmente molto più elevato rispetto al valore soglia dei composti sulfurei ed azotati derivanti dai precursori idrosolubili. Rispetto a questi ultimi, però, aldeidi sature e insature derivanti dai precursori lipidici sono più abbondanti perciò svolgono un ruolo predominante nella formazione del flavour.
2.2. Formazione del flavour: ruolo dei fattori intrinseci e dell’alimentazione animale
Le sostanze che danno vita alle reazioni chimiche su descritte sono presenti nel muscolo già prima della cottura. L’accumulo di queste sostanze dipende sia da fattori intrinseci (età, sesso, specie, ecc.) sia da fattori estrinseci (alimentazione, sistema di allevamento), nonché dalla loro interazione.
Alcuni fattori intrinseci hanno effetti comuni su tutte le specie. Ne è un esempio il raggiungimento della maturità sessuale, il quale rappresenta un grave problema per la produzione di carne. Il testosterone e l’androsterone, ormoni steroidei prodotti dagli organi sessuali dei maschi interi maturi, si accumulano nel tessuto adiposo degli animali conferendogli il tipico odore di verro o selvatico (Sellier et al. 2000; Quintanilla et al. 2003). La quantità di ormoni che si depositano nel grasso aumenta con l’età dell’animale fino a renderne la carne inaccettabile per il consumatore (Schoenfeldt et al., 2011).
19 Altri fattori sono, invece, peculiari di ogni specie e contribuiscono a sviluppare aromi ed odori specie-specifici. È il caso della composizione acidica della carne ovina. Tra gli acidi grassi responsabili del tipico aroma della carne ovina, un ruolo fondamentale è giocato da quelli a catena ramificata (Branched Chain Fatty Acids, BCFA), in particolare dall’acido 4-metilottanoico e dall’acido 4-metilnonanoico (Wong et al., 1975; Mottram, 1998). I carboidrati ingeriti con la dieta vengono metabolizzati dalla flora ruminale fino alla formazione di acidi grassi volatili a catena corta (acido propionico, acetico e butirrico). Nei piccoli ruminanti più che nei bovini, l’acido propionico promuove la biosintesi e l’accumulo di BCFA nel grasso corporeo (Vlaemink et al., 2006).
Altri fattori intraspecifici sembrano essere importanti nell’accumulo di BCFA nei tessuti, tra cui età e sesso. Agnelli macellati a 215 giorni di età presentavano una concentrazione di acido 4-metilottanoico e l’acido 4-metilnonanoico nel grasso significativamente maggiore rispetto a quella riscontrata in agnelli di 100 giorni di età e che avevano ricevuto la stessa dieta (Rousset-Akrim et al.,1997). Allo stesso modo, agnelli castrati e interi presentavano livelli diversi di BCFA con valori più elevati negli animali interi (Young et al., 2006).
Il processo di biosintesi endogeno degli acidi grassi a catena ramificata rappresenta un esempio interessante dell’interazione che, talvolta, può esistere tra fattori intrinseci ed estrinseci. L’accumulo di BCFA nel tessuto adiposo e nel grasso del muscolo, già particolarmente spinto nei piccoli ruminanti, può essere ulteriormente amplificato dalla dieta somministrata agli animali. Un eccesso di carboidrati non strutturali causa, infatti, un incremento della formazione di acido propionico a livello ruminale. Poiché esso rappresenta il principale precursore per
20 la gluconeogenesi nel fegato, quando la sua quantità supera la capacità del fegato di metabolizzarlo per la biosintesi di nuovi zuccheri, viene destinato alla produzione di BCFA (Vlaemink et al., 2006). Altri acidi grassi a catena dispari e ramificata vengono sintetizzati nel rumine come risultato della deaminazione e del metabolismo di sostanze azotate quali la valina, la leucina e l’isovalina quando l’apporto di carboidrati fermentescibili è troppo basso (Kaneda, 1991). Nonostante la correlazione positiva tra la concentrazione di BCFA e l’aroma di pecora, Young et al., (2006) suggeriscono che esso potrebbe essere molto forte anche quando la loro concentrazione non è elevata. Questo vuol dire che altri composti sono coinvolti nella formazione dell’aroma di pecora.
Oltre alle sostanze sintetizzate a livello endogeno, altre sostanze di origine esogena, o comunque riconducibili a fattori estrinseci contribuiscono alla formazione del flavour.
Nonostante le differenze culturali influiscano sulla percezione del flavour della carne ed esistano numerose variabili in grado di confondere i risultati delle ricerche (età dell’animale alla macellazione, peso vivo, marezzatura, ecc), tutti gli studi condotti concordano sul fatto che esiste una differenza tra animali allevati al pascolo o alimentati con foraggi rispetto ad animali che hanno ricevuto concentrati o cereali (per review vedi e Priolo et al., 2001; Schreurs et al., 2008). In particolare, è stato riscontrato un flavour molto intenso in animali alimentati al pascolo rispetto a quelli allevati con concentrati, definito come “selvatico”, “fecale”, “latteo”, “di verro”, “di cortile”, “di pecora”. Vista la correlazione tra questi aromi e il sistema di allevamento, sono stati raggruppati sotto il termine generico di “pascolo” (Schreurs et al., 2008). Bisogna fare, tuttavia, attenzione a
21 non confondere l’indesiderabile aroma di pascolo con quello normale distintivo della carne ovina e che rappresenta un fattore importante per le scelte dei consumatori. Senza dubbio l’alimentazione rappresenta in assoluto la fonte più importante di composti che contribuiranno a formare il flavour della carne. Una possibilità è che le sostanze aromatiche ingerite con la dieta possano essere assorbite e trasferite inalterate al muscolo e al tessuto adiposo. In realtà la maggior parte dei nutrienti assunti con la dieta vengono dapprima modificati dalle fermentazioni ruminali, assorbiti dall’intestino per poi essere ulteriormente metabolizzati e, infine, essere parzialmente escreti o depositati nei muscoli e nel grasso. I diversi costituenti aromatici e non (e i relativi loro prodotti di degradazione) che caratterizzano i pascoli e i foraggi tra cui la clorofilla e composti secondari come tannini e terpeni, contribuiscono a differenziare direttamente o indirettamente l’aroma della carne in funzione del regime alimentare con cui gli animali sono stati allevati (Vasta e Priolo, 2006).
Una vasta gamma di queste sostanze tra cui composti sulfurei, fenolici, indolo e scatòlo si originano dalle fermentazioni a livello ruminale delle sostanze azotate ingerite con la dieta (Serrano et al., 2001). Le proteine assunte tramite la dieta per poter essere digerite ed utilizzate dalla microflora ruminale e dall’animale devono prima essere solubilizzate (Min et al., 2000). La solubilizzazione consiste nella liberazione delle proteine vegetali nel rumine: in conseguenza della masticazione, le cellule vegetali vengono rotte e le sostanze azotate contenute nel lume cellulare vengono liberate nel rumine. Qui subiscono la degradazione operata dagli enzimi della microflora ruminale. Il risultato della combinazione dei processi di solubilizzazione e degradazione delle proteine sono i loro costituenti elementari,
22 ovvero peptidi ed amminoacidi. Una parte di essi lascia il rumine tal quale e viene assorbita dall’intestino. Il destino della restante parte di peptidi ed aminoacidi varia in funzione della disponibilità energetica, rappresentata dai carboidrati fermentescibili, della microflora. In presenza di una sufficiente fonte di energia, peptidi e aminoacidi vengono utilizzati per la biosintesi di proteine batteriche; quando l’energia non è più sufficiente, i composti azotati vengono essi stessi utilizzati come fonte energetica e quindi ulteriormente degradati e metabolizzati, e alcuni di essi come ad esempio il triptofano danno vita a nuove sostanze con potere aromatico che vengono escrete tramite le feci e le urine, ma che in parte vengono anche assorbite e trasferite al muscolo e al grasso andando a costituirne l’aroma (Deslandes et al., 2001). Di conseguenza il regime alimentare e in particolare il rapporto tra carboidrati fermentescibili e proteine, nonché la natura delle proteine rappresenta un fattore essenziale nel determinare l’aroma della carne. È noto che i foraggi verdi e il pascolo presentano un rapporto carboidrati:proteine-fermentescibile molto elevato e che le loro proteine sono molto più solubili rispetto a quelle di cereali e concentrati (Prache et al., 2005). La conseguenza di queste caratteristiche è che la disponibilità di aminoacidi e peptidi, in seguito all’ingestione di una dieta basata su pascolo o foraggi verdi, eccede l’energia necessaria per la biosintesi di nuove proteine e che per questo motivo la componente estranea dell’aroma della carne sarà predominante.
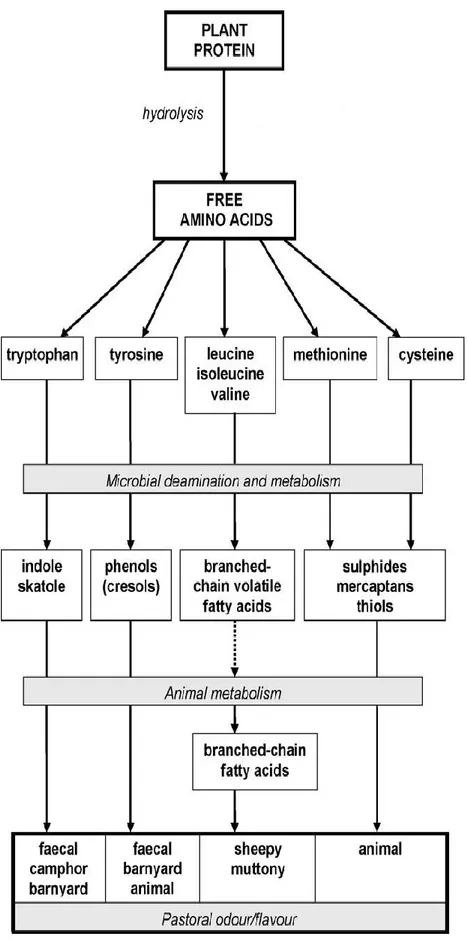
Tra i prodotti della degradazione proteica (Fig. 6), i composti sulfurei e fenolici, scatòlo e indolo rivestono particolare importanza nel conferire alla carne un flavour sgradevole. Essi possono essere percepiti anche quando sono presenti in quantità molto basse. Per lo scopo del presente lavoro di tesi, scatòlo e indolo
23 verranno trattati in una sezione a se stante. Per quanto riguarda i composti sulfurei, in condizione di anaerobiosi i batteri convertono gli aminoacidi contenenti atomi di zolfo (metionina, cisteina e cistina) in solfiti e mercaptani (Le et al., 2005) facendo aumentare l’odore fecale e latteo. Per quel che concerne i composti fenolici, i più rappresentativi sono il 3-metilfenolo e il 4-metilfenolo, derivanti rispettivamente dalla fermentazione delle fibre vegetali e della lignina in particolare e dalla fermentazione della tirosina (Fraser et al., 2003).
24
Figura 6 – Meccanismo di produzione di sostanze aromatiche a partire da sostanze azotate.
25
3. Scatòlo e indolo
L’indolo (Fig. 7) e lo scatòlo (Fig. 8) sono composti volatili solubili in acqua, alcol, benzene e cloroformio. Chimicamente sono composti eterociclici aromatici. L’indolo (2,3-benzopirrolo) è costituito da un anello pirrolico saldato ad un anello benzenico; lo scatòlo deriva dall’indolo per sostituzione di un atomo di idrogeno con un gruppo metilico in posizione 3 dell’anello pirrolico (3-metil-indolo).
Figura 7 - Struttura dell'indolo Figura 8 - Struttura dell'indolo
Entrambi i composti sono stati isolati dalle feci dei mammiferi come conseguenza del metabolismo batterico della flora ruminale nei poligastrici e di quella intestinale nei monogastrici (Merck, 1984). Oltre che per azione dei microrganismi, questi composti possono formarsi dalla pirrolisi del triptofano ed essere sintetizzati per reazione dell’idrossido di potassio con l’albumina della uova e sono stati ritrovati nelle feci degli uccelli, nel fumo di sigaretta e nel catrame (Merck, 1984; Thornton-Manning et al., 1993).
Inizialmente, la presenza dei composti di derivazione indolica negli alimenti, ed in particolare lo scatòlo, è stata studiata perché ritenuta responsabile dell’insorgenza di diverse malattie umane ed animali tra cui la schizofrenia, il coma epatico, il cancro al colon e alla vescica, l’edema e l’enfisema polmonare nei bovini
26 (Yokoyama e Carlson, 1979). Nonostante il nome della malattia, l’edema e l’enfisema polmonare non riguardano solo la specie bovina, ma tutti i ruminanti, gli equidi e l’uomo (Linden et al. 1996).
Nel circolo sanguigno, lo scatòlo agisce da pneumotossina altamente selettiva per l’apparato respiratorio, ma non provoca gravi danni ai tessuti e agli organi extra-polmonari. Viene attivato dal citocromo P450, una superfamiglia enzimatica di emoproteine presenti in tutti i domini viventi appartenente alla sottoclasse enzimatica delle ossidasi a funzione mista, responsabili della detossificazione delle sostanze xenobiotiche. Nei ruminanti, il citocromo P450 agisce formando con lo scatòlo un macromolecola che causa la perossidazione dei lipidi cellulari determinandone la degenerazione e la necrosi (Thornton-Manning et al., 1993). La capacità dello scatòlo di distruggere le membrane biologiche è dovuta alla sua lipofilia; infatti, grazie a questa caratteristica si infiltra nel doppio strato lipidico delle membrane cellulari, riducendone la fluidità e la mobilità dell’acqua causando una elevata instabilità (Bray et al., 1975). Secondo quanto riportato da Robic et al. (2008), i suini non sono sensibili alla tossicità dello scatòlo perché metabolizzano lo scatòlo in maniera diversa dalle altre specie. La detossificazione dello scatolo nei suini prevede una prima fase, simile a quella osservata nelle altre specie, che coinvolge il pool enzimatico P450; una seconda fase in cui lo scatolo viene solfatato per mezzo di una fenol-zolfotransferasi, a formare una molecola non in grado di destabilizzare la struttura della membrana cellulare.
27 3.1. Biosintesi dei composti indolici e influenza sulla qualità della carne
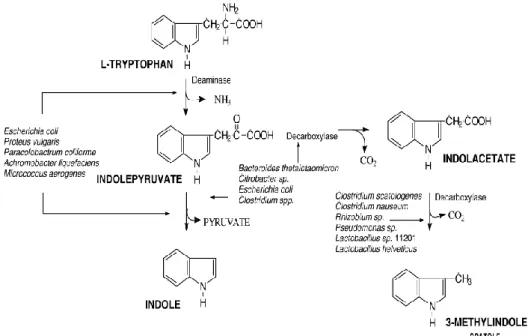
La biosintesi dell’indolo e dello scatòlo (Fig. 9) avviene a livello del rumine per i poligastrici e a livello dell’intestino cieco e del colon per i monogastrici (suini). Nonostante questa differenza, il processo biosintetico risulta simile grazie al fatto che la flora batterica del rumine non è molto dissimile da quella che popola la porzione distale dell’intestino dei suini. L’unica differenza risiede pertanto nella sede di origine del triptofano: nei ruminanti esso deriva dai processi digestivi operati dai batteri ruminali a carico della componente proteica della dieta, mentre nei monogastrici deriva dalla digestione della componente proteica della dieta che avviene nella porzione prossimale dell’intestino. Inoltre, poiché l’acido indolacetico (precursore dello scatolo) è naturalmente presente nei vegetali, parte dello scatòlo viene prodotto direttamente dall’acido indolacetico ingerito mediante la dieta (Leveau et al., 2008).
In condizioni di anaerobiosi, in seguito all’azione di una deaminasi batterica, il triptofano perde un gruppo amminico e viene trasformato in indolpiruvato; questo può seguire due destini differenti: 1) essere degradato ad indolo dagli enzimi batterici mediante l’idrolisi del piruvato; 2) essere decarbossilato ad acido indolacetico, il quale può a sua volta essere ulteriormente decarbossilato e convertito in scatòlo.
28
Figura 9 - Biosintesi dello scatòlo e dell'indolo. Fonte Schreurs et al., 2008.
Entrambi questi prodotti rappresentano i prodotti finali della degradazione del triptofano, il che significa che non verranno ulteriormente trasformati, ma che potranno essere assorbiti nel ciclo ematico per essere depositati nei tessuti o escreti. È, infatti, stato dimostrato che la presenza di questi composti raggiunge il livello massimo nel sangue di bovini e caprini circa 12-24h dopo l’ingestione della fonte di triptofano per poi diminuire costantemente se non viene somministrata una nuova fonte dell’aminoacido (Hammond, 1984; Hammond et al., 1984). Tuttavia, fonti più recenti indicano che le massime concentrazioni di indolo e scatolo si raggiungono 1-2 ore dopo la fine del pasto, indicando pertanto un rapido assorbimento ruminale (Schreurs et al., 2007b)
Le vie di escrezione sono diverse: scatolo e indolo si possono infatti trovare nelle urine e nelle feci (Spiehs et al., 2011) ma anche nel latte (Roy et al., 2004). L’accumulo invece avviene preferenzialmente nel tessuto adiposo tanto da poter
29 essere utilizzato come parametro per tracciare il sistema di allevamento e l’alimentazione dei ruminanti (Vasta e Priolo 2006; Serrano et al., 2011).
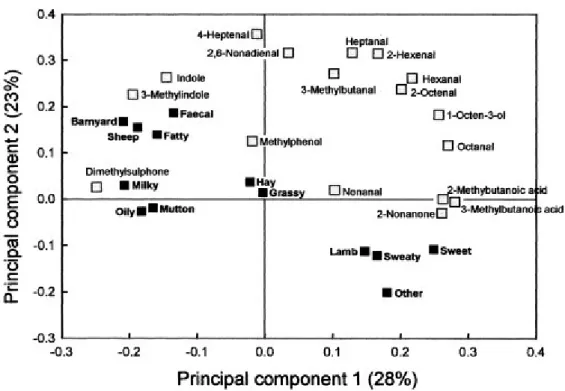
La capacità di queste due molecole di conferire l’aroma fecale ai prodotti di origine animale dipende dalla loro concentrazione nell’alimento: se presenti in piccolissime quantità essi conferiscono un piacevole aroma di tipo floreale e di panna dolce, ma non appena si oltrepassa un valore soglia l’aroma si trasforma in un inaccettabile odore di feci (Peterson e Reineccius, 2003). Sebbene sia comunemente accettato che lo scatòlo sia il principale responsabile nel conferire alla carne un inaccettabile aroma fecale, gli studi effettuati su specie diverse forniscono risultati a volte contrastanti. Young et al. (2003) hanno fornito evidenze dirette sia strumentali sia sensoriali dell’effetto che lo scatòlo nel grasso della carne di agnelli allevati al pascolo ha sul flavour. La gascromatografia olfattometrica ha dimostrato che, tra tutti, lo scatòlo era l’unico composto odoroso in grado di fornire il distintivo odore fecale; inoltre, un’analisi alle componenti principali della percezione odorosa registrata da un panel addestrato, ha mostrato che l’odore di feci (Faecal) e l’aroma “di pascolo” (insieme di faecal, Sheep barnyard) erano associati alla presenza di scatolo e indolo (Fig. 10). Per la carne suina il ruolo dello scatòlo non è ancora così chiaro: Rius et al. (2001) hanno constatato la percezione di aroma fecale anche in presenza di basse concentrazioni di scatòlo, attribuendo un ruolo più importante agli ormoni androgeni accumulatisi nella carne.
30
Figura 10 – Relazione tra sostanze aromatiche e flavour. Fonte: Young et al., 2003.
3.2. Fattori che influiscono sull’accumulo dei composti indolici
L’andamento della biosintesi dell’indolo e dello scatòlo è influenzato da diversi fattori come la velocità di transito nel rumine o nell’intestino, la velocità con cui vengono escreti, lo stato nutrizionale dell’animale, ma di fondamentale importanza sono la tipologia di microrganismi che popolano l’apparato digerente e la dieta somministrata agli animali Zamaratskaia et al., 2009).
Riguardo la microflora, un’ampia gamma di microrganismi (Escherichia coli,
Proteus vulgaris, Paracolobactrum coliforme, Achromobacter liquefaciens, Micrococcus erogene) e diversi protozoi sono in grado di produrre l’indolo perché
possiedono la triptofanasi, un enzima batterico che catalizza reversibilmente la scissione della catena laterale del triptofano con formazione di indolo, ammoniaca e acido piruvico. La triptofanasi viene attivata dalla presenza di triptofano e
31 repressa dalla presenza di glucosio (Yokoyama e Carlson, 1979); vista la diffusione di questo enzima in molte specie batteriche, la produzione di indolo viene utilizzato come test diagnostico di routine per valutare l’attività metabolica della flora intestinale (Deslandes et al., 2006).
A differenza dell’indolo e dell’acido indolacetico, lo scatòlo viene prodotto da un numero limitato di microrganismi, in particolare lattobacilli e clostridi, ma non dai protozoi (Whitehead et al., 2008). Tuttavia, la contemporanea presenza di protozoi sembra aumentare la capacità dei batteri di produrre scatòlo (Mohammed et al., 2003); probabilmente, il metabolismo dei protozoi mette a disposizione una maggiore quantità di intermedi che possono essere trasformati in scatòlo. Deslandes et al. (2001) riportano sei specie di batteri in grado di produrre scatòlo:
Clostridium scatòlogenes, Clostridium nauseum, Pseudomonas sp., Rhizobium sp., Lactobacillus helveticus e Lactobacillus sp. Strain 11201. Tra questi, l’unico
batterio in grado di produrre lo scatòlo direttamente dal triptofano è il Clostridium
scatologenes (Cook et al., 2007). In maniera simile a quanto visto per l’apparato
respiratorio, lo scatòlo sembra presentare un’attività tossica anche nei confronti dei microrganismi. La sua presenza inibisce, infatti, la crescita microbica fatta eccezione per il Lactobacillus sp. Strain 11201, che riesce a sopravvivere in un ambiente con concentrazione di scatòlo fino a 700 μg/ml (Cook et al., 2007). Ad oggi, dalle ricerche effettuate in letteratura, non è presente alcuno studio che abbia investigato l’effetto diretto dell’alimentazione sulla crescita microbica dei diversi batteri che sintetizzano indolo e scatolo. Tuttavia, sono stati eseguiti alcuni studi
in vitro relativi all’effetto del pH e della temperatura sulla proliferazione di tali
32 massimi di crescita microbica si ottenevano a una temperatura di circa 37 °C e valori di pH compresi tra 5 e 7.5. Più recentemente, Liou et al. (2005) e Doerner et al. (2009) hanno confermato questi risultati relativamente al Clostridium
scatologenes; questi autori hanno infatti osservato che il batterio si riproduce due
volte più velocemente alla temperatura di 37 °C con un pH di 6.0 rispetto alla condizione di neutralità (pH=7.0).
Così come descritto per gli altri prodotti della degradazione proteica, anche per i prodotti di derivazione indolica, la dieta, ed in particolare il rapporto tra carboidrati fermentescibili e proteine, rappresenta un fattore determinante nella biosintesi dell’indolo e dello scatòlo (vedi paragrafo 2.2). In tabella 3 sono riportati i valori del rapporto tra carboidrati-fermentescibili e proteine di alcune essenze foraggere e di concentrati somministrati agli animali in diverse prove sperimentali.
Tabella 3 - Rapporto Carboidrati-fermentiscibili:Proteina in diversi alimenti zootecnici
Carboidrati fermentescibili
Proteina grezza Autore
Pascolo naturale 0.73 Young et al., 2003
Lolium multiflorum 0.87 Gregorini et al., 2007
Dactylis Glomerata 0.80 Gregorini et al., 2008
Tripsacum dactyloides 0.84 Huntington et al.,
2007
Medicago sativa 0.42 Burns et al., 2005
Fieno di erba medica 0.55 Burns et al., 2007 Fieno di erba medica 0.59 Avondo et al., 2009 Concentrato a base di erba medica 1.3 Pagano et al., 2012 Concentrato a base di erba medica 1.76 Young et al., 2003 Concentrato a base di mais 2.93 Young et al., 2003
33 Come si può osservare, i concentrati mostrano valori più elevati dei foraggi; tra questi ultimi, i foraggi verdi hanno rapporti più alti rispetto ai foraggi essiccati. Secondo quanto riportato da Sheat et al. (2001), per sostenere il metabolismo batterico è fondamentale sincronizzare la presenza di un’adeguata quantità di proteine e di energia, sottoforma di carboidrati fermentescibili. Infatti, in presenza di un basso rapporto tra carboidrati e proteine, la carenza di energia disponibile per i batteri ruminali rende necessario l’utilizzo degli aminoacidi come fonte energetica determinando la formazione di indolo e scatolo. Per questo motivo l’accumulo dei composti che derivano dalla degradazione proteica è maggiore negli animali allevati al pascolo (in cui questo rapporto è sempre inferiore ad uno) rispetto a quelli allevati in stalla.
A supporto di quanto detto, in letteratura sono presenti numerosi articoli che confermano questa relazione. Young et al. (2003) hanno osservato l’accumulo di scatolo e di indolo nel grasso perirenale di agnelli alimentati al pascolo o in stalla con due concentrati a diverso rapporto carboidrati:proteine. Gli autori hanno riportato che l’indolo e lo scatolo erano significativamente più alti nel grasso perirenale degli animali che avevano utilizzato il pascolo rispetto a quelli che avevano ricevuto le due tipologie di concentrato; inoltre, dal confronto tra i due tipi di concentrati, si è evidenziato come l’accumulo di indolo e scatolo fosse più alto per il gruppo di animali che aveva ricevuto il concentrato con il rapporto carboidrati:proteine più basso. In uno studio simile in cui Priolo et al. (2009) avevano comparato la presenza di indolo e scatolo nel tessuto adiposo di agnelli allevati in stalla con un concentrato commerciale o con erba verde sfalciata, i risultati indicano che l’indolo e lo scatolo erano significativamente più alti nel
34 gruppo di animali che avevano ricevuto l’erba verde rispetto a quelli che avevano ricevuto il concentrato. In questo esperimento gli autori hanno valutato anche l’effetto della somministrazione di una fonte esterna di tannini condensati. I tannini sono composti secondari che si ritrovano in quantità variabili nei foraggi animali, i quali hanno la capacità di formare legami stabili con le proteine e con gli enzimi, sequestrandoli, e di ridurre il metabolismo batterico e quindi in teoria anche la produzione dei loro metaboliti. A conferma di ciò, gli autori riportano che la quantità di scatolo è risultata significativamente più bassa nel grasso degli animali cui era stata somministrata la fonte di tannini condensati rispetto a quelli che non l’avevano ricevuta. Un risultato simile era stato precedentemente riportato da Schreurs et al. (2007b) i quali avevano comparato la presenza di scatolo e indolo nel grasso della carne di agnelli alimentati con essenze foraggere a contenuto crescente di tannini condensati.
Per quel che riguarda l’effetto dell’alimentazione sull’accumulo dei derivati indolici nelle carni degli animali di specie bovina, sono stati riportati risultati simili a quanto ottenuto per la specie ovina. Serrano et al. (2011) hanno osservato che lo scatolo si accumulava in quantità minori nel tessuto adiposo di vitelli alimentati al pascolo cui veniva somministrato anche un concentrato ad libitum rispetto a vitelli alimentati al pascolo cui il concentrato veniva fornito, invece, in quantità limitata. Anche in questo caso gli autori hanno attribuito questo risultato al rapporto carboidrati:proteine, più alto nella dieta contenente la maggiore quantità di concentrato, e che quindi avrebbe ridotto la degradazione delle proteine a livello ruminale e la conseguente disponibilità di triptofano per la biosintesi batterica di indolo e scatolo. Recentemente, Vasta et al. (2011) hanno
35 osservato, per la prima volta, la presenza di scatolo nel muscolo longissimus dorsi di gruppi di giovenche alimentate rispettivamente solo al pascolo, solo con concentrato, con insilato e pascolo o con insilato, pascolo e un’integrazione di concentrato. Secondo quanto riportato da questo studio, lo scatolo si accumula anche nel muscolo in quantità minori quando la dieta è ricca di concentrati. Gli autori concludono, anche, che la presenza di scatolo nel muscolo può far parte di un pool di parametri da utilizzare al fine di risalire alla tipologia di alimentazione somministrata agli animali.
3.3. Strategie per ridurne l’accumulo 3.3.1. Castrazione
Ridurre l’accumulo dei composti responsabili di aromi sgradevoli nella carne è uno degli obiettivi fondamentali per gli allevatori e i produttori di carne. Gli approcci usati fino ad oggi hanno riguardato sia metodi in grado di inibire il passaggio alla maturità sessuale, sia metodi meno cruenti basati sullo studio di alimentazioni studiate per ridurre la biosintesi di indolo e scatolo.
La castrazione chirurgica è stata ampiamente usata nella specie suina per ridurre la concentrazione di scatolo nel grasso al di sotto del valore soglia di 0.20-0.25 ppm oltre il quale l’odore viene avvertito (Peterson e Reineccius, 2003), inoltre, la castrazione elimina la possibilità di accoppiamenti non programmati che metterebbero a rischio i programmi di selezione e riduce l’aggressività tipica dei suini interi. Questa tecnica non è, tuttavia, esente da problemi. Inoltre, la castrazione chirurgica avviene senza l’uso di anestesia e questo sembra causare un trauma nei piccoli suinetti, che, rispetto ai non castrati, presentano alcuni disturbi
36 comportamentali. I comportamenti anomali iniziano pochi giorni dopo l’intervento e proseguono nelle settimane successive (Hay et al., 2003): il sintomo più evidente è l’elevato livello di vocalizzazione mostrato dai maialini castrati rispetto a quelli non castrati e alle femmine (Marx et al., 2003). Gli stessi sintomi sono stati riscontrati anche nei suinetti castrati chirurgicamente ma su cui era stata eseguita l’anestesia. (McGlone et al., 1993). Allevare animali interi è senza dubbio più conveniente perché la conversione dei nutrienti e la crescita ponderale sono superiori le carcasse ottenute sono più magre rispetto a quelle dei suini castrati (Bañòn et al., 2004). Anche a livello nutrizionale, la carne dei maiali interi è superiore grazie al più alto contenuto di proteine (Naděje et al., 2000).
Prove simili sono state effettuate anche sugli agnelli. Young et al. (2006), in uno studio avente come scopo quello di ridurre il livello di scatolo nella carne ovina prodotta in Australia in modo da renderla accettabile anche in altri paesi, hanno confrontato la quantità di scatolo e indolo nella carne di agnelli interi e castrati macellati in modo scalare in un arco di tempo distribuito su due anni. I risultati mostrano differenze significative tra animali interi che presentavano livelli di scatolo e indolo costantemente più alti dei castrati durante tutto l’arco dei due anni. Tuttavia, andando a valutare l’effetto della castrazione sul flavour, le differenze tra animali interi e castrati si perdevano già dopo i primi tre mesi di ingrasso, rendendo quindi inutile la castrazione.
Oltre a tutti i motivi legati al benessere animale e al maggior costo di alimentazione legati all’allevamento di animali castrati, la tecnica della castrazione non può essere perseguita come metodo per la riduzione della presenza di scatolo nelle carni in quanto messa al bando da sempre più paesi. Dal
37 2009 la castrazione è stata vietata nel Regno Unito e in Australia, dal 2010 in Svizzera e dal 2018 lo sarà nei paesi dell’Unione Europea.
3.3.2. Selezione genetica
I divieti sulla castrazione stanno stimolando la ricerca di strumenti alternativi finalizzati alla riduzione dello scatolo nei tessuti animali. Tra le possibili alternative si annoverano la selezione di genotipi animali che naturalmente producono meno scatolo (Gregersen et al., 2012) e lo studio di tecniche di alimentazione in grado di ridurre la produzione di scatolo e indolo. La selezione genetica ha riguardato particolarmente la specie suina. Un tipo di approccio si basa sull’individuazione di una regione del DNA correlata alla presenza di scatolo e indolo nella carne per poi analizzare la reale relazione tra il gene o i geni presenti in quella zona e la presenza dei composti indolici. Un altro metodo è quello di analizzare l’espressione di quei geni ritenuti potenzialmente coinvolti nel metabolismo dello scatolo. Recentemente, Moe et al. (2009) hanno compendiato i geni candidati ad avere un effetto sull’odore di verro nella carne suina.
3.3.3. Alimentazione
Nei ruminanti, la produzione di indolo e scatòlo è dovuta all’intensa attività operata dalla microflora ruminale che, in assenza di ossigeno e in condizioni di un disequilibrio tra energia disponibile (zuccheri fermentescibili) e proteine solubili, degrada il triptofano per trarne energia. Le strategie alimentari volte a ridurre la produzione di indolo e scatòlo devono, pertanto, essere volte ad aumentare il rapporto carboidrati-fermentescibili: proteine-solubili (Schreurs et al., 2008).
38 Inoltre, è ben noto che tramite la dieta è possibile selezionare la microflora che colonizza l’ambiente ruminale.
Secondo gli studi presenti in letteratura ed esaminati nel paragrafo precedente, la via più semplice per ridurre la produzione di scatòlo e indolo è quella di somministrare agli animali una dieta a base di concentrati. Tutti gli studi concordano sul fatto che il flavour fecale e pastorale si riduce drasticamente quando il pascolo rappresenta una quota minoritaria della dieta animale. Priolo et al. (2009) hanno osservato i livelli di scatolo e di indolo nel liquido ruminale e nel grasso perirenale di agnelli alimentati con erba fresca e con concentrati; i risultati mostrano, indiscutibilmente, come i livelli di scatolo e di indolo fossero il doppio nel grasso degli agnelli alimentati con erba rispetto a quelli alimentati concentrati. Questa soluzione, pur se semplice tecnicamente, è difficilmente applicabile a causa dei costi di gestione che si genererebbero. Infatti, l’utilizzo del pascolo naturale rappresenta un efficace metodo di riduzione dei costi di produzione che consente di rendere economicamente sostenibile l’attività di allevamento, in particolar modo nell’allevamento dei piccoli ruminanti in zone svantaggiate come quelle dell’area mediterranea (Galanopoulos et al., 2011).
Un periodo di finissaggio basato su concentrati potrebbe ridurre sia i costi sia l’effetto del pascolo sul flavour della carne (Leao et al., 2012), d’altro canto è stato osservato che spostando gli animali dal pascolo in stalla, si ottiene un iniziale e repentino calo del livello di scatolo che nel grasso perirenale rimane stabile a partire dalla seconda settimana successiva al cambio di alimentazione (Priolo et al., 2001 citato da Vasta e Priolo, 2006).
39 Anche l’utilizzo di essenze di pascolo diverse potrebbe contribuire a ridurre la formazione dello scatolo. Schreurs et al. (2007a) hanno riportato differenze di flavour derivanti dall’uso di specie vegetali con differente attitudine a generare indolo e scatolo. Queste differenze sono legate alla concentrazione di proteine grezze, nonché alla loro solubilità e degradabilità a livello ruminale sia in vivo (Schreurs et al., 2007b) sia in vitro (Schreurs et al., 2007a) che si è tradotta in una diversa produzione di scatolo e indolo. Schreurs et al. (2008) hanno raccolto in una tabella l’effetto di alcune essenze vegetali sul flavour (Tab. 3) derivante da una diversa biosintesi ruminale ed accumulo di indolo e scatolo nei tessuti esaminati, tuttavia gli autori non escludono che i diversi effetti possano essere dovuti anche alla presenza di altri derivati azotati sintetizzati a livello ruminale.
40
Tabella 4 – Influenza dei diversi foraggi sul flavour della carne ovina - Fonte Schreurs et al.
(2008)
Reference Forage diets Meat Floavour/odour results Cramer et al. (1967) White clover, perennial ryegrass
Feeding clover gave a stronger flavour compared to feeding
ryegrass
Shorland et al. (1970) White clover, perennial ryegrass
Feeding clover gave a stronger flavour compared to feeding
ryegrass Nicol and Jagusch
(1971) Lucerne, ryegrass pasture
Lucerne gave more intense odour
Nixon (1981)
Lotus pedunculatus, red clover, white clover, Lucerne, perennial
ryegrass Off-flavours more predominant Bailey et al. (1994),
Trial 2
Lotus corniculatus, Lucerne,perennial ryegrass, white
clover
No difference in flavour intensity Fraser et al. (2004)
Red clover, lucerne, perennial
ryegrass No difference in flavour between Schreurs et al. (2007b) White clover, perennial ryegrass
Overall flavour intensity was higher from lambs fed white
clover
Di particolare interesse è l’idea di sfruttare sostanze naturalmente presenti nei vegetali in grado di interferire con il metabolismo della microflora ruminale. I tannini condensati (TC) sono composti fenolici che si trovano nelle cellule di molte specie vegetali usate come foraggi, in grado di formare complessi insolubili con le proteine proteggendole dall’attacco degli enzimi ruminali e rallentandone la
41 degradazione (Min et al., 2003). Allo stesso modo i TC possono formare complessi con gli enzimi dei batteri del rumine interferendo con la normale attività (Molan et al., 2001, Vasta et al., 2009a). Min et al. (2002) hanno riscontrato un’attività batteriostatica nei confronti di batteri proteolitici. I TC esplicano la loro azione anche nei confronti dei protozoi (Vasta et al., 2010), anch’essi coinvolti nelle produzione di indolo.
Basandosi sul presupposto che i tannini condensati possano avere un effetto inibitorio sull’attività proteolitica dei batteri ruminali, sono stati effettuati diversi studi per valutare l’impatto che i TC hanno sulla produzione di indolo e scatolo, che confermano la loro capacità di inibirne la produzione.
Schreurs et al. (2007a,b) hanno messo a confronto tre essenze foraggere (Loglio perenne, sulla e trifoglio bianco) contenenti diverse quantità di tannini o privi di TC. Sebbene la quantità di proteina grezza non differisse significativamente tra i tre foraggi, la quantità di scatolo e indolo prodotta era inversamente proporzionale alla quantità di tannini presenti. Lo stesso risultato è stato ottenuto sia in vitro (Schreurs et al., 2007a) sia in vivo (Schreurs et al., 2007b). Ad ulteriore conferma del ruolo dei TC nell’inibire la produzione di scatolo ed indolo, nell’esperimento in vitro fu aggiunto polietilene glicole (PEG), un polimero in grado di legarsi ai TC con maggiore affinità rispetto alle proteine e creare complessi stabili. Il risultato fu un netto incremento della produzione di indolo e/o scatolo.
Tuttavia, l’effetto dei TC dipende anche dalla loro concentrazione. Priolo et al. (2005) mettendo a confronto una dieta di sola sulla (leguminosa foraggera contenente TC) con una dieta a base di concentrati, osservarono una maggiore quantità di scatòlo nel grasso perirenale degli agnelli alimentati con foraggio.
42 Questo risultato sembrava essere in contrasto con quanto riportato precedentemente in letteratura e in particolare con uno studio simile effettuato per studiare la relazione tra i TC presenti nella sulla e la presenza di scatòlo nel latte (Roy et al., 2004). Questi ultimi autori osservarono una riduzione della concentrazione di scatolo nel latte come conseguenza della somministrazione di
Hedysarum coronarium. Priolo et al. (2005) conclusero ipotizzando che la
quantità di TC forniti con la sulla non era sufficientemente elevata per produrre un effetto sulla microflora ruminale. In esperimenti in vitro, Schreurs et al. (2007a) riportano una riduzione tra il 20 e il 45% della produzione di scatolo come conseguenza della presenza dei tannini pari a 35g/kg di sostanza secca. Secondo gli autori, la variabilità dei risultati ottenuta con lo stesso livello di tannini condensati potrebbe essere ascritta alla tipologia di tannini condensati utilizzati. In un esperimento successivo, Priolo et al. (2009) per studiare l’effetto dei TC sulla produzione di scatolo e indolo e sul flavour della carne di agnelli alimentati con erba fresca (veccia, foraggera leguminosa non contenente TC) o concentrato, hanno aggiunto alle diete una fonte di tannini esterna, costituita da polvere di quebracho (Schinopsis lorentzii), in quantità sufficiente (40 g/kg SS) ad avere un effetto sulla popolazione ruminale. I risultati di questo studio evidenziano una riduzione significativa della concentrazione di scatolo nel liquido ruminale e nel grasso caudale come conseguenza della somministrazione TC.
Infine, un’ultima strada da seguire è quella di aumentare l’apporto di carboidrati altamente fermentescibili in modo da ridurre il rapporto carboidrati:proteine. Questo fornirebbe ai batteri ruminali l’energia necessaria per incorporare gli aminoacidi nelle proteine batteriche evitando il metabolismo del
43 triptofano e la conseguente produzione di indolo e scatolo. Mohammed et al. (2003), hanno dimostrato in vitro che è possibile ridurre da due a quattro volte la produzione di indolo e scatolo da triptofano, semplicemente aggiungendo al terreno di coltura amido o glucosio. In un esperimento eseguito in vivo su bovini da latte, Tavandale et al. (2006) hanno osservato che l’uso di una varietà di loglio ad alto contenuto di zuccheri ha ridotto significativamente la quantità di scatolo, indolo e p-cresolo nel latte rispetto alla varietà standard. Ad oggi nessuno studio del genere è stato effettuato sulla specie ovina.