Corso di Dottorato Tecnologie per la Salute:
Valutazione e Gestione delle Innovazioni nel Settore Biomedicale S.S.D. Med. 18
Tesi di Dottorato:
APPLICAZIONE DEL SISTEMA ROBOTICO
“DA VINCI”
ALLA CHIRURGIA RESETTIVA DEL
PANCREAS.
INDICE
Pg.
Capitolo I: Introduzione 4-19
1.1 Cenni storici di chirurgia pancreatica 4-8
1.2 Lo sviluppo della chirurgia mini invasiva del pancreas
9-15
1.3 Chirurgia Robotica 16-20
1.4 Scopo dello studio 20
Capitolo II: Materiali e Metodi 22-32
2.1 Il sistema robotico Da Vinci 22-23
2.2 Criteri di inclusione dei pazienti 23
2.3 Work-up pre-operatorio 24-25
2.4 Tecnica chirurgica 25-29
2.5 Casistica 30-33
Capitolo III: Risultati 35-44
3.1 Risultati istologici 35-36
3.2 Risultati intra-operatori 36-39
3.3 Risultati peri-operatori 40-44
Capitolo IV: Conclusioni 46-50
Capitolo V: Bibliografia 52-56
CAPITOLO I
1.1. Cenni storici di chirurgia pancreatica
La chirurgia resettiva del pancreas ha da sempre rappresentato una sfida per il chirurgo generale, ponenedo una serie di difficoltà tecniche in grado di condizionare in maniera pesante l’outcome dell’intervento, a fronte di risultati oncologici tuttora poco incoraggianti, ciò che giustifica probabilmente lo sviluppo relativamente tardivo di questa disciplina, spesso costellata, fino anche ai tempi moderni, di correnti nichilistiche propense ad interventi spesso palliativi e comunque avverse ad un approccio aggressivo. I primi interventi sul pancreas e/o sulla regione periampollare risalgono alla fine dell’ ‘800: nel 1898 Codivilla (Fig. 1.1) eseguì la prima duodenocefalopancreasectomia in un unico step, ma il paziente morì 16 giorni dopo l’intervento.
Fig. 1.1. Alessandro Codivilla
Lo stesso intervento in 2 step ma con risultati analoghi venne eseguito 14 anni dopo da Kausch (Fig. 1.2.).
Fig. 1.2.
Fig. 1.3.
Nello stesso anno presso l’Università Johns Hopkins di Baltimora (USA), Wiliam Halsted (Fig. 1.3), eseguiva la prima ampullectomia. Il paziente
Nonostante tutto queste esperienze pionieristiche rimasero casi isolati e gli scarsi risultati ottenuti configuravano questo settore della chirurgia come assolutamente proibitivo per l’elevata morbilità correlata, associata alla scarsa prognosi ottenuta dalla chirurgia resettiva quando non ancora affiancata da terapie farmacologiche antiblastiche efficaci.
L’avvento della moderna chirurgia pancreatica si deve, alla metà degli anni ’30, ad Allan Whipple (Fig. 1.4) che, nel 1935, pubblica i primi risultati della sua esperienza2.
Fig. 1.4: Ritratto di Allan Whipple.
Da questo punto in poi seguirono, alternati a periodi di stasi, periodi di rapida crescita dovuti, soprattutto, al miglioramento delle tecniche anestesiologiche e rianimatorie, all’innovazione delle più sofisticate tecniche di imaging ed all’introduzione della terapia intensiva.
Di questo passo, è solo agli inizi degli anni ’80 che, si assiste ad una progressiva riduzione della morbilità perioperatoria e quindi ad una più ampia diffusione della chirurgia oncologica del pancreas (Tabella 1.1).
Tabella 1.1: Morbilità e mortalità correlata a resezione pancreatica/era
Autore pubblicazioneAnno di Anno mediano della serie pazientiNo. Di Mortalità ComplicanzeComplicanze f i s t o l a pancreatica f i s t o l a biliare Monge12 1964 1951 239 19 (si) 13 5 Warren13 1973 1957 348 16 (si) 8 7 Smith14 1973 1959 224 7 (sc) 8 Herter15 1982 1959 102 15 (si) 9 4 Nakase16 1977 1962 822 21 (mi) 14 4 Warren13 1973 1966 139 10 (si) 7 21 Yeo17 1995 1982 201 5 (si) Andersen18 1994 1983 117 8 (si) 16 5 Tsao19 1994 1986 101 2 (si) 15 5 Nitecki20 1995 1986 186 3 (si) Geer21 1993 1987 146 5 (si) 2 2 Trede22 1990 1987 118 0 (sc) 8 3 Swope23 1994 1989 299 8 (mi) Cameron24 1993 1989 145 0 (si) 19 6 Gordon25 1995 1990 271 2 (si) F e r n a n d e z d e l Castillo26 1995 1992 142 0 (sc) 7 4
Proprio per questo motivo si è progressivamente passati da un atteggiamento “nichilistico”, di cui Crile3 agli inizi degli anni ‘70
rappresentava il capofila e che affermava “l’inutilità della chirurgia resettiva pancreatica”, ad una filosofia aggressiva della chirurgia pancreatica che ha dominato con Fortner4 la metà degli anni ’70.
Gli anni ’80-’90 hanno visto il fiorire di dibattiti focalizzati più sul valore oncologico delle resezioni pancreatiche che sul rischio peri-operatorio5-6.
Oggi, ad oltre 70 anni dalla nascita della moderna chirurgia del pancreas, molto è stato definito circa lo standard della tecnica chirurgica, l’estensione della clearance linfatica o il ruolo delle resezioni
Figura 1.5: Evoluzione storica delle tecniche di duodenocefalopancreasectomia
Uno dei dibattiti più accesi riguardo alle tecniche chirurgiche di base è l’associazione alle pancreasectomie convenzionali di eventuali resezioni vascolari in particolar modo a carico dell’asse venoso mesenterico-portale13 (Fig. 1.6 - 1.8).
Fig. 1.6, 1.7, 1.8.
Ma la rivoluzione più tangibile nella tecnica chirurgica delle pancreasectomie è stata senz’altro l’applicazione dell’approccio
1.2. Lo sviluppo della chirurgia mini-invasiva del pancreas
Da circa un decennio a questa parte la tecnica mini-invasiva, che fino a pochi anni fa era considerata incompatibile con interventi di chirurgia oncologica maggiore, ha preso campo sempre più in pancreatologia e, se è vero che la tecnica laparoscopica pura ha reso fattibili in modo mininvasivo le resezioni corpo-caudali ma ha lasciato irrisolte molte problematiche tecniche legate alle resezioni cefaliche, una nuova rivoluzione in tal senso è stata apportata dall’introduzione del sistema robotico Da Vinci, che ha rimesso in gioco la fattibilità delle duodenocefalopancreasectomie con tecnica miniinvasiva; il dibattito rimane tuttavia aperto soprattutto in merito alla selezione dei pazienti candidabili a tali tipi di interventi e ai costi delle nuove tecniche robotiche.
Nell’Ottobre del 1910, Jacobaeus (Figura 1.5), medico presso l’Università Karolinska di Stoccolma, sviluppa per primo l’idea di utilizzare un cistoscopio da introdurre in cavità peritoneale a scopo esplorativo. Il medico svedese, dopo una fase sperimentale animale, pubblica una serie di 17 casi di pazienti con ascite indagati mediante questa nuova metodica diagnostica chirurgica14.
Poco più tardi, all’Università Johns Hopkins di Baltimora (USA), Bernheim (Figura 1.6), descrive un’esperienza simile nella quale, per la prima volta, viene descritta una “esplorazione mini invasiva della cavità peritoneale” per un carcinoma della testa del pancreas15.
Figura 1.6.
Le tecniche laparoscopiche, laddove applicabili, sembrano molto promettenti in termini di un più rapido recupero da parte del paziente, a seguito della ridotta morbilità associata ad ampie incisioni chirurgiche, alla minore risposta allo stress legata alla ridotta estensione del trauma chirurgico e al più rapido recupero della canalizzazione intestinale a seguito di una minor manipolazione e disidratazione dell’intestino.
E’ tuttavia solamente alla fine degli anni ‘80 che la laparoscopia inizia ad essere utilizzata in maniera significativa nella pratica clinica; nel 1987 Philippe Mouret a Lione (Fig. 1.7), eseguì il primo intervento di colecistectomia laparoscopica.
Poco più tardi l’uso della laparoscopia venne introdotta in chirurgia pancreatica in maniera sistematica per la stadiazione delle neoplasie del pancreas, avvalendosi nei tempi moderni anche dell’uso della ecografia di contatto, e permettendo la caratterizzazione istologica16,17 della
lesione primitiva o di eventuali localizzazioni a distanza.
Grazie al miglioramento delle tecnologie “miniinvasive”, sia relative ai sistemi ottici che ai devices chirurgici, e grazie ad una nuova generazione di chirurghi pancreatici che hanno investito tempo ed energie per ampliare le proprie capacità tecniche nel campo delle metodiche mininvasive, la laparoscopia del pancreas diventa anche “operativa” e non solo “diagnostica” all’inizio degli anni ’90.
Inizialmente la laparoscopia trova applicazione nella chirurgia palliativa del cancro del pancreas. Nei casi in cui la laparoscopia diagnostica mostra una situazione per la quale la resezione non è indicata, nella stessa seduta, si procede all’intervento palliativo che, invece di richiedere una conversione ad un intervento “open” tradizionale, viene eseguito per via laparoscopica, permettendo così al paziente, in molti casi già defedato per lo stato neoplastico avanzato, un rapido recupero ed anticipando i tempi delle terapie antiblastiche a cui il paziente è candidato. Nel 1992 Cuschieri18 pubblica l’esperienza di 5
colecisto-digiuno-anastomosi per la palliazione dell’ittero in pazienti affetti da carcinoma della testa del pancreas non resecabile. In 4 dei 5 pazienti il decorso post-operatorio è regolare con una rapida risoluzione dei sintomi e un breve ricovero. Le conclusioni degli autori sono che la laparoscopia potrebbe rappresentare una valida alternativa alla chirurgia tradizionale o a quella endoscopica nel trattamento “palliativo” chirurgico del cancro del pancreas. Solo nella prima metà degli anni ’90
di 6 trocar da 10 mm.In questo intervento la fase ricostruttiva ha previsto come primo step una anastomosi intracorporea pancreatico-digiunale (T-L), quindi, distalmente a questa e sulla stessa ansa, una anastomosi epatico-digiunale (T-L). A questo punto il pezzo operatorio è stato estratto attraverso una piccola incisione epigastrica da dove poi è stata eseguita anche l’anastomosi duodeno-digiunale (T-L). L’innovazione e i progressi che l’approccio mininvasivo ha portato nel mondo della chirurgia hanno rappresentato una vera e propria rivoluzione in termini tecnici anche se non poche sono le problematiche che lo accompagnano. La mancanza di una visione tridimensionale, la riduzione della sensibilità tattile, la difficoltà nella fase ricostruttiva sono solo alcune delle carenze che questa metodologia inevitabilmente si è portata dietro dai suoi albori. Anche lo sviluppo di nuove metodiche, come la laparoscopia hand-assisted, ha sicuramente ridotto alcune delle limitazioni delle tecniche mininvasive ma non hanno spostato in modo significativo i limiti della metodica, tanto che, a distanza di molti anni dalle prime resezioni pancreatiche laparoscopiche, ancora oggi non vi è un accordo universalmente accettato su quello che sia il reale ruolo della laparoscopia in ambito pancreatologico, con particolare riferimento alle resezioni cefaliche.
Recentemente Briggs21 ha pubblicato una revisione molto dettagliata
della letteratura che ha cercato di comprendere, in modo razionale, il reale ruolo della laparoscopia in questo settore chirurgico. In questo lavoro gli autori hanno analizzato i risultati di 39 lavori riportati in letteratura.
In conclusione gli autori affermano che le resezioni distali22-27 (Tabella
1.2) e le enucleazioni28 (Tabella 1.3), pur caratterizzate da una discreta
morbilità, sono interventi che oggi possiamo definire sicuri, ripetibili e caratterizzati, in genere, da una riduzione della degenza
post-altrettanto ripetibili né, tantomeno, mostrano alcun vantaggio in termini di decorso post-operatorio29.
In realtà le conclusioni dello studio di Briggs non sorprendono molto se si pone attenzione all’evoluzione ed alle attuali “possibilità” della chirurgia laparoscopica. In effetti oggi è abbastanza chiaro come, per via laparoscopica, sia possibile eseguire, almeno da un punto di vista tecnico, la maggior parte degli interventi demolitivi che, fino a pochi anni fa, sarebbe stato impensabile eseguire se non a cielo aperto. L’aumento dell’expertise chirurgica, ma soprattutto l’avvento dei nuovi dissettori ad ultrasuoni o a radiofrequenze ha consentito il diffondersi della chirurgia colorettale, epatica, pancreatica (sinistra prevalentemente) laparoscopica.
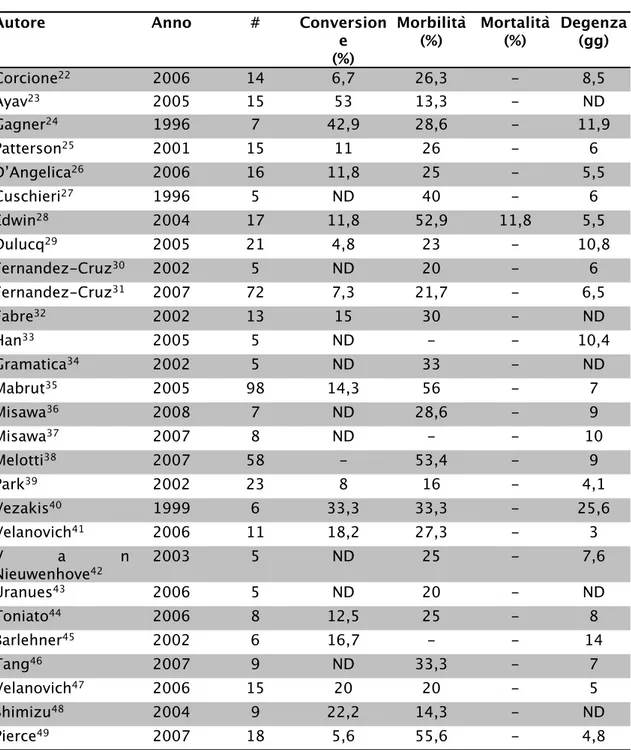
Tabella 1.2.: risultati pubblicati di pancreasectomie distali laparoscopiche.
Autore Anno # Conversion
e (%) Morbilità (%) Mortalità(%) Degenza(gg) Corcione22 2006 14 6,7 26,3 - 8,5 Ayav23 2005 15 53 13,3 - ND Gagner24 1996 7 42,9 28,6 - 11,9 Patterson25 2001 15 11 26 - 6 D’Angelica26 2006 16 11,8 25 - 5,5 Cuschieri27 1996 5 ND 40 - 6 Edwin28 2004 17 11,8 52,9 11,8 5,5 Dulucq29 2005 21 4,8 23 - 10,8 Fernandez-Cruz30 2002 5 ND 20 - 6 Fernandez-Cruz31 2007 72 7,3 21,7 - 6,5 Fabre32 2002 13 15 30 - ND Han33 2005 5 ND - - 10,4 Gramatica34 2002 5 ND 33 - ND Mabrut35 2005 98 14,3 56 - 7 Misawa36 2008 7 ND 28,6 - 9 Misawa37 2007 8 ND - - 10 Melotti38 2007 58 - 53,4 - 9 Park39 2002 23 8 16 - 4,1 Vezakis40 1999 6 33,3 33,3 - 25,6 Velanovich41 2006 11 18,2 27,3 - 3 V a n Nieuwenhove42 2003 5 ND 25 - 7,6 Uranues43 2006 5 ND 20 - ND Toniato44 2006 8 12,5 25 - 8 Barlehner45 2002 6 16,7 - - 14 Tang46 2007 9 ND 33,3 - 7 Velanovich47 2006 15 20 20 - 5 Shimizu48 2004 9 22,2 14,3 - ND Pierce49 2007 18 5,6 55,6 - 4,8
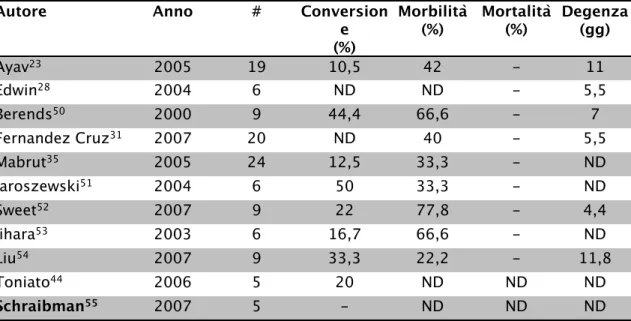
Autore Anno # Conversion e (%) Morbilità (%) Mortalità(%) Degenza(gg) Ayav23 2005 19 10,5 42 - 11 Edwin28 2004 6 ND ND - 5,5 Berends50 2000 9 44,4 66,6 - 7 Fernandez Cruz31 2007 20 ND 40 - 5,5 Mabrut35 2005 24 12,5 33,3 - ND Jaroszewski51 2004 6 50 33,3 - ND Sweet52 2007 9 22 77,8 - 4,4 Iihara53 2003 6 16,7 66,6 - ND Liu54 2007 9 33,3 22,2 - 11,8 Toniato44 2006 5 20 ND ND ND Schraibman55 2007 5 - ND ND ND
Tabella 1.3.: risultati pubblicati di enucleazioni laparoscopiche.
Autore Anno # Conversion
e (%) Morbilità (%) Mortalità(%) Degenza(gg) Palanievelu56 2007 45 - 26,7 2,2 10,2 Dulucq57 2006 25 12 31,8 4,5 16,2 Gagner58 1997 10 40 “high” - 22,3 Lu59 2006 5 ND 60 20 ND
Tabella 1.4.: risultati pubblicati di resezioni pancreatiche cefaliche laparoscopiche.
Il vero limite della laparoscopia è invece da cercarsi negli interventi di chirurgia pancreatica che prevedono una fase ricostruttiva. Infatti il grado di movimento fine degli strumenti laparoscopici ed il grado di percezione del ritorno di forza da parte del chirurgo sono sicuramente ridotti rispetto alla tradizionale tecnica manuale a cielo aperto.
1.3 Chirurgia robotica
Con l’avvento della tecnica robotica, i vantaggi della chirurgia miniinvasiva sono associati alla precisione dell’atto manuale anche nella fase ricostruttiva.
La prima strumentazione robotica fa la sua comparsa in chirurgia già alla fine degli anni ’80, sia pure con un significato ed uno spettro di potenzialità del tutto differente da quello odierno.
Infatti in quegli anni iniziavano le esperienze di uso di apparecchi “robotici” per applicazioni neurochirurgiche60 e urologiche61.
Tuttavia l’applicazione della robotica alla chirurgia generale inizia un po’ più tardi e può essere fatta risalire al 1994 quando nella pratica clinica la FDA autorizza l’utilizzo di un dispositivo “robotico” per la gestione dell’ottica in chirurgia laparoscopica, guidato dalla voce del chirurgo: AESOP (Computer Motion, Santa Barbara, CA, USA) (Figura 1.8). Siamo nell’era della “solo-surgery”, in cui il chirurgo primo operatore continua ad avere un ruolo operativo ma può gestire in autonomia la camera e
dunque la visione.
Fig. 1.8: Sistema robotico a controllo vocale AESOP.
Poco più tardi fa ingresso nel campo della chirurgia generale un dispositivo sicuramente più simile alla odierna idea di Robot, il sistema Zeus (Computer Motion), con un
sistema di movimento dei device interni molto simile a quello della mano (fig. 1.9).
Fig. 1.9: ZEUS Surgical System.
Il sistema Zeus non ha comunque avuto una larga diffusione in quanto la FDA ne ha consentito un utilizzo esclusivamente come “assistente chirurgo” e non come “operatore”.
Il primo dispositivo robotico “operatore” ad essere stato approvato dalla FDA per utilizzo in chirurgia generale in USA è stato il sistema Da Vinci® (Intuitive Surgical Inc., Sunnyvale, CA, USA) (Figura 1.10).
Figura 1.10: Sistema robotico “da Vinci”®.
Oggi il sistema robotico “da Vinci” viene comunemente impiegato in molti centri per interventi di chirurgia generale, tuttavia non esistono ancora dati a supporto di un reale vantaggio rispetto agli interventi eseguiti per via tradizionale.
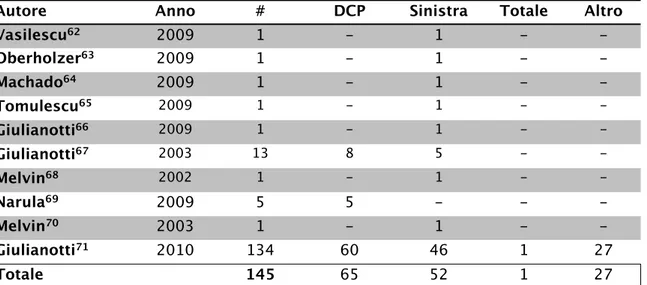
Tabella 1.5: Lavori in letteratura su pancreasectomie robotiche
L’utilizzo di questi sistemi presenta una serie di vantaggi evidenti, soprattutto nei confronti della laparoscopia tradizionale, ma anche nei confronti della chirurgia open. Tuttavia sono osservabili anche una serie di svantaggi, che impediscono, nell’attesa di studi randomizzati a lungo termine di confronto, di decretare una superiorità dell’una sull’altra metodica123
Autore Anno # DCP Sinistra Totale Altro
Vasilescu62 2009 1 - 1 - -Oberholzer63 2009 1 - 1 - -Machado64 2009 1 - 1 - -Tomulescu65 2009 1 - 1 - -Giulianotti66 2009 1 - 1 - -Giulianotti67 2003 13 8 5 - -Melvin68 2002 1 - 1 - -Narula69 2009 5 5 - - -Melvin70 2003 1 - 1 - -Giulianotti71 2010 134 60 46 1 27 Totale 145 65 52 1 27
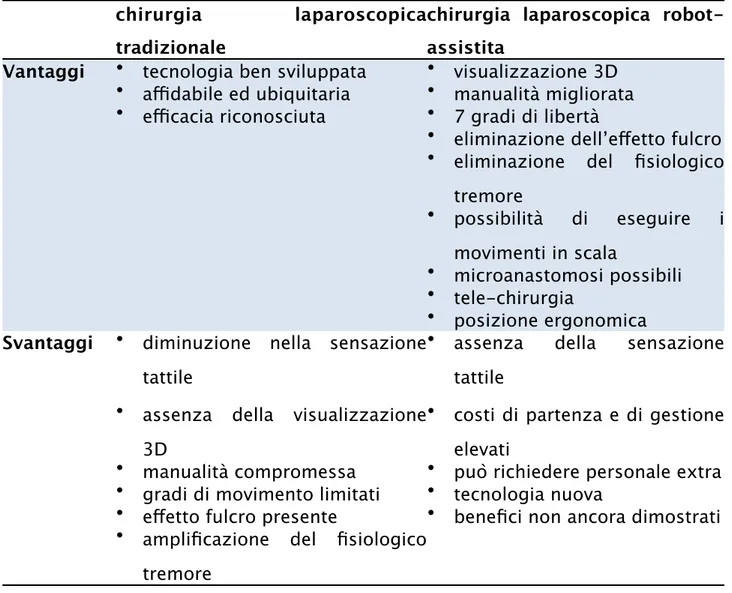
Tabella 1.5 – Confronto chirurgia laparoscopica tradizionale vs robot assistita.
chirurgia laparoscopica tradizionale
chirurgia laparoscopica robot-assistita
Vantaggi • tecnologia ben sviluppata • visualizzazione 3D • affidabile ed ubiquitaria • manualità migliorata • efficacia riconosciuta • 7 gradi di libertà
• eliminazione dell’effetto fulcro • eliminazione del fisiologico
tremore • possibilità di eseguire i movimenti in scala • microanastomosi possibili • tele-chirurgia • posizione ergonomica
Svantaggi • diminuzione nella sensazione tattile
• assenza della sensazione tattile
• assenza della visualizzazione 3D
• costi di partenza e di gestione elevati
• manualità compromessa • può richiedere personale extra • gradi di movimento limitati • tecnologia nuova
• effetto fulcro presente • benefici non ancora dimostrati • amplificazione del fisiologico
tremore
1.4
.
Scopo dello studioScopo del presente studio è analizzare i risultati a breve termine di una serie consecutiva di pancreasectomie robotiche eseguite presso la U.O. di Chirurgia Generale e Trapianti della Azienda Ospedaliero-Universitaria Pisana. L’analisi di tali dati è volta alla valutazione della “fattibilità” e della sicurezza delle pancreasectomie robotiche.
CAPITOLO II
2.1. Il Sistema robotico Da Vinci.
Il sistema robotico Da Vinci è costituito da tre componenti fondamentali: consolle, torre e carrello (figura 2.1).
La consolle è la postazione, collocata a distanza dal tavolo operatorio, da cui il chirurgo opera, manovrando gli strumenti della torre. E’ costituita da un dispositivo di osservazione binoculare, facente parte del sistema di visone 3D HD, due master controllers, cioè i manipolatori manovrati dal chirurgo, una pedaliera e un pannello di controllo.
La torre sorregge e manovra l’ottica e gli strumenti chirurgici, attraverso gli spostamenti dei quattro bracci articolabili che seguono i comandi elettromeccanici imposti dal chirurgo attraverso la consolle.
Il carrello contiene la tecnologia ausiliaria necessaria al funzionamento del sistema e all’esecuzione dell’intervento, come monitor, insufflatore di CO2, doppia
sorgente di luce ad alta intensità, unità videocamera e strumenti elettromedicali149.
Le caratteristiche interessanti di questo sistema sono molteplici. Innanzitutto la collocazione spaziale reciproca dei master controllers rispetto al sistema oculare, che permette di mantenere l’allineamento occhi-mani, come in chirurgia open, facilita il lavoro del chirurgo rispetto alla laparoscopia tradizionale. Inoltre altro indiscutibile vantaggio rispetto alla metodica mini-invasiva tradizionale è rappresentato dagli strumenti chirurgici, che presentano un’articolazione interna “endo-wrist”, che fornisce loro sette gradi di libertà di movimento e novanta gradi di angolazione consentendo un range di spostamenti superiore addirittura a quello della mano umana. Infine il sistema è in grado di convertire i movimenti della mano, rendendoli più precisi, fluidi e senza scatti, eliminando il fisiologico tremore.
2.2. Criteri di inclusione pazienti
Lo studio di tipo retrospettivo si basa sui dati raccolti in maniera prospettica in un database elettronico (Microsoft Excel©) e relativi ai pazienti sottoposti dal 1 Aprile 2008 al 30 Settembre 2011 a pancreasectomia mediante l’utilizzo del sistema robotico Da Vinci©.
Tutti i pazienti candidati a resezione pancreatica per patologie pancreatiche benigne o neoplasie maligne non localmente avanzate osservati presso la Divisione di Chirurgia Generale e Trapianti della Azienda Ospedaliero-Universitaria Pisana sono stati valutati per un approccio robotico.
I criteri utilizzati per escludere i pazienti da un programma resettivo robotico sono riportati in tabella 2.1.
2.3. Work-up pre-operatorio
Tutti i pazienti inseriti nello studio sono stati sottoposti ad un work-up pre-operatorio sia di tipo “generale” volto a valutare il rischio anestesiologico, sia specifico volto alla diagnosi e stadiazione della patologia pancreatica in oggetto.
Work-up pre operatorio “generale”
Ogni paziente è stato sottoposto a esami ematochimici pre-operatori di routine, a determinazione del gruppo sanguigno, radiografia del torace standard in 2 proiezioni, elettrocardiogramma e visita cardiologica.
Esami generali di secondo livello (ecocardiografia, coronarografia, ECG da sforzo, Holter cardiaco, prove di funzionalità respiratoria, ecc), sono stati eseguiti in base ai risultati degli accertamenti di base o alla presenza di comorbidità.
Diagnostica per immagini pre-operatoria
Tutti i pazienti sono stati sottoposti, in fase pre-operatoria a TC multistrato dell’addome, eseguita da un radiologo esperto in patologie del pancreas. L’esame, oltre ad informazioni circa il sospetto di natura della malattia è stato utilizzato per valutare la sua stadiazione ed in particolare l’estensione locale. Le lesioni che presentavano segni di avanzamento locale sono state escluse da un approccio robotico.
Altri esami strumentali utilizzati nei pazienti sottoposti a pancreasectomia robotica sono stati:
- ecografia addome;
- Colangio-wirsung RM: questo accertamento è stato eseguito in tutti i pazienti affetti da neoplasia cistica in quanto consderato il gold-standard per lo studio di patologie del sistema duttale (IPMN) a potenziale interessamento panghiandolare;
- Altri accertamenti, quali octreoscan, PET, ecoendoscopia, EGDS, colonscopia, sono stati eseguiti a seconda delle esigenze del singolo caso.
2.4. Tecnica chirurgica
Vengono descritte le procedure degli interventi più frequenti nella serie (DCP: duodenocefalopancreasectomia; PDSP: pancreasectomia distale spleen-preserving; PSD: splenopancreasectomia distale).
in regione sottombelicale, è introdotto in sede paraombelicale destra un trocar da 12 mm per l’ottica. Quindi, sotto visione, sono introdotti altri 4 trocar operativi: tre da 7 mm per gli strumenti robotici (in sede sottocostale sinistra, destra e al fianco sinistro) e l’ultimo accessorio (in sede sottombelicale), disposti come in figura 2.1. Questa disposizione è la medesima anche nelle PT, PC e nelle E. L’intervento inizia con l’esplorazione della cavità addominale, in modo da evidenziare eventuale patologia occasionale e procede con le seguenti fasi. Sezione del legamento gastrocolico ed apertura della retrocavità degli epiploon. Mobilizzazione del colon di destra, manovra di kocherizzazione del duodeno e sezione del legamento di Treitz con retrazione dell'angolo duodenodigiunale. Linfoadenectomia lungo il legamento epatoduodenale, l'arteria epatica fino al tripode e il lato destro dell'arteria mesenterica superiore. Isolamento dell’arteria epatica comune. Isolamento della vena porta sottoepatica e della vena mesenterica superiore, sotto il corpo del pancreas, attraverso la creazione di un tunnel retropancreatico. Isolamento del duodeno appena sotto il piloro e sua sezione con endoGIA da 45 mm. Dopo la completa mobilizzazione del pancreas, sezione a livello del collo, utilizzando il bisturi ad ultrasuoni. Quindi, sezione del digiuno a livello della prima ansa mediante endoGIA da 45 mm e duodenocefalopancreasectomia con conservazione del piloro. La fase ricostruttiva prevede: anastomosi pancreatico-digiunale T-L eseguita in duplice strato con punti staccati di lino; anastomosi epatico-digiunale T-L in doppio strato in PDS 6/0 e anastomosi duodeno-digiunale in duplice strato sulla medesima ansa a decorso retromesenterico. Infine laparotomia sovrapubica tipo Pfannestiel ed estrazione del pezzo operatorio all'interno di un endobag. Al termine della procedura, dopo il risultato dell’esame istologico estemporaneo, posizionamento di due drenaggi di Redon in sede sottoepatica destra e due peripancreatici e sutura dell’incisione di servizio e degli accessi laparoscopici.
Fig. 2.3. Alcune fasi della linfoadenectomia lungo ilo epatico e tripode celiaco.
Fig. 2.4. Alcune fasi della Pancreaticodigiunostomia.
Pancreasectomia distale spleen-preserving (PDSP)
Il settaggio è simile a quello della DCP: l’unica differenza è rappresentata dall’inversione reciproca del posizionamento del trocar accessorio e di quello dell’ottica (figura 2.8). Quindi, si accede alla retrocavità degli epiploon, previa sezione del legamento gastro-colico. Si mobilizza il colon sinistro con retrazione craniale dello stomaco, in modo da esporre la faccia anteriore del pancreas. Evidenziata la lesione, si esegue pancreasectomia sinistra con conservazione dei
strutture dal pancreas, progressivamente in direzione testa-coda. Liberazione della ghiandola dall’ilo splenico. Completata la mobilizzazione, si seziona il collo del pancreas utilizzando un bisturi ad ultrasuoni. Infine, si effettua un’incisione di servizio sovrapubica tipo Pfannestiel con estrazione da questa del pezzo operatorio all'interno di un endobag. A seguito dei risultati dell’esame istologico estemporaneo, si esegue sutura della trancia pancreatica con punti staccati di Prolene 4/0, dopo legatura selettiva del dotto di Wirsung. Al termine della procedura, si posizionano due drenaggi di redon, vicini al moncone pancreatico e sutura degli accessi cutanei e della incisione di servizio.
Pancreasectomia distale con splenectomia (PSD).
Paziente in decubito semilaterale destro. Posizionamento di 5 trocar: ottica in sede paraombelicale sinistra, accessorio in paraombelicale destra, robotici in sottocostale destra, sinistra e al fianco sinistro. Resezione in unico blocco di pancreas e milza, senza conservazione dei vasi splenici. Fasi medesime a quelle della DPSP.
2.5. Casistica
Dal 1 Aprile 2008 al 30 Settembre 2011, presso la U.O. Chirurgia Generale e dei Trapianti dell’AOUP, sono state eseguite 76 pancreasectomie robot-assistite consecutive utilizzando il sistema Da Vinci Si.
Le informazioni relative ad ogni singolo caso sono state raccolte in un database elettronico Excel. I dati analizzati includono: età, genere, BMI, familiarità, fattori di rischio, comorbilità, pregressi interventi chirurgici, sintomatologia, tempo tra diagnosi e ricovero, esami strumentali, esami ematochimici preoperatori, tipologia intervento, durata intervento, decorso postoperatorio, diagnosi istologica e follow-up a breve termine. I pazienti hanno un’età media di 58 (range 21-80). I dati riguardanti la popolazione sono riportati in tabella 2.2.
Tabella 2.2 – Caratteristiche della popolazione in studio
numero di pazienti 76
sesso
maschi 24
femmine 52
età media (range) 57,8±14,9 (21 –
80)
BMI medio (range) 24,5±4,2 (16,9 –
35,9) ASA
1 6
2 45
Tabella 2.3 – Comorbilità presenti nella popolazione in studio
Comorbilità numero di casi
ipertensione 26 cardiopatia 5 BPCO 4 diabete mellito Fatt 8 pancreatopatia cronica 4 IRC 4 Epatopatia cronica 2 Patologia tiroidea 10
Il 58% era già stato sottoposto ad un intervento di chirurgia addominale, precedente a quello robotico (tabella 2.4). Nonostante tale sottogruppo sia costituito da ben più della metà dei pazienti, questo dato non ha determinato in nessuno di essi la necessità di conversione dell’intervento da robotico ad open.
Tabella 2.4 – Interventi chirurgici presenti nell’anamnesi patologica remota dei pazienti in studio
Intervento chirurgico Numero di casi
appendicectomia 13 colecistectomia laparoscopica 2 laparotomica 2 appendicectomia e colecistectomia laparoscopica 1 appendicectomia e colecistectomia laparotomia 1 annessectomia 1 appendicectomia e isteroannessectomia 2 plastica ernia inguinale monolaterale 3 plastica ernia inguinale bilaterale 2
Il 47,6% (n=37) dei pazienti è risultato sintomatico al momento della diagnosi. Nel restante 52,4% (n=39) di pazienti, asintomatici, la diagnosi veniva effettuata mediante indagini di diagnostica per immagini eseguite per altre motivazioni, generalmente il follow-up di altre patologie.
Per quanto concerne il tempo intercorso tra diagnosi e ricovero, la mediana per la popolazione è risultata di 3 mesi, con un range interquartile di 2-9 mesi. Per il carattere asimmetrico della distribuzione la media e la deviazione standard del tempo intercorso non sono valori utilizzabili.
Tabella 2.5 – Esami di imaging effettuati durante il percorso diagnostico
Esami di imaging # % Eco addome 76 100 TC addome 76 100 Colangio-wirsung RM 48 63,1 Ecoendoscopia 6 7,9 Octreoscan 4 5,2 PET 14 18,4
In 4 casi (5,2%) è stata eseguita anche una biopsia preoperatoria: 3 di questi nello studio di lesione periampollare ed 1 nello studio di linfonodi perilesionali.
Nonostante 2 (2,6%) pazienti si presentassero itterici al momento del ricovero, il posizionamenti della protesi biliare si è reso necessario solo in un caso, mentre il drenaggio biliare non è mai stato posizionato.
Tabella 2.6 – Valori dei marker neoplastici preoperatori
Marker neoplastico pazienti con valori superiori a quelli normali [n(%)] mediana (U/mL) range interquartile (U/mL) Ca 19.9 (v.n. 37 U/ mL) 14 17 7,4 - 39 CEA (v.n. 5 ng/mL) 6 1,9 1,1 – 2,8
Tutte le DCP sono state eseguite con conservazione del piloro, con tecnica secondo Traverso-Longmire. Delle 36 pancreasectomie sinistre 23 (63,8%) sono state eseguite con conservazione dei vasi splenici e della milza.
In 14 interventi è stata effettuata una procedura chirurgica aggiuntiva, sempre eseguita per via robotica (2 colecistectomie, 2 biopsie epatiche, 2 surrenalectomie, 2 asportazioni colon e mesocolon adeso alla lesione pancreatica, 1 asportazione cisti parannessiale, 1 ricostruzione della vena splenica con safena, 1 drenaggio cisti pancreatica, 1 colecistectomia con anche chiusura del tripode, 1 surrenalectomia con anche annessiectomia, 1 plastica di parete).
I casi sono stati suddivisi in tre periodi (I da Aprile 2008 a Aprile 2009; II da Maggio 2009 a Aprile 2010; III da Maggio 2010 a Settembre 2011), in modo da valutare la modificazione delle principali variabili analizzate con l’aumento del numero di casi.
CAPITOLO III
3.1 Risultati istologici
I risultati dell’esame istologico sul pezzo operatorio sono riportati in tabella 3.1. Tabella 3.1 – Risultati istologici
Istotipo
n %
Tumore neuroendocrino 12 15,7
Tumore solido pseudopapillare 2 2,7
Adenoma papillare 1 1,3
Cistoadenoma mucinoso 9 11,8
Cistoadenoma sieroso 16 21,1
IPMN 18 23,7
Carcinomi
Carcinoma mucinoso papillare
intraduttale 2 2,6 Adenocarcinoma duttale 4 5,2 Carcinoma adenosquamoso 1 1,3 Adenocarcinoma papillare 4 5,2 Adenocarcinoma coledocico 2 2,6
Patologie non neoplastiche
Pancreatite cronica 3 4,0
Endometriosi 1 1,4
Milza accessoria 1 1,4
Totali 76 100
Nella casistica totale sono stati asportati in media 22,3±16,5 linfonodi. Considerando il tipo d’intervento è stata evidenziata una differenza statisticamente significativa nel numero di linfonodi asportati (DCP 31,2±11; DP 16,4±13; PT 52±21,1; p<0,0001). Con l’incremento della casistica, comparando i
In 8 casi sono stati dimostrati linfonodi metastatici. Il numero di linfonodi metastatici sul totale di linfonodi asportati è stato di: 1/23 (4,3%) e 2/29 (6,9%) in 2 casi di adenocarcinoma duttale, 6/15 (40%) in 1 singolo caso di adenocarcinoma papillare, 3/29 (10,3%) in 1 singolo caso di carcinoma mucinoso papillare e 1/42 (2,4%), 3/25 (12%), 8/13 (61,5%) e 14/57 (24,6%) in 4 casi di tumore neuroendocrino, senza correlazione diretta tra il numero dei linfonodi metastatici e il numero dei linfonodi asportati. In tutti i casi osservati i margini di resezione sono risultati negativi (R0 = 100%).
3.2 Risultati intra-operatori
La percentuale di conversione ad open è stata nulla. La durata media dell’intervento, considerando globalmente tutte le procedure, è risultata di 449,3±169,7 (105-960) minuti. In tabella 3.2 viene evidenziata la durata in base al tipo d’intervento.
Tabella 3.2 – Durata media dell’intervento
T i p o
d’intervento Casi totaliCasi totaliCasi totaliCasi totali
Casi senza procedura chirurgica aggiuntiva
Casi senza procedura chirurgica aggiuntiva
Casi senza procedura chirurgica aggiuntiva
Casi senza procedura chirurgica aggiuntiva n M e d i a ORT 1 D S ORT Range ORT n M e d i a ORT 1 D S ORT R a n g e ORT DCP 26 581 120,9 420-960 21 565 96,2 4 2 0 - 7 80 Sinistra 36 364 97,6 180-540 19 336 107,7 1 8 0 - 5 40 Totale 5 652 159 510-800 4 652 159 5 1 0 - 8 00 Intermedia 3 430 26,4 400-450 3 430 26,4 4 0 0 - 4 50 Enucleazione 6 179 62,7 105-240 5 179 62,7 1 0 5 - 2 40 ORT = operative room time
In tabella sono riportati oltre ai casi totali, anche i casi senza procedura chirurgica aggiuntiva, in quanto è stato rilevato un aumento statisticamente significativo
associate. In particolare è stata riscontrata nei casi con procedura chirurgica aggiuntiva una durata dell’intervento per le DCP di 691±233 (535-960) vs. 565±96 (420-780), p<0,04; mentre per le sinistre di 411±53 (320-495) vs. 336±108 (180-540), p<0,03.
Considerando i tre diversi periodi di osservazione, è stata riscontrata la progressiva riduzione, statisticamente significativa, della durata dell’intervento nei casi di pancreasectomia sinistra. I valori sono riportati in tabella 3.3.
Tabella 3.3 – Variazione della durata dell’intervento di PD nei tre periodi in studio
Periodi Casi totaliCasi totaliCasi totaliCasi totali Casi senza procedura chirurgica aggiuntiva Casi senza procedura chirurgica aggiuntiva Casi senza procedura chirurgica aggiuntiva Casi senza procedura chirurgica aggiuntiva n M e d i a ORT 1 DS ORT R a n g e ORT n M e d i a ORT 1 DS ORT R a n g e ORT I (4/08-4/09) 6 405* 80 300-540 3 400** 125 300-540 I I (5/09-4/10) 10 417* 60 320-510 6 431** 64 360-510 I I I (5/10-6/11) 20 308* 100 180-495 10 260** 59 180-375 * p=0,02; **p=0,005
Abbiano inoltre analizzato l’impatto dell’instrument traffic sia nell’ambito di una duodenocefalopancreasectomia.
FASE DEMOLITIVA
113 cambi del robot, tempo = 1573s (26,21 min). 36 cambi laparoscopici, tempo = 485s (8,08 min).
74 cambi laparoscopici, tempo = 564s (9,24 min).
Tempo totale = 698s (11,38 min).
Anastomosi bilio-intestinale 4 cambi per il robot, tempo = 60s (1 min). 8 cambi laparoscopici, tempo = 83s (1,23 min). Tempo totale = 143s (2,23 min).
Anastomosi gastro-digiunale 11 cambi per il robot, tempo = 147s (2,27 min).
38 cambi laparoscopici, tempo = 201s (3,21 min). Tempo totale = 348s (5,48 min).
TEMPO TOT (laparoscopia-robot) = 3345 secondi (55,50 minuti). Il 12,33 % della durata dell’intervento.
Sia nell’ambito di una pancreasectomia distale:
ROBOT
Per sistemare la posizione del robot ed i trocar sono occorsi circa 2,18 minuti.
N° cambi Tempo medio
(s)
Tempo totale (s)
strumenti 34 17,2 585
(10,25min)
1. L’ottica è stata pulita 2 volte per un tempo tot = 31s ed un tempo medio = 15,5 s.
2. 3 cambi per “hem-o-lock”per un tempo tot = 47s ed un tempo tot = 15,6 s.
LAPAROSCOPIA
1. Per passare lacci e riprenderli. 2. Per passare punti e riprenderli.
N° cambi Tempo medio
(s)
Tempo totale (s)
strumenti 21 5,47 115 (1,55min)
Levare il pezzo operatorio 3,55 minuti.
TEMPO TOT (laparoscopia-robot) = 700 secondi (11,40 minuti). Il 7,65 % della durata dell’intervento.
Sia nell’ambito di una splenopancreasectomia:
ROBOT
N° cambi Tempo medio
(s)
Tempo totale (s)
strumenti 53 15,05 798 (13,3
min)
3. L’ottica è stata pulita 3 volte tempo tot =84s, tempo medio = 28s.
4. 3 cambi per “hem-o-lock”per un tempo tot = 47s ed un tempo tot = 15,7s.
LAPAROSCOPIA
3. Per passare lacci e riprenderli. 4. Per passare punti e riprenderli. 5. Suturare i vasi splenici.
N° cambi Tempo medio
(s)
Tempo totale (s)
3.3 Risultati peri-operatori
La mortalità a 30 giorni dall’intervento nell’intera serie è nulla.
In 40 (52,%) pazienti sono state riportate una o più complicanze nel decorso postoperatorio. Le più frequenti sono risultate: la fistola pancreatica (n=26), le raccolte addominali (n=10), il ritardato svuotamento gastrico (n=5) e le complicanze respiratorie (n=4). I vari tipi di complicanza sono riportati nella tabella 3.4.
Tabella 3.4 – Complicanze del decorso post-operatorio
Complicanze DCPDCP PDPD TotaleTotale
n % n % n %
Fistola pancreatica 9 34,6 15 41,6 26 34,2
Pancreatite moncone 1 3,8 0 1 1,3
Fistola enterica 1 3,8 0 1 1,3
Ritardato svuotamento gastrico
(DGE) 5 19 0 5 6,5 Emoperitoneo 1 3,8 0 1 1,3 Sanguinamento erosivo 1 3,8 1 2,7 2 2,6 Raccolte addominali 6 22,8 2 5,4 10 13,1 Chirurgiche 1 3,8 1 2,7 2 2,6 Cardiologiche 1 3,8 1 2,7 3 3,9 Respiratorie 3 11,4 1 2,7 4 5,2 Altre mediche 8 30,4 5 13,5 14 18,2 Mortalità (30 giorni) 0 0 0 Mortalità (90 giorni) 1 3,8 0 1 1,3
pazienti con complicanze 15 62,5 25 67,5 40 52
Nella tabella 3.5 sono riportate le percentuali delle complicanze postoperatorie raggruppate in base al periodo d’osservazione.
Tabella 3.5 – Variazione della prevalenza delle diverse tipologie di complicanze nei tre periodi in studio
Complicanze I (04/08-04/ 09) n=12 I (04/08-04/ 09) n=12 II (05/09-04/ 10) n=23 II (05/09-04/ 10) n=23 III (05/10-09/ 11) n=35 III (05/10-09/ 11) n=35 Totale n=76 Totale n=76 n % n % n % n % Fistola pancreatica 5 41,7 8 34,8 13 37,1 26 34,2 Pancreatite moncone 0 1 4,4 0 1 1,3 Fistola enterica 0 1 4,4 0 1 1,3 Ritardato svuotamento gastrico (DGE) 0 2 8,7 3 8,4 5 6,5 Emoperitoneo 0 1 4,4 0 1 1,3 Sanguinamento erosivo 0 1 4,4 1 2,8 2 2,6 Raccolte addominali 3 25 3 13 4 11,2 10 13 Chirurgiche 0 1 4,4 1 2,8 2 2,9 Cardiologiche 1 8,3 1 4,4 1 2,8 3 4,4 Respiratorie 0 2 8,7 2 5,6 4 5,8 Altre mediche 2 16,7 3 13 9 25,2 14 20,3
La degenza media in terapia intensiva postoperatoria nella serie in studio è risultata di 0,55±0,5 (0-1) giorni, mentre la media del valore della degenza postoperatoria globale è risultata di 15,3±8,8 (5-51) giorni. E’ stata riscontrata una differenza statisticamente significativa in relazione alla tipologia d’intervento [DCP 20,2±10,2 (10-51); PD 12,3±6,6 (7-35); PT 15,5±3,1(13-20); p<0,0001]. E’ stata dimostrata una riduzione statisticamente significativa dei giorni di degenza media nel sottogruppo dei pazienti con decorso senza complicanze rispetto a quello con complicanze [11,2±3,8 (5-19) vs. 18,9±10,3 (7-51); p=0,0002], sia considerando globalmente tutti gli interventi, sia nei sottogruppi delle varie
pancreasectomia distale con complicanze postoperatorie (I 16,3±10,2; II 12,6±6,5; III 15,2±8,8; P= NS) e senza complicanze (I 9±1; II 9±1; III 8±1; p= NS).
Tabella 3.6 – Durata del ricovero
Tipo d’intervento Casi totali (giorni) Casi totali (giorni) Casi senza complicanze postoperatorie (giorni) Casi senza complicanze postoperatorie (giorni) Casi con complicanze postoperatorie (giorni) Casi con complicanze postoperatorie (giorni) m e d i a ±DS range m e d i a ±DS range m e d i a ±DS range DCP 20,2±10, 2 10-51 14,9±3,2 10-19 23,4±11, 6 14-51 Sinistra 12,3±6,6 7-35 8,6±1 7-11 14,6±8 7-35 Totale 15,5±3,1 13-20 14±1 13-15 20 -Intermedia 20±9,8 12-31 - - 20±9,8 12-31 Enucleazione 7,6±2,3 5-10 7,6±2,3 5-10 -
-La ripresa dell’alimentazione per OS in media è risultata essere di 5,7±4,9 (0-29) giorni con una differenza statisticamente significativa tenendo conto della tipologia d’intervento. E’ stata osservata una riduzione statisticamente significativa dei giorni necessari alla ripresa dell’alimentazione per OS nei pazienti senza complicanze postoperatorie rispetto a quelli con complicanze (tabella 3.7).
Tabella 3.7 – Tempi di ripresa dell’alimentazione per OS
Tipo d’intervento Casi totali (giorni) Casi totali (giorni) Casi senza complicanze postoperatorie (giorni) Casi senza complicanze postoperatorie (giorni) Casi con complicanze postoperatorie (giorni) Casi con complicanze postoperatorie (giorni) m e d i a ±DS range m e d i a ±DS range m e d i a ±DS range DCP 10,1±5,7 * 2-29 8±2,9¶ 6-13 11,2±6,5 ¶ 2-29 Sinistra 3,9±2* 1-10 3,2±1,5¶ 1-6 4,5±2,2¶ 1-10 Totale 7,8±1,5* 6-9 8±1,7¶ 6-9 7¶ -Intermedia 2±2* 0-4 - - 2±2 0-4 Enucleazione 0* - 0 - - -* p<0,0001; ¶p=0,05
La deambulazione spontanea è stata ripresa dopo una media di 2 giorni e la pompa elastomerica per la terapia antidolorifica sospesa 1,5 giorni dopo l’intervento.
Un ricovero ripetuto è stato necessario in 8/76 (10,5%) pazienti con una media di giorni intercorsi dalla data dell’intervento di 37,3±20,8 (17-67). Il motivo del ricovero è stato: febbre 2 (25%), dolore addominale 3 (37,5%), febbre e dolore addominale 1 (12,5%), nausea e vomito 1 (12,5%) e non specificato 1 (12,5%). La durata media del ricovero postoperatorio è stata di 15,9±9,8 (6-35) giorni. Tra questi pazienti 4 avevano effettuato una DCP, 2 una pancreasectomia sinistra e 2 una pancreasectomia intermedia, con una durata media dell’intervento di 423±136 minuti e una degenza postoperatoria media di 20,6±14,1 giorni. E’ stato osservato che in 7/8 (87,5%) pazienti avevano avuto un decorso postoperatorio non regolare caratterizzato dalla presenza di varie complicanze, in particolare fistola pancreatica (87,5%) e raccolte addominali (50%) (vedi tabella
Tabella 3.8 – Complicanze post-operatorie caratterizzanti il decorso dei pazienti con ricovero ripetuto
Complicanze n %
Fistola pancreatica 7 87,5
Pancreatite moncone 1 12,5
Fistola enterica 1 12,5
Ritardato svuotamento gastrico (DGE) 1 12,5
Emoperitoneo 1 12,5
Sanguinamento erosivo 2 25
Raccolte addominali 4 50
Chirurgiche 2 25
CAPITOLO IV
Dalla metà del ‘900 fino agli inizi del nostro secolo, fatto salvo per una progressiva riduzione della mortalità correlata, legata anche ai progressi in campo anestesiologico e rianimatorio, non vi sono stati sostanziali cambiamenti nella chirurgia del pancreas.
Nonostante molti siano stati gli sforzi per testare strategie chirurgiche più aggressive (interventi estesi, ampie linfadenectomie...) al fine di migliorare la sopravvivenza dei pazienti affetti da neoplasie pancreatiche, nessuno di questi, fino ad oggi, ha portato frutti consistenti72, 73 e ciò deve essere principalmente attribuito al fatto che
ogni sforzo chirurgico di bonifica locale o loco-regionale della malattia è vanificato dalla natura sistemica del cancro del pancreas e contemporaneamente dalla mancanza di trattamenti farmacologici in grado di contrastare efficacemente sulla malattia microscopicamente metastatica, come invece accade per altre forme tumorali.
Peraltro, anche sul versante della morbilità e mortalità, dagli anni ’90 ad oggi non si sono osservati importanti cambiamenti.
Le varie modalità di ricostruzione digestiva nella duodenocefalopancreasectomia d’altronde non si sono mostrate utili alla riduzione del ritardo di canalizzazione che è una complicanza tipica della procedura74 , così come le varie tecniche di gestione del moncone
pancreatico non hanno portato ad una riduzione di morbilità e mortalità ad esso correlate che, da sempre, rappresentano il vero tallone d’Achille della chirurgia resettiva del pancreas75,76.
La vera “novità” nella chirurgia del pancreas possiamo quindi dire che, negli ultimi 30 anni, è stata l’avvento della chirurgia mini-invasiva.
Tuttavia, ancora oggi, nonostante siano passati molti anni da quando questa metodica è stata utilizzata per la prima volta per una resezione pancreatica, la chirurgia mini invasiva resettiva del pancreas rimane un
argomento di discussione anche tra esperti e le sue reali indicazioni non sono ancora ben chiare.
Oggi possiamo affermare che la chirurgia laparoscopica sembra non essere inferiore alla chirurgia “open” nelle resezioni pancreatiche distali e nelle enucleazioni eseguite per patologia benigna o per patologia a basso grado di malignità21. Le casistiche invece che riguardano le
resezioni cefaliche sono poche, costituite da pochi pazienti e rimane ancora in gran parte da definire, anche al netto dei costi, quali siano i reali vantaggi dell’approccio mini invasivo per questo tipo di chirurgia21.
Certamente rispetto alla laparoscopia tradizionale la chirurgia robotica probabilmente potrebbe offrire qualche vantaggio soprattutto per le resezioni cefaliche. Qui infatti la chirurgia mini invasiva trova la sua più grande limitazione nella ristretta “gamma di movimenti” che gli strumenti laparoscopici sono in grado di compiere e quindi nella oggettiva difficoltà nelle varie e delicate fasi ricostruttive che sono parte integrante della duodenocefalopancreasectomia (in particolare l’anastomosi pancreatico-digiunale). Tuttavia i dati riportati in letteratura, ad oggi, sono molto esigui (Tabella 1.5) e sicuramente non consentono di esprimere un giudizio sul ruolo della chirurgia mini-invasiva robotica nelle resezioni pancreatiche.
Nella nostra casistica abbiamo analizzato i risultati a breve termine di 27 pazienti consecutivi sottoposti a resezione pancreatica robotica presso il nostro Centro.
Sia pure se nella selezione dei pazienti avevamo posto come criterio di esclusione i soggetti con cancro del pancreas, in due casi il work-up pre-operatorio non era stato in grado di porre diagnosi corretta e quindi
di questi errori diagnostici dovrà essere valutato alla luce di quanto emergerà circa l’effetto della chirurgia robotica sul cancro del pancreas.
La durata degli interventi chirurgici è stata elevata, tuttavia, considerando anche i dati riportati in letteratura, essa non si discosta molto dalla durata media degli interventi di pancreasectomia. Inoltre se da un lato è vero che alcune fasi dissettive, ma soprattutto ricostruttive, con l’approccio robotico sono più lunghe, dall’altro è anche vero che con l’approccio mini invasivo non si ha il tempo della sutura della parete addominale.
Sia pure se non si sono avuti casi di mortalità, la morbilità complessiva è stata elevata (51,8%). In particolare la morbilità di moncone è stata molto elevata (42,3%) e decisamente superiore rispetto a quella riportata dal nostro gruppo nella chirurgia pancreatica “open”13. Tuttavia
dobbiamo fare almeno due considerazioni a questo proposito. La prima è che questo gruppo di pazienti è selezionato come gruppo ad alto rischio per complicanze di moncone. E’ infatti noto come le lesioni cistiche del pancreas, ma anche i tumori neuroendocrini e le lesioni periampollari del pancreas si associno quasi mai ad una pancreatopatia cronica satellite né a problemi ostruttivi duttali cronici. Pertanto i monconi pancreatici di questi pazienti sono generalmente soffici e con dotto non dilatato, quindi più inclini allo sviluppo di complicanze di moncone. Inoltre, se si fa eccezione per un paziente, tutte le fistole pancreatiche sono state di grado A o B e si sono risolte spontaneamente con terapia medica senza la necessità di reintervento.
Anche la degenza media non è stata particolarmente corta rispetto ai dati riportati in letteratura e anche pubblicati dal nostro gruppo13,
tuttavia anche per questo parametro dobbiamo fare alcune considerazioni. Se analizziamo infatti la degenza media dei pazienti con decorso non complicato vediamo che questa è decisamente inferiore (in
complicati ed anche rispetto alla media di degenza dei nostri pazienti trattati con tecnica “open”13. Inoltre, dal momento che questa
rappresenta la parte iniziale della nostra esperienza, l’accorciamento della degenza non ha rappresentato un end-point e spesso la degenza è stata condizionata anche da una iniziale mancata esperienza nella gestione post-operatoria di questo gruppo di pazienti.
Sarà tuttavia interessante capire, a regime, quanto la chirurgia robotica, probabilmente nel paziente con decorso regolare, sarà in grado di ridurre la degenza e quindi anche pesare sulla spesa sanitaria.
Inoltre, altro aspetto importante, è che i pazienti hanno avuto una breve permanenza in Terapia Intensiva, hanno necessitato di una terapia antidolorifica in infusione per un breve periodo di tempo e soprattutto hanno ripreso rapidamente l’alimentazione per OS ed una mobilità autonoma.
Sia pure nella piena consapevolezza che 27 pancreasectomie robotiche, pur essendo un ottimo numero relativo, sono un piccolo numero in senso assoluto e quindi assolutamente insufficiente ad esprimere lapidarie conclusioni che abbiano un valore comprovato dalla statistica, sicuramente questa esperienza ha consentito di aprire le porte alla chirurgia robotica resettiva del pancreas e a esprimere alcune sia pur provvisorie deduzioni:
1) La chirurgia robotica può essere applicata in modo ripetibile alle resezioni pancreatiche
3) Nei casi non complicati la chirurgia robotica sembra ridurre la degenza del paziente e favorirne un più rapido recupero funzionale.
4) La chirurgia robotica rende “ripetibili” le fasi demolitive, ma soprattutto ricostruttive durante duodenocefalopancreasectomia.
Tuttavia anche dopo questo studio e quindi oggetti di future indagini, rimangono alcuni punti importanti che rappresenteranno la chiave di volta per la definitiva affermazione della chirurgia robotica nella pancreatologia:
1) La sicurezza oncologica. Sarà importante definire , attraverso il follow-up di questi pazienti se la chirurgia robotica offre intanto risultati oncologici paragonabili alla chirurgia tradizionale nelle lesioni a basso o medio grado di malignità e poi nelle lesioni più aggressive
2) Il miglioramento del performance status e della qualità di vita. Sarò opportuno misurare con appositi strumenti il performance status dei pazienti e la loro qualità di vita rispetto a pazienti trattati con tecnica open.
3) Lo stato immunologico. Valutare se un approccio mini-invasivo è in grado di ridurre l’immunosoppressione dell’intervento.
4) Costo/beneficio. Sarà opportuno capire se la chirurgia robotica del pancreas è una metodica “efficiente” o meno nel trattamento delle patologie del pancreas.
CAPITOLO V
1. Howard JM, Hess W. History of the Pancreas. Mysteries of a Hidden Organ. Ed Springer 2002.
2. Whipple AO, Parsons WB, Mullins CR. Treatment of Carcinoma of Ampulla of Vater. Ann Surg. 1935 Oct;102(4):763-79.
3. Crile G Jr. The advantages of bypass operations over radical pancreatoduodenectomy in the treatment of pancreatic carcinoma. Surg Gynecol Obstet. 1970 Jun;130(6):1049-53.
4. Fortner JG. Regional resection of cancer of the pancreas: a new surgical approach. Surgery. 1973 Feb;73(2):307-20.
5. Wilson SM, Bolck GE. Proceedings: Periampullary carcinoma. Arch Surg 1974. Apr; 108(4):539-44.
6. Trede M, Schvall G, Saeger HD. Survival after pancreatoduodenectomy. 118 consecutive resections without an operative mortality. Ann Surg. 1990. Apr;211 (4):447-58.
7. Monge JJ, Judd ES, Gage RP. RADICAL PANCREATODUODENECTOMY: A 22-YEAR EXPERIENCE WITH THE COMPLICATIONS, MORTALITY RATE, AND SURVIVAL RATE. Ann Surg 1964 Oct;160:711-22.
8. Yeo CJ, Cameron JL, Lillemoe KD, et al. Pancreaticoduodenectomy for cancer of the head of the pancreas. 201 patients. Ann Surg. 1995 Jun;221(6):721-31; discussion 731-3.
9. Fernandez del Castillo C, Rattner DW, Warshaw AL. Standards for pancreatic resection in the 1990s. Arch Surg. 1995 Mar;130(3):295-9; discussion 299-300.
10.Evans DB, Farnell MB, Lillemoe KD, et al. Surgical treatment of resectable and borderline resectable pancreas cancer: expert consensus statement. Ann Surg Oncol. 2009 Jul;16(7):1736-44.
11.M. Del Chiaro, U. Boggi, F. Mosca. RESECTION CRITERIA IN PANCREATIC SURGERY: LYMPHADENECTOMY AND VASCULAR RESECTION. In Surgical Treatment of Pancreatic Diseases. From Siquini W. Springer editions 2008.
12.Mosca F, Boggi U, Del Chiaro M. Chap 53: MANAGEMENT OF TUMOR INVASION/ ADHESION TO THE SUPERIOR MESENTERIC-PORTAL VEIN DURING PANCREATECTOMY. In Diseases of the Pancreas. Current Surgucal Therapy. Ed Springer 2008, pp 593-609
13.Boggi U, Del Chiaro M, Croce C, et al. PROGNOSTIC IMPLICATIONS OF TUMOR INVASION OR ADHESION TO PERIPANCREATIC VESSELS IN RESECTED PANCREATIC CANCER. Surgery. 2009 Nov;146(5):869-81.
14.Jacobaeus HC, Ueber die M6glichkeit die Zystoskopie dei Untersuchung seroser Hohlungen anzuwenden. Munch. Med. Woch 1910, No 40
15.Bernheim BM. Organoscopy: Cystoscopy of the Abdominal Cavity. Ann Surg 1911 Jun; 53 (6): 764-7
16.Cuschieri A. Laparoscopy for pancreatic cancer: does it benefit the patient? Eur J Surg. Onc 1988 Feb; 14(1): 41-4 Oct; 23(10): 998-1002
17.Pietrabissa A, Caramella D, Di Candio et al. Laparoscopy and laparoscopic ultrasonography for staging pancratic cancer: critical appraisal. World J Surg 1999 Oct; 23(10): 998-1002.
18.Cuschieri A. Laparoscopic surgery of the pancreas. J R Coll Surg Edinb. 1994 Jun; 39(3): 178-84
19.Shimi S, Banting S, Cuschieri A. Laparoscopy in the management of pancreatic cancer: endoscopic cholecystojejunostomy for advanced disease. Br J Surg 1992 Apr; 79(4): 317-9
20.Gagner M, Pomp A. Laparoscopic pylorus-preserving pancreatoduodenectomy. Surg Endosc 1994 May; 8(5): 408-10.
21.Briggs CD, Mann CD, Irving GRB et al. Systematic Review of Minimally Invasive Pancreatic Resection. J Gastroint Surg 2009. Jun; 13(6):1129-37
22.Corcione F, Marzano E, Cuccurullo D, et al. Distal pancreas surgery: outcome for 19 cases managed with a laparoscopic approach. Surg Endosc 2006;20 (11): 1729–1732.
23.Gagner M, Pomp A, Herrera MF. Early experience with laparoscopic resections of islet cell tumors. Surgery 1996;120 (6):1051–1054.
24.Patterson EJ, Gagner M, Salky B, et al. Laparoscopic pancreatic resection: single-institution experience of 19 patients. J Am Coll Surg 2001;193(3):281–287.
25.D’Angelica M, Are C, Jarnagin W, et al. Initial experience with hand-assisted laparoscopic distal pancreatectomy. Surg Endosc 2006;20(1):142–148.
26.Cuschieri A, Jakimowicz JJ, van Spreeuwel J. Laparoscopic distal 70% pancreatectomy and splenectomy for chronic pancreatitis. Ann Surg 1996;223(3): 280–285.
27.Edwin B, Mala T, Mathisen O, et al. Laparoscopic resection of the pancreas: a feasibility study of the short-term outcome. Surg Endosc 2004;18(3):407–411.
28.Ayav A, Bresler L, Brunaud L, et al. Laparoscopic approach for solitary insulinoma: a multicentre study. Langenbecks Arch Surg 2005;390(2):134–140.
29.Dulucq JL, Wintringer P, Stabilini C, et al. Are major laparoscopic pancreatic resections worthwhile? A prospective study of 32 patients in a single institution. Surg Endosc 2005;19(8):1028–1034.
30.Fernandez-Cruz L, Saenz A, Astudillo E, et al. Laparoscopic pancreatic surgery in patients with chronic pancreatitis. Surg Endosc 2002;16(6):996–1003.
31.Fernandez-Cruz L, Cosa R, Blanco L, et al. Curative laparoscopic resection for pancreatic neoplasms: a critical analysis from a single institution. J Gastrointest Surg 2007;11(12):1607–1621.
32.Fabre JM, Dulucq JL, Vacher C, et al. Is laparoscopic left pancreatic resection justified? Surg Endosc 2002;16(9):1358–1361.