SCUOLA DI SCIENZE
Dipartimento di Chimica Industriale “Toso Montanari”
Corso di Laurea Magistrale in
Chimica Industriale
Classe LM-71 - Scienze e Tecnologie della Chimica Industriale
Acido (R)-9-idrossiottadecanoico veicolato
da nanoparticelle proteiche: sintesi,
caratterizzazione e valutazione
dell’attività biologica
Tesi di laurea sperimentale
CANDIDATO
Alberto Busi
RELATORE
Prof.ssa Carla Boga
CORRELATORE
Dott.ssa Claudia Ferroni
Dott.ssa Greta Varchi
____________________________________________Sessione III___________________________________________
ABSTRACT
This work describes the preparation and characterization of protein nanoparticles loaded with (R)-9-hydroxystearic acid, (R)-9-HSA. This fatty acid is an endogenous product of lipid metabolism that acts as histone deacetylase 1 inhibitor and exerts anti-proliferative activity by arresting colon cancer cells (HT29) growth in G0/G1 phase.
The formation of nanoparticles was induced by hydrophobic interactions between (R)-9-HSA and the hydrophobic protein domains, affording water-stable nanoparticles with no need of toxic cross-linking agents. Nanoparticles were characterized in terms of hydrodynamic diameter, surface charge, morphology and thermogravimetric behavior. The controlled release of (R)-9-HSA from nanoparticles was determined at 37°C and at different pH values by internal standard method with quantitative 1H-NMR spectroscopy (qNMR).
The in vitro evaluation of nanoparticles uptake and cytoxicity was performed on human colorectal adenocarcinoma cells (HT29). Collected data show that the activity of (R)-9-HSA as free or loaded onto nanoparticles is similar in terms of anti-proliferative effect; however, some significant differences were observed in the cell cycle analysis, showing that while free (R)-9-HSA causes a growth arrest in the G0/G phase, it induces a S phase
arrest when loaded on nanoparticles.
In summary, protein nanoparticles loaded with (R)-9-HSA, described here for the first time, represent an effective tool against colon cancer cells proliferation. Additional studies are ongoing to better elucidate the underpinning biochemical mechanism of action of our newly developed delivery system.
ABSTRACT
Questo lavoro descrive la preparazione e la caratterizzazione di nanoparticelle proteiche caricate con acido (R)-9-idrossistearico, (R)-9-HSA. Questo acido grasso è un prodotto endogeno del metabolismo lipidico e un inibitore delle istone deacetilasi 1 esercitando un’attività antiproliferativa nei confronti delle cellule di adenocarcinoma del colon (HT29) grazie all’arresto in fase G0/G1.
La formazione delle nanoparticelle è indotta dalle interazioni idrofobiche tra (R)-9-HSA e i domini idrofobici della proteina; rendendo possibile la formazione di nanoparticelle stabili in ambiente acquoso, senza l’utilizzo di agenti reticolanti tossici. Le nanoparticelle sono state caratterizzate in termini di diametro idrodinamico, carica superficiale, morfologia e comportamento termico.
Il rilascio controllato di (R)-9-HSA dalle nanoparticelle è stato determinato a 37°C e a diversi valori di pH, tramite spettroscopia 1H-NMR quantitativa (qNMR), utilizzando il metodo dello standard interno.
L’internalizzazione e la citotossicità delle nanoparticelle sono state valutate in vitro su cellule di adenocarcinoma umano del colon (HT29). I dati raccolti mostrano che (R)-9-HSA libero e caricato su nanoparticelle esercitano una simile attività antiproliferativa, tuttavia alcune differenze significative si riscontrano nell’analisi del ciclo cellulare, in particolare (R)-9-HSA libero provoca un arresto in fase G0/G1, mentre quando è caricato
su nanoparticelle induce un arresto in fase S.
In conclusione, le nanoparticelle proteiche caricate con (R)-9-HSA, descritte per la prima volta in questo lavoro, rappresentano uno strumento efficace contro la proliferazione delle cellule di adenocarcinoma del colon. Ulteriori studi sono in corso per comprendere meglio i meccanismi biochimici alla base dell’azione di questo nuovo sistema di veicolazione.
1
INDICE
1. Introduzione...5
1.1. Nanomedicina e drug delivery...5
1.1.1. Nanoparticelle...10
1.1.1.1. Nanoparticelle metalliche...10
1.1.1.2. Nanoparticelle di polimeri sintetici...11
1.1.1.3. Nanoparticelle polisaccaridiche...12
1.1.1.4. Liposomi...12
1.1.1.5. Nanoparticelle proteiche...13
1.1.2. Metodi di preparazione di nanoparticelle proteiche...14
1.1.2.1. Desolvatazione...15
1.1.2.2. Emulsione...15
1.1.2.3. Elettrospray drying...16
1.1.2.4. Self-assembly...17
1.2. Cheratina...18
1.2.1. Struttura e ruolo fisiologico...18
1.2.2. Classificazione, composizione amminoacidica e caratteristiche...20
1.2.3. Proprietà...21
1.2.4. Metodi di estrazione...22
1.2.5. Applicazioni...23
1.3. Istoni e deacetilasi istoniche (HDACs)...25
1.4. Inibitori delle deacetilasi istoniche (HDACi)...27
1.5. Acido 9-idrossistearico (9-HSA)...29
2. Scopo della tesi...32
3. Risultati e discussione...33
3.1. Sintesi di (R)-9HSA...33
3.2. Estrazione della cheratina...36
3.3. Metodi di preparazione delle nanoparticelle...36
3.4. Nanoparticelle di cheratina...38
3.5. Nanoparticelle di cheratina e (R)-9-HSA, (R)[email protected]
3.5.1. Studio di ottimizzazione delle condizioni operative...39
2
3.5.3. Prove di rilascio...43
3.5.4. Caratterizzazione delle NPs (R)[email protected]
3.6. Nanoparticelle di cheratina funzionalizzata con FITC...50
3.7. Nanoparticelle di HSA e cheratina funzionalizzata con FITC, (R)[email protected]
3.8. Nanoparticelle di cheratina e acido idrossistearico (HSA), [email protected]
3.9. Nanoparticelle di albumina...52
3.10. Nanoparticelle di albumina e (R)-9-HSA, (R)[email protected]
3.11. Analisi biologiche in vitro...53
3.11.1. Analisi dell’internalizzazione delle nanoparticelle...53
3.11.2. Analisi delle interazioni con la membrana cellulare...55
3.11.3. Effetti sulla proliferazione cellulare...58
3.11.4. Analisi del ciclo cellulare...59
4. Conclusioni...61
5. Parte sperimentale...63
5.1. Sintesi di acido (R)-9-idrossistearico, (R)-9-HSA...65
5.1.1. Valutazione dell’eccesso enantiomerico...67
5.2. Metodo di estrazione della cheratina...68
5.3. Nanoparticelle di cheratina...69
5.3.1. Nanoparticelle bianche...69
5.3.1.1. Self-assembly...69
5.3.1.2. Desolvatazione...69
5.3.2. Funzionalizzazione della cheratina con FITC, Ker-FITC...70
5.3.3. Nanoparticelle fluorescenti, KNPs-FITC...70
5.3.4. Nanoparticelle cariche...70
5.3.4.1. Nanoparticelle caricate con (R)-9-HSA, (R)[email protected]
5.3.4.2. Nanoparticelle fluorescenti caricate con HSA, (R)[email protected]
5.3.5. Prove di rilascio...71
5.4. Nanoparticelle di albumina...72
3
5.4.2. Nanoparticelle caricate con (R)-9-HSA, (R)[email protected]
5.5. Analisi biologiche in vitro...73
5.5.1. Colture cellulari...73
5.5.2. Internalizzazione nanoparticelle...73
5.5.3. Analisi delle interazioni con la membrana cellulare...74
5.5.4. Conte cellulari...74
5.5.5. Analisi del ciclo cellulare...74
5
CAPITOLO 1
Introduzione
1.1. Nanomedicina e drug delivery
Durante la storia dell’uomo sono avvenute tre grandi rivoluzioni scientifiche: La rivoluzione industriale nel XIX secolo;
La rivoluzione nucleare nel XX secolo;
La rivoluzione nanotecnologica nel XXI secolo e attualmente in corso.
La nanoscienza si occupa dei fenomeni e delle manipolazioni della materia su scala nanometrica. Il termine fu coniato da Richard Feynman nel 1959 durante il suo celebre discorso “There's Plenty of Room at the Bottom” (“C’è tanto spazio giù in fondo”)1
nel quale argomentò la possibilità di manipolare la materia a livello atomico e di costruire macchine di dimensioni molecolari.
Nel 1974, Norio Taniguchi definì per la prima volta la nanotecnologia come un processo di separazione, consolidamento e deformazione di materiali a livello atomico o molecolare (“Nano-technology mainly consists of the processing of separation, consolidation, and deformation of materials by one atom or one molecule”).2
Il termine “nanomedicina” ad oggi non ha una definizione universalmente accettata: per l’European Science Foundation si tratta della “scienza e tecnologia di diagnosi, trattamento e prevenzione di malattie e lesioni traumatiche, di attenuazione del dolore, di preservazione e miglioramento della salute umana grazie all’utilizzo di strumenti molecolari e la conoscenza molecolare del corpo umano”.3 Mentre per il National Institute of Health degli USA si tratta di una “branca della nanotecnologia che si riferisce a interventi medici altamente specifici su scala molecolare rivolti alla cura di malattie o riparazione di tessuti danneggiati, come ossa, muscoli o nervi”.4
La nanomedicina trova ampia applicazione per la veicolazione di farmaci (drug
delivery), la diagnostica, la medicina rigenerativa e i dispositivi medici impiantabili.
Il drug delivery ha come obiettivo lo sviluppo di sistemi di trasporto di dimensioni nanometriche (nanocarriers) in grado di veicolare principi attivi in maniera mirata. Fra i vari tipi di farmaci possibilmente veicolabili con nanocarriers, i farmaci antitumorali
6
sono certamente quelli sui quali si sono maggiormente concentrati gli studi degli scienziati. Infatti, i trattamenti chemioterapici prevedono l’uso di molecole molto tossiche, scarsamente o per nulla solubili in acqua che richiedono pertanto l’uso di solventi organici altamente tossici che concorrono ad aumentare il numero e l’intensità degli effetti collaterali sul paziente. In particolare, i taxani (paclitaxel e il docetaxel) sono tra i farmaci antitumorali più utilizzati ed efficaci nel trattamento del tumore al seno5, tuttavia la loro efficacia è limitata dalla formulazione a base solvente, alla quale è associata una severa tossicità. Il solvente migliore per aumentare la solubilità in ambiente acquoso del paclitaxel è una miscela di olio di ricino etossilato (Cremophor® EL) ed etanolo. L’insieme di paclitaxel e questa miscela solvente fu chiamato Taxol®. I problemi associati all’utilizzo di Cremophor® EL sono la necessità di utilizzare speciali set di infusione per minimizzare la contaminazione da parte degli ftalati presenti nella plastica, tempi di infusione lunghi (3h) e procedure di medicazione preventive per evitare reazioni di ipersensibilità.6,7,8 Da queste premesse è emersa la necessita di sviluppare nuovi sistemi di veicolazione per i taxani e i farmaci idrofobici in generale. Esistono diverse tipologie di nanocarriers: nanoparticelle (polimeriche e metalliche), liposomi, micelle, nanotubi, dendrimeri, ecc.
Il drug delivery presenta numerosi vantaggi rispetto all’utilizzo del farmaco libero: a) Proteggere il principio attivo dalla degradazione in vivo e aumentarne il tempo di
emivita;
b) Migliorare l’efficacia e la specificità del farmaco e contemporaneamente ridurne gli effetti collaterali;
c) Diminuire la dose somministrata di principio attivo;
d) Aumentare il controllo sulla biodistribuzione grazie al targeting passivo ed attivo; e) Rendere solubili in ambiente acquoso principi attivi altamente lipofilici.
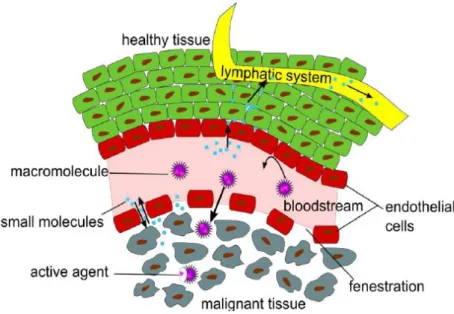
Nonostante i potenziali vantaggi nell’utilizzo di nanocarriers, numerose barriere biologiche ne limitano l’efficacia reale (Fig. 1). Infatti, una volta in circolo i nanosistemi sono rivestiti, attraverso il processo di opsonizzazione, dalle proteine
7
plasmatiche, formando le proteine corona che sono riconosciute e fagocitate dal sistema reticoloendoteliale o dei fagociti mononucleati (Mononuclear Phagocyte System, MPS). Inoltre i meccanismi di accumulo ed eliminazione del nanocarrier, dopo aver esplicato la sua funzione, sono complessi e dipendono da diversi fattori come, ad esempio, la via di somministrazione.
Figura 1: Rappresentazione delle principali barriere biologiche che riducono l'efficacia della
terapia con nanoparticelle.9
La percentuale di nanoggetti che effettivamente raggiunge il tumore è definita come “efficienza di veicolazione”. Nel 2016 Wilhelm et al.10
hanno condotto uno studio statistico sulla letteratura degli ultimi dieci anni riguardante la nanomedicina e hanno concluso che in media solamente lo 0.7% dei nanoggetti iniettati raggiunge il tumore. Tale valore indica che per raggiungere un’efficacia soddisfacente sono necessarie
8
elevate quantità di nanoggetti, con conseguenti problemi di scale-up delle sintesi e aumento dei costi.
Una strategia per aggirare il MPS è detta “stealth” e consiste nel rivestire i nanoggetti con materiali, come il glicole polietilenico (PEG), in grado di non essere riconosciuti come estranei dai macrofagi.11
Targeting passivo
La distribuzione preferenziale nei tessuti tumorali rispetto a quelli sani venne attribuita alla presenza di ampie fenestrazioni e scarso drenaggio linfatico dei vasi sanguigni nei tessuti malati rispetto a quelli sani. Tale effetto venne definito come EPR: Enhanced
Permeability and Retention effect. Infatti, i tessuti tumorali necessitano di elevate
quantità di nutrienti e ossigeno per sostenere la loro crescita incontrollata, per questo le cellule sintetizzano quantità molto elevate di fattore di crescita dell’endotelio vascolare di tipo A (VEGF-A), il quale promuove l’angiogenesi, cioè la formazione di nuovi vasi sanguigni da altri preesistenti. I nuovi vasi generati presentano delle fenestrazioni di dimensioni variabili tra i 200 e i 1200 nm, strettamente legate al tipo di tumore, alla sua localizzazione e al micro-ambiente tumorale.12
In condizioni fisiologiche, in quasi tutti i tessuti sani, i fluidi extracellulari sono drenati costantemente dal sistema linfatico, mentre nei tumori solidi il drenaggio è assente, in questo modo le macromolecole o nanoparticelle con volume idrodinamico elevato sono trattenute all’interno delle cellule tumorali (Fig. 2).13
Grazie all’effetto EPR è possibile ottenere concentrazioni di principio attivo molto elevate nella zona tumorale, anche 10-50 volte maggiori rispetto ai tessuti sani.14
Negli ultimi vent’anni questa caratteristica dei tumori solidi è stata la forza trainante per il design e lo sviluppo di nanomedicine nel trattamento antitumorale.
9
Figura 2: Schema dei meccanismi che prendono parte all'effetto EPR. Tra le cellule endoteliali
dei vasi sanguigni tumorali sono presenti delle fenestrazioni che consentono l’ingresso delle nanoparticelle nei tessuti tumorali. Inoltre, l’assenza di drenaggio linfatico permette la ritenzione delle nanoparticelle e il conseguente accumulo di principio attivo. https://www.researchgate.net/profile/Hanno_Schieferstein/publication/261372022/figure/fig1/A S:296891494486016@1447795856067/Figure-1-Illustration-of-the-Enhanced-Permeation-and-Retention-EPR-effect-of.png (ultimo accesso 06/01/2017)
Targeting attivo
Il targeting attivo si basa sull’interazione specifica delle cellule tumorali con il
nanocarrier. In linea di principio, questo può essere ottenuto attraverso diversi approcci
come ad esempio il riconoscimento selettivo di recettori localizzati sulla membrana cellulare da parte di ligandi specifici presenti sulla superficie dei nanocarriers che contengono il principio attivo. I ligandi possono essere proteine, anticorpi, acidi nucleici, carboidrati o piccole molecole come le vitamine.15 Le molecole bersaglio “target” possono essere proteine, zuccheri o lipidi presenti sulle cellule tumorali o nei tessuti malati.16 La progettazione di nanosistemi destinati al targeting attivo è più complicata rispetto al targeting passivo perché l’efficacia del nanosistema dipende dalla sua struttura, dalla tipologia di ligando e da come questo è legato al carrier. Inoltre si può avere legame non specifico con proteine presenti nel flusso sanguigno con conseguente perdita di efficacia della terapia.17 L’efficacia del targeting attivo aumenta
10
all’aumentare della densità dei ligandi, della concentrazione dei nanoggetti e dell’espressione dei recettori da parte delle cellule bersaglio.18
I due aspetti fondamentali che determinano l’efficienza di un sistema basato sul
targeting attivo sono la specificità nel raggiungimento dell’obiettivo e la capacità di
trasporto. Il primo dipende dalla biodistribuzione dei nanosistemi e dalla loro interazione con le cellule sane ed è definito dai leganti e dalle proprietà del nanoggetto. Il secondo è direttamente correlato al materiale di cui è fatto il nanocarrier e alla sua struttura.19 La difficoltà più grande di questo approccio è la necessità, per il nanosistema funzionalizzato, di trovarsi in prossimità dei recettori per consentire il riconoscimento e l’interazione.20
1.1.1. Nanoparticelle
Per nanoparticella si intende una particella solida con un diametro tra i 10 e i 1000 nm.21 A seconda della struttura le nanoparticelle possono essere suddivise in nanocapsule, se il farmaco è confinato al centro della particella e ricoperto da una membrana polimerica, e nanosfere se il farmaco è omogeneamente disperso nella matrice polimerica.
I materiali con cui si possono ottenere nanoparticelle sono molti e di diversa natura, infatti, esistono nanoparticelle formate da metalli (Au, Ag, Cu, ecc.), da semiconduttori (Si) e da polimeri sia sintetici che naturali. La scelta del materiale più adatto dipende da molti fattori come le dimensioni, la solubilità e stabilità del farmaco in ambiente acquoso, il profilo di rilascio controllato che si intende ottenere, le cariche superficiali e l’idrofobicità delle nanoparticelle, la biocompatibilità e biodegradabilità della matrice, la non tossicità e immunogenicità del prodotto.22
1.1.1.1. Nanoparticelle metalliche
Le nanoparticelle metalliche, in particolare di metalli nobili come oro e argento, hanno molte applicazioni nel settore biomedicale, ad esempio nell’ipertermia, nel drug
delivery, nell’imaging e nella radioterapia.23 Quando le particelle metalliche hanno dimensioni nanometriche mostrano proprietà molto diverse da quelle dei metalli bulk. La conseguenza più evidente delle dimensioni nanometriche dei metalli è la risonanza plasmonica di superficie localizzata (Localized Surface Plasmon Resonance, LSPR),
11
questa consiste in una oscillazione coerente degli elettroni di superficie della nanoparticella metallica indotta da una radiazione elettromagnetica. La frequenza di risonanza plasmonica è un parametro molto sensibile alle variazioni delle dimensioni, della forma, e della funzionalizzazione delle nanoparticelle come anche delle condizioni ambientali. L’elevata sensibilità nei confronti di questi parametri rende le nanoparticelle metalliche adatte all’impiego nella rilevazione di molecole e nella diagnostica.24
Attualmente le nanoparticelle di oro (AuNPs) vengono impiegate nella terapia fototermica del cancro (Photothermal Therapy, PTT) grazie alla loro capacità di assorbire la radiazione elettromagnetica trasformandola in calore. Tra queste le AuNPs di forma cilindrica (nanorods) risultano essere quelle più efficaci.25
Un altro metallo utilizzato per sintetizzare nanoparticelle è l’argento. Le nanoparticelle di argento (AgNPs) possiedono particolari caratteristiche chimico-fisiche come elevata conducibilità elettrica e termica, stabilità meccanica, attività catalitica, proprietà ottiche non lineari e proprietà antibatteriche.26 Grazie a queste ultime le AgNPs sono diventate popolari in molti settori come quello delle plastiche, quello alimentare e tessile.
Alcuni metalli esibiscono proprietà paramagnetiche, ovvero la capacità di sviluppare un momento magnetico non nullo solamente quando vengono immerse in un campo magnetico esterno. Se le dimensioni delle particelle di tali materiali sono abbastanza piccole da contenere un singolo dominio magnetico si ha il fenomeno di superparamagnetismo. Le nanoparticelle superparamagnetiche più conosciute sono quelle a base di -Fe2O3 o Fe3O4, SPION (Superparamagnetic Iron Oxide
Nanoparticles), le quali trovano applicazione nell’imaging a risonanza magnetica
(Magnetic Resonance Imaging, MRI), nell’ipertermia oncologica e nella radioterapia.27
1.1.1.2. Nanoparticelle di polimeri sintetici
Nanoparticelle a base di polimeri sintetici sono utilizzate per il trasporto di farmaci, per la terapia fotodinamica e nella teranostica.28,29 L’utilizzo di polimeri sintetici è vantaggioso perché consente di aggiungere il principio attivo lipofilico direttamente durante la polimerizzazione, evitando quindi modifiche post-sintetiche.30
I polimeri sintetici maggiormente utilizzati per la preparazione di nanoparticelle sono il polietilenglicole (PEG), la poli(N-(2-idrossipropil)metacrilammide) (HPMA) e il polimetilmetacrilato (PMMA).
12
Ad esempio, PK1 è un coniugato tra doxorubicina e HPMA che ha superato la fase I degli studi clinici nel trattamento di tumori resistenti alla chemioterapia e/o radioterapia.31
1.1.1.3. Nanoparticelle polisaccaridiche
I polisaccaridi sono polimeri costituiti da unità monomeriche monosaccaridiche, le cui fonti naturali possono essere vegetali (alginati, pectina) o animali (chitosano, condroitina, acido ialuronico). Le loro strutture e proprietà sono strettamente influenzate dalla composizione chimica, dai gruppi funzionali presenti e dai pesi molecolari.32 I polisaccaridi sono stabili, non tossici, biodegradabili, ottenibili da fonti rinnovabili e con processi economicamente sostenibili, inoltre i gruppi idrofilici (idrossilici, carbossilici e amminici) sono in grado di interagire non covalentemente con i tessuti biologici33, prolungandone i tempi di permanenza all’interno dell’organismo.
Le nanoparticelle polisaccaridiche possono essere preparate mediante reticolazione covalente, reticolazione ionica, complessazione polielettrolitica (PEC) o
self-assembly.34,35,36
1.1.1.4. Liposomi
I liposomi sono delle vescicole sferiche costituite da molecole anfifiliche che, in ambiente acquoso, appaiano le loro code idrofobiche e si dispongono spontaneamente in modo da formare uno o più strati concentrici (Fig 3). Le molecole che possono formare liposomi sono il colesterolo, i fosfolipidi, i glicolipidi, i surfattanti, gli acidi grassi a lunga catena e le proteine di membrana.37
Figura 3: Struttura generica di un liposoma.
13
I liposomi sono ampiamente utilizzati nel drug delivery grazie alla loro capacità di internalizzare e rendere solubili farmaci lipofilici, di proteggerli dalla degradazione in
vivo, di aumentarne la permanenza nel flusso sanguigno e di consentirne un rilascio
controllato.
Ad oggi esistono molti farmaci commercializzati in formulazione con liposomi, i più noti nella terapia antitumorale sono Doxil®, contenente doxorubicina e approvato nel 1995 dall’FDA38
, il suo derivato non pegylato, Myocet®39, e DaunoXome®, a base di daunorubicina.40
1.1.1.5. Nanoparticelle proteiche
Le proteine sono candidati ideali per la sintesi di nanoparticelle in quanto biodegradabili, biocompatibili e facilmente funzionalizzabili41, inoltre la loro anfifilicità permette di interagire sia con l’ambiente acquoso che con farmaci lipofilici.42
L’utilizzo di nanoparticelle proteiche nel drug delivery è favorito anche dall’eliminazione di solventi necessari per solubilizzare i principi attivi e dal potenziale aumento della concentrazione intratumorale del farmaco.43 Sono state utilizzate con successo varie proteine, idrosolubili come albumina sierica umana (HSA) e bovina (BSA), e insolubili come zeina e gliadina.44,45
L’albumina è la principale proteina presente nel plasma ed è coinvolta nel mantenimento della pressione osmotica e nel trasporto dei nutrienti alle cellule. Ha un peso molecolare di 66.5 kDa e presenta un’elevata solubilità in acqua e in soluzione saline diluite, a pH 7.4 la solubilità è pari al 40% w/v. È stabile tra pH 4 e 9 e può essere scaldata a 60°C per 10 ore senza che si degradi.46 Le nanoparticelle a base di albumina sono biodegradabili, facili da sintetizzare, hanno dimensioni ben definite e presentano numerosi gruppi funzionali (tiolici, amminici, carbossilici).22
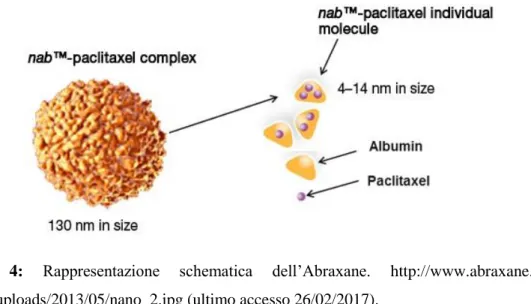
Il primo prodotto commerciale a scopo chemioterapico a base di nanoparticelle di albumina umana (HSA) caricate con paclitaxel fu l’Abraxane® (nabTM-paclitaxel), (Fig. 4).
14
Figura 4: Rappresentazione schematica dell’Abraxane.
http://www.abraxane.eu/wp-content/uploads/2013/05/nano_2.jpg (ultimo accesso 26/02/2017).
L’Abraxane è stato approvato nel 2005 dall’FDA per il trattamento del cancro al seno. L’impiego di tali nanoparticelle ha consentito l’eliminazione della miscela solvente (Cremophor EL) diminuendo l’insorgenza di reazioni di ipersensibilità e riducendo notevolmente i tempi di infusione rispetto alla terapia con Cremophor EL (30 minuti vs 3 ore).
1.1.2. Metodi di preparazione di nanoparticelle proteiche
La formazione di nanoparticelle proteiche è basata sull’equilibrio tra forze attrattive e repulsive presenti nella proteina. L’aumento della denaturazione e la diminuzione delle interazioni idrofobiche intramolecolari sono fondamentali per la formazione delle nanoparticelle.47 Durante la formazione di nanoparticelle, le proteine subiscono dei cambiamenti conformazionali che dipendono dalla concentrazione, dal pH, dalla forza ionica e dal tipo di solvente. La denaturazione delle proteine espone all’ambiente esterno i gruppi funzionali reattivi, come quelli tiolici e amminici, che possono successivamente essere reticolati chimicamente o termicamente portando alla formazione di nanoparticelle stabili.22
15
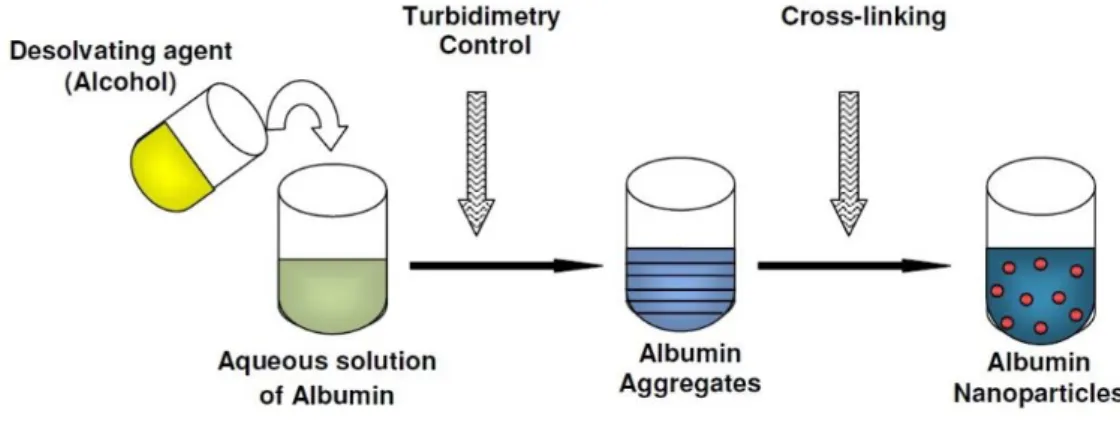
1.1.2.1. Desolvatazione
La desolvatazione (Fig. 5) è un metodo basato sulla variazione di solubilità di una proteina in solventi diversi. Infatti, l’aggiunta di un non-solvente ad una soluzione di proteina, provoca cambiamenti conformazionali, con conseguente riduzione della solubilità e precipitazione. Quando le nanoparticelle si sono formate viene aggiunto un agente reticolante, ad esempio glutaraldeide, che mediante la formazione di legami covalenti, stabilizza la struttura nanoparticellare. La desolvatazione per produrre nanoparticelle di albumina venne utilizzata per la prima volta nel 1993.48 Gli agenti desolvatanti più comunemente utilizzati sono l’etanolo e l’acetone. Le dimensioni delle nanoparticelle sono modulabili in base alle condizioni operative, all’agitazione, alla specie desolvatante, al rapporto solvente/antisolvente, al pH della soluzione e alla concentrazione salina.48,49
Figura 5: Metodo di preparazione per desolvatazione di nanoparticelle di albumina.41
1.1.2.2. Emulsione
Questo metodo prevede la formazione di un’emulsione tra una soluzione acquosa di proteina e una fase oleosa, in presenza di un tensioattivo (fosfatidilcolina, Span 80 ecc.) (Fig. 6).50 Le nanoparticelle, che si formano all’interfaccia tra le due fasi, vengono stabilizzate da un agente reticolante ed infine la fase oleosa viene allontanata utilizzando solventi organici. Le dimensioni delle nanoparticelle aumentano all’aumentare della concentrazione iniziale e del rapporto volumetrico tra fase acquosa e oleosa. Questa metodica presenta il grande svantaggio di utilizzare solventi organici e surfattanti che successivamente devono essere rimossi. Inoltre le nanoparticelle ottenute per emulsione
16
hanno dimensioni generalmente più elevate rispetto a quelle ottenute per desolvatazione.51
Figura 6: Metodo di preparazione in emulsione di nanoparticelle proteiche.22
1.1.2.3. Elettrospray Drying
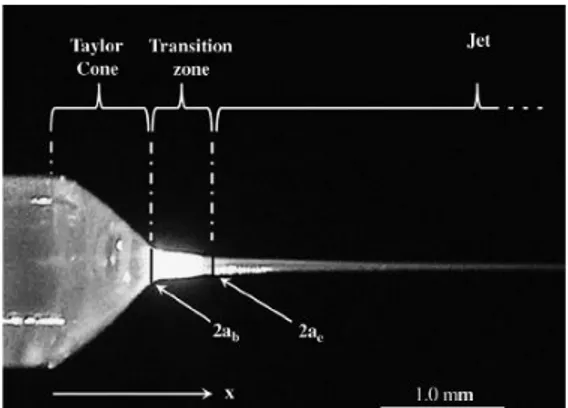
L’elettrospray drying è una tecnica usata per disperdere i liquidi in goccioline di dimensioni micro- o nano-metriche. Una soluzione liquida o un fuso polimerico, con conducibilità elettrica sufficiente, viene estruso attraverso un ago e sottoposto all’azione di un campo elettrico.52 La differenza di potenziale impartita da due elettrodi genera una forza che si oppone alla tensione superficiale che tende a trattenere il fluido all’interno del capillare. All’aumentare dell’intensità del campo, il menisco del liquido assume una caratteristica forma a cono, chiamato “cono di Taylor” (Fig. 7). Quando le forze elettrostatiche superano la tensione superficiale dalla sommità di questo cono esce un sottilissimo getto di liquido che successivamente viene disgregato in un aerosol di goccioline cariche elettrostaticamente.53 La capacità di produrre particelle nanometriche monodisperse con relativa facilità rende l’elettrospray drying la migliore tra le tecniche basate su aerosol. Il vantaggio più importante di questa tecnica è l’ottenimento di una polvere nanometrica istantaneamente asciutta, eliminando pertanto la necessità di successivi procedimenti di rimozione del solvente.
17
Figura 7: Formazione del cono di Taylor.54
1.1.2.4. Self-assembly
Self-assembly è il processo per cui i componenti di un sistema, siano essi molecole,
polimeri, colloidi o particelle macroscopiche, si organizzano spontaneamente in strutture ordinate e/o funzionali.55
Il processo di self-assembly di nanoparticelle proteiche sfrutta la presenza concomitante di residui idrofilici e idrofobici sulla stessa proteina. In ambiente acquoso le proteine formano strutture micellari nelle quali i domini idrofobici sono rivolti verso il nucleo mentre in superficie si orientano i domini idrofilici (Fig. 8).
Sfruttando l’instaurarsi di interazioni tra i residui idrofobici della proteina (leucina, fenilalanina) con molecole lipofiliche è possibile caricare il core idrofobico della nanoparticella con principi attivi lipofili, che nella loro forma libera sono insolubili in ambiente acquoso.
Figura 8: Ripiegamento delle proteine in ambiente acquoso.
18
1.2. Cheratina
1.2.1. Struttura e ruolo fisiologico
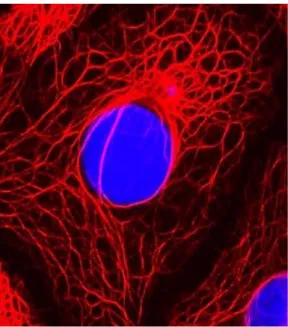
Le cheratine sono un’ampia famiglia di proteine fibrose, insolubili e ad alto contenuto di zolfo che vengono sintetizzate nelle cellule di molte specie animali principalmente con funzione strutturale. La cheratina è sintetizzata e accumulata all’interno dei cheratinociti, le principali cellule dell’epidermide, e rappresenta una tra le proteine più abbondanti nei filamenti intermedi che, insieme a microtubuli e microfilamenti di actina compongono il citoscheletro (Fig. 9). Il citoscheletro svolge una funzione strutturale organizzando gli organelli nel citoplasma, permette alla cellula di muoversi e prende parte alla divisione cellulare, inoltre mediante i desmosomi permette l’ancoraggio tra le diverse cellule.
Figura 9: Immagine al microscopio del citoscheletro di cellule epiteliali. Filamenti di cheratina
(rosso) e nucleo cellulare (blu).56
I filamenti intermedi sono delle superstrutture fibrose composte da unità polipeptidiche diverse tra loro che però presentano una struttura simile composta da una testa N-terminale, un dominio centrale lineare ad α-elica ed una coda C-terminale. Due catene polipeptidiche si superavvolgono con orientazione parallela in una spirale, definita
19
i residui idrofili siano rivolti verso l’esterno.57 I dimeri a loro volta si affiancano in modo sfalsato e con orientamento antiparallelo per formare dei tetrameri, che si allineano in protofilamenti. Il filamento intermedio è l’unione di più protofilamenti (Fig. 10).
Figura 10: Schema di assemblaggio di un filamento a partire dai polipeptidi.58
La cheratina gioca un ruolo fondamentale anche nella barriera placentare59, nella prevenzione dell’apoptosi60
, nella regolazione della sintesi di proteine e nella crescita cellulare.61
20
1.2.2. Classificazione, composizione amminoacidica e caratteristiche
L’ampia famiglia delle cheratine si può suddividere in cheratina “hard” e “soft”. La cheratina hard contiene molto zolfo e costituisce i capelli, la lana, le unghie, gli zoccoli e le corna degli animali. La cheratina soft contiene meno zolfo e costituisce parte dei filamenti intermedi riscontrabili nelle cellule epiteliali.
La cheratina contenuta nei capelli e nella lana è composta da tre tipologie di cheratina: a) α-cheratine: hanno un peso molecolare che tra i 60 e gli 80 kDa, la loro struttura è
un’alfa-elica, contengono relativamente poco zolfo, si organizzano in microfibrille andando a comporre la corteccia (parte interna del capello) e rappresentano il 50-60% del capello;62
b) β-cheratine: svolgono una funzione protettiva infatti sono la componente principale della cuticola (rivestimento protettivo del capello), la loro estrazione è difficoltosa e i prodotti estratti non hanno impieghi interessanti;
c) γ-cheratine: sono proteine globulari, hanno un peso molecolare di circa 15 kDa. Compongono la matrice che circonda le microfibrille, grazie al loro elevato contenuto di zolfo possono formare legami disolfuro, conferendo compattezza alla struttura globale.
Gli amminoacidi più presenti nella cheratina sono serina, acido glutammico e cisteina.63 La concentrazione elevata di residui cisteinici (dal 7 al 20%, rispetto agli amminoacidi totali)64 distingue la cheratina dalle altre proteine e consente la formazione di molti legami a ponte disolfuro. L’inerzia chimica e l’insolubilità in comuni solventi della lana è riconducibile alla struttura delle sue fibre che viene mantenuta compatta grazie ai numerosi ponti disolfuro, oltre a legami a idrogeno, alle interazioni elettrostatiche e interazioni idrofobiche (Fig. 11).
21
Figura 11: Interazioni tra due α-eliche di cheratina
La cheratina presenta sequenze amminoacidiche, leucina-acido aspartico-valina (LDV) e arginina-glicina-aspartato (RGD), tipiche delle proteine della matrice extracellulare, che promuovono l’adesione, la diffusione e la crescita cellulare.65
1.2.3. Proprietà
La cheratina ha caratteristiche tali che ne consentono la facile manipolazione e trasformazione in oggetti tridimensionali, inoltre la sua biocompatibilità e biodegradabilità garantiscono un utilizzo sicuro in molti ambiti.66
La cheratina possiede una buona resistenza termica, anche senza reticolazione, che le consente di essere sottoposta a trattamenti chimici e a successivi lavaggi senza essere degradata. Ad esempio la cheratina non viene degradata durante l’estrazione a 100°C né durante spray drying a 60°C.67 Le proprietà termiche della cheratina estratta da lana dipendono dal livello di umidità presente al suo interno68, in particolare all’aumentare del contenuto di umidità si nota una diminuzione della temperatura di transizione vetrosa e quindi un aumento della mobilità della struttura proteica.67
22
La cheratina ha un’elevata biocompatibilità, infatti non provoca reazioni da parte del sistema immunitario, non è citotossica, promuove l’adesione e la proliferazione cellulare.
Inoltre, la cheratina è biodegradabile69, pur essendo la sua velocità di degradazione in
vivo da parte delle proteasi inferiore rispetto a quella di altre proteine.
La cheratina possiede il vantaggio, rispetto ad altre proteine, di poter essere ricavata da materie prime rinnovabili e di scarto, come lana70, piume71 o capelli63, ed essere poi trasformata in prodotti ad alto valore aggiunto. Gli attuali metodi di smaltimento degli scarti a base di cheratina, incenerimento o trasformazione in mangimi, non sono efficienti rispettivamente a causa dell’autoestinguenza (Limiting Oxigen Index > 21)72 e dei trattamenti ad alta pressione e temperatura necessari che però riducono i valori nutritivi.73
La cheratina è altamente funzionalizzabile, grazie alla presenza nella sua struttura di gruppi carbossilici (COOH), amminici (NH2), ammidici (CONH2), alcolici (OH), tiolici
(SH) o solfonici (SO3H).
1.2.4. Metodi di estrazione
La struttura compatta delle sue fibre e l’abbondanza di interazioni determinano l’inerzia chimica della lana e la sua insolubilità in solventi comuni.
L’estrazione di proteine dalla lana implica l’uso di agenti ossidanti o riducenti per la scissione dei ponti disolfuro presenti nella cistina e l’aggiunta di urea per la rottura dei legami a idrogeno.
L’utilizzo di ossidanti come cloro, acido ipocloroso e acido peracetico permette un’ossidazione completa della cistina, mentre l’azione di acido permanganico o ipoclorito non porta oltre al 25% di ossidazione.74 Si ottengono delle proteine ricche in acido cistinico dette cheratina ossidata o “cheratosi”. Grazie alla presenza di gruppi solfonici acidi (SO3H), la cheratina ossidata è solubile in acqua, igroscopica, sensibile
all’idrolisi a pH estremi, non può riformare i ponti disolfuro e per questo è degradabile velocemente in vivo.75
La reazione con riducenti come acido tioglicolico, ditiotreitolo o 2-mercaptoetanolo, invece genera la cheratina ridotta, ricca in cisteina, meno idrofilica di quella ossidata,
23
più resistente a pH estremi, stabile per periodi più lunghi e che può essere ossidata per rigenerare i legami disolfuro.
Dal momento che la maggior parte degli agenti riducenti e ossidanti risulta nociva, in alternativa l'estrazione della cheratina può essere ottenuta tramite il processo di solfitolisi. I legami S-S vengono scissi in residui di cisteina e residui cistein-S-solfonati (sali di Bunte), solubili in acqua, tramite ioni solfito, bisolfito o metabisolfito anche se con questo metodo le rese di estrazione risultano inferiori.76
L’analisi elettroforetica assicura che il trattamento di solfitolisi condotto a 65°C, a pH 7 per 5 ore non porta alla degradazione della cheratina ridotta.
L’aggiunta di sodio dodecilsolfato (SDS), un surfattante, è necessaria per aumentare la stabilità della soluzione grazie alla solvatazione delle proteine, che ne evita l’aggregazione pur non influenzando la resa di estrazione.
1.2.5. Applicazioni
Le molteplici proprietà della cheratina ne hanno promosso lo studio per svariate applicazioni, non solo in campo medicale. La cheratina può essere utilizzata in ambito cosmetico77, in formulazione nelle schiume per estintori78, nel packaging79, in sistemi di filtrazione attiva delle acque e di purificazione dell’aria80, nell’industria tessile81 e nel
wound-healing82.
L’ingegneria tissutale ha lo scopo di rigenerare tessuti ed organi grazie alla crescita cellulare su supporti polimerici chiamati scaffolds. Per scaffold si intende un supporto poroso tridimensionale realizzato in un materiale biocompatibile e bioerodibile sul quale far avvenire l’adesione delle cellule e la successiva ricrescita fino alla formazione del tessuto e in maniera tale che esso si biodegradi a velocità controllata simile a quella di ricrescita. Risale al 2001 in Giappone, la prima applicazione di uno scaffold cheratinico per la proliferazione cellulare.83
Le caratteristiche che uno scaffold deve avere sono:
• porosità elevata ed interconnessione tra i pori in modo da favorire la crescita cellulare, il trasporto delle sostanze nutritive e l’eliminazione delle sostanze di rifiuto;
24 • biodegradabilità controllata;
• superficie chimicamente adatta all’adesione, alla proliferazione e alla differenziazione delle cellule;
• proprietà meccaniche simili a quelle dei tessuti che si devono riprodurre sullo scaffold; • riproducibilità, in modo semplice, in diverse forme e dimensioni.
Gli scaffold possono presentarsi in diverse forme:
Spugne: le spugne sono strutture tridimensionali rigide ad elevata porosità e con pori omogeneamente distribuiti e interconnessi (Fig. 12). Le spugne di cheratina possono essere ottenute tramite liofilizzazione di una soluzione acquosa e utilizzate nella medicina rigenerativa.84,85
Figura 12: Aspetto macroscopico di una spugna di cheratina (a) e visualizzazione al
microscopio elettronico a scansione (b).84
Film: i film sono delle sottili pellicole ottenute tramite deposizione uniforme (casting) ed essiccamento di una soluzione di proteina, sia pura69 sia in formulazione con altri polimeri naturali86 o sintetici.76
Fibre: la cheratina può essere processata, mediante elettrofilatura, in fibre micrometriche o nanometriche dall’elevata area superficiale ed elevata porosità.87,88
Idrogel: un idrogel è un reticolo polimerico tridimensionale e idrofilo capace di assorbire grandi quantità di acqua o fluidi biologici.89 Idrogel a base di cheratina
25
sono stati studiati per la medicina rigenerativa, in particolare per la rigenerazione di nervi periferici90, di vasi sanguigni e nell’emostasi (HemCom® e Quickclot®).91
1.3. Istoni e deacetilasi istoniche (HDACs)
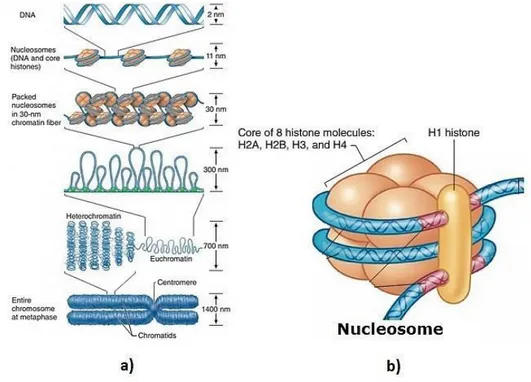
Il DNA nel genoma non è presente in forma libera ma è associato a istoni, cioè delle proteine basiche attorno alle quali il DNA si avvolge in maniera sinistrorsa. L’associazione tra DNA e istoni prende il nome di cromatina. Gli istoni sono carichi positivamente a causa della presenza di gruppi funzionali amminici protonati, appartenenti a residui lisinici. Gli istoni si organizzano in ottameri detti nucleosomi, ognuno dei quali è costituito da quattro coppie di istoni (H2A, H2B, H3, H4) attorno ai quali si avvolgono circa 146 coppie di basi azotate del DNA.92 È poi presente un ulteriore istone (H1) che svolge una funzione aggregativa tra i nucleosomi e consente la formazione di una fibra cromatinica di circa 30 nm di diametro (Fig. 13).
Figura 13: a) Schema di assemblaggio di un cromosoma partendo dal DNA. b) Struttura di un
nucleosoma. http://www.getmededu.com/chromatin.html (ultimo accesso 25/01/2017)
La struttura della cromatina è dinamica e regola l’attività trascrizionale. Nel 1964 Allfrey et al.93 ipotizzarono che la regolazione della struttura della cromatina e delle sue
26
funzioni dipendesse dall’acetilazione degli istoni. La cromatina può presentarsi in due conformazioni, una aperta e una chiusa, ed il passaggio da una all’altra è dovuto al grado di acetilazione dei residui lisinici degli istoni. Infatti, l’iperacetilazione comporta una maggiore neutralizzazione della carica positiva istonica e quindi un rilassamento della conformazione. Quando la cromatina assume questa conformazione più aperta, è chiamata eucromatina e grazie a questa forma è promossa la trascrizione.94 Viceversa l’ipoacetilazione porta a un impaccamento della cromatina in una struttura chiamata eterocromatina. La cromatina, quindi, può presentare due regioni, l’eucromatina contenente la maggior parte dei geni attivi e l’eterocromatina contenente in preponderanza geni inattivi. Il passaggio da una forma all’altra è un processo enzimatico reversibile che vede come protagoniste due classi di enzimi, le istone acetiltransferasi (HATs) e le istone deacetilasi (HDACs). Il nome di questi enzimi deriva dal fatto che inizialmente furono identificati per la loro funzione di rimozione di gruppi acetilici dai residui lisinici sulle code N-terminali degli istoni.95
Uno squilibrio tra l’attività di HDAC e HAT, con conseguente ipoacetilazione istonica, può essere un passaggio fondamentale durante la carcinogenesi.96,97,98 Nello specifico: una sovraespressione di HDACs è stata rilevata in molti tumori solidi.96,99
La famiglia delle HDACs è vasta e comprende almeno 18 elementi, suddivisi in 4 classi secondo il criterio di omologia con le relative HDACs dei lieviti e in base ad analisi filogenetiche:100,101
Classe 1. Comprende le HDACs 1,2,3 e 8. Sono formate dai 350 ai 500 amminoacidi. Si trovano principalmente nel nucleo e sono conosciuti come co-repressori trascrizionali;
Classe 2. Comprende le HDACs 5, 6, 7, 9 e 10. Sono formate da circa 1000 amminoacidi. HDAC6 e HDAC10 contengono due domini catalitici;
Classe 3. Chiamate anche sirtuine (SIRT1-7), comprende 7 proteine NAD+
-dipendenti e strutturalmente non correlate a quelle delle altre classi;102
27
1.4. Inibitori delle deacetilasi istoniche (HDACi)
Gli inibitori delle deacetilasi istoniche (HDACi) sono un’ampia classe di molecole che mostrano attività antitumorale, riconducibile alla capacità di influenzare diversi processi cellulari che, nelle cellule neoplastiche, sono fuori controllo. Anche se i meccanismi specifici di azione non sono ancora chiari, è evidente che l’inibizione delle HDACs ha diverse conseguenze sulle cellule tumorali tra le quali l’arresto del ciclo cellulare, la differenziazione, l’induzione dell’apoptosi e la riduzione dell’angiogenesi.103
Il trattamento con HDACi, sia di cellule sane sia tumorali, genera un accumulo confrontabile di istoni H2A, H2B, H3 e H4104,105,106, nonostante ciò, gli HDACi hanno un effetto più marcato sulle cellule tumorali rispetto a quelle normali, in termini di apoptosi e inibizione della crescita cellulare.107,108
Un elevato numero di HDACi è stato ottenuto da fonti naturali o per via sintetica. La grande varietà strutturale fra le molecole che appartengono a questa classe può far pensare che esse agiscano secondo diversi meccanismi. Gli inibitori delle HDACs possono essere classificati in quattro grandi classi in base alla loro struttura.
Acidi idrossamici: sono una classe di molecole che presentano un gruppo idrossilico
legato all’azoto di un gruppo ammidico.
A questa categoria appartengono la tricostatina A (TSA) e l’acido idrossamico suberoilanilide (SAHA)(Fig. 14).
Figura 14: Strutture di TSA e SAHA.
TSA è stato il primo acido idrossamico naturale del quale si hanno evidenze d’inibizione delle HDACs già a basse concertazioni (nM)109
, induce differenziazione e inibisce la crescita tumorale, pur avendo effetti trascurabili sulle cellule normali.110
28
Un altro acido idrossamico è il SAHA (Vorinostat), strutturalmente simile al precedente, che rappresenta il primo inibitore delle HDACs approvato dall’FDA per il trattamento del linfoma cutaneo a cellule T.111
Acidi grassi a corta catena: a questa categoria appartengono butirrato, fenilbutirrato, acido valproico (Fig. 15) e i loro derivati. La loro attività inibitoria nei confronti delle HDACs è relativamente debole, sono richieste concentrazioni mM per ottenere un effetto significativo.112 Per questo motivo l’interesse nei loro confronti non è molto elevato.
Figura 15: Strutture di acido valproico e fenilbutirrato di sodio.
Benzammidi: MS-275 (Fig. 16) è una benzammide sintetica che ha raggiunto la fase II
dei test clinici e presenta attività inibitoria verso HDAC1, HDAC2 e HDAC3 in concentrazioni µM. È usata nel trattamento di leucemie, linfomi e tumori solidi.113,114
Figura 16: Struttura di MS-275.
Peptidi ciclici: sono gli HDACi strutturalmente più complessi. In questa categoria
rientrano depsipeptide, apicidina e acidi idrossamici ciclici contenenti gruppi peptidici. Il primo è anche conosciuto come romidespin (FK228), una molecola naturale estratta da Chromobacterium violaceum115 e che nel 2009 è stata approvata dall’FDA per il trattamento del linfoma cutaneo a cellule T.
29
1.5. Acido 9-idrossistearico (9-HSA)
I derivati idrossilici degli acidi grassi a lunga catena, prodotti per via enzimatica o meno, hanno ricevuto sempre più attenzione nel corso degli anni grazie ai loro effetti, in
vitro e in vivo, sulla sintesi del DNA e sulla proliferazione cellulare.116,117
Alcuni di questi acidi grassi sono prodotti endogeni cellulari e la loro quantità nelle cellule tumorali è diversa rispetto alle cellule sane. Studi in vitro hanno evidenziato che nelle cellule tumorali la loro quantità diminuisce all’aumentare della densità cellulare mentre in quelle sane la quantità aumenta proporzionalmente alla proliferazione cellulare.118
Due acidi grassi in particolare, 9-idrossistearico (9-HSA) (Fig. 17) e 10-idrossistearico (10-HSA), sono stati individuati come prodotti endogeni della perossidazione lipidica nelle cellule del carcinoma polmonare di Lewis (C108) in vitro e la loro concentrazione è risultata diminuire proporzionalmente all’aumentare della confluenza cellulare.118 Sulla base di queste evidenze sperimentali è stato ipotizzato che 9-HSA e 10-HSA avessero un ruolo preciso nel controllo delle funzioni cellulari.
Figura 17: Struttura dell'acido-9-idrossistearico (9-HSA).
Successivamente Masotti et al.119 hanno esteso i loro studi a cellule tumorali umane HT29 (adenocarcinoma del colon) e a cellule embrionali intestinali (I-407), utilizzate come controllo. In entrambe le linee cellulari sono stati nuovamente riscontrati 9-HSA e 10-HSA, la loro concentrazione endogena nelle I-407 aumenta proporzionalmente alla proliferazione cellulare, mentre nelle HT29 diminuisce all’aumentare della densità cellulare. Questa è un’ulteriore conferma della relazione tra questi acidi grassi e la proliferazione delle cellule neoplastiche.
Nello stesso studio, la somministrazione esogena di una miscela di 9-HSA e 10-HSA, sulla linea C108, ha mostrato che l’azione antiproliferativa è funzione della concentrazione somministrata e del tempo di coltura. Nello specifico, fino a una
30
concentrazione di 50 µM si osserva solamente un effetto citostatico, mentre per concentrazioni pari a 100 µM si osserva un effetto citotossico dopo 2-3 giorni. Nel caso in cui sia ripristinato il mezzo di coltura originale, senza acido idrossistearico, le cellule tumorali riprendono a proliferare.
L’effetto di HSA sul ciclo cellulare è diverso tra HT29, C108 e I-407, infatti, nelle prime avviene un blocco in G0/G1 mentre nelle seconde si ha accumulo cellulare in
G2/M, infine nelle ultime si ha un effetto citotossico solo per concentrazioni superiori a
150 µM. L’evidenza che HSA agisce secondo un meccanismo biochimico comune alle fasi G0/G1 e G2/M è alla base dell’ipotesi che esso influenzi l’attività di una chinasi
ciclina dipendente (CDK1), in particolare HSA ne inibisce l’attività. CDK1 è un enzima necessario per la cellula nell’ingresso nella fase mitotica, nella progressione in G1 e
nella transizione G1/S.119
La miscela di 9-HSA e 10-HSA può avere un effetto citostatico o citotossico a seconda delle linee cellulari tumorali alle quali è somministrata.119
Inoltre, la somministrazione separata di 9-HSA e 10-HSA in cellule HT29 ha mostrato che i due isomeri hanno effetti diversi. Entrambi provocano un blocco in fase G0/G1, il
9-HSA genera un blocco più importante rispetto al 10-HSA, inoltre l’isomero 9 porta ad apoptosi mentre il 10-HSA a necrosi. Il forte blocco in G0/G1 è riconducibile
all’espressione, indotta da 9-HSA, della proteina p21WAF1
, una proteina che regola in modo negativo il ciclo cellulare. L’espressione di p21WAF1 è generalmente indotta da p53, una proteina in grado di arrestare temporaneamente il ciclo cellulare o indurre apoptosi. L’espressione di p21WAF1 indotta da 9-HSA è indipendente da p53.120 Inoltre è stato dimostrato che 9-HSA necessita di p21WAF1 per esercitare la sua funzione di controllo della crescita cellulare.120 L’espressione della proteina p21WAF1 è parzialmente regolata dall’acetilazione istonica della zona di cromatina associata al gene p21WAF1
. Calonghi et al.121 hanno ipotizzato che il bersaglio di 9-HSA sia l’enzima istone deacetilasi 1 (HDAC1), il quale viene inibito con conseguente iperacetilazione degli istoni, e che il meccanismo di azione sia simile a quello di classici inibitori delle istone deacetilasi (HDACi), come alcuni acidi idrossamici. Da studi in vitro122 è emerso che la somministrazione di una miscela racemica di (R)-9-HSA e (S)-9-HSA ha un effetto antiproliferativo sulle cellule HT29 grazie all’interazione di 9-HSA con il sito catalitico di HDAC1 (Fig. 18) e conseguente mancata formazione del complesso HDAC1/ciclina
31
D1. L’interazione con HDAC1 è energicamente differente per i due enantiomeri di 9-HSA, in particolare l’energia libera di legame stimata per l’enantiomero R è pari a -6.31 kcal/mol mentre quella della forma S è +4.98 kcal/mol. Questa evidenza suggerisce l’importanza della configurazione assoluta nell’interazione tra HDAC1 e substrato.
Figura 18: Elaborazione computazionale dell’interazione tra (R)-9-HSA e il sito attivo
catalitico di HDAC1. In rosso sono mostrati il sito attivo e i residui che si legano allo zinco.121 Le predizioni emerse dagli studi computazionali spinsero i ricercatori a sintetizzare e somministrare separatamente i due enantiomeri di 9-HSA. Parolin et al.123 hanno studiato gli effetti della configurazione del centro stereogenico di 9-HSA sull’attività inibitoria delle HDACs ed hanno riscontrato che quella dell’enantiomero R è maggiore rispetto all’S. Gli stessi studi hanno dimostrato che entrambi gli enantiomeri causano una simile acetilazione dell’istone H4 e provocano un blocco nella fase G0/G1, inoltre la
forma R ha mostrato un effetto del 25% maggiore rispetto alle cellule di controllo mentre la forma S solo del 16%.
32
CAPITOLO 2
Scopo della tesi
Lo scopo del presente lavoro di tesi è la sintesi di (R)-9-HSA in forma otticamente pura, la sua veicolazione grazie a nanoparticelle proteiche di cheratina e la valutazione dell’attività antiproliferativa nei confronti delle cellule di adenocarcinoma umano del colon (HT29). La sintesi di (R)-9-HSA otticamente puro è stata effettuata attingendo al
pool chirale naturale presente nell’olio dei semi di Dimorphotheca sinuata L.. L’acido
grasso ottenuto è stato caricato su nanoparticelle di cheratina e albumina, tramite interazioni idrofobiche, allo scopo di renderlo veicolabile in ambiente acquoso, proteggerlo dai processi di degradazione e consentirne l’accumulo nelle cellule tumorali grazie all’effetto Enhanced Permeability and Retention (EPR). Le nanoparticelle ottenute sono state caratterizzate dal punto di vista morfologico (forma e dimensioni), della polidispersità, della stabilità termica e del loading di principio attivo.
Inoltre il rilascio di (R)-9-HSA nel tempo, e a diversi pH, è stato analizzato mediante risonanza magnetica nucleare al protone, in presenza di uno standard interno.
L’attività antiproliferativa delle nanoparticelle caricate con (R)-9-HSA è stata valutata sulla linea cellulare HT29, siccome è su questa linea cellulare che in passato sono stati studiati il target molecolare e il meccanismo di azione di (R)-9-HSA.
La sintesi e la caratterizzazione delle nanoparticelle è stata svolta presso l’Istituto per la sintesi organica e la fotoreattività (ISOF) del Consiglio Nazionale delle Ricerche, sede di Bologna, sotto la guida della Dott.sse Claudia Ferroni e della Dott.ssa Greta Varchi. Le indagini biologiche sono state condotte dal gruppo di ricerca della Prof.ssa Natalia Calonghi del Dipartimento di Farmacia e Biotecnologie dell’Università di Bologna.
33
CAPITOLO 3
Risultati e discussione
3.1. Sintesi di (R)-9-HSA
Per ottenere l’enantiomero (R)-9-HSA, più attivo sulle linee cellulari HT29, in forma otticamente pura si è attinto al pool chirale naturale, in questo caso rappresentato dai semi della Dimorphotheca sinuata L., una pianta perenne originaria del Sudafrica. Si è scelta questa strategia poiché la riduzione enantioselettiva del precursore chetonico o la risoluzione enzimatica della miscela racemica non sono efficaci a causa della quasi-simmetria della molecola attorno al centro chirale.124
I trigliceridi costituenti l’olio dei semi di Dimorphotheca sinuata L. contengono fino al 70% di acido (S)-(-)-dimorfecolico (acido 9-(S)-idrossi-10(E),12(E)-ottadecanoico) 125 che ha due caratteristiche vantaggiose: la presenza di un gruppo ossidrilico con configurazione S in posizione 9 e la sua abbondanza nei semi di questa pianta, reperibili facilmente in commercio.
Per estrarre l’acido dimorfecolico contenuto nell’olio dei semi di Dimorphotheca
sinuata, questi ultimi sono stati sminuzzati in un macinaspezie per aumentare l’area
interfacciale e successivamente è stata condotta un’estrazione con una miscela cloroformio/metanolo. L’estratto oleoso è stato sottoposto a transmetilazione utilizzando metilato sodico in metanolo per ottenere il metilestere dell’acido dimorfecolico [(S)-dimorfecolato di metile]. Sulla catena alifatica di questo estere sono presenti due doppi legami, in posizione 10 e 12. Questi doppi legami possono essere ridotti per idrogenazione alla pressione di circa 3 bar in presenza di ossido di platino come catalizzatore (catalizzatore di Adams) per ottenere il derivato saturo (R)-9-idrossistearato di metile. Infine l’idrolisi base-catalizzata del metilestere porta all’ottenimento di (R)-9-HSA (acido (R)-9-idrossiottadecanoico) con una purezza enantiomerica superiore al 95%. Nello schema 1 è riportato lo schema di reazione.
34
Schema 1
Tutti gli intermedi e il prodotto finale sono stati purificati e completamente caratterizzati.
La determinazione della purezza enantiomerica è stata effettuata grazie alla derivatizzazione del gruppo ossidrilico del metilestere del 9-HSA con acido (R)-(–)-O-acetilmandelico secondo lo schema 2, che mostra il diastereoisomero ottentuo per derivatizzazione dell’enantiomero con configurazione R.
35
Schema 2
Il triestere ottenuto è stato isolato mediante cromatografia su lastra preparativa, quindi analizzato allo spettrometro NMR Varian Inova 600. Lo spettro 1H NMR risultante, riportato in Fig. 19, presenta due segnali relativi al gruppo metossilico estereo in rapporto circa 95/5, corrispondenti rispettivamente ai diastereoisomeri (R,R) e (R,S). Lo stesso rapporto è stato ottenuto analizzando la miscela grezza di reazione prima della purificazione cromatografica, per verificare l’assenza di arricchimento in uno dei due diastereoisomeri durante la procedura di isolamento della frazione contenente gli stessi.
Figura 19: Espansione dello spettro 1H NMR, nella zona relativa ai segnali del gruppo
metossilico estereo, dei diastereoisomeri ottenuti dalla reazione tra metil 9-idrossistearato preparato da semi di Dimorphotheca sinuata L. e acido (R)-(–)-O-acetilmandelico. I due diastereoisomeri (R,R)/(R,S) sono in rapporto relativo di circa 95/5.
36
3.2. Estrazione della cheratina
L’estrazione della cheratina dalla lana Merino è stata effettuata mediante reazione di solfitolisi, grazie all’aggiunta di ioni metabisolfito (S2O5--) e urea. Durante la reazione i
legami disolfuro (WSSW) vengono scissi e si formano due prodotti principali, cheratina ridotta (WS-) e cheratina solfonata (WSSO3-).
La soluzione ottenuta dal processo di solfitolisi, è filtrata sotto vuoto, sottoposta a dialisi per 3 giorni contro acqua distillata ed infine liofilizzata per ottenere una polvere di cheratina solfonata pura (Fig. 20), che risulta solubile in ambiente acquoso a pH ≥ 7.
Figura 20: Cheratina solfonata liofilizzata.
3.3. Metodi di preparazione delle nanoparticelle
Le diverse tipologie di nanoparticelle (NPs) sintetizzate sono state ottenute sfruttando diverse metodiche.
Il processo di self-assembly (Fig. 21) si basa sull’anfifilicità della proteina, ovvero la presenza di amminoacidi idrofilici e idrofobici sulla stessa catena polipeptidica. Quando una proteina, come la cheratina, si trova in ambiente acquoso tende a formare delle micelle nelle quali i gruppi idrofilici si dispongono sulla superficie a contatto con l’acqua, mentre i gruppi idrofobici rimangono confinati nel nucleo, dove possono interagire tra loro.
37
Figura 21: Rappresentazione schematica del processo di sintesi di nanoparticelle tramite
self-assembly.
Il processo di desolvatazione (Fig. 22) sfrutta la variazione di solubilità di una proteina, inizialmente disciolta in ambiente acquoso, quando viene effettuata un’aggiunta di un antisolvente, come etanolo o acetone. L’aggiunta dell’agente desolvatante induce dei cambiamenti conformazionali nella proteina e di conseguenza ne provoca l’aggregazione in forma di NPs.
Figura 22: Schema del processo di sintesi di nanoparticelle tramite desolvatazione.
Infine la formazione di NPs proteiche caricate con acido idrossistearico è stata ottenuta mediante un processo di aggregazione, indotta dalle caratteristiche fortemente idrofobiche dell’acido grasso e dalla capacità della proteina di ripiegarsi in strutture micellari, confinando nel nucleo i residui idrofobici.
38
3.4. Nanoparticelle di cheratina
Le NPs di cheratina sono state ottenute per self-assembly e per desolvatazione.
Le NPs per self-assembly sono state sintetizzate partendo da una soluzione di cheratina in tampone carbonato (15 mg/mL) e stabilizzate mediante aggiunta di glutaraldeide (all’8%), un agente reticolante che si lega ai residui ε-amminici delle lisine della proteina.
Le NPs ottenute per desolvatazione sono state sintetizzate partendo da una soluzione di cheratina in tampone carbonato (15 mg/mL) e stabilizzate mediante aggiunta di glutaraldeide (all’8%), liofilizzate previa aggiunta di saccarosio, che agisce da crioprotettore favorendo la risospensione delle NPs.
La resa è stata calcolata secondo l’equazione (1):
𝑅𝑒𝑠𝑎 (%) =
𝑀𝑎𝑠𝑠𝑎 𝑛𝑎𝑛𝑜𝑝𝑎𝑟𝑡𝑖𝑐𝑒𝑙𝑙𝑒𝑀𝑎𝑠𝑠𝑎 𝑐ℎ𝑒𝑟𝑎𝑡𝑖𝑛𝑎 𝑖𝑛𝑖𝑧𝑖𝑎𝑙𝑒
∙ 100 (1)
Le NPs ottenute per desolvatazione hanno un diametro idrodinamico minore rispetto a quelle per self-assembly (126 ± 4 nm vs 153 ± 7 nm) e un indice di polidispersità (PDI) migliore (0.115 ± 0.005 vs 0.31 ± 0.01), mentre le rese dei due metodi sono paragonabili, 89.3% vs 91.7%, (Tab. 1).
Metodo Diametro (nm) PDI Resa% (w/w) Desolvatazione 126 ± 4 0.115 ± 0.005 89.3
Self-assembly 153 ± 7 0.31 ± 0.01 91.7
Tabella 1. Confronto tra i due metodi di sintesi di NPs in termini di dimensioni, PDI e
39
3.5. Nanoparticelle di cheratina (R)-9-HSA, (R)-9-HSA@Ker
Le NPs di cheratina caricate con (R)-9-HSA, (R)-9-HSA@Ker, sono state ottenute per aggregazione.
La cheratina solfonata è solubilizzata in acqua sotto vigorosa agitazione fino all’ottenimento di una soluzione limpida incolore. Successivamente viene effettuata l’aggiunta di una soluzione di (R)-9-HSA sciolto in etanolo. L’analisi al DLS (Dynamic
Light Scattering) mostra che dopo circa 15 minuti la formazione e stabilizzazione delle
nanoparticelle è completa e si procede pertanto alla loro liofilizzazione (Fig. 23).
Le NPs si ottengono mediante un processo puramente fisico, che non implica la formazione di alcun legame covalente con (R)-9-HSA, e sono sufficientemente stabili da non richiedere ulteriori crosslinking con glutaraldeide.
Figura 23: (R)-9-HSA@Ker liofilizzate.
3.5.1. Studio di ottimizzazione delle condizioni operative
Effetto del pH della soluzione acquosa
Il pH della soluzione acquosa di cheratina influenza significativamente il folding della proteina e di conseguenza le dimensioni delle NPs. La proteina è ricca di gruppi amminici e carbossilici che, a seconda del pH, possono conferire una carica netta positiva, neutra o negativa. Inoltre, la cheratina utilizzata presenta dei gruppi solfonici che a pH≥7 sono dissociati e la rendono solubile, oltre che contribuire alla repulsione elettrostatica tra le NPs.
La sintesi di NPs è stata condotta in H2O (pH = 7.0), in tampone fosfato salino (PBS,
pH = 7.4) e in tampone carbonato 0.1 M (pH = 9.2). In H2O sono state ottenute NPs con
40
sono osservati fenomeni di aggregazione. Sulla base di queste evidenze sperimentali la scelta del mezzo è ricaduta sull’H2O.
Concentrazione della soluzione di cheratina
Mantenendo costanti la percentuale di (R)-9-HSA caricato (8% w/w) e la concentrazione della soluzione dell’acido grasso in etanolo (20 mg/mL), le dimensioni delle NPs sono state studiate in funzione della concentrazione della soluzione acquosa di cheratina.
Alla concentrazione di 2 mg/mL di cheratina sono state ottenute NPs di169 ± 3 nm, PDI 0.19 ± 0.01, mentre con una soluzione 1 mg/mL le NPs risultavano più piccole 75 ± 1 nm, PDI 0.30 ± 0.02. Sulla base di questi dati, la concentrazione utilizzata per la sintesi di NPs è stata mantenuta pari a 1 mg/mL.
Effetto di (R)-9-HSA
Partendo da una soluzione acquosa di cheratina (1 mg/mL), gli esperimenti sono stati condotti prima variando la concentrazione della soluzione etanolica di (R)-9-HSA e mantenendo costante la percentuale totale di (R)-9-HSA caricato (10% w/w), in seguito fissando la concentrazione della soluzione di acido (10 mg/mL) e modificando la quantità totale di (R)-9-HSA caricata sulle NPs.
Il risultato è che le dimensioni delle NPs sono strettamente correlate alla concentrazione della soluzione alcolica di (R)-9-HSA, in particolare aumentano proporzionalmente e gradualmente all’aumentare della concentrazione. Utilizzando una concentrazione di 5 mg/mL si sono ottenute NPs con dimensioni 180 ± 2 nm (Tab. 2)
(R)-9-HSA
(mg/mL in EtOH) Diametro (nm) PDI
20 198 ± 4 0,21 ± 0,02
10 185 ± 2 0,19 ± 0,01
5 180 ± 2 0,13 ± 0,01
Tabella 2. Effetto della concentrazione della soluzione di (R)-9-HSA sulle dimensioni