Capitolo 1:
Sintesi dei fosfiti
Per sintetizzare i fosfiti 69-75 (Figura 1) è stato necessario funzionalizzare l’acido deossicolico in modo da avere i due substrati con un solo gruppo ossidrilico libero, rispettivamente alle posizioni 3 e 12, a cui legare i vari bifenilclorofosfiti.
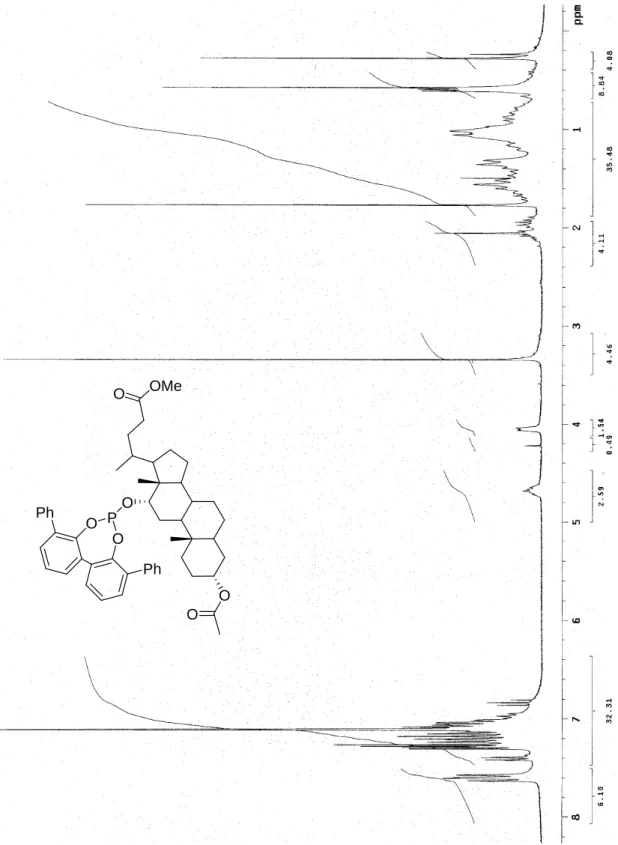
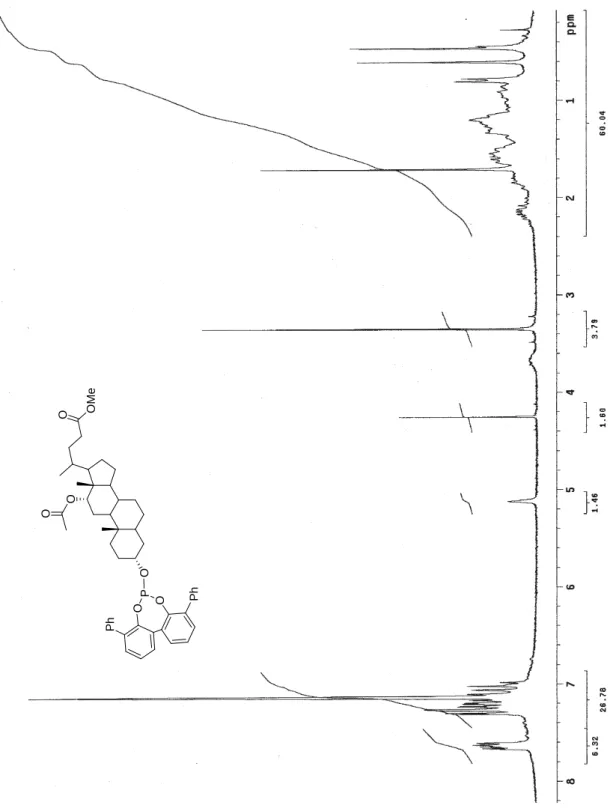
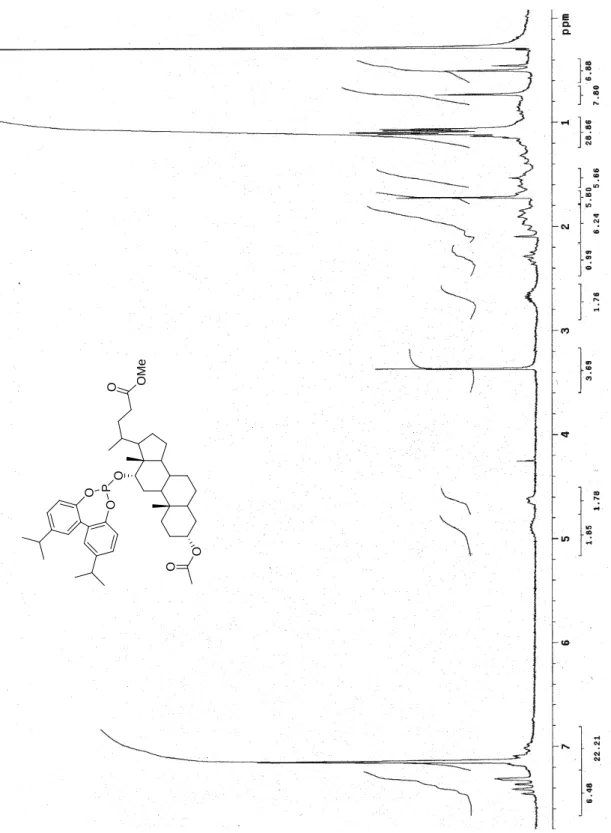
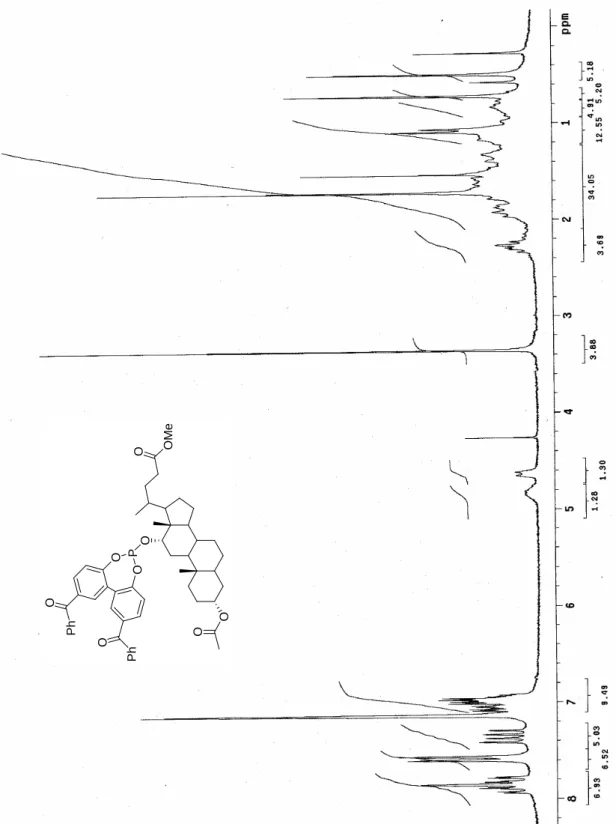
O O O P O O O O P O O O O O O O O O O P O O O O R R O O O O O 69 70 71: R = H 72: R = i-Pr 73: R = Ph Ph O 74: R = R a: R = O b: R = OP O OP 75a-b Figura 1 Fosfiti 69-75.
È stato inoltre necessario sintetizzare il 3,3’-difenilbifenolo, mentre i bifenoli necessari per la sintesi dei fosfiti 72, 73 e 74 sono stati preparati impiegando una procedura sintetica messa a punto nel laboratorio dove è stato effettuato questo lavoro di Tesi1.
1.1
Preparazione dei sistemi biliari protetti
I due substrati stereoidei utilizzati per la formazione dei fosfiti sono stati ottenuti sfruttando la differente reattività degli ossidrili dell’acido deossicolico; infatti l’ossidrile in posizione 3 è equatoriale, mentre quello in posizione 12 è assiale e quindi meno reattivo dell’altro. In ogni caso per preparare i fosfiti 69-75 è stato necessario proteggere preventivamente come metilestere il gruppo carbossilico, che altrimenti reagirebbe con i bifenilclorofosfiti utilizzati per la sintesi dei derivati 69-75 (Schema 1).
OH HO OH O OH O OMe O O 76 77 a
Schema 1 Sintesi di 77. a: AcOMe, p-TsOH.
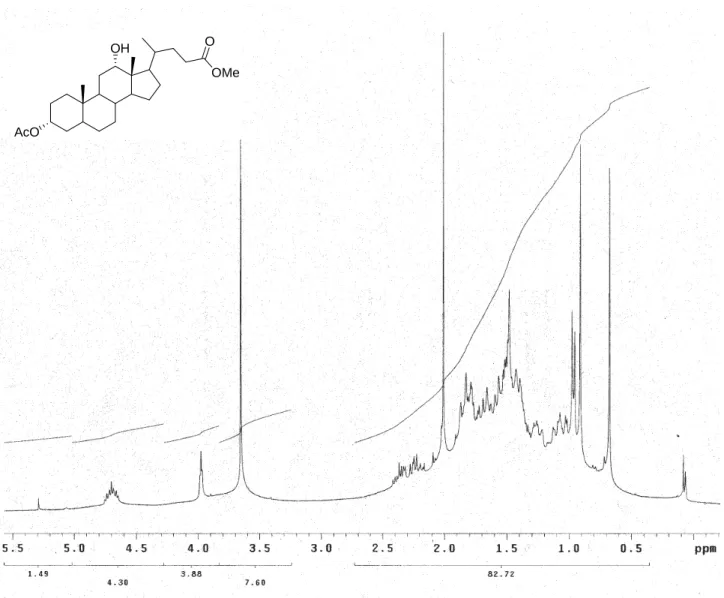
L’esterificazione del gruppo carbossilico e l’acetilazione del gruppo ossidrilico in posizione 3 dell’acido deossicolico per ottenere il derivato 77 si realizzano in un unico stadio, per reazione tra l’acido deossicolico e acetato di metile in presenza di acido p-toluensolfonico ed acqua. In tali condizioni infatti l’ossidrile in 12 non reagisce e il 3-acetildeossicolato di metile 77 si ottiene con una resa del 78% previa purificazione mediante cromatografia su colonna. Lo spettro NMR del prodotto ottenuto (Figura 2) mostra un insieme di segnali compresi tra 1.00-2.40 ppm, attribuibili ai protoni dello scheletro steroideo, tra i quali spicca il singoletto che integra per tre protoni a 2.01 ppm relativo alla risonanza dei protoni metilici del gruppo acetile introdotto in posizione 3. La presenza di un segnale, anch’esso singoletto, integrante per 3 protoni, a 3.66 ppm è dovuta alla risonanza dei protoni del raggruppamento metilestere introdotto in seguito all’esterificazione della funzione acida, mentre i multipletti a 3.98 ppm e 4.70 ppm sono attribuibili, rispettivamente, al protone in 12 e a quello in 3, più deschermato per effetto della presenza del gruppo acetile.
Figura 2 Spettro 1H-NMR (300 MHz, CDCl3) di 77.
Il 12-O-acetilderivato dell’acido deossicolico 79 (Schema 2) non può essere preparato direttamente, infatti, l’ossidrile in tale posizione è assiale e quindi risulta meno reattivo di quello in 3, che è equatoriale, è inevitabile dover prima proteggere quest’ultimo, che poi è possibile deproteggere selettivamente. A tale scopo il derivato 77 è stato sottoposto a reazione di acetilazione dell’ossidrile libero in posizione 12 con anidride acetica, trietilammina e DMAP, ottenendo così l’intermedio 78 con una resa del 92%. Trattando 78 con acido cloridrico in metanolo, si ottiene l’idrolisi selettiva della funzione esterea alla posizione 3 ottenendo il prodotto 79 con resa del 99%. Nello spettro IR è presente una banda molto larga a 3441 cm-1 tipica di una funzione ossidrilica e nello spettro 1H-NMR (Figura 3) si nota lo spostamento del segnale relativo al protone legato al carbonio in 3 a 3.50 ppm in seguito alla deacetilazione.
AcO
OH
OMe O
OH O OMe O O 77 O O OMe O O 78 O HO OMe O 79 O O a b
Schema 2 Sintesi di 79. a: Ac2O, DMAP, Et3N; b: HCl, MeOH.
Figura 3 Spettro 1H-NMR (300 MHz, CDCl3) di 79. HO
OAc
OMe O
1.2
Preparazione dei bifenoli
Per la preparazione dei fosfiti 69, 70, 72, 73 e 74 è stato necessario sintetizzare i bifenoli flessibili 80, 81, 82 e 83 (Figura 4), precursori dei corrispondenti bifenilfosfiti.
OH OH OH OH OH OH Ph Ph Ph O Ph O 81 82 80 OH OH Ph Ph 83 Figura 4 Struttura dei bifenoli flessibili.
I bifenoli 80 e 81 sono stati sintetizzati secondo la stessa procedura sintetica a partire da prodotti commerciali seguendo un metodo di letteratura2 (Schema 3).
OMe R OMe Br R OMe OMe R R OH OH R R a b c R = 2-Ph 84 4-i-Pr 87 8588 86 89 8081
Schema 3 Sintesi di 80 e 81; a: BuLi, TMEDA, Br2; b: BuLi, CuCl2; c: BBr3.
La bromurazione dei reagenti 84 e 87 prevede un’orto-metallazione con BuLi e tetrametiletilendiammina (TMEDA), che, complessando il BuLi, ne esalta le caratteristiche basiche. Il risultante litio derivato è stato trattato con bromo a -78°C, recuperando i prodotti 85 e 88, rispettivamente, dopo estrazione. Tali prodotti non sono stati purificati, ma usati tali e quali per la reazione di coupling che conduce all’ottenimento di 86 e di 89.
Tale coupling è mediato dal CuCl2, previo trattamento con BuLi che genera il derivato arillitio
su cui agisce il rame. Un modo schematico di descrivere l’andamento di questa reazione è rappresentato nello Schema 4.
Br R BuLi Li R Li R + CuCl2 (II) OMe OMe OMe OMe OMe R R
Schema 4 Coupling promosso dal rame.
Questa reazione è stata effettuata a -78°C e i due prodotti sono stati recuperati puri dopo cromatografia flash. Nello spettro protonico del prodotto 86 è presente un singoletto a 3.20 ppm generato dalla risonanza dei protoni del gruppo metossile e un multipletto a 7.20-7.70 ppm dovuto alla risonanza dei protoni aromatici.
La deprotezione dei gruppi metossilici a generare gruppi ossidrilici è stata effettuata con BBr3
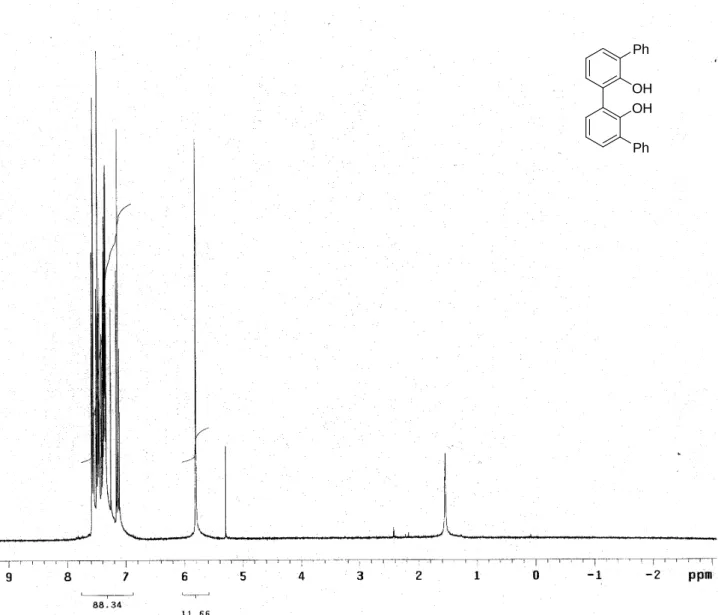
a 0°C; i bifenoli sono stati recuperati puri dopo cristallizzazione. Il prodotto 80 è stato ottenuto con una resa dell’ 80% e il suo spettro protonico è riportato in Figura 5. Il prodotto 81, che era già stato sintetizzato in precedenza seguendo la procedura appena riportata,1 mostrava caratteristiche identiche a quelle già riportate. 1
Figura 5 Spettro 1H-NMR (300 MHz, CDCl3) di 80.
Per la sintesi del diolo 82 è stata adottata una procedura diversa:1 il gruppo benzoile è stato introdotto nelle posizioni 5,5’ mediante acilazione di Friedel-Crafts sul 2,2’-bifenolo 90, prodotto commerciale (Schema 5).
OH OH OH OH Ph O Ph O 82 a 90
Schema 5 Sintesi di 82; a: AlCl3, cloruro di benzoile, DMF.
OH OH Ph
È stata scelta questa via di sintesi in quanto la presenza dei due gruppi ossidrilici alle posizioni 2,2’ del sistema bifenilico attiva le posizioni 5,5’ e 3,3’ alla sostituzione elettrofila. Di queste, le posizioni 5,5’ sono le più reattive in quanto meno ingombrate stericamente. La reazione è stata effettuata impiegando un forte eccesso di AlCl3, come acido di Lewis, e DMF
come solvente mantenendo la miscela a 85°C per 5 ore. 1 Il prodotto 82 è stato recuperato dopo idrolisi e purificazione mediante cromatografia flash del grezzo con resa del 27%.
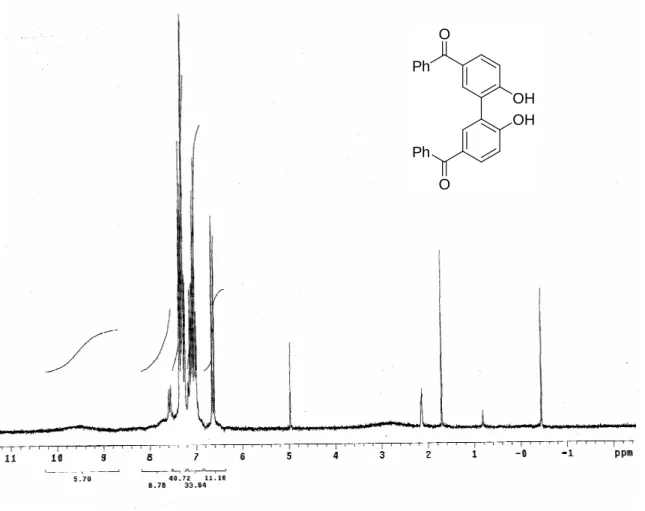
Lo spettro 1H-NMR (Figura 6) mostra a 9.50 ppm un picco molto largo attribuibile ai protoni ossidrilici, a 6.61 ppm un doppietto dovuto alla risonanza dei protoni nelle posizioni 3,3’, che conferma l’avvenuta sostituzione alle posizioni 5,5’ e nella zona tra 6.99 e 7.36 ppm due multipletti generati dalla risonanza degli altri protoni.
Figura 6 Spettro 1H-NMR (300 MHz, CDCl 3) di 82. OH OH Ph O Ph O
Per quanto riguarda il bifenolo 83 è stata seguita una procedura riportata nello Schema 6 messa a punto in precedenza1 all’interno del laboratorio dove è stato svolto questo lavoro di Tesi. OMOM Ph OMOM Ph OH Br OH Br 93 91 OH OH OMOM Br OMOM Br 92 OH Ph OH Ph 83 a b c d 90
Schema 6 Sintesi di 83. a: Br2, CH2Cl2; b: NaH, THF, MOMCl;
c: Pd(PPh3)4, PhB(OH)2, DME; d: HCl, MeOH.
La bromurazione di 90, facilitata in queste posizioni dalla presenza di un gruppo orto-para orientante come l’OH, il quale al contempo, tuttavia, rende problematica la regioselettività della sostituzione, è stata effettuata aggiungendo lentamente il bromo ad una soluzione di bifenolo in diclorometano. Secondo una procedura di letteratura, impiegata per la preparazione del 6,6’-dibromo-binaftolo3, la reazione è stata condotta a bassa temperatura (-78°C) per facilitare la sostituzione alla posizione para, stericamente meno impedita di quella orto. Il derivato 91 è stato quindi utilizzato per la sintesi del 5,5’-difenilbifenolo, che prevede, come stadio chiave, la formazione del legame C-C tra due atomi di carbonio arilici. Per sintetizzare 83 è stato necessario proteggere i due gruppi ossidrilici di 91, i quali altrimenti, nelle condizioni di formazione del legame C-C potrebbero dar luogo alla formazione di prodotti secondari indesiderati. Le due funzioni alcoliche sono state pertanto protette come metossimetossili, in quanto tale gruppo protettivo è di facile introduzione, di non eccessivo ingombro sterico, cosa che agevola la contemporanea protezione di entrambe le funzioni fenoliche, e di facile rimozione. La protezione è stata realizzata aggiungendo ad una soluzione tetraidrofuranica di 91 e idruro di sodio un eccesso di metossimetil-cloruro4 a temperatura
ambiente. Dopo ricristallizzazione da diclorometano il prodotto è stato ottenuto con una resa del 60%.
A questo punto è quindi possibile procedere con la reazione di coupling. Per la formazione di legami C-C tra due gruppi arilici vengono abitualmente utilizzate la reazione di Suzuki,5 coinvolgente acidi arilboronici, o la reazione di Negishi,6 nella quale si adoperano arilzincoalogenuri.
L’introduzione del gruppo fenile è stata effettuata mediante coupling di Suzuki, utilizzando come reagente organometallico l’acido fenilboronico (prodotto commerciale) e come catalizzatore Pd(PPh3)4, che rende possibile eludere completamente una delle principali
reazioni secondarie che generalmente affliggono questo tipo di coupling, ossia lo scambio tra i fenili delle fosfine del legante e il sostituente arilico dell’organoboro, una reazione secondaria che è spesso responsabile della formazione di quantità significative di sottoprodotti. La reazione è stata condotta in dimetossietano ed è stata utilizzata una soluzione 1M di bicarbonato di sodio, opportunamente degasato per evitare la decomposizione del catalizzatore. Tale base ha la funzione di sostituirsi all’alogenuro nel complesso di Pd(II) che si forma in seguito all’addizione ossidativa del Pd(PPh3)4 a 92, ed è inoltre necessaria per
quaternizzare l’acido fenilboronico, aumentando le caratteristiche nucleofile dell’atomo di boro e rendendolo pertanto più reattivo nello stadio di transmetallazione.
La miscela è stata mantenuta in agitazione a temperatura ambiente per 70 ore e successivamente a riflusso per 24 ore, al termine delle quali si è proceduto a filtrare su celite il nero di palladio formatosi in seguito al riscaldamento. Dopo purificazione tramite cromatografia su colonna, 93 è stato ottenuto con resa del 93%.
L’ultimo stadio della sintesi prevede la deprotezione delle funzioni ossidriliche mediante idrolisi acida delle funzionalità acetaliche. Il composto 93 è stato pertanto disciolto in metanolo e trattato con acido cloridrico concentrato a temperatura ambiente. Al termine della reazione l’eccesso di acido è stato neutralizzato con una soluzione di bicarbonato di sodio e 83 è stato ottenuto puro con resa del 93%.
1.3
Preparazione dei fosfiti
Per preparare i composti 69-75 è stato necessario preparare in primo luogo i rispettivi bifenilclorofosfiti che sono stati impiegati, senza essere isolati, nella successiva reazione con i derivati steroidei 77 e 79 secondo una procedura riportata in letteratura da Pfaltz e collaboratori7 leggermente modificata (Schema 7).
OH OH O O R R1 R1 R + R2OH R R1 R1 R P OR2 PCl3 Et3N DMAP 69-75
Schema 7 Sintesi dei fosfiti 69-75.
Il bifenilclorofosfito è stato preparato aggiungendo lentamente ad una soluzione mantenuta a temperatura ambiente (o a -60°C per i fosfiti 71 e 75) di PCl3 e Et3N, una soluzione del
bifenolo in toluene (o THF per il fosfito 74).
Con l’evolversi della reazione si ha formazione di acido cloridrico, il quale viene neutralizzato dalla base formando cloruro di trietilammonio, che è insolubile nell’ambiente di reazione. Si osserva pertanto la formazione di un precipitato che è stato rimosso alla fine della reazione mediante filtrazione in atmosfera inerte. Il filtrato, contenente il bifenilclorofosfito, è stato aggiunto mediante lento gocciolamento ad una soluzione toluenica (o tetraidrofuranica per il fosfito 74) di Et3N in forte eccesso e DMAP in quantità stechiometrica, mantenuta a
-60°C, a cui è stato infine aggiunto il derivato biliare. Dopo aver lasciato la miscela sotto
R R1 R2OH Fosfito Ph H 77 69 Ph H 79 70 H H 77 71 H iPr 77 72 H Ph 77 73 H PhC=O 77 74 H naftile 77 75
agitazione a temperatura ambiente per 24 ore, il prodotto grezzo è stato recuperato, dopo filtrazione dei sali di ammonio ed evaporazione del solvente, e sottoposto a purificazione mediante cromatografia flash. È importante sottolineare come sia fondamentale, nella fase di purificazione, impiegare una miscela eluente che consenta un’eluizione rapida del prodotto; infatti i fosfiti sono composti piuttosto delicati, che subiscono un’idrolisi ossidativa (il PIII passa a PV) anche in presenza di tracce di acidità, perciò una permanenza prolungata a contatto con il gel di silice ne causa una parziale degradazione.
Le analisi NMR dei fosfiti sono state effettuate in benzene deuterato, anziché in cloroformio deuterato perché i fosfiti non tollerano neanche le tracce di acidità presenti in quest’ultimo. Dagli spettri protonici (Figura 7 - Figura 10) si nota lo spostamento a campi più bassi dei segnali dovuti alla risonanza dei protoni legati agli atomi di carbonio sostituiti con il gruppo fosfito; infatti mentre il segnale di tali protoni nei derivati biliari aventi l’ossidrile libero si trova a chemical shift che variano da 3.97 ppm per 77 a 3.50 ppm per 79, nei prodotti ottenuti la derivatizzazione causa un effetto di deschermo su di essi con conseguente spostamento dei relativi segnali a valori compresi tra 3.98 ppm del CH in 3 di 70 e 4.68 ppm del CH in 12 di 72.
La zona dei segnali stereoidei, tra 0 e 2.50 ppm, rimane sostanzialmente inalterata, come anche la zona aromatica tra 7 e 8 ppm.
Negli spettri 13C-NMR è interessante notare come sia facile distinguere gli atomi di carbonio direttamente legati al sostituente fosfito: i loro segnali infatti si presentano sotto forma di doppietti, in quanto soggetti all’accoppiamento con l’atomo di fosforo. In virtù di ciò, nello spettro di 69, ad esempio, è possibile identificare nella zona degli atomi di carbonio sp3 un doppietto a 76.5 ppm derivante dal C-12 e nella zona dei carboni aromatici due doppietti a 147.1 e 146.7 ppm del C-1 e del C-1’.
Figura 7 Spettro 1H-NMR (300 MHz, benzene-d6) di 69. O O OMe O O P O O Ph Ph
Figura 8 Spettro 1H-NMR (300 MHz, benzene-d6) di 70. O O M e O P O O P h P h O O
Figura 9 Spettro 1H-NMR (300 MHz, CDCl3) di 72. O O O M e O O P O O
Figura 10 Spettro 1H-NMR (300 MHz, benzene-d6) di 74. O O O M e O O P O O P h O P h O
BIBLIOGRAFIA
1 (a) Facchetti, S.; Losi, D.; Iuliano, A. Tetrahedron: Asymmetry 2006, 17, 2993-3003. (b) Iuliano, A.; Losi, D.;
Facchetti, S. J. Org. Chem. 2007, 72, 8472-8477.
2 Kadyrov, R.; Heller, D.; Selke, R. Tetrahedron: Asymmetry 1998, 9, 329-340. 3 Sogah, G.D.Y.; Cram, D.J. J. Am. Chem. Soc. 1979, 118, 6841.
4
Alexakis, A.; Polet, D.; Rosset, S.; March, S. J. Org. Chem. 2004, 69, 5660-5667.
5
Miyaura, N.; Yanagi, T.; Suzuki, A. Synth. Commun. 1981, 11, 513.
6 Negishi, E.; King, A.O.; O/kukado, N. J. Org. Chem. 1977, 42, 1821. 7 Escher, I.H.; Pfaltz, A. Tetrahedron 2000, 56, 2879-2888.