INTRODUZIONE
L’Embryo Transfer (=ET) è una tecnica che consiste nel prelevare uno o più embrioni da una cavalla donatrice, così da poter essere trasferiti in un’altra cavalla, chiamata ricevente.
In passato sia il recupero che il trasferimento degli embrioni veniva effettuato tramite laparotomia. Il recupero a 2-4 giorni dall’ovulazione tramite cateterizzazione e lavaggio dell’ovidutto (Allen e Rowson, 1975; Betteridge, 1975); mentre per il trasferimento l’embrione veniva inoculato nel lume uterino da una piccola incisione fatta in un corno precedentemente esteriorizzato (McKinnon e Squires, 1988). Al giorno d’oggi il recupero degli embrioni viene effettuato tra il 6º e l’8º giorno, quando l’embrione è già presente in utero, per mezzo di un lavaggio transcervicale (Carnevale 2003) come anche il trasferimento in quanto le percentuali di successo ormai eguagliano quelle ottenute dalla tecnica chirurgica (Squires, 2004).
Nel cavallo il tasso medio di recupero embrionale è circa del 50% e i tassi di gravidanza nelle riceventi, dopo trasferimento, sono del 75%. Quindi, nel migliore dei casi si avrà il 35% di gravidanze a termine per ogni ciclo (Panzani, 2004). Considerando anche che l’ET risulta essere una pratica onerosa per l’allevatore (Squires 1999), oggi questa tecnica viene principalmente utilizzata in quelle cavalle ad elevato valore economico e sportivo.
I vantaggi di questa pratica sono: (a) ottenere puledri da cavalle anziane o problematiche, (b) incrementare il numero di nati/anno da cavalle geneticamente importanti, (c) avere puledri da cavalle di 2 anni, (d) ottenere puledri da cavalle che hanno partorito tardi durante la stagione riproduttiva (Squires, 1993).
La cavalla ricevente è quell’animale che farà da madre biologica all’embrione. Questo comporta che la sua valutazione e successiva scelta è un momento cardine per la riuscita dei programmi di ET. Appare dunque importante eseguire sia un’accurata anamnesi sia un accurato esame obbiettivo generale (EOG) dell’animale e particolare (EOP) dell’apparato genitale femminile. Per fare questo, oltre alla visita clinica e morfologica delle fattrici, possiamo utilizzare alcune analisi strumentali e di laboratorio (citologico, batteriologico e biopsia uterina) (Squires, 1993; Squires et al., 1999; Blanchard et al., 2003). Da alcuni decenni, nella donna, viene utilizzato con frequenza, nella pratica clinica ecologica, l’ecodoppler per valutate le condizioni fisiologiche e patologiche dell’utero, così da fornire dei dati più precisi nel caso si voglia affrontare programmi di fecondazione assistita e quindi di ET (Catizarone et al., 1992).
Il sonogramma Doppler di un vaso rappresenta lo scorrimento del flusso sanguigno nel vaso stesso. I globuli rossi, movendosi con velocità differenti, generano uno spettro di shift di frequenza, che corrisponde alla distribuzione delle velocità delle emazie nel vaso. Lo scopo dell’esame Doppler è quello di ottenere informazioni immediate riguardo la perfusione dell’organo irrorato dall’arteria in studio (La Torre et al., 2006).
Anche in campo veterinario, negli ultimi tre decenni, i ricercatori hanno rivolto l’attenzione all’esame flussimetrico delle arterie dell’apparato riproduttore. In particolare, la valutazione del flusso dell’arteria uterina ha permesso di capire quali sono le variazioni fisiologiche della perfusione sanguigna durante il normale ciclo estrale e in gravidanza (Bollwein et al., 1998; Bollwein et al., 2002). In alcuni casi è stato anche visto le variazioni che si possono avere nel corso di patologie uterine (Uta Blaich et al., 1999).
Gli indici flussimetrici maggiormente utilizzati durante l’esame doppler dell’arteria uterina sono la Pulsatilità (PI) e la Resistenza (RI). Essendo in relazione con le resistenze periferiche, maggiore è il valore di questi indici, minore è la perfusione sanguigna dell’organo (Ginther et al. 2004). Allo stato dell’arte non esistono lavori sulla selezione delle riceventi di embrioni tramite la valutazione della flussimetria uterina.
Cap. 1
ANATOMIA E FISIOLOGIA RIPRODUTTIVA DELLA
CAVALLA
1.1 Caratteri generali
L’attività riproduttiva della cavalla è regolata da vari fattori, primo fra tutti il fotoperiodo, seguito dallo stato nutritivo e dalla temperatura ambientale (Daels et al., 1993). Alle nostre latitudini, la ciclicità si ha da aprile ad ottobre. Per questo motivo la cavalla è definita come un animale poliestrale stagionale a giorni lunghi. In alcuni casi l’estro può perdurare anche in inverno (Daels et al., 1993). In generale possiamo suddividere l’anno in quattro differenti periodi, secondo il momento fisiologico della cavalla:
1. anestro
2. transizione primaverile 3. stagione riproduttiva 4. transizione autunnale
L’anestro è definito come il periodo (da novembre a gennaio) compreso tra l’ultima ovulazione della stagione riproduttiva e la prima della stagione successiva, in cui le cavalle non accettano lo stallone o sono indifferenti ad esso (questo comportamento è dovuto a bassi livelli di progesterone e all’assenza di estrogeni circolanti). L’asse endocrino è essenzialmente non funzionante e la concentrazione ematica di gonadotropine è ridotta. Come conseguenza l’attività
ovarica è minima e la follicologenesi si arresta. Ecograficamente le ovaie appaiono piccole e si possono osservare pochi follicoli non più grandi di 10 o 15mm (Sharp et al., 1993).
La transizione primaverile è il momento fisiologico, successivo all’anestro, in cui si riscontra crescita e regressione follicolare senza ovulazione. Si osserva principalmente nei mesi di febbraio e marzo ed è dovuto ad una concatenazione endocrinologia d’eventi (Sharp et al., 1993).
La concentrazione ematica di GnRH (Gonadotropin Release Hormone = Ormone gonadotropo) aumenta, determinando l’aumento di FSH (Follicle stimulating hormone = ormone di stimolo del follicolo) ma non di LH (Luteinizing hormone = ormone luteinizzante). Questo sembra dovuto ad un’insufficiente concentrazione di estrogeni, i quali non sono in grado di contribuire significativamente al feed-back positivo sull’ipotalamo e quindi all’aumento della concentrazione e frequenza del GnRH, responsabile di una competente secrezione di LH. Durante la transizione la progesteronemia rimane a livelli basali. Questo spiega il comportamento sessuale delle fattrici verso lo stallone. Gli estrogeni determinano accettazione prolungata del maschio e il basso livello di progesterone, il mancato rifiuto (Sharp et al., 1993; Ginther, 1995;).
La stagione riproduttiva, che prende inizio con la prima ovulazione dell’anno, è caratterizzata dal susseguirsi di modificazioni cicliche dell’apparato genitale femminile e del comportamento dell’animale. Durante questo periodo si susseguono fasi in cui la cavalla accetta il maschio rendendo possibile l’accoppiamento (fase follicolare) e momenti di indifferenza sessuale o non accettazione del maschio (fase luteale o luteinica)(Aguggini et al., 1998).
La fase follicolare del ciclo estrale è caratterizzata da crescita follicolare e produzione di estrogeni. La fase luteinica, caratterizzata dalla secrezione di progesterone, prende inizio con l’ovulazione e termina con la lisi del corpo luteo (Daels et al., 1993; Aguggini et al., 1998).
La transizione autunnale, come la transizione primaverile, è caratterizzata da ondate follicolari senza ovulazione, dovute probabilmente ad una scarsa concentrazione di LH. Durante l’autunno le ore di buio prevalgono e questo comporta il ripristino dell’azione inibitrice della melatonina sull’ipotalamo, fatto che determina una diminuzione del rilascio di GnRH. Questa fase termina con l’anestro vero e proprio (Sharp, 1993).
1.2 Anatomia dell’apparato femminile
L’apparato genitale femminile è suddiviso in tre sezioni (Figura 1.1): 1. la sezione ghiandolare, costituita dalle ovaie;
2. la sezione tubulare, formata dalle vie genitali propriamente dette, presenta distretti diversi tra loro, sia per funzione sia per conformazione; è costituita dalle tube uterine, l’utero e la vagina; 3. il seno-urogenitale, composto dal vestibolo vaginale e dalla
vulva.
Figura 1.1: apparato genitale della cavalla, veduta ventrale dopo isolamento e distensione (da Barone, vol. 4).
Ovaio
L’ovaio è un organo pari, di colore bianco-madreperlaceo, di consistenza solida e poco elastica, di forma ellissoidale. Si trova situato nella regione lombare, appeso all’estremità craniale del legamento largo (mesovario).
Rappresenta la gonade femminile ed esplica funzione gametogena e (sotto il controllo ipofisario) endocrina.
Ha un peso medio di 60g (20-170), la lunghezza media è 65 mm e vi sono circa 35 mm tra la faccia mediale e quella laterale.
Le ovaie generalmente sono situate a livello della 4a-5a vertebra lombare, ad una distanza variabile di 5-15 cm dal polo caudale dei reni e a 4-5 cm dall’estremità delle corna uterine. Il peritoneo le avvolge totalmente ad eccezione della fossetta d’ovulazione, zona in cui avviene l’ovulazione, situata nel margine libero dell’ovaio in posizione ventro-craniale. Sono rivestite da uno strato di tessuto connettivo ricco di fibre collagene e povero di cellule, chiamato Tunica albuginea. Nella cavalla questa assume una reale importanza funzionale, poiché non permette lo scoppio follicolare nei punti in cui è presente.
L’ovaio può essere diviso in due zone:
la zona vascolare: rappresenta la parte esterna (a differenza delle altre specie che è centrale) ed accoglie i vasi principali dell’organo, che le conferiscono un aspetto spongioso;
la zona parenchimatosa: è centrale e costituisce, dalla pubertà, la quasi totalità della gonade. È formata da tessuto plastico in grado di adattarsi alle modificazioni delle strutture che in esso si formano. I vasi sono numerosi e formano una ricca rete capillare attorno ai follicoli ovarici.
I follicoli maturi possono raggiungere un diametro di 3-5 cm e sono apprezzabili sulla superficie dell’ovaia, la quale è deformata e sollevata. Perché avvenga l’ovulazione, il follicolo deve prendere contatto anche con la fossetta ovulatoria formando lo stigma d’ovulazione.
Tuba uterina
La tuba uterina o salpinge costituisce la parte iniziale delle vie genitali femminili. È un condotto pari, stretto, tubulare lungo circa 20-30 cm e un diametro di 5-9 mm a livello dell’ampolla e 2-3 mm vicino all’utero, appesa alla parete addominale dal mesosalpinge. Riceve gli oociti liberati dall’ovaio, è sede della fecondazione e assicura il trasferimenti dello zigote sino all’utero. E’ suddiviso in quattro segmenti: infundibolo, ampolla, istmo, porzione tubarica (Barone, 1994).
La mucosa della salpinge è rivestita da un epitelio cilindrico costituito di cellule secernenti e di cellule cigliate. L’attività delle ciglia e la contrattilità della parete tubarica consentono, da una parte, la progressione degli spermatozoi dall’utero, dell’altra la progressione dell’oocita verso l’ampolla. La fecondazione, infatti, avviene a livello della giunzione istmo-ampollare (Aguggini et al., 1998).
Utero
L’utero è un viscere cavo appeso alla regione lombare mediante un robusto meso, il legamento largo. È costituito da una mucosa ricca di ghiandole e da una potente tonaca muscolare (Barone, 1994).
Nella cavalla l’utero è bicorne ed è lungo circa 40 cm, suddiviso in: collo, 5-8 cm
corpo, 14-24 cm 2 corna, 12-20 cm
Il corpo è largo 6-8 cm mentre le corna 5-6 cm. Le corna sono cilindroidi, un po’ convesse ventralmente e concave nel loro margine dorsale mosometriale. Il loro apice è quasi emisferico e nella parte centrale da attacco alla tube uterina. Il collo è appena segnato in superficie da un leggero restringimento ma è facilmente palpabile a causa della sua buona consistenza. Possiede una spessa parete e delimita un canale cervicale rettilineo, lungo 5-8 cm. Il corpo è costituito da una cavità virtuale ampia e facilmente dilatabile. E’ rivestito da una mucosa giallo-ocra o rossastra. L’endometrio è caratterizzato dalla presenza di numerose cripte, ciascuna delle quali riceve lo sbocco di numerose ghiandole (Barone, 1994).
Vagina
Deriva dalla parte più caudale dei dotti paramesonefrici ed è un organo impari e mediano, situato interamente in cavità pelvica. È provvista di pareti molli e più sottili di quelle dell’utero, la vagina è un condotto cilindroide a cavità virtuale. È lunga in media 20-25 cm con un diametro trasversale di 6-9 cm e ventro-dorsale 3-4 cm. La mucosa è finemente pieghettata in senso longitudinale ed elastica (Barone, 1994).
È connessa carnalmente alla cervice (Aguggini et al., 1998) attraverso l’ostio cervicale esterno. Questo è portato sulla sommità di una porzione vaginale che sporge 3-4 cm, circoscritta da un fornice vaginale il quale forma un fondo ceco anulare. Le pieghe del canale cervicale si riflettono sul versante vaginale di questa salienza, diventando più numerose. Quest’insieme è comunemente chiamato “fiore sbocciato” (Barone, 1994).
Vestibolo vaginale
Nei periodi di riposo è un condotto lungo 10-15 cm e alto 4-6 cm. Ha una mucosa giallo-ocra che forma delle pieghe longitudinali. Cranialmente continua con la vagina, mentre caudalmente è in rapporto con la vulva (Barone, 1994).
Deriva dal seno uro-genitale è un organo impari muscolo membranoso. Nel pavimento sbocca l’uretra con il meato urinario. Il vestibolo rappresenta quindi la parte comune tra apparato genitale e quello urinario.
Vulva e clitoride
La vulva è la parte esterna dell’apparato genitale femminile. È costituita da due labbra che delimitano la rima vulvare mediana e normalmente chiusa. Dalla loro unione originano la commessura dorsale (situata a breve distanza dall’ano) e la commessura ventrale che accoglie il clitoride.
Il clitoride è l’equivalente rudimentale del pene, ma è sprovvisto della parte corrispondente dell’uretra. È lungo circa 7-9 cm.
Circolazione arteriosa uterina
L’utero è irrorato dall’arteria uterina, che rappresenta il vaso principale. A differenza delle altre specie, nella cavalla deriva dall’arteria iliaca esterna (Barone, 1994). Questa nasce molto vicina all’arteria iliaca interna, sotto la penultima vertebra lombare. Nella sua parte iniziale stacca l’arteria uterina che si impegna subito nel legamento largo. L’arteria uterina è relativamente poco flessuosa al di fuori della gravidanza ed è sprovvista di anastomosi di una certa importanza con i rami uterini delle arterie ovarica e vaginale. Una volta raggiunto la metà del legamento largo, stacca un ramo per la parte media del
corno uterino e, alcuni centimetri più lontano, si divide in due branche, una per la parte caudale delle corno e l’altra per il corpo e il collo dell’utero. Quest’ultimo inoltre, è raggiunto da una branca del ramo uterino dell’arteria vaginale. Ogni ramo arterioso uterino fornisce parecchie divisioni alla parete uterina, senza presentare anastomosi di qualche importanza con i rami vicini (Figura 1.2 e Figura 1.3)(Barone, 1993; Barone, 1994).
1.3 Fisiologia riproduttiva della cavalla
PubertàLa pubertà è il momento in cui l’animale acquisisce la capacità di riprodursi. Generalmente si raggiunge prima del completo sviluppo somatico ed è più precoce nelle femmine che nei maschi. Questa è influenzata in maggior misura dal peso corporeo e dallo stato nutrizionale rispetto all’età dell’animale (ad eccezione del suino). In media gli animali domestici raggiungono la pubertà al 40-70% del peso corporeo, secondo la specie o razza. In ogni caso, negli equini si ha intorno a 12-24 mesi d’età (Squires, 1993b; Aguggini et al., 1998). E’ stato visto che con un adeguato razionamento alimentare e con un giusto apporto di microelementi (in particolare la vit. A) il raggiungimento della maturità sessuale è anticipato (Aguggini et al., 1998).
Un altro elemento che può influenzare la pubertà è il fotoperiodo. Camillo e collaboratori (1995), hanno visto che in cavalle nate in primavera l’asse endocrino raggiungeva la maturità a circa 12 mesi; mentre i puledri nati in autunno attenderebbero la primavera successiva (circa 18 mesi) per iniziare l’attività riproduttiva (Camillo et al., 1995).
Due sono le teorie sul conseguimento della pubertà: 1) Almeno un elemento dell’asse endocrino è immaturo.
2) L’asse endocrino matura prima della pubertà, ma esiste un’inibizione ancora da rimuovere (gonadostasi).
La seconda ipotesi è quella più accreditata. Prima della pubertà gli estrogeni determinano un feed-back negativo sull’ipotalamo, il quale non potrà determinare la secrezione ipofisaria di FSH e LH. Ad un certo punto, il feed-back negativo degli estrogeni viene meno (grazie
ad una down-regulation recettoriale) e i follicoli ovarici possono iniziare a crescere e a secernere più estrogeni. La concentrazione ematica degli ormoni sessuali ipofisari aumenta. I picchi di LH si fanno più frequenti (circa uno ogni ora) e i follicoli ovarici possono completare lo sviluppo, così da riuscire a secernere una quantità tale d’estrogeni da avere un feed-back positivo a livello ipotalamico, determinando il picco preovulatorio d’ormone luteinizzante e la deiscenza follicolare (Squires, 1993b).
Il ciclo estrale
Raggiunta la pubertà, vale a dire quando le ovaie sono in grado di rispondere efficacemente alla stimolazione delle gonadotropone ipofisarie, iniziano i cicli estrali. Il ciclo estrale è definito come quel periodo che va dalla prima ovulazione a quella successiva e può essere diviso in due fasi: estro e diestro (Squires, 1993b; Blanchard et al., 2003).
L’intero periodo tra le due ovulazioni dura mediamente 21-22 giorni (18-24 gg.), con la fase estrale di 4-7 giorni (con una range di 2-12 giorni) e il diestro di 14-15 giorni. Mentre quest’ultimo rimane abbastanza costante, la durata dell’estro varia in funzione della fase della stagione riproduttiva, risultando più lungo ad inizio stagione. Questo potrebbe essere dovuto alle inadeguate scariche di LH che si riscontano in tale periodo (Blanchard et al., 2003).
La regolazione funzionale dell’attività riproduttiva è controllata dall’asse endocrino ipotalamo-ipofisi-ovaio-utero. L’ipotalamo produce GnRH, il quale è responsabile della sintesi e rilascio di FSH e LH. L’FSH è fondamentale per lo sviluppo del follicolo a partire dalla formazione dell’antro. In sinergismo con gli estrogeni, determina moltiplicazione e sviluppo completo delle cellule della granulosa, come
pure la formazione su di loro dei recettori sia per FSH sia per LH. E’ responsabile della sintesi del liquido follicolare. Invece l’LH stimola a livello ovarico la produzione di progesterone da parte del corpo luteo e la sintesi d’androgeni ed estrogeni. Concorre alla maturazione del follicolo ed è indispensabile nel determinare la deiscenza follicolare e la successiva formazione del corpo luteo (Daels et al., 1993; Aguggini et al., 1998). Possiamo così riassumere (Ginther, 1992) il comportamento di LH e FSH:
La concentrazione ematica di LH rimane a livelli basali a metà diestro; inizia ad aumentare alcuni giorni prima dell’inizio dell’estro; aumenta progressivamente raggiungendo il valore massimo dopo l’ovulazione e decresce fino al 4-6° giorno del diestro.
La concentrazione ematica di FSH è basso durante l’estro; aumenta durante il diestro e comincia a diminuire circa 8 giorni prima dell’ovulazione.
La fase follicolare è caratterizzata da crescita follicolare e produzione di estrogeni. Questi determinano ipertrofia e iperplasia dell’utero e ipertrofia della vagina e della vulva. La vascolarizzazione endometriale aumenta, così come lo sviluppo ghiandolare. L’endometrio s’ispessisce con formazione di creste e cripte. Aumenta l’eccitabilità muscolare, favorendo così il trasporto degli spermatozoi attraverso l’utero, grazie all’incremento dell’attività muscolare spontanea. La cervice si rilascia e presenta caratteristiche secrezioni mucose che costituiscono una parte importante delle secrezioni vulvare osservabili al momento del calore.
Diversi follicoli iniziano a maturare (ondata follicolare) ma generalmente solo uno di questi giungerà a maturazione. Gli altri andranno incontro a regressione (Grafico 1.1). Questo comporta che
circa 7 gg. prima dell’ovulazione si potrà trovare ecograficamente un follicolo dominante (>30 mm in diametro) (Blanchard et al., 2003). Alcuni piccoli follicoli possono continuare a crescere durante il diestro raggiungendo i 25-30 mm di diametro al momento della luteolisi (Daels et al., 1993).
Circa 48h prima (78% dei casi) dalla fine dell’estro, quando il follicolo ha raggiunto una dimensione media di 40-45 mm, avviene l’ovulazione, provocata dal picco di LH. Il fatto che quest’ormone raggiunga livelli massimi dopo l’ovulazione, giustifica la relativamente alta percentuale di doppie ovulazioni (mediamente il 16%), con un intervallo tra le due di circa 1 giorno con un range di 0-5 giorni (Daels et al., 1993).
Grafico 1.1: Relazione temporale tra ormoni circolanti e modificazioni ovariche (Ginther, 1992).
La fase luteale ha inizio dall’ovulazione tramite la formazione del corpo luteo secernente progesterone (P4). I massimi livelli di progesterone si hanno circa 6 giorni dopo l’ovulazione superando il livello soglia nel plasma di 2 ng/ml (Blanchard et al., 2003).
Durante il diestro il progesterone nel sangue rimane a livelli elevati (6-10 ng/ml), fatto che determina un feedback-negativo sull’asse ipotalamo-ipofisi, con diminuzione dei livelli di LH ma non di FSH. Diversamente dalle altre specie, nella cavalla il P4 non inibisce completamente la crescita follicolare e quindi l’ovulazione (Ginther, 1992; Daels et al., 1993). L’attività biologica del progesterone si esplica soprattutto a livello dell’utero. Il tono aumenta, la contrattilità diminuisce, la cervice si chiude e la stimolazione delle ghiandole uterine porta alla produzione e secrezione del “latte uterino”, indispensabile al nutrimento dell’embrione prima del suo annidamento e impianto. Inoltre, la temporanea immunosoppressione, evita in rigetto del conceptus (Ginther, 1992; Squires, 1993a).
In caso di mancata fecondazione, circa quindici giorni dopo l’ovulazione, avviene la luteolisi per opera delle PGF2α (prostaglandine F2α), secrete dall’endometrio. Il progesterone, dopo circa 40 ore dal rilascio iniziale di prostaglandine, è a livelli basali. Il feed-back negativo sul distretto ipotalamo-ipofisi viene meno e una nuova fase estrale può iniziare (Blanchard et al., 2003).
Nella figura 1.4 sono schematizzate le interrelazioni ormonali per il controllo dell’attività ovarica.
Figura 1.4: rappresentazione schematica del controllo dell’attività ovarica nella cavalla (Blanchard, 2003).
Stagionalità
Il primo fattore che condiziona l’attività riproduttiva della cavalla è il fotoperiodo, modulando la secrezione di GnRH. Il sistema riproduttivo risponde positivamente all’aumento della quantità di luce e negativamente alla sua riduzione. E’ stato visto che durante le ore di buio la secrezione di melatonina aumenta. Quindi, quando la lunghezza del giorno è corta (autunno-inverno), il rilascio di melatonina inibisce la sintesi e il rilascio dell’ormone gonadotropo. Diversamente, quando la durata delle ore di luce è lunga, il rilascio di melatonina diminuisce e il blocco sull’ipotalamo viene meno (Blanchard et al., 2003).
In uno studio condotto da Ginther e collaboratori (1992) è stato visto che, cavalle sottoposte a 16 ore di luce (a partire da metà novembre)
anticipano la prima ovulazione (28 febbraio) rispetto alle cavalle sottoposte a 24 ore di luce (18 aprile) o ad un fotoperiodo naturale (24 maggio). Questo potrebbe far supporre l’importanza sia della luce sia del buio per influenzare la durata del periodo anovulatorio. Nello stesso studio hanno visto anche che la prima ovulazione è maggiormente ritardata in quelle cavalle che erano state sottoposte a sole 9 ore di luce artificiale (1 giugno).
Negli ultimi anni è stato notato che gli oppioidi possono partecipare alla regolazione della stagionalità riproduttiva modulando la secrezione di LH durante l’anestro invernale. E’ stato dimostrato che durante l’inverno i livelli ematici di oppioidi endogeni sono elevati rispetto alla stagione riproduttiva. Sono stati provati protocolli per alterare la stagionalità ma non hanno avuto successo (Blanchard et al., 2003). Anche l’età sembra giocare un ruolo importante sulla stagionalità. Ginther (1992) riporta che il numero di ovulazioni aumenta progressivamente tra la pubertà e i 5 anni, rimane stabile fino al 15° anno di età e poi si assiste ad un declino dopo i quindici anni.
Palpazione transrettale ed esame ecografico [fisiologia]
La palpazione transrettale dell’apparato genitale è un importante esame che il veterinario utilizza per valutare lo stato riproduttivo della cavalla. E’ necessario porre particolare attenzione a questa procedura, in quanto non sono infrequenti le lesioni accidentali che essa comporta. Buona regola è quella di assecondare le eventuali costrizioni attorno al braccio, dovute ad onde peristaltiche o a tensioni del retto. L’esame non dovrebbe durare a lungo e non si deve forzare la parete rettale in presenza di eccessiva aria. Altra accortezza è quella di tenere il pollice all’interno del palmo della mano, in caso contrario, al sopraggiungere di una contrazione improvvisa, potrebbe
verificarsi una lacerazione della parete. L’esaminatore introduce il braccio (sx o dx) nel retto dell’animale dopo aver indossato un apposito guanto da esplorazione adeguatamente lubrificato. Tolte le feci, si va a cercare l’utero a livello della biforcazione. Identificare la porzione craniale della pelvi può aiutare. A questo punto ci si sposta a sinistra lungo il corno uterino e si procede alla palpazione dell’ovaia corrispondente. Successivamente, seguendo con la mano il corno sx, la biforcazione e il corno dx si procede alla palpazione dell'altra ovaia. Infine, ritraendo il braccio e eseguendo una leggera pressione nella porzione ventrale del retto, è possibile valutare tonicità e dimensione della cervice. Grazie alla palpazione rettale, siamo in grado di valutare lo stato di gravidanza della cavalla, la turgidità dell’utero, la presenza di follicoli ovarici o di eventuali anomalie.
L’esame ecografico consiste nell’osservazione diretta, su di un monitor, di immagini (immagini bi-dimensionali in scala di grigi: B-mode) in tempo reale degli organi esaminati.
Il sistema B-mode consiste in un trasduttore collegato, tramite un lungo cavo, ad un monitor con pannello dei comandi. Il trasduttore trasmette e riceve onde sonore ad alta frequenza, le quali producono immagini in sezione degli organi e tessuti che hanno incontrato sul loro cammino. L’ecogenicità dei tessuti varia in funzione della loro capacità di propagare o riflettere le onde sonore. In particolare, i fluidi propagano facilmente le onde, mentre l’aria ne riflette la quasi totalità. Un tessuto si definisce ecogeno quando riflette le onde (es. tessuto osseo), producendo immagini bianche sul monitor, mentre un tessuto è anacogeno quando non riflette le onde (es. fluido) così da produrre immagini nere. Le varie gradazioni di grigio che si vengono a formare danno vita all’immagine ecografica (tabella 1.1). Il pannello di controllo permette all’operatore di regolare la qualità dell’immagine e di poterla
bloccarla per effettuare le misurazioni del caso (es: dimensione dei follicoli).
Organo Struttura Descrizione ecografica
Ovaio Stroma Uniformemente ecogeno, bianco.
Follicolo Il liquido follicolare appare anecogeno,
nero. La parete follicolare appare ecogena.
Corpo luteo
L’immagine può essere varia. Il CL può apparire uniformemente iperecogeno o presentare zone ecogene e anecogene contemporaneamente.
Utero In base al momento, l’ecogenicità può
apparire più o meno omogenea. Tabella 1.1: ecogenicità di utero e ovaie.
Nella riproduzione equina, si usano principalmente sonde lineari a 5-6 MHz. Frequenze di 7.5-8 MHz sono utilizzate per studiare con più precisione la struttura dell’organo, ma essendo il loro potere penetrante minore, ci permetteranno di visualizzare solo i tessuti più superficiali. Trasduttori a bassa frequenza (3 MHz), hanno una maggior capacità penetrativa (utile nel caso di gravidanza avanzata) ma minore risoluzione (Blanchard et al., 2003).
L’ecografia è eseguita con la stessa tecnica descritta per la palpazione transrettale e valgono le medesime precauzioni. Il punto di repere da cui far iniziare l’esame è la vescica, perché dorsalmente ad essa è possibile visualizzare l’utero in sezione longitudinale. Procedendo in avanti si arriva al fondo dell’utero, dove ruotando la sonda a sx o a dx si possono osservare le corna uterine in sezione trasversale. Proseguendo nella rotazione, lungo le corna, si raggiungono le ovaie. La diagnostica ecografica e la palpazione sono molto utili per verificare lo stato fisiologico o patologico in cui si trova la cavalla, perché
assumono caratteristiche diverse a seconda della stagione (anestro invernale, transizione primaverile e autunnale, stagione riproduttiva), della fase del ciclo estrale (estro o diestro) o delle patologie presenti (McKinnon et al., 1993a).
Anestro
L’utero è di dimensioni ridotte, di consistenza flaccida, a volte difficilmente palpabile. Le ovaie sono piccole e dure. Ecograficamente l’utero appare appiattito e irregolare, grazie alla compressione esercitata dagli organi vicini. Le ovaie non presentano corpi lutei e la dimensione dei follicoli sono < 20 mm (McKinnon et al., 1993a; Ginther, 1995).
Transizione
Le ovaie sono dure al tatto e di dimensioni aumentate. L’utero mantiene una consistenza flaccida. Ecograficamente non si osserva alcun corpo luteo ed i follicoli sono generalmente >25 mm. L’utero ha un aspetto simile all’estro (Ginther, 1995; Blanchard et al., 2003).
Stagione riproduttiva
Estro: Alla palpazione si percepisce l’utero di dimensioni aumentate e
di consistenza pastosa. Ecograficamente si notano aree iperecogene alternate ad aree ipoecogene e le corna uterine assumono il tipico aspetto a “ruota di carro” o di “buccia d’arancia”, riferibili alle pieghe della mucosa. L’ipoecogenicità è dovuta alla presenza di edema endometriale, sotto l’influenza estrogenica. Queste pliche sono visibili all’inizio calore, diventano più evidenti a metà calore e tendono a diminuire o a scomparire circa 1 giorno prima dell’ovulazione. Il lume è spesso visibile, perché al suo interno sono presenti piccole quantità di
fluido (Figura 1.6) (per altro normale durante la prima parte della fase estrale).
Le ovaie possono essere di grandi dimensioni, per la presenza di uno o più follicoli e diventano morbide al tatto man mano ci si avvicina al momento dell’ovulazione. I follicoli appaiono anecogeni, di dimensioni variabili (Figura 1.5) (Shideler, 1993a; Carleton, 1997).
L’ecografia può in alcuni casi essere utile per predire il momento dell’ovulazione. Circa 24 ore prima dell’ovulazione, alcuni follicoli cambiano la loro forma passando da più o meno sferici ad ovali o a “pera”. La parete follicolare si ispessisce e assume un aspetto edematoso (alla sua base può essere presente una sottile banda anecogena) e può presentare un aspetto conico verso la fossetta ovulatoria. A volte, all’interno del liquido follicolare appaiono piccoli spot iperecogeni, probabilmente dovuto al distacco delle cellule della granulosa. Il follicolo preovulatorio è molto morbido ed alla palpazione è presente algia (McKinnon et al., 1993b; Blanchard et al., 2003).
Figura 1.5: immagine ecografica in fase estrale di un’ovaia con un follicolo dominante (dx) e di un corno uterino con il tipico aspetto a ruota di carro (sx).
Figura 1.6: immagine ecografica in fase estrale di utero con abbondanti pliche. Presenza di liquido nel lume dell’utero.
Diestro: alla palpazione il tono uterino è aumentato e le ovaie sono
generalmente dure e prive di grossi follicoli. Il corpo luteo risulta palpabile solo nelle prime 24 ore, come un avvallamento crepitante, per l’invasione ematica nella cavità follicolare. Successivamente la consistenza diventa simile a quella del parenchima ovarico. Ecograficamente il CL si presenta in modo variabile. Può apparire come una formazione rotondeggiante uniformemente iperecogena (Figura 1.9) o come una formazione ad ecogenicità eterogenea, presentando aree anecogene al suo interno (Figura 1.7 e 1.8). L’utero presenta un’ecostruttura omogenea, dove non è possibile visualizzare pieghe e cavità (Figura 1.7, 1.8 e 1.9). Qualche volta, nella sezione longitudinale del corpo uterino, il lume può essere visibile come una sottile linea bianca centrale.
Figura 1.7: Immagine ecografica in diestro. A sx si vede l’utero senza pieghe e a dx un CL 80% ecogeno con un follicolo vicino.
Figura 1.8: Immagine ecografica in diestro. A sx si vede l’utero senza pieghe e a dx un corpo luteo con ecogenicità del 50%.
Figura 1.9: Immagine ecografica in diestro. A sx un corpo luteo molto ecogeno e a dx l’utero privo di pieghe.
Cap. 2
VALUTAZIONE DELLE POTENZIALITA’ RIPRODUTTIVE
DELLA CAVALLA RICEVENTE DI EMBRIONI
2.1 Selezione della ricevente di embrioni
Uno dei più importante fattori per il successo dei programmi di Embryo Transfer è la selezione e valutazione delle riceventi (McKinnon et al., 1988; Squires, 1993; Shideler, 1993b; Squires et al., 1999; Carnevale et al., 2000; Blanchard et al., 2003). La ricevente è l’incubatrice che, per tutta la durata della gestazione, dovrà garantire le esigenze dell’embrione/feto. Sarebbe buona norma avere, presso il centro di ET, un minimo di 2-3 riceventi per ogni donatrice. Questo, da una parte facilita la possibilità di avere almeno una cavalla sincronizzata in modo appropriato con la donatrice, dall’altra ci permette di far fronte all’eventuale recupero di più embrioni dalla singola donatrice (Squires et al., 1995; Panzani, 2002). Squires et al. (1999) e Allen (2002) riassumono così i criteri di selezione:
• Peso corporeo (400-550 Kg)
• Taglia della ricevente simile alla donatrice • Età (3-10 aa)
• Buona predisposizione materna • Buono sviluppo mammario
• Normali caratteristiche fisico-anatomiche dell’apparato genitale La storia riproduttiva è il primo elemento da prendere in considerazione. E’ opportuno, ove possibile, sapere l’età della cavalla,
se si è riprodotta in passato, se ha partorito, quanti puledri, se ha avuto problemi al parto, se la durata della gestazione è stata regolare o se ha mai abortito. Altre informazioni devono essere ottenute riguardo i cicli estrali. Cicli troppo corti possono suggerire l’esistenza di infezioni uterine, invece cicli più lunghi suggeriscono la possibilità di fasi luteali prolungate in cavalle non in riproduzione e morte embrionale o fetale nelle cavalle in riproduzione. Anche disfunzioni ormonali possono essere causa di irregolarità nei cicli estrali (Blanchard et al., 2003).
L’esame clinico dell’animale, generalmente, oltre all’anamnesi, si compone dell’Esame Obbiettivo Generale (EOG) e dell’Esame Obbiettivo Particolare (EOP). L’EOG viene effettuato tramite l’ispezione, palpazione, percussione, auscultazione e la misurazione delle caratteristiche generali del paziente e delle grandi funzioni organiche. Si valutano, tra le altre cose, lo sviluppo scheletrico, la costituzione, lo stato nutritivo e segni particolari. Nell’EOP invece si entra più in dettaglio ad analizzare i vari apparati, come quello genitale. Nell’esame particolare rientrano anche quelle procedure strumentali e di laboratorio come biopsie, citologici e batteriologici. Tappa importante per la selezione delle riceventi è la valutazione della taglia dell’animale (Tischner, 1985; Tischner, 1987; Tischner et al., 1989; Doig et al., 1993). Walton et al. (1938) hanno visto che la taglia della cavalla aveva effetto sia sullo sviluppo intrauterino sia sulla velocità di sviluppo postnatale. Essi incrociarono cavalle di grossa taglia di razza Shire con pony Shetland. I puledri nati da madri Shire risultarono tre volte più grossi rispetto a quelli ottenuti da madre pony. La situazione si stabilizzò al raggiungimento dell’età adulta. Tischner (1985) ottenne 6 embrioni da cavalle pony. Tre vennero trasferiti in cavalle di grossa taglia e tre vennero trasferiti in madri di piccole
dimensione. Confrontando i puledri, notò che i nati dalle cavalle da tiro erano più alti e più pesanti dei fratelli nati dalle cavalle pony. In uno studio successivo vide che questa differenza era molto marcata allo svezzamento ma comunque presente anche al raggiungimento della maturità, seppur in misura minore (Tischner, 1987; Tischner et al., 1989).
Anche Allen et al (2002 e 2004) hanno ottenuti risultati simili ai succitati autori eseguendo questi incroci:
purosangue in purosangue (PSI-in-PSI, n=8); attraverso AI pony in pony (P-in-P, n=7); attraverso AI
purosangue in pony (PSI-in-P, n=8); da embrioni PSI-in-PSI pony in purosangue (P-in-PSI, n=11); da embrioni P-in-P
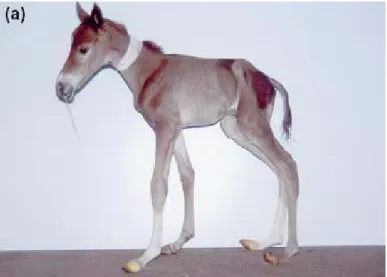
confrontando la taglia/peso dei nati, lo sviluppo placentare e la durata della gestazione (Allen et al., 2002). I puledri PSI-in-P e quelli P-in-PSI risultarono di dimensioni rispettivamente diminuite e aumentate dei puledri nati da madri geneticamente affini. Questa differenza nelle dimensioni corporee era approssimativamente del 15%, anche se all’età di 3 anni scese al 5%. Nonostante le differenze significative tra il gruppo di studio e i controlli, i maggiori segni di immaturità si ebbero nei puledri PSI-in-P. In questo gruppo la superficie placentare risultò notevolmente inferiore rispetto al gruppo PSI-in-PSI (Allen et al., 2004). Lo stress per il ridotto spazio intrauterino e il deficit nutrizionale ha determinato un incremento nella produzione di pregnenolone fetale, fatto che ha portato all’istaurarsi della cascata ormonale, anticipando il parto. I puledri apparirono prematuri e necessitarono di assistenza per alzarsi e per l’assunzione del latte durante le prime 24 ore (Figura 2.1a).
Figura 2.1a: PSI-in-P, evidenti segni di ridotta crescita intrauterina, con atrofia muscolare al posteriore e agli arti superiori, iperestensione del nodello e malformazione degli zoccoli
(da Allen, 2002).
I pony, invece, indipendentemente dalla madre, si alzarono tutti velocemente e iniziarono l’assunzione di latte senza problemi (Figura 2.1b)
Figura 2.1b: P-inPSI, di dimensioni chiaramente maggiori, miglior sviluppo muscolare, pastorale dritto e ben formato, zoccoli duri (da Allen, 2002).
Le condizioni generali dell’animale non dovrebbero essere trascurate. Segni di navicolite, laminite, tendinite diminuiscono il potenziale riproduttivo. Inoltre, condizioni di sforzo respiratorio, come in caso di
patologie respiratorie ostruttive con tosse e dispnea respiratoria, possono predisporre a pneumovagina, quindi a infezioni uterine (Easley, 1993).
Altra causa di pneumovagina è l’anomala conformazione del perineo. La rima vulvare rappresenta la prima difesa tra l’ambiente esterno e l’utero. Deve essere verticale (o comunque con inclinazione non superiore a 10°), con le labbra vulvari ben adese tra loro. La commessura dorsale non dovrebbe estendersi oltre 4 cm dall’osso pubico (Figura 2.2) (Pascoe, 1979; Blanchard et al., 2003).
Figura 2.2: sezione di un normale perineo di cavalla (da McKinnon, 1993).
L’anormale conformazione comporta una riduzione delle percentuali di gravidanza e quindi delle potenzialità riproduttive (Caslick, 1937; Walton et al., 1938; Hemberg et al., 2005).
In uno studio condotto su oltre 9000 cavalle, Pascoe (1979) distinse la conformazione vulvare in tre differenti tipi (Tabella 2.1) a seconda della distanza tra commessura dorsale-osso pubico e il grado di inclinazione vulvare, attribuendogli un indice (Indice Caslick = cm tra la commessura dorsale e l’osso pubico x angolo di inclinazione): cavalle
con indice superiore a 150 avevano gravi problemi riproduttivi rispetto a quelle con indice minore di 50 (Caslick, 1937; Pascoe, 1979).
Tipo Descrizione
Tipo I (Figura 2.1) Commessura dorsale non oltre 2-3 cm oltre il pube. Generalmente non necessita della vulvoplastica di Caslick.
Tipo II
La commessura dorsale è a circa 6-7 cm dal pavimento pelvico (indice click >50). Con l’età la conformazione tende a peggiorare (indice Caslick >150).
Tipo III (Figura 2.3)
Tra il pettine del pube e la commessura dorsale ci sono circa 5-9 cm e la conformazione è tale da richiedere l’operazione di Caslick.
Tabella 2.1: conformazione vulvare secondo Pascoe (1979).
Figura 2.3: sezione del perineo di cavalla con conformazione tipo III. L’indice di Caslick è >150 (da McKinnon, 1993).
La più comune procedura per risolvere la pneumovagina è l’operazione di Caslick modificata (Figura 2.4).
Figura 2.4: Operazione di Caslick – A, iniezione locale di anestetico; B, asportazione della mucosa e esposizione della sottomucosa; C, sutura a punti staccati o continui; D, sutura di rinforzo.
(da McKinnon, 1993).
La cavalla è posta in un travaglio. La coda è fasciata e spostata di lato ed il perineo deve essere lavato con sapone disinfettante. Le labbra vulvari sono infiltrate di anestetico locale, estendendo l’anestesia fin sopra la commessura dorsale. Se ritenuto opportuno la cavalla può essere sedata. L’estensione ventrale della sutura può essere determinata tramite pressione digitale sulla vulva fino ad incontrare il
pube. Se non si prolunga la sutura fino a quel livello, durante i movimenti della cavalla, la vagina spingendosi in avanti può determinare aspirazione d’aria. Dopo l’infiltrazione di anestetico locale, si procede all’asportazione di una porzione di tessuto (largo circa 0.5 cm) alla giunzione muco-cutanea della rima vulvare. A questo punto si uniscono le due labbra attraverso una sutura continua o a punti staccati, generalmente con filo non riassorbibile. Comunque, se il perineo o l’ano sono particolarmente affossati, l’operazione di Caslick potrebbe non correggere la pneumovagina (Blanchard et al., 2003). Un fattore predisponente ad una anormale conformazione perineale è l’elevato livello di allenamento sportivo. Numerose cavalle, tra i 3 e i 6 anni di età, durante la loro carriera sportiva perdono un notevole quantità di grasso corporeo a livello del perineo. Questo fa sì che il retto si sposta troppo anteriormente, permettendo alla vulva di essere tirata a livello del bordo pelvico. Durante l’esercizio fisico, l’affaticamento muscolare e l’estro, contribuiscono al rilassamento perineale, provocando espirazione di aria, materiale fecale e batteri all’interno. Il risultato finale è la pneumavagina (Hurtgen, 2006).
Altra conseguenza di un’anormale conformazione del perineo è l’urovagina. Quando l’orifizio uretrale è spinto cranialmente al pube, l’urina non può uscire dalla rima vulvare, la quale va a raccogliersi nella porzione anteriore della vagina. Questo, assieme alla pneumovagina sono fattori predisponesti per cerviciti, vaginiti ed endometrite (Pascoe, 1979).
2.2 Endometrite ed endometriosi come cause di
infertilità
Le ENDOMETRITI sono la causa maggiore di infertilità nella cavalla e vengono considerate la terza patologia in ordine di importanza dopo le coliche ed i disordini respiratori (Liu, 1988; Troedsson, 1999).
Nel 1969 Hughes et al. videro che cavalle giovani, con apparato genitale normale, a cui venne inoculato lo Streptococcus
zooepidemicus nell’utero, riuscivano nell’arco di 96 ore a eliminare
l’infezione. Al ciclo successivo vennero inseminate con seme di stallone fertile, rimanendo tutte gravide.
Da allora questo tipo di cavalle vennero definite come resistenti all’endometrite. Invece, cavalle che non erano in grado, con le loro naturali difese, di eliminare gli agenti estranei/infettivi vengono classificate come suscettibili ad endometrite (Blanchard et al.,2003; LeBlanc, 2003).
Con questo tipo di classificazione le fattrici costituiscono un gruppo alquanto eterogeneo, nel quale entrerebbero in gioco numerosi fattori di predisposizione, rendendo più difficile la loro identificazione. Ad oggi le endometrite non puerperali sono state suddivise in quattro categorie (Perkins, 2004b; Bruyas, 2006) in base ai meccanismi eziopatogenetici:
1. Endometrite a trasmissione venerea 2. Endometrite cronico-degenerativa 3. Endometrite infettiva cronica
4. Endometrite persistente accoppiamento o post-inseminazione
L’endometrite a trasmissione venerea è causata principalmente da
Taylorella equigenitalia (metrite contagiosa equina), Pseudomonas aeruginosa, Klebsiella pneumoniae. La diagnosi viene fatta tramite
isolamento e identificazione dell’agente patogeno. La cavalla non deve essere accoppiata fino a quando lo specifico trattamento non ha eliminato l’infezione (Perkins, 2004b).
L’endometrite cronico-degenerativa è una patologia a carattere irreversibile, comunemente riscontrata nelle cavalle anziane. Sono un fattore predisponente per infezioni recidivanti con possibile evoluzione cronica. La diagnosi è possibile tramite esame istologico, che permetterà di evidenziare alterazioni fibrotiche. Nel tentativo di rimediare al problema, in passato veniva eseguito il curetage chirurgico uterino per via transvaginale. Oggi è spesso preferito il curetage chimico attraverso l’infusione uterine di DMSO o Kerosene. Questi trattamenti hanno la funzione di indurre una reazione infiammatoria con possibile effetto rigenerativo dell’endometrio (Perkins, 2004b; Bruyas, 2006). Va posta però particolare attenzione all’utilizzo di sostanze irritanti, perché l’eccessiva irritazione potrebbe causare un peggioramento delle condizioni degenerative e addirittura portare a formazioni di aderenze. Inoltre recentemente è stato visto da alcuni veterinari che l’utilizzo, come infusione uterine, di enrofloxacina può essere molto irritante, determinando severe reazioni infiammatorie con fluido uterino sanguinolento (Perkins, 2004b).
L’endometrite infettiva cronica è causate da germi comuni presenti nell’ambiente e a volte da lieviti o funghi, in quelle cavalle con difetti nei meccanismi di difesa del sistema riproduttivo. Un comune problema associato a queste infezioni è la pneumovagina, cioè quella
condizione che implica l’aspirazione di aria o detriti nel tratto genitale (Blanchard et al., 2003). Anche quelle cavalle che sono di per sé resistenti ad endometriti batteriche, vedono compromessa questa loro caratteristica dai continui insulti causati da pneumovagina, come nel caso di giovani cavalle dopo un eccessivo periodo di allenamento (Hurtgen, 2006).
Queste endometrite possono essere causate anche da un’inadeguata gestione delle fattrici, come nel caso di inseminazioni in fase luteinica utilizzando come unico criterio la presenza di un follicolo di grandi dimensioni (Bruyas, 2006). L’utero, sotto l’influenza del progesterone, presenta difese ridotte, così da favorire lo sviluppo di germi (McDonnell e Watson, 1992).
Inoltre questo tipo di infezione potrebbe essere secondaria alla flogosi post-accoppiamento/IA (Bruyas, 2006).
L’endometrite persistente post-accoppiamento o post-inseminazione è una patologia che ha sviluppato molto interesse in tempi più recenti, in quanto si è approfondito la ricerca dei meccanismi patogenetici che la caratterizzano (LeBlanc, 2003). L’individuazione delle cavalle sensibili e la loro corretta gestione, potrebbe minimizzare i fattori predisponenti, determinando un incremento delle percentuali di gravidanza (Blanchard et al., 2003; LeBlanc. 2003). Questa patologia merita un maggior approfondimento perché numerose sono le cavalle che possono presentare problemi dopo l’introduzione di seme in utero. Zent e Troedsson (1998) videro che il 15% della normale popolazione di purosangue era soggetta a sviluppare una persistente infiammazione post-accoppiamento.
In due studi condotti su più di 400 cavalle di razza purosangue sottoposte a monta naturale (Zent et al. 1998) e razza da sella
sottoposte ad IA (Barbacini, 2003), hanno riportato un’incidenza di endometrite del 15 e del 25 % rispettivamente. In un altro studio, condotto su 560 fattrici in estro (Pycock et al., 1996), è stato messo in evidenza che il 20% dei soggetti mostrava accumulo di liquido in utero e che le cavalle non trattate presentavano un tasso di gravidanza più basso (21% contro 62%).
Fisiologicamente, in cavalle normali, dopo l’introduzione di seme, avviene una reazione immunitaria (come risposta alla presenza di batteri e spermatozoi), che è velocemente risolta tra le 24-48 ore. Questa risposta uterina all’insulto esterno è indispensabile per poter ripulire l’utero da tutto il materiale in eccesso introdotto, permettendo di ricreare quelle condizioni atte alla sopravvivenza dell’embrione dopo la sua discesa al 5°-6° giorno post-ovulazione (Blanchard et al., 2003). Le prime cellule ad arrivare al sito infiammatorio sono i polimorfonucleati, in quanto l’utero risponde molto velocemente agli antigeni presenti, rilasciando mediatori chemiotattici (Troedsson, 1999). I PMNs, giunti nel lume uterino, iniziano la loro attività fogocitoria di spermatozoi e batteri e determinano il rilascio di PGF2α. Queste, se il processo di pulizia dai residui infiammatori fallisce, determinano la lisi precoce del corpo luteo (Troedsson et al., 2001). Alcuni ricercatori ritennero che nelle cavalle suscettibili vi era una ridotta funzionalità dei PMNs (Cheuug et al., 1985; Liu et al., 1985; Watson et al., 1987), in contrasto con altri studi che misero in evidenza che la competenza dei PMNs era simile o superiore nelle cavalle sensibili rispetto alle resistenti (Hansen et al., 1987; Asbury et al., 1987). Comunque, più recentemente, è stato visto che i neutrofili uterini, ottenuti da cavalle suscettibili, sono perfettamente funzionanti se posti in appropriate condizioni, ma disfunzionali quando le secrezioni uterine di fattrici problematiche sono utilizzate come fonte di
opsonizzazione (Troedsson et al., 1993a). Inoltre, queste discrepanze dei lavori succitati, potrebbero essere dovute al fatto che sono stati condotti in modo diverso e in diversi momenti del ciclo estrale. E’ stato anche visto che i livelli di immunoglobuline libere nell’utero sono, anche in questo caso, simili o superiori nelle cavalle sensibili, suggerendo che i mediatori anticorpali uterini sono perfettamente funzionanti (Troedsson, 1999).
LeBlanc et al. (1994) attraverso l’uso della scintigrafia, mostrarono che le cavalle resistenti riuscivano ad eliminare entro 2 ore più del 50% dei radiocolloidi infusi nell’utero, rispetto alle cavalle sensibili ad endometrite (eliminazione dei radiocolloidi < 20%).
Grazie a questo studio si iniziò a parlare di “clearance uterina ritardata” e negli anni seguenti venne accettato che le alterazioni meccaniche fossero alla base del meccanismo patogenetico (Figura 2.5) dell’endometrite persistente post-accoppiamento/inseminazione (LeBlanc, 2003; Bruyas, 2006).
Figura 2.5: schema patogenetico delle endometriti post-accoppiamento (da Bruyas 2006, secondo Troedsson 1999).
Sempre grazie alla scintigrafia, si è potuto notare che un’eccessiva inclinazione dell’utero in direzione ventro-craniale predispone le cavalle a processi infiammatori (figura 2.6) (LeBlanc et al., 1998).
Figura 2.6: immagine scintigrafia dell’utero di cavalla sensibile a endometrite (da LeBlanc, 2003).
Troedsson et al. (1993b) sottoposero ad elettromiografia cavalle sensibili e non ad endometrite. Essi videro che la ridotta clearance uterina in cavalle suscettibili era associata ad una ridotta attività miometriale in risposta all’infiammazione.
Questo difetto muscolare sembra essere dovuto ad una disfunzione intrinseca del miometrio, perché l’utilizzo di ossitocina o prostaglandine F2α ristabiliscono la normale tensione muscolare. Questa disfunzione potrebbe essere causata dall’accumulo di ossido nitrico (NO) all’interno del lume uterino dopo l’inseminazione. L’assorbimento di NO nell’endometrio può ridurre l’attività mioelettrica dell’utero, anche se il suo ruolo preciso non è stato ancora determinato (Alghamdi et al., 2002; Alghamdi et al., 2005).
Le contrazioni uterine quindi sono necessarie per avere un’efficace pulizia uterina attraverso la cervice e il sistema linfatico (Asbury et al.,
1993; Troedsson, 1999; Nikolakopoulos et al., 1999; LeBlanc, 2003; Blanchard et al., 2003; Bruyas, 2006).
In particolare è stato visto che le cavalle sensibili hanno un deficit del drenaggio linfatico, ritardando la pulizia dell’utero e la rimozione dell’edema (LeBlanc, 2003).
Altro fattore che potrebbe contribuire a diminuire la clearance uterina è la degenerazione endometriale vascolare. Queste alterazioni sono l’elastosi, la fibrosi e la fibroelastosi della parete dei vasi sanguigni, così come la fibrosi perivascolare e i processi di calcificazione. L’angiosi sembra ridurre indirettamente la fertilità della fattrice attraverso sia una riduzione della perfusione endometriale sia tramite la diminuzione del drenaggio uterino, causato dall’alterazione della funzionalità venosa. Il perdurare, dopo l’estro, dell’edema è segno di una persistente linfangiectasia (LeBlanc, 2003).
E’ stato anche notato che le cavalle sottoposte ad IA sviluppano endometrite con maggiore facilità. Questo potrebbe essere dovuto proprio all’uso di seme refrigerato/congelato (Bruyas, 2006). L’infiammazione indotta dallo sperma è più rilevante se il seme è maggiormente concentrato, di basso volume e privo di plasma seminale (Nikolakopoulos et al., 2000).
Troedsson et al. (2001 e 2002) videro che il fluido seminale riduceva la fisiologica risposta infiammatoria dopo inseminazione attraverso la riduzione della migrazione dei neutrofili all’interno del lume uterino. Inoltre, l’aggiunta di plasma seminale nelle secrezioni uterine ottenute dopo inseminazione, riduce, in vitro, l’attacco agli spermatozoi da parte delle cellule infiammatorie. Troedsson et al. (2002) ottennero un numero di gravidanze nettamente superiori nelle cavalle inseminate con seme intero rispetto a quelle a cui, pur mantenendo la stessa
concentrazione e numero di spermatozoi, è stato tolto il plasma seminale (17/22 contro 1/22).
Appare quindi importante riuscire ad individuare le cavalle predisposte a sviluppare endometrite. Nella pratica, essendo impossibile utilizzare gli strumenti diagnostici come la scintigrafia o l’elettromiorafia, si rende necessario utilizzare metodi più pratici (Bruyas 2006).
Brinsko et al. (2003) videro che era possibile distinguere le cavalle problematiche in base alla quantità di fluido intrauterino visibile ecograficamente. In questo studio conclusero che potevano essere considerate suscettibili di endometrite post-accoppiamento quelle cavalle che presentavano una di queste anomalie:
1. Fluido uterino > 2 cm in estro 2. Fluido durante il diestro
3. Fluido 72 ore dopo l’inseminazione
A conferma dell’inefficiente contrattilità uterina o drenaggio linfatico c’è il fatto che, nei campioni per l’esame citologico e batteriologico prelevati da fattrici con fluido in estro, spesso non viene evidenziato alcun batterio o evidenza infiammatoria (Bruyas, 2006).
La prevenzione è il primo principio da prendere in considerazione per limitare i danni provocati dall’infiammazione. Inoltre, nell’immediato periodo post-ovulatorio è possibile attuare una serie di accorgimenti per eliminare o ridurre al minimo l’endometrite. Vari autori (Bruyas, 2006; LeBlanc, 2003; Blanchard et al., 2003; Perkins, 2004b; LeBlanc, 2004) riassumono nei seguenti punti la gestione delle cavalle problematiche:
1. Realizzare se possibile una sola monta o inseminazione per ciclo. Meglio sarebbe utilizzare seme fresco. E’ stato anche visto
che l’utilizzo dell’inseminazione endocornuale profonda induce una minor reazione infiammatoria anche nelle cavalle suscettibili. 2. L’igiene deve essere rigoroso per tutte le manualità che
prevedono operazioni intravaginali/intrauterine. Inoltre potrebbe essere importante ridurre al minimo indispensabile le suddette manualità per evitare contaminazioni iatrogene.
3. Realizzare lavaggi uterini tra le 4 e le 8 ore post-inseminazione. E’ stato visto che 4 ore è un periodo di attesa adatto, in quanto gli spermatozoi raggiungono gli ovidutti già dopo 2 ore (Bader, 1982). Va però detto che se si aspetta solo due ore dopo l’accoppiamento, il tasso di gravidanza diminuisce. Il lavaggio ha lo scopo di limitare il più possibile il contatto tra i prodotti dell’infiammazione e l’endometrio. Tecnicamente consiste nell’introduzione di 500-1000 mL di soluzione fisiologica o ringer lattato in utero, i quali vengono successivamente recuperati per gravità. Questa procedura può essere ripetuta più volte e, se necessario, ripetuta ogni 24 ore fino a circa il 3°-4° giorno post-inseminazione. Vanderwall et al. (2003) hanno anche notato che i lavaggi uterini (con ringer lattato) prima dell’inseminazione non hanno effetto sulle percentuali di gravidanza. Questo può essere tenuto in considerazione quando si deve ripetere l’inseminazione in quelle cavalle sottoposte a lavaggio uterino da 4-6 ore e che non hanno ovulato nel momento previsto.
4. Dopo il lavaggio uterino risulta particolarmente utile l’utilizzo di sostanze uterotoniche. In particolare, è possibile somministarare ossitocina (da 10 a 20 UI, iv o im) per favorire le contrazioni uterine. Questa molecola esplica il sue effetto entro 60 secondi e perdura per 40-60 minuti. Il trattamento può essere ripetuto dopo
intervalli di almeno 8 ore. Inoltre, dosi superiori a quelle consigliate (> 20 UI) riducono le percentuali di cavalle gravide. Nel caso si sia osservato un deficit del sistema linfatico, sarebbe più indicato utilizzare le prostaglandine, in particolare cloprostenolo. Questo esplica il suo effetto entro 10 minuti e perdura per circa 5 ore.
L’utilizzo e le modalità di somministrazione di prostaglandine è controverso. Contrariamente a ciò che è comunemente considerato come un dato di fatto scientifico, Bergfelt e Ginther (2004) hanno riferito che la somministrazione di 10 mg di PGF2α è capace, dal terzo giorno post-ovulazione, di indurre una luteolisi efficace come quella determinata al decimo giorno post-ovulazione. Iniezioni sistematiche potrebbero influire sulla funzione luteinica, mentre una sola somministrazione non determina alcun effetto negativo. Molti però somministrano cloprostenolo ogni 24 ore non oltre le 48 ore post-ovulazione ad una dose di 250 microgrammi IM, in quanto non sono state notate differenze nei tassi di gravidanza rispetto all’utilizzo di ossitocina.
5. E’ possibile anche utilizzare antibiotici in soluzione dopo i lavaggi uterini. L’utilizzo di uterotonici immediatamente dopo l’infusione di soluzioni antibiotate, possono determinarne l’espulsione prima che possano esplicare la loro azione battericida. Blanchard et al (2003) suggeriscono le seguenti opzioni:
a. Se il lavaggio uterino è evacuato completamente e l’antibiotico è infuso successivamente, l’uterotonico può essere somministrato 4-8 ore dopo.
b. Se il lavaggio uterino è accompagnato dalla somministrazione di uterotonico, l’antibiotico andrebbe
infuso circa 1 ora dopo se l’iniezione è di ossitocina, 3-4 ore dopo se è stato somministrato PGF2α.
c. Se l’ossitocina è somministrata prima del lavaggio e questo richiede 20-30 minuti per essere completato, l’antibiotico può essere infuso subito dopo il lavaggio.
Concludendo, se la quantità di fluido non supera i 2 cm e si presenta anecogeno, la sola somministrazione (singola o ripetuta) di ossitocina determina l’evacuazione completa del liquido e la risoluzione della condizione infiammatoria.
Oltre all’esame clinico, anche gli esami di laboratorio, come citologico, batteriologico e biopsia, ci permettono di distinguere le cavalle suscettibili da quelle non suscettibili ad endometrite. Troedsson et al. (1993) videro che esisteva un’associazione significativa tra grado della biopsia uterina e suscettibilità ad infezione uterina cronica (CUI), dopo inoculazione di una dose infettante. Suddivise 25 fattrici in 4 gruppi:
Gruppo 1 (n =6), nessun cambiamento patologico Gruppo 2 (n=5), lievi cambiamenti patologici
Gruppo 3 (n=7), moderati cambiamenti patologici
Gruppo 4 (n=7), gravi cambiamenti infiammatori e fibrotici
L’inoculazione (5 x 106 Streptococcus zooepidemicus) è stato effettuato tre giorni dopo l’inizio dell’estro e con follicoli >30mm. Le cavalle con >1 neutrofilo in 5 campi microscopici (400x) e > 20 colonie all’esame batteriologico 96 ore dopo l’inoculazione sono state considerate sensibili a CUI. Essi videro che se la biopsia era normale le cavalle erano resistenti, invece le gravi alterazioni erano significativamente associate a suscettibilità alla CUI. Le lesioni intermedie non hanno avuto una correlazione significativa con la CUI.
2.3 Metodiche di valutazione della funzione uterina
Palpazione transrettale ed esame ecografico [Aspetti patologici]Le principali patologie verificabili manualmente sono:
L’assenza di una o più organi dell’apparato genitale
Le variazioni in dimensione, disposizione e tono dell’utero Le dimensioni ovariche e la presenza di ematomi o cisti Patologie cervicali
Numerose possono essere le affezioni che interessano la cervice. Spesso si procede al suo esame visivo diretto o tramite palpazione transvaginale (Shideler, 1993a; Blanchard et al., 2003; Perkins, 2004a).
La cervice è una struttura dinamica che deve rilassarsi durante l’estro, così da permettere al seme di entrare e ai contaminanti di uscire, per poi richiudersi in diestro o durante la gravidanza. Qualunque difetto, incompetenza, lacerazione possono essere causa di endometrite ed aborto (LeBlanc, 2005). LeBlanc e collaboratori (2005) sintetizzano così i vari segni di patologie cervicali:
Accumulo di liquido in utero dopo l’accoppiamento in cavalle nullipare
Infertilità
Aborto tra i 50 e i 150 giorni Pregressa distocia
Scolo vulvare
In alcuni casi, in cavalle giovani o anziane (>14 aa) nullipare ritirate dall’attività agonistica, si può verificare un’insufficiente dilatazione cervicale, nella quale, durante l’estro, dovrebbero passare con facilità due dita.
Dopo una distocia si possono verificare due tipi di lesioni (LeBlanc et al., 2005):
1. lacerazione dell’ostio esterno e di una porzione del canale
cervicale: se interessano più del 25% della circonferenza il
trattamento è quello chirurgico. Quelle di lieve entità possono essere trattate tramite applicazione locale di creme antibiotiche. 2. Eccessivo stiramento della componente muscolare del canale
cervicale: queste fattrici tendono ad abortire dopo 5-7 mesi di
gravidanza. In diestro la cervice dovrebbe essere efficacemente chiusa.
Aspetti patologici
Le principali alterazioni riscontrabili a livello ovarico sono:
I follicoli anovulatori sono follicoli preovulatori al cui interno appaiono sparse macchioline e tralci di fibrina iperecogeni (Figura 2.7). Possono avere la parete nettamente iperecogena (forse dovuta ad una luteinizzazione delle cellule). La spiegazione rimane sconosciuta, ma spesso questi follicoli si formano dopo somministrazione di gonadotropina corionica umana (human chorionic gonadotropin = hCG) (Ginther, 1995). Questa struttura potrebbe essere la conseguenza del declino di GnRH e dell’inadeguata concentrazione di LH (Bosu et al.,
1993). I follicoli anovulatori generalmente si riducono in circa 3-6 settimane (Blanchard et al., 2003).
Figura 2.7: follicolo luteinizzato (da McCue, 2000).
L’ematoma ovarico è caratterizzato da un grosso follicolo pieno di sangue. E’ una struttura normalmente presente durante la stagione riproduttiva (Bosu et al., 1993). Alcune volte però può raggiungere dimensioni notevoli (>10 cm) interferendo così con la normale motilità uterina e l’eventuale riconoscimento materno di gravidanza (Blanchard et al., 2003). Si risolve normalmente nell’arco di due cicli estrale, ma qualche volta può persistere fino a tre mesi (Bosu et al., 1993).
Le neoplasie ovariche sono abbastanza comuni nelle cavalle e i più osservati sono il tumore delle cellule della granulosa (2.5% di tutti i tumori equini) e il teratoma. Il primo, ecograficamente, può apparire in vari modo: uniformemente ecogeno se il tumore è solido, multiloculato se il tumore è multicistico (Figura 2.8A e 2.9)
o ipoecogeno se il tumore è composto da un’unica formazione cistica contenente fluido (Figura 2.8B). Ecograficamente non è possibile emettere diagnosi certa. Deve essere associata a anamnesi storica (la cavalla è aciclica da diversi mesi) e palpazione transrettale (generalmente l’ovaia controlaterale è atrofica). Il trattamento è la rimozione chirurgica (Blanchard et al., 2003).
A B
Figura 2.8A e B: tumori delle cellule della granulosa, A multiloculare; B monoloculare (da McCue, 2000).
Figura 2.9: immagine ecografica di ovaia (sx) con tumore delle cellule della granulosa. L’ovaia di dx risulta atrofica.
Per quanto riguarda le patologie più riscontrate nell’utero sono:
le cisti uterine, la cui diagnosi è emessa facilmente tramite esame ecografico, mono o multiloculate, originanti o dalle ghiandole uterine (con dimensioni ≤ 1 cm) o da vasi linfatici (> 1 cm). Ecograficamente si vede la presenza di formazioni vescicolari anecogene, variamente conformate, nella parete dell’utero. Non è chiaro se possono interferire con la fertilità della cavalla. Sembra che la presenza di estese e grosse cisti causano infertilità. Inoltre se sono situate a livello della biforcazione possono essere confuse con una gravidanza, e creare qualche problema soprattutto se siamo davanti ad una possibile gravidanza gemellare. Comunque le cisti sono statiche e, nell’arco di alcuni giorni, non presentano variazioni di volume (Van Camp, 1993).
La presenza di fluido nel lume uterino è frequentemente osservato in cavalle normali durante il ciclo estrale e non ha effetti sulle percentuali di gravidanza. La visione di un’eccessiva quantità di fluido o di fluido di densità e opacità aumentata è sintomo di alterazioni di vario genere. Ecograficamente il fluido uterino può assumere diverse gradazioni di grigio (tabella 2.2):
Sistema di classificazione del fluido uterino sulla base della sua ecostruttura
Grado Evidenze ecografiche Aspetto
I Bianco (iperecogeno) Denso e cremoso
II Grigio Lattescente
III Nero con punti bianchi Evidente sedimento
IV Nero (anacogeno) Fluido chiaro
Tabella 2.2: classificazione in gradi del fluido uterino sulla base della sua ecostruttura (da McKinnon et al., 1993b).
In condizioni normali il fluido dovrebbe essere ecograficamente nero e di aspetto limpido. Questo può essere valutato tramite lavaggi uterini con soluzione fisiologica o ringer lattato ed è buona pratica, nel caso che il liquido refluo appare opaco, continuare il lavaggio fino a quando non torna nuovamente limpido. Successivamente possono essere somministrati uterotonici per facilitare l’eliminazione del liquido rimasto dopo il lavaggio (McKinnon et al., 1993b; Perkins, 2004b).
Linfoangiectasia: in alcuni casi, ecograficamente, è possibile
rilevare delle immagini che mostrano a livello della parete uterina delle dilatazioni riferibili a vasi linfatici. Essi appaiono come piccoli dischi anacogeni, del diametro di pochi millimetri, situati nella porzione esterna dell’endometrio (Bruyas, 2006).
Esame citologico
L’esame citologico è un’importante strumento per valutare lo stato infiammatorio dell’utero e la presenza o meno di neutrofili, batteri o altri microrganismi (Roszel et al., 1988; Blanchard et al., 2003).
Premessa importante è quella di utilizzare del materiale sterile protetto a sua volta da guaine sanitarie, in modo da prevenire la raccolta di materiale vaginale e cervicale, evitando così la contaminazione accidentale e l’ottenimento di falsi positivi (Brook, 1993; Perkins, 2004a). Inoltre la regione perineale deve essere preparata come nel caso di inseminazione artificiale o embryo transfer (Card, 2005).
Diversi sono i metodi per ottenere un campione da analizzare. Se si usa un tampone semplice, lo si deve proteggere all’interno del palmo della mano. Meglio sarebbe utilizzare un tampone con doppia guaina protettiva, una interna e una esterna. Lo strumento è introdotto in utero
e la guaina interna è spinta attraverso la guaina esterna. A questo punto, aiutandosi con la mano che si trova in vagina, gli si fanno compiere movimenti rotatori, spingendolo contemporaneamente avanti e indietro, in modo da ottenere materiale cellulare da varie parti dell’utero. Il tampone poi è retratto nella guaina interna che a sua volta ritorna dentro la seconda guaina. Il campione così ottenuto viene rotato su un vetrino sterile, colorato (es: Diff-Quik) e osservato al microscopio ottico (Card, 2005).
Un altro metodo è quello del lavaggio uterino. Con una pipetta da inseminazione si introducono in utero 60 mL di PBS (Figura 2.10) (Phosphate Buffered Saline). Dopo aver massaggiato l’utero si procede alla sua aspirazione. Il liquido raccolto è inserito in una provetta e centrifugato (400x g per 10’). Il sedimento viene ridiluito in 1 mL di medium e colorato, previa asciugatura, su dei vetrini sterili (Brook, 1993; Card, 2005). Anche in questo caso possono essere utilizzati dei cateteri da flush uterino con sistema protettivo per garantire una maggior attendibilità all’esame (Brook, 1993).
Figura 2.10: esempio di lavaggio uterino per prelevare un campione su cui eseguire l’esame citologico. Aiutandosi con l’indice si introduce il catetere in utero (da Betsch 2004a).
Ci sono differenti opinioni sul periodo in cui effettuare i campionamenti. Alcuni suggeriscono l’inizio dell’estro, altri preferiscono il momento in