Capitolo 2
Processi di abbattimento
e/o recupero del Cromo:
stato dell’arte
2.1
Concentrazioni tipiche del Cromo negli
scarichi industriali
Il cromo esavalente, come gli altri metalli (Cd, Cu, Fe, Pb, Hg, Ni, Zn), è presente negli effluenti industriali in un ampio range di concentrazioni le quali variano da caso a caso a seconda dello specifico processo produttivo. Tuttavia, si può fare una distinzione tra livelli di concentrazione: “bassa”, “tipica” ed “alta”. La Tabella.2. 1 mostra questa distinzione e riporta i valori frequentemente ritrovati negli scarichi [4].
Tabella.2. 1 Concentrazione dei metalli nelle acque industriali [4].
Concentrazione mg/l
Metallo bassa Tipica alta
Arsenico 0.5 10 1000 Cadmio 1.0 25 5000 Cromo(VI) 1.0 50 100000 Rame 1.0 25 7500 Ferro 5.0 50 5000 Piombo 0.5 10 900 Mercurio 0.005 1.0 2000 Nickel 5.0 50 900 Zinco 5.0 50 3000 Le tecnologie convenzionali sono normalmente studiate per abbattere valori di concentrazioni tipiche. Qualora le concentrazioni delle acque di scarico siano estremamente basse, le normative riguardanti gli scarichi siano molto restrittive o vi siano problemi di altra natura che complicano la situazione, bisogna ricorrere ad un processo di trattamento atipico e studiato appositamente [4].
2.2
Tecnologie convenzionali di abbattimento
Per quanto concerne il Cromo esavalente, le tecnologie convenzionali di abbattimento e/o recupero applicate dall’industria sono sostanzialmente di tre tipi [4]:
Riduzione chimica e successiva precipitazione come idrossido di cromo(III).
Trattamenti con resine a scambio ionico. Recupero evaporativo.
Queste tecnologie non si escludono mutuamente, ma trovano spazio nello stesso stabilimento laddove si tende a realizzare processi di produzione a “circuito” chiuso che tendono idealmente ad un livello zero di emissioni. La riduzione chimica è un metodo pratico, affidabile e consolidato per l’abbattimento del cromo. I trattamenti a scambio ionico permettono livelli di concentrazione in uscita molto bassi e il recupero del cromo in fase di rigenerazione. Il recupero evaporativo diminuisce sensibilmente i volumi delle correnti scaricate dall’impianto.
2.3 Riduzione
chimica
La riduzione chimica è la tecnologia più utilizzata per l’abbattimento del cromo esavalente nelle correnti di scarico industriali. Gli scarichi contenenti cromo esavalente sono trattati col metodo della riduzione chimica da molte industrie galvaniche e di finitura dei metalli. Gli scarichi finali di questi stabilimenti hanno concentrazioni in cromo esavalente che vanno da 5 a 500 mg/l. Si tratta per lo più correnti provenienti da processi di lavaggio seguenti alle operazioni di cromatura elettrolitica. Spesso in tali correnti sono presenti anche cianuri [5].
Anche le industrie conciarie, che prevedono operazioni di concia al cromo, sfruttano questa tecnologia per abbattere i residui di acido cromico presenti nelle acque di scarico e di lavaggio [5].
Questa tecnologia è unicamente volta all’abbattimento del cromo in soluzione e non ne permette il recupero. Se si devono trattare grandi portate di scarico contenenti apprezzabili quantità di cromati, diviene conveniente utilizzare trattamenti di scambio ionico seguiti da recupero evaporativo.
La riduzione chimica è una tecnica in cui si abbassa lo stato di ossidazione di uno ione metallico presente in soluzione, convertendolo in una forma meno tossica, facilmente precipitabile e più facilmente gestibile.
In particolare, il cromo esavalente (s.o. +6), molto solubile e tossico si riduce a cromo trivalente (s.o. +3) meno tossico ed insolubile in forma di idrossido.
I vantaggi nell’utilizzo di questa tecnica sono la versatilità, che permette di adattarsi a qualsiasi condizione operativa e la semplicità, che comporta costi di impianto relativamente bassi. Gli svantaggi sono la produzione di fanghi chimici che vanno smaltiti o trattati, e il consumo costante di reagenti.
Una reazione di ossidoriduzione è una reazione in cui si ha il trasferimento di elettroni da una sostanza ad un’altra. L’agente riducente è il donatore di elettroni, mentre l’agente ossidante è l’accettore di elettroni.
La reazione si può scrivere come
A(riducente) + B(ossidante) ↔ A(ossidato) + B(ridotto)
Ovvero scrivendo le due semireazioni
A(riducente) → A(ossidato) + ne -B(ossidante) + ne- ← B(ridotto)
Il potenziale di reazione, o potenziale redox, è l’espressione, in termini di potenziale, della variazione dell’energia libera tra reagenti e prodotti della reazione di ossidoriduzione ed è descritto dalla ben nota equazione di Nerst.
E = E° - (RT/nF) lnQ
Con: E° = - ∆G°/nF potenziale redox in condizioni standard. N = numero di elettroni scambiati.
F = 96485 C/mole costante di Faraday. Q = quoziente di reazione.
T = temperatura assoluta in K. R = costante dei gas ideali.
Una reazione di ossidoriduzione avviene in maniera spontanea se, ad essa, è associata una variazione di energia libera ∆G < 0 ovvero se E > 0.
Non ci sono regole del tutto generali per predire la velocità di reazione, dato che i fattori controllanti sono diversi. Tuttavia, una regola di uso comune è che reazioni redox in cui avviene lo scambio di un elettrone e il cui potenziale redox è positivo, per valori superiori a 0.6V, procede velocemente [4].
Nel processo di riduzione chimica è necessario l’aggiustamento del pH della soluzione da trattare. Ad esempio, se si usa come riducente l’anidride solforosa, il pH va aggiustato tra 2 e 3 ai fini di favorire la reazione. L’aggiustamento del pH viene fatto con un acido appropriato, per esempio l’acido solforico. Di seguito si aggiunge l’agente riducente. Occorre tenere ben miscelato il sistema per favorire il contatto tra i reagenti aggiunti e il metallo presente nelle acque di scarico.
Il tempo di reazione varia a seconda del tipo di scarico, dell’agente riducente, della temperatura, del pH e della concentrazione. Per operazioni di trattamento del cromo esavalente su scala industriale, i tempi di reazione sono dell’ordine dei minuti. Normalmente si prolungano i tempi di ritenzione per assicurare il completo miscelamento e la completa riduzione.
Una volta reagita, la soluzione ridotta è generalmente assoggettata a qualche tipo di trattamento per la decantazione o la precipitazione del materiale ridotto. Occorre, inoltre, un trattamento per eliminare o recuperare il riducente non reagito e quello ossidatosi. Gli idruri dei metalli alcalini sono decomposti per aggiunta di piccole quantità di acido. Il pH del mezzo di reazione è tipicamente aumentato fino a che il materiale ridotto precipita. La separazione del precipitato viene fatta con filtri o chiarificatori [5]. La reazione chimica nel trattamento di cromo esavalente con anidride solforosa e successiva precipitazione con calce è la seguente:
riduzione
SO2 + H2O → H2SO3
2 H2CrO4 + 3 H2SO3 → Cr2(SO4)3 + 5 H2O
precipitazione
Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)2 + 3 CaSO4
I riducenti più usati sono anidride solforosa, sali solfitici (bisolfito, metabisolfito, idrosolfito di sodio), solfato di ferro e boroidruro di sodio [5]. Gli alcalinizzanti più usati sono la calce o il bicarbonato di sodio. Il dosaggio dei vari riducenti dipende dalla particolare natura dello scarico. Nella fase di precipitazione spesso si introducono quantità opportune di agenti coagulanti e flocculanti che favoriscono l’aggregazione degli idrossidi e rendono più rapido il processo di decantazione. Le apparecchiature necessarie in un impianto di trattamento che sfrutta il processo di riduzione chimica sono relativamente semplici. Occorrono serbatoi di stoccaggio, dosatori dei reagenti, miscelatori, misuratori di pH e di potenziale redox, pompe. Inoltre occorrono decantatori, chiarificatori,
filtropresse ed eventualmente essiccatori per ridurre il volume dei fanghi [4]. Nell’utilizzo di questo tipo di processo si ha l’introduzione, nella soluzione da trattare, di sostanze estranee (reagenti e prodotti di reazione) i quali, nel caso in cui superino i valori di emissione previsti dalla legge, vanno eliminati con ulteriori trattamenti. I fanghi chimici prodotti in fase di precipitazione vanno filtrati, pressati, essiccati e smaltiti in discarica, qualora non sia economicamente conveniente trattarli per il recupero delle sostanze in essi presenti [5].
2.3.1 Esempi applicativi della riduzione chimica
In un’industria di produzione di automobili in cui è presente una linea di cromatura elettrolitica, si producono scarichi provenienti da linee di lavaggio post cromatura dei pezzi. In aggiunta vi sono correnti contenenti cromati che provengono dal blowdown delle torri di raffreddamento. Per il trattamento, prima dello scarico, si utilizza la tecnica della riduzione chimica. Il riducente utilizzato è SO2 in presenza di H2SO4 a pH 2.5. La
concentrazione di ingresso dello scarico è 8.75 mg/l di Cr(VI) che viene portata, dopo riduzione e precipitazione, a 0.03mg/l (con abbattimento percentuale del 99,7%) [4].
In una industria galvanica gli scarichi provenienti dal lavaggio delle vasche contenenti i bagni di elettrodeposizione sono caratterizzati da una concentrazione di 140 mg/l di Cr(VI). In questo caso il riducente utilizzato è il bisolfito di sodio a pH 2.8. La concentrazione dopo il trattamento mediante riduzione risulta essere di 0.7 – 1 mg/l (con abbattimento percentuale del 99,3%) [4].
Un’altra industria galvanica con il metodo al bisolfito raggiunge concentrazioni di Cr(VI) di 0.1mg/l a partire da scarichi con concentrazioni superiori a 688 (con abbattimento percentuale del 99,9%) mg/l [4]. Come si evince dai dati riportati in letteratura le concentrazioni degli scarichi variano in un ampio range, ma il sistema rimane comunque efficace.
Occorre fare alcune precisazioni riguardo all’utilizzo del bisolfito nei trattamenti di riduzione, infatti questo può causare problemi di cattivi odori e pericolo di corrosione dell’ambiente operativo. D’altra parte l’anidride solforosa è un gas tossico e può causare problemi di sicurezza in caso di rilascio accidentale da una perdita in una tubazione.
Alcuni autori [6] propongono l’utilizzo, come agente riducente, di scaglie di ferro. Questo riduce il consumo di reagente e di fanghi prodotti e non comporta problemi di sicurezza. Utilizzando il ferro metallico al posto del Fe(II), il rapporto stechiometrico del ferro col cromo è di 1:1 anziché di 3:1. Naturalmente il processo diventa economicamente vantaggioso laddove questo tipo di reagente esiste in abbondanza. Ad esempio, nelle industrie di finitura dei metalli, i pezzi, prima di essere sottoposti ad operazioni di cromatura, vengono modificati attraverso processi meccanici di limatura, tornitura, alesatura, ecc.; queste operazioni meccaniche rendono disponibili il ferro, in forma di scaglie, che può essere riutilizzato, o usato come riducente nel trattamento degli scarichi provenienti dai bagni di elettrodeposizione. In modo analogo alle scaglie di ferro possono essere utilizzate scaglie di alluminio o polvere di zinco metallico [4]
2.3.2 Esempio di impianto al bisolfito
Si riporta, a titolo di esempio, un impianto (Figura 2. 1 [7]) di depurazione specifico per l’abbattimento di metalli pesanti in soluzione, tra cui il Cr(VI) progettato e realizzato dalla GM impianti S.R.L. L’impianto è progettato per trattare in discontinuo una portata di 1 m3/h di scarichi provenienti da processi di elettrodeposizione contenenti piombo, cianuri, sali metallici come ferro nickel e zinco, cromati. La corrente effluente dal trattamento rientra nelle specifiche imposte dalla normativa [7].
Figura 2. 1 Impianto di abbattimento di metalli pesanti [7].
Descrizione dell’impianto
Le acque reflue vengono convogliate in una vasca di raccolta costruita in materiale antiacido (P.V.C.) e poi inviate, mediante una pompa centrifuga, all'impianto di depurazione. Il funzionamento automatico della pompa è condizionato da un interruttore di livello installato nella vasca di raccolta. Le acque provenienti dalla vasca di raccolta vengono inviate al flocculatore. Raggiunto il massimo livello, per mezzo di apparecchiature
elettriche, viene interrotta l'erogazione della pompa di carico e viene dato inizio al ciclo di lavorazione. Un regolatore di pH aziona l'immissione di calce idrata tramite una pompa dosatrice e ne interrompe il funzionamento a pH stabilito (8 - 9), contemporaneamente vengono messe in funzione le soffianti di miscelazione, le pompe dosatrici del flocculante e del polielettrolita, tramite interruttori temporizzati. Il tempo di questo ciclo di lavorazione è in funzione del quantitativo di acido presente nell'acqua ed è compreso tra 20 e 30 min. A ciclo ultimato si apre automaticamente la valvola di scarico, collegata internamente da un tubo flessibile, che preleva l'acqua di sfioro tramite un galleggiante. L'acqua viene inviata ad un chiarificatore statico e successivamente viene filtrata su un filtro a carta e inviata allo scarico. Raggiunto il minimo livello, nel flocculatore, si chiude automaticamente la valvola di scarico. La pompa della vasca di raccolta si rimette in funzione per un successivo ciclo di lavorazione. I fanghi raccolti vengono inviati ad un filtro ispessitore, mediante il quale si toglie l'acqua, in modo da rendere i fanghi palabili.
L'impianto, variando gli additivi chimici e le sequenze elettriche, viene impiegato per processi di decianurizzazione, decromatazione, neutralizzazione, depurazione di scarichi contenenti sali metallici [7].
Decromatazione
I composti di cromo esavalente contenuti nelle correnti da trattare vengono ridotti a cromo trivalente mediante acidificazione a pH < 3 e immissione di bisolfito sodico. Dopo la riduzione a cromo trivalente si fa precipitare il cromo come idrato aggiungendo degli alcali [7].
I consumi teorici per abbattere 1 kg di Cr in soluzione, nel caso si utilizzi acido solforico come agente acidificante e bisolfito di sodio come riducente sono pari a:
H2SO4 = 0,74 kg
Na HSO3 = 1 ,56 kg
In Tabella.2. 2 si riportano i valori della produzione di fanghi chimici nelle operazioni di riduzione e precipitazione corrispondenti a diverse coppie di reagenti utilizzati [7].
Tabella.2. 2 Produzione di fanghi nel processo di abbattimento [7].
Reagenti di riduzione
Reagenti di neutralizzazione
Fanghi prodotti per kg di Cr abbattuto
FeSO4 CaO 12,4 kg
FeSO4 NaOH 4,2 kg
NaHSO3 CaO 4,0 kg
NaHSO3 NaOH 1,1 kg
Precipitazione degli idrossidi dei metalli pesanti in soluzione
In Tabella.2. 3 si riporta il consumo teorico di alcali per far precipitare i metalli pesanti presenti in soluzione [7].
Tabella.2. 3 Consumo teorico di alcali in grammi, per sedire 100 g di metalli pesanti [7]. Metalli da rimuovere Alcali Fe2 Fe3 Cu Ni Cr Zn Ca(OH)2 134 201 116 126 213 114 NaOH 144 216 126 136 231 122 Na2CO3 190 285 168 181 307 162 CaO 100 150 88 96 162 86 MgO 73 110 63 69 117 62 Mg(OH)2 105 158 92 100 169 90
Neutralizzazione
Le acque di scarico acide vengono neutralizzate con NaOH o con Ca(OH)2. Le acque di scarico alcaline vengono neutralizzate con HCl o con
H2SO4. In Tabella.2. 4 si riportano i consumi teorici degli agenti
neutralizzanti [7].
Tabella.2. 4 Consumo teorico di alcali in grammi per neutralizzare 100 g di acido [7]. Acidi da neutralizzare Alcali H2SO HCI HNO3 Ca(OH)2 76 101 59 CaCO3 103 137 80 NaOH 82 110 39 Na2CO3 108 146 84 CaO 57 77 44 MgO 41 55 32 Mg(OH)2 59 80 46
2.3.3 Esempio di impianto di elettroflocculazione
Un altro impianto di trattamento basato sulla riduzione del Cr(VI) a Cr(III) è l’mpianto di elettroflocculazione tipo ECO 2000 (Figura 2. 2).
Figura 2. 2 Impianto di elettroflocculazione [8].
La Ecoteam propone un impianto in cui si ha riduzione elettrochimica del cromo (VI) [8].
Il sistema funziona secondo il principio che un potenziale applicato ad una soluzione acquosa può favorire e/o accelerare processi di ossido-riduzione delle sostanze contenute in essa. A seconda dei potenziali in gioco si possono sviluppare al catodo o all’anodo microbolle di idrogeno o ossigeno. Queste microbolle di gas insolubili, di dimensioni estremamente ridotte (< 10-2 mm), per differenza di peso specifico, nei confronti del liquido da trattare, tendono a risalire verso la superficie della cella
trascinando tutte le sostanze presenti in sospensione, gli idrocarburi, i colloidi etc., provocando già in questa fase una chiarificazione dei liquidi trattati (flottazione).
Se gli anodi sono solubili, ad esempio realizzati in Alluminio, Magnesio oppure in Ferro, il passaggio di corrente attraverso di essi provoca la loro dissoluzione secondo le seguenti reazioni:
(-) Catodo 2 H 2O + 2 e - ↔ H 2 + 2 OH -(+) Anodo Fe ↔ Fe 3+ + 3 e -Oppure (+) Anodo Al ↔ Al 3 + + 3e -Oppure (+) Anodo Mg ↔ Mg + + + 2e
-Il pH nel reattore viene regolato in ingresso ad un valore compreso tra 6,5 < pH < 9 e si ha quindi la immediata formazione degli idrossidi corrispondenti, per reazione con i gruppi ossidrili OH-. Inoltre la riduzione dell’acqua al catodo mantiene inalterata l’alcalinità anche dopo la precipitazione degli idrossidi, permettendo notevole risparmio di prodotto alcalinizzante NaOH oppure Ca(OH)2.
Fe3+ + 3 (OH)- ↔ Fe(OH) 3
Mg2+ + 2 (OH)- ↔ Mg(OH) 2
Al3+ + 3 (OH)- ↔ Al(OH) 3
Questo fenomeno elettrochimico si chiama elettrocoagulazione. In sintesi, l'elettrocoagulazione garantisce la formazione degli idrossidi di tutti
gli ioni metallici presenti, (non solo degli elettrodi) sotto forma di fiocco fangoso il quale, successivamente, viene recuperato per decantazione o flottazione, a seconda del tipo di applicazione [8].
Figura 2. 3 Celle di riduzione elettrolitica [8].
Il fenomeno più interessante che si verifica all’interno della cella (Figura 2. 3) è rappresentato dalla ossidazione o riduzione delle sostanze presenti nell’acqua, contemporaneamente alla ossidazione o riduzione dell’acqua stessa, come mostrato in precedenza. Ad esempio in una industria galvanica dove avviene un processo di Zincatura elettrolitica con passivazioni cromiche, oppure un processo di Cromatura elettrolitica, tutte le acque (in assenza di cianuri tolti preventivamente) affluiscono nel reattore elettrochimico, dove avvengono le seguenti reazioni [8]:
(-) Catodo 2H2O + 2e- ↔ H2 + 2(OH)
-Conseguentemente l’idrogeno sviluppato produce la seguente reazione
-provocando la riduzione del Cromo da esavalente a trivalente in ambiente alcalino, senza aggiunta di prodotti chimici e risparmiando quindi, rispetto al tradizionale sistemi depurativo, acido solforico, bisolfito di sodio, idrossido di sodio che impedirebbero il riutilizzo delle acque depurate per aumento di salinità [8]. Utilizzando un anodo in Ferro si ha dissoluzione di ione Fe3+, il quale si lega anch’esso agli ossidrili formando, come già detto, idrossido di Ferro che ha effetto coagulante nei confronti degli altri idrossidi metallici. La presenza diffusa dello ione Fe3+ in ogni parte della cella e la contemporanea formazione degli idrossidi di ferro e degli altri metalli aumenta enormemente il rendimento del sistema. L’effetto di campo elettrico inoltre, è tale da provocare la frantumazione delle grosse molecole organiche dei composti etossilati (tensioattivi non ionici) in frazioni a peso molecolare più basso, demolendo il tensioattivo come principio attivo e più in generale ottenendo anche una riduzione del C.O.D.. Questo sistema si applica perfettamente anche su liquidi contenenti fosfati. Infatti nel reattore ECO 2000 si può ottenere la formazione di FePO4 o AlPO4 che possono essere poi eliminati in una successiva fase di
Schema semplificato dell’impianto
Figura 2. 4 Schema dell’impianto [8].
In Figura 2. 4 è riportato lo schema a blocchi dell’impianto di elettroflocculazione. La sezione di neutralizzazione finale si rende necessaria solo nei casi in cui il valore ottimale del pH di precipitazione degli idrossidi dei metalli presenti (Cu, Ni, ecc.) risulti superiore a 9 / 9,5. La filtrazione su letti di carbone attivo si rende necessaria solo nei casi in cui i valori di tensioattivi e/o COD presenti siano molto elevati. La resina selettiva è facoltativa in quanto il raggiungimento dei valori fissati dal D.L. n°152 dell’11/05/1999, Allegato 5, Tab.3 per i metalli presenti si ottiene
già in uscita dal filtro a quarzite [8]. Considerazioni di opportunità per una maggiore sicurezza, per la certezza del mantenimento nel tempo di certi risultati di depurazione anche in presenza di particolari eventi o guasti, possono consigliare o meno l’installazione delle citate sezioni. In questi casi comunque il costo di gestione delle sezioni finali sarà estremamente ridotto in quanto ad esse è affidata solamente l’emergenza. Il sistema di trattamento elettrochimico, denominato commercialmente ECO 2000, offre eccellenti risultati su tutti i tipi di scarichi ove siano presenti soprattutto sostanze colloidali e/o sostanze in sospensione in genere (per effetto della flottazione), dove vi sia presenza di metalli pesanti di tutti i tipi in soluzione, compreso eventuali metalli complessati (per effetto della flocculazione) [8]. Nel corso degli ultimi anni sono stati realizzati impianti completi con il nuovo sistema di trattamento basato sull’elettrofloculazione, in vari settori galvanici e non. Gli impianti realizzati hanno portate comprese tra 0.5 e 20 m3/h con riutilizzo dal 30 al 80% dell’acqua utilizzata [8]. I principali vantaggi di questo impianto sono:
• Risultati di abbattimento generalmente superiori almeno del 25% rispetto al tradizionale metodo di precipitazione chimica.
• Utilizzo ridotto di prodotti coagulanti, flocculanti, acidi e basi.
• Produzione di fanghi ridotta in media del 40% rispetto ai sistemi tradizionali.
• Riduzione del C.O.D., del B.O.D. e dei tensioattivi.
• Eliminazione diretta del Cr (VI) senza installazione di apposito reattore.
• Abbattimento dei fosfati senza utilizzo di calce . • Ossidazione dei Nitriti e dei Solfiti a Nitrati e Solfati. • Costi di gestione in generale ridotti in media del 50% • Possibilità di riciclare una parte di acque trattate.
2.4
Trattamenti con resine a scambio ionico
Questa tecnologia è utilizzata specialmente per l’addolcimento delle acque; tuttavia ha una discreta applicazione anche nel controllo delle emissioni dei metalli pesanti. Può essere impiegata sia come trattamento terziario di un effluente prima dello scarico, sia come metodo di recupero dell’inquinante. Un esempio tipico è proprio il recupero del cromato dai bagni di elettrodeposizione esausti nell’industria galvanica.
Il vantaggio principale di questa tecnologia risiede nella possibilità di recuperare i prodotti contenuti nelle correnti trattate. Gli impianti basati sulla tecnologia di scambio ionico sono semplici da gestire, funzionano su richiesta, smorzano bene variazioni di concentrazione delle correnti in ingresso, hanno altissime efficienze di abbattimento. Inoltre sul mercato è presente una grande varietà di resine specifiche per ogni tipo di applicazione di depurazione civile ed industriale.
Per contro i costi d’impianto sono molto elevati. Le correnti da trattare devono rispondere a specifiche ben precise: devono contenere un basso livello di solidi sospesi, non possono contenere sostanze sporcanti. Tali sostanze possono intasare i pori dei grani della resina, facendo diminuire drasticamente l’efficienza di abbattimento. Infine i letti di resine a scambio ionico devono essere rigenerati una volta che siano esauriti. Questo comporta un consumo di agente rigenerante, nonché la necessità di trattare le correnti eluite in fase di rigenerazione.
2.4.1 Scambiatori ionici
Molti materiali, organici e inorganici, esibiscono proprietà di scambio ionico. Questi materiali possono essere sia naturali che sintetici ed hanno tutti una proprietà in comune, sono elettroliti solidi insolubili. Tali elettroliti hanno un gruppo ionico fisso bilanciato da un controione di carica opposta che garantisce l’elettroneutralità. Il controione è lo ione che viene scambiato con quello in soluzione.
Nell’applicazione industriale è predominante l’utilizzo di resine a scambio ionico sintetiche. Queste, infatti, sono più economiche e possono essere fabbricate con caratteristiche chimico fisiche specifiche che si adattino ad un particolare processo. Nel caso specifico del trattamento di acque di scarico industriali contenenti cromati, occorrono materiali con alta resistenza all’aggressione chimica e buone proprietà termomeccaniche.
Materiali naturali organici come cellulosa, acido alginico, chitina e chitosano, pur esibendo buone capacità di scambio ionico deficitano di resistenza termomeccanica e sono soggetti a biodegradazione, motivo per il quale non trovano applicazione in campo industriale [9].
Materiali inorganici naturali come zeoliti naturali e minerali argillosi sono scambiatori ionici. Sono costituiti principalmente da alluminosilicati e sono caratterizzati da strutture cristalline in cui le unità tetraedriche di SiO4
e AlO4 sono collegate da atomi di ossigeno. Questo tipo di struttura
tridimensionale ha dei piccoli pori nei quali sono presenti ioni mobili che danno vita allo scambio ionico. Gli atomi di silicio sono tetravalenti e quelli di alluminio sono trivalenti perciò, questi ultimi, risultano caricati negativamente. Ad ogni mole di alluminio è associata una mole equivalente di controione disponibile allo scambio.
Vi sono anche materiali inorganici sintetici come le zeoliti sintetiche i sali acidi di metalli polivalenti, gli esacianoferrati. Questi materiali sono
molto costosi e non vengono impiegati nel trattamento di acque industriali contenenti cromo poiché si dispone delle resine, economicamente più convenienti. Esaferrocianati, idrossiapatiti e titanati modificati sono stati studiati perché hanno un ottima resistenza alla decomposizione in presenza di radiazioni ionizzanti e resistono alle alte temperature [9]. Trovano dunque impiego nel trattamento di rifiuti nucleari per la separazione selettiva di Sr, Cs e Ag da rifiuti nucleari [9].
Tutti questi materiali sono oggetto di studio da parte della comunità scientifica ma attualmente non trovano applicazione pratica nell’ambito dei processi di trattamento di effluenti contenenti cromo (VI), essendo la tecnica basata sulle resine sintetiche ormai assodata e tecnologicamente sviluppata.
2.4.2 Resine a scambio ionico sintetiche
Una resina a scambio ionico organica è composta da polielettroliti ad alto peso molecolare che scambiano il loro ione mobile con quello di stessa carica presente nel mezzo di contatto. Ogni tipo di resina ha un suo specifico numero di siti ionici che stabilisce la quantità massima di scambio per unità di peso della resina. Le resine a scambio ionico possono essere a scambio di cationi, aventi ioni mobili di carica positiva, e a scambio di anioni, aventi ioni mobili di carica negativa. Ambedue i tipi di resine sono generalmente prodotte a partire dallo stesso polimero organico di base. Si differenziano solo nel gruppo ionizzabile attaccato alle catene di idrocarburi. Questo gruppo funzionale determina il comportamento chimico della resina [10].
Lo scheletro idrocarburico della maggior parte delle resine sintetiche è prodotto attraverso copolimerizzazione dello stirene e del divinilbenzene. Lo stirene (80 – 92%) provvede a costituire la matrice di base della resina, il divinilbenzene (8 – 20%) è utilizzato come cross-linker per garantire alla resina insolubilità e stabilità [10]. Per produrre le varie tipologie di resine anioniche e cationiche, la struttura plastica viene funzionalizzata per reazione con acidi o basi. In Figura 2. 5 [10] si riporta la struttura molecolare tipica di una resina sintetica.
Figura 2. 5 Copolimero stirene-divinilbenzene X=gruppo ionico [10].
Vi sono cinque tipi fondamentali di resine [9]:
1) resine cationiche acide forti, chiamate così perché il loro comportamento chimico è simile a quello di un acido forte. Queste resine hanno come gruppi funzionali solfonici R–SO3H e solfonati
R–SO3Na e sono altamente ionizzate in ogni range di pH.
2) Resine cationiche acide deboli, in cui il gruppo funzionale è un acido carbossilico –COOH. Queste resine si comportano come un acido organico debole, debolmente dissociato.
3) Resine anioniche basiche forti che, come le acide forti, sono altamente ionizzate e possono essere utilizzate in ogni range di pH. Sono funzionalizzate con gruppi di ammonio quaternario.
4) Resine anioniche basiche deboli, i cui gruppi funzionali sono ammine primarie secondarie o terziarie, in cui il grado di ionizzazione è influenzato molto dal pH.
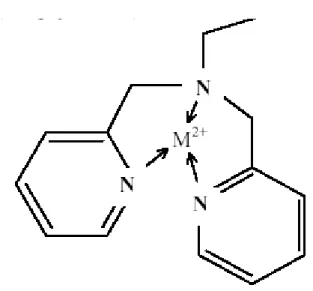
5) Resine chelanti, selettive verso i metalli pesanti. Queste resine si comportano come resine cationiche acide deboli, ma mostrano un alto grado di selettività verso i metalli pesanti in forma di cationi. Le resine chelanti tendono a formare complessi stabili con i metalli ed i legami che si vengo a formare tra lo ione metallico e il materiale adsorbente hanno caratteristiche sia ionici che covalenti. Un esempio di resina chelante è la picolilammina. In Figura 2. 6 è mostrata l’azione chelante della resina verso un generico catione metallico divalente. In pratica le resine chelanti non vengono utilizzate nel trattamento degli scarichi industriali per diverse ragioni. Le resine chelanti sono molto più costose delle resine convenzionale. Inoltre necessitano di tempi di contatto più lunghi a causa della presenza di reazioni di complessazione. Questo impone volumi maggiori dei letti rispetto a quelli delle resine convenzionali [9].
Le proprietà che caratterizzano una resina a scambio ionico sono capacità, dimensione delle particelle e stabilità.
La capacità è la quantità massima di controioni che la resina può scambiare. La capacità totale corrisponde al numero di gruppi funzionali presenti nella resina. Nel caso delle resine stirene-divinilbenzene i gruppi funzionali sono aggraffati agli anelli dello stirene, perciò, una resina con un basso grado di cross-linking, può avere una concentrazione teorica di gruppi funzionali di 9 mmol/g. Normalmente le resine commerciali hanno una concentrazione di gruppi funzionali di 2,5 – 5 mmol/g [9].
La capacità effettiva è quella parte della capacità totale che viene effettivamente utilizzata durante il processo ed è dipendente dalle condizioni operative.
La dimensione delle particelle influenza tempi di scambio e perdite di carico. Il tempo di diffusione all’interno di una particella di resina, da parte delle specie ioniche presenti in soluzione, aumenta all’aumentare del raggio. Un diametro di particella piccolo garantisce una rapida diffusione all’interno del granulo di resina, ma ingenera grandi perdite di carico che impongono alte prevalenze per pompare l’effluente attraverso il letto. Occorre perciò, in fase di dimensionamento, trovare il giusto compromesso.
La stabilità della resina, sotto certe condizioni chimiche e fisiche, è fondamentale nell’applicazione delle tecniche di scambio ionico. Lo stress fisico, come l’eccessivo rigonfiamento osmotico o gli incrementi di temperatura nonché la semplice usura meccanica nel caso di letti mobili, può cambiare la struttura della resina guastandone le proprietà. Un attacco chimico può rompere la struttura dei polimeri o modificare i gruppi funzionali. La presenza di colloidi e sporco in soluzione può provocare intasamento [9]. Per un ampia rassegna di resine a scambio ionico si rimanda ai testi di riferimento [10, 11].
2.4.3 Meccanismo di scambio ionico
La scambio ionico è una reazione chimica reversibile e stechiometrica che avviene tra gli ioni presenti in soluzione ed i gruppi funzionali presenti nella resina. Tale scambio avviene secondo i seguenti stadi:
1. diffusione degli ioni dal Bulk della soluzione alla superficie della particella di resina.
2. Diffusione attraverso il film esterno alla particella.
3. Diffusione all’interno della particella sino al sito di scambio. 4. Reazione di scambio ionico sul sito di scambio.
5. Contro diffusione dello ione scambiato dalla resina al bulk della soluzione.
Il tasso di scambio può risultare determinato da uno di questi stadi, o può essere controllato dalla combinazione dei diversi meccanismi. In realtà Helferric [11] ritiene controllanti solo i meccanismi di diffusione attraverso il film esterno e all’interno della particella. La diffusione dal bulk è generalmente trascurabile, mentre la reazione di scambio ionico diviene controllante solo nel caso di resine chelanti.
Helferric propone il parametro
(
A)
B CDr D X δ α 2 5 0 + (dove X = concentrazione dei gruppi ionici fissi nella resina. C = concentrazione della soluzione in equivalenti. Ď = Diffusività dello ione mobile nella resina. D = Diffusività dello ione mobile attraverso il film. r0 = raggio della particella.
δ = spessore del film.
per determinare il meccanismo controllante. Se
(
A)
B CDr D X δ α 2 5 0 + (<< 1 il meccanismo che controlla il tasso di scambio è la diffusione all’interno della particella.
In questo caso il tempo medio di diffusione è dato da
D r t 2 0 2 / 1 ∝ . Se
(
A)
B CDr D X δ α 2 5 0 + (>> 1 il meccanismo che controlla il tasso di scambio è la diffusione attraverso il film esterno alla particella.
In questo caso il tempo medio di diffusione è dato da
C D C r t ( δ 0 2 / 1 ∝ .
Per valori intermedi del parametro il tasso di scambio è controllato da ambedue i meccanismi e si hanno relazioni più complesse [11].
In Tabella.2. 5 si riportano i fattori che influenzano la cinetica di scambio ionico nel caso dei due meccanismi controllanti.
Tabella.2. 5 Dipendenza del tasso di scambio ionico dalle condizioni sperimentali [11].
Meccanismo Controllante
Fattore Diffusione nella particella Diffusione nel film
Mobilità del controione nella
resina ∝ Ď Nessun effetto
Mobilità del controione nella
soluzione Nessun effetto ∝ D Mobilità del coione nella
soluzione Nessun effetto Nessun effetto Capacità della resina Nessun effetto ∝ 1/X Natura del gruppo fisso tende ad associarsi col controione Lento quando il gruppo fisso Nessun effetto Grado di cross-linking Decresce con il grado di cross-linking Nessun effetto
Selettività della resina Il controione preferito dalla resina è preso con un tasso più veloce di scambio e rilasciato più lentamente Concentrazione della soluzione Nessun effetto ∝ C
Volume della soluzione Decresce col crescere del volume della soluzione
Temperatura Cresce con la temperatura dal 4 all’8% per °C Cresce con la temperatura dal 3 al 5% per °C Tasso di agitazione o portata Nessun effetto Cresce con l’agitazione o la portata
Il grado di scambio della resina dipende principalmente dalla affinità con i vari ioni presenti in soluzione; questa affinità è detta “selettività” della resina. L’equilibrio di scambio ionico può essere espresso in termini di coefficiente di selettività K espresso, per ioni della stessa valenza, come:
[ ] [ ]
[ ] [ ]
res sol sol res b ab
a
b
a
K
− − − −⋅
⋅
=
− −Il coefficiente di selettività dipende da molti fattori come: Dimensione e carica degli ioni scambiati.
Concentrazione degli ioni in soluzione.
Natura chimico fisica della resina e degli ioni. Temperatura.
In generale, a basse concentrazioni, le resine divengono più selettive all’aumentare della valenza dello ione. Si può scrivere una scala di validità generale.
Per resine cationiche: Ra2+ > Ba2+ > Sr2+ > Ca2+ > Ni2+ > Cu2+ > Co2+ > Zn2+ > Mn2+ > UO22+ > Ag+ > Cs+ > K+ > NH4+ > Na+ > Li+.
Per resine anioniche: CrO42- > HcrO4- > ClO4- > SeO4- > SO4- > NO3- >
Br- > HPO4-, HAsO4-, SeO3- > CO3- > CN- > NO2- > Cl- > H2PO4-, H2AsO4-,
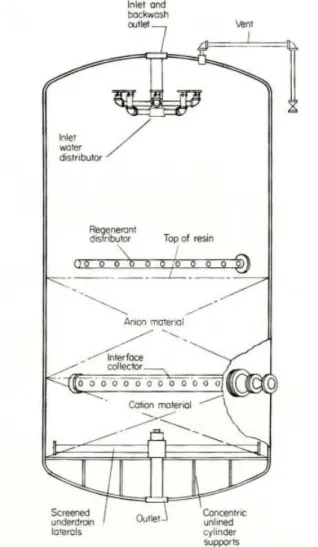
A livello impiantistico gli impianti a scambio ionico vengono realizzati mettendo a contatto le resine con le soluzioni da trattare in colonne a letto fisso, a letto fluido o a letto mobile [10]. Gli impianti a letto fisso hanno colonne in cui è disposto un letto di resina. La soluzione da trattare viene fatta percolare dall’alto attraverso il letto per garantire il giusto tempo di scambio; una volta che le resine sono sature si passa alla fase di lavaggio (generalmente con acqua). In questa fase il letto è sciacquato per eliminare l’eccesso di corrente inquinata rimasta impregnata nella resina. Nella fase di rigenerazione si inviano alla colonna soluzioni acide (per le resine a scambio cationico) o alcaline (per le resine a scambio anionico) che estraggono gli ioni metallici ripristinando la resina. In Figura 2. 7 si riporta la sezione di una unità di scambio ionico [10].
Nelle colonne a letto fluido la soluzione da trattare pompata dal basso e fluidizza il letto. Questo comporta un aumento degli spazi tra le particelle e una diminuzione dell’efficienza di contatto. Spesso però questo metodo è necessario, specialmente in casi in cui sono presenti solidi sospesi che possono provocare intasamenti negli interstizi tra le particelle.
La tecnologia a letto mobile è di recente concezione. Le resine si muovono continuamente dalla regione in cui avviene lo scambio, a quella dove avviene la rigenerazione. I vantaggi di questa tecnica sono l’alta efficienza di rigenerazione che riduce i costi operativi in termini di soluzioni rigeneranti, delle resine stesse, di risparmio di spazio. Gli svantaggi sono la complessità e il costo dei controlli meccanici, l’eccessivo attrito che degrada le resine. Nella seguente tabella si riportano le principali caratteristiche di una resina a scambio di anioni della IONAC® tipo A365 utilizzata per depurare acque di risciacquo provenienti da processi di cromatura elettrolitica.
2.4.4 Esempi applicativi del trattamento con resine a scambio
ionico
Le applicazioni più comuni degli impianti di scambio ionico per quanto riguarda il cromo esavalente sono:
1) demineralizzazione delle acque di lavaggio post cromatura per il riciclo.
2) Controllo delle emissioni allo scarico negli stabilimenti conciari e galvanici.
3) Recupero chimico di cromati dai bagni di elettrodeposizione.
Nella prima applicazione vengono trattate tutte le correnti provenienti dalle operazioni di lavaggio dei pezzi sottoposti a cromatura elettrolitica, delle vasche di contenimento dei bagni, e le correnti di blowdown delle torri di raffreddamento. Questi scarichi sono continui e con concentrazioni che oscilla tra 10 e 500 mg/l. Le correnti, una volta miscelate e condizionate al pH operativo delle resine, sono demineralizzate per trattamento consecutivo su resine a scambio cationico e anionico. Una volta purificate, le correnti vengono riciclate. Questo riduce drasticamente il consumo di acqua e limita le portate degli effluenti da inviare allo scarico che si riducono alle sole correnti di rigenerazione delle resine. Conseguentemente l’impianto di depurazione a valle dello stabilimento può avere una taglia considerevolmente più piccola.
Nella seconda applicazione, il processo a scambio ionico è utilizzato come metodo di finitura per eliminare le ultime impurità residue
riduzione e precipitazione chimica). Le correnti in ingresso hanno concentrazioni basse (1 – 20 mg/l). In ogni caso è comunque necessario, prima di avviare gli effluenti alle colonne contenenti le resine, eseguire pretrattamenti per aggiustare il pH entro il campo di operabilità, eseguire operazioni di filtrazione per eliminare solidi sospesi e sporco che possono provocare intasamenti e perdite di efficienza.
Nel recupero chimico si sfrutta la capacità delle resine di trattenere i cromati e rilasciarli in fase di rigenerazione come sali praticamente puri. Spesso il recupero chimico è affiancato alla demineralizzazione delle acque di scarico così da raggiungere (idealmente) un livello zero di emissioni. Il processo di recupero chimico è molto utilizzato per recuperare i cromati dai bagni di cromatura esausti. E’ realizzato in due stadi: il primo purifica, mediante resine cationiche, le soluzioni provenienti dai bagni dalle impurità metalliche (Fe3+, Pb+, Zn2+ ecc.), andate in soluzione durante il processo di elettrodeposizione; il secondo toglie cromati e dicromati, mediante resine anioniche. Il cromo viene recuperato in fase di rigenerazione come soluzione salina riutilizzabile nei bagni [4].
Di seguito si riportano alcuni esempi applicativi di trattamenti con resine a scambio ionico.
Demineralizzazione
Rimozione di cromati dagli scarichi delle torri di raffreddamento
I cromati sono spesso aggiunti alle acque di raffreddamento allo scopo di inibire i fenomeni corrosivi sulle superfici di scambio degli scambiatori di calore, perciò si ritrovano nei circuiti delle torri di raffreddamento e devono essere abbattuti prima dello scarico. Per far ciò si utilizzano resine a scambio anionico basiche forti (Type I – Ionac® A-540) e soluzioni di cloruro di sodio per la rigenerazione. La maggiore capacità di abbattimento è ottenuta condizionando a pH 4.5 o 5.0 la corrente in ingresso allo scambiatore ionico. La capacità del letto è di 64 kg di cromati rimossi per m3 di resina (~ 28 grammi di Cromo per litro di letto). La rigenerazione avviane mediante l’utilizzo di una soluzione contenente 1 kg di idrossido di sodio e 3 kg di cloruro di sodio. La portata attraverso il etto è di 30 m3/h per m3 di resina. I cromati sono recuperati in fase di rigenerazione e riutilizzati [10].
Recupero chimico
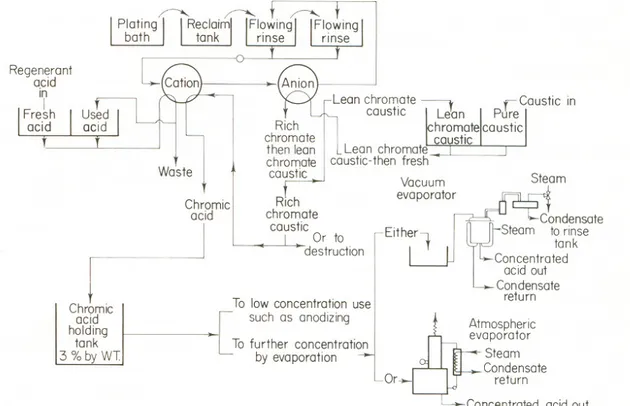
Recupero di acido cromico dai bagni di elettrodeposizione[10].
Figura 2. 8 Impianto di depurazione di bagni di elettrodeposizione esausti.
I bagni di cromatura elettrolitica tendono ad esaurirsi a causa della riduzione del Cr(VI) a Cr(III), della dissoluzione degli anodi (composti da Fe, Pb, Zn), e dell’accumulo di oli e grassi. Perciò, periodicamente, vanno scaricati e reintegrati o purificati con conseguenti problemi ambientali ed incremento dei costi [10].
Lo scambio ionico provvede al recupero di tutte le specie ioniche presenti in soluzione e produce acqua demineralizzata che può essere riciclata costituendo un notevole vantaggio economico.
Le resine utilizzate in questo processo sono anioniche basiche forti e cationiche acide forti [10]. La problematica principale nell’uso di questa tecnica è la suscettibilità delle resine all’attacco chimico da parte di forti
agenti ossidanti come l’acido cromico, specialmente sotto condizioni di pH < 0.1 ed ad alte concentrazioni di acido (300 – 400 g/l). Perciò vengono usate resine macroreticolari e con alto grado di cross-linking (Type I – Ionac® A 540, A-641) che hanno maggiore stabilità ed eccellente resistenza chimica. La resistenza di queste resine è tale da sopportare contrazioni di 150 – 200 g/l di acido cromico. Perciò soluzioni provenienti da bagni ad alte concentrazioni ad esempio i bagni di cromatura forte o di strippaggio del rame (400 g/l) devono essere diluite prima di essere inviate alle colonne contenenti le resine e poi riconcentrate in un evaporatore atmosferico o sottovuoto per portare la soluzione alla forza adeguata [4,10].
I bagni esausti vengono dapprima diluiti, miscelandoli alle acque di lavaggio post cromatura, poi fatti passare in resine a scambio cationico che rimuovono le impurità metalliche cationiche (Cr3+, Fe3+, Pb+, Zn2+ ecc.) finite in soluzione in seguito alla dissoluzione degli anodi di elettrodeposizione ed a reazioni di ossidoriduzione che riducono parte del Cr(VI). In seguito le resine a scambio anionico rimuovono i cromati e gli altri anioni producendo acqua demineralizzata destinata al lavaggio[4,10]. Gli ioni cromato e dicromato sono rimossi dalla resina secondo le reazioni seguenti:
2ROH + CrO4-- = R2CrO4 + 2OH
-R2CrO4 + CrO4-- + H+ = R2Cr2O7 + OH
-Il cromo esavalente rimosso è strippato poi, in fase di rigenerazione, con soluzioni di soda caustica. In questa fase di rigenerazione, dalla colonna, esce una soluzione di cromato e dicromato di sodio (a seconda del pH) al 3% in peso. Questa soluzione è fatta passare attraverso una resina cationica
acida forte in forma di idrogeno producendo così l’acido cromico secondo la reazione:
2RH + Na2CrO4 = 2RNa + H2CrO4
2RH + Na2Cr2O7 = 2RNa + H2Cr2O7
Infine l’acido cromico viene concentrato fino al 30% in peso mediante evaporatori atmosferici o sotto vuoto, e quindi riutilizzato nei bagni di elettrodeposizione [10].
Figura 2. 9 Impianto a letto fisso di resine per il riciclo delle acque di scarico e la rimozione selettiva di metalli.
La Tabella.2.7 mostra altri esempi applicativi dello scambio ionico per il trattamento di acque di scarico contenenti cromo esavalente estratti dal testo di riferimento [4].
Tabella.2. 7 Esempi applicativi di scambio ionico [4]. Cromo mg/l
Sorgente di scarico Ingresso Uscita Capacità della
resina (gCr/l) Blowdown torri di raffreddamento 17.9 1.8 36,4 10 1.0 18,2 9.0 0.2 18,2 Soluzioni di lavaggio post Elettrodeposizione 44.8 0.025 11,96 41.6 0.01 36,4 Verniciature 1210 < 0.5 -
2.5 Recupero
evaporativo
Il recupero evaporativo non è un vero e proprio metodo di abbattimento. Per ciò che concerne il cromo esavalente, principalmente applicato per concentrare le acque di lavaggio dei pezzi sottoposti a cromatura elettrolitica. Questo processo consiste nell’evaporare le correnti di scarico per ottenere soluzioni concentrate di acido cromico ed acqua distillata. Le correnti prodotte sono inviate al riciclo.
Un altro utilizzo è quello del trattamento delle correnti di rigenerazione delle resine a scambio ionico. Queste contengono cromati di sodio o acido cromico a concentrazioni non superiori al 3% che non possono essere scaricate. Sono perciò concentrate fino al 30 - 40% ed inviate a serbatoi di stoccaggio per il reintegro dei bagni esausti. Se al gruppo evaporativo è abbinato un cristallizzatore si può recuperare il cromo sotto forma di sale solido.
Il processo evaporativo può essere utilizzato anche a scopi diversi dal recupero. Nel caso in cui non ci sia interesse nel recuperare gli inquinanti presenti in soluzione, il processo evaporativo offre, comunque, la possibilità di concentrare gli effluenti, riducendone i volumi e quindi i costi di smaltimento.
In applicazioni per l’industria galvanica le correnti inviate al recupero evaporativo devono avere un basso grado di impurità, poiché queste vengono concentrate e possono creare problemi di perdita di efficienza nel processo di elettrodeposizione. Deve quindi essere previsto un pretrattamento. La presenza di specie ioniche estranee al processo di deposizione può essere eliminata pretrattando le soluzioni con resine a scambio ionico, la presenza di solidi sospesi può essere eliminata per
filtrazione, mentre residui organici possono essere eliminati con carboni attivi [12].
A livello applicativo le correnti provenienti dal lavaggio dei pezzi vengono inviate ad evaporatori che possono essere a singolo effetto, a pressione ambiente o sotto vuoto, a multiplo effetto, e previsti o meno di sistemi di recupero energetico come sistemi a compressione di vapore.
Le soluzioni, contenenti pochi mg/l di acido cromico, sono concentrate a valori superiori a 300 g/l [4].
2.5.1 Esempi applicativi del recupero evaporativo
Sono riportati alcuni esempi pratici di applicazione su scala industriale. In una industria di fabbricazione navale si trattano le acque di lavaggio provenienti da una linea di cromatura, contenenti 10g/l di acido cromico più impurità cationiche Fe3+ e Cr3+. Le impurità sono rimosse con un pretrattamento su resine a scambio cationico. L’effluente è poi concentrato a 250 g/l di acido cromico in un evaporatore a compressione di vapore. Il concentrato è riciclato ai bagni di elettrodeposizione. Il distillato è riciclato ai serbatoi di lavaggio [4].
I vantaggi nell’utilizzo di questo metodo sono il risparmio ottenuto dal riciclaggio dei prodotti di processo (acido cromico) e nella diminuzione del consumo d’acqua, la diminuzione del volume di effluenti scaricati e la semplicità delle apparecchiature. Gli svantaggi sono i costi operativi elevati dovuti al consumo energetico.
2.6
Metodi di abbattimento alternativi
Negli anni sono stati condotti molti studi sperimentali al fine di ricercare un metodo di abbattimento del cromo esavalente che fosse economicamente più conveniente rispetto ai metodi tradizionali. Le tecnologie studiate sono le più disparate: adsorbimento, estrazione con solvente , ultrafiltrazione, osmosi inversa, elettrodialisi.
Per le tecniche di adsorbimento si ricercano materiali adsorbenti a basso costo come carboni attivi di origine naturale, zeoliti, prodotti secondari dell’industria alimentare (bucce, puliture, gusci etc.), della produzione dell’energia (fuliggine, char, residui di combustione), fanghi biologici e chimici esausti. I vantaggi nell’utilizzo di questi materiali adsorbenti deriva principalmente dalla loro scarso valore commerciale e dalla loro ampia disponibilità.
Gli studi in letteratura mostrano che questi materiali possono avere capacità di adsorbimento apprezzabili, ma mancano studi su un loro effettivo utilizzo in ambito industriale [12].
Studi riguardanti estrazione con solvente di cromo esavalente da soluzioni acquose sono stati condotti utilizzando solventi organici miscelati con EDTA (etilen dietilammina), complessanti, chelanti, tensioattivi cationici. Le efficienze di abbattimento raramente sono superiori al 99% e dipendono fortemente dalle condizioni operative, inoltre c’è il problema di dover trattare la soluzione organica residua [14].
Ultrafiltrazione, nanofiltrazione, osmosi inversa ed elettrodialisi sono stati testati con varie membrane commerciali ultraporose [15,16,17,18], in alcuni casi coadiuvando la ritenzione della membrana con l’inserimento di
tensioattivi cationici in soluzione per costituire micelle [19]. Le micelle adsorbono le molecole di cromato e costituiscono una nanoparticella di dimensioni tali da non filtrare attraverso la membrana. Benché molto efficienti nell’abbattimento, le problematiche di questi sistemi sono principalmente le alte pressioni necessarie per la permeazione attraverso le membrane e i fenomeni di competizione allorché sono presenti altre specie in soluzione [20].
2.6.1 Adsorbimento su carboni attivi
Alla fine degli anni settanta è stato proposto l’utilizzo di carboni attivi ottenibili a partire da materiali a basso costo e presenti in abbondanza (ad esempio sotto forma di sottoprodotti dell’industria agricola), per rimuovere il Cr(VI) [21].
L’abbattimento del cromo esavalente presente in soluzione acquosa mediante carboni attivi avviene principalmente attraverso due reazioni all’interfaccia liquido – solido, l’adsorbimento e la riduzione da Cr(III) a Cr(VI). La riduzione a Cr(III) avviene generalmente a pH < 3, ma la sua estensione è dipendente da numerosi fattori sperimentali come il materiale grezzo da cui si ricava il carbone, il metodo di attivazione, la porosità e dalla natura delle specie di Cr(VI) esistenti a un dato pH e ad una data concentrazione. A pH alcalini le capacità di adsorbimento diminuiscono drasticamente a causa della difficoltà dei carboni attivi a trattenere la specie CrO42-, maggiormente presente a pH > 6. Si pensa che i fattori che
influenzano il processo riduzione siano legati alla presenza di gruppi ossigeno sulla superficie del carbone attivo, ma questa ipotesi è ancora oggetto di studio [22]. In genere si ritrova che per quanto riguarda i carboni attivati fisicamente (tramite processi termici), la capacità di abbattimento è influenzata dalla distribuzione porosimetrica del carbone.
In letteratura vi sono studi sull’adsorbimento di cromo esavalente su carboni attivati termicamente e chimicamente [22].
Nella tabella seguente si riportano le caratteristiche e le capacità di alcuni tipi di carboni attivi proposti e studiati per l’abbattimento di Cr(VI).
Tabella.2. 8 Capacità di adsorbimento di carboni attivi [22].
Capacità [mg Cr /g] Carbone Materiale Grezzo carbonizzazione Condizioni di attivazione Tipo di attivante Agente Condizioni di attivazione pH = 3 pH = 5
Granulare Cuoio N2 / 1173 K / 5h Fisica CO2 1098 K / 8h 250 100 Granulare Cuoio N2 / 1173 K / 5h Fisica CO2 1098 K / 45h 300 170 Granulare Noccioli di oliva N2 / 1173 K / 2h Chimica H3PO4 753 K / 3h 370 270 Granulare Noccioli di oliva N2 / 1173 K / 2h Chimica ZnCl2 998 K / 3h 400 290 Granulare Noccioli di oliva N2 / 1173 K / 2h Fisica H2O 1133 K / 2h 420 300 Granulare Noccioli di oliva N2 / 1173 K / 2h Fisica CO2 1093 K / 72h 590 450 Granulare Almond shell N2 / 1173 K / 3h
Chimico Fisica ZnCl2 + CO2 (3:1) agente:mat. Grezzo 1093 K /69h 410 300 Polvere NORIT CA-1 Sconosciute Chimica H3PO4 Sconosciute 320 280 Polvere
PROQUIFI
Andujar 39 Sconosciute Chimica H3PO4 Sconosciute 350 290
Benché le capacità di adsorbimento siano elevate, occorre dire che il trattamento con carboni attivi richiede spesso tempi di contatto tecnologicamente improponibili (> 100 h).
Per i carboni attivati chimicamente la formazione di composti di Cr(III) sulla superficie comporta un avvelenamento irreversibile. Quindi, una volta esauriti, i carboni devono essere smaltiti e sostituiti. A causa di questi fattori, attualmente non esistono configurazioni in grado di sfruttare i carboni attivi come processo industriale di abbattimento per il Cr(VI).
2.6.2 Risultati sperimentali di adsorbimento su materiali a
basso costo
Numerosi studi sono stati condotti su materiali adsorbenti a basso costo, e di seguito si riporta un’ampia rassegna dei risultati ottenuti in letteratura.
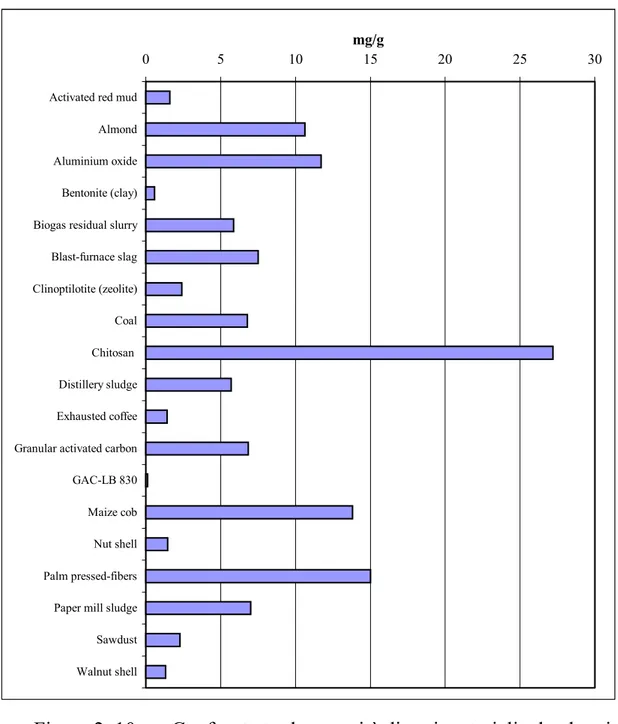
Le capacità di adsorbimento vanno da 0.5 a 30 mg di Cr per g di adsorbente.
Tabella.2. 9 Capacità adsorbenti di materiali a basso costo. Materiale Capacità mg Cr/g pH Max Co Articolo di riferimento
Activated red mud 1,6 J. Pradhan, S.N. Das, R.S. Thakur, 1999
Almond 10,62 M. Dakiky, M. Khamis, A. Manassra, M. Mer’eb, 2002
Aluminium oxide 11,7 D.C. Gupta, U.C. Tiwari, 1985
Bentonite (clay) 0,572 2 S.A. Khan, R. Rehman, M.A. Khan, 1995
Biogas residual slurry 5,87 2 40 C.Namas,vayam and R.T.Yamuna, 1994
Blast-furnace slag 7,5 S.K. Srivastava, V.K. Gupta, D. Mohan, 1997
Clinoptilotite (zeolite) 2,4 S.K. Ouki, M. Kavanagh, 1997
Coal 6,78 M. Dakiky, M. Khamis, A. Manassra, M. Mer’eb, 2002
Chitosan 27,2 Masri M. S., Friedman M. 1974
Distillery sludge 5,7 K. Selvaraj, S. Manonmani, S. Pattabhi, 2003
Exhausted coffee 1,42 Orhan Y. and Buyukgungot H.,1993
Granular activated carbon 6,84 L. Monser, N. Adhoum, 2002
GAC-LB 830 0,13 I. Han, M.A. Schlautman, B. Batchelor, 2000
Maize cob 13,8 1,5 300 Sharma,D.C.,Forster,C.F.,1994b.
Nut shell 1,47 Orhan Y. and Buyukgungot H.,1993
Palm pressed-fibers 15 2 Tan, W. T.; Ooi, S. T.; Lee, C. K., 1993
Paper mill sludge 7 N. Calace, A. Di Muro ed al. 2002
Sawdust 2,29 2 N.K. Hamadi, X.-D. Chen, M.M. Farid, M.G.Q. Lu, 2001
In Figura 2. 10 si riporta un grafico con le capacità adsorbenti a confronto.
0 5 10 15 20 25 30
Activated red mud Almond Aluminium oxide Bentonite (clay) Biogas residual slurry Blast-furnace slag Clinoptilotite (zeolite) Coal Chitosan Distillery sludge Exhausted coffee Granular activated carbon GAC-LB 830 Maize cob Nut shell Palm pressed-fibers Paper mill sludge Sawdust Walnut shell
mg/g
Figura 2. 10 Confronto tra le capacità di vari materiali adsorbenti. Questi materiali sono da diversi anni oggetto di studio da parte della comunità scientifica ma attualmente non trovano applicazione pratica nell’ambito dei processi di trattamento di effluenti contenenti cromo (VI) a causa della carenza di studi su situazioni reali e di impianti pilota che possano dare informazioni attendibili sulla loro efficacia.
Cap II – Processi di abbattimento e/o recupero del cromo: stato dell’arte
[4] Ford, Water Quality Management Library – Volume 3. Technomic Publishing Company, Inc. 1992.
“Toxicity Reduction: Evaluation and Control”.
[5] Berbenni, Biannucci. Etas distribuzioni, Milano 1968. “Trattamenti di acque di scarico”
[6] Lee, Lim, Lee, Park; Chemosphere vol.53 (2003) p.p.479 – 485. [7] GM Impianti S.R.L. http://www.gmimpianti.com.
“Impianto di trattamento di acque acide”.
[8] Ecoteam S.R.L. http://www.ecoteam.it.
“Impianto di elettroflocculazione”.
[9] Leinonen. Report Series in Radiochemistry 13/1999.
“Removal of harmful metals from metal plating waste waters using selective ion exchangers”.
[10] Applebaum. Academic Prss, New York, 1968.
“Demineralization By Ion Exchange”
[11] Helfferich. McGraw-Hill Book Company, Inc. New York, 1962.
“Ion Exchange”.
[12] National metal finishing resource center. http://www.nmfrc.org.
“Pollution Prevention and Control Technologies for Plating Operations”.
[13] Babel, Kurniawan; Journal of Hazardous Materials vol.97B (2003) p.p.219–243.
[14] Venkateswaran, Palanivel; Separation and Purification Technology vol. 40 (2004) p.p.279–284.
[15] Keskinler, Danis, Cakici, Akay; Sep. Sci. Technol. vol. 32 (1997) p.p.1899. [16] Christian, Scamehom, Bhat, Ei-Sayed, Tucker; AIChe J. vol.34(2) (1988) p.p.189. [17] Renault, Aulas, Rumeau; Chem. Engineer. J. vol.23 (1982) p.p.137.
[18] Hafiarle, Lemordant, Dhahbi; Desalination vol.130 (2000) p.p.305-312.
[19] Gzara, Dhahbi; Desalination vol.137 (2001) p.p.241-250. [20] Baek, Yang; Chemosphere vol.57 (2004) p.p.1091– 097.
[21] Orhan, Buyukgungot; Water Sci. Technol. vol.28(2) (1193) p.p. 247-255.
[22] Pérez-Candela, Martin-Martinez, Torregrosa-Marcia; Wat. Res. vol. 29, n°9 (1195) p.p. 2174 – 2180.
![Figura 2. 1 Impianto di abbattimento di metalli pesanti [7].](https://thumb-eu.123doks.com/thumbv2/123dokorg/5694457.72902/11.892.167.790.478.771/figura-impianto-abbattimento-metalli-pesanti.webp)
![Figura 2. 2 Impianto di elettroflocculazione [8].](https://thumb-eu.123doks.com/thumbv2/123dokorg/5694457.72902/15.892.328.627.293.750/figura-impianto-elettroflocculazione.webp)
![Figura 2. 3 Celle di riduzione elettrolitica [8].](https://thumb-eu.123doks.com/thumbv2/123dokorg/5694457.72902/17.892.253.706.251.555/figura-celle-riduzione-elettrolitica.webp)
![Figura 2. 4 Schema dell’impianto [8].](https://thumb-eu.123doks.com/thumbv2/123dokorg/5694457.72902/19.892.242.717.185.808/figura-schema-dell-impianto.webp)
![Figura 2. 5 Copolimero stirene-divinilbenzene X=gruppo ionico [10].](https://thumb-eu.123doks.com/thumbv2/123dokorg/5694457.72902/25.892.232.730.117.495/figura-copolimero-stirene-divinilbenzene-x-gruppo-ionico.webp)