INTRODUZIONE
1. Inquinamento da metalli pesanti
1.1 Caratteristiche dei metalli pesanti
Con l’intensificarsi dei fenomeni di inquinamento, un crescente interesse è stato rivolto ai metalli cosiddetti pesanti, il cui accumulo nell’ambiente è imputabile principalmente a processi industriali, ad attività civili e all’utilizzo di antiparassitari e fertilizzanti nelle pratiche agricole. Non venendo degradati, in pochi anni i metalli si accumulano nel terreno e nelle acque in concentrazioni tali da risultare tossici e possono inoltre essere assorbiti dalle piante, costituendo quindi oltre che un problema ambientale anche un rischio per la salute umana. Sono definiti metalli pesanti sia gli elementi di transizione caratterizzati da una densità maggiore di 7,0 g/cm3 (tabella 1-1), sia altri elementi di minore densità, come
per esempio il selenio, il vanadio e l’arsenico che, però, presentano proprietà fisiche e chimiche simili a quelle dei veri metalli pesanti.
Recentemente è stato proposto di abbandonare la classificazione in base alla densità in favore di una nuova suddivisione che ripartirebbe i metalli in tre gruppi:
1. metalli che hanno una prevalente affinità per gli atomi di ossigeno; 2. metalli maggiormente affini all’azoto e allo zolfo;
3. metalli con comportamento intermedio.
Questa classificazione tuttavia continua a non essere seguita (Sanità di Toppi, 2002). ELEMENTO SIMBOLO PESO
ATOMICO DENSITA’ (g/cm3) Cadmio Cd 112.4 8.6 Cobalto Co 58.9 8.9 Cromo Cr 51.9 7.2 Manganese Mn 54.5 7.2 Mercurio Hg 200.6 13.6 Molibdeno Mo 95.9 10.2 Nichel Ni 58.7 8.9 Piombo Pb 207.2 11.3 Rame Cu 63.6 8.9 Stagno Sn 118.7 7.3 Zinco Zn 65.4 8.6
Tabella 1-1: Metalli pesanti coinvolti nei fenomeni di inquinamento ambientale (Sanità di Toppi & Gabbrielli, 1998)
I metalli pesanti sono costituenti naturali della crosta terreste, ma le attività antropiche alterano i loro cicli geochimici e il bilancio biochimico. Attualmente, infatti, vaste aree di terreno risultano contaminate dai metalli pesanti prodotti da attività urbane (incenerimento di rifiuti e acque di scarico urbano), agricole (utilizzo di fertilizzanti e di pesticidi in cui si ritrovano tali elementi) ed industriali (miniere metallifere, fonderie, industrie della vernice e concerie). Sono inquinanti del suolo, delle acque e dell’atmosfera, che ritroviamo soprattutto in aree fortemente antropizzate, ed anche in tracce possono causare problemi a tutti gli organismi, animali e vegetali, grazie alla loro capacità di accumularsi nelle catene alimentari.
Quando presenti nel terreno, i metalli pesanti possono:
- sostituire elementi presenti nelle strutture cristalline (per esempio il Ni sostituisce il Mg),
- fungere da atomo centrale nella formazione di complessi con la sostanza organica, - precipitare come ossidi, idrossidi, carbonati, fosfati, solfuri o come componenti
citoplasmatici di organismi in decomposizione (per esempio Co, Cu, Mn e Ni),
- essere presenti in soluzione acquosa e quindi disponibili ad essere estratti dagli apparati radicali delle piante (Sanità di Toppi & Gabbrielli, 1998).
Tali elementi tendono a distribuirsi nel suolo in equilibrio dinamico tra le fasi liquida e solida, sulla base della capacità di scambio cationico, del pH, del potenziale redox, della tessitura, della quantità e tipo di colloidi, della temperatura e del contenuto idrico del suolo. Ad esempio, al diminuire del pH aumenta la concentrazione dei metalli in soluzione, ad eccezione di Cr(VI) e di Mo che diventano più solubili all’aumentare di tale parametro. Diversi metalli di transizione sono essenziali per le piante e le alghe. Essi sono vanadio (V), cromo (Cr), manganese (Mn), ferro (Fe), cobalto (Co), nichel (Ni), rame (Cu), zinco (Zn) (appartenenti al quarto periodo della tavola periodica) e molibdeno (Mo) (appartenente al quinto periodo), tutti caratterizzati da particolari proprietà che li rendono essenziali per gli organismi. Ad esempio il Fe è un componente di proteine, come i citocromi, le catalasi, le perossidasi e proteine Fe-S come la feredossina, e di molti altri enzimi; il Cu è un componente di certe proteine che trasferiscono gli elettroni durante la fotosintesi (plastocianina) e la respirazione (citocromo c, ossidasi)o che sono coinvolte nel processo di lignificazione della parete cellulare (laccasi). Il Mn, invece, è un metallo con un minor potenziale redox, ma comunque coinvolto nella fotosintesi (ad esempio nella produzione di ossigeno), lo Zn è un metallo non-redox, ma con un ruolo strutturale e/o catalitico in molte proteine ed enzimi. Altri metalli come il Ni e il Mo sono micronutrienti
essenziali per il funzionamento della pianta. Quando anche uno solo di questi elementi è presente in quantità limitata, appaiono sintomi di carenza nutritiva e la crescita della pianta si riduce (Marschner, 1995). Però, se presenti in eccesso, tali metalli possono risultare tossici per la pianta, infattile loro proprietà più importanti sono legate alla loro reattività, al loro potere inquinante e alla loro tossicità sugli organismi. Esse sono:
- la possibilità di assumere molti stadi di ossidazione e di formare composti intermedi con molta facilità;
- le proprietà catalitiche, in quanto sono ottimi catalizzatori di numerose reazioni biologiche;
- la capacità di dare origine a complessi, a causa dei loro orbitali d spesso incompleti. Le costanti di instabilità dei complessi del metallo sono infatti indici attendibili del grado di tossicità, in quanto i metalli che hanno una maggiore tendenza a formare complessi stabili con molecole organiche sono quelli che hanno una più elevata capacità di danneggiare le membrane biologiche. ;
- la tendenza a dare luogo a composti non stechiometrici con i solidi ionici; - l’elevata affinità per i gruppi tiolici (SH) degli amminoacidi e delle proteine.
Nelle cellule viventi i metalli pesanti alterano la struttura delle proteine legandosi ai gruppi tiolici, carbossilici e amminici degli amminoacidi interferendo conseguentemente con la loro funzione sia di tipo strutturale che enzimatica.
I metalli di transizione in eccesso all’interno dei tessuti delle piante, agendo come catalizzatori del deterioramento delle macromolecole biologiche, possono stimolare la formazione di radicali liberi e di specie reattive dell’ossigeno (ROS) come i radicali superossido (O2•-),il perossido di idrogeno (H2O2), i radicali idrossilici (•OH) e l’ossigeno
singoletto (O2*) e di conseguenza determinare uno stress di tipo ossidativo. In particolare,
in presenza di gruppi tiolici e di atomi di ossigeno, alcuni metalli come Cu e Fe sono in grado di incrementare la formazione di radicali liberi e ioni superossido mediante le reazioni di Haber-Weiss e di Fenton.La reazione di Fenton, infatti, prevede la riduzione di H2O2 a radicale idrossilico ad opera di Fe2+:
Fe2+ + H2O2 Fe3+ + OH- + OH•
Mentre la reazione di Haber Weiss è la seguente: O2•- + H2O2 OH• + OH- + O2
Le ROS così prodotte sono capaci di reagire in modo incontrollato con i gruppi funzionali contenenti S, N e O delle molecole biologiche, causandone l’inattivazione.
Uno dei più importanti effetti dannosi provocato da tali prodotti tossici derivati dall’ossigeno è la perossidazione dei lipidi di membrana (Halliwell, 1982) e l’ossidazione delle proteine. Il range fisiologico tra l’essenzialità e la tossicità di tali metalli essenziali risulta essere molto ristretto, per cui è necessaria una rete molto efficiente di controlli omeostatici da parte della pianta, per “tamponare” le fluttuazioni nella disponibilità di questi elementi. Entro certi limiti, infatti, le piante sono in grado di proteggersi nei confronti del danno ossidativo, poiché possiedono sistemi antiossidanti costituiti sia da molecole come il glutatione ridotto (GSH), l’acido ascorbico, l’α-tocoferolo e i carotenoidi, che da enzimi come superossido dismutasi (SOD), catalasi (CAT) e perossidasi (POD).
Molti dei metalli pesanti, però, non sono essenziali per gli organismi. Alcuni esempi sono il cadmio (Cd), l’arsenico (As, posizionato nel gruppo V) e il selenio (Se, nel gruppo VI), che, essendo elementi con caratteristiche chimico-fisiche molto simili ai metalli essenziali, sono potenzialmente molto tossici per tutte le componenti biotiche dell’ecosistema. A causa delle loro ridotte dimensioni e della loro somiglianza con alcuni nutrienti essenziali, né i vegetali, né gli animali sono infatti in grado di evitarne completamente l’assorbimento. A tal proposito alcuni dei disordini causati nelle piante sono legati a interferenze dei metalli pesanti con gli altri nutrienti essenziali poiché competono con i loro sistemi di assorbimento, alterando così la nutrizione minerale delle piante. Inoltre, in seguito all’assorbimento e all’accumulo dei metalli nei tessuti delle piante e la compartimentazione nelle cellule, si verificano forti squilibri nel metabolismo (Brune & Dietz, 1995) dovuti alle alterazioni indotte a carico di pressoché tutti i processi vitali, come la traspirazione, la fotosintesi, il trasporto elettronico, la biosintesi della clorofilla e l’integrità delle membrane cellulari (Bonnet et al.,2000).
In generale, inoltre, tutti i metalli pesanti possono anche avere azione mutagena ed attività cancerogena interagendo con il DNA, che, infatti, rappresenta un bersaglio preferenziale a causa dei numerosi siti di legame che offre a tali ioni (Sanità di Toppi, 2002).
Le specie vegetali che sono in grado di accumulare quantità tossiche di alcuni metalli nei loro tessuti grazie alla formazione di chelati, che risultano meno tossici per le piante stesse, hanno rapidamente colonizzato gli ambienti contaminati da alte concentrazioni di metalli pesanti fornendo un esempio di evoluzione attraverso la selezione naturale. Per questo motivo molto spesso queste specie botaniche, denominate iperaccumulatrici, sono utilizzate per il risanamento e la rivegetazione dei suoli contaminati (bioremediation), con evidenti riflessi ecologici.
L’elevata concentrazione di metalli pesanti nel suolo oltre a causare danni alle piante quali clorosi, necrosi o altre alterazioni dei processi metabolici, può mostrarsi pericolosa anche per la salute dell’uomo attraverso l’ingestione di alimenti di origine vegetale prodotti in suoli contaminati.
1.2 Caratteristiche del cadmio
Il cadmio è un elemento metallico di colore bianco-argenteo, duttile e malleabile, di simbolo Cd e numero atomico 48; è uno degli elementi di transizione ed appartiene al gruppo IIB (o 12) della tavola periodica.
Figura 1-1
Tale metallo fu scoperto nel 1817 dal chimico tedesco Friedrich Stromeyer che lo individuò nelle incrostazioni presenti all'interno di una fornace di zinco. Fonde a 321 °C, bolle a 765 °C, ha densità relativa 8,64 g/cm3 e peso atomico 112,40. A temperatura ambiente si
conserva inalterato per lungo tempo, ma se riscaldato si incendia facilmente in presenza d'aria, generando una fiamma brillante, e si trasforma rapidamente in ossido, CdO.
In natura, il Cd non si trova mai allo stato nativo ed è generalmente poco abbondante nella crosta terrestre, dove si ritrova associato ad un eccesso di Zn in molte formazioni rocciose. E’ presente in piccole quantità in alcuni minerali, come ad esempio la greenockite, piuttosto rari e difficilmente sfruttabili industrialmente. Si ottiene prevalentemente come sottoprodotto della raffinazione di minerali di Zn, dal quale viene separato mediante distillazione frazionata o elettrolisi.
Il Cd viene rilasciato nell’ambiente dalle raffinerie, dai sistemi di riscaldamento, dalle industrie metallurgiche, dagli inceneritori di rifiuti, dal traffico urbano, dalle industrie del cemento e dall’utilizzo di fertilizzanti fosfati. In aree poco antropizzate può essere rilasciato nell’ambiente in seguito al processo di mineralizzazione delle rocce.
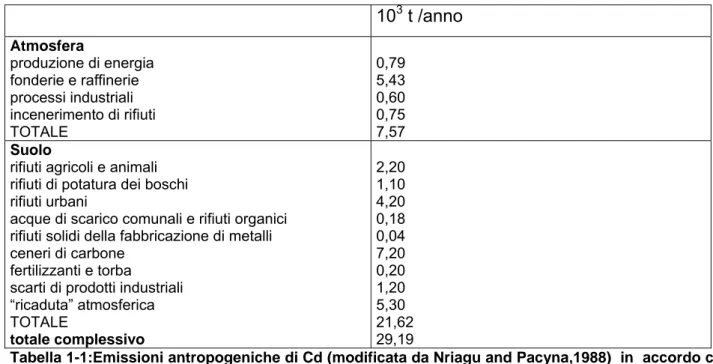
La tabella 1-1 riporta le principali emissioni antropogeniche di Cd nell’atmosfera e nel suolo e le relative entità.
C
C
d
d
Tabella 1-1:Emissioni antropogeniche di Cd (modificata da Nriagu and Pacyna,1988) in accordo con Mhatre and Pankhurst,1997.
Soluzioni di un suolo non inquinato presentano una concentrazione di Cd compresa tra 0,04 e 0,32 μM, mentre se tale concentrazione si attesta tra 0,32 e 1 μM si parla di suoli moderatamente inquinati, e per concentrazioni superiori di suoli inquinati da Cd (Wagner, 1993). Su terreni che raggiungono una concentrazione di Cd superiore a 35 μM (suoli metalliferi) riescono a crescere solo le piante iperaccumulatrici, in grado, cioè, di accumulare nei loro tessuti una quantità molto elevata di Cd (almeno 100 mg/Kg) senza alcun sintomo di fitotossicità e riuscendo a completare il proprio ciclo vitale. A tutt’oggi si conoscono due sole specie iperaccumulatrici di Cd: Thlapsi caerulescens, che accumula nelle foglie più di 1000 mg/Kg di Cd (Baker et al., 2000) e Arabidopsis talleri, che ne accumula 157 mg/Kg (Bert et al., 2003).
Per quanto riguarda la tossicità per gli organismi presenti nel suolo e per i processi microbici, Duxbury (1985) classifica il Cd come un elemento a tossicità intermedia. Alte concentrazioni nel terreno possono risultare mutagene e teratogene per molte specie animali (Degraeve, 1981).
I limiti per il contenuto di tale metallo nel suolo è previsto dalla Direttiva 86/278/CEE (limite massimo di concentrazione di Cd, pari a 3 mg/kg s.s.) e dal D. lgs. 99/92 (limite di concentrazione di Cd, pari a 1,5 mg/kg s.s.,). Il DM Ambiente 471/99 sui siti inquinati stabilisce valori diversi, a seconda dell’uso del suolo, considerando tali livelli sia come limiti per i suoli contaminati, sia come obiettivi di bonifica. Tali valori sono di 2 mg/kg s.s. per l’uso del suolo come verde e residenziale e di 15 mg/kg s.s. per l’uso commerciale e industriale. 103 t /anno Atmosfera produzione di energia fonderie e raffinerie processi industriali incenerimento di rifiuti TOTALE 0,79 5,43 0,60 0,75 7,57 Suolo
rifiuti agricoli e animali rifiuti di potatura dei boschi rifiuti urbani
acque di scarico comunali e rifiuti organici rifiuti solidi della fabbricazione di metalli ceneri di carbone
fertilizzanti e torba
scarti di prodotti industriali “ricaduta” atmosferica TOTALE totale complessivo 2,20 1,10 4,20 0,18 0,04 7,20 0,20 1,20 5,30 21,62 29,19
Solo una frazione del Cd totale presente in un terreno risulta disponibile per l’assorbimento da parte delle piante, e la sua entità è largamente influenzata dal pH del suolo e dal suo contenuto in sostanza organica. Oltre alla biodisponibilità, altri due processi determinano il livello di esposizione al metallo e il suo accumulo nella pianta: l’attività di assorbimento dal terreno (uptake) e l’efficienza di traslocazione. Non esiste, quindi, una correlazione diretta tra il contenuto di metallo nel suolo e il suo contenuto nella pianta.
Il Cd è il metallo che più rapidamente viene assorbito dalle radici della pianta, per poi in minima parte essere traslocato, attraverso lo xilema, alle foglie e ai frutti (Wagner, 1993). Bisogna considerare che solo gli ioni del metallo assorbiti dalle radici possono esercitare i loro effetti tossici e indurre delle risposte e che solo gli ioni traslocati verso la parte aerea della pianta possono agire nei confronti delle cellule fogliari.
1.3 Meccanismi e processi coinvolti nell’uptake del cadmio
Negli ultimi anni sono stati compiuti molti progressi per comprendere le basi molecolari dell’uptake del Cd2+ nelle cellule vegetali. Alcuni studi storici hanno dimostrato come l’eccesso di alcuni cationi, quali Zn2+ e Ca2+, abbia un ruolo protettivo contro gli effetti
legati alla tossicità del Cd (Antonovics et al., 1971) e ciò è stato interpretato come il risultato della competizione per l’uptake.
Dato che il Cd è un metallo non essenziale, si è sempre sostenuta l’assenza di un meccanismo specifico di uptake per tale metallo, il cui ingresso nelle cellule vegetali avverrebbe piuttosto tramite i sistemi utilizzati dai cationi essenziali. E’ stato riscontrato, ad esempio, che in Arabidopsis thaliana, la famiglia di trasportatori di metalli ZIP (ZRT, IRT-like proteins) (in particolar modo ZRT1 e IRT1) oltre a rappresentare il principale sistema di uptake di Fe2+ per le cellule radicali (Vert et al., 2002), contribuisce anche all’assorbimento di Zn2+, Mn2+, Co2+ e Cd2+ (Korshunova et al, 1999).
Il Cd sarebbe inoltre capace di entrare nelle cellule vegetali attraverso i canali di ingresso dello ione calcio, come è stato dimostrato tramite studi compiuti da Perfus-Barbeoch et al. (2002), che mostrano, elettrofisiologicamente, come i canali del Ca2+ delle cellule di guardia risultino permeabili anche al Cd2+.
Un’altra famiglia di trasportatori di metalli che risulta coinvolta nell’ingresso del Cd all’interno delle cellule vegetali è costituita dalla Nramp (Natural resistance associated macrophage proteins) (Maser et al., 2001); infatti il trasportatore AtNramp3, situato sulla
membrana vacuolare, sembra essere coinvolto nella mobilizzazione del metallo all’interno del vacuolo (Thomine et al., 2003).
Perciò lo ione Cd2+ può comunemente entrare all’interno delle cellule vegetali attraverso i trasportatori e i canali a bassa specificità coinvolti nell’uptake di Fe2+, Ca2+ e Zn2+.
Nella pianta Thlapsi caerulescens, iperaccumulatrice di Cd, però, si ipotizza l’esistenza di uno specifico sistema di uptake di tale elemento, in quanto studi compiuti con due ecotipi di tale specie hanno mostrato che l’ingresso di esso all’interno delle radici non veniva inibito da una concentrazione equimolare di Zn2+ (Lombi et al., 2001), suggerendo l’indipendenza dei meccanismi coinvolti nell’assorbimento radicale di questi due elementi. Le radici delle piante contribuiscono a rendere gli ioni metallici maggiormente disponibili per l’uptake, non solo acidificando la rizosfera attraverso le pompe protoniche localizzate sulle membrane, ma anche producendo composti a basso peso molecolare, quali i fitosiderofori e gli acidi organici (ad esempio il citrato) che agiscono chelando i metalli. Non è però ancora chiaro se e a quale livello tali composti siano in grado di influenzare l’uptake di ioni metallici non essenziali, come il Cd2+, in quanto ci sono molte evidenze che suggeriscono la capacita dei fitosiderofori di chelare tale metallo, ma da alcuni studi sembra che tali complessi non riescano ad entrare nelle cellule radicali (Shenker et al., 2001).
La mobilizzazione e il trasporto degli ioni metallici attraverso la plasma-membrana sono solo il primo passo nell’uptake e nell’accumulo di tali metalli e le forze che guidano tali processi sono il potenziale negativo della membrana e la presenza di siti intracellulari a cui si legano i metalli o in cui vengono compartimentalizzati.
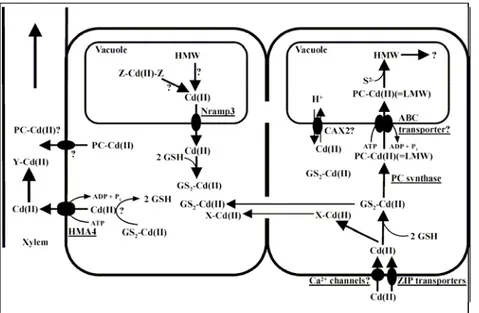
Figura 1-2: rappresentazione schematica dei processi coinvolti nell’uptake, sequestro e traslocazione del Cd nelle radici delle piante (Clemens, 2006).
Nella figura 1-2 sono rappresentate due cellule radicali, una a contatto con la rizosfera (destra) e l’altra adiacente al tessuto che trasporta l’acqua e i sali minerali (xilema), connesse simplasticamente attraverso i plasmodesmi.
Gli ioni Cd2+ entrano all’interno della cellula adiacente alla rizosfera attraverso i trasportatori di Fe2+/Zn2+ della famiglia ZIP, i canali di ingresso del Ca2+ e probabilmente tramite gli altri trasportatori discussi precedentemente.
Molti, se non tutti, gli ioni metallici si trovano all’interno delle cellule non come idrati, ma legati a complessi a basso (LMW) o alto peso molecolare (HMW). Ciò vale anche nel caso del Cd e di tutti gli altri metalli di transizione, in quanto, grazie alla loro elevata affinità nei confronti dei tiolati, riescono a legarsi a molte molecole cellulari contenenti tali gruppi. Inizialmente, nel citosol, il Cd si lega al glutatione (GSH) e, potenzialmente, ad altre molecole sconosciute (X), formando così i complessi GS2-Cd(II) (o X-Cd(II)) in grado di
interagire con l’enzima fitochelatina sintasi (PCS), inducendo la sintesi delle fitochelatine (PCs). Le fitochelatine sono peptidi con la seguente struttura: (γ-Glu-Cys)n-Gly (n=2-11),
sintetizzati a partire dal GSH tramite una reazione di transpeptidasi catalizzata dall’enzima PCS, che viene attivato dalla presenza di ioni metallici, in particolar modo da Cd2+. Perciò,
la presenza di un eccesso di Cd determina la sintesi delle fitochelatine, che catturano ed immobilizzano il metallo stesso (Howden et al., 1992; Larsson et al., 2002).
I complessi a basso peso molecolare (LWH) che si formano tra Cd2+ e fitochelatine (PC-Cd2+) vengono trasportati all’interno del vacuolo, il più importante sito in cui vengono sequestrati i metalli, tramite un trasportatore di tipo ABC (ATP-binding cassette), l’Hmt1 (Ortiz et al., 1992). Al suo interno, i complessi LWH legano il solfuro (S2-), formando complessi ad alto peso molecolare (HWM), che probabilmente sono transitori, anche se il loro destino è tutt’ora sconosciuto (Clemens, 2006).
Un secondo possibile meccanismo di sequestro del Cd è rappresentato dall’antiporto Cd2+/H+ attraverso il tonoplasto (trasporto contemporaneo di due specie ioniche, che si muovono in direzioni opposte attraverso la membrana, in cui una delle due sostanze viene lasciata fluire secondo gradiente, generando l'energia entropica necessaria per guidare il trasporto dell'altro soluto contro gradiente), probabilmente tramite un trasportatore della famiglia CAX (catione divalente/H+) (Hirschi et al., 1996).
I fattori chiave nel determinare il tasso di traslocazione del Cd nelle parti aeree della piante, sono, quindi:
- l’attività di sequestro del metallo nelle cellule radicali,
- l’efficienza del passaggio simplastico attraverso le radici e l’endoderma, - l’attività di trasporto da parte dello xilema (Clemens et al., 2002).
Una frazione del Cd vacuolare legato ai complessi HWH può di nuovo essere mobilizzato e tornare nel citosol attraverso alcune proteine, come la AtNramp3 (Thomine et al., 2003). Il trasferimento simplastico richiede la disponibilità di ligandi mobili ad elevata affinità per il Cd, quali il Gs2-Cd(II) o X-Cd(II) (figura 1-2).
Il passaggio dal citosol delle cellule radicali ai tessuti vascolari richiede il trasporto degli ioni dei metalli e/o dei complessi a cui sono legati i metalli attraverso la membrana cellulare. Tale attività viene probabilmente svolta dai trasportatori P-type ATPasi (HMAs), che funzionano da pompe di efflusso di molti metalli e, tra queste, dall’AtHMA4, che ha come substrato anche il Cd. E’ stata inoltre ipotizzata la possibilità di un efflusso dei complessi PC-Cd2+, mentre restano sconosciuti i ligandi del Cd nello xilema (Clemens, 2006).
1.4 Effetti fitotossici del cadmio e meccanismi di risposta delle piante
Negli organismi vegetali, l’esposizione ad elevate concentrazioni di Cd comporta l’inibizione della crescita sia delle radici che della parte aerea, la comparsa di clorosi fogliari, l’alterazione del bilancio idrico (Costa & Morel, 1994) e l’inibizione dell’apertura stomatica. La riduzione della crescita è legata alla diminuzione del tasso di allungamento delle cellule vegetali, in particolar modo di quelle del fusto, causato dall’inibizione irreversibile esercitata dal metallo sulla pompa protonica responsabile di tale processo (Aidid & Okamoto, 1992, 1993).
Per quanto riguarda l’inibizione dell’apertura stomatica, probabilmente l’azione esercitata dal Cd non interessa direttamente i movimenti stomatici, ma interferisce con gli spostamenti di K+, Ca2+ e dell’acido abscissico nelle cellule di guardia (Barcelò et al., 1990). Inoltre, la presenza di tale metallo riduce significativamente il normale scambio H+/K+ e l’attività delle ATPasi di membrana (Obata et al., 1996).
Il Cd, inoltre, provoca disturbi nel metabolismo del cloroplasto attraverso la degradazione e l’inibizione della biosintesi di clorofilla e carotenoidi (Somashekaraiah et al, 1999; Bazzaz et al., 1992). Ciò può determinare alterazioni nel trasporto elettronico nei fotosistemi, determinando la produzione di ROS.
Alte concentrazioni di tale metallo sono perciò in grado di danneggiare l’apparato fotosintetico, in particolare l’LHCII (light harvesting complex II) (Krupa, 1988) e i due
fotosistemi (PSI e PSII) (Siedlecka et al., 1996) . Studi in vitro hanno infatti dimostrato che il Cd riduce drammaticamente la fotosintesi a vari livelli, in quanto determina:
- effetti diretti sul trasporto elettronico nel PSII (van Assche et al., 1985; Basynsky, 1986);
- riduzione nel contenuto di plastochinone nel cloroplasto (Krupa et al., 1992); - inibizione del ciclo di Calvin (Weigel, 1985);
- diminuzione della biosintesi di clorofilla (Padmaja et al., 1990).
In vivo, però gli effetti del Cd sulla fotosintesi possono essere molto vari o addirittura nulli, a seconda della specie vegetale considerata, dell’età della pianta, della durata di esposizione, del regime luminoso a cui è sottoposta la pianta.
Molti studi hanno dimostrato l’interferenza spesso negativa esercitata dal Cd nei confronti del contenuto e dell’attività di molti enzimi metabolici, quali glucosio 6-fosfato deidrogenasi, glutammato deidrogenasi, enzima malico, isocitrato deidrogenasi (van Assche et al.,1990; Mattioni et al., 1997), Rubisco e anidrasi carbonica (Siedlecka et al., 1997).
Tale metallo è in grado anche di ridurre la fosforillazione ossidativa nei mitocondri, probabilmente tramite l’incremento della permeabilità passiva delle membrane mitocondriali interne agli ioni H+ (Kessler & Brand, 1995).
E’ stato riscontrato come uno degli effetti primari dell’esposizione al Cd sia rappresentato dallo stress ossidativo (Hendry et al., 1992), anche se, non essendo un metallo redox (infatti con le normali condizioni fisiologiche è presente esclusivamente come catione divalente), non partecipa alle reazioni di Fenton e di Haber-Weiss. Sembra, quindi, che il Cd non produca direttamente le specie reattive dell’ossigeno (ROS) (Salin, 1988), ma induca alterazioni nell’attività degli enzimi antiossidanti e nel livello di antiossidanti solubili, con conseguente diminuzione della capacità di scavenging delle ROS prodotte dal normale metabolismo cellulare. In condizioni non perturbate, nelle cellule vegetali viene mantenuto uno stato di equilibrio tra la formazione delle ROS e la loro rimozione attraverso l’azione di sistemi antiossidanti di natura enzimatica, quali superossido dismutasi (SOD), catalasi (CAT) e perossidasi (POD), e di natura non enzimatica, quali acido ascorbico, glutatione, carotenoidi, flavonoidi e composti fenolici (Noctor & Foyer, 1998; Podila et al., 2001). La presenza di Cd, invece, riduce l’attività di molti enzimi antiossidanti, quali ascorbato perossidasi (APX), glutatione riduttasi (GR) e deidroascorbato riduttasi (DHAR) (Gallego et al., 1996). Molti sintomi dello stress ossidativo, come ad esempio la perossidazione lipidica, sono la conseguenza della
diminuzione di GSH, dovuta al suo legame con Cd2+ per formare le fitochelatine (Schützendübel et al., 2002), oltre che dell’aumento indotto a carico dell’attività dell’enzima lipossigenasi (Gallego et al., 1996). Inoltre il Cd è in grado di legarsi ai tioli (gruppi S-H) e quindi, come già accennato, di ridurre il contenuto degli enzimi contenenti tali gruppi, come la GR (Mullineaux et al, 1997) e lo stesso meccanismo di inibizione agisce nei confronti dell’APX, in quanto sensibile ai reagenti tiolici. (Chen & Asada, 1992). Tale metallo, quindi, inibisce il sistema coinvolto nell’eliminazione di H2O2 (GSH/GR, CAT, APX) e aumenta
l’attività della SOD, che tramite una reazione di dismutazione produce H2O2, assistendo,
quindi, ad un accumulo di quest’ultima. (Polle, 2001).
Le piante rispondono alla presenza di un’eccessiva concentrazione di Cd nel suolo, attraverso una serie di meccanismi atti a contrastare l’assorbimento del metallo e/o a difendersi dai suoi effetti tossici, come di seguito riportato (Sanità di Toppi et al., 1999): - Esclusione, meccanismo di prevenzione dell’ingresso degli ioni Cd2+ nel citosol
attraverso la modifica del pH della rizosfera, l’aumento del rilascio di acidi organici chelanti e di mucillagini da parte delle radici.
- Immobilizzazione dello ione da parte della parete cellulare e dei carboidrati extracellulari (mucillaggini, callosio) (Verkleij & Schat, 1990; Wagner,1993). Costituisce la prima barriera di difesa a livello radicale.
- Produzione di fitochelatine, cioè di agenti complessati che legano il metallo ai gruppi S-H della cisteina (Cys) prevenendo così la circolazione di Cd2+ libero nel citosol (Grill et al.,
1985).
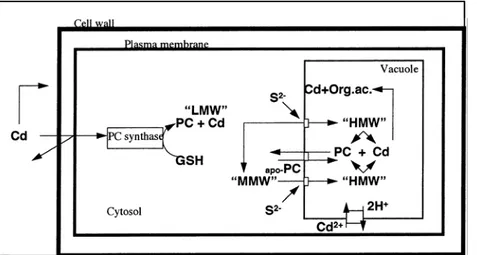
- Compartimentalizzazione vacuolare dei complessi PC-Cd(II) che si legano al solfuro dando origine a complessi ad alto peso molecolare (Speiser et al., 1992), la principale forma di immagazzinamento del Cd (figura 1-3). Ciò previene la libera circolazione degli ioni Cd2+ nel citosol in quanto li costringe in un’area limitata, il vacuolo, che rappresenta il principale comparto di stoccaggio dei composti tossici.
- Produzione di metallotionine, cioè di peptidi a basso peso molecolare, ricchi di cisteina e capaci di complessare il Cd in animali, cianobatteri e funghi, mentre non è stata accertata la loro presenza nelle cellule vegetali.
- Sintesi di proteine da stress (heat shock protein, hsp), quali l’ubiquitina, l’hsp 100, 90, 70, 60 e piccole proteine con un PM compreso tra 17000 e 30000 Da (Waters et al., 1996).
- Biosintesi di etilene attraverso la via dell’MSAE (metionina, S-adenosilmetionina, 1-aminociclopropano 1-acido carbossilico, etilene) (Adams & Yang, 1979). Tale ormone
rappresenta un importante segnale coinvolto nella modulazione delle risposte delle piante a stress di natura sia biotica che abiotica, in grado di accelerare la lignificazione (Ievinsh & Romanovskaya, 1991), ridurre il flusso di acqua e di Cd nelle foglie a causa dell’alterazione delle pareti cellulari del sistema vascolare (Fuhrer et al., 1981), indurre l’attività dell’ascorbato perossidasi (Mehlhorn, 1990) e regolare l’espressione dei geni che codificano metallotionine e/o proteine da stress (Whitelaw at al., 1997).
figura 1-3: rappresentazione schematica dei meccanismi coinvolti nella chelazione del Cd e della sua compartimentalizzazione nel vacuolo (Sanità di Toppi et al.,1999)
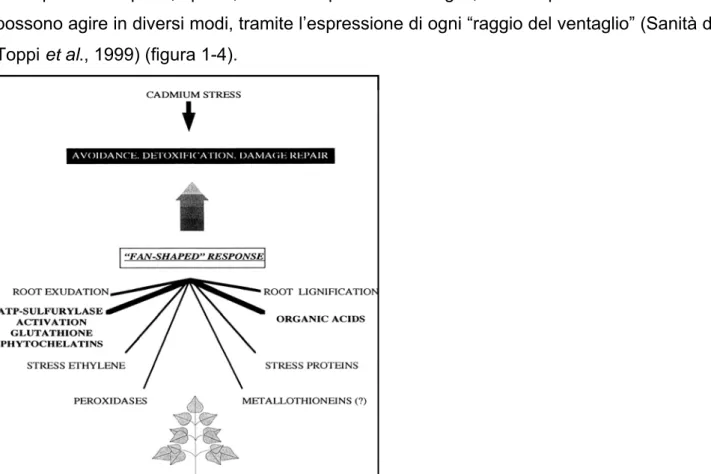
I principali meccanismi di difesa che la pianta mette in atto quando sottoposta ad uno stress da Cd coinvolgono processi per la complessazione del Cd nel citosol tramite il glutatione e nel vacuolo tramite acidi organici quando la pianta è sottoposta a bassi livelli di metallo, mentre la presenza di concentrazioni più elevate richiedono anche altri meccanismi, quali la sintesi e complessazione tramite fitochelatine e solfuro (Vogeli-Lange & Wagner, 1996). Le proteine da stress sembrano essere indotte solo da alte o altissime concentrazioni di Cd e possono agire per limitare e riparare i danni alle proteine cellulari e forse esercitano anche un’azione protettiva delle membrane (Panaretou & Piper, 1992). L’esposizione al Cd richiede, quindi, una risposta da parte della pianta costituita da eventi in parallelo e/o consecutivi, rapidi processi fisiologici e lenti processi morfologici. La prima linea di meccanismi di difesa è costituita dalle fitochelatine (importanza della loro quantità, rapidità nel formare complessi ad elevato peso molecolare, numero di gruppi γ-Glu-Cys, incorporazione di S2-) e dalla compartimentalizzazione vacuolare, mentre la seconda linea è formata dalla proteine da stress (in grado di riparare i danni molto velocemente), dall’etilene e dalle perossidasi. Altre strategie di difesa che le piante possono adottare consistono nello sviluppo delle radici per evitare il contatto con il Cd e nel’intervento delle micorrizze per legare i metalli pesanti. Tutti i meccanismi di difesa precedentemente
della pianta. Si parla, quindi, di una risposta a ventaglio, in cui questi diversi sistemi possono agire in diversi modi, tramite l’espressione di ogni “raggio del ventaglio” (Sanità di Toppi et al., 1999) (figura 1-4).
Figura 1-4: “risposta a ventaglio” (fan-shaped response) di piante esposte a Cd (Sanità di Toppi et
al., 1999).
La risposta alla presenza di Cd è in accordo con la sindrome generale di adattamento (GAS=general adaptation syndrome), infatti non esiste una specificità di risposta a tale metallo, ma i vari meccanismi di difesa sono comuni a quelli che la pianta utilizza in caso di stress da altri metalli pesanti e da altri agenti, come la salinità, la temperatura, l’esposizione all’ozono, la siccità, ecc.
1.5 Meccanismi di tolleranza al cadmio
Si parla di tolleranza reale al Cd quando ci riferiamo alla capacità, naturale o acquisita artificialmente, regolata dall’interazione di fattori genetici e ambientali, di sopportare elevati livelli di tale metallo per un lungo periodo tempo, senza effetti apprezzabili sul metabolismo. Essa considera un processo a lungo termine e coinvolge modifiche nel patrimonio genetico della pianta. Ad esempio, alcuni geni “minori”, che di per sé non conferiscono tolleranza, possono modificare l’espressione di geni “maggiori”, perfezionando e aumentando i loro effetti sulla tolleranza. Sotto una pressione selettiva di lungo termine, la frequenza e l’espressione di certi geni può conferire o incrementare la
reale tolleranza al Cd e il requisito essenziale perché una pianta possa acquisirla è la plasticità del proprio fenotipo (Sanità di Toppi et al, 1999).
Le piante caratterizzate dalla tolleranza reale ad un certo metallo sono le iperaccumulatrici, in grado di vivere, crescere e riprodursi in suoli metalliferi. Grazie all’evoluzione, però, molti habitat naturali delle piante terrestri non presentano contaminazione da Cd (e anche da altri metalli non essenziali come As e Hg) e quindi ci si chiede da dove provenga la pressione selettiva che ha mantenuto in ogni specie i meccanismi di detossificazione e di tolleranza per tale metallo. Probabilmente si tratta di un relitto dell’evoluzione o di un fenomeno biochimico accidentale (Chaney et al., 1997), ma sono state proposte anche altre tre possibili spiegazioni (Clemens, 2006):
- le vie di detossificazione dei metalli non essenziali potrebbero giocare un ruolo importante nel mantenere l’omeostasi relativamente ai metalli essenziali,
- i meccanismi molecolari della tolleranza ai metalli pesanti potrebbero avere altre funzioni, ancora sconosciute
- Cd e As potrebbero essere considerati metalli essenziali e i meccanismi di detossificazione prendere parte al processo di omeostasi di tali elementi. Ad esempio, in ambiente marino il Cd si comporta da micronutriente.
2. Inquinamento da ozono troposferico
2.1 Monitoraggio dell’esposizione all’ozono degli ecosistemi forestali
A partire dai primi anni ’80 la preoccupazione generata dalla drammatica perdita di vitalità di molte aree forestali in Europa e Nord America, associata alla crescente consapevolezza dell’importanza degli ecosistemi forestali, sia da un punto di vista ecologico che economico, ha gettato le basi per una serie di studi volti a ricercare le cause responsabili del cosiddetto “forest decline”. Tale graduale deterioramento sembrava non essere riconducibile a fattori biotici o abiotici ben precisi, perciò si iniziò a parlare di “danno di nuovo tipo”. I principali sintomi osservati erano: ingiallimento e perdita delle foglie, riduzione della crescita del diametro del fusto, prematuro declino della crescita in altezza del fusto, morte delle radici assorbenti, produzione di rami di forma e lunghezza anomale, eccessiva produzione di gemme avventizie ed alterazione della frequenza di fruttificazione (Borghetti & Giannini, 1998).
Questo fenomeno di deperimento forestale viene sempre più spesso messo in correlazione con i danni indotti dall’inquinamento atmosferico (Ciesla & Donabauer 1994), che nel bacino del Mediterraneo rappresenta una delle principali cause del deperimento delle specie arboree (Inclán et al. 1999, Fumagalli et al. 2001), manifestandosi non solo attraverso un’azione fitotossica diretta, ma anche inducendo nelle piante un’aumentata suscettibilità a fattori stressanti abiotici e a malattie parassitarie. Tra i diversi fattori correlabili all’insorgenza di questo fenomeno l’ozono (O3) troposferico sembra essere uno
dei maggiori responsabili, dal momento che è in grado di esercitare la propria fitotossicità anche a concentrazioni piuttosto basse.
L’O3 troposferico viene oggi considerato il più importante inquinante atmosferico
secondario, prodotto attraverso reazioni biochimiche a partire dalle emissioni dei precursori primari, costituiti dagli ossidi di azoto (NOx) e dai composti organici volatili
(COV). Risulta essere l’inquinante più diffuso nelle zone rurali e forestali nel corso della stagione primaverile-estiva, quando si verificano le condizioni più favorevoli alla sua formazione.
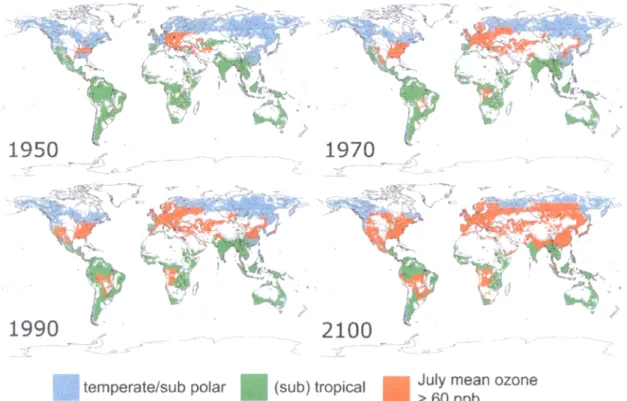
Come mostrato dalla figura 2-1, la distribuzione su scala globale dell’O3 evidenzia come
nel periodo compreso tra il 1950 e il 1970 la superficie forestale complessiva esposta a concentrazioni di O3 maggiori di 60 ppb sia triplicata. Dal 1990 l’esposizione a tale
concentrazione ha interessato il 24% della superficie forestale globale ed in base alle previsioni questa percentuale arriverà nel 2100 al 50%, risultando pari a circa 17 milioni di km2 di foreste (Fowler et al., 1999). Si tratta di una previsione allarmante, dal momento
che piante con un’elevata sensibilità nei confronti dell’inquinante sono già a rischio in presenza di 40 ppb di O3 (Holopainen, 1996).
Figura 2-1: Superficie forestale globale in cui i picchi di concentrazione in Luglio superano il valore di 60 ppb (Fowler et al., 1999).
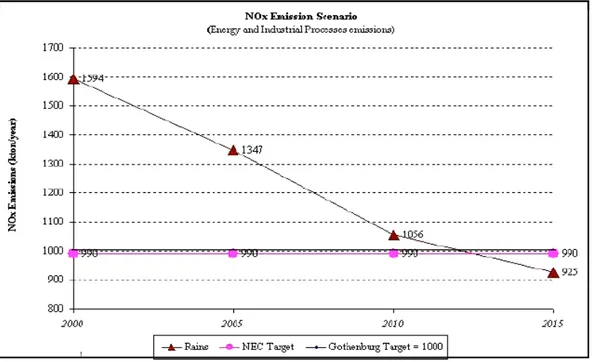
In America del nord e in Europa occidentale l’entità delle emissioni dei precursori dell’ O3
si sono ridotte di circa il 30% tra il 1990 ed il 2000 (EEA, European Environment Agency, 2003). Come evidenziato dalle figure 2-2 e 2-3, tale decremento continua tutt’oggi e, in base a quanto riportato in “Europe’s environment: the third assessment” (2003), i modelli di previsione per il 2010 mostrano una riduzione dell’esposizione a concentrazioni di O3
Figura 2-2: Emissioni di NOx da processi industriali e dal comparto energetico. Anni 2000-2015.
(Rains = modello matematico di riferimento; NEC/Gothenburg Target = obiettivi europei per il 2010) (Fonte: elaborazione ENEA su dati ENEA/APAT)
Figura 2-3: Emissioni di composti organi volatili (COV). Anni 2000-2015. (Rains = modello matematico di riferimento; NEC/Gothenburg Target = obiettivi europei per il 2010) (Fonte: elaborazione ENEA su dati ENEA/APAT).
Nonostante i picchi di concentrazione a breve termine si stiano progressivamente riducendo, esistono evidenze relative ad un aumento globale delle concentrazioni basali di O3, con conseguenti significativi incrementi nell’esposizione complessiva delle piante
all’inquinante. Ad esempio, in Gran Bretagna il NEGTAP (2001) ha riscontrato, nell’ultimo decennio, una riduzione del 30% dei picchi di concentrazione dell’O3, ma anche un
L’aumento delle concentrazioni basali può ridurre, o addirittura annullare, l’impatto delle politiche regionali di controllo delle emissioni volte a ridurre la concentrazione di tale inquinante. Inoltre, in molte regioni in via di sviluppo dell’Asia, America latina ed Africa l’aumento delle concentrazioni basali è accompagnato dall’incremento delle emissioni dei precursori dell’ O3, suggerendo che l’impatto futuro dell’inquinante sulle foreste e sulle
culture in queste aree diventerà molto significativo (Emberson et al., 2003).
Studi e monitoraggi condotti alle medie latitudini dell’emisfero settentrionale suggeriscono un incremento annuale delle concentrazioni basali compreso tra lo 0,5 e il 2% (Vingarzan, 2004), dovuto soprattutto all’incremento a livello mondiale delle emissioni degli ossidi di azoto.
L’Europa, ed in particolar modo quella meridionale, è interessata da concentrazioni molto elevate di O3, soprattutto nella stagione estiva, quando le condizioni di temperatura e luce
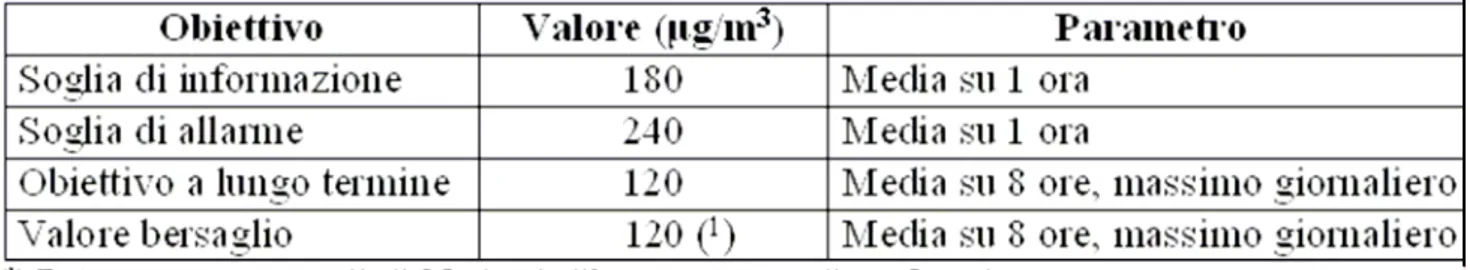
sono più favorevoli alla sua produzione (Lorenzini et al., 1994, Nolle et al., 2002). In particolare, in Italia esse superano i limiti stabiliti per proteggere la salute umana e la vegetazione (EEA, 2003, 2005). Proprio per far fronte a tale problema, a partire dai primi anni ’90 dello scorso secolo, l’Unione Europea ha iniziato a sviluppare una politica mirata alla riduzione della concentrazione atmosferica di O3, come di altri inquinanti dannosi per
gli ecosistemi vegetali. Oggi, il testo a cui ogni Stato europeo deve far riferimento è la Direttiva 2002/3/CEE, recepita in Italia con il D.Lgs n.183 del 21/05/2004, in cui sono stati fissati gli obiettivi primari a lungo termine, le soglie di allerta e le soglie di informazione per evitare, prevenire o ridurre gli effetti dannosi dell’O3 sulla salute umana e sull’ambiente
(Tabella 2-1). In tale direttiva sono stati forniti metodi e criteri per la valutazione della concentrazione ambiente di O3, sulla base della quale rendere disponibili per la
popolazione adeguate informazioni ed inoltre è stata promossa una sempre maggiore collaborazione tra gli Stati membri per la riduzione dei livelli di tale inquinante.
Tabella 2-1: Valori soglia, obiettivi a lungo termine e valori bersaglio di concentrazione di ozono per la protezione della salute umana, come previsto dalla Direttiva 2002/3/CEE (EEA, 2005)
Il monitoraggio degli ecosistemi forestali è molto importante per capire gli effetti che l’esposizione all’O3 determina sulla vegetazione. L’indice di esposizione si basa sul
concetto di dose effettiva, ossia rileva le caratteristiche dell’esposizione che più direttamente sono correlate con la quantità di O3 assorbita dalla vegetazione (Grünhage &
Jäger, 1994).Per stimare il rischio per le colture e le foreste, l’indice più appropriato deve essere di tipo cumulativo, in quanto generalmente esse risultano interessate da un’esposizione di tipo cronico, ossia da basse concentrazioni di inquinante per lunghi periodi di tempo. A tale proposito, si fa riferimento al concetto di livello critico, inteso come “la concentrazione, l’esposizione cumulativa o il flusso stomatico cumulativo dell’inquinante atmosferico al di sopra della quale possono verificarsi effetti negativi sui recettori, come le piante, gli ecosistemi ed i materiali, sulla base delle conoscenze attuali” (UN/ECE, 2004).
Nell’area UN/ECE i due principali approcci al concetto di livello critico (CLe) sono:
- livello critico basato sulla concentrazione (CLec), - livello critico basato sul flusso (CLef).
Essi identificano l’esposizione cumulativa (O3 cumulato al di sopra di x ppb, AOTx) o il
flusso cumulativo (flusso di O3 cumulato, al di sopra una soglia y, AFsty) che causa la
riduzione del 5% del raccolto (UN/ECE, 2004).
Il livello critico che comunemente viene adottato per l’O3 si basa sull’indice di esposizione
cumulativa AOT40 (Accumulated Ozone Exposure Over a Threshold Concentration of 40 ppb) (UBA, 1996). Questo indice è espresso come sommatoria delle eccedenze delle concentrazioni medie orarie di O3 al di sopra del valore di 40 ppb in un determinato
intervallo di tempo ed è calcolato durante le ore del giorno in cui si registra una radiazione globale uguale o superiore a 50 W m-2. Vengono quindi escluse le ore notturne, durante le quali sono stati misurati soltanto valori trascurabili di deposizione dell’O3 sulle colture
agricole e sulle specie arboree forestali (WHO, 2000).
Il livello critico (CLec) per gli ecosistemi forestali è stato fissato in 10000 ppb h,
recentemente portata a 5.000 ppb h per le piante più sensibili, in condizioni stazionali favorevoli all’assorbimento di O3, come media di 5 anni nelle ore di luce della stagione
vegetativa da Aprile a Settembre, mentre per le colture agrarie e gli ecosistemi semi-naturali è stato fissato in 3000 ppb h, calcolato nelle ore di luce nel periodo Maggio-Luglio (UN/ECE, 2004).
Per quanto riguarda la situazione italiana, il Ministero delle Politiche Agricole e Forestali ha avviato nel 1995 il Programma Nazionale Integrato per il Controllo degli Ecosistemi
Forestali (CONECOFOR) per il monitoraggio forestale intensivo, con l’obiettivo di studiare le interazioni ecologiche tra le componenti strutturali e funzionali degli ecosistemi forestali ed i fattori di pressione e di cambiamento su larga scala (inquinamento atmosferico, cambiamenti climatici, variazione dei livelli di biodiversità). Tale Programma, svolto nel quadro della Convenzione Internazionale UN/ECE sull'Inquinamento Atmosferico Transfrontaliero a Lungo Raggio ed in attuazione del Regolamento (CE) n. 2152/2003 sul monitoraggio delle foreste e delle interazioni ambientali (Forest Focus), è il primo ed unico esperimento riuscito di Rete ecologica a lungo termine su scala nazionale. Esso è basato su 31 aree permanenti sparse su tutto il territorio nazionale e rappresentative di tutte le principali comunità forestali italiane (faggete, peccete, cerrete, leccete, foreste planiziali, ecc.).
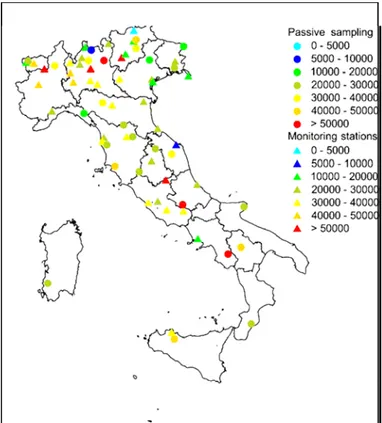
Le misure effettuate con i campionatori passivi dislocati presso le aree di monitoraggio permanente della Rete CONECOFOR, hanno stimato livelli di O3 pari a circa 15.000 ppb h
in molti siti della Penisola e degli Appennini, con una punta massima annuale di 45.500 ppb h in Sicilia, tutti valori ben al di sopra della soglia di rischio per le piante stabilita a livello internazionale (10.000 ppb h).
In base ai primi dati disponibili, la situazione degli altri Paesi europei partecipanti al Programma Paneuropeo di monitoraggio intensivo degli ecosistemi forestali appare a grandi linee analoga a quella italiana soltanto in Spagna, mentre sembra di gran lunga migliore nella zona centroeuropea, con valori al di sotto della soglia di danno di 10.000 ppb h. Ancora non si dispone di dati di questo genere per l’Europa Settentrionale.
In molte delle aree di monitoraggio sono stati osservati chiari sintomi dei danni arrecati dall’ O3 alle foglie, mentre riduzioni dell’accrescimento ed aumento della defogliazione
delle piante sono risultati parzialmente correlabili all’azione dell’O3. Questi risultati
costituiscono le prime evidenze sperimentali dei potenziali effetti dell’inquinante atmosferico sulla vitalità delle foreste, la loro capacità di sequestro del carbonio ed il livello di biodiversità.
La figura 2-4 mostra i valori medi di AOT40 forestale nel periodo 2000-2003, ottenuti da 41 stazioni automatiche della rete nazionale di monitoraggio della qualità dell’aria e da 26 siti di campionamento passivo appartenenti al Programma CONECOFOR. Nel 98% dei siti forestali monitorati si registrava il superamento dei livelli critici, evidenziando, perciò, il grave rischio a cui sono sottoposte le nostre foreste.
Figura 2-4:Valori medi di AOT40 forestale misurati nel periodo 2000-2003 in Italia (Ferretti et al.,2006).
Negli ultimi anni in Europa si è aperto un forte dibattito sulla possibilità di sostituire, per la valutazione del rischio su scala regionale, gli indici di esposizione con modelli di flusso cumulato, poiché questi ultimi tengono conto dell’influenza dei fattori climatici ed ontogenetici sull’assorbimento dell’O3, mentre gli indici di esposizione dipendono solo
dalle condizioni atmosferiche che determinano gli episodi fotochimici, prescindendo dalle caratteristiche degli organismi e dalle funzioni che regolano l’assunzione di O3 (Ashmore,
2005).
Gli indici di flusso che sono stati proposti da Pleijel et al. (2004), Karlsson et al. (2004) e Uddling et al. (2004) assumono un valore soglia di flusso al di sotto del quale non si hanno effetti da O3 e che può essere correlato con la capacità della pianta di detossificare l’O3
assorbito.
Nonostante l’introduzione di modelli sempre più precisi e che considerano sempre più parametri ambientali, valutando i sintomi di piante forestali esposte alla presenza dell’O3,
viene riscontrata la mancanza di una chiara relazione tra la frequenza ed intensità dei sintomi e l’esposizione all’O3 (valutata utilizzando sia i livelli critici di esposizione che di
flusso) (Busotti et al., 2003; Ferretti et al., 2004; Ferretti et al., 2006). Ciò è probabilmente dovuto alle seguenti cause:
- mancata specificità degli indicatori utilizzati per monitorare gli effetti dell’O3
- inadeguatezza dei livelli critici (CLec e CLef) fissati. I valori di AOT40, pari a 3000 e
10000 ppb h rispettivamente per le colture agrarie e per le foreste non risultano infatti realistici, ed inoltre gli stessi valori non possono essere applicati alle diverse condizioni ambientali e climatiche presenti in Europa;
- difficoltà nello stimare gli effetti dell’esposizione all’O3 tramite funzioni di risposta
lineare, in quanto, nelle condizioni di campo, agiscono simultaneamente molti fattori, che possono modificare la risposta delle piante ad un singolo inquinante;
- presenza di limitazioni ambientali all’uptake di tale inquinante e quindi al suo ingresso all’interno della pianta, soprattutto nell’Europa meridionale. Esse sono costituite dal deficit idrico estivo (riduce la conduttanza stomatica, e quindi l’uptake, proprio nel periodo caratterizzato dai livelli di O3 più elevati), dalla salinificazione delle acque
superficiali (se utilizzate per irrigare riducono il potenziale idrico del suolo, che va incontro a deficit idrico) e dalle caratteristiche della vegetazione mediterranea (costituita da sclerofille, che tollerano meglio l’O3 grazie alle foglie spesse e con piccoli
spazi intercellulari, al basso tasso di traspirazione e alle forti emissioni di isoprenoidi, che proteggono le membrane plasmatiche dallo stress ossidativo).
Le limitazioni che l’ambiente pone all’uptake di O3 sono state il fattore chiave che ha
portato ad attribuire una sempre maggiore importanza all’utilizzo di modelli e livelli critici basati sul flusso (UN/ECE, 2004), che prendono infatti in considerazione anche le condizioni climatiche e le caratteristiche della vegetazione presente. Tali modelli possono inoltre fornire le basi per previsioni sul futuro impatto di mutevoli esposizioni all’O3 in
relazione ai cambiamenti del clima (Ashmore, 2005).
Tuttavia considerando solamente il periodo estivo, caratterizzato da deficit idrico, si riscontra un andamento analogo dei due indicatori. In base a considerazioni riguardanti la disponibilità idrica risulta infatti che l’AOT40 rappresenta un indicatore distorto dell’uptake di O3 solo quando l’approvvigionamento idrico alle piante non è regolare. In questo caso,
infatti, i valori massimi di conduttanza stomatica variano da periodo a periodo e così anche i flussi stomatici. In condizioni xeriche, invece, la conduttanza stomatica (gs) risulta essere
costantemente vicina al suo valore minimo e quindi il flusso di O3 dipende esclusivamente
dalla sua concentrazione esterna. Risulta perciò che in ambienti serici, quali quello mediterraneo, l’AOT40 può rivestire ancora un ruolo importante come indicatore dell’uptake stomatico (Ferretti et al., 2006).
2.2 Caratteristiche e genesi dell’ozono troposferico
L’ozono è un gas azzurrognolo, la cui molecola è costituita da tre atomi di ossigeno (O3)
(figura 2-5).Ha un peso molecolare di 48 Dalton, densità pari a 2,14 g l-1 e possiede un elevato potere ossidante, conferitogli da un potenziale redox pari a +2,07 V. Tale gas è in grado di reagire con composti organici, organismi biologici e vari tipi di materiale oltre ad essere soggetto a continue reazioni di produzione e di degradazione, l’equilibrio tra le quali determina la concentrazione dello stesso nell’atmosfera.
Figura 2-5: Rappresentazione schematica della molecola di ozono
In atmosfera è presente in concentrazioni dell’ordine di 20-80 μg/m3 e per il 90% si trova
nello strato di atmosfera che si estende tra i 15 ed i 50 km di altezza dalla superficie terrestre, denominato stratosfera.
In stratosfera l’O3 si forma per scissione fotolitica dell’ossigeno biatomico ad opera delle
radiazioni ultraviolette e successiva ricombinazione dell’ossigeno atomico con l’ossigeno molecolare, secondo le seguenti reazioni:
O2 + hν O + O (λ < 242.4 nm: ultravioletto)
O + O2 + M O3 + M
dove M rappresenta una specie, come azoto o ossigeno, in grado di assorbire l’energia in eccesso rilasciata dalla reazione e di stabilizzare la molecola di O3 che si è formata.
Dalla stratosfera, l’O3 può passare nella troposfera, lo strato di atmosfera più vicino alla
superficie terrestre (compreso tra 0 e 10 km di altezza) per azione di correnti verticali, rappresentando quindi una fonte naturale di O3 troposferico.
Mentre la presenza di tale gas nella stratosfera è essenziale in quanto, avendo un’azione filtrante e protettiva nei confronti delle radiazioni solari ultraviolette, garantisce la
sopravvivenza degli esseri viventi e degli ecosistemi, nella troposfera si comporta da pericoloso inquinante, con effetti nocivi sulla salute umana, sui materiali e sulla vegetazione (Heagle, 1989).
La presenza di O3 nella troposfera è comunque prevalentemente dovuta a complesse
reazioni fotochimiche che avvengono direttamente in tale regione. Tali reazioni coinvolgono la radiazione solare, gli ossidi di azoto (NOx), emessi come gas di scarico
dagli autoveicoli, ed i composti organici volatili (VOC, Volatile Organic Compounds) di origine sia antropica che naturale. Le principali sorgenti dei VOC sono costituite dal circuito del carburante (produzione, distribuzione ed uso), dall’industria e dall’impiego dei solventi organici, anche se nel periodo estivo l’emissione di idrocarburi dalla vegetazione (terpeni ed isoprene) rappresenta un contributo che, in certe aree, può essere paragonabile o addirittura predominante rispetto a quello delle emissioni antropiche (Ballarin Denti, 1997).
La presenza delle radiazioni ultraviolette nella troposfera determina una serie di reazioni che inducono la continua formazione e distruzione di O3 secondo un ciclo fotolitico. In
particolare, il biossido d’azoto subisce la riduzione a monossido di azoto e libera ossigeno monoatomico:
NO2 + hν NO + O
L’ossigeno atomico può ricombinarsi con l’ossigeno molecolare, che rappresenta quindi un precursore dell’ O3:
O + O2 + M O3 + M
Il monossido di azoto reagisce quindi con l’ O3 formato dando nuovamente origine
biossido di azoto ed ossigeno biatomico: NO + O3 NO2 + O2
Questa terza reazione “consuma” O3 e ciò fornisce la spiegazione dell’apparente
paradosso che vede le più basse concentrazioni di tale inquinante monitorate proprio nelle aree urbane, in cui le emissioni di ossido di azoto superano di gran lunga quelle rilevabili nelle zone a sviluppo rurale, dove l’ O3 e gli ossidi di azoto vi arrivano perché trasportati
dal vento.
Il risultato netto di questo ciclo è un rapido ricambio di NO2 a livello della troposfera, senza
che si verifichi alcun accumulo di O3. Tale ricambio risulta in particolare favorito da elevate
concentrazioni di NO e più esattamente da un rapporto NO2/NO spostato a vantaggio del
La presenza dei composti organici volatili (idrocarburi) interferisce con tale ciclo fotolitico e l’equilibrio dinamico delle varie specie chimiche coinvolte viene modificato. La loro reazione con l’ossigeno atmosferico o con il radicale idrossilico (HO•) porta alla formazione di composti intermedi, quali il radicale alchilperossido (ROO•) e idroperossido (HOO•), che interferiscono a livello della reazione di ossidazione dell’NO, che viene sostituita dalla più veloce reazione:
NO + ROO • RO• + NO2
NO + HOO • HO• + NO2
L’NO viene perciò ossidato a NO2 senza consumo di O3 e il ciclo di reazioni così ottenuto
conduce all’accumulo del gas inquinante nella troposfera (Gerosa et al., 1998).
La formazione ed accumulo di tale inquinante nella troposfera non dipende solo dalla presenza dei suoi precursori, ma anche dalle particolari condizioni metereologiche, in quanto nelle reazioni interviene la radiazione solare e quindi le condizioni di forte irraggiamento, tipiche della stagione primaverile-estiva, favoriscono tale processo. Anche l’elevata temperatura, la bassa umidità relativa e la stabilità atmosferica determinano una massiccia produzione fotochimica di O3, mentre i venti e le brezze contribuiscono a
ridistribuirlo, fino a interessare zone remote come quelle rurali e montane (Ballarin Denti, 1997).
Il tipico andamento giornaliero della concentrazione di O3 è rappresentato da una curva “a
campana”, con un valore massimo corrispondente alla massima intensità luminosa con un fattore di ritardo di circa un’ora (il tempo, cioè, necessario per l’innesco delle reazioni). Nonostante la produzione di O3 sia tipica delle aree urbane ad alta densità veicolare è
ampiamente accertata la presenza di elevate concentrazioni in zone lontane dai punti di emissione dei suoi precursori, come le aree rurali e forestali (Ranieri et al., 2001; Ashmore, 2005). I precursori dell’ O3 possono infatti essere trasportati per grandi distanze
(European Environment Agency, EEA, 2003) e, a causa dei movimenti di trasporto orizzontali, nelle aree rurali si verifica un accumulo di NO2, in condizioni di assenza o
scarsità di NO. Ciò determina una elevata produzione di O3 troposferico, che però non
viene “consumato”, poiché non avviene la reazione tra O3 e NO.
2.3 Assorbimento dell’ozono e suoi effetti fitotossici
La quantità di O3 che viene effettivamente assorbita dai tessuti vegetali gioca un ruolo
chiave nel determinare gli effetti sul metabolismo e sulla fisiologia della pianta. L’assorbimento viene regolato principalmente dalla velocità degli scambi gassosi fogliari
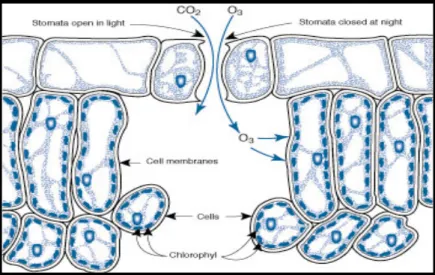
(Barnes et al., 1999, Ferretti et al., 2003). L’O3, infatti, penetra nella foglia principalmente
attraverso gli stomi (Tausz et al., 2006) (figura 2-6) e tale ingresso è regolato dal numero e dalle dimensioni degli stomi, nonché dal loro grado di apertura (Reich, 1987). Il flusso effettivo di gas che penetra all’interno del mesofillo dipende sia dalla conduttanza stomatica che dall’area effettiva del mesofillo esposta all’inquinante, dallo spessore della parete cellulare e dalla presenza di molecole detossificanti capaci di reagire con l’O3 e
quindi limitarne il flusso prima che esso possa raggiungere le plasmamembrane (Chameides, 1989).
In particolare tale flusso può essere espresso tramite la Legge di Fick: F = g * (Ca – Ci)
dove “F” rappresenta il flusso, “g” la conduttanza stomatica, “Ca” la concentrazione di O3
all’esterno della foglia e “Ci” quella all’interno, che viene assunta pari a zero a causa
dell’elevata velocità delle reazioni chimiche in cui è coinvolto l’O3 nella camera
sottostomatica (Laisk et al., 1989).
Figura 2-6:Rappresentazione schematica del meccanismo di uptake dell’ozono attraverso le aperture stomatiche
La fitotossicità di questo inquinante non dipende quindi dal suo accumulo in elevate concentrazioni all’interno dei tessuti vegetali, ma dalla sua capacità di dare origine già nella fase acquosa dello spazio extracellulare (apoplasto) a specie reattive dell’ossigeno (ROS), quali l’anione radicale superossido (O2•-), il radicale idrossilico (OH•) ed il
perossido di idrogeno (H2O2) (Laisk et al., 1989). Tali molecole tossiche sono in grado di
reagire rapidamente con le molecole delle pareti cellulari adiacenti o con i costituenti delle membrane cellulari, modificando o distruggendo importanti biomolecole come le proteine, i lipidi, i pigmenti, gli acidi nucleici, ecc.
La fitotossicità dell’O3 si differenzia in effetti acuti, determinati da alte concentrazioni
dell’inquinante presenti per brevi periodi, ed effetti cronici, provocati da prolungate esposizioni della vegetazione a dosi inferiori (Sandermann, 1996). Un’esposizione di tipo cronico determina danni molto simili a quelli provocati da una senescenza precoce, quali disturbi nel metabolismo degli zuccheri, inibizione della fotosintesi, sbilanciamenti nello stato di ossido-riduzione di alcuni metaboliti e di molecole intermediarie della catena di trasporto elettronico fotosintetico, nonché produzione di ROS (specie reattive dell’ossigeno), mentre generalmente non produce danni visibili.
L’esposizione di tipo acuto, invece, induce risposte d’ipersensibilità (HR) analoghe a quelle attivate in seguito all’attacco di fitopatogeni (Sandermann, 1996), come la comparsa di lesioni necrotiche (di colore porpora, bianco-avorio, brunastro) localizzate negli spazi internervali della pagina adassiale delle foglie mature, la cui formazione è dovuta essenzialmente all’azione delle ROS, e all’induzione di morte cellulare programmata mediata da una serie di molecole messaggero prodotte in seguito all’esposizione all’O3.
L’O3 determina alterazioni a livello fisiologico, in quanto l’attacco della membrana del
cloroplasto da parte delle ROS comporta la conseguente riduzione dell’attività fotosintetica ed inibisce l’attività e la quantità di Rubisco (enzima Ribulosio bifosfato carbossilasi), riducendo in tal modo la fissazione della CO2. Alterazioni dell’attività fotosintetica possono
manifestarsi prima dell’apparizione di sintomi visibili di danno sulla superficie fogliare e la loro entità dipende dalla specie vegetale, dall’età della foglia, dalla durata di esposizione all’O3 e dalle condizioni ambientali (Castagna et al., 2001). Alcuni autori hanno correlato la
diminuzione dell’attività fotosintetica con una riduzione della conduttanza stomatica (Hill & Littlefield, 1969; Moldau et al., 1993). Comunque, la riduzione della conduttanza fogliare non sembra essere, almeno nelle foglie mature, la causa primaria della riduzione della fotosintesi in presenza di O3 (Grandjean-Grimm & Fuhrer, 1992), mentre la riduzione
nell’efficienza di carbossilazione gioca un ruolo essenziale nel determinare variazioni nel processo fotsintetico (Pell et al., 1992, 1994; Farage & Long, 1999). La diminuzione dell’attività fotosintetica determina un decremento nella produzione di zuccheri solubili ed amido, con la conseguente riduzione della crescita, fenomeno aggravato dalla sottrazione di una parte delle risorse destinate all’accrescimento per potenziare i processi di detossificazione e di difesa (Guderian et al., 1985).
A livello ultrastrutturale, l’ O3 provoca la perdita dell’integrità delle membrane cellulari e la
conseguente riduzione nella capacità di trasportare sostanze chimiche e di mantenere l’omeostasi. Le membrane degli organelli, e specialmente quelle dei cloroplasti, sono i
bersagli più sensibili al danno da O3, che si manifesta tramite rigonfiamento dei tilacoidi e
produzione di plastoglobuli (Sutinen et al.,1990; Sellden et al.,1996; Holopainen et al., 1996).
2.4 La formazione delle ROS
L’origine delle specie reattive dell’ossigeno non è ancora completamente chiarito.
Secondo alcuni autori tali molecole vengono prodotte direttamente dalla decomposizione spontanea dell’O3 nell’apoplasto, attraverso una catena di reazioni che coinvolgono lo ione
radicale ozonide (•O3-), il radicale OH• e l’anione radicale O2•- (Laisk et al., 1989). Sembra
però che la diretta dissoluzione dell’O3 in ambiente acquoso si realizzi soltanto a pH
relativamente elevati, lontani da quelli fisiologici.
Secondo altri, invece, esse si producono a causa dell’interazione tra l’O3 e le molecole
organiche contenenti legami C-C, quali gli acidi grassi della componente lipidica delle plasmamembrane o gli idrocarburi endogeni emessi dalle piante (etilene, isoprene, terpeni) (Salter & Hewitt, 1992).
Infine, secondo le più recenti acquisizioni, si verificherebbe un’attiva generazione di H2O2
e O2•- da parte della cellula, il cosiddetto “burst ossidativo”, sia durante che dopo
l’esposizione all’O3 (Pellinen et al., 1999). In particolare, le prime ROS generate
direttamente o indirettamente dall’O3 stimolerebbero un’ulteriore produzione di specie
reattive dell’ossigeno da parte di sistemi enzimatici quali il complesso NAD(P)H-ossidasi legato al plasmalemma, in associazione con le superossido dismutasi, ed alcune isoforme perossidasiche extracellulari pH-dipendenti (Lamb & Dixon 1997; Bolwell 1999; Scheel 2002). Dal momento che la capacità delle perossidasi di produrre H2O2 è massima in
ambiente neutro o basico, la loro attività sarebbe favorita dalla temporanea alcalinizzazione dello spazio extracellulare, conseguente all’ingresso dell’O3.
2.5 Mecanismi di risposta della pianta all’ozono
Generalmente le piante sono ben adattate a minimizzare il danno ossidativo, in quanto la produzione di ROS avviene comunemente non solo come conseguenza della presenza di agenti stressanti quali O3, condizioni di basse temperature, carenze nutrizionali, presenza
di ferite, agenti patogeni, metalli pesanti, ecc. (Alonso et al., 2001; Baier et al., 2005; Ranieri et al., 2005), ma anche come risultato del loro normale metabolismo aerobico cellulare, in particolare in processi metabolici quali il trasporto elettronico fotosintetico nei
cloroplasti e durante la respirazione nei mitocondri (Sharma & Davis, 1997; Foyer & Noctor, 2003).
Dato che l’O3 viene assorbito dai vegetali soprattutto attraverso le aperture stomatiche e
successivamente decomposto nelle specie reattive dell'ossigeno (ROS), le piante possono adottare fondamentalmente due strategie difensive per proteggersi da questo inquinante. La prima prevede un meccanismo di esclusione dello stress, che consiste nella chiusura degli stomi e, quindi, in una riduzione della conduttanza con conseguente riduzione del flusso di O3 che entra nella pianta. Ciò però comporta anche una diminuzione
nell’assorbimento della CO2 e, qualora la chiusura stomatica sia eccessivamente
prolungata, la compromissione del processo fotosintetico. Questo metodo di difesa può perciò risultare vantaggioso soltanto nel caso di un’esposizione all’inquinante di tipo acuto, ossia limitata ad un periodo di tempo relativamente breve (Polle, 1998).
La strategia difensiva più efficace riguarda invece la tolleranza dello stress attraverso l’attivazione di sistemi di detossificazione per le ROS, in grado di mantenere sotto controllo il livello di tali molecole tossiche (Sharma & Davis, 1997) (figura 2-7). In condizioni non perturbate nelle cellule vegetali viene quindi mantenuto uno stato di equilibrio tra la formazione delle ROS e loro rimozione attraverso l’azione di tali sistemi antiossidanti, costituiti da:
- antiossidanti a basso peso molecolare, quali l’acido ascorbico, il glutatione, i carotenoidi, i flavonoidi e i composti fenolici (Noctor & Foyer, 1998; Podila et al., 2001); - enzimi antiossidanti quali le superossido dismutasi (SOD), le catalasi (CAT), le
perossidasi (POD) e l’ascorbato perossidasi (APX) ed enzimi che partecipano alle reazioni redox di rigenerazione degli antiossidanti, quali monodeidroascorbato riduttasi (MDHAR), deidroascorbato riduttasi (DHAR) e glutatione riduttasi (GR).
Figura 2-7: Schema semplificato di alcuni sistemi di difesa antiossidanti nelle cellule vegetali, loro compartimentalizzazione ed interazione con l’O3 (AA=acido ascorbico, DHAA=acido deidroascorbico,
GSH=glutatione, GSSG=glutatione ossidato, PA=apparato fotosintetico, cp=cloroplasto, cw= parete cellulare) (tratto da Tausz et al., 2006).
Glutatione ed acido ascorbico partecipano al ciclo ascorbato-glutatione (figura 2-8) insieme agli enzimi ascorbato perossidasi (APX), deidroascorbato riduttasi (DHAR) e glutatione riduttasi (GR), per mantenere l’equilibrio redox della cellula. In tale ciclo l’H2O2
generata dal metabolismo cellulare viene convertita in H2O a spese del NADPH (Conklin &
Barth, 2004; Foyer & Noctor, 2005).
Figura 2-8: Rappresentazione del ciclo ascorbato-glutatione (o ciclo di Halliwell-Asada)
Affinchè possa svolgere la sua funzione antiossidante, l’ascorbato deve essere presente in forma ridotta; quindi sia il tasso di sintesi sia quello di rigenerazione dell’acido ascorbico, attraverso deidroascorbato e monodeidroascorbato reduttasi, risultano fondamentali nel mantenimento di un elevato stato redox di tale composto (Conklin & Barth, 2004). La riduzione dell’acido ascorbico ossidato è operata da reduttasi localizzate nel citoplasma, per cui si rende necessario il trasporto dell’ascorbato attraverso le plasmamembrane (Veljovic-Jovanovic et al., 2001).
Esistono anche altri enzimi antiossidanti che svolgono un ruolo cruciale nella rimozione delle ROS. Questi includono varie isoforme di superossido dismutasi che convertono l’O2•
-in H2O2 e catalasi e perossidasi che metabolizzano ulteriormente l’H2O2 a H2O
(Kangasjärvi et al., 1994; Inzè & van Montagu, 1995; Sandermann, 1996). Mentre l’enzima catalasi è principalmente localizzato nei perossisomi, isoforme di perossidasi e superossido dismutasi sono variamente dislocate nella cellula e possono essere localizzate nel citosol, nei mitocondri e nei cloroplasti.
Secondo recenti studi, l’induzione della produzione di ROS in conseguenza dello stress da O3 rappresenta un segnale di allarme a carattere generale che determina la modificazione
dell’espressione genica e del metabolismo in condizioni di stress (López-Huertas et al., 2000; Podila et al., 2001; Kangasjaervi et al., 2005). In particolare l’H2O2, insieme ad altre