I risultati di questo lavoro hanno confermato un aspetto che era già emerso in precedenti studi (Guennégan et al., 1992, Colloca, 1999), ovvero la grande variabilità e, quasi imprevedibilità, delle catture della specie. Tali caratteristiche sono spiegabili con le peculiarità biologiche ed etologiche di P. edwardsii. Questo crostaceo pandalide possiede caratteristiche spiccatamente gregarie ed è in grado di compiere spostamenti nictemerali nella colonna d’acqua (Relini et al., 1999); la specie effettua inoltre spostamenti batimetrici lungo la scarpata per motivi trofici e riproduttivi (Company et al., 2003). Anche il regime delle correnti, la stagionalità e le fasi lunari sembrano influenzare la distribuzione nella colonna d’acqua di P. edwardsii (Colloca, 1999).
Tutti questi fattori, pertanto, fanno sì che la disponibilità della specie agli attrezzi di cattura (reti a strascico, nasse) vari sensibilmente nei diversi momenti della giornata.
L’intervallo di taglia degli esemplari campionati nel presente lavoro (10-29 mm LC) è risultato sostanzialmente simile a quello riportato negli altri studi effettuati in Mediterraneo (Guennégan et al., 1992; Company e Sardà, 1997; García Rodriguez et al., 2000; Colloca, 2002). In Atlantico Sud-Orientale (Isole Canarie) la specie sembrerebbe raggiungere dimensioni considerevolmente maggiori, 40 mm LC le femmine e 34 mm LC i maschi (Santana et al., 1997), rispetto al Mediterraneo dove le dimensioni massime sembrano essere intorno a 30 mm LC per le femmine.
Nonostante la spiccata variabilità delle catture, sono state osservate più componenti demografiche nella popolazione campionata ciascun mese; si
va da una sola moda presente nei mesi invernali (20 mm LC) a due o più mode nei mesi primaverili ed estivi (15 e 22 mm LC circa). Il picco di reclutamento più evidente è sempre stato osservato in primavera, nel mese di maggio; nei mesi successivi è stato possibile seguire l’accrescimento di questa coorte. In pratica, nel corso dell’anno si succedono più generazioni, come conseguenza di un periodo riproduttivo prolungato nel tempo.
Simili caratteristiche di dinamica di popolazione sono state individuate anche dagli altri studi realizzati su questa specie. Guennégan et al. (1992) e Colloca (2002) hanno osservato la prima classe modale nel mese di gennaio, corrispondente a 9 mm LC; questa coorte raggiunge circa 15 mm LC nel mese di maggio, taglia che coincide con quella delle reclute osservate nello stesso mese nel presente lavoro di tesi.
Gli studi di Company e Sardà (1997) nel Mar Catalano hanno mostrato differenze nella distribuzione in taglie con la profondità, con gli esemplari più piccoli maggiormente abbondanti fra 200 e 300 metri.
I dati analizzati nel presente lavoro provengono da un ristretto intervallo batimetrico (300-400 metri), mentre quelli utilizzati da Guennégan et al. e da Colloca provengono da più ampi intervalli di profondità, 100-380 e 90-300 m, rispettivamente.
La presenza di una moda costituita da individui sensibilmente più piccoli rispetto a quelli osservati nel presente lavoro può essere quindi dovuta ai differenti intervalli batimetrici investigati in studi diversi.
Una relazione taglia-profondità sembra essere una caratteristica comune a molte specie di pandalidi.
Ad eccezione di P. acanthonotus, anche le altre specie del genere Plesionika mostrano una distribuzione taglia-profondità, dello stesso tipo di quella di P. edwardsii: gli esemplari più piccoli di P. gigliolii e di P. heterocarpus si trovano maggiormente fra 300 e 500 metri di profondità, mentre i giovani di P. martia sono concentrati tra 400 e 500 metri di profondità (Company e Sardà, 1997).
L’intervallo batimetrico di campionamento potrebbe avere avuto influenza anche sul rapporto sessi, che sulla base di quanto osservato da Company e Sardà (1997) ha mostrato sensibili differenze con la batimetria. Nel presente lavoro la sex-ratio è risultata nettamente sbilanciata a favore delle femmine (sex ratio = 62%). In altri studi, che hanno investigato un più ampio intervallo batimetrico, la sex ratio è risultata prossima al 50% (Guennégan et al., 1992; Garcia Rodriguez et al., 2000). Fa eccezione il lavoro di Colloca (2002), ove risulta che la distribuzione dei sessi è spostata a favore delle femmine (58,9%) per quasi tutti i mesi di campionamento. Sempre Colloca (1999) ha riportato che il rapporto sessi è risultato sbilanciato a favore delle femmine nelle cale effettuate tra 100 e 200 metri di profondità, mentre si è spostato verso il 50% o a favore dei maschi tra 200 e 250 m. Nelle cale più profonde (250-320 m) sembrano prevalere ancora le femmine.
Una situazione simile è stata rilevata alle Canarie dove è stata riscontrata una maggiore concentrazione delle femmine ovigere a minori profondità; nel periodo invernale la specie sembrerebbe invece concentrarsi a profondità maggiori rispetto alla primavera e all’estate (Santana et al., 1997).
La sex ratio in funzione della profondità è stata osservata anche in altre specie del genere Plesionika, ad eccezione di P. acanthonotus, che non ha mostrato differenze significative; P. gigliolii ha mostrato una più alta proporzione di femmine in un intervallo compreso fra 350 e 450 metri, mentre P. martia in aree con profondità inferiori a 450 metri (Company e Sardà, 1997).
Le differenze nel rapporto sessi e nella struttura in taglie in funzione della profondità possono costituire delle strategie adattative messe in atto dalla specie per minimizzare fenomeni di competizione e per ottimizzare lo sfruttamento delle risorse. Questa strategia sembra essere particolarmente indicata in un mare oligotrofico come il Mediterraneo, dove spazio e cibo sono limitanti per specie di simile morfologia ed abitudini alimentari (Company e Sardà, 1997).
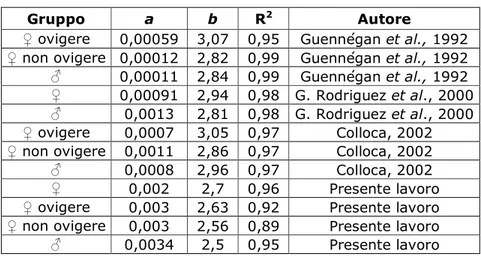
La stima dei parametri della relazione taglia-peso suggerisce un’allometria negativa nella crescita di P. edwardsii per entrambi i sessi, con un tasso di crescita comunque più elevato nelle femmine rispetto ai maschi. Un risultato simile è stato ottenuto da Garcia Rodriguez et al. (2000) nel Mare di Alboràn. Colloca (2002), nel Mar Tirreno Centrale, e Guennégan et al (1992), nelle acque intorno alla Corsica, riportano risultati leggermente diversi: una relazione di tipo isometrico per le femmine ovigere e una relazione di tipo allometrico negativo per i maschi; queste differenze scompaiono quando le femmine non sono più mature e la relazione taglia-peso tende all’allometria, confermando quanto già detto prima.
Garcia Rodriguez et al. (2000) e Colloca (2002) riportano che gli individui giovani incrementano in peso più velocemente degli adulti e le femmine
più rapidamente rispetto ai maschi. In Tab. 5.1 sono riassunte le stime dei parametri della relazione taglia-peso di P. edwardsii effettuate in differenti studi.
Differenze significative nella crescita relativa tra maschi e femmine sono state osservate anche in altre specie di pandalidi (Sanz, 1986).
Tab. 5.1 – Parametri relativi alla crescita di P.edwardsii (relazione taglia-peso
del tipo: Peso = a*LCb) osservate da vari autori.
Gruppo a b R2 Autore
♀ ovigere 0,00059 3,07 0,95 Guennégan et al., 1992
♀ non ovigere 0,00012 2,82 0,99 Guennégan et al., 1992
♂ 0,00011 2,84 0,99 Guennégan et al., 1992
♀ 0,00091 2,94 0,98 G. Rodriguez et al., 2000
♂ 0,0013 2,81 0,98 G. Rodriguez et al., 2000
♀ ovigere 0,0007 3,05 0,97 Colloca, 2002
♀ non ovigere 0,0011 2,86 0,97 Colloca, 2002
♂ 0,0008 2,96 0,97 Colloca, 2002
♀ 0,002 2,7 0,96 Presente lavoro
♀ ovigere 0,003 2,63 0,92 Presente lavoro
♀ non ovigere 0,003 2,56 0,89 Presente lavoro
♂ 0,0034 2,5 0,95 Presente lavoro
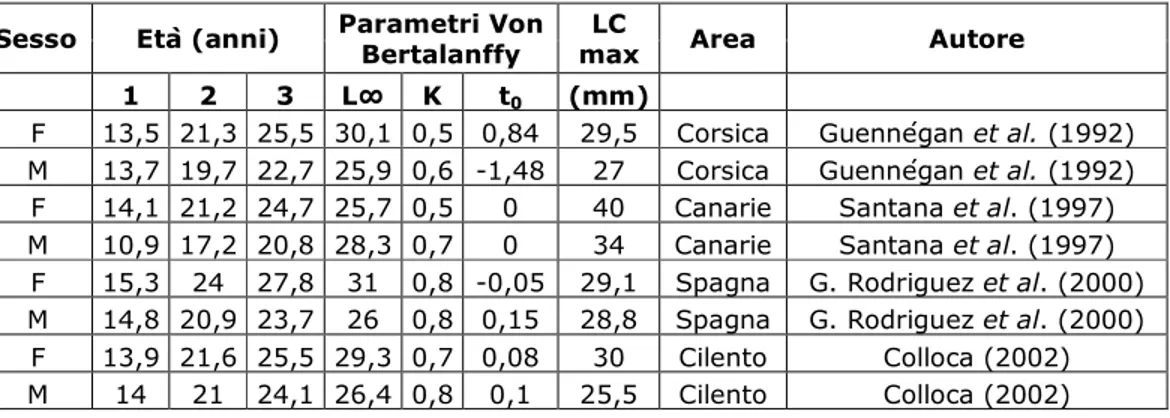
Colloca (2002) ha effettuato stime di longevità della specie attraverso l’analisi delle curve di crescita, con l’equazione di Von Bertalanffy, per entrambi i sessi. Secondo queste stime, le nuove reclute che compaiono a gennaio nelle catture avrebbero un’età di circa 8 mesi. La longevità è stata stimata intorno a tre anni e mezzo, con le femmine che mostrano una maggiore velocità di accrescimento. Stime di crescita molto simili sono state ottenute da Guennégan et al. (1992) e nel Mar Mediterraneo Occidentale da Garcia Rodriguez et al. (2000), mentre nell’Atlantico Sud-Orientale (Canarie) i parametri di crescita sono risultati lievemente diversi (Santana et al., 1997) (Tab. 5.2).
Tab. 5.2 – Accrescimento di P.edwardsii in diverse aree.
Tenendo in considerazione questi risultati, le reclute catturate in grandi quantità nel mese di maggio nel presente studio avrebbero un’ età di circa 13 mesi (prima moda primaverile) e raggiungerebbero i due anni di vita quando la taglia è 22 mm LC (seconda moda primaverile). La massima taglia corrisponderebbe a 3,5 anni o poco più.
I risultati di questo lavoro hanno evidenziato che P. edwardsii presenta un periodo riproduttivo esteso a quasi tutto l’anno; solo nei mesi invernali l’attività sessuale sembra essere considerevolmente ridotta. Tuttavia è stato osservato con chiarezza un picco di femmine mature nei mesi primaverili. Anche la percentuale di femmine ovigere mostra un andamento stagionale: le percentuali più alte di femmine ovigere sono state osservate sia in primavera che in estate; le femmine con uova scompaiono a dicembre.
Un periodo riproduttivo del tutto simile è stato evidenziato nel Mar Tirreno Centrale (Colloca, 2002), nel Mar Mediterraneo Occidentale (Company e Sardà, 1997) e nel Mar Tirreno Centro Settentrionale (Guennégan et al., 1992). Qualche differenza è stata osservata nel Mar Mediterraneo Occidentale (Garcia Rodriguez et al., 2000), dove la
Sesso Età (anni) Parametri Von Bertalanffy
LC
max Area Autore
1 2 3 L∞ K t0 (mm)
F 13,5 21,3 25,5 30,1 0,5 0,84 29,5 Corsica Guennégan et al. (1992) M 13,7 19,7 22,7 25,9 0,6 -1,48 27 Corsica Guennégan et al. (1992) F 14,1 21,2 24,7 25,7 0,5 0 40 Canarie Santana et al. (1997) M 10,9 17,2 20,8 28,3 0,7 0 34 Canarie Santana et al. (1997)
F 15,3 24 27,8 31 0,8 -0,05 29,1 Spagna G. Rodriguez et al. (2000) M 14,8 20,9 23,7 26 0,8 0,15 28,8 Spagna G. Rodriguez et al. (2000)
F 13,9 21,6 25,5 29,3 0,7 0,08 30 Cilento Colloca (2002) M 14 21 24,1 26,4 0,8 0,1 25,5 Cilento Colloca (2002)
percentuale di femmine mature è risultata maggiore in autunno, sebbene la percentuale più alta di femmine ovigere sia stata osservata in primavera. In Atlantico Orientale (Isole Canarie) il periodo di maggiore attività riproduttiva è più lungo, andando da Aprile a Settembre (Santana et al., 1997). Un lungo periodo riproduttivo caratterizza anche le popolazioni tropicali della specie (Poupin et al., 1990).
La riproduzione continua durante tutto l’anno è tipica delle specie distribuite su fondi batiali ed è da mettere in relazione con la stabilità di molti parametri ambientali che caratterizza queste aree (Tyler, 1988). La temperatura è il fattore abiotico più importante che può determinare la durata di incubazione delle uova nei crostacei (Wear, 1974; Sastry, 1983). Questo potrebbe implicare che il numero di deposizioni per anno potrebbe essere più basso per le specie di acque profonde.
Tuttavia, in alcune specie di pandalidi mediterranei, è stato evidenziato un accentuarsi della stagionalità riproduttiva all’aumentare della profondità (Company e Sardà, 1997).
Il fatto che P. edwardsii abbia la caratteristica di portare le uova attaccate ai pleopodi fino alla loro schiusa ha permesso di fare un’analisi più approfondita della biologia riproduttiva e della fecondità.
Sono state stimate sia la taglia di maturità fisiologica (19,50 mm LC) che quella funzionale (20,13 mm LC), parametri che sono risultati in sostanziale accordo con quanto riportato da Guennégan et al. (1992) e da Colloca (2002) (Tab. 5.3).
Tab. 5.3 – Maturità fisiologica e funzionale di altri autori per P. edwardsii. Maturità fisiologica (mm LC) Maturità funzionale (mm LC) Autore 18 18,4 Guennégan et al., 1992 17,9 21,8 Colloca, 2002 19,5 20,1 Presente studio
Le differenze riscontrate nelle stime sono dovute probabilmente alla diverse profondità analizzate nei tre studi che, come è stato visto influenzano la struttura in taglia della specie.
Gli studi di Guennégan et al. (1992) e di Colloca (2002) hanno anche evidenziato variazioni sostanziali nella taglia di maturità nel corso dell’anno ed hanno messo in relazione queste differenze con le caratteristiche del ciclo riproduttivo della specie, ipotizzando deposizioni successive delle uova.
Sulla base degli studi sull’accrescimento di P. edwardsii effettuati da Colloca (2002) si può inoltre affermare che le taglie di maturità stimate in questo lavoro (19,50 mm LC e 20,13 mm LC) corrispondano all’incirca ad un’età di due anni.
I risultati ottenuti con questo lavoro hanno anche permesso di elaborare una scala di maturità a cinque stadi, che tiene in considerazione sia la morfologia delle gonadi che la presenza di uova attaccate ai pleopodi. La scala permette di analizzare la maturità sessuale della specie in maniera più semplificata di quanto fino ad oggi era disponibile (Ceccaldi, 1966; Guennégan et al., 1992). Si ritiene quindi che questa scala di maturità possa essere uno strumento utile per un monitoraggio della biologia della specie.
La Fig. 5.1 visualizza schematicamente l’evoluzione della maturità sessuale durante il ciclo vitale di P. edwardsii: dopo lo stadio 1 (immatura vergine) le gonadi cominciano a maturare (stadio 2 vergine in maturazione) e poi passano allo stadio 3 (matura), a partire da circa 17 mm LC, taglia che corrisponde a poco meno di due anni di vita. Come già detto, la taglia di maturità sessuale viene raggiunta tra 19 e 20 mm LC. Successivamente le femmine passano allo stadio 4 (a riposo non vergine), e allo stadio 5 (in maturazione non vergine) per poi ritornare nello stadio 3. Le femmine pertanto si riproducono più di una volta nel corso della stagione riproduttiva, come dimostrato dal fatto di poter trovare femmine ovigere con ovari nei diversi stadi di maturazione. Il ciclo vitale si completa intorno ai 3 anni e mezzo di vita.
Nel presente lavoro sono state effettuate stime assolute di fecondità, il cui valore massimo è risultato intorno a 20.000 uova per una femmina di 25 mm LC, con un minimo di circa 900 uova per una femmina di 21 mm LC, anche se i valori più frequenti si aggirano intorno alle 15.000 uova. Le stime di Guennegan et al. (1992), Company e Sardà (1997) e di Colloca (2002) riportano una fecondità assoluta sensibilmente inferiori, con valori massimi non superiori a circa 13.000 uova.
Un fattore importante da rilevare è che solo in questo studio la fecondità è stata studiata in maniera approfondita, effettuando 218 conteggi di ovari, mentre Guennégan et al. (1992), Company e Sardà (1997) e Colloca (2002) hanno effettuato lo studio rispettivamente su 46, 21 e 5 ovari. Inoltre in questo lavoro è stato possibile quantificare le differenze nella stima di fecondità dovute al metodo di campionamento delle femmine ovigere. È stato osservato che il numero di uova provenienti da
individui campionati con la rete a strascico è sensibilmente inferiore rispetto a quello ottenuto da femmine catturate con le nasse. È stato così dimostrato che c’è una grossa perdita di uova quando le catture vengono effettuate con la rete a strascico. Le cause di tale perdita sono probabilmente da attribuire alle operazioni di pesca e salpamento della rete, durante le quali le specie sono sottoposte ad elevati stress, ma anche allo smistamento e lavaggio del pescato a bordo del motopeschereccio. Per questi motivi la fecondità ottenuta da individui provenienti dalla pesca a strascico risulta sottostimata rispetto a quella ottenuta da campioni catturati con altri attrezzi più selettivi, quali le nasse sperimentali. Questo fattore spiegherebbe la differenza tra le stime di Company e Sardà (1997), provenienti da campioni prelevati con reti a strascico, e quelle del presente lavoro.
Gran parte delle stime di fecondità effettuate in altre specie di crostacei che trattengono le uova sull’addome, danno valori lievemente inferiori di quelli stimati per P. edwardsii nel presente lavoro. Il numero di uova massimo osservato per Nephrops norvegicus è risultato non maggiore di 10.000 uova (Thomas, 1964; Gramitto e Froglia, 1980; Morizur et al., 1981; Mori et al., 1998b; 2001); lo stesso vale per le altre specie di Plesionika, dove il numero varia da circa 3.000 uova per P. gigliolii e P. acanthonotus, 6.000-7.000 per P. heterocarpus fino a circa 11.000 per P. martia (Company e Sardà, 1997; Maiorano et al., 2002).
Le specie di crostacei che portano le uova fissate ai pleopodi mostrano una fecondità nettamente più bassa rispetto ai pesci, come ad es. Merluccius merluccius (nasello), che hanno una fecondità notevolmente superiore. La maggior parte delle specie ittiche infatti ha privilegiato una
strategia riproduttiva tesa alla produzione di un elevato numero di uova. Le uova prodotte da un pesce sono di solito in eccesso rispetto a quelle che l’habitat può sopportare e la mortalità densità dipendente, spesso elevata durante lo stadio larvale, porta a notevoli riduzioni del futuro numero di giovani (Bagenal, 1966). Per M. merluccius è stato stimato un numero medio di uova che va da circa 500.000 a oltre 2.000.000 (Sarano, 1986; Balbontin e Fisher, 1981; Cesarini, 1994). I crostacei quindi, a differenza dei pesci, mostrano una fecondità bassa, poiché utilizzano una strategia adattativa diversa mirata a produrre un numero basso di uova, che sopravvive con una percentuale molto alta. Ciò può dipendere dalle caratteristiche etologiche della specie, che attua nei confronti delle uova una sorta di cura parentale, trattenendole tra i pleopodi attraverso una serie di accorgimenti. Nelle femmine infatti, durante la muta che precede la copula, compaiono setole ovigere sui pleopodi e altre modificazioni per trattenere le uova, che scompaiono con la muta successiva. Inoltre le uova sono fissate ai pleopodi per mezzo di un liquido che forma una rete molto resistente intorno ad esse, che si disgrega con lo sviluppo delle uova, fino a scomparire con il rilascio delle larve.
Le variazioni della fecondità sono conseguenti ad una diversa distribuzione tra accrescimento e riproduzione dell’energia in eccesso a quella necessaria per il mantenimento (Roff, 1983). Il modo con il quale questa distribuzione è effettuata costituisce la base della strategia riproduttiva. Differenti popolazioni che vivono sotto diverse condizioni, presentano diverse fecondità; questo può riflettere situazioni diverse quali la disponibilità di cibo, il tasso di predazione a cui sono sottoposte
(Nikolskii, 1969) e non ultimo il tasso di sfruttamento da parte delle attività di pesca.
L’analisi della fecondità è quindi importante per approfondire i meccanismi di riproduzione informando sulla capacità prolifica della specie , sul tipo di strategia adottata e offre la possibilità di individuare la porzione di femmine riproduttrici che contribuisce in modo maggiore al rinnovamento della popolazione.
Le stime di fecondità assoluta realizzate nel presente lavoro hanno anche evidenziato un andamento stagionale: il numero di uova per femmina è risultato sensibilmente superiore nei mesi primaverili, in coincidenza del picco riproduttivo, quando le condizioni ambientali sono propizie per la riproduzione.
La presenza massiccia di femmine con uova in stadio 1 nella stagione primaverile-estiva diminuisce notevolmente a settembre; questo potrebbe indicare che le uova vengono incubate per circa 5-6 mesi, per poi essere definitivamente rilasciate in mare sotto forma di larve.
La fecondità di P. edwardsii, sebbene caratterizzata da un’alta variabilità, è risultata proporzionale alla taglia materna; le femmine di maggiori dimensioni producono cioè un maggior numero di uova rispetto agli individui più piccoli. Questo è in accordo con quanto osservato nella quasi totalità dei crostacei decapodi (Thomas, 1964; Gramitto e Froglia, 1980; Morizur et al., 1981; Abellò e Sardà, 1982; Mori et al., 2004).
Nonostante questo, la fecondità relativa (numero di uova per grammo di peso corporeo) è rimasta sostanzialmente stabile con la taglia, a testimonianza della stessa efficienza riproduttiva.
Il presente lavoro ha evidenziato che il numero di uova diminuisce sensibilmente nel corso dello sviluppo fino al momento del rilascio della larve in mare. È stata stimata una perdita di uova di circa il 18% nel corso del loro del loro sviluppo; Guennégan et al. (1992), con un’analisi simile, hanno stimato una perdita del 35%. È noto infatti che la fecondità diminuisce con l’aumentare del tempo d’incubazione; le cause di perdita delle uova durante l’incubazione possono essere, oltre al naturale rilascio in mare, di natura meccanica come l’abrasione con il substrato, ma anche di origine naturale come il cannibalismo materno e la predazione, ad esempio ad opera di nemertini (Kuris, 1991).
Il presente lavoro ha anche permesso individuare una scala per lo sviluppo delle uova, sulla base di osservazioni allo stereomicroscopio. Sono stati identificati con chiarezza 4 stadi di sviluppo delle uova e un quinto stadio, larvale, grazie allo studio morfologico delle uova incubate. È stato anche stimato un fattore di conversione per stimare la misura delle uova a fresco a partire da uova conservate in formalina. Quest’ultima osservazione è risultata utile per la stima dell’accrescimento in lunghezza delle uova nel corso del loro sviluppo.
La dimensione media delle uova in formalina stimata in questo lavoro è risultata compresa tra 0,6 e 0,7 mm, misura che corrisponde circa a 0,7-0,8 mm a fresco. Company e Sardà (1997) riportano valori compresi tra 0,5 e 0,6 mm, ma si riferiscono alla lunghezza media tra asse maggiore e minore dell’uovo.
Fig. 5.1 – Evoluzione della maturità sessuale durante il ciclo di P. edwardsii. Taglia di maturità = 19,50 mm LC Età ~ 2 anni 4 3 5 2 Matura Con o senza uova
LC ≥ 17 mm In maturazione Con o senza uova LC ≥ 17 mm
A riposo Con o senza uova
LC < 17 mm Immatura Senza uova LC < 17 mm In maturazione Senza uova 1
Il gobbetto striato, P. edwardsii, è una specie con rilevante importanza a livello commerciale (15-25 euro al kg sul mercato), nonostante la presenza occasionale sui mercati (De Ranieri, 2005). In effetti ad oggi la pesca di questa specie, almeno in Italia, è ancora limitata a casi sporadici ed effettuata solo con la rete a strascico. La specie è invece oggetto di pesca mirata in altre aree del Mediterraneo, in particolare presso la marineria spagnola, che utilizza come metodo di cattura le nasse.
Una marineria che pratica questa pesca in maniera sistematica è quella della regione di Murcia (levante spagnolo). È stato stimato che le catture di un’imbarcazione che cala circa 400 nasse raggiungono 70-80 kg di gamberi al giorno, con un rendimento medio di 175-200 g per nassa (Gonzalez et al., 1992).
Ad oggi non sono ancora disponibili stime sulla reale consistenza dello stock di P. edwardsii; tuttavia, la specie avendo un ciclo vitale relativamente breve, un rapido accrescimento e considerando che ad oggi non esiste ancora una pesca mirata, può essere considerata una risorsa “vergine” e si può ragionevolmente presumere che in Italia possa essere sfruttata dalla pesca
Sarebbe però auspicabile una maggiore conoscenza della specie, presupposto indispensabile per la futura gestione dello stock. L’obiettivo di questo lavoro di tesi è stato proprio quello di fornire una più approfondita conoscenza delle sue caratteristiche biologiche e di individuare un metodo semplice e immediato di monitoraggio di P. edwardsii. Di fatto la conoscenza della biologia riproduttiva e fecondità di una specie o popolazione è fondamentale nella corretta gestione degli stocks perché permette di calcolare il potenziale riproduttivo utile per
stimare l’abbondanza minima di adulti necessaria per mantenere stabile il reclutamento ed offre, inoltre, un’ulteriore metodologia per l’elaborazione di modelli di valutazione degli stock (Holden e Raitt, 1974).
Tutto ciò potrebbe essere utile per indicare misure gestionali per sfruttare in maniera oculata questa risorsa e per attuare un approccio precauzionale (Garcia, 1994) in modo da garantirne uno sfruttamento sostenibile.
La taglia di prima maturità sessuale potrebbe essere una misura utile per stabilire una taglia minima di cattura.
La specie potrebbe essere catturata con attrezzi più selettivi dello strascico, come le nasse utilizzate dalle marinerie spagnole. In acque italiane, queste nasse per la pesca dei gamberi sono state sperimentate in Sardegna e in Campania dove hanno fornito rese giornaliere di P. edwardsii apprezzabili se confrontate con quelle dello strascico (Secci et al., 1994; Colloca, 1999), evidenziando le potenzialità di diffusione di questo mestiere di pesca.
La presenza di un picco riproduttivo concentrato in un periodo ben definito potrebbe permettere di regolamentarne la pesca, interrompendola quando la presenza di femmine ovigere è maggiore. Sarebbe anche necessario associare le misure gestionali ad un attento monitoraggio dello stato della risorsa, per valutare l’efficacia delle misure di gestione e, eventualmente per adottare misure correttive.