1. INTRODUZIONE
1.1 Risposte innate e risposte condizionate
Il comportamento è definito come l’insieme delle risposte oggettive a uno stimolo o a una serie di stimoli da parte di un organismo. Tali reazioni possono essere indotte sia da stimoli interni al corpo (pulsioni) o esterni provenienti dall’ambiente circostante. Tali risposte possono essere classificate in due categorie: risposte innate (incondizionate) e risposte apprese (condizionate). Le risposte innate possono essere potenzialmente espresse sin dalla nascita e sono pertanto ereditarie. A questa categoria appartengono risposte effettuate per far fronte efficacemente alle necessità primarie dell’individuo favorendone la sopravvivenza, come ad esempio le reazioni riflesse correlate all’alimentazione o indotte dalla presenza di un pericolo. Essendo geneticamente determinate queste risposte risultano poco flessibili, stereotipate e difficilmente modificabili. Ciascun organismo nel corso della propria esistenza tuttavia, deve rispondere nella maniera più ottimale a stimoli spesso imprevedibili e, per tanto, le sole risposte innate non risultano sufficienti. Questo limite è superabile attraverso l’acquisizione di capacità funzionali che consentono l’adattamento alle situazioni più imprevedibili che si costruiscono attraverso l’apprendimento e memoria. Le risposte che si basano su questi processi sono definite apprese o condizionate
1.2 Apprendimento e memoria
Studi biologici e comportamentali hanno dimostrato che l’apprendimento e la memoria, seppur intimamente connessi, non costituiscono un processo unitario, ma sono processi distinti ciascuno con una propria funzione.
In senso generale l’apprendimento può essere considerato il processo attraverso cui sono acquisite e trattenute nuove informazioni dall’ambiente o nuovi comportamenti, mentre la memoria è definibile come la capacità di conservare
le informazioni acquisite sotto forma di tracce mnemoniche e di utilizzarle ogni volta che ne nasce la necessità.
I sistemi di memoria possono essere distinti in due grandi categorie: le memorie esplicite (o dichiarative) e le memorie implicite (non dichiarative o procedurali, (fig.1) (Squire 1994).
La memoria esplicita è il recupero conscio di eventi, esperienze, informazioni riguardanti luoghi, fatti e persone. La memoria implicita riguarda invece, le modalità di esecuzione delle azioni comportamentali e viene richiamata alla mente in modo automatico e non conscio. La memoria implicita è assai più rigida ed è connessa all’addestramento o all’esecuzione di compiti, motori o percettivi. Al contrario la memoria esplicita è molto duttile e richiede la capacità di associare i vari elementi informativi. Nei vertebrati si distinguono due forme di memoria correlabili rispettivamente alla memoria esplicita ed a quella implicita: una memoria detta relazionale o configurale che si basa sulla capacità di creare relazioni tra stimoli sensoriali, oggetti ed eventi, ed una memoria definita non relazionale che riguarda la memorizzazione di singoli stimoli sensoriali o l’attribuzione ad essi di un significato emotivo (Squire, 1992; Young et al., 1994; Nadel and Moscovich, 1997; Burgess et al., 1999). Le diverse forme di memoria sono state ampliamente studiate esponendo gli animali ad esperienze sensoriali controllate. In particolare per lo studio delle memorie implicite si sono sviluppati diversi paradigmi sperimentali che hanno permesso di distinguere due sottoclassi di questo tipo di memoria: l’apprendimento associativo e non associativo (fig.1).
Nell’apprendimento non associativo il soggetto apprende quali siano le proprietà di un singolo stimolo e tale apprendimento si manifesta quando il soggetto è esposto ripetutamente a tale stimolo. Nell’apprendimento associativo, invece, l’individuo impara quali sono le relazioni che intercorrono fra due stimoli o fra uno stimolo ed un comportamento. L’apprendimento associativo in base alle procedure sperimentali impiegate per ottenerlo si distingue in: condizionamento classico, che comporta l’apprendimento dei rapporti che intercorrono fra due stimoli; ed in condizionamento operante, che comporta
l’apprendimento della relazione esistente fra uno o più stimoli e le risposte che ne derivano. Il condizionamento classico (CC) fu scoperto dal fisiologo russo Ivan Pavlov (Pavlov, 1927). Egli osservò che se si presenta ripetutamente ad un soggetto sperimentale uno stimolo neutro che normalmente non produce risposte apprezzabili (ad esempio un suono), definito “stimolo condizionato” (CS), in stretta associazione temporale con uno stimolo (come la vista del cibo), definito “incondizionato” (US) in grado di indurre una certa risposta innata (come l’aumento della salivazione), la successiva presentazione del CS, anche in assenza dell’US, induce la risposta innata, che in questo caso, è definita risposta appresa o “condizionata”.
La peculiarità del condizionamento classico consiste nell’accoppiamento tra i due stimoli CS e US. Pavlov dimostrò che esistono condizioni ben definite necessarie affinchè si possano instaurare le risposte apprese: i due stimoli CS e US devono essere presentati al soggetto sperimentale contemporaneamente oppure il CS deve precedere di poco l’US; durante la presentazione di CS ed US non devono essere forniti altri stimoli che potrebbero ostacolare l’associazione CS-US; l’associazione CS-US deve essere ripetuta un numero sufficiente di volte. Durante il CC, è proprio il ripetuto accoppiamento di CS con US che trasforma CS in un segnale anticipatorio di US. Pertanto, dopo un certo numero di ripetizioni, l’animale risponderà a CS come se si apprestasse a ricevere US. In altri termini, il CC rappresenta un paradigma sperimentale attraverso il quale il soggetto impara a prevedere gli eventi che si verificheranno nell’ambiente che lo circonda. Per lungo tempo si è creduto che la contiguità temporale fosse il punto chiave per l’induzione del condizionamento classico. Osservazioni più recenti enfatizzano invece la relazione causale tra CS e US e sottolineano l’importanza dell’informazione che il CS fornisce rispetto al verificarsi dell’US (Rescorla, 1988). Il CC è in grado di associare una risposta riflessa inconscia ad uno stimolo neutro e perciò coinvolge soprattutto forme implicite di memoria. Numerosi studi hanno dimostrato però che, anche queste forme elementari di apprendimento in alcuni casi possono interessare la memoria esplicita di modo
che l’acquisizione delle risposte risulta essere mediata almeno in parte da processi di tipo cognitivo (Kandel, 2001).
Fig.1: Sistemi multipli di memoria (modificato da “Squire 1994”).
1.3 La memoria come fenomeno di plasticità sinaptica
Tutte le forme di memoria sono collegate a fenomeni di plasticità neuronale. Infatti la costruzione della memoria è strettamente dipendente da modificazioni (biochimiche e strutturali) delle connessioni sinaptiche che determinano un rafforzamento del modo in cui i neuroni interagiscono. Queste modificazioni plastiche e attività-dipendenti dell’efficacia sinaptica sono correlabili direttamente con l’apprendimento e necessarie per la conservazione delle informazioni di natura appresa. La memoria esplicita è stata ampiamente studiata sui mammiferi, mentre vertebrati non mammiferi e invertebrati si sono dimostrati ottimi modelli sperimentali per lo studio delle memorie implicite. Entrambe le forme di memoria sono graduali e la loro durata è correlata al numero di prove di addestramento. E’ ormai generalmente accettata l’idea che il processo mnemonico si costruisca attraverso fasi sequenziali. Nella prima fase di codificazione le nuove informazioni sono acquisite, analizzate e trasformate
in tracce mnemoniche. Successivamente queste tracce labili vengono consolidate, conservate e recuperate successivamente se necessario.
La memoria associata alle forme di apprendimento può essere ulteriormente classificata in due componenti temporalmente distinte, che trovano una precisa corrispondenza con fenomeni di plasticità sinaptica: una memoria a breve termine che dura per minuti o al massimo ore ed una memoria a lungo termine che perdura per giorni, settimane o addirittura per tutta la vita. La memoria a breve termine è data esclusivamente da modificazioni covalenti (fosforilazioni) di proteine già preesistenti nei neuroni, mentre la memoria a lungo termine richiede la modulazione dell’ espressione genica e sintesi di nuove proteine. Studi condotti a livello cellulare e molecolare su forme di apprendimento implicito ed esplicito hanno evidenziato la presenza di una cascata di eventi molecolari e trascrizionali che avvengono durante il periodo di consolidamento. Il consolidamento della memoria dipende dunque dalla modulazione della trascrizione genica de novo e dalla sintesi di proteine (Matthies, 1989). Inoltre, il consolidamento della memoria, comprende anche quei processi che modificano le informazioni appena acquisite, ma ancora labili, in modo da renderle più stabili e durature determinando modificazioni strutturali capaci di conservare le tracce mnemoniche in maniera stabile nel tempo.
I primi studi che hanno messo in relazione alcune forme di apprendimento a fenomeni di plasticità sinaptica sono stati condotti nei laboratori diretti da Eric Kandel utilizzando come modello sperimentale l’invertebrato Aplysia
californica. Questo gasteropode marino si è rivelato un ottimo modello per
studiare, in parallelo, le modificazioni comportamentali e i cambiamenti cellulari e molecolari che si instaurano nei circuiti neuronali in seguito ad apprendimento. In particolare utilizzando come modello comportamentale il riflesso di retrazione della branchia, sono state ottenute interessanti indicazioni riguardo alle due forme più semplici di apprendimento non associativo: l’abitudine e la sensitizzazione. L’abitudine permette all’organismo di apprendere le proprietà di uno stimolo che si rivela innocuo e ignorarlo in seguito a ripetute esposizioni. La sensitizzazione, invece, risulta essere un
fenomeno più complesso: l’organismo in seguito all’esposizione di uno stimolo nocivo impara a rispondere in maniera più vigorosa non solo ad esso ma anche a stimoli di altra natura anche se innocui. In seguito all’applicazione di un leggero tocco al sifone, Aplysia risponde con una retrazione della branchia e del sifone. Tale risposta è amplificata se all’animale viene applicato uno stimolo nocicettivo alla coda o alla testa. Un’unica stimolazione nocicettiva produce una sensitizzazione a breve termine che dura pochi minuti mentre l’applicazione di più stimoli nocicettivi ad intervalli di tempo prestabiliti fa comparire una sensitizzazione a lungo termine che può durare giorni o settimane (Castellucci et
al., 1986). A livello sinaptico, la stimolazione della coda induce il rilascio
transiente di un neuromodulatore specifico, la serotonina (5HT) da parte di interneuroni che contraggono sinapsi asso-assoniche con le terminazioni presinaptiche dei neuroni sensitivi nel circuito del riflesso. Studi in vitro hanno dimostrato che è possibile riprodurre ciò che si osserva durante l’addestramento comportamentale in seguito ad applicazioni esogene di 5-HT (Montarolo et al., 1986). La 5-HT rilasciata in vivo o applicata in vitro si lega a specifici recettori posti sulla superficie cellulare del neurone presinaptico e promuove la produzione di un secondo messaggero diffusibile l’adenosin-monofosfato ciclico (cAMP) attraverso la stimolazione dell’enzima di membrana adenilato ciclasi (AC). L’aumento della concentrazione intracellulare di cAMP e la cascata di eventi molecolari che ne seguono producono un aumento a breve termine dell’efficacia funzionale delle connessioni sinaptiche tra neurone sensitivo e motoneurone. Tale aumento è chiamato facilitazione presinaptica a breve termine (Brunelli et al., 1976). La facilitazione è in parte dovuta ad un aumento del rilascio di 5-HT da parte del neurone sensoriale ed è accompagnata da un incremento dell’eccitabilità del neurone sensoriale attribuibile alla chiusura di specifici canali per lo ione potassio Ks (Klein et al., 1982; Dale et
al., 1988). Infatti l’aumento dei livelli di cAMP attiva un protein-chinasi
cAMP-dipendente (PKA) responsabile di almeno tre eventi molecolari successivi: il primo è rappresentato dalla fosforilazione dei Ks con conseguente riduzione della ripolarizzazione che prolunga la durata del potenziale di azione e
quindi aumenta l’ingresso di Ca2+ nel terminale presinaptico e la liberazione di neurotrasmettitore; il secondo evento è rappresentato dalla mobilizzazione delle vescicole sinaptiche; il terzo dall’aumento dell’ingresso di Ca2+ in seguito a fosforilazione dei canali calcio di tipo L.
In seguito a ripetute stimolazioni o applicazioni di 5-HT si assiste a un persistente aumento dei livelli intracellulari di cAMP. Tale variazione rappresenta il punto di transizione tra la facilitazione a breve termine e una forma più duratura detta facilitazione a lungo termine. Da un punto di vista molecolare ciò fa si che la subunità catalitica della PKA recluti una ulteriore chinasi: la protein-chinasi attivata dalla mitosi (MAPK). Queste due chinasi traslocano assieme nel nucleo del neurone sensitivo dove fosforilano diversi target nucleari incluse altre chinasi che, a loro volta, possono fosforilare fattori di trascrizione e modificare l’espressione genica. E’ un’ipotesi, ormai comunemente accettata, che le memorie a lungo termine nel sistema nervoso centrale di tutti gli animali siano correlate a modificazioni durature della forza e della struttura delle connessioni sinaptiche che dipendono dall’attivazione di specifici patterns di espressione genica (Martin et al., 2000).
Studi successivi hanno messo in evidenza il ruolo svolto nella plasticità correlata alla memoria di promotori dai trascrizione che rispondono al cAMP (cAMP responsive element, CRE) a valle della via del cAMP. In particolare nel passaggio molecolare che regola l’instaurarsi della facilitazione a lungo termine in Aplysia sono coinvolti fattori di trascrizione che legano il CRE: i cAMP
responsive element binding factor (CREB). La subunità catalitica della PKA
fosforila e attiva un fattore di trascrizione attivatore detto CREB-1 che si lega all’elemento promotore CRE e per mezzo della MAPK agisce anche indirettamente reprimendo l’attività inibitoria di un repressore della trascrizione CREB-2. Entrambi i passaggi sono necessari per indurre il processo di facilitazione a lungo termine. Iniezioni di anticorpi specifici per CREB-2 nei neuroni sensoriali di Aplysia fanno si che singole somministrazioni di 5-HT, che normalmente determinano solo una facilitazione a breve termine, producano una facilitazione a lungo termine che perdura per giorni. (Bartsch et al., 1995).
Nei neuroni sensoriali di Aplysia l’attivazione di CREB-1 e la repressione di CREB-2 attivano l’espressione di geni precoci fra cui il gene codificante l’enzima idrolasi dell’ubiquitina (che attiva i proteosomi proteolitici che degradano la subunità regolatrice della PKA rendendola persistentemente attiva) e il gene codificante per il fattore di trascrizione C/EBP (che si lega all’elemento di risposta del DNA CCAAT) che attiva la trascrizione di geni codificanti per proteine coinvolte nella formazione di nuove connessioni sinaptiche. L’importanza della via cAMP-PKA-CREB nella conservazione a lungo termine delle tracce mnemoniche implicite è stata dimostrata anche da ricerche genetiche. Le prime evidenze si sono ottenute dallo studio di mutanti di
Drosophyla con deficit nella formazione delle memorie (Duday et al., 1976) che
successivamente sono stati attribuiti a mutazioni di geni coinvolti nella cascata del cAMP (Byes et al., 1981). Esperimenti ancora successivi hanno confermato che l’equilibrio tra le 2 isoforme di CREB (attivatore e repressore) è particolarmente critico per l’apprendimento associativo e la memoria a lungo termine anche in Drosophyla (Yin et al., 1994; 1995).
Molti dei segnali a monte della cascata molecolare che conduce all’attivazione di CREB appaiono conservati durante l’evoluzione e molti aspetti del ruolo di CREB nella plasticità sinaptica descritti negli Invertebrati sono stati riscontrati anche nel cervello dei mammiferi (Barco et al., 2006).
La conservazione delle memorie esplicite sia nell’uomo che negli animali sperimentali dipende criticamente dall’integrità di specifiche strutture cerebrali localizzate a livello dei lobi temporali come l’ippocampo.
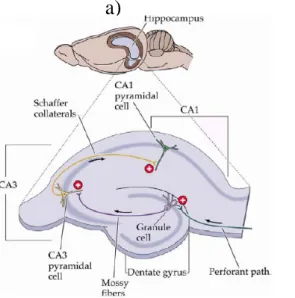
L’ippocampo possiede tre vie nervose eccitatorie principali: la “via perforante” che decorre dalla corteccia entorinale alle cellule granulari del giro dentato, la “via delle fibre muscoidi” costituita dagli assoni delle cellule dei granuli che si connettono con i neuroni piramidali del campo CA3 dell’ippocampo, la “via delle collaterali di Schaffer” costituita dalle proiezioni dei neuroni del campo CA3 che terminano nel campo CA1. Nel 1973 Bliss e Lomo dimostrarono che i
Fig.2:Meccanismi molecolari alla base delle forme di plasticità sinaptica a breve e a lungo termine a) negli Invertebrati b) nei Vertebrati (tratta da “Barco et al. 2006”).
neuroni dell’ippocampo possedevano capacità plastiche persistenti simili a quelle richieste per la conservazione delle tracce mnemoniche. L’applicazione di una breve scarica di stimoli ad alta frequenza in una qualunque delle tre vie eccitatorie ippocampali determina un aumento dell’ampiezza dei potenziali postsinaptici eccitatori nei neuroni bersaglio. Questo aumento dell’efficacia sinaptica, che può durare giorni o settimane, viene definito long term
potentiation (LTP). Tale fenomeno nell’ippocampo dei mammiferi condivide
solo in parte gli stessi meccanismi molecolari visti per la facilitazione sinaptica in A. californica.
L’LTP nella via delle fibre muscoidi, che avviene a livello delle sinapsi tra le cellule dei granuli del giro dentato e i neuroni piramidali del campo CA3, è dovuto essenzialmente ad un aumento del rilascio del neurotrasmettitore glutammato dal terminale presinaptico mediato dall’ingresso di Ca2+ in seguito
a) b)
Fig. 3: Veduta dell’ippocampo e delle tre principali vie afferenti a) nel ratto b) nell’uomo
(tratte da “Memory from mind to molecules”, Kandel & Squire, Scientific American Library). alla stimolazione tetanica e all’attivazione della via del cAMP. In questa via l’induzione e l’espressione dell’LTP sono dovuti a fenomeni di facilitazione presinaptica simili a quelli ritrovati in A. californica. Al contrario, l’LTP che avviene tra le collaterali di Schaffer e i neuroni dell’area CA1 è più complesso. Infatti la fase di induzione dell’LTP è un evento di natura postsinaptica che coinvolge un ingresso massiccio di Ca2+ nel terminale postsinaptico attraverso l’apertura di recettori-canali del N-metil-D-aspartato (NMDA) e il reclutamento di vie di traduzione del segnale che attivano differenti chinasi quali: la chinasi
Ca2+/calmodulina dipendente (CaMK), la PKC, la PKA e la tirosina
protein-chinasi fyn (Kandel and Mack, 2003). La protein-chinasi CaMK dipendente fosforila i recettori-canale AMPA (alfa-Amino-3-Idrossi-5-Metil-4-isoxazolone propinato) aumentando la loro sensibilità al glutammato e attiva altri recettori normalmente inattivi. Queste modificazioni forniscono un valido contributo postsinaptico al mantenimento dell’LTP. In queste sinapsi è stato inoltre notato che l’espressione e il mantenimento dell’LTP, al contrario dell’induzione, non sono legate solo a fattori postsinaptici ma richiedono altresì un aumento della
liberazione del neurotrasmettitore dal terminale presinaptico. Questo ultimo aspetto sembra essere indotto dal rilascio di messaggeri retrogradi dalle spine dendridiche delle cellule postsinaptiche che raggiungerebbero il terminale presinaptico attivando una o più vie di secondi messaggeri che porterebbero ad un aumento del rilascio del neurotrasmettitore.
Analogamente a quanto visto nella facilitazione sinaptica in A. californica anche per l’LTP possono essere individuate due fasi temporalmente distinte ciascuna caratterizzata da meccanismi cellulari e molecolari di base specifici. La fase precoce (early LTP o E-LTP) è indotta da una singola stimolazione tetanica, dura poche ore ed è legata esclusivamente a modificazioni a livello di proteine già preesistenti. La ripetizione della stimolazione tetanica determina invece la comparsa di una fase duratura dell’LTP mantenuta per almeno 24 ore che viene definita LTP tardivo (late LTP o L-LTP). Mentre il meccanismo di induzione dell’LTP precoce è differente nelle diverse vie ippocampali, il meccanismo dell’L-LTP appare simile in tutte e tre le vie e necessita sempre di modulazione dell’espressione genica e sintesi di nuove proteine. Tali eventi dipendono da una cascata di segnali cellulari stimolata dall’incremento della concentrazione
intracellulare di cAMP. L’ingresso di Ca2+ andrebbe ad attivare una AC
sensibile con conseguente aumento della concentrazione intracellulare di cAMP e attivazione della via PKA-MAPK-CREB. Numerosi studi hanno messo in evidenza il ruolo della PKA come induttore della sintesi proteica nella fase tardiva dell’LTP utilizzando inibitori della sintesi proteica o inibitori specifici per PKA (Abel et al., 1997; Schafe et al., 1999). Topi transgenici con un’attività alterata della PKA presentano un L-LTP anomala ed esibiscono anche deficit nella memoria spaziale a lungo termine. Questo suggerisce che questa chinasi gioca un ruolo fondamentale durante la fase di consolidamento in alcune forme di memoria (Abel et al., 1998).
1.4 Condizionamento alla paura (fear conditioning)
Tutti gli animali in grado di sviluppare un apprendimento associativo, dai gasteropodi all’Uomo, riescono a mettere in relazione gli eventi che si verificano nell’ambiente circostante in base alla loro contingenza e non semplicemente in base alla loro contiguità temporale. Questa capacità nasce dall’esigenza di far fronte ai problemi legati alla sopravvivenza e all’adattamento. In questo senso è plausibile pensare che a livello cerebrale si siano evoluti meccanismi neurali in grado di fungere da rilevatori dei rapporti di causalità che si instaurano tra gli eventi che si verificano nell’ambiente. Nell’ambito delle risposte condizionate si ritrovano non solo quelle risposte innate relative agli stimoli alimentari studiate da Pavlov, ma anche quelle relative a stimoli di altra natura. Tra queste, quelle indotte dalla presenza di un pericolo sono state e sono tuttora correntemente studiate in molti modelli animali e sono definite “risposte condizionate di paura”. Come le altre risposte apprese, esse si basano sui meccanismi neurali di apprendimento e memoria, e consentono a ogni singolo individuo di rispondere nella maniera tendenzialmente più efficace a stimoli, i quali senza l’apprendimento, non indurrebbero le risposte spontanee di paura. Questa possibilità è essenziale per la sopravvivenza, in quanto consente di apprendere quali siano gli stimoli (o le informazioni) che indicano la presenza di un pericolo e di associarli ad esso. Pertanto questo tipo di il condizionamento viene rapidamente appreso e mantenuto a lungo nel tempo. Le risposte condizionate alla paura possono essere facilmente indotte anche sperimentalmente. Infatti, se ad un soggetto sperimentale si presenta uno stimolo sensoriale neutro (CS) (una luce ad esempio) in stretta associazione temporale con uno stimolo avversivo (US) (rappresentato da una scossa elettrica alle zampe), la successiva presentazione del CS indurrà nell’animale le risposte di paura, anche senza la presenza dell’US. Queste risposte possono instaurarsi in seguito a pochi o un solo accoppiamento CS-US (Fanselow, 1980; 1990; Muller et al., 1997) e possono essere ritenute per lungo tempo (Kim and Fanselow, 1992; Sacchetti et al.,
1999a). Si è osservato che questo tipo di condizionamento dipende strettamente dall’attivazione dell’amigdala (LeDoux, 2000; Maren, 2001). Il complesso amigdaloideo è costituito da quattro regioni distinte: Amigdala Laterale, Basolaterale, Centrale e Mediale. Ciascuna di queste regioni mostra caratteristiche funzionali e fisiologiche simili nel ratto e nei primati. Nel suo complesso l’amigdala rappresenta un punto di connessione tra le aree sensoriali corticali e sottocorticali e le strutture sottocorticali che regolano le risposte endocrine e comportamentali.
Molte delle conoscienze sul ruolo dell’amigdala nei fenomeni di apprendimento e memoria derivano da studi su soggetti sperimentali sottoposti a condizionamento alla paura. Lesioni bilaterali dell’amigdala sono accompagnate da amnesia anterograda e retrograda per le risposte di paura condizionata e rendono i soggetti incapaci di apprendere nuove risposte di paura in seguito al condizionamento (LeDoux, et al., 1990; Phillips and LeDoux, 1992; LeDoux; 1995; Maren et al., 1996). Inoltre è stato dimostrato che l’amigdala svolge un ruolo fondamentale nell’apprendimento e nella memorizzazione delle risposte condizionate alla paura indipendentemente dalla modalità sensoriale utilizzata come CS. Altri studi hanno dimostrato che le informazioni sensoriali riguardanti sia gli stimoli condizionati sia quelli incondizionati convergono a livello dei neuroni dell’amigdala (LeDoux 1995; Shi and Davis, 1999) e che i neuroni dell’amigdala mostrano modificazioni plastiche dell’efficacia sinaptica durante il condizionamento avversivo (Maren, 2000). Lo stimolo emozionale raggiunge il talamo e da qui viene proiettato alla corteccia sensoriale primaria e al nucleo laterale dell’amigdala. Quest’ultimo, tramite i nuclei basolaterali e basomediali, invia l’informazione al nucleo centrale, che, a sua volta, lo proietta alle seguenti aree cerebrali: al nucleo della stria terminale, al nucleo parabrachiale, al grigio centrale, all’ipotalamo laterale, al nucleo reticolaris pontis caudalis e al nucleo basale. Ognuna di queste aree produce una particolare componente della risposta emotiva alla paura con risposte comportamentali, neurovegetative e ormonali specifiche (fig. 4).
Fig.4: Pathways del fear conditioning (tratto da Le Doux and Muller 1997)
Un altro aspetto importante del circuito alla base del condizionamento della paura riguarda la modalità con cui le informazioni arrivano all’amigdala. Uno stimolo, infatti, può raggiungere l’amigdala attraverso due vie distinte e simultanee: la via extralemniscale (detta anche “via bassa”) e una via lemniscale (detta anche “via alta”) (LeDoux, 1992; Doron and LeDoux 2000). La prima è una via subcorticale che trasferisce le informazioni sensoriali, in modo rapido ma poco specifico, al talamo che a sua volta invia segnali direttamente all’amigdala. Il segnale così trasmesso risulta non elaborato, perché non presenta un’analisi specifica delle informazioni sensoriali trasferite. Allo stesso tempo, però, l’informazione sensoriale relativa allo stimolo viene proiettata all’amigdala attraverso la via corticale, che risulta meno rapida ma più specializzata nell’effettuare l’analisi infomazionale. Tramite la via alta l’informazione sensoriale viene così proiettata al talamo, poi alla corteccia sensoriale e infine alla amigdala. L’esistenza di queste due vie può apparire ridondante ma, quando si tratta di rispondere ad uno stimolo potenzialmente minaccioso, la velocità e la certezza della risposta assume un valore adattativo fondamentale per la sopravvivenza.
Esiste anche un’altra forma di condizionamento alla paura, non legata ad una singola modalità usata ma all’ambiente in cui avviene il condizionamento. In questo caso il soggetto sperimentale impara ad associare l’ambiente o il contesto (inteso come l’intero panorama sensoriale in cui avviene l’addestramento) all’US. Quindi in questa forma di condizionamento, che viene definita condizionamento contestuale alla paura o contextual fear conditioning (CFC), l’ambiente assume le caratteristiche di CS e, successivamente la sola presentazione dell’ambiente (senza US), sarà in grado di determinare risposte di paura. Numerosi studi hanno dimostrato che questo tipo di condizionamento è legato all’attivazione sia dell’amigdala che dell’ippocampo (Phillips and LeDoux, 1992; Rodrigues et al., 2001).
Recenti studi suggeriscono che i substrati neurali necessari per l’acquisizione delle risposte condizionate alla paura verso il contesto o verso un CS discreto possono essere parzialmente dissociabili e quindi tali risposte possono essere apprese contemporaneamente ma posseggono rappresentazioni mnemoniche distinte (Corodimas and LeDoux, 1995; Kim and Fanselow, 1992; LeDoux, 1995; Sacchetti et al., 1999b; Shumyatsky et al., 2005).
Il ruolo dell’ippocampo nel condizionamento alla paura contestuale è stato oggetto di numerosi studi dai quali è emerso che questa struttura cerebrale gioca un ruolo fondamentale nella formazione e nel consolidamento delle relazioni tra diversi stimoli o eventi (Rudy et al., 2004; Anagnostaras et al., 2001). Secondo questi modelli l’ippocampo è necessario quando più stimoli debbano essere associati, cioè durante una seduta di addestramento o subito dopo. Una volta compiuta l’associazione e quindi la costruzione di una rappresentazione unificata del contesto, l’ippocampo non sarebbe più necessario, se non quando le associazioni vengano richiamate. Questa ipotesi è in linea con i risultati ottenuti da studi su animali sottoposti a lesioni cerebrali che hanno messo in evidenza il ruolo temporalmente determinato di questa struttura nella formazione di alcuni aspetti della memoria alla paura contestuale.
Fig.5: Protocollo per i due tipi di fear conditioning (tratta da “Memory from mind to
molecules”, Kandel & Squire, Scientific American Library).
Lesioni dell’ippocampo prima o subito dopo il condizionamento comportano perdita delle risposte di paura, mentre lesioni eseguite parecchi giorni dopo l’addestramento non compromettono l’acquisizione delle risposte condizionate (O’Keefe and Nadel, 1978; Morris et al., 1986; Squire, 1992; Young et al., 1994; Mc Nisch et al.,1997; Burgess et al., 1999). Secondo questa ipotesi l’ippocampo è coinvolto nell’acquisizione e nel mantenimento temporaneo della rappresentazione del contesto (CS), mentre l’amigdala è coinvolta nell’associazione US-CS, nell’elaborazione delle singole entrate sensoriali,
nell’attribuzione ad esse di un significato emotivo e nella produzione delle risposte di paura (Maren and Fanselow, 1996; Lee et al., 1996). E’ noto che, dopo essere stati sottoposti al paradigma comportamentale del CFC, i soggetti addestrati apprendono con maggior facilità e mostrano di associare l’ambiente
in cui si trovano agli stimoli avversivi (US) forniti loro durante l’esplorazione dell’apparato di condizionamento. I soggetti addestrati mostrano freezing o immobilità ogni volta che sono inseriti nell’apparato di condizionamento (retrieval test). La risposta di freezing è definita come la completa assenza di mobilità del corpo ad eccezione dei movimenti respiratori ed oculari. Tale reazione non è rilevabile quando gli stessi soggetti, precedentemente sottoposti alla sessione di condizionamento, sono inseriti in un ambiente diverso da quello in cui sono stati forniti gli stimoli avversivi. Pertanto il freezing espresso nel
retrieval test rappresenta una risposta condizionata dovuta all’associazione tra
quello specifico ambiente e gli stimoli avversivi (Fanselow, 1990; Kim and Fanselow, 1992; Milanovich et al., 1998; Sacchetti et al., 1999a;b). Inoltre il
freezing non è rilevabile quando i soggetti esplorano l’apparato di
condizionamento senza che siano forniti loro stimoli avversivi (exploration
procedure) oppure quando agli animali inseriti nell’apparato di
condizionamento sono forniti stimoli avversivi di pari intensità ma in un intervallo di tempo minore, rispetto al protocollo del CFC, così da impedire l’associazione fra questi stimoli e il nuovo ambiente (shock-only procedure) (Fanselow, 1990; Taubenfeld et al., 1999; Rodrigues et al., 2001).
Altri studi sottolineano il coinvolgimento nell’apprendimento alla paura anche di aree corticali (Sacchetti et al., 2002). Queste aree non solo sono coinvolte nel consolidamento delle tracce mnemoniche, ma giocano ruoli diversi a seconda del tipo di apprendimento preso in esame e a seconda della fase di elaborazione della traccia mnemonica. In particolare la corteccia pre-frontale sembra avere un ruolo modulatorio sulle risposte a stimoli avversivi quando tali stimoli sono utilizzati per indurre il condizionamento. La corteccia frontale e parietale, in linea con la loro funzione durante la fase di acquisizione dell’apprendimento, giocano invece un importante ruolo nel freezing indotto sia dal condizionamento alla paura acustico che contestuale. L’integrità funzionale della corteccia peririnale sembra essere necessaria sia per la fase di acquisizione che per la fase di consolidamento della traccia mnemonica in seguito a condizionamento alla paura, sia acustico che contestuale (Sacchetti et al., 1999b). L’inattivazione
dell’amigdala durante la fase di acquisizione determina amnesia sia durante il paradigma di condizionamento alla paura acustico che contestuale (Phillips and LeDoux, 1992; Rosen et al., 1992; Maren et al., 1996). E’ stato suggerito che durante la fase di acquisizione l’informazione acustica giunge all’amigdala tramite la corteccia frontale e parietale (LeDoux, 2000). In condizioni normali la corteccia prefrontale, tramite le sue connessioni con l’amigdala, inibisce lo stato di paura (Morgan and LeDoux, 1995). L’inibizione sperimentale della funzionalità dell’ippocampo induce amnesia solo nel caso della ritenzione della memoria della paura contestuale (Phillips and LeDoux, 1992). Poco è ancora noto circa le vie che trasferiscono le informazioni riguardanti il contesto all’ippocampo. Tuttavia i risultati ottenuti dall’inattivazione dell’attività della corteccia peririnale indotta da lidocaina (LIDO) suggeriscono l’ipotesi che le informazioni contestuali possono raggiungere l’ippocampo tramite questa area corticale (Morgan and LeDoux, 1995; LeDoux, 2000).
I risultati di tutte queste ricerche sia sui primati che su altri mammiferi sottolineano il ruolo primario svolto dall’amigdala, dall’ippocampo e di alcune aree corticali a loro adiacenti nei processi di apprendimento e memoria legati al condizionamento alla paura.
1.5 Fear conditioning come paradigma sperimentale per lo
studio dei processi mnemonici
Il condizionamento alla paura rappresenta oggi uno dei più interessanti paradigmi comportamentali per lo studio delle basi neurobiologiche dell’apprendimento e della memoria perché può essere facilmente inducibile in condizioni sperimentali e viene mantenuto per lungo tempo. Inoltre questa forma di apprendimento è largamente diffusa nel mondo animale e coinvolge circuiti neurali simili nelle diverse specie di vertebrati, uomo compreso. Questo paradigma quindi è stata ampliamente studiata per determinare gli eventi molecolari che sono alla base dell’acquisizione e del consolidamento delle tracce mnemoniche. Al contrario di altri paradigmi comportamentali che
richiedono più sedute di addestramento per essere apprese il condizionamento alla paura determina un apprendimento duraturo dopo una singola sessione di addestramento. Questo permette di circoscrivere temporalmente un unico evento e di seguire lo sviluppo temporale della traccia mnemonica corrispondente. In più offre la possibilità di evidenziare e distinguere le differenti fasi della costruzione del processo mnemonico.
Sebbene le vie neuroanatomiche e gli eventi sinaptici alla base del condizionamento alla paura siano stati ben caratterizzati (Davis, 1992; Le Doux, 1992;1995), i meccanismi molecolari alla base la memoria alla paura sono ancora poco conosciuti. Numerosi studi hanno dimostrato come meccanismi biochimici che sono alla base dell’LTP sono anche necessari per il consolidamento della memoria alla paura nell’amigdala. Infusioni intra-amigdaloidee di inibitori della sintesi di mRNA distruggono la memoria a lungo termine per la paura uditiva e contestuale (Bailey et al., 1999).
Analogamente infusioni intra-amigdaloidee di inibitori della sintesi proteica o della PKA danneggiano il consolidamento della memoria alla paura uditiva compromettendo la memoria a lungo termine e risparmiando quella a breve termine (Canal and Gold, 2007).
Iniezioni di Rp-cAMPS, inibitore delle PKA, a livello del nucleo laterale dell’amigdala di ratti sottoposti al il paradigma del condizionamento alla paura, determinano dopo 24 h il danneggiamento della memoria a lungo termine (Schafe et al., 2000). Il consolidamento della memoria emozionale, in particolare della paura, richiede dunque espressione genica PKA-dipendente e sintesi proteica nell’amigdala.
Studi elettrofisiologici condotti dal nostro gruppo di ricerca in collaborazione con il gruppo diretto dal Prof. Bucherelli dell’Università di Firenze è emerso il ruolo centrale dell’ippocampo nell’acquisizione e nel consolidamento delle risposte alla paura legate al contesto. È stata, infatti, dimostrata una chiara correlazione tra l’aumento dell’eccitabilità a livello delle sinapsi tra collaterali di Schaffer e i dendriti dei neuroni del campo CA1 e il consolidamento della risposta di freezing (Sacchetti et al., 2001). In queste ricerche i soggetti
sperimentali sono stai divisi in quattro gruppi: ratti condizionati (animali soggetti a CFC), exploration (animali che avevano esplorato liberamente l’apparato), naïve (mai entrati nell’apparato di condizionamento) o shock-only (animali che avevano ricevuto lo stesso numero di scosse di intensità pari a quella dei condizionati, ma compresse temporalmente così da non poter associare US al contesto). I ratti condizionati esibivano freezing duraturo quando posti nuovamente nello stesso apparato di condizionamento (retrieval
test) immediatamente dopo l’addestramento e anche 1, 7 e 28 giorni dopo il
condizionamento (fig.6).
Fig.6: Misurazione della durata della risposta di freezing nei 4 gruppi sperimentali subito
dopo il CFC subito dopo (0) e 1,7,28 giorni dopo il condizionamento. Per spiegazione vedere il testo (tratto da “Sacchetti et al., 2001).
Gli altri soggetti sperimentali non esibivano la risposta condizionata di freezing. In tutti e quattro i gruppi sperimentali sono state misurate le modificazioni dell’eccitabilità ippocampale misurando le input/output curvers (IOC) in seguito all’applicazione di un singolo stimolo di bassa intensità in slices di ippocampo preparate a diversi intervalli di tempo dal condizionamento. Subito dopo la seduta di addestramento (all’inizio del periodo di post-acquisizione) si è osservato un aumento dell’eccitabilità sinaptica, a partire da 1 fino a 7 giorni dopo il condizionamento solamente nel gruppo di animali condizionati. A
distanza di 28 giorni dal condizionamento non si osservava alcuna modificazione dell’eccitabilità sinaptica.
Modificazioni nell’attività sinaptica sono presenti anche nell’ippocampo dei soggetti exploration ma solamente subito dopo l’esplorazione (fig.7).
Questo ha suggerito l’ipotesi che gli stimoli contestuali siano sufficienti a indurre l’attivazione di meccanismi che controllano l’eccitabilità sinaptica, mentre quando stimoli avversivi sono associati al contesto la grande quantità di informazioni può essere processata solamente attraverso un aumento della durata dell’eccitabilità stessa. L’aumento dell’eccitabilità sinaptica registrato solamente fino a sette giorni dopo il CFC e la durata del freezing in seguito al condizionamento per circa un mese dopo il CFC (fig.7 e fig.6) indicano che l’ippocampo non è direttamente coinvolto nella conservazione a lungo termine delle risposte alla paura contestuale. I cambiamenti elettrofisiologici registrati a livello dell’ippocampo possono essere correlati al consolidamento delle tracce mnemoniche del CFC. La riduzione dell’incremento dell’attività sinaptica a distanza di sette giorni dall’addestramento può essere dovuta alla trasformazione delle tracce mnemoniche appena consolidate in altre forme di memoria. Gli effetti dell’apprendimento contestuale alla paura sull’eccitabilità sinaptica a livello dell’ippocampo sono stati studiati anche per mezzo di stimolazioni tetaniche ad alta frequenza (HFS), su slices della regione CA1 dell’ippocampo di ratto preparate immediatamente, 1 e 7 giorni dopo il
condizionamento (Sacchetti et al., 2002). Normalmente dopo questo tipo di
stimolazione si osserva un precoce e transiente potenziamento dell’attività sinaptica conosciuto come short-term potentiation (STP) (Malenka, 1991; Bliss
and Collingridge, 1993; Schulz et al., 1994), seguito dal potenziamento più
a
b
Fig.7: a) Time course dell’attività ippocampale misurata tramite le IOC ottenute da slices di
ippocampo nei soggetti analizzati (ulteriori spiegazioni nel testo) b)Risultati dell’analisi statistica delle registrazioni effettuate. Per spiegazione vedere il testo (tratto da “Sacchetti et al., 2001).
HFS produce un decremento nell’ampiezza dell’STP e dell’ LTP nei condizionati e non nei naïve. La riduzione di STP è presente solo nelle slices preparate immediatamente dopo CFC e fino a poche ore dopo. La diminuzione di LTP è ancora presente trascorse 24 h, mentre 7 giorni dopo non è misurabile alcun decremento. Entrambe le modificazioni appaiono essere chiaramente correlate al processo di apprendimento (associazione contesto-US), poiché non sono osservate nei soggetti shock-only. Nei soggetti exploration sono presenti diminuzioni dell’LTP, ma solo immediatamente dopo il condizionamento, e l’STP non risulta mai essere modificata (Sacchetti et al., 2002). Questi dati sono
in linea con risultati ottenuti da altri gruppi di ricerca (Foster et al., 1996; Waters et al., 1997). L’assenza di modificazioni nelle preparazioni ottenute da animali shock-only, conferma i dati precedenti, che hanno evidenziato che l’emozionalità, l’attività muscolare e gli stimoli nocicettivi non sono sufficienti ad innescare il processo di apprendimento e le variazioni nell’eccitabilità ippocampale connesse ad esso (Fanselow, 1990; Milanovich et al., 1998; Sacchetti et al., 2001 ).
Il decremento dell’STP è misurabile nei soggetti condizionati, ma solo subito dopo il condizionamento. Ciò suggerisce che le modificazioni dell’STP sono chiaramente correlate alla fase di acquisizione dell’associazione CS-US (che si verifica immediatamente in seguito all’addestramento negli animali condizionati) e non a eventi successivi quali il consolidamento dell’associazione CS-US. La differenza tra STP e LTP, già nota a livello biochimico ed elettrofisiologici, è ulteriormente sottolineata dal fatto di essere differentemente influenzate da processi associativi (Malenka, 1991; Bliss and Collingridge, 1993). L’affermazione che il processo associativo mnemonico è la causa principale del decremento nell’induzione di STP e LTP, basa sull’ipotesi che l’STP e l’LTP condividono meccanismi comuni i quali portano all’elaborazione specifica dell’apprendimento (Foster et al., 1996; Jeffery, 1997; Rioult-Pedotti
et al., 2000). Questi risultati, nel complesso, mostrano che il processo di
apprendimento delle risposte condizionate di paura al contesto influenza in maniera diversa l’eccitabilità sinaptica e l’induzione di STP e LTP nella regione CA1. Inoltre questi risultati sono in linea con studi che hanno dimostrato una riduzione dell’induzione dell’LTP prima e dopo un aumento dell’attività sinaptica (Huang et al., 1992) e un incremento dell’eccitabilità sinaptica associato a un calo dell’induzione dell’LTP nella corteccia motrice di ratti in seguito ad apprendimento di compiti motori (Rioult-Pedotti et al., 2000).
In accordo con questi dati e con la recente letteratura (Martin et al., 2000) è stato supposto che il rafforzamento dell’attività sinaptica durante i processi di consolidamento della memoria coinvolga un meccanismo LTP-simile. I risultati, inoltre, mostrano che il processo mnemonico influenza STP e LTP a tempi
diversi in relazione a fasi mnemoniche differenti. Immediatamente dopo la sessione di addestramento, quando sia STP che LTP sono basse, entrambe sottendono i meccanismi neuronali della memoria a breve termine (Kim and Fanselow, 1992; Abel et al., 1998). Durante la successiva fase di consolidamento, invece, solo l’induzione dell’LTP viene ad essere aumentata. I meccanismi biochimici e molecolari di consolidamento, che hanno luogo nell’ippocampo, avvengono entro le 24 h seguenti la sessione di acquisizione (Matthies, 1989; Olds et al., 1989; Bernabeu et al., 1997). Dunque i processi di induzione dell’LTP potrebbero essere correlati alle modificazioni dell’eccitabilità dovute a questo fenomeno. Dopo 7 giorni dall’acquisizione, l’LTP non mostra più modificazioni, tuttavia si può affermare con sicurezza che l’ippocampo sia ancora coinvolto in processi associativi a lungo termine anche sette giorni dopo (Kim and Fanselow 1992; Thompson et al., 1996; Riedl et al., 1999; Shimizu et al., 2000). Questi processi tardivi sembrano essere distinti da quelli correlati alle fasi precoci della memorizzazione. Infatti risultano essere meno facilmente eliminabili e solo inattivazioni reversibili ripetute o lesioni irreversibili possono essere seguite da amnesia.
Alla luce di quanto riportato risulta assodato che i fenomeni di memoria a lungo termine indotti dall’apprendimento alla paura determinano effetti comportamentali ed elettrofisiologici ormai conosciuti in dettaglio. I meccanismi biomolecolari, invece, risultano ancora poco conosciuti. Pertanto l’utilizzo di tecniche di biologia molecolare, in particolare quelle di analisi dei
patterns di espressione genica, rappresenta un mezzo di ricerca interessante che
può portare ad una conoscenza più approfondita dei meccanismi molecolari alla base di questo tipo di memoria.