INTRODUZIONE
1.1. Proprietà salutistico nutrizionali dei vegetali
Negli ultimi anni le ricerche scientifiche e gli studi epidemiologici hanno dimostrato che una dieta sana ed equilibrata, ricca di frutta e verdura, può aiutare a mantenere uno status di equilibrio psico-fisico ottimale.
Ad oggi, soprattutto in Occidente, l’alimentazione non è più vista solo come il mero soddisfacimento di un fabbisogno fisico ma è anche una continua ricerca di alimenti di prevenire patologie e arricchire l’organismo di sostanze benefiche.
Quest’ultima funzione è attribuibile principalmente all’apporto di vitamine, minerali nonche di fitochimici con azione antiossidante come carotenoidi, antociani, flavonoidi e altri composti fenolici, ampiamente distribuiti largamente in tutto il regno vegetale. (Luthria et al., 2006).
L’evidenza di una correlazione positiva tra il consumo di frutti e vegetali e la prevenzione di malattie degenerative emerge dallo studio delle proprietà antiossidanti dei vegetali; per questo, , la ricerca è sempre più focalizzata su incroci genetici e modifiche delle condizioni di crescita volte ad aumentare il contenuto di micronutrienti e in grado di avere effetti positivi sulla prevenzione di patologie cardiovascolari e tumorali.
L’aumento di attenzione sulla nutrizione e sulle proprietà salutistiche dei vegetali inoltre, deriva anche dall’incapacità dell’organismo animale di proteggersi dai processi ossidativi.
Gli alimenti vegetali, quindi, possono essere considerati dei “functional foods”, definizione data nel 1994 dall’Istitute of Medicine’s Food and Nutrition Board per quei cibi o ingredienti che possono fornire un beneficio alla salute ritardando i processi di invecchiamento cellulare, in aggiunta ai tradizionali nutrienti che contiene. Tale categoria di alimenti può contribuire
ad incrementare le difese biologiche, a prevenire l’insorgenza di specifiche patologie o a permettere un loro recupero.
L'agricoltura è sempre più indirizzata verso la produzione di alimenti funzionali, in particolare frutta ed ortaggi ricchi di vitamine protettive e di altri composti con potenziali effetti positivi sulla salute. In particolare c'è un forte interesse verso quelle metodologie “environmental friendly” che possono indurre un innalzamento delle proprietà antiossidanti dei prodotti vegetali.
La stima dell’attività antiossidante di un alimento è oggi utilizzata è utilizzata come parametro di valutazione per la sua qualità nutrizionale.
Le richieste da parte di consumatori sempre più accorti ed attenti si indirizzano verso prodotti vegetali che, oltre a soddisfare le richieste nutritive per le quali sono conosciuti, presentino un bell'aspetto e risultino gradevoli, ed inoltre siano capaci di fornire anche un importante apporto di sostanze che siano benefiche alla salute umana, individuando, in questo modo, quelli che possono essere considerati dei prodotti di alta qualità.
1.2.
Qualità e proprietà benefiche del pomodoro
Il pomodoro, alimento simbolo della dieta mediterranea e oggetto di questo studio, appartiene alla categoria dei “cibi funzionali” in quanto in grado di svolgere funzioni benefiche oltre ad essere nutrimento. Esso è una grande fonte di antiossidanti e contribuisce al consumo giornaliero di una significativa quantità di queste molecole.
I pomodori vengono consumati freschi o trattati industrialmente (salse, ketchup, zuppe, pomodoro in scatola, etc.), ed il loro consumo è stato dimostrato essere inversamente correlato allo sviluppo di alcuni tipi di cancro e all’ ossidazione lipidica nel plasma.
I pomodori contengono diverse classi di sostanze con proprietà antiossidanti
(Lenucci et al., 2006); tali sostanze, che recentemente sono state definite col
classi dei carotenoidi e dei flavonoidi, anche se è appurato che anche altri componenti minoritari del metaboloma del frutto di pomodoro come la vitamina E, la vitamina C ed altri composti fenolici non flavonoidici contribuiscono a completare tale quadro caratterizzato dall'estrema ricchezza in molecole utili per la salute. E’ stato dimostrato che un singolo composto o una singola classe di composti non può determinare completamente l’effetto positivo sulla salute in mancanza del sinergico effetto di altri composti (Stevens et al. 1977).
Come tutte le specie vegetali, anche la pianta di pomodoro è caratterizzata da un metabolismo secondario decisamente sviluppato. Tale metabolismo, si realizza a livello cellulare parallelamente a quello che viene definito metabolismo primario. Quest'ultimo svolge principalmente il ruolo di produrre i "mattoni molecolari", essenzialmente di natura carboidratica, tramite i quali verranno costruite la gran parte delle strutture della pianta. Diversamente, il metabolismo secondario risulta relativamente più modulabile del primario ed inducibile, soprattutto in condizioni colturali ed ambientali che possono essere definite non del tutto ideali, bensì caratterizzate dalla presenza di qualche tipo di stress, di natura abiotica o biotica.
Qualora una specie vegetale venga coltivata in modo da poter disporre di elementi nutritivi in abbondanza, delle condizioni di luce che non siano né deficitarie né troppo elevate in termini di intensità ed, infine, in assenza di qualsiasi, anche debole, fonte di stress, questa tenderà a privilegiare la produzione di un'elevata biomassa a scapito del contenuto in metaboliti secondari. Diversamente, qualora si riesca a individuare il giusto compromesso tra richieste nutritive della specie in questione e l'introduzione nelle condizioni colturali di una blanda fonte di stress controllato, a fronte, in certi casi, di una minima riduzione nella biomassa, il prodotto ottenuto potrebbe essere caratterizzato da un notevole ricchezza in metaboliti secondari e, quindi, di elevata qualità nutrizionale. Tuttavia, a dispetto di ciò ed anche allo scopo di fornire prodotti fuori stagione destinati alla grande distribuzione, molte delle realtà produttive in campo
agricolo, spesso di natura industriale, si sono indirizzate verso un tipo di produzione che privilegiasse la quantità a dispetto della qualità.
A oggi i produttori desiderano un pomodoro di buon aspetto con meno difetti visibili possibili, una produzione cospicua, che mostri resistenze alle malattie e presenti facilità di raccolta (Stevens et al. 1977).
L’interesse dei ricercatori in campo agronomico si volge verso lo studio di possibili fonti di stress foto-ossidativo, come la radiazione UV-B, per approfondire gli aspetti dell'interazione tra g li ef fe tt i d i q ue st e sor ge nt i d i st re ss e la fisiologia vegetale ed anche allo scopo di valutare il suo effetto sulla modulazione di alcune caratteristiche desiderate per l'ottenimento di prodotti agricoli di qualità.
1.3.
Il pomodoro: origini e generalità
Il pomodoro (Lycopersicum esculentum) è una pianta erbacea dicotiledone appartenente alla famiglia delle Solanacee ed è originario dell’area sudamericana compresa tra Cile ed Ecuador. Descritto per la prima volta da padre Josè de Acosta nella sua Historia del 1589; egli definì i pomodori come grossi chicchi freschi, sani e sugosi “con i quali vengono fatte salse saporite che riescono a frenare gli effetti dell’aggressivo peperoncino…ma sono ugualmente buoni da mangiare da soli”.Questo nuovo prodotto raggiunse l’Europa attraverso la Spagna, ma con ogni probabilità i primi esemplari essere talmentepiccoli da essere denominati Licopersicum cerasiforme, per via della loro somiglianza a grosse ciliegie.
Lo si può vedere ancora oggi nel celebre ritratto dell’imperatore Rodolfo II in veste di Vertunno (antico dio romano della vegetazione) realizzato nel 1591 da Giuseppe Arcimboldi che utilizzò due piccoli pomodori per raffigurare le labbra.
Inizialmente il pomodoro era apprezzato più per il suo aspetto che per il suo sapore, in Francia nel Cinquecento qualcuno gli attribuì proprietà eccitanti e afrodisiache tanto da attribuirgli l’appellativo di pomme d’amour.
Si dovette attendere la fine del Settecento se non la fine dell’Ottocento perché i primi gastronomi e cuochi rivalutassero il frutto. Grazie ad incroci con varietà più redditizie si ebbe una svolta produttiva, passando dalla coltura familiare alla produzione per fini industriali.
Nel 1856 l’industriale Francesco Cirio a Torino cominciò una vasta produzione di conserve alimentari e nel 1875 apri la prima fabbrica si conserva di pomodoro. Per noi italiani il pomodoro insieme all’olio d’oliva è il condimento mediterraneo per eccellenza di pasta e pizza, alimenti che ci rappresentano in tutto il mondo.(Caterina e Giorgio Calabrese 2007).
1.4.
Morfologia
Il pomodoro è considerato in coltura, pianta annuale nelle condizioni di origine, in relazione alle condizioni climatiche favorevoli ha tendenza perennante (in condizioni ideali come le serre può restare in coltivazione da 5 a 7 anni) e può avere durata e vigore vario a seconda della varietà.
La radice
L’apparato radicale fibroso e ramificato può spingersi ad elevate profondità ma la maggior parte delle radici rimane nel primo strato di 30 cm, esso assume conformazioni differenti in relazione all’origine della pianta; se questa proviene da semina diretta, in campo la radice presenta un robusto fittone centrale, con numerose ramificazioni laterali; questo tipo di apparato andando in profondità consente alla pianta di essere meno soggetta a squilibri idrici e a danni da eccessi termici e di essere quindi più vigorosa. Nel caso in cui si effettua il trapianto, l’apparato radicale si sviluppa soprattutto lateralmente, interessando uno strato di terreno molto più superficiale (circa 30 cm), pertanto il rifornimento idrico dello stesso dovrà essere più costante con irrigazioni più frequenti con quantità d’acqua inferiori (La Malfa 2001).
Il fusto
Il fusto, nella pianta originaria, è eretto nei primi stadi di sviluppo, poi diviene decombente e bisognoso di un tutore. E’ costituito da nodi ingrossati, dai quali si dipartono le foglie e i getti ascellari, e da internodi più o meno lunghi sui quali si inseriscono le infiorescenze. L’accrescimento è teoricamente indefinito, in quanto dopo ogni infiorescenza si ha la differenziazione di una nuova gemma apicale. Il fusto può raggiungere e superare altezze di 2 m, con vigorose ramificazioni dicotomiche rigonfie nel punto d’inserimento sul fusto principale (La Malfa 2001).
Le foglie
La disposizione delle foglie sugli steli è alterna. Le foglie sono imparipennate, picciolate, lunghe 20-30 cm e sono composte da 7-11 foglioline diseguali; spesso i lobi presentano bollosità più o meno pronunciate. Esse sono ricoperte di peli ghiandolari che secernono, al contatto, una sostanza di odore acre: solanina. I caratteri fogliari possono presentare grandi differenze in seguito alle variazioni del clima, del terreno e dei sistemi colturali. Tuttavia si possono distinguere due forme di foglie, ossia quella normale e quella a “ patata” ; nel primo caso, il numero delle foglie semplici è più elevato delle altre, il lembo è sottile, mentre il bordo è solitamente sinuato, inciso o dentato. La foglia “ a patata” è invece caratterizzata da un lembo fogliare più grande delle prime e più spesso con margine generalmente intero (La Malfa 2001).
Fioritura
La fioritura è scalare, con progressiva formazione delle infiorescenze in tempi diversi e internodi successivi lungo il fusto principale e quelli secondari. I fiori sono ermafroditi con peduncoli articolati e non e riuniti in infiorescenze a racemo, portate lungo il fusto o sulle ramificazioni più grosse. Le infiorescenze possono essere in racemi semplici, biforcuti o ramificati. Il tipo semplice si trova più frequentemente nella parte bassa della pianta, mentre i tipi ramificati di solito si trovano nella parte superiore. Il numero di fiori per infiorescenza è vario e nello stesso racemo la fioritura spesso non è
contemporanea. Il singolo fiore è dotato di un calice gamosepalo, costituito generalmente da 5 sepali verdi e persistenti. La corolla, anch’essa gamopetala, è rotata, con un numero di petali normalmente pari a 5 di colore giallo. Gli stami, in numero solitamente uguale a quello degli elementi che formano la corolla, sono corti e uniti fra di loro a livello delle antere biloculari a formare una sorta di cono attorno al pistillo. L’ovario è supero e bicarpellare, ma si presenta plurisettato e porta molti ovuli a placentazione parietale. Lo stilo ha lunghezza variabile e si presenta slargato nella parte terminale a formare lo stigma, il quale, nei tipi lungi-stilo, può spengere dal cono delle antere favorendo l’impollinazione incrociata.
All’apertura della corolla corrisponde l’inizio del periodo di recettività degli stigmi, mentre la deiscenza degli stami ha inizio solo 24-48 ore dopo. Le antere del cono staminale che circondano il pistillo deiscono verso l’interno assicurando in tal modo l’impollinazione. A causa dell’anticipo di maturità dello stigma, rispetto alla deiscenza delle antere, può avvenire, anche se raramente, che polline estraneo provochi la fecondazione, cosa che si verifica più frequentemente in alcune varietà a stilo lungo (La Malfa 2001).
Germinazione
La germinazione del polline è alquanto lenta e la fecondazione avviene mediamente due giorni dopo l’impollinazione. Pertanto, visto che dall’antesi alla fecondazione intercorre un periodo abbastanza lungo, l’andamento stagionale in questa fase può facilmente compromettere tale processo (pioggia, vento, temperature estreme minori di 12°C o maggiori di 36°C). Se la fecondazione non si verifica, il fiore appassisce e dissecca a partire dai petali e cade. La caduta dei fiori può essere dovuta anche a cause patologiche (cascola), in questo caso può verificarsi dopo pochi giorni dall’antesi o anche a qualsiasi stadio di sviluppo del frutto (La Malfa 2001).
Il frutto
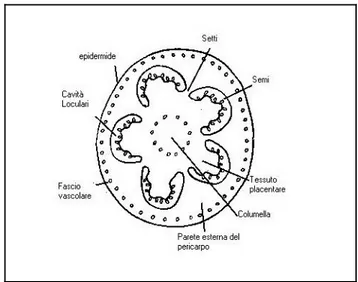
Il frutto è una bacca di colore rosso di diverse tonalità (in qualche vecchia cultivar giallo o bianco), di grandezza e forma variabile. Il contorno della bacca può essere liscio o variamente costoluto. Il frutto liscio ha una superficie priva di ondulazioni, quello costoluto presenta depressioni longitudinali che suddividono la superficie del frutto in spicchi a partire dall’estremità peduncolare e per la metà della lunghezza del frutto o anche più. Il pericarpo, sviluppandosi da un ovario, è interamente carnoso ed i semi sono contenuti all’interno delle cavità loculari. I frutti hanno da due a più carpelli, con un peso finale variabile da pochi grammi a qualche etto . Il pericarpo consiste in un esocarpo, o epidermide, un mesocarpo, costituito da un parenchima con un fascio vascolare ed un singolo strato di cellule costituenti l’endocarpo, che riveste la cavità loculari. La parete del pericarpo è ulteriormente divisibile in parete esterna e pareti radiali (setti) che separano cavità loculari adiacenti e la parete interna detta columella. Il mesocarpo della parete esterna è composto principalmente da cellule parenchimatiche le cui dimensioni sono massime nella regione centrale e diminuiscono man mano che si procede verso l’epidermide e le cavità loculari. Anche i setti e la columella presentano le stesse caratteristiche cellulari del mesocarpo. Talvolta la columella può apparire meno colorata del pericarpo a causa dell’inclusione di ampi spazi di aria che rendono il tessuto più chiaro. (La Malfa 2001) (Figura 1).
1.5.
Ciclo vitale dei prodotti ortofrutticoli
Il ciclo vitale dei prodotti ortofrutticoli può essere suddiviso in tre stadi fisiologici:
1. crescita: divisione cellulare ed aumento di volume cellulare fino alla
dimensione massima;
2. maturazione: inizia prima della cessazione della crescita. Per i frutti
si usa il termine ripening,che si riferisce alla fase finale dello stadio di maturazione,dopo la fine della crescita. È’ il risultato di eventi biochimico-fisici che trasformano un organo della pianta da non commestibile a commestibile;
3. senescenza:il metabolismo catabolico prevale sul metabolismo
anabolico.
Gli zuccheri principali che si trovano nei sink, sono il saccarosio (pomodoro, fragola, uva, agrumi, ecc), il sorbitolo (rosacee), il mannitolo (olivo) ed il raffinosio (cucurbitacee).
I frutti di pomodoro durante la crescita e la maturazione sono utilizzatori di zucchero per la respirazione e lo accumulano. Lo stoccaggio di saccarosio ed amido è temporaneo, perché tali zuccheri vengono scissi e risintetizzati, mentre nel frutto maturo si trovano glucosio e fruttosio.
Il metabolismo del saccarosio, che viene scaricato dal floema nei frutti, vede il coinvolgimento di alcuni enzimi importanti come la Saccarosio sintasi (Susy), la Saccarosio-P-sintasi (SPS), la Invertasi (INV) e la ADPGlucosio – pirofosforilasi (ADPG-PPasi).Tali enzimi sono coinvolti in 4 cicli metabolici nominati “ futili”, perché prevedono la degradazione e la sintesi del saccarosio (Susy,sps,INV), e la sintesi ed idrolisi dell’amido (ADPG-PPasi).
Il primo ciclo futile avviene nel citosol ed è responsabile dell’idrolisi e della ri-sintesi del saccarosio nel citosol. Nello scaricamento floematico del saccarosio si distinguono due fasi: una prima fase che comprende i primi
30-35 giorni dopo l’antesi (Days After Anthesis, DAA),in cui lo scaricamento è simplastico e dipende dall’attività di idrolisi del saccarosio da parte della Susy, ed una seconda fase, più lenta, che avviene dopo i primi 35 giorni fino a maturità, in cui lo scaricamento è apoplastico. Nella prima fase di crescita, la ri-sintesi del saccarosio è operata oltre che dalla Susy, anche dalla SPS. La risintesi del saccarosio diminuisce con la maturità.
Durante il secondo ciclo futile, che avviene nel vacuolo, parte del saccarosio scaricato nel citosol delle cellule di sink, viene trasportato nel vacuolo e qui scisso in glucosio e fruttosio tramite un’invertasi acida. Una parte di glucosio e fruttosio poi possono ritornare nel citosol per la ri-sintesi di saccarosio.Gli zuccheri esosi non si possono accumulare nel citosol perché inibiscono l’espressione genica.
Durante il terzo ciclo futile che avviene nella seconda fase di sviluppo del frutto, il saccarosio viene idrolizzato dall’invertasi acida apoplastica ed il glucosio e fruttosio prodotti nell’apoplasto sono trasportati nel citosol, per la ri-sintesi del saccarosio.
Nel quarto ciclo futile, che avviene nell’amiloplasto, avviene la sintesi e l’idrolisi di amido. Nel citolol, da glucosio, fruttosio e UDP-glucosio si forma un pool di esosi-P (G1P,G6P e F6P). Da questi, il glucosio6-P viene trasportato nel plastidio ed usato per sintetizzare amido tramite l’enzima ADPGlucosio-PPasi. Durante i primi 20 DAA prevale la sintesi di amido, mentre dai 20 ai 35 DAA prevale l’idrolisi di amido.
1.6.
Accrescimento del frutto: cambiamenti chimico-fisici
Lo sviluppo del frutto avviene dapprima lentamente poi sempre più velocemente fino al raggiungimento del volume massimo. (La Malfa 2001)
Il tasso di crescita può essere descritto da una curva ad andamento sigmoidale suddivisibile in tre fasi. La prima è una fase di lenta crescita che si protrae per 2-3 settimane con un peso del frutto che è minore del 10% del peso finale
di rapida crescita. Infine si ha un periodo di lenta crescita di due settimane durante il quale si nota un piccolo aumento di peso del frutto ed in cui hanno luogo intensi cambiamenti metabolici.
La lenta crescita iniziale risulta dalla divisione e dalla successiva distensione cellulare, mentre la seguente rapida crescita è interamente dovuta alla distensione (Monselise et al., 1978) e comporta, quindi un notevole incremento nel peso fresco. Si ha, infine, una nuova fase di lento accrescimento in cui il frutto va incontro ad una serie profondi cambiamenti anatomici, fisiologici e metabolici, che lo portano alla maturazione (Ho e Hewit, 1988). Tra le modificazioni metaboliche una evidente anche a occhio nudo, è la variazione di colore. Durante la maturazione prevalgono le clorofilla a e b, successivamente queste vengono demolite e cominciano ad accumularsi due carotenoidi: il licopene di colore rosso e il β-carotene di colore giallo arancio, nel momento in cui i cloroplasti si trasformano in cromoplasti. Il prevalere dell’uno o dell’altro alla completa maturazione determina l’intensità del colore rosso del frutto. Questo è un carattere varietale, ma è anche sotto l’influenza delle condizioni climatiche: un moderato ombreggiamento favorisce la formazione del licopene, mentre se il frutto è esposto alla luce più intensa e a temperature intorno a 30°C il β-carotene continua a formarsi, mentre si arresta la produzione di licopene. Dal momento che il colore della buccia è un eccellente indicatore del grado di maturazione del frutto, sono state sviluppate alcune scale di valutazione per classificare gli stadi maturativi dei pomodori sulla base della colorazione mostrata dal frutto (Grierson e Kader, 1986)( Tabella 1).
Classificazione Descrizione Immagine
Verde Colorato interamente di verde chiaro o scuro
Invaiatura
Prima apparizione di un colorito esterno roseo, rosso o giallo-tannino, che interessa
non più del 10% della superficie della buccia
Viraggio
La colorazione rosea, rossa o giallo-tannino interessa una superficie che rientra tra il 10% e il 30% della buccia
Rosa Più del 30% ma meno del 60% della buccia appare rosa o rossa
Rosso chiaro Più del 60% ma meno del 90% della buccia risulta rossa
Rosso Più del 90% della buccia risulta rossa
Tabella 1: Principali stadi maturativi del frutto di pomodoro sulla base della colorazione della buccia
Per quanto riguarda i cambiamenti fisici, durante la prima settimana di sviluppo del frutto sono osservabili cambiamenti anatomici a carico delle cellule del pericarpo. Uno-due giorni dopo l’impollinazione i piccoli vacuoli presenti all’interno di ogni cellula si uniscono a formare un grosso vacuolo centrale (Mohr e Stein, 1969) e, nel giro di un paio di settimane il citoplasma si riduce divenendo un sottile strato confinato alla periferia cellulare.
In contemporanea si ha lo stadio iniziale di separazione delle cellule, che inizia nei punti di contatto delle pareti comuni a cellule contigue e continua lungo la lamella mediana.
I plasmodesmi, che costituiscono punti di continuità tra i citoplasmi di cellule adiacenti, sono molto piccoli. Mentre ciò avviene, tutti gli organelli oltre al tonoplasto ed al plasmalemma, rimangono fisicamente intatti (Mohr e Stein,
1969) e fisiologicamente attivi.
Il frutto maturo conserva, infatti, un alto grado di organizzazione ultrastrutturale osservata, in particolare, a carico dei mitocondri, cromoplasti e reticolo endoplasmatico rugoso (Crookes e Grierson, 1983). I plastidi contengono amido e sono dotati di un sistema tilacoidale con grana ed intergrana Nel frutto verde le cellule epidermiche contengono meno amido di quelle parenchimatiche più interne. A livello di pericarpo le mitosi avvengono soprattutto nella prima settimana dopo la fecondazione e continuano ad un ritmo elevato anche nella seconda in questo periodo il numero delle cellule può incrementarsi da 8 a 30 volte.
Durante la crescita del frutto, il contenuto di materia secca diminuisce, con l’aumento del peso fresco dovuto da un più alto accumulo di acqua. Prima della fecondazione la materia secca è circa il 17% del peso dell’ovario, ed una volta che il frutto comincia a crescere, questa diventa il 10% dopo 10 giorni, e il 5-7 % dopo 20 giorni, rimanendo a tali livelli fino alla maturità. Gli elementi minerali più presenti, che contano per il 90% del contenuto totale di minerali, sono il potassio, azoto e fosforo. Durante lo sviluppo, l’azoto e il fosforo si riducono, mentre il contenuto di potassio rimane costante.
Gli zuccheri, soprattutto glucosio e fruttosio,contano per la metà della materia secca, e per il 65% dei solidi solubili totali di un pomodoro maturo. Appena il frutto comincia a crescere, il contenuto di zuccheri ridotti aumenta da 0,1% del peso fresco dell’ovario al 2 % del peso fresco del frutto in circa 2 settimane, e diventa il 3,5% alla maturazione. Il saccarosio conta solo per l’1% della materia secca; dopo l’impollinazione, il contenuto di zuccheri ridotti e di amido aumenta notevolmente, ma il contenuto di saccarosio si riduce dall’1% del peso fresco dell’ovario allo 0,2% del peso fresco del frutto in 8 giorni.
Sebbene il saccarosio sia il principale prodotto di assimilazione, la sua concentrazione rimane sempre piuttosto bassa. Il tasso di accumulo di amido raggiunge un picco in cui conta per il 30% della materia secca accumulata, dopo circa 20 giorni. Il massimo accumulo di amido conta per il 20% della materia secca a 25-30 giorni dopo l’antesi. La quantità più alta di amido si accumula nel tessuto loculare e placentare più che nel pericarpo, durante il periodo di crescita rapida. L’amido comincia a scindersi quando il frutto raggiunge la sua dimensione massima ed il suo contenuto diventa l’1% della materia secca allo stadio mature green (o lo 0,03 % del peso fresco del frutto al ripening). La rottura dell’amido è correlata con un accumulo di zuccheri ridotti.
Il contenuto di acidi organici incrementa durante tutto lo sviluppo ed il pH di un frutto mature green è circa 4.0.Il contenuto di acidi è più alto nei loculi che nel pericarpo e nei tessuti placentari. Gli acidi organici nel frutto di pomodoro consistono principalmente di acido citrico e malico, e contano per circa il 13% della materia secca totale.Durante il primo periodo di crescita, l’acido malico è l’acido predominante, mentre il citrico conta solo per il 2,5% dell’acidità totale.
1.7. Effetto dei fattori ambientali sulla crescita del frutto
L’epoca di raccolta varia a seconda del tipo di coltura e delle condizioni climatiche delle zone di coltivazione. Poiché il pomodoro ha maturazione scalare occorre effettuare la raccolta a mano; il miglioramento genetico tende ad agevolare la raccolta dei pomodori con le macchine. Inoltre si è ottenuta la contemporaneità di maturazione selezionando dei geni che ritardano la maturazione (non si producono o si ritardano gli enzimi che demoliscono la parete cellulare); sono geni “portatori di resistenza alla sovra maturazione”, che impediscono che si inneschi la distruzione di pectine nei frutti già maturi, mentre i pomodori “indietro” raggiungono la maturazione: in questo modo la
macchina raccoglie l’intera pianta, separando le foglie dal frutto ed eliminando eventuali frutti verdi. (Chamley et al. 2005).
• Luce e CO2 : sia la dimensione che il contenuto di solidi solubili del frutto
di pomodoro sono fortemente influenzati dalla radiazione solare ricevuta. L’intensità e la qualità della luce possono influenzare l’epoca di fioritura, l’allegazione, e la qualità delle bacche.
Quando la radiazione solare è più alta, sia la materia secca che il contenuto di zuccheri del frutto raggiungono i loro livelli massimi. Ci sono anche effetti diretti della luce sul metabolismo, come la fissazione di CO2, la sintesi
proteica e la sintesi di pigmenti. Un arricchimento di CO2 incrementa la resa
dei frutti, incrementandone il numero ed il peso. In frutti arricchiti con CO2 è
stato notato un lieve incremento di zuccheri e potassio ed un decremento di acidità e bassi contenuti di azoto e fosforo. Il frutto di pomodoro verde contiene clorofilla e fissa CO2 . Anche a livelli di luce saturante, ovvero 200
W/m2, il tasso di fotosintesi è solo 0,064 mg di CO
2 g/fw h per molti giovani
frutti e la fotosintesi non viene rilevata nei frutti vecchi. Sotto un flusso di luce di 40 W/ m2 , la fotosintesi non viene rilevata in nessun frutto di pomodoro, a
qualunque stadio e dimensione.
La CO2 viene fissata dalla polpa attraverso la via dei pentoso-fosfati nei
cloroplasti. Inoltre c’è una fissazione della CO2 in assenza di luce, che
coinvolge la fosfoenolpiruvato carbossilasi sia nella polpa che nella buccia, ed il principale intermedio è il malato. La CO2 ottenuta dal metabolismo del
malato all’interno dei frutti viene fissata di nuovo tramite un fissaggio al buio, nella forma di acido citrico con zuccheri ed amido. Attraverso il ciclo dell’acido citrico, il glutammato viene sintetizzato per la sintesi proteica.
L’ammontare del carbonio fissato al buio ed alla luce, comparato con quello richiesto per la crescita, è molto poco. Il contributo di carbonio auto-fissato, è al massimo il 10-15% del totale accumulo di carbonio. Probabilmente il contributo più significativo del fissaggio alla luce e al buio è conservare il carbonio ottenuto dalla respirazione per la sintesi di proteine e pigmenti durante il ripening. Il tasso respiratorio di un frutto di pomodoro varia da 0,4-0,6 mg di CO2 g/fw h in due settimane per un frutto vecchio, fino a 0,05-0,07
in un frutto mature green e poi raddoppia il suo tasso minimo durante il climaterio allo stadio arancione.
Il tasso di respirazione è legato al tasso di crescita relativo del frutto, e un alto accumulo di amido è associato con un alto tasso di crescita tra le varie cultivars (Chamley et all. 2005).
• Temperatura: Il pomodoro essendo originario delle zone tropicali, necessita di temperature moderatamente alte per completare il ciclo vegetativo e portare a completa maturazione i frutti. Pertanto la coltura è diffusa prevalentemente in climi miti temperati dove viene coltivata in pien’aria nel periodo primaverile estivo ed in serra tutto l’anno. Il pomodoro non può essere coltivato dove il periodo senza gelate è inferiore ai 4 mesi, per cui nei climi temperato freddi può essere allevato solo in serra riscaldata. I limiti termici per la coltura sono di 0-2 °C, come temperatura minima letale, mentre la minima biologica è di 7-10°C. La temperatura minima di germinazione del seme è di 12°C, con un optimum compreso tra 20-30°C; in queste condizioni l’emergenza avviene in 4-6 giorni. Le plantule sono sensibili ai danni a freddo, quelle non indurite, se esposte a 0°C per un periodo prolungato, sono facilmente danneggiate. Le temperature ottimali per la crescita della pianta sono di 22-26 °C di giorno e 13-16 °C di notte con un optimum intorno ai 21°C per la fioritura e 23°C per la maturazione. Temperature superiori ai 30-35 °C influiscono negativamente sulla allegazione e sulla sintesi di licopene, il carotene continua a formarsi, ma si arresta la produzione di licopene, facendo assumere alla bacca un colore giallo-arancione e consistenza molle; per questa ragione è molto importante aerare le serre quando al loro interno si superano i 25°C. (La Malfa 2001). Il colore della pigmentazione è fortemente influenzato dalla temperatura: la clorofilla è sempre presente quando la temperatura non supera i 10°C; durante la maturazione la clorofilla scompare e si formano carotene di colore giallo paglierino e il licopene di colore rosso. La temperatura ha effetto sull’assimilazione, cambiando il tasso di respirazione e la sintesi di amido. Durante il ripening, la temperatura inoltre influenza il tasso
di sintesi di pigmenti; l’ineguale pigmentazione del frutto potrebbe essere causata da un effetto localizzato della temperatura per esempio una insolazione diretta.
• Acqua e nutrienti: la dimensione del frutto di pomodoro è minore a seguito di uno stress idrico, a causa di un minore periodo di crescita. La dimensione del frutto può inoltre essere controllata agendo sulla conducibilità elettrica della soluzione nutriente (concentrazionesalina). Con una conduttività minore si ottengono frutti con peso maggiore. Sotto queste condizioni, si hanno effetti sull’accumulo di acqua più che sull’accumulo di materia secca. Sia la concentrazione zuccherina che l’acidità aumentano tramite una conduttività più alta nella soluzione nutriente. Il potassio conta per oltre l’85% dei cationi nei frutti di pomodoro, ed il suo accumulo è proporzionale a quello della materia secca. La relazione varia in accordo al livello di rifornimento di potassio e alle condizioni di crescita. Con un alto rifornimento di potassio si incrementa l’acidità, ed il colore e la forma del pomodoro migliorano. Con basso rifornimento di potassio il periodo di crescita del frutto di pomodoro è minore e la respirazione climaterica massima aumenta. Il metabolismo degli assimilati nel frutto è sicuramente legato alla concentrazione di potassio. L’azoto stimola l’attività vegetativa delle piante, se però il contenuto nel terreno è eccessivo si può avere un eccessivo rigoglio della vegetazione e un ritardo e una riduzione della fruttificazione, oltre ad un generale peggioramento delle caratteristiche qualitative della bacca. Il fosforo ha influenza sull’equilibrio tra fase vegetativa e riproduttiva, favorisce la formazione di tessuti più resistenti e la produzione e consistenza dei frutti . Anche il calcio pare avere un ruolo nella consistenza delle bacche, inoltre la sua carenza pare che accentui l’insorgenza di marciume apicale.
2. ANTIOSSIDANTI
2.1. Specie reattive dell’ossigeno ROS
Figura 2: radicali liberi
La percezione degli effetti del danno ossidativo dei radicali liberi sulla salute umana è recentemente cresciuto. I radicali liberi (Figura 2) sono delle molecole instabili che aumentano fisiologicamente durante il metabolismo aerobio, reagiscono velocemente con altri composti iniziando reazioni a catena. Normalmente il corpo umano può occuparsi di questi composti, ma se il loro ammontare diventa eccessivo si verifica il danno. I radicali liberi sono stati indicati come i probabili patogeni determinanti di molte malattie degenerative e croniche che si sviluppavano con l’età, tra cui, il cancro, la cataratta, le disfunzioni del sistema immunitario. Grazie al loro ruolo potenziale nella prevenzione di malattie, i composti naturali con attività antiossidante hanno guadagnato l’attenzione di ricercatori e nutrizionisti.
(Lenucci et al., 2006 ).
Nella frutta, il danno foto-ossidativo è normalmente dovuto ad una ingiuria fotodinamica del tessuto riscaldato che avviene sotto condizioni di intensa radiazione solare ed elevate temperature; questa forma di danno
foto-ossidativo, nominato “sunscald“ può causare perdite economiche nelle produzioni di pomodoro di scala industriale e non. Nel pomodoro, tale danno avviene principalmente nell’epidermide verde e nei tessuti ipodermici, sebbene i frutti mature green e breaker siano quelli più suscettibili. Lo stress foto-ossidativo nei frutti è legato alla loro maturazione, perché nel processo di ripening sono implicati processi ossidativi.
Il danno foto-ossidativo è causato dalle specie reattive dell’ossigeno (Reactive Oxigen Species, ROS), il flusso dei quali aumenta sotto stress foto-ossidativo. I ROS vengono prodotti normalmente e continuamente dalle cellule e sono altamente controllati da sistemi antiossidanti, complessi e dinamici. Le difese antiossidanti delle piante comprendono enzimi e metaboliti non enzimatici, localizzati in tessuti specifici (epidermide/ipoepidermide) e in compartimenti cellulari (cloroplasti), che funzionano in una complessa serie di pathway di ossidazione-riduzione.
Gli isoenzimi della superossido dismutasi (SOD) catalizzano la dismutazione dell’anione superossido (O2. -) producendo perossido di idrogeno (H2O2), che
viene ridotto ad acqua da altre catalasi (CAT) o ascorbato per ossidasi (APX) (Torres et al., 2006). La produzione dei ROS nelle cellule vegetali è un fenomeno normale che avviene in continuazione principalmente nei cloroplasti, nei mitocondri, e nei perossisomi. Sono composti tossici generati dalla riduzione incompleta dell’ossigeno molecolare (O2) o dalla incompleta
ossidazione dell’acqua da parte delle catene di trasferimento elettronico mitocondriale o cloroplastico.
La tossicità dell’ossigeno può essere legata all’accumulo e alla formazione dell’anione superossido (O2.-), del radicale idrossilico (OH.), perossido
d’idrogeno (H2O2) e dell’ossigeno singoletto (O2.- ) e alla capacità che queste
specie hanno di reagire con le biomolecole organiche.
I potenziali di riduzione di O2.-, H2O2 e OH. mostrano come essi siano
ossidanti molto più forti dell’O2.
Alcuni di questi composti sono responsabili per la prima linea di difesa (direttamente o indirettamente) contro eventuali attacchi di patogeni.
Sotto condizioni di stess biotico o abiotico l’incremento nei ROS porta a reazioni ossidative che causano il danneggiamento di proteine, DNA e pigmenti.
I ROS sono normalmente prodotti durante il metabolismo cellulare, ma la loro formazione può essere incrementata da particolari condizioni dell’ambiente esterno, quali ad esempio l’esposizione a radiazioni ionizzanti, l’incremento della pressione dell’ossigeno e la presenta di ossidanti. La tossicità del O2·- dipende soprattutto dalla sua interazione con il perossido di
idrogeno, che può portare alla formazione della specie più reattiva tra i radicali dell’ossigeno, il OH..
Le reazioni di formazione dei principali radicali sono:
1.Riduzione monovalente dell’ossigeno con produzione del radicale superossido:
O2 + e- → O2 •−
2. Dismutazione del superossido con formazione di acqua ossigenata: 2O2 •- + 2 H+→ H2O2 + O2
3. Riduzione dell’acqua ossigenata con formazione di radicali idrossilici: HOOH + D →•OH + OH- + D+
4.Degradazione di idroperossidi organici con generazione di radicali alcossilici:
ROOH + Me2+ → RO•+ OH- + Me3+
5.Produzione di radicali alchilici per estrazione di idrogeno da parte di
radicali •OH o per formazione di complessi fra metalli di transizione e l’ossigeno:
RH + •OH → R•+ OH
-6. Addizione di ossigeno molecolare a questi radicali alchilici con formazione di radicali perossilici:
R• + O
2→ ROO•
7.Formazione di nuovi radicali alchilici per reazioni a catena: R1H + ROO•→ R1•+ ROOH
8. In aggiunta a queste specie radicaliche e perossidiche l’ossigeno singoletto è un agente tossico di grande importanza. Può essere prodotto attraverso tre meccanismi di notevole rilevanza biologica:
a) attività fotosintetica: P + hv → P*
P* + O2→1O2 + P
b) reazione dell’acqua ossigenata con l’ipoclorito nel fagosoma di leucociti attivati:
H2O2 + OCl-→ Cl- + 1O2 + H2O
c) per interazione bimolecolare fra radicali perossidici: ROO• + •OOR → ROOOOR→1O
2 + 2RO•
Quando due radicali liberi si incontrano possono riunire in un doppietto i due elettroni spaiati formando un legame covalente e quindi un composto non radicalico. I radicali possono reagire con molecole non radicaliche trasformandole in radicali (reazioni a catena).
I radicali liberi risultano comunque estremamente importanti in alcuni processi metabolici quali, ad esempio, il metabolismo dei lipidi (biosintesi delle prostaglandine e del leucotriene negli animali) e la biosintesi della lignina nelle pareti cellulari dei vegetali.
2.2. Antiossidanti in pomodoro
Per antiossidanti si intendono quei composti che avendo un potenziale redox molto negativo si ossidano facilmente per questo motivo sono anche facilmente instabili e poco conservabili ; esse costituiscono un bersaglio preferenziale delle molecole ossidanti proteggendo quindi le cellule sia vegetali che animali da stress di tipo ossidativo, salvaguardano l’organismo dall’insorgenza di patologie ampiamente diffuse (cancro, arteriosclerosi, artrite, cataratta, diabete), grazie all’azione di detossificazione dei radicali liberi e delle forme attive dell’ossigeno. Molte sostanze antiossidanti si trovano nelle piante perché sintetizzate ad opera del metabolismo vegetale secondario, queste sono: acido ascorbico (AsA), glutatione ridotto (GSH), β-Carotene, α-Tocoferolo e composti fenolici (molti dei quali localizzati all’interno del vacuolo), ed enzimi antiossidanti come la superossido dismutasi (SOD), la catalasi (CAT) ed una varietà di perossidasi. Questi composti secondari vengono sintetizzati dalla pianta a spese di intermedi del metabolismo primario che è invece finalizzato alla crescita rifornendo di composti organici quali zuccheri, proteine e lipidi, utilizzabili dalla pianta sia come costituenti delle strutture cellulari sia come fonti energetiche. Le piante nelle quali il metabolismo secondario è particolarmente sviluppato saranno tendenzialmente più ricche in sostanze antiossidanti; le condizioni nelle quali crescono hanno riflessi importanti sulla qualità di prodotto infatti le condizioni che favoriscono l’accrescimento (disponibilità ottimale d’acqua e nutrienti , trattamenti antiparassitari) porteranno ad una grande quantità di prodotto che però potrebbe risultare qualitativamente meno ricco in componenti antiossidanti, soprattutto per quanto concerne la presenza di sostanze prodotte attraverso il metabolismo secondario. Al contrario piante che sperimentano ambienti sub-ottimali tendono a potenziare il metabolismo secondario e producono alimenti con maggiore valore nutrizionale e salutistico.
In un gran numero di studi epidemiologici che analizzavano le relazioni tra dieta e insorgenza di patologie cancerose, è stato riscontrato un effetto protettivo da parte del consumo di ortaggi e frutta nei confronti di queste patologie (Hertog et al.1997; Pietta, 2000; Duthie e Crozier, 2000). E’ da tempo oggetto di studio l’influenza dei fattori genetici, fisiologici ed agronomico-ambientali sulle proprietà antiossidanti del frutto di pomodoro. Infatti in questa specie il contenuto di antiossidanti, oltre che dalla componente varietale, dipende strettamente dalle condizioni ambientali in cui sono allevate le piante (Crozier et al.1997). Persiste infatti una ampia variabilità nei livelli di composti bioattivi presenti nei frutti di pomodoro in funzione della cultivar, delle condizioni climatiche presenti nell’ambiente di coltura e durante la “shelf-life”. E’ ben noto che in molte piante, coltivate e non, elevati livelli di energia radiante inducono la produzione di maggiori livelli di flavonoidi nei vari tessuti.
2.3. Carotenoidi
I carotenoidi sono pigmenti gialli, lipo-solubili, situati all’interno delle membrane dei cloroplasti e dei cromoplasti; appartenenti alla grande famiglia dei terpenoidi (tetraterpeni) sono importanti agenti antiossidanti e sequestratori di luce (componenti dei sistemi antenna).
Nei tessuti possono essere protetti dalle ossidazioni dalla presenza dei tocoferoli. Sono presenti praticamente in tutti i tessuti fotosintetici, nei fiori e nei frutti e nei pollini mentre nei semi si trovano solo in tracce.
Essi svolgono svariate funzioni: possono agire da ormoni vegetali, funzionare come pigmenti fotosintetici, come trasportatori di elettroni, ed essere componenti di membrana. I terpenoidi coinvolti nei meccanismi di difesa delle piante sono quelli con un peso molecolare più basso, ovvero molecole che vanno dai 10 ai 20 atomi di carbonio. I terpenoidi sono anche la base per aromi, profumi e medicinali.
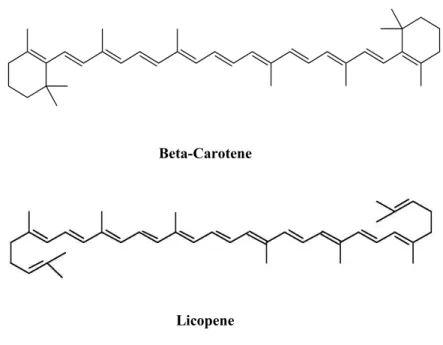
I carotenoidi possono essere sintetizzati ex novo in tutti gli organismi fotosintetici ed in molti non fotosintetici (Bartley et al., 1994). Nei tessuti verdi delle piante superiori i carotenoidi esplicano essenziali funzioni protettive bloccando la formazione di ROS anche mediante il cosidetto ciclo delle xantofille deputato alla dissipazione dell’energia in eccesso sotto forma di calore. Questo ciclo, consistente nella de-epossidazione della violaxantina a zeaxantina attraverso l’intermedio anteraxantina, è comunemente attivato in condizioni di luminosità eccessiva o in presenza di stress che riducono la capacità di utilizzo della radiazione luminosa per via fotochimica. Questi pigmenti si trovano, inoltre, nei cromoplasti come responsabili della colorazione gialla, arancione e rossa di molti fiori, frutti e radici. Carote, pomodori e verdure (spinaci, broccoli e fagiolini verdi) sono esempi di eccellenti fonti di carotenoidi, per questo importanti nella dieta umana (Tonucci et al.,1995) .I principali carotenoidi presenti nel pomodoro sono il β-carotene e il licopene (Figura 3), essi rappresentano la più importante fonte di antiossidanti nella dieta umana, il loro contenuto nel frutto è fortemente influenzato dallo stadio di maturazione ma anche da numerose altre variabili. Il licopene è un carotenoide insaturo a catena aperta presente in pochi altri vegetali, è recentemente emerso come un efficiente radical quencher, di conseguenza capace di combattere le specie reattive dell’ossigeno e di evitare le lesioni cellulari, esso a differenza del β-carotene non viene trasformato in vitamina A ma svolge indipendentemente la sua attività antiossidante . Il licopene è l’elemento che dà il colore rosso al frutto maturo e negli alimenti freschi si trova sotto forma strutturale di isomeri “trans”. L’assorbimento intestinale risulta maggiore se gli isomeri hanno forma “cis” e tale trasformazione accade con la cottura degli alimento. Il prodotto trasformato ha quindi una maggiore attività protettiva antiossidante; l’assorbimento del licopene è influenzato dall’assorbimento dei lipidi, infatti con essi i carotenoidi formano delle micelle miste che attraverso la mucosa intestinale vengono incorporati nei chilomicroni e rilasciati attraverso il sistema linfatico nel flusso sanguigno, successivamente si depositano nei tessuti ricchi di recettori per le LDL (fegato, prostata, surrene e testicoli); il
licopene svolge la sua attività antiossidante catturando l’ossigeno singoletto e riducendo la formazione di radicali liberi che rappesentano i maggiori responsabili del danno cellulare.
L’ossigeno singoletto è spento dal licopene ad una velocità almeno doppia del β-carotene. Si aggiunge alle sue proprietà antiossidanti la capacità di indurre la comunicazione cellulare , la modulazione ormonale, la stimolazione del sistema immunitario e di altre vie metaboliche, le quali possono essere responsabili di effetti benefici. Il licopene è uno dei carotenoidi più presenti nella dieta europea e del nord america, accentuando l’importanza nutrizionale di questi componenti. Si crede ad una simultanea presenza e sinergica azione di β-carotene e licopene e di altri composti antiossidanti nella prevenzione di malattie degenerative. (Lenucci et al.,2006 ).
Beta-Carotene
Licopene
Figura 3: β-carotene e licopene Biosintesi carotenoidi
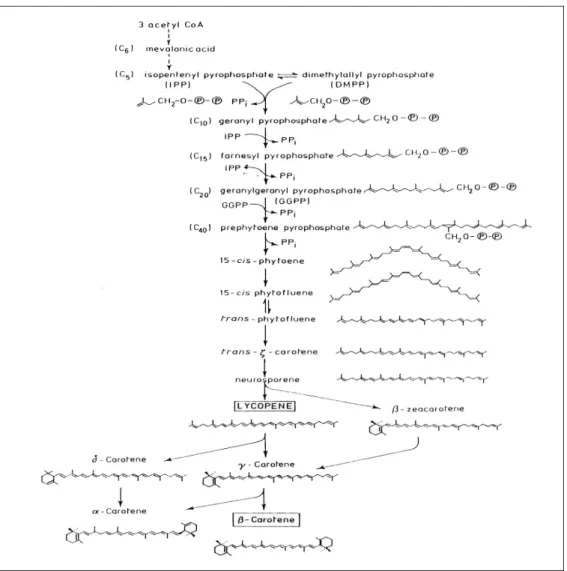
I terpenoidi si originano dalla via biosintetica dell’acido mevalonico, e l’acetil CoA rappresenta il mattone con il quale vengono costruiti ( Figura 4). Inizialmente assistiamo alla condensazione di due molecole di acetil CoA per formare l’acetoacetil CoA, azione catalizzata dall’enzima acetil CoA
acetiltrasferasi; poi viene sintetizzato un composto a sei atomi di carbonio, il (3S)-3-idrossi-3-metilglutaril-CoA (HMG-CoA), tramite l’enzima HMG-CoA sintasi.
L’HMG-CoA viene poi ridotto ad acido (3R)-mevalonico, in due tappe, con una reazione catalizzata dalla HMG-CoA reduttasi, che porta dapprima alla formazione del tioemiacetale, poi questo per perdita del CoA porta alla formazione dell’acido mevaldico, e la seconda riduzione porta alla formazione dell’acido mevalonico.
L’acido mevalonico viene trasformato in un composto a 5 atomi di carbonio, l’isopentenil pirofosfato, tramite la mevalonato chinasi e la fosfomevalonato chinasi.
La decarbossilazione del mevalonato-5-pirofosfato, che richiede ATP e metalli bivalenti, è catalizzata dalla pirofosfatomevalonato decarbossilasi. Si forma un’olefina, l’isopentenil pirofosfato (IPP), e viene persa una molecola di CO2 e una funzione ossidrilica.
L’IPP viene considerato l’elemento di base per la costruzione di tutti gli altri terpenoidi, infatti viene isomerizzato dalla IPP isomerasi, con la formazione del dimetilallil pirofosfato (DMAPP).
L’enzima isoprene sintasi catalizza l’eliminazione del gruppo di fosfato del DMAPP per formare l’isoprene, un composto volatile.
Gli enzimi prenilttrasferasi catalizzano poi la condensazione di una molecola di isopentenil pirofosfato con un pirofosfato allilico, in modo che si possa giungere ad una molecola con 5 atomi di carbonio in più di quella di origine.
Per esempio, la preniltrasferasi GPP sintasi catalizza la condensazione dell’IPP con il DMAPP, per formare il geranil pirofosfato (GPP), una molecola a dieci atomi di carbonio,da cui hanno origine tutti i monoterpeni. La più importante trasformazione è rappresentata da una ciclizzazione dell’anello, catalizzata da enzimi definiti ciclasi, e che porta ad una gran varietà di molecole. Dalla condensazione di una molecola di IPP con una di GPP, reazione catalizzata dalla farnesil pirofosfato sintasi, si ottiene una molecola di farnesil pirofosfato (FPP). Anche l’FPP può andare in contro a reazioni di ciclizzazione; la condensazione di due molecole di FPP invece può portare alla
formazione di una molecola a trenta atomi di carbonio, lo squalene; tale reazione è catalizzata dalla squalene sintasi, enzima che può catalizzare anche l’eliminazione del residuo pirofosforico dal presqualene pirofosfato. La condensazione di una molecola di FPP con una di IPP,che viene catalizzata dall’enzima GGPP sintasi, può dare luogo ad una molecola di GGPP (geranilgeranil pirofosfato).
Dalla condensazione di due molecole di GGPP si ottengono si ottengono i tetraterpeni, composti formati da 8 unità isopreniche (40 atomi di carbonio). L’enzima fitoene sintasi (PSY) catalizza la condensazione di due molecole di GGPP e porta alla formazione di prefitoene pirofosfato (PPPP) e successivamente di fitoene, per distacco del gruppo pirofosforico in C-1. Tale composto è incolore, e con successive desaturazioni può essere convertito in carotenoidi colorati, che presentano doppi legami coniugati.
Dopo 4 desaturazioni si forma il pigmento rosso licopene, mentre prima si formano fitofluene (incolore),ζ-carotene (giallo) e neurosporene (arancio). Sul licopene, con la presenza del FAD, agisce la licopene ciclasi, portando alla formazione di β-carotene.
Le xantofille sono idrossi,spossi,furanossi e ossi derivati carotenoidici. Per ossidazione degli anelli iononici in posizione 3 e 3’ si fomano le prime xantofille, tra cui la zeaxantina; un’ulteriore epossidazione nelle posizioni 5,6 e 5’,6’ porta alla formazione di xantofille quali la violaxantina. In questa ultima reazione, l’epossidazione può avvenire in presenza di luce e può portare alla interconversione della violaxantina nella zeaxantina, e viceversa.
Figura 4: Rappresentazione della via biosintetica dei carotenoidi
2.4. Flavonoidi
Recentemente è aumentata l’attenzione verso le funzioni nutrizionali e salutistiche dei polifenoli vegetali, in particolare dei flavonoidi (Hertog et
al., 1993). I flavonoidi (Figura 5) costituiscono una grande classe di
composti ubiquitari nelle piante che hanno in comune la struttura base del 2-fenil-benzopirone.
conferiscono loro proprietà antiossidanti. Questi polifenoli vegetali possono funzionare da agenti riducenti, da antiossidanti, donatori di idrogeno, grazie al loro potenziale redox e da chelanti di metalli.
I flavonoidi formano una larga famiglia di composti polifenolici a basso peso molecolare i quali si trovano naturalmente nei tessuti delle piante e includono i flavonoli, flavoni, flavanoni, catechine, antocianine, isoflavonoidi, diidroflavonoli e stilbeni. A oggi sono stati descritti più di 4000 flavonoidi, essi si trovano naturalmente in frutta e vegetali, semi, fiori e perciò fanno parte della nostra dieta (Verhoeyen et al., 2001).
Figura 5: Struttura base dei flavonoidi
Funzioni dei flavonoidi nei vegetali
La funzione fondamentale di questo gruppo di sostanze naturali presenti quasi esclusivamente nelle piante superiori, è quella di impartire una colorazione ai fiori, ma anche ai frutti e talora alle foglie. Molti flavonoidi hanno una colorazione gialla o giallastra, che rende ragione del loro nome (dal latino flavus, giallo). Oltre a determinare tali bellissime pigmentazioni, i flavonoidi hanno un ruolo chiave anche nel complesso sistema di segnali tra piante e microbi, nella fertilità maschile di alcune specie, come deterrenti per la predazione e nella difesa come agenti antimicrobici. Il ruolo svolto dai flavonoidi nella protezione della pianta nei confronti di attacchi microbici vede coinvolta non solo la loro presenza come agenti costitutivi, ma anche il loro accumulo con funzione di fitoalessine (Hartborne e Williams, 2000).
I flavonoidi, soprattutto gli isoflavonoidi e i flavanoni hanno inoltre la capacità di inibire la germinazione delle spore dei patogeni fungini delle piante. Un’altra azione legata alle caratteristiche del loro spettro di assorbimento può anche essere quella di proteggere la foglia dalla radiazione UV, infatti, aumentando l’altitudine aumenta nelle foglie il contenuto in antocianidine. Dal momento che i primi steps della via biosintetica dei flavonoidi sono rintracciabili anche nelle briofite, si suppone che i flavoni, i flavanoni e i flavonoli abbiano avuto inizialmente il ruolo di messaggeri chimici per divenire solo in seguito filtri nei confronti delle radiazioni UV.
Come composti della dieta umana essi hanno proprietà salutari e benefiche, probabilmente dovute alle loro capacità antiossidanti antiallergica, antimutagena, antitumorale molte delle quali dimostrate nell’uomo e con effetto terapeutico o preventivo.
L’attività antiossidante dei flavonoidi è supportata dalla loro abilità in vitro di indurre sistemi enzimatici protettivi ed effetti preventivi contro malattie cardiovascolari, cancro e malattie legate all’età come la demenza. Pochi studi sono stati fatti in vivo, solo uno studio sulla quercitina ha riportato la sua capacità ad abbassare la pressione sanguigna e ad inibire l’ossidazione delle proteine liposolubili a bassa densità. L’interesse per i flavonoidi ha condotto a ritenere il pomodoro un eccellente candidato, esso è molto coltivato e contiene modesti livelli di flavonoidi nella buccia (Verhoeyen et al., 2001).
I livelli di flavonoidi come di altri composti antiossidanti nel frutto di pomodoro non risultano fissi ma vengono influenzati da numerosi fattori, tra cui spiccano la componente varietale, le condizioni di crescita, in particolare quelle che si realizzano durante la fase di accrescimento e maturazione del frutto stesso.
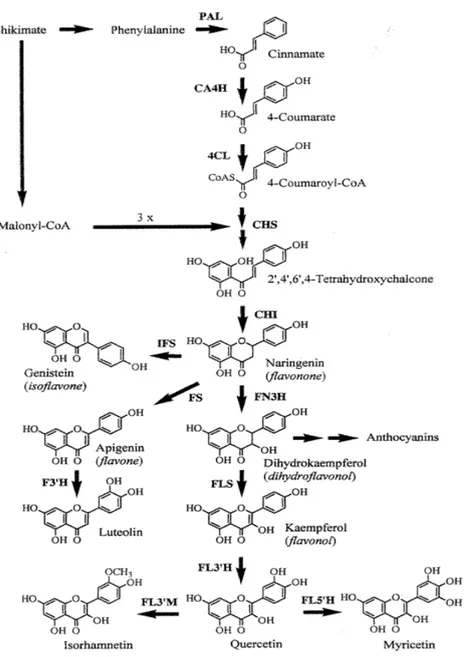
Biosintesi dei flavonoidi
La via biosintetica dei flavonoidi (Figura 6) prende le mosse dalla via dell’acido schichimico.
tiroxina e fenilalanina. L’enzima fenilalanina ammonio liasi (PAL) diammina la fenilalanina ad acido transcinnamico, che viene convertito da due ulteriori enzimi (acido-4-idrossilasi e 4-cumaril-CoA-ligasi) nel cumaril-CoA. Questo processo, denominato via del fenilpropano, fornisce l’anello B dei flavonoidi. Nella via biosintetica dei flavonoidi una molecola di cumaril-CoA è condensata dall’enzima calcone sintasi (CHS) consecutivamente con tre molecole di malonil-CoA. In questo modo si forma l’anello A dello scheletro di base del flavone.
La formazione delle strutture base per la sintesi di flavonoidi, e quindi per la chiusura dell’anello eterociclico centrale, prevede una serie di reazioni fra le quali la più conosciuta è catalizzata dall’enzima calcone isomerasi (CHI). La CHI catalizza l’isomerizzazione stereospecifica del composto 2’,4’,6’,4-tetraidrossicalcone nel composto naringenina che serve da precursore per la sintesi degli altri flavonoidi.
Figura 6: Rappresentazione schematica delle ramificazioni più importanti del percorso di
biosintesi dei flavonoidi.
2.5.
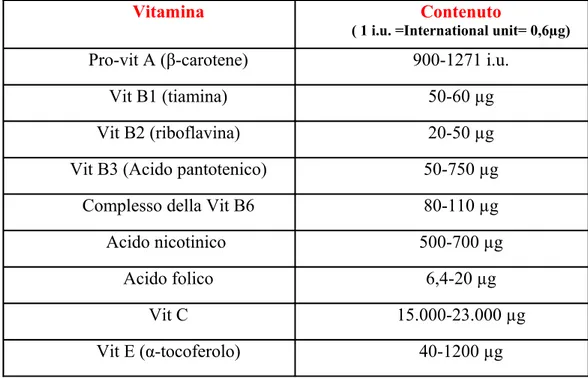
Vitamine
Il pomodoro è una importante fonte dietetica di vitamine, soprattutto A e C, i cui contenuti sono indice di qualità. Il β-carotene da origine alla vitamina A, la sua azione protettiva associata a quella della riboflavina ( vitamina B2) e della Niacina (vitamina PP) anch’esse presenti nel pomodoro, è rivolta soprattutto alla cute e alle mucose. Previene infatti l’invecchiamento cutaneo e i danni da
raggi UV ( tumori della pelle, infezioni del cavo orale) , neutralizza in parte i danni del fumo ( infatti si afferma che i fumatori bruciano vitamina A), riducendo il rischio di cancro polmonare. Protegge inoltre gli occhi e la sua carenza sarebbe imputata nell’insorgenza della cataratta. Non di minore importanza è il pomodoro come fonte di vitamina C che ha azione antiossidante in quanto funge da “scavenger (spazzino)” di radicali liberi e rigenera vitamina E dopo che questa ha neutralizzato sostanze dannose. La vitamina B1 o Tiamina protegge le membrane cellulari del sistema nervoso, cardiovascolare e digerente per la sua azione sul metabolismo glicidico. La concentrazione di vitamine nella materia prima è influenzata dalla varietà, dalle condizioni e scelte agronomiche, dalle condizioni climatiche ( esposizione al sole, coltivazione in serra o in campo), dal grado di maturazione ( è maggiore nei frutti maturi).
Vitamina Contenuto
( 1 i.u. =International unit= 0,6µg)
Pro-vit A (β-carotene) 900-1271 i.u.
Vit B1 (tiamina) 50-60 µg
Vit B2 (riboflavina) 20-50 µg
Vit B3 (Acido pantotenico) 50-750 µg
Complesso della Vit B6 80-110 µg
Acido nicotinico 500-700 µg
Acido folico 6,4-20 µg
Vit C 15.000-23.000 µg
Vit E (α-tocoferolo) 40-1200 µg
Tabella 2: Contenuto vitaminico di un pomodoro maturo ( range di valori corrispondenti a
100 gr di frutto) ( da Davies e Hobson 1981)
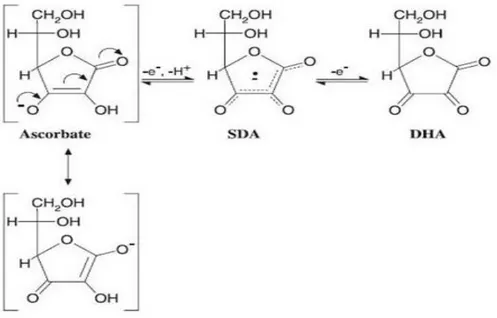
L’acido ascorbico (vitamina C) è una molecola organica idrosolubile si presenta in cristalli di sapore acidulo gradevole, solubili in acqua e in alcool, ha potere riducente per cui si ossida facilmente all’aria dando acido L-deidroascorbico (Figura 7). La sua azione biologica è legata al fatto che costituisce un sistema redox assai efficiente a causa della presenza di un gruppo riduttore. Questa vitamina resiste bene alla luce ed agli acidi mentre è scarsamente resistente al calore, agli alcoli, al tabacco, agli antistaminici, ai barbiturici, ai contraccettivi, all’aspirina, ai corticosteroidi. La Vitamina C è contenuta in tutti gli agrumi (limone, arancia, pompelmo...), fragola, kiwi, peperoni cavolo, cavolfiore, pomodoro e anche in verdure verdi a foglia come la lattuga o il radicchio. Essa stimola il metabolismo cellulare, agisce come catalizzatore nella respirazione cellulare ed è essenziale per la formazione del collagene, proteina fondamentale per mantenere elastici i tessuti cartilaginei, vasi sanguigni, ossa e denti. Collabora alla formazione delle cellule del sangue e contribuisce alla integrità dei vasi capillari. Disciplina il ricambio del ferro e ne esalta l’assorbimento. Agisce nel ricambio del calcio, magnesio e zinco. Accresce la resistenza alle malattie infettive e contribuisce al recupero da stanchezza fisica. Un’altra importante funzione è quella di contrastare la tossicità delle nitrosammine (formate dai nitriti e nitrati contenuti in alcuni alimenti industriali). Non viene accumulata dall’organismo, pertanto la colazione e i due pasti principali dovrebbero garantirne l’ apporto giornaliero costante. Una sua carenza determina una serie di sintomi come perdita di sangue dalle gengive, fragilità dei capillari, dolori articolari, perdita di appetito e debolezza generale. Un eccesso di vitamina C può indurre diarrea, aumento della diuresi, alterazione nell’ equilibrio dei minerali e calcolosi renale. Va evidenziato che sulla vitamina C sono stati efettuati molti studi e alcuni sono ancora in corso: sembra ormai accertato che essa sia in grado di prevenire l'insorgere di tumori (in particolare quelli derivati dal fumo), di avere effetti positivi nei malati di AIDS, di difendere dagli effetti dell'inquinamento. Ancora aperta è la discussione riguardo alla capacità della vitamina C di combattere il raffreddore: la cosa certa è che ne riduce i sintomi e ne abbrevia il decorso. E' importante notare che la vitamina C (più ancora di altre) è una sostanza che
viene facilmente distrutta durante la cottura, la conservazione dei cibi (anche in frigorifero), l'esposizione di questi all'aria e alla luce, inoltre il nostro organismo la elimina giornalmente attraverso le urine e il sudore, quindi mentre sono rare nei paesi occidentali le carenze gravi, può essere frequente il caso di ipovitaminosi se nell'alimentazione mancano o sono scarse frutta e verdura fresche o in seguito a particolari situazioni che rendono necessario incrementare la dose giornaliera di vitamina C (per esempio il fumo che la distrugge). La dose giornaliera consigliata oscilla tra i 45 e i 60 g ma ci sono in corso di studi sugli effetti positivi di macrodosi di vitamina C in condizioni molto particolari: persone affette da malattie mentali gravi, tossicodipendenti, persone in condizioni di stress elevato. Nelle piante è altamente abbondante e si accumula in concentrazione intracellulare di 2-25 Mm. L’acido ascorbico è conosciuto principalmente per le sue proprietà antiossidanti ma agisce anche come cofattore per vari enzimi e contribuisce alla regolazione della divisione cellulare e espansione, è essenziale per la crescita delle piante, partecipa alla resistenza allo stress e sembra controllare il tempo di fioritura e l’inizio della senescenza. L’acido ascorbico AA e la sua forma ossidata, acido deidroascorbico, possono agire come agenti segnale, partecipando all’interazione con l’ambiente, per esempio con l’ozono, patogeni e agenti ossidanti e perdita d’acqua. I benefici che si presentano dall’aumento di AA nelle piante sono profondi, comunque , ancora recentemente molti aspetti della biosintesi dell’acido ascorbico, metabolismo e funzione, rimangono irrisolti. E’ un importante micronutriente, migliora la qualità nutrizionale e la resistenza allo stress abiotico delle piante. L’ascorbato è sintetizzato da mannosio-6-fosfato, via GDP-mannosio e GDP-L-galattosio. La prima parte del pathway
fornisce precursori per la sintesi di certe cellule, muro polisaccaridico contenente mannosio, L-Gal e L-fucosio. La seconda parte del pathway è
preposta alla sintesi di ascorbato. L-Gal libero è rilasciato da GDP-L-Gal,
attraverso l’azione del GDP-L-Gal fosforilato e L-Gal-1-fosfato fosfatasi (GPP),
e poi è ossidato attraverso L-GAL deidrogenasi a formare L-galattono-l,
4-lattone. L-Galattono-1,4-lattone è ossidato ad ascorbato da L
mitocondriali. (Figura 8) (Ioannidi et al., 2009 )
Figura 7: vitamina C
3.
FOTOMORFOGENESI E FOTORECETTORI
3.1. La luce
La luce è una radiazione elettromagnetica che si propaga in linea retta nello spazio sotto forma di fotoni o quanti. L’energia radiante (identificabile con la radiazione luminosa) si esprime normalmente sotto forma di irradianza (μmol m-2 sec-1), ossia come flusso di energia che incide su una
superficie unitaria piana in un dato intervallo di tempo.
La luce è in grado di influenzare numerosi processi fisiologici attraverso stimoli direzionali e non direzionali. I primi sono responsabili di fenomeni quali il il fototropismo (crescita asimmetrica di un organismo in direzione della sorgente luminosa) e la fototassi (movimento di organismi, cellule e/o organelli cellulari regolato dalla luce). I secondi sono correlati al
nell’arco del giorno), alla fotosintesi (processo grazie al quale l’energia radiante è trasformata in energia chimica sotto forma di sostanze organiche a partire da CO2 ed H2O) ed alla fotomorfogenesi (cambiamenti
morfo-fisiologici, conseguenza della variazione della lunghezza del giorno, della notte e dell’alternanza delle stagioni ,conseguenza di quei caratteri che distinguono la luce, lunghezza d’onda, frequenza e flusso di fotoni).
Le piante utilizzano quindi la luce come fonte di energia oppure come sorgente di segnali (in termini di intensità, qualità e durata), modulando il loro sviluppo in base alle informazioni che ricevono. La luce può quindi determinare l’attitudine di un seme a germinare, l’angolo di crescita del germoglio, la velocità di allungamento del fusto, l’espansione fogliare o il momento della fioritura.
3.2. Lo spettro solare ed UV-B
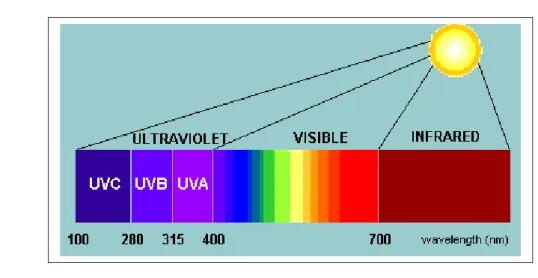
Figura 8: spettro solare
Luce visibile : La luce visibile è una radiazione non ionizzante ed è molto
solare (400-700 nm) e la usa per assimilare il diossido di carbonio nelle molecole organiche, saccarosio o amido, che sono i substrati per la respirazione. La luce guida il trasporto di elettroni e i processi struttura-dipendenti. I pigmenti vengono raggruppati in unità funzionali con centri di conversione fotochimica e altri catalizzatori sono collocati in membrane legate a sacchi appiattiti (tilacoidi). Nelle piante superiori, queste strutture sono concentrate in organelli speciali, i cloroplasti.
Luce UV: La radiazione ultravioletta è una radiazione elettromagnetica non
ionizzante, con lunghezze d’onda leggermente inferiori a quelle percepite dall’occhio umano. Dato che i fotoni delle radiazioni hanno livelli energetici tanto più elevati quanto minore è la lunghezza d’onda, le radiazioni UV sono particolarmente efficaci nel provocare reazioni fotochimiche, e ciò vale anche per i sistemi biologici. La luce UV può essere divisa in tre parti, UV-A (315-400 nm), UV-B (280-315 nm) e UV-C (sotto i 280 nm). Uno dei fattori di rischio più critici per l’avvio e lo sviluppo di diverse malattie della pelle è l'esposizione ai raggi solari UV. La radiazione solare UV sulla superficie della Terra comprende circa 90-99% dei raggi UVA e 1-10% degli UVB. La lunghezza d’onda media della luce UVB è ampiamente assorbito (95%) nello strato protettivo di ozono. Per questo motivo la riduzione di quest’ultimo sta diventando un grave problema. In generale ogni riduzione di ozono dell’1% causa un incremento di 1,3-1,8 % delle radiazioni UV-B che raggiungono la biosfera. La formazione di eritema (arrossamento), accompagnato con la formazione di cellule scottate, ed edema (gonfiore) è tipica dell’esposizione UVB. Il DNA con le sue basi eterocicliche è un cromoforo che assorbe la luce UVB con conseguente rottura dello stesso, e formazione di dimeri di cyclobutanepyrimidine e pirimidina-pyrimidone. Fotoni UVB interagiscono anche direttamente con gli amminoacidi aromatici, tirosina e triptofano principalmente, e la loro modifica può alterare la funzione della proteina. (Svobodova et al.,2009). Gli UVB inoltre possono provocare danno biologico indiretto tramite la produzione di specie reattive dell'ossigeno (ROS). In organismi aerobici sani, la produzione di ROS e di altri radicali liberi come RNS (specie reattive dell’azoto) è equilibrata da sistemi antiossidanti di difesa,