64 Capitolo 4
Risultati e discussione
4.1 Profili di espressione ottenuti con RT-PCR di possibili target
implicati nell’azione dei cannabinoidi
L’estrazione dell’RNA totale dalle cellule è stata eseguita secondo la procedura descritta nella sezione “Materiali e Metodi”. I campioni di RNA ottenuti sono stati analizzati mediante spettrofotometro NanoDrop. I risultati dell’analisi hanno mostrato un rapporto A260/A280 compreso tra 1,8 e 2,0 per tutti i campioni, indice di un buon grado di purezza dell’RNA estratto. Per quanto riguarda la stima della concentrazione, i valori sono espressi come rapporto μg/μl e rientrano nei range indicati nel manuale del kit fornito da Qiagen.
Successivamente all’analisi quali-quantitativa, l’RNA è stato valutato tramite elettroforesi, al fine di verificarne l’integrità.
L’RNA totale (1μg) è stato poi retrotrascritto, al fine di ottenere cDNA da utilizzare nelle reazioni di PCR.
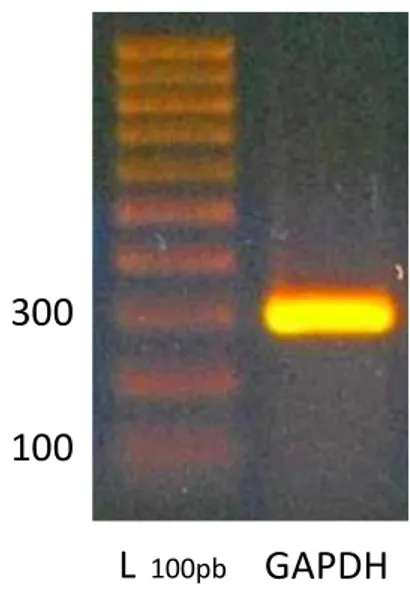
Per verificare l’efficacia dell’esecuzione del protocollo di retrotrascrizione, è stata eseguita una PCR iniziale con primer specifici per la GAPDH. Il gene della GAPDH è un gene costitutivo, definito anche housekeeping, in quanto, codificando per proteine ed enzimi fondamentali per la vita della cellula, è sempre presente ed espresso in misura simile nei diversi organi e tessuti di un organismo. Le condizioni di PCR per l’amplificazione con primer relativi alla GAPDH sono state perciò ottimizzate in modo da ottenere una sola banda elettroforetica
65
delle dimensioni molecolari attese (vedi Tabella 7) ed evitare la formazione di amplificati aspecifici. Nei diversi campioni, le bande relative alla GAPDH hanno esibito una stessa intensità, come è ragionevole aspettarsi dallo studio di espressione di un gene costitutivo.
Figura 18. Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi alla
GAPDH.
Una volta verificata la corretta esecuzione del protocollo di retrotrascrizione, è stato possibile procedere con l’indagine dell’eventuale espressione dei geni per i recettori cannabinoidi e di altri possibili target per i composti cannabinoidi.
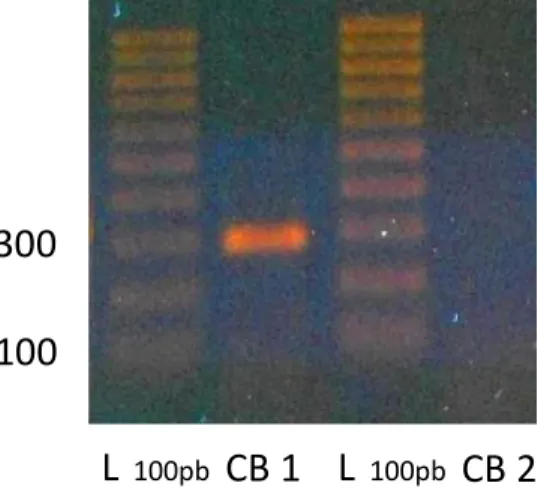
Nella sezione “Materiali e Metodi”, la Tabella 7 indica i protocolli utilizzati per le PCR eseguite e la lunghezza degli amplificati ottenuti. L’espressione dei recettori CB1 e CB2 è stata indagata utilizzando, in entrambi i casi, un protocollo di amplificazione che prevede l’impiego di un gradiente di temperatura per la ricerca della T di annealing ottimale per le coppie di primer scelti. Per il CB1, delle otto temperature testate, la
L 100pb GAPDH
100 300
66
T di annealing che ha dato la banda attesa, priva di aspecifico, è risultata 59,7°C. Per il CB2, nessuna delle temperature ha dato bande ad altezza attesa. In questo caso, per verificare la corretta scelta del protocollo di amplificazione utilizzato, è stata eseguita una PCR su cDNA ottenuto da cellule leucemiche Jurkat, che rappresentano un controllo positivo di espressione per il CB2. Il protocollo è stato applicato tale e quale su cDNA di A375 e, anche dopo riamplificazione, non è stata osservata nessuna banda relativa al CB2.
Figura 19. Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi ai
recettori CB1 e CB2.
È stata in seguito verificata la presenza di altri due recettori, descritti come possibili target di composti cannabinoidi: il TRPV1, attivato da anandamide e composti strutturalmente simili, e il GPR55, indicato come target di sostanze quali AM251 e SR141716A, oltre che bersaglio degli endocannabinoidi [Oesch S. and Gertsch J., 2009]. Anche in questo caso, sono stati testati dei protocolli di PCR che utilizzano gradienti di Ta, per la ricerca della Ta migliore. Per il GPR55, tutte le temperature del gradiente hanno dato bande ad altezza attesa, con la banda più intesa a 55°C. Per il TRPV1, la temperatura di annealing ottimale è risultata 69,7°C.
300 100
CB 1 CB 2
67
Figura 20. Elettroforesi su gel di agarosio per il prodotto di PCR con primer relativi al GPR55
e al TRPV1.
Sono stati, inoltre, valutati due recettori appartenenti alla famiglia PPAR: PPARα e PPARγ. Per entrambi, l’amplificazione non ha dato nessun tipo di banda elettroforetica ad altezza attesa. È stata effettuata una riamplificazione del prodotto PCR, mantenendo lo stesso protocollo, per confermare l’assenza dei due recettori nucleari. Nessuna banda è risultata visibile dopo corsa elettroforetica dei campioni ottenuti in seguito a riamplificazione, escludendo perciò sia il PPARα sia il PPARγ dai possibili target presenti nella linea cellulare in studio.
300 100 GPR55 TRPV1 L 100pb L 100pb 100 400
68
Figura 21. Elettroforesi su gel di agarosio dell’amplificato ottenuto con primer per PPARα e
PPARγ.
Successivamente, è stata valutata l’espressione delle ciclossigenasi, che catalizzano la conversione dell’acido arachidonico in prostaglandine: la COX-1, enzima costitutivamente espresso, e la COX-2, enzima inducibile. Per entrambe le coppie di primer utilizzate, è stata ottenuta una singola banda elettroforetica delle dimensioni molecolari attese.
Figura 22. Elettroforesi su gel di agarosio per il prodotto di PCR per l'amplificazione della
COX-1 e della COX-2.
In ultimo, è stata indagata l’espressione del recettore adenosinico A1, data l’evidenza presente in letteratura della possibile interazione del
L 100pb PPARα L 100pb PPARγ L 100pb L 100pb COX-1 COX-2 100 400 400 100
69
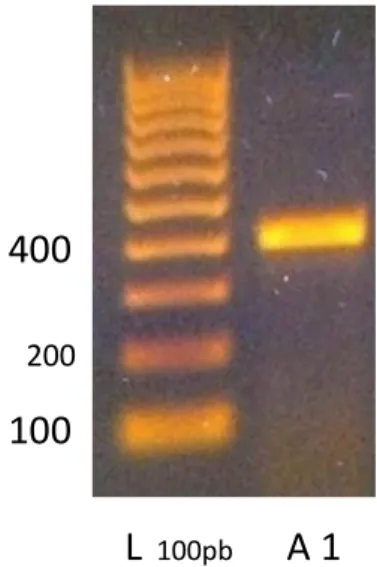
composto AM251 con questo recettore [Pertwee R.G., 2010], verso il quale si comporterebbe da antagonista; tale indagine è stata condotta utilizzando primer che amplificano le due varianti della proteina e disegnati per dare origine a prodotti di lunghezza diversa. Le PCR sono state inoltre condotte in gradiente di temperatura per la fase di annealing, non essendo conosciuta la T ottimale. La variante 1 del recettore è risultata essere espressa sulla linea cellulare, portando alla visualizzazione di una banda elettroforetica singola ad altezza attesa. Non è stata invece riscontrata la presenza della banda relativa alla variante 2 dell’A1, nemmeno dopo riamplificazione.
Figura 23. Elettroforesi su gel di agarosio per il prodotto di PCR ottenuto con primer relativi
al recettore A1.
L 100pb A 1
100 400 200
70
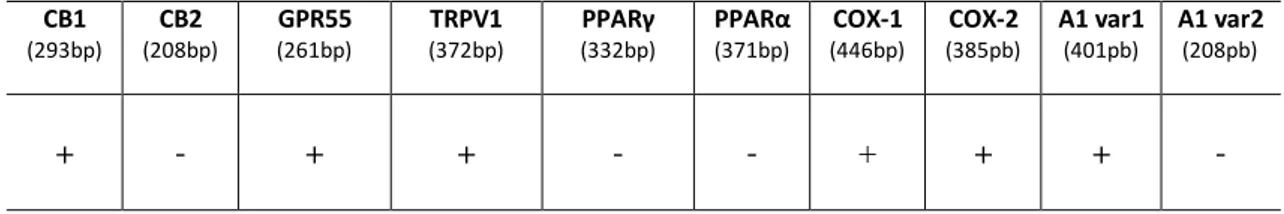
I profili di espressione dei possibili target dei cannabinoidi, risultati dalle RT-PCR condotte sul cDNA delle cellule A375, sono riassunti nella tabella seguente: CB1 (293bp) CB2 (208bp) GPR55 (261bp) TRPV1 (372bp) PPARγ (332bp) PPARα (371bp) COX-1 (446bp) COX-2 (385pb) A1 var1 (401pb) A1 var2 (208pb) + - + + - - + + + -
Tabella 9. Profilo di espressione qualitativa di target valutati tramite RT-PCR. Simboli: + :
71
4.2 Valutazione dell’attività antiproliferativa di AEA e 2-AG
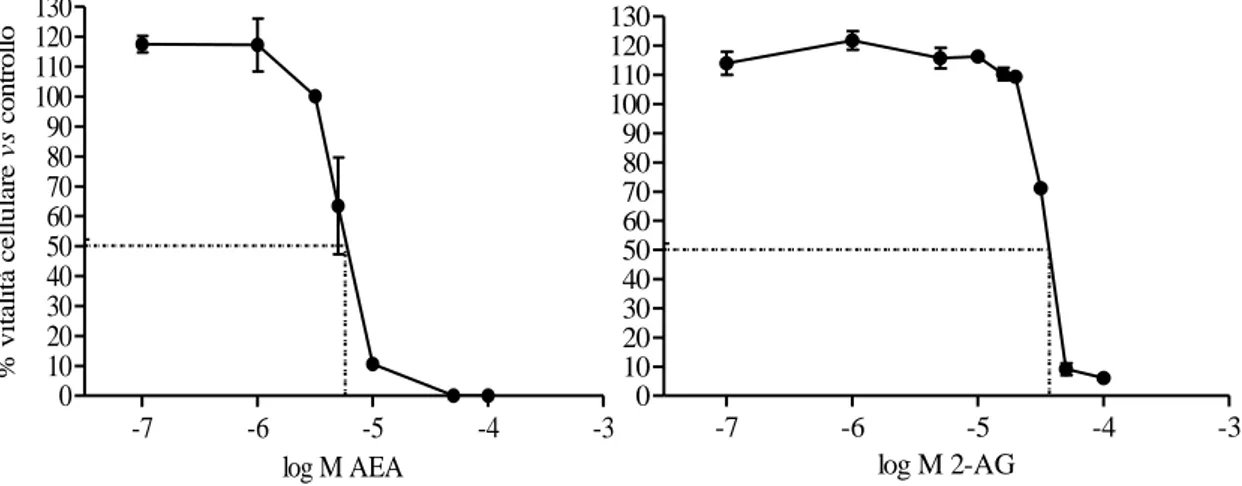
Gli endocannabinoidi anandamide e 2-arachidonoilglicerolo sono stati testati in un range di concentrazione tra 0,1 e 100μM per 48 ore di esposizione sulla linea cellulare umana di melanoma cutaneo, A375. I risultati hanno mostrato che entrambi gli endocannabinoidi sono in grado di ridurre la proliferazione cellulare in modo concentrazione-dipendente. I valori di IC50 calcolati dalle curve dose-effetto hanno, però, evidenziato un differente profilo antiproliferativo tra i due composti: l’anandamide, infatti, risulta essere il composto più attivo, con un IC50 pari a 5,6μM, rispetto al 2-AG, la cui IC50 è di 35,64μM.
Figura 24. Riduzione della vitalità cellulare della linea A375, dopo trattamento con AEA
(sinistra) e 2-AG (destra), in un range di concentrazione 0,1-100 μM, dopo 48h di esposizione, DMEM+1% di siero.
Le diverse IC50 possono essere spiegate in base ai differenti target che i due endocannabinoidi riconoscono. AEA e 2-AG sono descritti come agonisti non selettivi CB1/CB2, un profilo che comporta un’azione antiproliferativa esercitata, sulla nostra linea cellulare, presumibilmente via CB1, per l’assenza di espressione del CB2. Entrambi sono stati
-7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 log M 2-AG -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 log M AEA % v it a li tà c e ll u la re vs c o n tr o ll o
72
indicati, inoltre, come agonisti GPR55 [Sharir H. and Abood M.E., 2010]; la loro attività intrinseca su tale recettore, tuttavia, non è chiara. L’assenza attuale di un profilo farmacologico chiaro per questo recettore rende difficile la formulazione di ipotesi ben fondate. Anche il ruolo nella proliferazione cellulare, da più studi indicato come facilitante, sembra essere smentito da una recente evidenza che indica come l’anandamide sia in grado di produrre inibizione della crescita del colangiocarcinoma tramite attivazione del GPR55.
La presenza sulla linea cellulare utilizzata di ulteriori recettori responsabili dell’effetto di inibizione dell’attività cellulare può ragionevolmente portare ad ipotizzare che nell’azione dell’AEA possano essere coinvolti altri target oltre a quelli sopra citati.
L’AEA infatti può agire da agonista sul recettore canale TRPV1, la cui attivazione può dare inibizione della proliferazione cellulare [Pertwee R.G., 2010]. Dati in letteratura indicano una diversa affinità del 2-AG e dell’AEA verso questo recettore, riconoscendo solo all’AEA la capacità di attivare il TRPV1 [Oláh M. et al., 2008]. Per verificare se l’azione dell’AEA sul recettore vanilloide potesse essere alla base dell’inibizione della proliferazione osservata, è stato testato un agonista VR1selettivo, la caspaicina, che, attivando il recettore, dovrebbe indurre morte cellulare. Per il trattamento sono state utilizzate soluzioni con concentrazioni comprese tra 0,1-100μM. Il tempo di esposizione è stato mantenuto, come negli esperimenti precedenti, di 48 ore.
73
Figura 25. Riduzione della vitalità sulla linea cellulare A375, inseguito a trattamento con
capsaicina, 48 ore di esposizione, 1% FBS.
Il risultato ottenuto permette di supporre che l’attivazione del TPRV1, causata dall’AEA, non incida in modo significativo nella determinazione dell’effetto antiproliferativo dell’endocannabinoide.
È stato recentemente dimostrato su cellule di tumore cutaneo (linea JWF2 di carcinoma squamoso), che l’AEA, in seguito all’azione COX-2 mediata, viene metabolizzata dando origine a prostaglandine citotossiche, che risultano essere le principali responsabili dell’effetto antitumorale dell’endocannabinoide [Van Dross R.T., 2009].
Figura 26. Rappresentazione schematica del ruolo del FAAH, MAGL e COX-2 sul
metabolismo di AEA, 2-AG e altri endocannabinoidi [Fowler C.J., 2007].
-7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 concentrazioni CAPSAICINA: 100, 50, 25, 10, 5, 3, 1, 0.1 log M CAPSAICINA % v it a li tà c e ll u la re vs co n tr o ll o
74
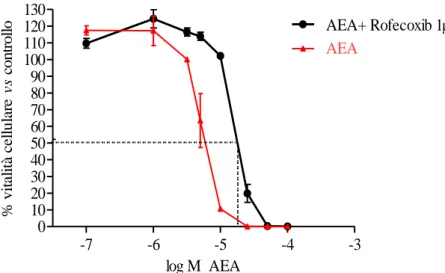
Per verificare il ruolo di derivati COX-2 dell’AEA, è stato testato un inibitore selettivo della COX-2 (Rofecoxib) a concentrazione fissa 1μM (ovvero una concentrazione che consente l’inibizione delle COX-2), in presenza di concentrazioni variabili di AEA (range 0,1-100μM). L’esperimento è stato condotto per un tempo di esposizione di 48 ore.
Figura 27. Riduzione della vitalità cellulare della linea A375, dopo trattamento con AEA, a
concentrazioni variabili 100μM), e Rofecoxib (1μM). In rosso: curva dell'AEA (0,1-100μM). In nero: curva AEA+ Rofecoxib.
I nostri dati sperimentali hanno confermato un’inibizione della vitalità cellulare causata dall’anandamide anche nell’associazione con il Rofecoxib; è possibile, tuttavia, registrare, a conferma della nostra ipotesi di coinvolgimento della COX-2 nell’effetto dell’AEA, un aumento dell’IC50 dell’endocannabinoide in seguito a blocco dell’enzima (da un IC50 di 5,6μM per l’AEA testata singolarmente, si passa a un IC50 di 22,58μM nell’associazione). -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 25M, 10M, 5M, 3M, 1M, 0,1M AEA+ Rofecoxib 1M AEA log M AEA % v it a li tà c e ll u la re vs co n tr o ll o
75
4.3 Valutazione dell’attività antiproliferativa di ACEA e Met-AEA
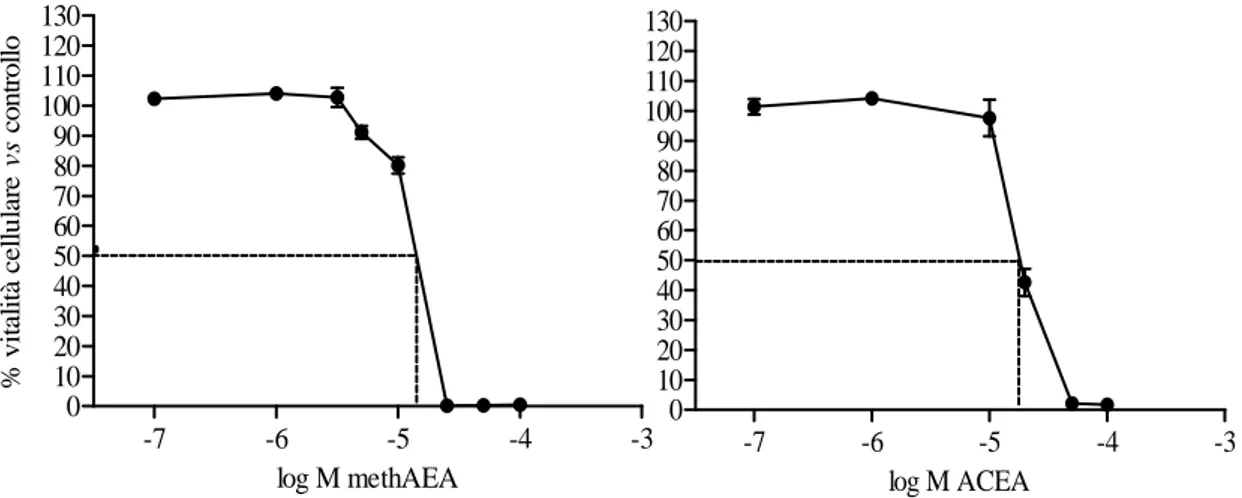
Per valutare l’entità dell’effetto dovuto all’agonismo CB1, sono stati testati due agonisti selettivi per tale recettore, ACEA e metanandamide, quest’ultimo analogo stabile, non soggetto a metabolismo FAAH, dell’anandamide.
Figura 28. Riduzione della vitalità cellulare sulla linea A375, dopo trattamento con Met-AEA
(sinistra) e ACEA (destra) nel range di concentrazione 0,1-100μM, 48h di esposizione.
Entrambi i composti inducono un’inibizione della vitalità cellulare dose-dipendente, con IC50 pari a 12,62μM per la metanandamide e 18,9μM l’ACEA. Il dato della metanandamide, confrontato con quello dell’anandamide, può far ipotizzare una minore suscettibilità della prima al metabolismo da parte della COX-2 e/o una minore affinità per i recettori diversi dal CB1, con cui l’endocannabinoide interagisce.
-7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 25M, 10M, 5M, 3M, 1M, 0,1M log M methAEA % v it a li tà c e ll u la re vs co n tr o ll o -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 20M, 10M, 1M, 0,1M 48h exp 1% FBS log M ACEA
76 4.4 Valutazione dell’azione del JWH133
Gli studi di biologia molecolare hanno evidenziato la mancanza dell’espressione nella linea cellulare utilizzata del recettore CB2. A conferma di questo dato, gli studi di vitalità, condotti in presenza di un agonista CB2-selettivo, hanno mostrato l’assenza di un profilo funzionale.
Figura 29. Riduzione della vitalità cellulare della linea A375, dopo trattamento con JWH133
(0,1-100μM), 48 ore di esposizione, 1% FBS. -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 10M, 5M, 1M, 0,1M log M JWH133 % v it al it à ce ll u la re vs co n tr o ll o
77
4.5 Valutazione dell’attività antiproliferativa del composto AM251
L’AM251 ha prodotto un’inibizione della crescita cellulare concentrazione dipendente con un IC50 di 6,32μM.
Figura 30. Riduzione della vitalità cellulare della linea A375, dopo trattamento con AM251
nel range di concentrazione 0,1-50 μM, per 48 ore di esposizione, 1% di FBS.
Oltre alla ben nota azione di antagonista CB1, l’AM251 ha mostrato di interagire anche con altri target; in particolare, è stato descritto come agonista GPR55, anche se il dato, ad oggi, rimane controverso [Oka S. et al., 2007].
Poiché differenti evidenze sperimentali suggeriscono una capacità pro-proliferativa su cellule tumorali da parte del lisofosfatidilinositolo (LPI) endogeno via GPR55, abbiamo ipotizzato che nel nostro modello sperimentale, le cellule fossero stimolate dal LPI in maniera massimale, e che l’AM251 potesse essere un agonista parziale di questo recettore, divenendo capace di dare origine ad un antagonismo funzionale nei confronti del mediatore endogeno.
-7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 50M, 30M, 20M, 15M, 10M, 5M, 3M, 1M, 0,1M log M AM 251 % v it a li tà c e ll u la re vs co n tr o ll o
78
Per verificare l’ipotesi dell’AM251 come agonista parziale del GPR55, è stato indagato l’effetto del composto in presenza di un inibitore della formazione di LPI, ovvero dell’AACOCF3, un inibitore specifico della fosfolipasi A2. L’esperimento è stato condotto a 48 e 72 ore di esposizione.
Figura 31. Riduzione della vitalità cellulare sulla linea A375, dopo trattamento con AACOCF3,
nel range di concentrazioni 0,1-100μM, con tempi di esposizione di 48h (sinistra) e 72h (destra), in presenza dell'1% di FBS.
In presenza di una concentrazione inibitoria del 50% sulla vitalità cellulare dell’AACOCF3 è stato osservato non a 48 ore, ma ad un tempo maggiore, 72 ore (Figura 32), un effetto pro-proliferativo dell’AM251, tendente ad invertire l’azione dell’AACOCF3. Questo effetto si pone in linea con un probabile ruolo dell’LPI endogeno nella proliferazione delle cellule di melanoma; la riduzione/eliminazione dell’effetto dell’LPI smaschererebbe l’attività agonista GPR55 dell’AM251. La latenza con cui si osserva (>48 ore) potrebbe derivare dal tempo di emivita dell’LPI.
-7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 30M, 15M, 10M, 5M, 1M, 0,1M 48h exp 1% FBS log M AACOCF3 % v it al it à ce ll u la re vs co nt ro llo -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 30M, 15M, 10M, 5M, 1M,0,1M 72h exp 1% FBS log M AACOCF3 48h exp 1% FBS 72h exp 1% FBS
79
Figura 32. Effetto sulla vitalità cellulare della contemporanea somministrazione di AACOCF3
e AM251. A) Effetto sulla vitalità dopo 48h di esposizione, 1%FBS. B) Effetto sulla vitalità dopo 72h di esposizione, 1% FBS. Vei colo M AA CO CF3 11 M + A M2 51 0 .1 M + A M2 51 1 M + A M2 51 3 M + A M2 51 5 M + A M2 51 10 M + A M2 51 15 M + A M2 51 20 M + A M2 51 30 0 25 50 75 100 V it al it à c el lu la re ( % vs co n tr o ll o )
WST-1 AACOCF3 10M + AM251 0.1-50M 1% FBS 60 h exp. su MEWO 15.09.2011
Vei colo M AA CO CF3 11 M + A M2 51 0 .1 M + A M251 1 M + A M2 51 3 M + A M251 5 M + A M251 10 M + A M251 15 M + A M2 51 20 M + A M2 51 30 0 25 50 75 100 V it al it à c el lu la re ( % vs co n tr o ll o ) A B 48h exp 1% FBS 72h exp 1% FBS
80
Successivi esperimenti verranno condotti per validare l’ipotesi formulata sull’azione dell’AM251, primo fra tutti il silenziamento del gene per il GPR55, in modo da valutare il coinvolgimento effettivo di tale recettore nella risposta al composto.
81
4.6 Valutazione del coinvolgimento COX-2 nell’azione dell’AM251
L’effetto di inibizione della proliferazione cellulare da parte dell’AM251 è stato precedentemente descritto nel nostro laboratorio, sulla linea cellulare MiaPaCa 2 [Fogli S. et al., 2006]. In questo studio l’AM251 mostrava la capacità di indurre apoptosi nella linea tumorale utilizzata, in modo CB-indipendente. Un coinvolgimento dell’inibizione COX-2, suggerita dalla forte somiglianza strutturale dell’AM251 con il COX-2 inibitore selettivo, celecoxib, veniva escluso per l’assenza di espressione delle cellule MiaPaCa 2.
Nelle cellule di melanoma utilizzate nel presente studio, invece, si è potuta osservare l’espressione, a livello di mRNA, della COX-2. Sono stati testati, dunque, due inibitori selettivi dell’enzima, il celecoxib, di cui sopra, e il rofecoxib. Un ulteriore esperimento è stato condotto con indometacina, inibitore non selettivo COX-1/COX-2, al fine di escludere anche il coinvolgimento dell’isoforma COX-1.
82
Figura 33. Effetto sulla vitalità cellulare di composti COX-inibitori, dopo 48h di esposizione,
1% FBS. A) Riduzione della vitalità cellulare dopo somministrazione di celecoxib, range di concentrazione 0,1-150μM. B) Effetto sulla vitalità cellulare dopo somministrazione di rofecoxib, 0,1-100μM. C) Effetto sulla vitalità cellulare dopo somministrazione di indometacina, 0,1-100μM.
In seguito a somministrazione di rofecoxib ed indometacina non è stata osservata alcuna variazione della vitalità cellulare, nemmeno alle più alte concentrazioni testate. Questo dato suggerisce che nessuna della due isoforme COX è responsabile, neppure parzialmente, dell’effetto antiproliferativo osservato con l’AM251. Il trattamento con celecoxib, invece, ha portato ad una riduzione della proliferazione, con un IC50 del farmaco pari a 44,25μM. A B C -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 IC50= 44.25M 150M, 100M, 50M, 25M, 10M, 1M, 0,1M log M CELECOXIB % v it al it à ce ll u la re vs co nt ro llo -7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 150M, 100M, 50M, 25M, 10M, 1M, 0.1M log M ROFECOXIB % v it a li tà c e ll u la re vs co n tr o ll o
WST-1 INDOMETACINA A375 48h exp 1%FBS 12.09.2011
-7 -6 -5 -4 -3 0 10 20 30 40 50 60 70 80 90 100 110 120 130 100M, 50M, 30M, 15M, 10M, 5M, 1M, 0,1M log M INDOMETACINA
83
I nostri dati sono in accordo, dunque, oltre che con i risultati precedentemente ottenuti su cellule tumorali pancreatiche, anche con un recente studio condotto su linee di melanoma, descrivente un meccanismo antiproliferativo del celecoxib del tutto indipendente dalle COX-2 [Bundscherer A. et al., 2008]. Sulla base di quanto detto sopra e dei risultati ottenuti con gli studi di vitalità effettuati è ragionevole supporre la presenza di un target comune tra celecoxib e AM251 responsabile, almeno in parte, dell’effetto antiproliferativo di entrambi. Ulteriori indagini verranno svolte per la ricerca di questo possibile target.
84
4.7 Valutazione dell’attività antiproliferativa dell’AM251 via A1
Studi condotti su cervello di ratto hanno dimostrato un’affinità dell’AM251 per il recettore adenosinico A1, verso il quale il composto si comporterebbe da antagonista con un IC50 di 10μM. L’andamento della curva dose-effetto dell’AM251 suggerisce la presenza di più target attraverso cui il diarilpirazolo può agire. Dopo aver valutato l’espressione del recettore A1 sulla linea A375, è stato testato il composto rolofillina, antagonista selettivo per tale recettore, in modo da valutarne il possibile ruolo antiproliferativo nelle cellule in studio.
Il trattamento è stato effettuato in un range di concentrazioni da 0,1 a 100μM, per 48 ore di esposizione, in presenza dell’1% di FBS. Solo la concentrazione massima (100μM) ha dato un 20% di inibizione della vitalità; per tutte le altre concentrazioni, non è stato osservato alcun effetto inibitorio sulla proliferazione cellulare. È, dunque, ragionevole escludere l’antagonismo A1 dai fattori responsabili dell’azione antiproliferativa dell’AM251.


![Figura 26. Rappresentazione schematica del ruolo del FAAH, MAGL e COX-2 sul metabolismo di AEA, 2-AG e altri endocannabinoidi [Fowler C.J., 2007]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7552636.109549/10.892.344.575.822.1048/figura-rappresentazione-schematica-ruolo-faah-metabolismo-endocannabinoidi-fowler.webp)