Capitolo 3
Risultati
L’indagine svolta sui pappagalli ha evidenziato la presenza sia di endoparassiti che di artropodi.
Gli endoparassiti isolati (Tabella 3.1) comprendono protozoi (Cryptosporidium baileyi) e nematodi (Strongili gastro-intestinali, Capillarie, Ascaridi, Heterakis sp, Strongyloides sp).
Gli artropodi isolati (Tabella 3.2) comprendono mallofagi (Afrimenopon waar), acari delle penne (Dubininia melopsittaci, Sideroferus lunula e Nymphicilicus perezae), acari ematofagi (Ornithonyssus sylviarum) ed acari della polvere domestica (Glycyphagus domesticus).
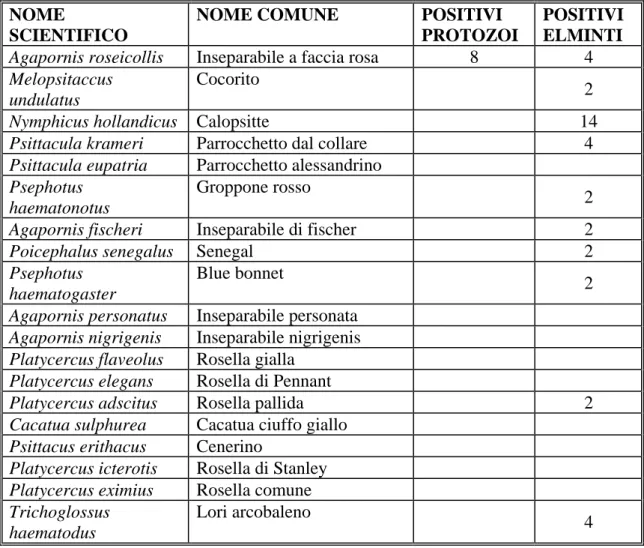
Tabella 3.1 Nome scientifico, nome comune dei pappagalli e numero di soggetti positivi agli endoparassiti
NOME
SCIENTIFICO
NOME COMUNE POSITIVI
PROTOZOI
POSITIVI ELMINTI Agapornis roseicollis Inseparabile a faccia rosa 8 4
Melopsitaccus undulatus
Cocorito
2
Nymphicus hollandicus Calopsitte 14
Psittacula krameri Parrocchetto dal collare 4
Psittacula eupatria Parrocchetto alessandrino
Psephotus haematonotus
Groppone rosso
2
Agapornis fischeri Inseparabile di fischer 2
Poicephalus senegalus Senegal 2
Psephotus haematogaster
Blue bonnet
2
Agapornis personatus Inseparabile personata
Agapornis nigrigenis Inseparabile nigrigenis
Platycercus flaveolus Rosella gialla
Platycercus elegans Rosella di Pennant
Platycercus adscitus Rosella pallida 2
Cacatua sulphurea Cacatua ciuffo giallo
Psittacus erithacus Cenerino
Platycercus icterotis Rosella di Stanley
Platycercus eximius Rosella comune
Trichoglossus haematodus
Lori arcobaleno
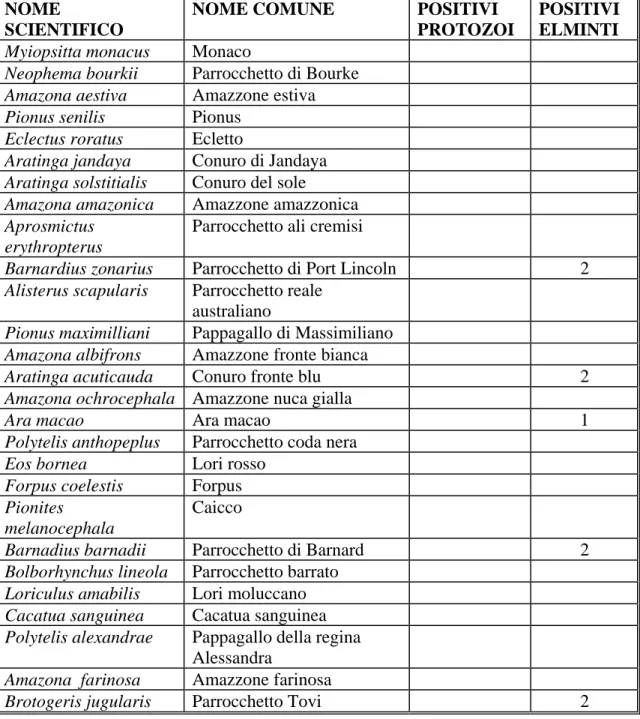
NOME
SCIENTIFICO
NOME COMUNE POSITIVI
PROTOZOI
POSITIVI ELMINTI
Myiopsitta monacus Monaco
Neophema bourkii Parrocchetto di Bourke
Amazona aestiva Amazzone estiva
Pionus senilis Pionus
Eclectus roratus Ecletto
Aratinga jandaya Conuro di Jandaya
Aratinga solstitialis Conuro del sole
Amazona amazonica Amazzone amazzonica
Aprosmictus erythropterus
Parrocchetto ali cremisi
Barnardius zonarius Parrocchetto di Port Lincoln 2
Alisterus scapularis Parrocchetto reale australiano
Pionus maximilliani Pappagallo di Massimiliano
Amazona albifrons Amazzone fronte bianca
Aratinga acuticauda Conuro fronte blu 2
Amazona ochrocephala Amazzone nuca gialla
Ara macao Ara macao 1
Polytelis anthopeplus Parrocchetto coda nera
Eos bornea Lori rosso
Forpus coelestis Forpus
Pionites
melanocephala
Caicco
Barnadius barnadii Parrocchetto di Barnard 2
Bolborhynchus lineola Parrocchetto barrato
Loriculus amabilis Lori moluccano
Cacatua sanguinea Cacatua sanguinea
Polytelis alexandrae Pappagallo della regina Alessandra
Amazona farinosa Amazzone farinosa
Brotogeris jugularis Parrocchetto Tovi 2
Tabella 3.2 Nome scientifico, nome comune dei pappagalli e numero di positivi agli artropodi
NOME SCIENTIFICO NOME COMUNE POSITIVI ACARI PLUMICOLI POSITIVI ACARI EMATOFAGI POSITIVI ACARI DELLA POLVERE
Agapornis roseicollis Inseparabile a
faccia rosa 3 3 Melopsitaccus ondulatus Cocorito 1 Nymphicus hollandicus Calopsitte 2
Psittacula krameri Parrocchetto
NOME SCIENTIFICO NOME COMUNE POSITIVI ACARI PLUMICOLI POSITIVI ACARI EMATOFAGI POSITIVI ACARI DELLA POLVERE
Psittacula eupatria Parrocchetto alessandrino
Psephotus haematonotus
Groppone rosso
2
Agapornis fischeri Inseparabile di
fischer Poicephalus senegalus Senegal Psephotus haematogaster Blue bonnet
Agapornis personatus Inseparabile
personata
Agapornis nigrigenis Inseparabile
nigrigenis
Platycercus flaveolus Rosella gialla
Platycercus elegans Rosella di
Pennant
Platycercus adscitus Rosella palida
Cacatua sulphurea Cacatua ciuffo
giallo
Psittacus erithacus Cenerino
Platycercus icterotis Rosella di
Stanley
Platycercus eximius Rosella
comune
Trichoglossus haematodus
Lori arcobaleno
Myiopsitta monacus Monaco
Neophema bourkii Parrocchetto di
Bourke
Amazona aestiva Amazzone
estiva 2
Pionus senilis Pionus
Eclectus roratus Ecletto 2
Aratinga jandaya Conuro di
Jandaya
Aratinga solstitialis Conuro del sole
NOME SCIENTIFICO NOME COMUNE POSITIVI ACARI PLUMICOLI POSITIVI ACARI EMATOFAGI POSITIVI ACARI DELLA POLVERE
Amazona amazonica Amazzone amazzonica
Aprosmictus erythropterus
Parrocchetto ali
cremisi
Barnardius zonarius Parrocchetto di
Port Lincoln
Alisterus scapularis Parrocchetto reale
australiano
Pionus maximilliani Pappagallo di
Massimiliano
Amazona albifrons Amazzone
fronte bianca
Aratinga acuticauda Conuro fronte
blu
Amazona ochrocephala
Amazzone
nuca gialla
Ara macao Ara macao
Polytelis anthopeplus Parrocchetto
coda nera
Eos bornea Lori rosso
Forpus coelestis Forpus 1
Pionites
melanocephala
Caicco
Barnadius barnadii Parrocchetto di
Barnard
Bolborhynchus lineola
Parrocchetto
barrato
Loriculus amabilis Lori moluccano
Cacatua sanguinea Cacatua
sanguinea
Polytelis alexandrae Pappagallo della regina Alessandra
Amazona farinosa Amazzone
farinosa
Brotogeris jugularis Parrocchetto
3.1 Endoparassiti
Protozoi
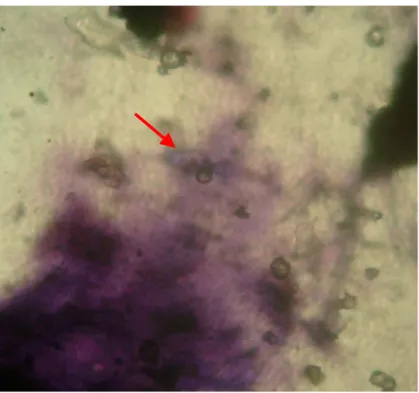
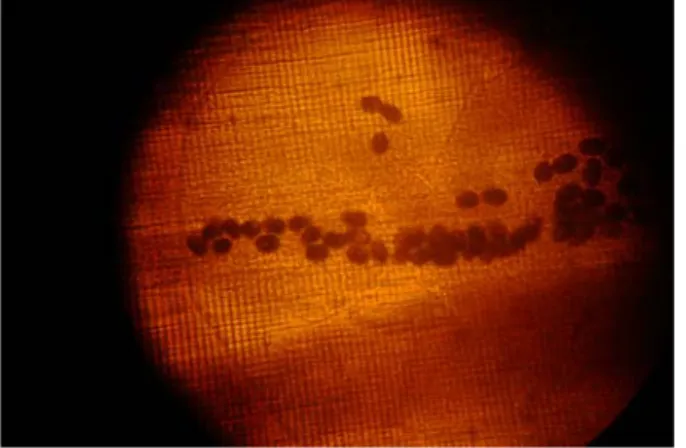
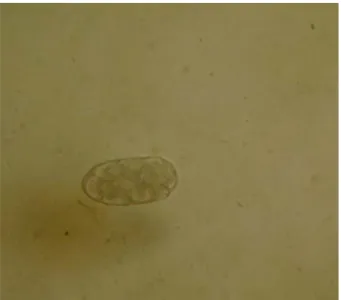
All’osservazione di uno striscio colorato con Ziehl-Nielsen modificata di un pool fecale, prelevato da una gabbia contenente otto esemplari di Agapornis roseicollis di un allevamento friulano, sono state evidenziate oocisti ovalari di 7,59 x 4,5µm (Fig. 3.1 )appartenenti a protozoi del genere Cryptosporidium.
Fig. 3.1 oocisti di C. baileyi
In base alla bibliografia consultata (Sréter e Varga, 2000; Xiao et al., 2004), nei pappagalli sono state isolate due specie appartenenti a questo genere: Cryptosporidium meleagridis che si localizza nell’apparato digerente e nella Borsa di Fabrizio e Cryptosporidium baileyi che si localizza nella Borsa di Fabrizio, nella cloaca, nell’intestino e nell’apparato respiratorio (Sréter e Varga, 2000; Xiao et al., 2004).
La loro forma infettante è rappresentata da oocisti prive di sporocisti, con 4 sporozoiti a forma di virgola,lunghi circa 1 µm ed un voluminoso residuo tra di essi (D’Agostino et al., 2002).
Le oocisti di C. baileyi hanno forma ovalare e dimensioni medie di 6,4 µm (5,6-7,5µm) x 4,8µm (4,8-5,7µm), mentre quelle di C. meleagridis sono rotondeggianti e misurano in media 5 (4,5-6) x 4,4 (4,2-5,3) µm. La morfologia e le dimensioni di C. meleagridis non ne permettono la distinzione da C. parvum ed analisi filogenetiche hanno rivelato che sono strettamente correlati (Sréter e Varga, 2000).
Per le dimensioni delle oocisti e la forma ovalare, si può ritenere che la specie da noi isolata sia Cryptosporidium baileyi (Sréter e Varga, 2000; Xiao et al., 2004).
In uno studio (Belton e Powell 1987), protozoi del genere Cryptosporidium sono risultati responsabili di episodi enterici negli inseparabili a faccia rosa, ma non è stata identificata la specie.
3.2 Nematodi
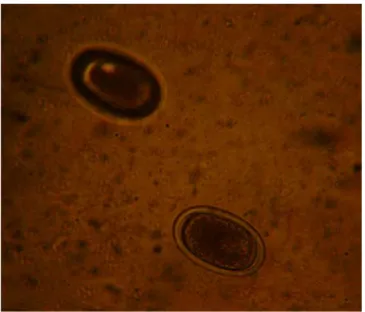
Capillaria
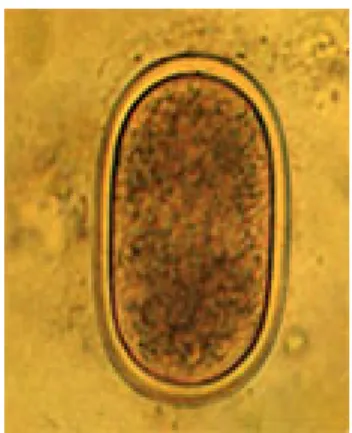
Uova dalla tipica forma a limoncino perché opercolate ai due poli e quindi riferibili al famiglia Capillaridae (Casarosa, 1985; Urquhart et al., 2002) sono state isolate dalle seguenti specie di pappagalli:
1. da una coppia di Agapornis roseicollis e le uova isolate misurano 53,13µm x 37,95µm (Fig. 3.2 );
2. da un maschio ed una femmina di Agapornis fischeri di un allevamento laziale e le uova hanno dimensioni medie di 47µm (40,6-52,78µm) x 30,45 µm (32,48-28,42µm);
3. da una coppia di calopsitte (Nymphicus hollandicus) di un allevamento toscano e le uova isolate misurano 55,2µm x 27,6 µm;
4. da una colonia di 12 calopsitte (Nymphicus hollandicus) di Treviso e le uova isolate misurano 52,78 x 32,48µm;
5. da una femmina di cocorito (Melopsittacus undulatus) vagante presso ad un allevamento della Toscana e successivamente catturata; le dimensioni medie delle uova sono risultate pari a 54,6µm (56,7-52,6µm) x 26,3µm (24,3-28,3µm);
6. da una coppia di parrocchetti dal collare (Psittacula krameri)di un allevamento di Treviso;e le uova isolate misurano 49,68 x 33,12 µm in media;
7. da una coppia di senegal (Poicephalus senegalus) di proprietà di un commerciante ambulante della Lombardia; le uova hanno dimensioni medie di 56,7 x 24,3 µm.
Dalla bibliografia da noi consultata (Freitas et al., 1959; Wakelin, 1967; Shock e Cooper, 1978; Barus e Sergeeva, 1990; Martínez et al., 2003; Kajerová e Baruš, 2005; Baruš et al., 2005) nei pappagallisono state isolate le seguenti specie:
• Baruscapillaria obsignata • Capillaria plagiaticia • Capillaria caudinflata
• Pterothominx (Pterothominx) moraveci • Eucoleus contortus
Gli adulti si presentano come vermi filamentosi, lunghi da 1 a 5 cm; i maschi hanno un lungo spicolo e spesso un abbozzo primitivo di borsa (Urquhart et al., 2002) .
Baruscapillaria obsignata si localizza nella parte prossimale dell’intestino tenue ed ha un ciclo diretto con ingestione dell’uovo. Kajerová e Baruš (2005) hanno isolato questa specie da un inseparabile a faccia rosa (Agapornis roseicollis), un (Barnardius zonarius) ed un cocorito (Melopsittacus undulatus), le uova misurano mediamente 54 (53-58) x 28 (27-28) µm.
C. caudinflata si localizza nell’intestino tenue, ma a differenza della prima necessita di un ospite intermedio, rappresentato da un lombrico che ingerisce le uova ed in cui si sviluppano le L3 infestanti (Urquhart et al., 2002). Il maschio misura 70-20 mm, presenta spiculo con relativa guaina spinulata ed è lungo 670-1890 µm, le femmine sono lunghe 9-36 mm e le uova 43-59 x 20-27 µm (Casarosa, 1985).
Martínez e collaboratori (2003) hanno isolato questa specie in un esemplare libero di Amazzone estiva (Amazona aestiva).
Capillaria plagiaticia è stata descritta per la prima volta da Freitas e collaboratori (1959) che la isolarono dal conuro dei Cactus (Aratinga cactorum caixana). Successivamente da Wakelin (1967) in due Nestori (Nestor notabilis), le uova misurano mediamente 50 (45-54) x 24 (21-29) µm. Pterothominx (Pterothominx) moraveci n. sp è stata isolata per la prima volta dal piccolo intestino di un parrocchetto di Port Lincoln (Barnardius zonarius), le uova misurano mediamente 48 (40-50) x 23 (20-25) µm (Baruš et al., 2005).
Eucoleus contortus localizzato a livello esofageo è stato isolato nel pappagallino ondulato (Melopsittacus undulatus) (Shock e Cooper, 1978). Nonostante sulla base delle caratteristiche morfo-metriche delle uova non sia possibile identificare la specie, dal momento che le misure delle uova riportate per Barsuscapillaria obsignata (Barus e Sergeeva, 1990) corrispondono a quelle da noi isolate nel cocorito (Melopsittacus undulatus) e considerando anche che questo nematode è stato riportato in questa specie di pappagallo (Barus e Sergeeva, 1990), si può ipotizzare che si possa trattare dello stesso parassita.
Nel caso delle calopsitte (Nymphicus hollandicus), del pappagallo del Senegal (Poicephalus senegalus), dell’inseparabile di Fischer (Agapornis fischeri) e
del parrocchetto dal collare (Psittacula krameri) il presente studio rappresenta la prima segnalazione di parassiti della famiglia Capillaridae in queste specie.
Fig. 3.2 uova della Famiglia Capillaridae
Per tutti i soggetti positivi, sono stati effettuati due trattamenti, a distanza di 15 giorni uno dall’altro e della durata di tre giorni ciascuno con Tetramisole® da miscelare nell’acqua da bere. Al successivo controllo sono risultati negativi.
Ascaridi
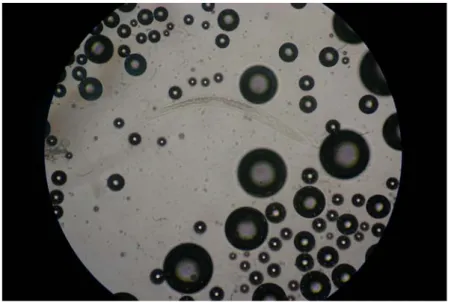
Larghe uova ovalari, a parete spessa, quasi completamente riempite da uno zigote di forma rotondeggiante e riferibili al genere Ascaridia (Casarosa, 1985; Urquhart et al., 2002) .
sono state riscontrate all’esame per flottazione nei campioni fecali di:
1. una coppia di Blue bonnet (Psephotus haematogaster) di circa 3 anni di età e provenienti da un allevamento della Toscana (Pisa), le uova misurano mediamente 88,32 µm x 66,24 µm (80 x 60 µm) (Fig 3.3);
2. una coppia di Groppone rosso (Psephotus haematonotus) di un grande allevamento di volatili del Lazio (Roma), le uova hanno dimensioni pari a 82,8 x 55,2µm;
3. una coppia di Rosella pallida (Platycercus adscitus), sempre dell’allevamento di Roma, le uova misurano in media di 86 µm (82,8-89,32µm) x 56 µm (55,2-56,4µm);
4. una coppia di Conuro a testa blu (Aratinga acuticaudata)
dell’allevamento di Roma, le uova presentano dimensioni medie pari a 81µm x 48,6µm;
5. una coppia di Lori arcobaleno (Trichoglossus haematodus), di proprietà di un commerciante ambulante di Pavia, le uova isolate misurano in media 71,56um x 55,2 um;
6. una coppia di Parrocchetto di Barnard (Barnardius barnardi) dello stesso venditore ambulante, le uova presentano dimensioni medie pari a 74,9µm (72,9- 76,9µm) x 52,6µm.
Dalla bibliografia consultata(Martínez et al., 2003; Kajerova et al., 2004) è emerso che le specie di questo genere isolate nei pappagalli sono:
• Ascaridia platyceri • Ascaridia hermaphrodita • Ascaridia sergiomeirai • Ascaridia ornata • Ascaridia nicobarensis • Ascaridia galli • Ascaridia columbae
A. hermaphrodita è stato isolato da Travassos (1913; 1930) nelle seguenti specie: Ara ararauna, Ara chloroptera, Ara macao, Aratinga acuticauda, Aratinga solstitialis, Aratinga leucophtalmus, Aratinga pertinax, Pyrrhura
leucotis, Pyrrhura molinae, Amazona vinacea, Amazona farinosa, Amazona festiva, Amazona aestiva, Amazona festiva, Amazona arausiaca, Amazona leucocephala, Amazona ochrocephala, Amazona vittata, Pionus maximiliani, Pionus fuscus e Pionus menstruus.
Altri isolamenti si sono avuti in Amazona aestiva (Pereira, 1933), Amazona ochrocephala (Vevers, 1923), Amazona leucocephala (Barus, 1969; Hartwich e Tscherner, 1979), Amazona autumnalis (Schmidt e Neiland, 1973), Anodorhynchus hyacinthinus (Hartwich e Tscherner, 1979), Amazona amazonica e Amazona festiva (Caravan, 1931) e Aratinga leucophtalmus, Pionus maximiliani e Pyrrhura leucotis (Pinto et al., 1993).
In due recenti studi (Martínez et al, 2003a) A. haermaphrodita è stato isolato da Ara militaris e, nuovamente, da Ara chloroptera (Martínez et al, 2003b).
A. sergiomeirai fu descritta da Pereira (1933) in base agli esemplari isolati da Forpus passerinus e Brotogeris chrysopterus.
Altri isolamenti sono stati riscontrati in Aratinga leucophtalmus e Pionus maximiliani (Pinto et al, 1993).
A. ornata è stata isolata solo da Amazona amazzonica (Kreis, 1955), mentre A. nicobarensis da Psittacula longicauda subsp. Nicobarica (Soota et al, 1971).
A. platyceri ( sin A. sprenti) è stato riportato da Hartwich e Tscherner (1979) in Platycercus eximius, Platycercus elegans, Cyanorhamphus auriceps, Neopsephotus bourkii, Nymphicus hollandicus, Polytelis authopeplus e Psephotus haematonotus. Mines (1979) lo ha invece riportato in Northiella (sin Psephotus) haematogaster, Aprostomictus erythropterus, Barnardius barnardi, Neophema elegans, Neophema pulchela, Neophema splendida, Polytelis authopeplus e Psephotus haematonotus; mentre Webster (1982) in Melopsittacus undulatus e Nymphicus hollandicus.
Altri isolamenti si sono avuti in Cyanoramphus sp (Nixon e Weekes, 1985) e
Agapornis personatus (Weeks,1981). A. galli normalmente parassita il pollo domestico, tuttavia Neophema elegans
e Platycercus eximius, che avevano avuto contatti con questi animali, sono risultati infestati da questa specie (Peirce e Bevan, 1973).
A. columbae, un nematode tipico del piccione, è stato isolato in Polytelis alexandrae (Johnston e Mawson, 1941) e Melopsittacus undulatus (Ferrola et al, 1976). Mines e Green (1983) hanno isolato questa specie anche da Alisterus scapularis, Polytelis alexandrae, Agapornis sp, Neopsephotus bourkii e Melopsittacus undulatus.
Nonostante sulla base delle caratteristiche morfo-metriche delle uova non sia possibile identificare la specie, dal momento che le misure delle uova riportate (Hartwich e Tscherner, 1979; Mines, 1979; Kajerova et al., 2004) per Ascaridia platyceri (60-90 x 40-57µm) corrispondono a quelle da noi isolate dal groppone rosso (Psephotus haematonotus), dal parrocchetto di Barnard (Barnardius barnardii) e dal Blue bonnet (Psephotus haematogaster) (Mines, 1979) e considerando anche che questo ascaride è già stato riportato precedentemente in queste due specie di pappagalli (Hartwich e Tscherner, 1979; Mines, 1979), si può ipotizzare che anche in questo caso si possa trattare dello stesso parassita.
La stessa cosa si può ipotizzare anche per Ascaridia hermaphrodita, le cui uova misurano 69-81 µm x 48-76 µm (Travassos, 1913, 1930; Vevers, 1923; Canavan, 1931), nel caso del Conuro a testa blu (Aratinga acuticaudata).
Per quanto riguarda il Lori arcobaleno (Trichoglossus haematodus) e la Rosella pallida (Platycercus adscitus), invece, il presente studio rappresenta la prima segnalazione di parassiti del genere Ascaridia in queste due specie animale.
Fig. 3.3 uova di Ascaridi
Per tutti i soggetti positivi, sono stati effettuati due trattamenti, a distanza di 15 giorni uno dall’altro e della durata di tre giorni ciascuno con Tetramisole® da miscelare nell’acqua da bere. Al successivo controllo sono risultati negativi.
L’esame necroscopico condotto su un esemplare maschio di Ara chloroptera proveniente da uno zoo e deceduto in seguito ad arresto cardio-circolatorio, ha consentito di rilevare all’esame esterno uno stato di nutrizione scadente. All'esame interno sono stati invece riscontrati un’ampia suffusione
emorragica localizzata al piatto della coscia sinistra, ascite, idropericardio con presenza di materiale fibrinoso, aree edematose ed emorragiche diffuse a carico del parenchima polmonare, periepatite ed ampie aree di fibrosi e
focolai necrotici diffusi a livello epatico, marcata splenomegalia ed una grave enterite parassitaria sostenuta da numerosissimi nematodi biancastri e di notevole dimensione riferibili ad ascaridi (Fig. 3.4).
Fig. 3.4 adulti di Ascaridi
I maschi adulti sono risultati mediamente lunghi 5cm (6-4 cm) e larghi 1,5mm (1,6-1,4 mm); essi presentano 12 paia di papille caudali, spicola con ali con una lunghezza media pari a 1,2 mm (1,1-1,4 mm) (Fig. 3.5) ed una ventosa anale di 235 x 150 µm. Sono privi di interlabia, cioè i processi che protrudono tra le labbra.
Fig. 3.5 spicole e ventosa anale del maschio
Le femmine adulte hanno una lunghezza compresa tra 5 e 7cm, la coda è arrotondata e misura 557,26µm di lunghezza e l’apertura vulvare (Fig. 3.6) si trova a metà del corpo.
Fig. 3.6 particolare dell’apertura vulvare della femmina
Le uova (Fig. 3.7), di forma ellissoidale e con una spessa parete, presentano dimensioni medie di 78,4 x 47,4 µm.
Fig. 3.7 uova di Ascaridia nell’apparato genitale femminile
Possiamo escludere che si tratti di Ascaridia nicobarensis (Soota et al., 1971) e di Ascaridia platyceri (Hartwich e Tscherner, 1979) perché in entrambe queste specie gli adulti presentano interlabia; nei maschi adulti, inoltre, la spicola non presenta ali. Possono essere esclusi anche Ascaridia galli (Schrank, 1788) e Ascaridia ornata (Kreis, 1955) in quanto i maschi della prima specie presentano solo 10 paia di papille caudali e solo nove paia i maschi adulti della seconda specie; questi ultimi, inoltre, presentano una spicola che misura 1,93-2,74 mm.
La lunghezza della spicola, invece, ci permette di escludere Ascaridia sergiomeirai (Pereira, 1933) in quanto in questa specie essa misura al
massimo 940 µm mentre nei nostri esemplari la lunghezza arriva fino a 1,2 mm.
Ascaridia hermaphrodita può essere escluso perché presenta dalle 13 alle 16 paia di papille caudali e la spicola misura 1,87-3,02 mm.
La corrispondenza morfo-metrica delle femmine e dei maschi adulti e della lunghezza della spicola ed il numero di paia di papille caudali di questi ultimi, ci permettono invece di affermare che si tratti di Ascaridia columbae (Levine, 1968; Kajerova et al., 2004).
Il presente studio rappresenta il primo isolamento di questa specie di ascaride da Ara chloroptera.
Heterakis
Uova con parete spessa e simili nella morfologia a quelle di Ascaridia, sono state isolate dai campioni fecali di una coppia di parrocchetti dal collare asintomatici, provenienti da un all’allevamento di Roma. Esse misurano 55,2µm x 30 µm in media (Fig. 3.8). Per quanto morfologicamente simili a quelle del genere Ascaridia, esse si differenziano per le dimensioni più piccole ed il maggior riempimento interno e, per questi stessi motivi, esse sono riconducibili invece al genere Heterakis.
Nel genere Heterakis, la specie Heterakis gallinarum è stata isolata dai pappagalli e precisamente dal pappagallino ondulato (Melopsittacus undulatus) (Shock e Cooper, 1978). Esso è un nematode di frequente riscontro nei polli, tacchini, anatre e fagiani. Le sue uova misurano 59-62 x 39-41 µm (Casarosa, 1985) e queste dimensioni corrispondono a quelle delle uova da noi isolate. Ciononostante, non disponendo di esemplari adulti, è possibile solo ipotizzare che si possa trattare di questa specie.
I soggetti positivi, sono stati effettuati due trattamenti, a distanza di 15 giorni uno dall’altro e della durata di tre giorni ciascuno con Tetramisole® da miscelare nell’acqua da bere. Al successivo controllo sono risultati negativi.
Strongyloides
Alcune larve con esofago strongiloide e coda appuntita sono state isolate dalle seguenti specie di pappagalli:
1. una coppia di Agapornis roseicollis asintomatici appartenente ad un venditore ambulante lombardo (Fig. 3.9); le loro dimensioni sono risultate mediamente di 550µm (440-660µm) x 35µm (30-41µm); 2. una coppia di parrocchetti tovi (Brotogeris jugularis) appartenente
ad un venditore ambulante lombardo; le larve isolate in media misurano 530µm (500-560µm) x 25µm (20-30µm);
3. una coppia di Lori arcobaleno (Trichoglossus haematodus),
appartenente allo stesso venditore ambulante; le larve misurano in media 500µm di lunghezza e 30µm di larghezza in media,
Nonostante dai pappagalli i parassiti del genere Strongyloides siano stati spesso isolati, non è mai stata identificata la specie in causa (De Freitas et al. 2002). L’unica specie di questo genere riportata negli uccelli è Strongyloides avium che ha come ospiti comuni pollo, tacchino, anatre e quaglie (Levine, 1968; Urquhart et al., 2002).
Fig. 3.9 larva di Strongyloides sp.
Nel nostro caso, non disponendo di parassiti adulti, sulla base delle dimensioni e della morfologia delle larve di terzo stadio isolate è possibile affermare solo che si tratti di L3 del genere Strongyloides (Levine, 1968). Nonostante non si conoscano gli effetti patogeni di queste larve nei pappagalli, sono stati effettuati due trattamenti, a distanza di 15 giorni uno dall’altro e della durata di tre giorni ciascuno con Tetramisole® da miscelare nell’acqua da bere.
Strongili intestinali
Da una coppia di parrocchetti dal collare (Psittacula krameri) di un allevamento di Treviso, la stessa dalla quale sono state isolate anche uova di Capillaria, è stata riscontrata anche la presenza di uova a parete sottile, di forma allungata e morulate all’interno e di dimensioni pari a 52,32 x 43,60 µm, riconducibili a uova di strongili gastro-intestinali (Fig. 3.10).
Fig 3.10 uovo di strongilo intestinale
In base allo studio effettuato da De Freitas e collaboratori (2002) in Brasile, nei pappagalli sono stati isolati nematodi appartenenti al genere Trichostrongylus.
Le due specie che parassitano i volatili risultano essere Trichostrongylus tenuis e Ornithostrongylus quadriradiatus.
Non disponendo di esemplari adulti, però è possibile solo ipotizzare che si possa trattare di una di queste due specie.
I soggetti positivi, sono stati effettuati due trattamenti, a distanza di 15 giorni uno dall’altro e della durata di tre giorni ciascuno con Tetramisole® da miscelare nell’acqua da bere.
3.3 Artropodi
Mallofagi
Da un esemplare femmina di Agapornis roseicollis di circa un anno di età, appartenente ad un allevamento amatoriale della provincia di Pisa, che
presenta il piumaggio completamente sfrangiato, sono stati isolati alcuni artropodi ecto-parassiti adulti. Essi mostrano tre paia di zampe, corpo diviso in testa, torace e addome ed un paio di antenne e, pertanto, inseribili nella classe Insecta.
La testa è sviluppata più in larghezza che in lunghezza e misura 240µm x 370µm; nella parte anteriore si trovano delle corte antenne costituite da 4 segmenti, sul lato ventrale sono presenti due mandibole con margini dentellati atte a masticare. Ai lati della testa sono presenti 3 paia di peli corti e 3 paia di peli più lunghi. L’addome si presenta segmentato e ricoperto di setole di lunghezza variabili.
Per queste caratteristiche morfologiche i parassiti isolati sono stati inseriti tra i mallofagi (Fig. 3.11).
Confrontando la morfologia della specie isolata in questo studio con quella dell’unica specie isolata dagli inseparabili (Price, 1970), si può ritenere che si tratti della specie Afrimenopon waar
.
Il presente studio rappresenta il primo isolamento di Afrimenopon waar in Italia.
La coppia è stata più volte trattata con Neoforactil ® spray e dopo circa due mesi il piumaggio della femmina è tornato normale
Acari plumicoli
Alcuni ectoparassiti che, per la morfologia del corpo allungato e appiattito dorso-ventralmente, l’assenza di suddivisone in segmenti, la presenza di 4 paia di zampe negli adulti e ninfe e 3 paia di zampe nelle larve, sono stati inseriti tra gli Acari (Krantz, 1978) sono stati riscontrati al controllo del fondo della gabbia e del piumaggio di una coppia di Agapornis roseicollis di un allevamento della provincia di Pisa, nel quale la femmina presenta piumaggio completamente sfrangiato e dalla quale è stata anche isolata una specie di mallofago e da una coppia di Agapornis roseicollis di un piccolo allevamento della Puglia (Bari).
Dalla femmina della prima coppia, sono stati isolati due acari femmine (Fig. 3.12) di dimensioni medie pari a 320 (310-330) x 130 (120-140) µm ed una larva di 190 x 90µm (Fig. 3.13); mentre dalla seconda coppia, che non presenta alterazioni del piumaggio, sono state isolate due femmine di dimensioni medie pari a 260 (230-340) x 110 (100-170) µm, morfologicamente simili ai precedenti. Esse presentano una forma allungata e, nella porzione terminale, si riconoscono due lunghe paia di sete; inoltre, la parte distale degli epimeriti I è connessa a formare una “V”.
Dalla bibliografia consultata (Schmäschke et al., 2002), l’unico acaro plumicolo isolato da questa specie è rappresentato da Dubininia melopsittaci
ed, in effetti, sulla base delle descrizioni fornite (Schmäschke et al., 2002) per questa speciepossiamo affermare che si tratti di questo parassita.
D. melopsittaci non è un acaro strettamente ospite-specifico ma, secondo Schmäschke e collaboratori (2002), presenta un ampio spettro di ospiti. Esso si localizza soprattutto sulle piccole penne anteriormente alle copritrici delle timoniere (Schmäschke et al., 2002).
Fig. 3.12 femmina di D. melopsittaci
La prima coppia è stata più volte trattata con Neoforactil ® spray e dopo circa due mesi il piumaggio della femmina è tornato normale; per la seconda coppia si è provveduto alla pulizia e disinfezione del fondo della gabbia con Stermina G ® e al successivo controllo non sono stati riscontrati acari.
Il presente studio rappresenta il primo isolamento di D. melopsittaci nei pappagalli in Italia.
Al controllo per gli ectoparassiti eseguito sulle penne e sulla lettiera di una coppia di calopsitte (Nymphicus hollandicus) provenienti da un negozio di animali della provincia di Pisa, il cui piumaggio all’esame visivo si presentava in buone condizioni, sono stati isolati alcuni esemplari di acari plumicoli.
Le femmine (Fig. 3.14) misurano in media 315µm (270-360µm) X 180µm (150-210µm) µm ed i maschi (Fig. 3.15) 260µm (250-270µm) X 175µm (150-200µm).
Nei maschi l’opistosoma termina a forma di uncino, le fessura terminale è concava e poco profonda, nella porzione caudale si trovano due ventose. In entrambi i sessi, in posizione latero-caudale, sono presenti 2 paia di lunghe sete caudali e delle formazioni rotondeggianti di colore scuro di 20µm di diametro.
Fig. 3.14 femmina di N. perezae
Fig. 3.15 maschio di N. perezae
In base alla bibliografia disponibile (Mironov e Galloway, 2002), l’unica specie di acaro plumicolo isolata nelle calopsitte è Nymphycillicus perezae.
Per le loro caratteristiche morfologiche e metriche, corrispondenti a quelle fornite da Mironov e Galloway (2002), gli acari isolati possono essere identificati con questa specie.
Il presente rappresenta il primo isolamento di N. perezae in Italia.
Dalle remiganti prelevate da un esemplare femmina di Melopsittacus undulatus di circa 1 anno di età, deceduto e necroscopizzato sono stati isolati alcuni artropodi ectoparassiti riconducibili ad acari plumicoli.
Tutti gli esemplari sono risultati di sesso femminile (Fig. 3.16) di dimensioni medie pari a 390µm (350-430µm) x 200µm (170-230µm); nella porzione caudale dell’idiosoma essi presentano due paia di lunghe sete laterali.
Dalla bibliografia consultata (Atyeo e Gaud, 1987; Schmäschke et al., 2002) è emerso che due diverse specie di acari plumicoli possono parassitare il cocorito: Sideroferus lunula e Dubininia melopsittaci
La prima specie parassita solo il cocorito e si localizza soprattutto a livello delle remiganti delle ali (Atyeo e Gaud, 1987; Schmäschke et al., 2002), mentre la seconda specie si localizza soprattutto a livello delle penne copritrici della coda (Atyeo e Gaud, 1987; Schmäschke et al., 2002) e interessa anche altre specie di pappagallo (Schmäschke et al., 2002).
Esse si distinguono anche per la morfologia della parte distale degli epimeriti I che formano una “V” in Dubininia melopsittaci e non in Sideroferus lunula (Atyeo e Gaud, 1987; Schmäschke et al., 2002).
Fig. 3.16 femmina di S. lunula
Sulla base della morfologia, delle dimensioni e della localizzazione e morfologia degli epimeriti, gli acari isolati sono stati identificati con la specie S. lunula (Atyeo e Gaud, 1987; Schmäschke et al., 2002).
Il presente studio rappresenta il primo isolamento di S. lunula in Italia.
Acari ematofagi
Da una coppia di Groppone rosso di un allevamento di Roma, durante il controllo di campioni di penne è stato isolato un acaro ectoparassita di colore rossastro.
L’acaro ha forma ovoidale (Fig. 3.17), misura 800µm X 420µm e presenta uno scudo dorsale che si restringe nella porzione caudale; nella faccia ventrale osserviamo due scudi, quello anteriore di forma triangolare con apice rivolto verso il basso e quello posteriore a forma di pera rovesciata nella cui porzione anteriore si apre l’ano.
Ai lati dell’apertura anale si trovano due setole e un’altra setola si trova subito sotto.
I cheliceri, ben evidenti anche a piccolo ingrandimento hanno forma di pinze. In base alla bibliografia consultata (Krantz, 1978; Manfredini, 2005) in questo genere si riconoscono due specie di acari ematofagi morfologicamente simili alla specie isolata: Dermanyssus gallinae ed Ornithonyssus sylviarum. Dermanyssus gallinae presenta zampe robuste, un corpo di forma ovalare di colorito grigiastro a digiuno e rossastro dopo il pasto, per tale caratteristica è comunemente chiamato acaro rosso. Facilmente riscontrabile di giorno al di sotto dei nidi, all’interno dei posatoi e in tutti gli interstizi presenti in un allevamento di uccelli, di notte si porta sul corpo dei volatili per cibarsi del loro sangue. Nei nascondigli l’acaro, una volta accoppiatosi depone uova, di forma ovalare di 300-400 µm di lunghezza (Krantz, 1978).
Ornithonyssus sylviarum è morfologicamente molto simile a Dermanyssus gallinae e se ne differenzia per la forma dei cheliceri simili a tenaglie mentre essi sono simili ad un ago in Dermanyssus, e per la posizione dell’ano che si trova nella parte anteriore della placca chitinosa dell’ ano in Ornithonyssus silvarium mentre in quella posteriore in D. gallinae. Il ciclo vitale dei due acari si differenzia poiché O. sylvarium può vivere permanentemente sugli uccelli e non li lascia mai (Manfredini, 2005).
Sulla base della bibliografia consultata (Kranz, 1978; Manfredini, 2005), per la morfologia dei cheliceri, dello scudo dorsale e dello scudo anale la specie da noi isolata è stata identificata con Ornithonyssus sylviarum.
Fig. 3.17 esemplare di O. sylviarum
Il presente studio rappresenta il primo isolamento di O. sylviarum nei pappagalli in Italia.
Acari della polvere domestica
L’esame di alcune penne cadute e raccolte dal fondo delle gabbie, ha permesso l’isolamento di artropodi dal corpo indiviso e 4 paia di zampe, inseribili tra gli acari.
Essi hanno forma rotondeggiante, con apparato buccale di tipo masticatore molto sviluppato; presentano un paio di setole anteriori e un paio posteriori e numerose e lunghe sete laterali. Dorsalmente è presente una cresta metopica mentre i tarsi hanno delle sete barbate (Fig. 3.18).
Essi sono stati riscontrati nei seguenti animali:
1. due soggetti maschi di Agapornis roseicollis di circa 2 anni di età tenuti come “pet birds” da un privato della provincia di Livorno; gli acari isolati hanno dimensioni pari a 500 x 300 µm;
2. un Forpus coelestis tentuto come “pet bird” assieme a due inseparabibili; gli acari isolati hanno dimensioni presentano dimensioni medie di 530µm (500-560µm) x 290 µm;
3. una coppia di Eclectus roratus, proveniente da un allevamento laziale; gli acari isolati hanno dimensioni pari a 490µm x 300 µm; 4. una coppia di Amazona aestiva proveniente da un allevamento
laziale; gli acari isolati hanno dimensioni pari a 530µm x 300 µm; 5. una coppia di Agapornis roseicollis dell’allevamento in provincia di
Pisa da cui erano già stati isolati mallofago e acari plumicoli; gli acari isolati misurano di 540 x 300 µm
Sulla base della bibliografia da noi consultata (Krantz, 1978; Robertson, 1946)l’acaro è stato identificato con la specie Glycyphagus domesticus.
Fig. 3.18 esemplare di G. domesticus
G. domesticus è un acaro comunemente riscontrato nella polvere domestica e responsabile nell’uomo di fenomeni allergici a livello cutaneo (Hewitt et al., 1973; Kapp et al., 1989; Lodi et al., 1990).
La caratteristica di questo artropode è quella di potersi trasformare, se le condizioni ambientali sono sfavorevoli, in deutoninfa ipopiale, una forma di resistenza immobile dove viene protetto da un exuvia e può spostarsi solo perché si attacca ad un animale o essere trasportato dal vento (Puccini e Tarsitano, 2003). Principato e collaboratori (1996) hanno dimostrato che in
mostravano prurito e lesioni da grattamento c’era un alto numero di questi acari. Alcuni di essi presentavano cute desquamata e calamo delle penne contornato da materiale furfuraceo(Principato et al, 1996).
3.4 Analisi statistica
Sono stati esaminati 571 animali appartenenti a diverse specie, con diversa origine (allevamento, negozio, pet) e provenienti da diverse regioni d’Italia. L’11,73 % è risultato essere parassitato, con prevalenza del 9,1 % per endoparassiti e del 2,6 % per ectoparassiti, prevalenze che sono risultate altamente significative all’analisi statistica (P<0.01). Anche la prevalenza dei diversi endoparassiti è risultata altamente significativa (P<0.01), mentre la prevalenza dei diversi ectoparassiti non presenta differenze significative (P= 0.073), i dati relativi alle prevalenze sono riportati nella tabella 3.3.
Tabella 3.3 Dati delle prevalenze
Positivi Negativi Prevalenza
% Parassitati 67 504 11,73 Endoparassiti 52 519 9,1 C. baileyi 8 563 1,4 Capillarie 26 545 4,5 Ascaridi 12 559 2,01 Strongiloides 6 565 1,00 Strongili 2 569 0,35 Ectoparassiti 15 556 2,6 Mallofagi 1 570 0,17 Acari penne 5 566 0,86 Acari polvere 8 563 1,4 O. sylviarum 2 569 0,35
Sono stati analizzati soggetti appartenenti a 46 specie diverse, di esse solo 16 sono risultate essere parassitate, di cui 6 specie hanno presentato ectoparassiti
e 13 endoparassiti. La prevalenza delle singole specie è riportata in tabella 3.4. A causa della alta variabilità di numero di soggetti per specie non è stata effettuata l’analisi statistica per singola specie in quanto sarebbe risultata poco indicativa e falsata dall’alta variabilità.
Tabella 3.4 Prevalenza delle singole specie
Numero Prevalenza Prevalenza Prevalenza
Specie di soggetti Endoparass
iti Ectoparassi ti Parassiti Agapornis fischeri 42 4,76 0,00 4,76 Agapornis nigrigenis 1 0,00 0,00 0,00 Agapornis personatus 45 0,00 0,00 0,00 Agapornis roseicollis 178 7,87 3,37 11,24 Alisterus scapularis 2 0,00 0,00 0,00 Amazona aestiva 16 0,00 12,50 12,50 Amazona albifrons 2 0,00 0,00 0,00 Amazona amazzonica 1 0,00 0,00 0,00 Amazona farinosa 1 0,00 0,00 0,00 Amazona ochrocephala 2 0,00 0,00 0,00 Aprostomictus erythropterus 3 0,00 0,00 0,00 Ara chloroptera 1 0,00 0,00 0,00 Aratinga acuticauda 4 50,00 0,00 50,00 Aratinga jandaya 1 0,00 0,00 0,00 Aratinga solstitialis 1 0,00 0,00 0,00 Barnadius barnadii 2 100,00 0,00 100,00 Barnardius zonarius 2 0,00 0,00 0,00 Bolborhynchus lineola 7 0,00 0,00 0,00 Brotogeris jugularis 4 50,00 0,00 50,00
Cacatua sanguinea 3 0,00 0,00 0,00 Cacatua sulphurea 2 0,00 0,00 0,00 Eclectus roratus 4 0,00 50,00 50,00 Eos bornea 1 0,00 0,00 0,00 Forpus coelestis 7 0,00 14,29 14,29 Loriculus amabilis 1 0,00 0,00 0,00 Melopsitaccus ondulatus 102 1,96 0,00 1,96 Myiopsitta monacus 2 0,00 0,00 0,00 Neophema bourkii 8 0,00 0,00 0,00 Nymphicus hollandicus 35 40,00 5,71 45,71 Pionites melanocephala 2 0,00 0,00 0,00 Pionus maximilliani 2 0,00 0,00 0,00 Pionus senilis 4 0,00 0,00 0,00 Platycercus adscitus 6 33,33 0,00 33,33 Platycercus elegans 4 0,00 0,00 0,00 Platycercus eximius 13 0,00 0,00 0,00 Platycercus flaveolus 2 0,00 0,00 0,00 Platycercus icterotis 4 0,00 0,00 0,00 Poicephalus senegalus 14 14,29 0,00 14,29 Polytelis alexandrae 1 0,00 0,00 0,00 Polytelis anthopeplus 1 0,00 0,00 0,00 Psephotus haematogaster 2 100,00 0,00 100,00 Psephotus haematonotus 6 33,33 33,33 66,67 Psittacula eupatria 4 0,00 0,00 0,00 Psittacula krameri 17 11,76 0,00 11,76 Psittacus erithacus 9 0,00 0,00 0,00 Trichoglossus haematodus 8 50,00 0,00 50,00
Analizzando invece i dati per i diversi generi che presentavano più di cinque soggetti (Tabella 3.5) la prevalenza dei soggetti parassitati è risultata altamente significativa tra i diversi generi così come la prevalenza per gli endo ed ectoparassiti (P<0.01).
Tabella 3.5 Prevalenza per i generi con più di cinque soggetti
Genere Totali Prevalenza Prevalenza Prevalenza
Endoparassiti Ectoparassiti parassiti
Agapornis 266 6,02 2,26 8,27 Amazona 22 0,00 9,09 9,09 Aratigna 6 33,33 0,00 33,33 Bolborhynchus 7 0,00 0,00 0,00 Cacatua 5 0,00 0,00 0,00 Forpus coelestis 7 0,00 14,29 14,29 Melopsitaccus 102 1,96 0,00 1,96 Neophema 8 0,00 0,00 0,00 Nymphicus 35 40,00 5,71 45,71 Pionus 6 0,00 0,00 0,00 Platycercus 29 6,90 0,00 6,90 Poicephalus 14 14,29 0,00 14,29 Psephotus 8 50,00 25,00 75,00 Psitacus 30 6,67 0,00 6,67 Trichoglossus 8 50,00 0,00 50,00
La prevalenza dei soggetti parassiti non è risultata significativa a seconda della provenienza (P=0.726) così come la prevalenza degli endoparassiti (P=0.214), mentre quella per gli ectoparassiti è risultata altamente significativa (P<0.01), risultando per gli animali pet molto più alta rispetto
Tabella 3.6 Prevalenza legata alla provenienza Tipo
allevamento
Numero Prevalenza Prevalenza Prevalenza
di animali Endoparassiti Ectoparassiti parassiti
Allevamento 454 8,81 2,20 11,01
Negozi 103 11,65 1,94 13,59
Pet 22 0,00 13,64 13,64
La prevalenza dei soggetti parassitati provenienti dalle diverse regioni prese in considerazione è risultata altamente significativa (P<0.01), così come la prevalenza degli endoparassiti e degli ectoparassiti (P<0.01). Il Veneto risulta essere la regione con più alta prevalenza per endoparassiti (66,67 %) mentre la Puglia per gli ectoparassiti (14.29 %); l’Emilia-Romagna risulta invece avere la più bassa prevalenza totale (0,00 %). Le prevalenze delle singole regioni sono riportate in tabella.
la Puglia per gli ectoparassiti (14.29 %); l’Emilia-Romagna risulta invece avere la più bassa prevalenza totale (0,00 %).
Tabella 3.7 Prevalenze delle singole regioni
Regione Numero Prevalenza Prevalenza Prevalenza di animali Endoparassiti Ectoparassiti Parassiti Emilia-Romagna 12 0,00 0,00 0,00 Friuli 110 7,27 0,00 7,27 Lazio 148 5,41 4,05 9,46 Lombardia 115 10,43 0,00 10,43 Puglia 14 0,00 14,29 14,29 Toscana 159 6,29 4,40 10,69
Veneto 21 66,67 0,00 66,67
3.5 Lieviti
Entrambi i campioni esaminati per la ricerca dei lieviti, sono risultati negativi e quindi scartati.
3.6 Batteri
Dagli esami batteriologici dei 10 campioni fecali provenienti dall’allevamento di Trieste, due di essi sono risultati positivi ad E. coli. I due isolamenti
presentano sensibilità diversa agli antibiotici come riportato nella tabella 3.8.
Tabella 3.8 Pappagalli positivi agli esami batteriologici e sensibilità agli antibiotici ANIMALE PROVENIENZA SPECIE
BATTERICA SENSIBILITA’ Agapornis roseicollis Allevamento Trieste
E. coli emolitico Cefotaxime Doxiciclina Enrofloxacina Tetraciclina Sulfametoxazolo + Trimethoprim Agapornis roseicollis Allevamento Trieste
E. coli emolitico Amikacina Doxiciclina Enrofloxacina