S
S
S
c
c
c
o
o
o
p
p
p
o
o
o
d
d
d
e
e
e
l
l
l
l
l
l
o
o
o
s
s
s
t
t
t
u
u
u
d
d
d
i
i
i
o
o
o
Sia nel diabete mellito tipo 1 che nel tipo 2, l’aggregazione tra le diverse complicanze microangiopatiche (per esempio, più dell’ 80% dei soggetti con nefropatia presentano segni di retinopatia spesso pre-proliferante o proliferante) e l’associazione stretta e irrisolta tra complicanze microangiopatiche e patologia cardiovascolare rendono razionale, allo scopo di individuare le componenti che regolano la predisposizione genetica alle complicanze, l'analisi dei fattori contemporaneamente coinvolti nel divenire del processo aterosclerotico e nella storia naturale delle complicanze microvascolari (203, 204). In altre parole, la ricerca dei geni capaci di modulare la suscettibilità alle complicanze del diabete si basa sul ruolo attribuito ai relativi prodotti genici nei processi di patogenesi. Emerge pertanto il razionale della forte attenzione dedicata a fattori genetici ritenuti implicati nell’emodinamica del micro- e del macrocircolo, associati alla presenza di ipertensione arteriosa o coinvolti nella regolazione della funzione endoteliale. Analogamente, numerosi studi sono stati dedicati alla esplorazione di fattori coinvolti nella modulazione del profilo lipidico. Alterazioni del profilo lipidico, e tra queste soprattutto l’aumento della concentrazione del colesterolo LDL, emergono infatti come il principale fattore di rischio cardiovascolare nel diabete tipo 2 (94). D’altra parte, alterazioni del pattern lipidico (ipercolesterolemia, ipertrigliceridemia, basse HDL) rappresentano un importante fattore di rischio e di progressione sia delle patologie renali non diabetiche (426) che delle fasi iniziali (nefropatia incipiente) (135) o di quelle più avanzate della nefropatia diabetica (202). Circa il 50% della variabilità dei livelli plasmatici del colesterolo è dovuta a differenze genetiche; circa il 16% della variabilità genetica dei livelli di colesterolo LDL è espressione di differenze alleliche a livello del gene che codifica per la apoliproteinaE (ApoE). Il gene dell’ApoE è stato oggetto di studi, relativamente numerosi, sia nel diabete tipo 1 che nel diabete tipo 2, soprattutto in relazione alla nefropatia diabetica, ma i risultati di tali studi non sono stati del tutto univoci (pagine 22 e 23) nell’individuare nell’allale
ε
2 un fattore di rischio importante per lo sviluppo della nefropatia diabetica. Recentemente il ruolo dell’allele ε2 del polimorfismo di apoE quale fattore sia di induzione che di progressione della nefropatia diabetica è stato confermato in uno in uno studio prospettico condotto in una popolazione giapponese con diabete tipo 2 (427).Durante il follow-up (4.4±10 anni), 31 dei 429 soggetti progredirono: 21 da normo- a microalbuminuria, 10 da microalbuminuria a nefropatia conclamata. La progressione era segnalata in 8 dei 42 portatori dell’allele ε2 (19%) ed in 23 dei 387 non portatori dell’allele ε2 (6%) con un rischio relativo pari a 3.2 (2.7 nei progressors a microalbuminuria, 4.2 nei progressors a nefropatia conclamata).
Il primo obiettivo del nostro studio è stato quindi quello di rivalutare in un'ampia coorte di pazienti con diabete tipo 2, mediante uno studio di associazione caso-controllo, la relazione tra complicanze microvascolari (nefropatia e retinopatia) e macroangiopatiche e polimorfismi ε2- ε3 -ε4 del gene dell’ apolipoproteinaE.
Nella stessa coorte, inoltre, sono state indagate eventuali differenze genotipo-correlate del profilo lipidico e, soprattutto delle concentrazioni plasmatiche delle LDL-ossidate. Le LDL-ossidate (ox LDL) rappresentano un fattore patogenetico causale nello sviluppo e nella progressione del processo aterosclerotico (87). Le LDL-ossidate sono state individuate non solo a livello della placca aterosclerotica, ma anche a livello delle lesioni glomerulosclerotiche. In entrambe le sedi esse agiscono come chemoattrattanti, contribuendo al reclutamento ed all’attivazione dei macrofagi. Le LDL-ossidate sono un potente stimolo capace di indurre danno ossidativo, sintesi di fibronectina a livello delle cellule mesangiali e proliferazione/espansione della matrice extracellulare del glomerulo.
Un altro obiettivo del nostro studio è stato quindi quello di verificare se un aumento della concentrazione delle LDL–ossidate è presente in pazienti con diabete tipo 2 e differenti livelli di escrezione urinaria di albumina.
L’ossidazione delle LDL è inibita dalle lipoproteine ad alta densità (HDL) che trasportano una proteina anti-ossidante, la paraoxonasi (PON-1), capace di deossidare fosfolipidi ossidati biologicamente attivi (428). Numerosi meccanismi sono stati proposti per spiegare le proprietà antiaterogene delle HDL. Tra questi, quello basato sull’attività della PON 1 ha suscitato particolare interesse. La PON 1 è una esterasi calcio-dipendente che è legata esclusivamente alla frazione delle HDL che trasporta la apolipoproteina A1. Studi in vitro dimostrano che PON 1 previene l’accumulo di lipoproteine ossidate a livello delle LDL. Inoltre, la PON 1 associata alle HDL è capace di distruggere i fosfolipidi ossidati delle LDL modificate, inibendo così l’azione proinfiammatoria delle LDL (429).
Terzo obiettivo del nostro studio è stato quindi quello di misurare, in ampio sottogruppo della popolazione con diabete tipo 2 che è stata reclutata, l’attività della PON 1 e di valutare la distribuzione di due polimorfismi della paraoxonasi in rapporto alla presenza o assenza delle complicanze micro- e macrovascolari del diabete. Sono state infine indagate l’associazione tra polimorfismi genici ed attività nonché i rapporti tra attività della PON 1 e profilo lipidico compresi i livelli plasmatici delle LDL-ossidate.
A
A
A
p
p
p
o
o
o
l
l
l
i
i
i
p
p
p
o
o
o
p
p
p
r
r
r
o
o
o
t
t
t
e
e
e
i
i
i
n
n
n
a
a
a
E
E
E
(
(
(
A
A
A
p
p
p
o
o
o
E
E
E
)
)
)
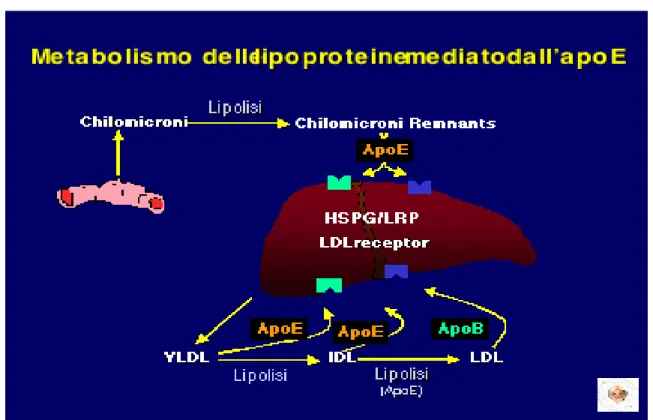
L’Apolipoproteina E (tipo E), è una glicoproteina di 34000 p.m., costituita nella sua forma matura da 299 aminoacidi. Essa é sintetizzata principalmente nel fegato e nel sistema nervoso, ma anche nei surreni, nelle gonadi, nei reni, nel muscolo striato e nella milza. L’ApoE rappresenta un importante costituente strutturale di alcune lipoproteine plasmatiche quali i chilomicroni, le lipoproteine a densità molto bassa (VLDL), le lipoproteine a densità elevata (HDL). Inoltre, insieme all’ApoB, l’ApoE costituisce la parte proteica delle lipoproteine a bassa densità (LDL). Tramite la sua interazione con i recettori delle LDL, l’ApoE svolge un ruolo chiave nell’internalizzazione e nel catabolismo delle lipoproteine plasmatiche (430) (figura 14).
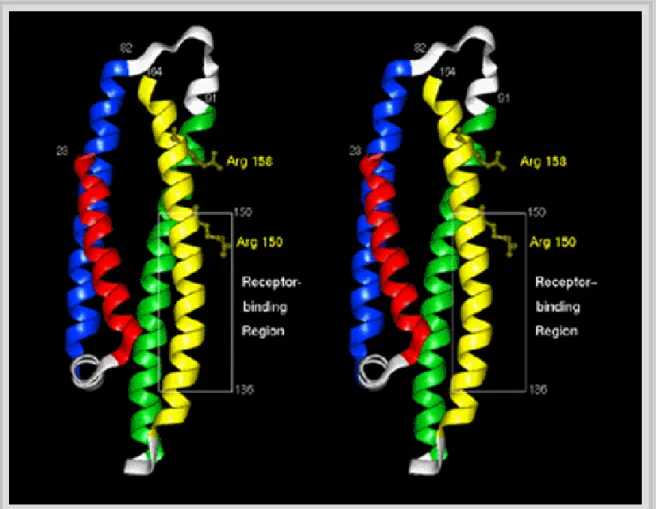
L’Apolipoproteina E é caratterizzata da due domini funzionali che possono essere separati in presenza di trombina: un frammento di 22 kDa, localizzato all'estremità aminoterminale della proteina, che contiene il dominio legante il recettore nella regione aminoacidica da 136 a 150, e un frammento di 10 kDa all'estremità carbossiterminale della proteina, contenente il dominio legante i lipidi. Il dominio di 22 kDa, caratterizzato da 4 α eliche, contiene gli aminoacidi che differenziano le isoforme dell'ApoE (431).
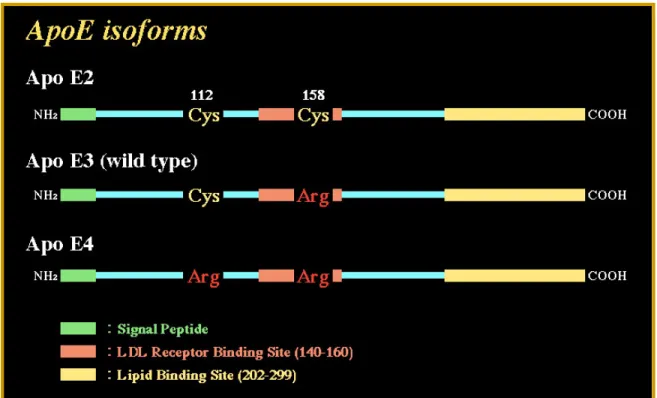
Il gene strutturale dell’ApoE, formato da 4 esoni e 3 introni, localizzato sulla porzione prossimale del braccio lungo del cromosoma 19, è polimorfico e codifica per 3 isoforme dell’ApoE (E2, E3, E4) (figura 15), con 3 diversi alleli (ε2, ε3, ε4) che producono 3 genotipi omozigoti (ε2/ε2, ε3/ε3, ε4/ε4) e 3 eterozigoti (ε2/ε3, ε2/ε4, ε3/ε4).
Figura 15 - Variazioni aminoacidiche e differenti isoforme dell'ApoE.
Queste isoforme descrivono la sostituzione aminoacidica a livello dei residui 112 (E3Cys/E4Arg) e 158 (E3Arg/E2Cys), corrispondenti alla sostituzione di una singola base T per C o viceversa nella sequenza del gene. Le isoforme si possono separare mediante isoelettrofocusing. L'ApoE2 e l’ApoE3 legano preferenzialmente le HDL, l’ApoE4 le VLDL.
Il legame del recettore delle LDL è isoforma specifico: ApoE3, che rappresenta l'isoforma wild type (Cys-112, Arg-158), lega il recettore per le LDL con alta affinità; Apo E4, un'isoforma mutata (Arg-112, Arg-158), lega il recettore con più alta affinità; ApoE2, l'altra isoforma mutata (Cys-112, Cys-158), presenta un'affinità di legame per il recettore delle LDL 100 volte inferiore a quella delle isoforme ApoE3 e ApoE4 (432) (figura 16).
Il legame dell'ApoE alla famiglia dei recettori per le LDL richiede la presenza di aminoacidi, quali lisina e arginina, nel dominio 136-150 dell'ApoE. Una carica elettrostatica positiva e non un aminoacido specifico è richiesta per il legame dell’ApoE al recettore. Inoltre una α elica anfipatica è critica per il legame con il recettore (433). Il microambiente creato dalle lisine nel dominio N-terminale è modificato dal legame con la componente lipidica. È stato dimostrato che l'ApoE associata ai lipidi presenta una esposizione ed un potenziale elettrostatico maggiore, spiegando così perché l'associazione con la componente lipidica è richiesta per il legame ad alta affinità con il recettore delle LDL (434).
Nel Framingham Offspring Study, le frequenze degli alleli ε2, ε3 e ε4 erano rispettivamente pari a 8%, 78% e 14% (435). Corbo e coll. (436) hanno esaminato le frequenze alleliche del polimorfismo della ApoE in popolazioni diverse; in tutte le popolazioni studiate l’allele ε3 è il più frequente e la sua prevalenza è inversamente correlata con quella dell’allele ε4. L’allele ε4 promuove l’assorbimento intestinale del colesterolo e i portatori di questo allele potrebbero essere stati avvantaggiati in condizioni di carestia.
Come già ricordato, circa il 50% della variabilità dei livelli plasmatici di colesterolo è dovuto a differenze genetiche individuali. Circa il 16% della variabilità genetica delle concentrazioni del colesterolo LDL è legata a differenze alleliche a livello del locus genico dell’ApoE. L’omozigosi per l’allele ε2 predispone allo sviluppo di dislipidemia di tipo III. Questa dislipidemia è caratterizzata da un difettoso legame di ApoE al recettore per le LDL a cui conseguono una rallentata clearance delle lipoproteine ricche in trigliceridi ed un aumento dei livelli plasmatici dei trigliceridi a digiuno ed in fase post-prandiale. Inoltre, l’allele ε2 è strettamente associato con lo sviluppo di una rara forma di glomerulopatia da lipoproteine (437). I portatori dell’allele ε4 presentano più elevate concentrazioni plasmatiche di colesterolo totale ed LDL rispetto ai portatori dell’allele ε2 e agli omozigoti per ε3. ApoE4 è un importante fattore di rischio per la malattia di Alzheimer (438) e un fattore di rischio moderato per la cardiopatia ischemica (347, 430), sia nella popolazione generale che nei soggetti con diabete mellito. In particolare, nel diabete tipo 1, il polimorfismo della ApoE sembra accelerare lo sviluppo di coronaropatia nei soggetti con nefropatia conclamata (439). La coronaropatia era infatti più frequente (36%) nei diabetici tipo 1 con nefropatia portatori dell’allele ε4 rispetto ai nefropatici omozigoti per l’ε3 (12%, p<0.001) (439). Questo risultato è in accordo con l’osservazione di uno studio precedente in soggetti con diabete tipo 2 (440), in cui la prevalenza di cardiopatia ischemica era più alta nei portatori dell’allele ε4 (81%) rispetto a quella dei soggetti con fenotipo E3/E3 (58%) o a quella dei portatori dell’allele ε2 (53%; p=0.011). Altri studi hanno invece rilevato una associazione fra ApoE2 e malattia renale (441a, 441b). Una stretta associazione tra presenza dell’allele ε2 e rischio di sviluppare nefropatia è stata descritta in coorti di pazienti con diabete tipo 1 (353, 442). I risultati ottenuti da Kimura e coll. (349) indicano invece che il polimorfismo dell’ApoE è associato con la progressione della nefropatia diabetica in pazienti con diabete tipo 2.
La presenza dell’allele ε4 sembra invece ritardare la progressione della nefropatia diabetica verso le fasi più avanzate svolgendo quindi un ruolo come possibile fattore protettivo. Nel complesso, relativamente numerosi sono gli studi caso-controllo che hanno esaminato l’associazione tra polimorfismo dell’ApoE e prevalenza della nefropatia diabetica nel diabete tipo 1 e nel tipo 2, ma i risultati di questi studi rimangono eterogenei ed inconclusivi (348, 349, 350, 353, 442, 443a, 443b).
Paraoxonasi 1 (PON 1)
La famiglia dei geni codificanti la paraoxonasi (PON) è costituita da tre geni, localizzati nell’uomo sul braccio lungo del cromosoma 7 tra Q21.3 e 22.1:
1. il gene PON1 che codifica per paraoxonasi 1 (PON 1), 2. il gene PON2 che codifica per paraoxonasi 2 (PON2 ), 3. il gene PON3 che codifica per paraoxonasi 3 (PON3 ).
I tre geni hanno una struttura simile e sembrano derivare da una duplicazione di un precursore comune. La paraoxonase sierica umana (PON1), una proteina di 335 aminoacidi, ha una massa molecolare di 43-45 kDa e contiene fino a tre catene di carboidrati.
All’interno di ciascuna specie di mammiferi PON 1, 2 e 3 mostrano una identità del 60-70% a livello aminoacidico e nucleotidico; tra le diverse specie di mammiferi i tre geni mostrano una identità di circa il 90% a livello aminoacidico ed una identità di 81-91% a livello nucleotidico. L’alto grado di conservazione suggerisce un importante ruolo metabolico per l’enzima (444, 445). Il codone 106 (lisina), presente in PON 1, manca in tutti i cDNA di PON 2 e PON 3 sequenziati fino ad oggi. Vicino al gene PON 1 c’è il gene che codifica per una delle piruvato deidrogenasi chinasi e questo potrebbe spiegare il linkage dei genotipi di PON1 con la concentrazione plasmatica del glucosio riportata nei non diabetici (446) e con il controllo glicemico riportato in alcuni studi su popolazioni di pazienti con diabete tipo 2 (447, 448). PON 1 è associata con l’apolipoproteina A1 e con l’apo J nelle lipoproteine ad alta densità (HDL) (449) e sembra in grado di ridurre la suscettibilità delle LDL alla perossidazione (450).
Questa proprietà spiega almeno in parte la capacità delle HDL di proteggere le LDL dall’eccesso di ossidazione, un processo che le rende particolarmante aterogene. La conformazione della paraoxonasi nell’ambiente idrofobico delle HDL può essere cruciale per l’attività; le HDL dei diabetici hanno una composizione alterata che può disturbare l’efficienza del legame della PON alle HDL.
Il gene che codifica PON 1 presenta due comuni siti polimorfici nella regione codificente: Leu-Met (L/M) in posizione 55 della sequenza aminoacidica e Gln-Arg (Q/R) in posizione 192. Comuni polimorfismi del gene che codifica PON 2 sono una sostituzione del nucleotide G con C (Cys 311Ser) nell’esone 9 ed una sostituzione di C con G (Ala148Gli) nell’esone 5. La sostituzione aminoacidica alla posizione 192 porta a due alloenzimi: alloenzima A (Gln192), a bassa attività, e alloenzima B (Arg192) ad alta attività. Inizialmente è stato riportato che il polimorfismo PON 1-55 non ha effetti sulla attività della paraoxonasi (451a); successivamente è stato dimostrato che tale polimorfismo modifica l’attività di PON 1 sia in una popolazione con diabete tipo 1 (451b), che tipo 2 (452a, 452b) che in una popolazione non diabetica (453). Studi epidemiologici hanno mostrato che i polimorfismi di PON 1 sono correlati con variazioni nei livelli delle lipoproeteine plasmatiche (454). La isoforma B (Arg192) del polimorfismo Gln192Arg rappresenta un fattore di rischio indipendente di patologia cardiovascolare e coronarica nel diabete tipo 2 (380, 382). Nello studio di Ruiz e coll. (380), l’odds ratio associato all’omozigosi per l’allele B era pari a 2.5, mentre quello associato all’eterozigosi era pari a 1.6, suggerendo un effetto codominante dell’allele. Nello studio di Pfohl e coll. (381), l’allele B (Arg 192) è associato con l’estensione angiografica della coronaropatia, ma non con l’incidenza di infarto del miocardio. L’odds ratio per la presenza di arteriopatia coronarica è risultato pari a 1.78 (p=0.072) nei portatori di almeno un allele Arg192 rispetto ai soggetti con genotipo Gln/Gln.
In particolare, tra i fumatori e gli ex-fumatori, i portatori di Arg192 presentano un odds ratio per arteriopatia coronarica pari a 3.58 (381). Diabetici tipo 2 di origine giapponese portatori dell’allele B presentano un aumentato rischio di patologia coronarica (odds ratio = 8.8 in regressione logistica multivariata) (383). D’altra parte, nessuna associazione è stata rilevata tra spessore dell’intima-media a livello carotideo e polimorfismo Glu-Arg 192 del gene PON 1 (384).
Infine, anche un polimorfismo sulla regione promoter (T-107C) del gene della PON 1 è risultato un fattore di rischio per patologia coronarica nel diabete tipo 2: il genotipo TT (low-expressor) è risultato associato con ridotte concentrazioni di PON ed iper-rappresentato in diabetici tipo 2 con coronaropatia indipendentemente sia dalla presenza di altri fattori di rischio che dalla coesistenza dell’allele Arg 192 della regione codificante (385). In un primo studio dedicato alle complicanze microvascolari del diabete nessuna associazione è stata osservata tra polimorfismo Gln-Arg 192 e nefropatia sia nel diabete tipo 1 che nel diabete tipo 2 (365) sebbene basse attività della paraoxonasi siano state descritte sia in diabetici tipo 2 con retinopatia (448, 455) che in diabetici tipo 2 con proteinuria (455). Tuttavia, studi più recenti hanno mostrato una associazione tra variante Leu55 (genotipo LL) del polimorfismo Met-Leu 55 di PON 1 e retinopatia diabetica nel diabete tipo 1 (456) e tra polimorfismi di PON 2 (Ala148Gly e Cys311Ser) e nefropatia nel diabete tipo 2. Nessuna associazione è stata invece descritta tra nefropatia e polimorfismi di PON 1 (Arg-Gln 192 e Met-Leu 55) (389). Nello studio di Kao e coll. (457) realizzato nel diabete tipo 1, PON 1 Leu/Leu aumenta il rischio di retinopatia, mentre PON 2 Ser/Ser aumenta il rischio di microalbuminuria. In accordo, Araki e coll. (391) non hanno rilevato alcuna associazione tra polimorfismi di PON 1 (Arg-Gln 192, Met-Leu 55 e T-107C) e nefropatia diabetica nel diabete tipo 1.
A
A
A
t
t
t
t
t
t
i
i
i
v
v
v
i
i
i
t
t
t
à
à
à
d
d
d
e
e
e
l
l
l
l
l
l
a
a
a
p
p
p
a
a
a
r
r
r
a
a
a
o
o
o
x
x
x
o
o
o
n
n
n
a
a
a
s
s
s
i
i
i
1
1
1
(
(
(
P
P
P
O
O
O
N
N
N
1
1
1
)
)
)
Accanto allo studio del genotipo, risulta di interesse l'analisi dell'attività della PON. La paraoxonasi sierica umana è una esterasi Ca2+
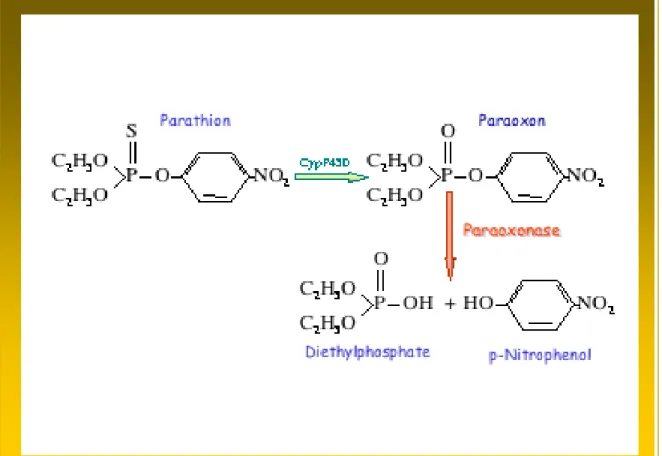
dipendente (aryldialkilfosfatasi [E.C.3.1.8.1]) che idrolizza organofosfati, quali paraoxon, diazoxon, sarin e soman, e arilesteri, come fenilacetato (458). Il paraoxon è un substrato non fisiologico: parathion, un organofosfato, è convertito in una specie attiva, il paraoxon, dal sistema microsomiale del citocromo P450 del fegato e di altri tessuti (figura 17).
Figura 17 - Idrolisi enzimatica del paraoxon.
In passato, PON1 ha ricevuto grande attenzione perché è l'enzima presente nel siero dei mammiferi responsabile per la resistenza alla tossicità degli organofosfati (459): esso infatti idrolizza gli insetticidi organofosfati e i gas nervini.
PON1, per la stabilità e per l'attività, richiede Ca2+ (458); l'EDTA, un chelante del Ca2+, è un
potente inibitore di PON1. L'attività di PON1 non deve perciò essere misurata su plasma. Sebbene i substrati naturali per PON1 non siano noti, recenti studi suggeriscono che PON previene l'ossidazione delle LDL idrolizzando i perossidi lipidici nelle lipoproteine (429, 460, 461, 462). Conseguentemente, la diminuzione dei livelli circolanti di PON1 dovrebbe favorire la modificazione ossidativa delle lipoproteine.
L'attività di PON1 associata alle HDL è correlata con la densità, la dimensione e la composizione delle HDL. Valabhji e coll. (463) hanno osservato che nel diabete tipo 1 e nei soggetti sani di controllo le HDL con dimensioni più piccole (e quindi con un più alto rapporto tra i fosfolipidi, i principali costituenti lipidici di superficie, ed il colesterolo esterificato, principale costituente del core) sono associate con una aumentata attività di PON.
La cisteina in posizione 283 è indispensabile per proteggere le LDL dall'ossidazione (464). La glicosilazione non è necessaria per l'attività antiossidante di PON1, ma è necessaria per l'attività di arilesterasi (465). Per una attività ottimale di PON1 è necessario l'assemblaggio dell'enzima sulle HDL nascenti; la regione N-terminale di ApoA1 sembra essere importante in questo processo (466). La iper-espressione di PON1 inibisce la formazione di idroperossidi lipidici sulle HDL e protegge l'integrità e la funzione delle HDL (467). I fosfolipidi ossidati sulle LDL minimamente ossidate agiscono diminuendo l'espressione di PON1 ed aumentano l'espressione di ApoJ attraverso l’interleuchina 6 (IL-6) (468). Alcuni studi hanno riportato che l'attività di PON è ridotta nel diabete mellito (469, 470, 448, 471) e ancora più bassa in pazienti con neuropatia diabetica (469, 471), nefropatia (455) e retinopatia (455, 448). Una diminuzione dell'attività è stata osservata nel diabete sperimentale indotto da streptozotocina (472). Inoltre una ridotta attività è stata descritta in soggetti che hanno avuto un infarto del miocardio (473).
Abbott CA e coll. (469) hanno osservato che la bassa attività sierica di PON1 nel diabete tipo 1 e nel tipo 2 è causata da una bassa attività specifica della PON e che questo effetto è più marcato in soggetti con neuropatia periferica clinicamente evidente.
Sözmen e coll. (474), valutando l'attività di enzimi antiossidanti, tra i quali la paraoxonasi, in pazienti diabetici con e senza complicanze, hanno osservato che l'attività di PON era diminuita anche in assenza di complicanze, confermando i risultati dello studio di Mackness e coll. (460) e di Inoue e coll. (475), che hanno dimostrato una diminuzione dell'attività di PON legata al diabete di per se.
Nello studio di Boemi e coll. (476) l'attività e la concentrazione della paraoxonasi sono risultate basse, indipendentemente dal genotipo, sia in diabetici di tipo 1 che nei loro parenti di primo grado non diabetici.
Mackness B e coll. (477) hanno osservato che nel diabete tipo 1 l'attività e la concentrazione di PON sono più basse indipendentemente dai polimorfismi PON1-55 e PON1-192; inoltre questi autori hanno osservato un'aumentata frequenza dell'allele Q di PON1-192 in associazione con la presenza di una o più complicanze.
Nello studio di Letellier e coll. (478) l'attività di PON è risultata minore nei diabetici tipo 2 rispetto ai controlli (p<0.001) e tra i diabetici è risultata ancora minore nei soggetti con complicanze vascolari; la frequenza dell'allele Q di PON1-192 (Arg 192) è risultata significativamente più alta (p<0.005) nei diabetici tipo 2, siano essi con o senza complicanze. Considerando il ruolo antiaterogenico di PON, è stato ipotizzato che la diminuzione dell'attività della paraoxonasi potrebbe promuovere il danno micro- e macrovascolare del diabete. Kopprash e coll. (479) hanno osservato che l'attività di PON non è alterata in soggetti con ridotta tolleranza al glucosio e diabete di nuova diagnosi quando confrontata con i soggetti con normale tolleranza al glucosio e che le variazioni dell'attività sierica di PON1 non correlano con i livelli delle LDL-ox, almeno nel diabete di nuova diagnosi. Gli autori suggeriscono che la perdita dell'attività di PON1 non sia un evento iniziale, ma si sviluppi in stadi tardivi del diabete, come risultato a lungo termine di modificazioni ormonali e metaboliche. Sono possibili numerose spiegazioni per i cambiamenti dell'attività della paraoxonasi associati al diabete. I cambiamenti conformazionali dell'enzima, come risultato dei processi di glicosilazione e/o lipossidazione, potrebbero modificarne l'attività. La paraoxonasi è legata ai lipidi delle HDL attraverso l'estremità N-terminale ed è legata all'ApoA1.
Le HDL nei diabetici hanno una composizione alterata (480) ed è possibile che questo comprometta il legame della PON alle HDL portando a cambiamenti conformazionali nella PON o nella regione idrofobica delle HDL a livello della quale la PON è attiva. Ci sono evidenze che le alterazioni nella composizione delle HDL possono modificare il legame dell'ApoA1 alla particella lipoproteica (481).
I cambiamenti nelle proprietà fisico chimiche delle HDL o nel metabolismo delle HDL potrebbero influenzare l'attività di PON1. La perdita della stretta correlazione tra la concentrazione della PON e la concentrazione dell'ApoA1 potrebbe essere espressione della difettosa interazione tra PON e HDL (469).
Recentemente, è stato suggerito che la riduzione delle dimensioni e l'accumulo di colesterolo non esterificato nelle HDL possono alterare la capacità delle HDL di favorire il rilascio di PON1 e di stabilizzare l'enzima. Anche altri meccanismi possono entrare in gioco (482). Deakin e coll., a differenza di quanto descritto da Kopprash e coll. (479), riportano che l’attività di PON è significativamente ridotta sia nei soggetti con alterata tolleranza al glucosio che nei diabetici.
L
L
LD
D
DL
L
L
o
o
o
s
s
s
s
s
s
i
i
i
d
da
d
a
a
t
t
t
e
e
e
:
:
:
q
q
qu
u
ua
a
a
l
l
l
e
e
e
r
r
ru
u
uo
o
ol
l
lo
o
o
n
ne
n
e
e
l
l
l
l
la
l
a
a
p
p
p
a
a
a
t
to
t
o
og
g
g
e
e
e
n
ne
n
e
e
s
si
s
i
i
d
de
d
e
e
l
ll
l
l
l
e
e
e
c
c
co
o
o
m
m
m
p
pl
p
l
li
i
i
c
c
c
a
a
a
n
nz
n
z
z
e
e
e
d
de
d
e
el
l
l
d
d
di
i
ia
a
a
b
be
b
e
e
t
te
t
e
e
Nel diabete di lunga durata, la lesione glomerulare è caratterizzata da un aumento della matrice mesangiale. Le cellule mesangiali giocano un ruolo chiave nella patogenesi della glomerulosclerosi (484). Le analogie nella patogenesi della glomerulosclerosi e dell’aterosclerosi (485) suggeriscono che l’iperlipidemia può essere direttamente coinvolta nello sviluppo della glomerulosclerosi (426, 486) e della nefropatia diabetica (193, 487). L’ipotesi è confermata da studi controllati, piccoli ma numerosi, che dimostrano come la riduzione dei lipidi plasmatici possa preservare la filtrazione glomerulare e ridurre la proteinuria e l’albuminuria (488). Le LDL ossidate sono un potente stimolo capace di indurre danno ossidativo a livello delle cellule mesangiali di glomeruli di ratto sia in vitro che in vivo (489) attraverso la generazione di radicali liberi dell’ossigeno.
Inoltre, le LDL ossidate agiscono stimolando la sintesi di fibronectina, un’importante componente proteica della matrice extracellulare, ad opera delle cellule mesangiali (490, 491).
Chen e coll. dimostrano che insulina ed eparina sopprimono la iperproduzione di radicale superossido indotta dalle LDL ossidate in glomeruli di ratti diabetici (492). Infine, il trattamento con gli inibitori della idrossi-metil-glutaril-CoA reduttasi (statine), indipendentemente dagli effetti ipocolesterolemizzanti, previene la proliferazione delle cellule mesangiali (493), inibisce la produzione di anione superossido e di fibronectina e riduce la espressione dell’mRNA per la fibronectina in cellule mesangiali del glomerulo esposte ad elevato glucosio ed elevate LDL ossidate (494), una condizione simile a quella del diabete con associata iperlipidemia. Infatti, i livelli plasmatici delle LDL ossidate sono stati riportati elevati nei pazienti con diabete mellito (495, 496). La dislipidemia del diabete tipo 2 è caratterizzata da aumento dei livelli dei trigliceridi e riduzione della concentrazione del colesterolo HDL (480). L’ipertrigliceridemia è anche comune nel diabete tipo 1, ma il colesterolo HDL è spesso normale o anche elevato a meno che il controllo della glicemia sia particolarmente cattivo o coesista la nefropatia diabetica (189). Colesterolemia totale e LDL sono simili a quelle della popolazione non-diabetica. I livelli degli acidi grassi non esterificati (NEFA) sono aumentati perché in molti pazienti la massa del tessuto adiposo da cui i NEFA sono rilasciati, particolarmente la massa del tessuto adiposo metabolicamente attivo, a distribuzione centrale, è tendenzialmente aumentata.
Inoltre, la lipasi intracellulare presente nel tessuto adiposo, la lipasi ormono-sensibile, è attivata dalla carenza di insulina o dalla insulino-resistenza. Ne consegue un aumento della liberazione di NEFA dai trigliceridi immagazzinati nel tessuto adiposo.
L’aumento di NEFA circolanti stimola la produzione epatica dei trigliceridi. La produzione epatica di trigliceridi sotto forma di VLDL è regolata ed inibita dall’insulina attraverso un meccanismo fisiologico probabilmente finalizzato a controllare l’aumento post-prandiale della trigliceridemia. I chilomicroni provenienti dall’assorbimento intestinale competono infatti con le VLDL epatiche per i processi di clearance. Nel diabete, tuttavia, la carenza di insulina e/o l’insulino-resistenza impediscono la normale soppressione della sintesi epatica delle VLDL (480). Il diabete è inoltre caratterizzato da un rallentato catabolismo delle VLDL circolanti, un processo regolato dalla lipoprotein-lipasi localizzata a livello dell’endotelio vascolare del tessuto adiposo e del muscolo scheletrico. Questo enzima è regolato dall’insulina in maniera opposta rispetto alla lipasi intracellulare ormono-sensibile; esso è cioè attivato dall’insulina.
In condizioni di carenza di insulina e/o di insulino-resistenza, la sua attività è ridotta e questa riduzione concorre all’ipertrigliceridemia.
In conclusione, l’insulino-resistenza comporta un aumento della lipolisi con aumentato afflusso di NEFA al fegato associato ad una minore inibizione della produzione delle VLDL che si arricchiscono in trigliceridi e permangono più a lungo in circolo a causa della ridotta idrolisi da parte della lipasi lipoproteica. Durante l’assorbimento del pasto, i chilomicroni competono con le VLDL per l’idrolisi, per cui l’ipertrigliceridemia a digiuno si associa ad ipertrigliceridemia post-prandiale. La presenza in circolo di VLDL ricche in trigliceridi e di un ampio pool di VLDL promuove lo scambio di particelle lipidiche tra VLDL da un lato e HDL e LDL dall’altro. Questo scambio è mediato dalla CEPT (cholesteryl ester transfer protein). Le VLDL cedono i trigliceridi ed accettano il colesterolo con formazione di HDL e di LDL deplete in esteri del colesterolo e ricche in trigliceridi. Queste lipoproteine rappresentano un substrato ottimale per la lipasi epatica che catabolizza le HDL ricche in trigliceridi e idrolizza le LDL. Ne conseguono una ridotta concentrazione plasmatica di HDL e la formazione di LDL piccole e dense (480). Concentrazioni di trigliceridi superiori a 130 mg/dl rappresentano verosimilmente la soglia per la transizione delle LDL dal pattern A (prevalenza di LDL di diametro >25.5 nm) al pattern B (prevalenza di LDL di diametro <25.5 nm). E’ interessante osservare, come nel Paris Prospective Study, il 72% dei diabetici tipo 2 che moriva per infarto del miocardio aveva una trigliceridemia superiore a 132 mg/dl.
La dislipidemia diabetica si caratterizza pertanto per la presenza della triade aterogena: ipertrigliceridemia, ridotto colesterolo HDL ed aumento delle LDL piccole e dense. Questa dislipidemia è presente già molti anni prima della comparsa dell’iperlipidemia e concorre a spiegare l’aterosclerosi precoce ed aggressiva che precede ed accompagna la comparsa del diabete. La particolare aggressività aterogenetica è dovuta al diminuito trasporto inverso del colesterolo e alla facilità con cui le LDL piccole e dense attraversano l’endotelio e vanno incontro ad ossidazione. E’ verosimile che la glicosilazione delle HDL comprometta ulteriormente il trasporto inverso del colesterolo e che la glicosilazione delle LDL faciliti ulteriormente la loro ossidazione (480).
L’aumentata ossidazione delle LDL è associata alla malattia coronarica e il valore delle LDL ossidate quale fattore predittivo di eventi cardiaci è additivo al “Global Risk Assessment Score” per la predizione del rischio cardiovascolare basato sull’età, il sesso, il colesterolo totale ed HDL, il diabete, l’ipertensione ed il fumo di sigaretta (497). LDL ossidate ed HDL sono antagonisti nel processo steno-trombotico e nello sviluppo delle patologie cardiovascolari (498). Le LDL ossidate inducono il processo aterosclerotico attivando le cellule endoteliali, stimolando la infiltrazione dei monociti nell’intima della parete vascolare, sostenendo la migrazione e la proliferazione delle cellule muscolari lisce, alterando la vasoreattività della parete vascolare. Esse contribuiscono alla aterotrombosi attraverso la apoptosi delle cellule endoteliali e la espansione/erosione della placca, alterando l’omeostasi anticoagulatoria della superficie endoteliale, stimolando la produzione di fattore tissutale da parte delle cellule muscolari lisce e inducendo l’apoptosi dei macrofagi. Le HDL tendono a contrastare l’effetto stimolatorio delle LDL ossidate sulla infiltrazione dei monociti. La paraoxonasi, enzima associato alle HDL, previene e inibisce l’ossidazione delle LDL e rende le HDL stesse resistenti alla ossidazione, mantenendo la capacità delle HDL di indurre il trasporto inverso del colesterolo. Altri enzimi associati alle HDL, quali LCAT (lecithin cholesterol acyltransferase) e la PAF-AH (platelet-activating factor acetylhydrolase) prevengono l’accumularsi di lipidi ossidati nelle LDL. Le LDL ossidate, d’altra parte, inibiscono tutte queste attività enzimatiche (498a). Le LDL ossidate sono verosimilmente il principale trigger per l’attivazione del processo infiammatorio e l’induzione della disfunzione endoteliale a livello della parete vascolare. Molto probabilmente sono anche, insieme all’iperglicemia, un fattore di rischio maggiore nello sviluppo delle complicanze vascolari (498b) e nella progressione della nefropatia diabetica. Le LDL ossidate, come già discusso, giocano con ogni probabilità un ruolo importante nelle alterazioni mesangiali caratteristiche della glomerulopatia diabetica. L’anione superossido è il principale radicale libero dell’ossigeno implicato nella patogenesi della nefropatia diabetica e una aumentata attività dei radicali liberi è stata descritta sia nel plasma che nelle urine dei pazienti diabetici con danno renale. Gli anioni superossido non solo inducono perossidazione lipidica, ma causano anche un aumento della formazione delle LDL ossidate con conseguente ulteriore insulto glomerulare.
Recentemente è stato suggerito che il trattamento in vitro di vasi di animali normocolesterolemici con LDL ossidate mima “farmacologicamente” la disfunzione endoteliale osservata nei vasi di animali cronicamente iperlipidemici ed aterosclerotici. In particolare, Jiang e coll. (499) hanno recentemente osservato che l’effetto delle LDL ossidate nell’aorta isolata di ratto in termini di induzione della disfunzione endoteliale NO-dipendente (500, 501) è simile a quanto spontaneamente osservato nel topo knockout per il gene dell’apolipoproteina E (ApoE -/-). Questo modello sperimentale, in cui manca il gene che codifica per l’ApoE, sviluppa una dislipidemia e un processo aterosclerotico strettamente simili a quelli descritti nell’uomo (502).