CAPITOLO I
L’ELETTROMIOGRAFIA.
1.1 CENNI STORICI E GENERALITÀ.
Per elettromiografia (EMG) s’intende classicamente la disciplina che studia la funzione muscolare in base alla misura dei potenziali elettrici che scaturiscono dalla contrazione del muscolo. La definizione moderna più corretta è, tuttavia, quella che intende l’elettromiografia come l’insieme delle tecniche di rilevazione, elaborazione ed impiego del segnale mioelettrico. Tale segnale è molto complesso, in quanto dipende da proprietà anatomiche, fisiologiche dei muscoli e dallo stato del sistema nervoso, il fine regista e coordinatore dell’attività muscolare. L’elettromiografia abbraccia un campo molto vasto di studi applicativi e di base, di ordine semeiologico, diagnostico funzionale e fisiopatologico. Essa ha preso le mosse attingendo alle più diverse branche delle neuroscienze e si è sviluppata nelle più diverse discipline neuromediche. Volendone tracciare un excursus storico, non ci si può che limitare a pochi cenni, lasciando agli appassionati un maggiore approfondimento. I primi cenni all'esistenza di un collegamento tra attività elettrica e contrazione muscolare si ritrovano negli studi, risalenti al 1666, di Francesco Redi, accademico della Crusca, medico, naturalista e letterato, alla corte dei Medici nel diciassettesimo secolo, ma è al fisico e neurofisiologo Carlo Matteucci, ben due secoli più tardi, ossia nel 1844, che se ne deve una spiegazione ed una prova. A pochi anni più tardi, nel 1849, risale la prima registrazione di un segnale mioelettrico cutaneo mediante un primitivo tipo di galvanometro, per opera del francese Dubois Raymond, seguita da altre effettuate nel 1907 dal tedesco Piper. Kasser ed Erlanger, nel 1922, sono invece i primi a visualizzare un segnale EMG su di uno schermo oscillografico, servendosi di uno dei primi esemplari di tubo a raggi catodici. Le interpretazioni che essi diedero di tale attività elettrica valse loro il conferimento del premio Nobel nel 1944. L’EMG assume la sua veste definitiva con Eric Kugelberg al Karolinska di Stoccolma nel 1940, grazie anche alla collaborazione di un allievo della scuola di Berlino operante a Copenhagen, Fritz Buchthal: il segnale elettromiografico diviene strumento di indagine sulle condizioni del sistema neuro muscolare. Negli anni 1942-44 avviene la costruzione del primo elettromiografo per mano del dottor Herbert Jasper alla Mc Gill University (Montreal Neurological Institute). Nel 1944, Hinnan pubblica uno studio clinico riferendo i risultati di una ricerca sui muscoli della spalla, si tratta del primo studio clinico universalmente riconosciuto in campo elettromiografico. Con il passare del tempo, il progresso dell’elettronica ha consentito sempre più a neurologi, chinesiologi ed ortopedici di fare dell'elettromiografia un esame di routine, seppure tanta strada resti ancora da percorrere. Con l’introduzione di elettrodi ad ago e cutanei sono andati sviluppandosi parallelamente lo studio sui “potenziali d'azione di unità motoria”, per una diagnosi di patologia neuro muscolare e quello relativo all'attività globale del muscolo. Negli ultimi venticinque anni le tecniche di prelievo, registrazione ed elaborazione del segnale EMG hanno avuto uno sviluppo notevole e nell’ultimo decennio sempre maggiore attenzione è stata rivolta al segnale mioelettrico di superficie, consentendo di allargare l’impiego dell’elettromiografia a tutta una vasta gamma di applicazioni, dalla neurodiagnostica alla neuroriabilitazione, alla caratterizzazione non invasiva dell’anatomia e fisiopatologia dei muscoli superficiali e alla valutazione di efficacia di interventi riabilitativi[1]. Oggi le nuove frontiere dell’elettromiografia sono il controllo motorio di protesi, le interfacce uomo-computer quale sostegno alla comunicazione per soggetti con disabilità motorie parziali, ma si tratta solo di alcuni degli studi avanzati più recenti che i ricercatori stanno eseguendo in questo affascinante mondo dal futuro promettente.
Figura 1.Uno dei primi elettromiografi, datato 1947.
1.2 L’ELETTROMIOGRAFIA DI SUPERFICIE.
Rispetto alla più consolidata elettromiografia con aghi, quella cutanea, o elettromiografia di superficie (SEMG), oltre ad evitare i rischi impliciti nell'uso di aghi, consente di analizzare il funzionamento di un organo in modo non invasivo, utilizzando i segnali elettrici che tale organo genera. Per il clinico, essa rappresenta un importante strumento sia per eseguire diagnosi, sia per valutare l’efficacia di terapie e l’evoluzione delle condizioni del paziente. Lo sviluppo tecnologico dell’elettromiografia di superficie è molto recente rispetto a quello di altre tecniche di indagine di segnali biologici, come ECG e EEG. Non tutte le metodiche sono ancora standardizzate e per tante di esse l’applicazione si trova ancora ad uno stato iniziale, essendo ancora poche quelle di routine. Le branche interessate sono la fisiatria, l’ortopedia e la neurologia. La SEMG permette l’utilizzo di schiere di elettrodi, la lettura simultanea del segnale in diversi punti della superficie cutanea, la definizione di mappe di potenziale e l’uso di tecniche di filtraggio bidimensionale. I vantaggi ad essa legati si riscontrano principalmente nelle seguenti situazioni:
1. Quando si vogliano indicazioni sul momento, sulla durata, sull'entità dell'attivazione di un muscolo durante un movimento.
2. Quando si vogliano indicazioni riguardo all’attività globale di un muscolo o gruppo muscolare.
3. Quando si desideri informare il paziente del grado di contrazione o di rilassamento di un suo muscolo o gruppo muscolare (es. tecniche di biofeedback).
4. Quando occorra un segnale mioelettrico con lo scopo di controllare un qualche dispositivo esterno (ad esempio uno stimolatore o una protesi).
5. In tutti quei casi in cui il paziente dimostri intolleranza all’inserimento di aghi (fenomeno molto sensibile nella casistica pediatrica).
I risultati di una generazione avanzata di studi, suggeriscono infine la possibilità di caratterizzare non invasivamente muscoli superficiali, determinando la tipologia delle fibre di un muscolo rispetto ad un altro, stimando la lunghezza e la localizzazione delle zone di innervazione delle fibre di quelle unità motorie che hanno un ruolo prevalente nella costituzione del segnale. Le tecniche di elettromiografia di superficie non sono di semplice impiego, ma richiedono una competenza specifica e multidisciplinare molto approfondita. Ad esempio, comprendere come i segnali siano influenzati dalla geometria e dal posizionamento degli elettrodi, separare correttamente i segnali da artefatti, rumore, disturbi, riconoscerne anomalie, interpretarne lo spettro risultante, estrarne informazione significativa, ecc., non sono di facile attuazione senza conoscenze, oltre che di tipo clinico e fisiologico, anche di tipo ingegneristico e fisico[1].
1.3 IL MUSCOLO SCHELETRICO. 1.3.1 La funzione.
Il muscolo striato scheletrico è l’esecutore dei programmi motori elaborati dal sistema nervoso centrale. La sua funzione è quella di creare una forza per stabilizzare o per muovere un'articolazione. Esso è la parte attiva del principale dei movimenti, la locomozione, assieme ad altri due gruppi di organi quali le ossa, la parte passiva, e le articolazioni, che rappresentano il dispositivo in corrispondenza del quale il movimento medesimo si esplica. L’azione combinata di questi tre elementi può essere associata a quella di una leva, di cui i pezzi scheletrici (le ossa) sono i bracci, l'articolazione è il fulcro e il muscolo la potenza. La forza che il muscolo produce a seguito della contrazione dipende da vari fattori, ma risulta comunque direttamente proporzionale alla sezione trasversa del muscolo stesso. La macchina muscolare è dotata di plasticità, ossia è in grado di modificare la propria struttura e, quindi, le prestazioni in base alle variazioni delle richieste funzionali, come testimoniato dal fatto che un allenamento di forza causa ipertrofia muscolare, così come una lunga immobilizzazione produce una diminuzione del volume muscolare, della forza, della capacità all'esercizio e della coordinazione neuro muscolare. Il muscolo scheletrico è così chiamato perché trae origine e si inserziona nelle ossa per mezzo dei tendini, robuste strutture fibrose che consentono di trasmettere, distribuire e graduare le sollecitazioni che le attività muscolari esercitano costantemente sull'apparato scheletrico. È proprio attraverso il tendine che il muscolo, contraendosi, è in grado di muovere il segmento osseo al quale è connesso. Sul tendine, che rappresenta, si può dire, la parte finale del muscolo, si scarica tutta la forza esercitata per ottenere il movimento.
1.3.2 La struttura.
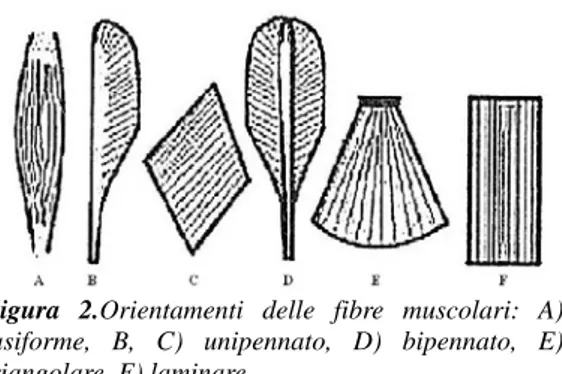
Esistono diversi tipi di muscoli, classificati secondo diversi parametri, ad esempio macroscopici, come le dimensioni, per cui si parla di muscoli più o meno lunghi o più o meno grandi e con architetture assai diverse. Riferendosi all’orientamento dei fasci di fibre, rispetto a quello del muscolo intero, si distinguono invece muscoli fusiformi, unipennati, bipennati, triangolari, laminari, come visibile nella figura sottostante (Fig. 2).
Figura 2.Orientamenti delle fibre muscolari: A)
fusiforme, B, C) unipennato, D) bipennato, E) triangolare, F) laminare.
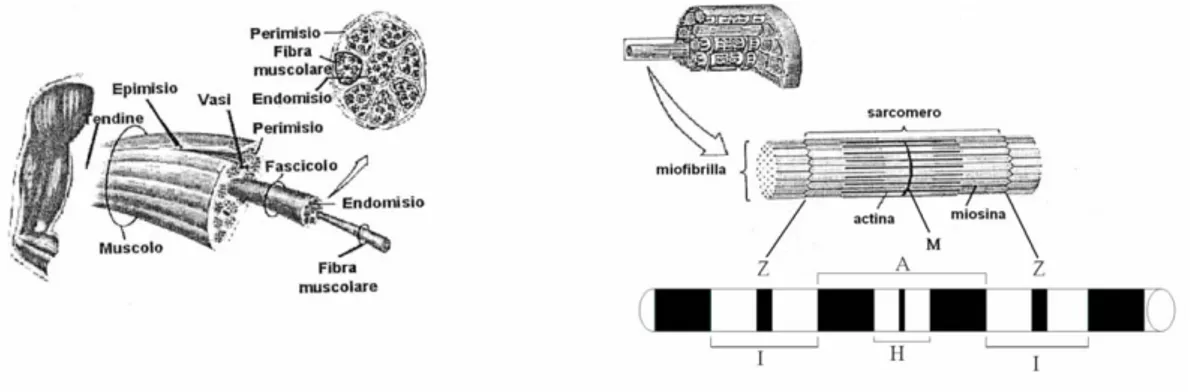
Un muscolo è costituito da molte sub unità e presenta una complessa composizione strutturale. Macroscopicamente circondato da una fascia chiamata epimisio, è suddiviso in un numero variabile di sub unità dette fascicoli circondate a loro volta da propaggini dell’epimisio, il perimisio. Ogni fascicolo è costituito da fasci di fibre muscolari (le cellule muscolari) avvolte da una lamina detta endomisio. Per il 75%, la massa delle cellule muscolari è costituita da acqua. Il restante 25% sono
quasi esclusivamente proteine solubili, miosina e actina. Si tratta di cellule multinucleate, con una densità stimata di 50-100 nuclei per mm di lunghezza della fibra. Ai nuclei è legata la qualità e la quantità, oltre che la distribuzione del materiale interno alla fibra [2]. Le caratteristiche soggettive di velocità, forza e resistenza di ogni fibra sono imposte dal tipo di proteine prodotte. Nel liquido intracellulare, il citoplasma, risiedono i motori energetici, i mitocondri, i quali producono l’ATP, la “moneta” corrente energetica, attraverso le vie del metabolismo ossidativo. La densità mitocondriale dipende dalla specializzazione della fibra muscolare e può raggiungere il 20% del volume della fibra nel caso di fibre altamente ossidative. La fibra ospita, inoltre, altre sostanze come il glicogeno, i lipidi e gli enzimi. I sistemi membranosi contenuti all’interno di una fibra muscolare sono di due tipi: il sistema dei tubuli trasversi ed il reticolo sarcoplasmatico. Sono due sistemi nettamente distinti tra loro e responsabili della propagazione del potenziale dalla superficie del sarcolemma all'interno della fibra. Il sarcolemma è la membrana cellulare delle fibre del tessuto muscolare striato. All’interno della fibra muscolare si trovano stipate le miofibrille, che occupano il 75-85% dell'intero volume della fibra. Esse sono disposte in parallelo tra loro e separate le une dalle altre dal citoplasma e dagli organelli citoplasmatici. Le miofibrille sono formate da una regolare successione di elementi in serie, detti sarcomeri, i quali rappresentano l'unità anatomo-funzionale elementare del muscolo scheletrico. I sarcomeri sono a loro volta costituiti da una matrice regolare di filamenti proteici, disposti in parallelo e sovrapposti. Due sono i tipi di miofilamenti proteici cruciali per il meccanismo di contrazione, ovvero filamenti spessi e sottili fatti, rispettivamente, di miosina e actina. Per avere un'idea delle proporzioni in gioco, in una miofibrilla del diametro di circa 1µm la miosina occupa il 55% del volume, mentre l’actina circa il 25%. Per denominare le diverse porzioni del sarcomero si ricorre classicamente al gergo della microscopia a luce polarizzata. Le porzioni della fibra muscolare che appaiono più scure di altre sono quelle in cui le proteine sono più addensate e deviano fortemente il piano di polarizzazione della luce. A tale zona è dato il nome di banda A (per Anisotropia). Altre aree in cui, essendo le proteine meno addensate, si ha più debole deviazione della luce, prendono il nome di bande I (per Isotrope). Al centro della banda I si trova una zona ad alta densità proteica chiamata linea Z (dal tedesco Zwischen-Scheibe, ovvero disco intermedio). Al centro della banda A è situata una zona più chiara detta zona H (dal tedesco Helle-Scheibe ovvero disco luminoso) ed al centro di questa si individua una linea più scura detta linea M (dall'inglese Middle, intermedia).Il sarcomero è la regione di fibra compresa tra due linee Z e, nel muscolo del mammifero, è lungo 2-3 mm. Quando il muscolo si contrae, la banda I e la zona H si accorciano, mentre la lunghezza della banda A rimane costante[3]. Una rappresentazione schematica dell’organizzazione strutturale del muscolo striato scheletrico a livello macroscopico e microscopico è visibile in Fig. 3.
1.3.3 Il modello e le proprietà meccaniche.
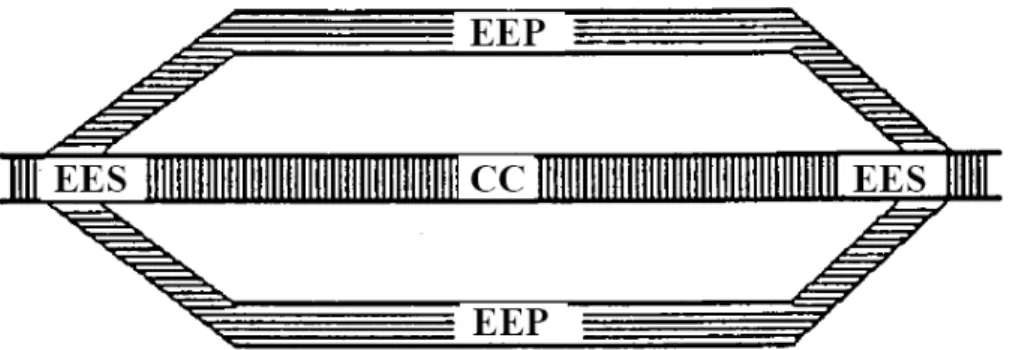
Figura 4.Modello meccanico del muscolo.
Con riferimento alla figura sopra (Fig. 4), il modello meccanico del muscolo che può essere utilizzato per descrivere la relazione forza-velocità è quello di Hill (1970) e fa ricorso ad elementi meccanici, comprendenti molle e componenti contrattili, i quali simulano il comportamento meccanico di un muscolo isolato. Il modello può essere così schematizzato:
− CC è la componente contrattile rappresentata dal sarcomero;
− EEP sono elementi elastici posti attorno alla componente contrattile, in parallelo, costituiti dalle guaine fibrose dei fascicoli muscolari, dalle guaine delle fibre muscolari (sarcolemma) e dal connettivo tra le fibre (endomisio);
− EES sono elementi elastici in serie, rappresentati dai tendini, le linee zeta e i ponti di actomiosina.
Tale modello si presta allo studio delle caratteristiche passive del muscolo, mentre risulta difficile assegnare agli elementi meccanici valori ragionevoli che derivino da considerazioni fisiologiche, ed inoltre esso non caratterizza il componente generatore di forza. Di seguito sono riportate le equazioni empiriche che Hill derivò dai suoi esperimenti, utilizzando contrazioni isotoniche (a forza costante), a lunghezza iniziale ottima e a muscolo preattivato:
(F + a)(V + b) = (F0 + a)b
è la formula originale, dove F = forza, V = velocità, F0 = forza massima, a e b sono due costanti;
(F + a)V = (F0 – F)b
è la relazione lineare che Hill trovò quando, in esperimenti successivi, dimostrò che il lavoro durante l'accorciamento è F∆s (∆s = spostamento) ed il calore in eccesso durante l'accorciamento era proporzionale alla distanza percorsa (a ∆s). (F + a)V è la portata di energia totale liberata in funzione della forza F. Dalla relazione proposta da Hill sono stati sviluppati diversi altri modelli, tra cui quello che, sostituendo al valore di forza massima F0 il valore di F ad una certa lunghezza
(F0(l)), permette di considerare la relazione tensione-lunghezza[3]. Focalizzando il discorso sulle
resiste allo stiramento oltre la lunghezza di riposo. Questa elasticità è data dal tessuto connettivo che avvolge la componente contrattile, che si trova in parallelo con essa. Quando il muscolo si contrae, prima che la tensione si manifesti nei tendini, deve comparire nel tessuto connettivo (EEP del modello).Quando una singola miofibrilla si contrae sviluppa una tensione uguale a quella unitaria di un singolo sarcomero. Il muscolo, contraendosi in toto, produce una forza complessiva data dalla somma delle forze sviluppate da ogni singolo elemento posto in parallelo. In definitiva, la forza prodotta da un muscolo con la contrazione, risulta proporzionale al numero di miofibrille poste in parallelo, cioè alla sua sezione trasversa. L'accorciamento totale è dato dalla somma degli accorciamenti dei singoli sarcomeri, pertanto è proporzionale al numero di sarcomeri posti in serie, cioè alla sua lunghezza. Poiché ciascun sarcomero, contraendosi, si accorcia di 1 nel tempo t, la velocità di accorciamento della miofibrilla, e quindi del muscolo, è uguale alla velocità di accorciamento di un sarcomero, l/t, moltiplicata per il numero di sarcomeri in serie, quindi la velocità di accorciamento di un muscolo è proporzionale alla sua lunghezza. Oltre a questo, la microscopia ottica rivela che la forza è proporzionale al grado di sovrapposizione tra filamenti spessi e sottili. Su questa osservazione è fondata la teoria dei filamenti scorrevoli, secondo cui la forza muscolare è generata dai piccoli ponti trasversali che agiscono tra i filamenti spessi e sottili come generatori individuali di forza, tirando i filamenti sottili verso il centro della linea M. La lunghezza della fibra determina l'estensione della sovrapposizione dei filamenti, che a sua volta determina il numero di ponti trasversali capaci di attaccarsi e produrre forza. Esiste un intervallo di valori di lunghezza della fibra entro cui essa produce la massima forza, come visibile in Fig. 5.
Figura 5.Diagramma tensione lunghezza riferito alla
1.4 LA CONTRAZIONE MUSCOLARE. 1.4.1 Il tessuto nervoso.
I muscoli scheletrici sono innervati da grosse fibre nervose, le cui origini sono i motoneuroni alfa, situati nelle corna anteriori del midollo spinale. Tali nervi di moto giungono al muscolo tramite i loro prolungamenti assonali (fibra nervosa), le cui ramificazioni terminali prendono ciascuna contatto con una singola fibra muscolare.
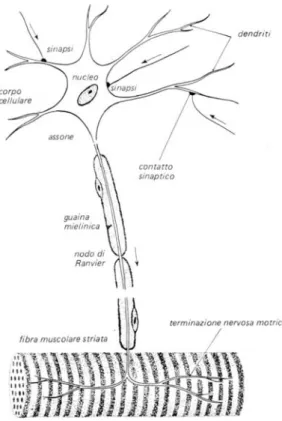
Il neurone è la cellula nervosa elementare ed è formato da numerosi dendriti, dalle sinapsi (dendriti e sinapsi formano l'organo di entrata del neurone), da un nucleo, un corpo cellulare, detto soma, da cui prende origine l'assone che forma l'organo di uscita del neurone. L’assone può essere rivestito da una guaina, detta mielina, e lungo esso sono presenti i nodi di Ranvier, mentre tutta la cellula nervosa è rivestita da una membrana (Fig. 6).
Figura 6.Il neurone.
Le due caratteristiche principali della cellula nervosa, che la rendono importante per la trasmissione delle informazioni sono:
− l’eccitabilità, cioè la capacità di generare un potenziale d'azione qualora la si ecciti con uno stimolo di ampiezza e durata opportune;
− la conduttività, cioè la capacità di propagare tale potenziale per una distanza rilevante e ad una velocità praticamente costante.
Gli stimoli sono raccolti dal soma e dai dendriti e trasmessi all'assone. Le sinapsi collegano funzionalmente tra loro i singoli neuroni e favoriscono la trasmissione dell'impulso nervoso. Poiché tale trasmissione avviene in una sola direzione, è possibile distinguere, in una sinapsi, la componente pre e post - sinaptica. La componente pre-sinaptica si presenta espansa, costituendo il
bulbo pre-sinaptico, caratterizzata dalla presenza di numerosi mitocondri e di vescicole, queste ultime contenenti il mediatore chimico, acetilcolina, responsabile della trasmissione dello stimolo. 1.4.2 L’unità motoria.
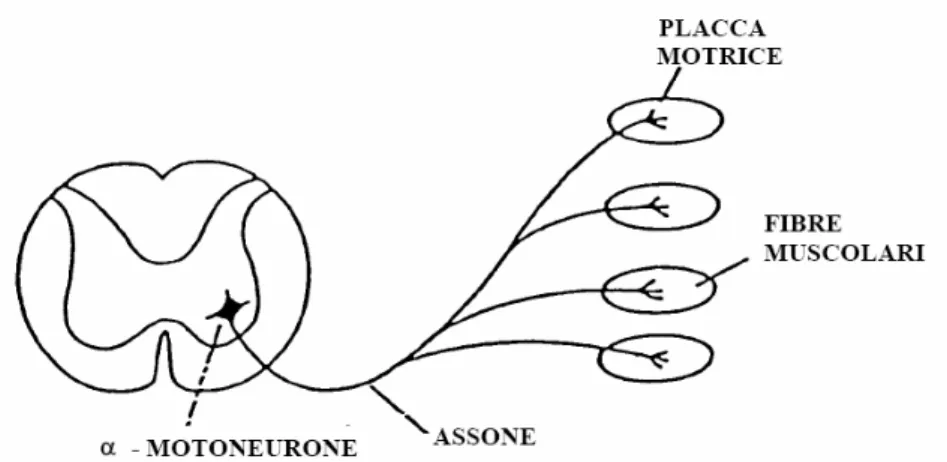
L'unità funzionale del muscolo è l'unità motoria (UM). Essa è data dal complesso del motoneurone e delle fibre muscolari che esso innerva (Fig. 7). Le fibre muscolari di un’unità motoria hanno nel muscolo una disposizione casuale, non contigua, sono, cioè, frammiste a mosaico con fibre muscolari appartenenti ad altre unità motorie.
Le unità motorie variano molto per quanto riguarda il numero di fibre muscolari: vi sono UM con 10 - 20 fibre muscolari, altre con più di 2000 e ciò influenza la forza generata dall'attività motoria stessa. Generalmente i muscoli preposti al controllo dei movimenti più fini hanno un basso numero di fibre muscolari per unità motoria; invece, i muscoli preposti a movimenti più grossolani sono usualmente caratterizzati da un elevato numero di fibre muscolari per unità motoria.
Figura 7.Singola unità motoria.
I motoneuroni hanno dimensioni diverse: quelli che innervano le unità motorie composte di fibre muscolari a contrazione rapida sono più grandi di quelli delle unità motorie composte di fibre muscolari a contrazione lenta. Il potenziale post-sinaptico eccitatorio ha un'intensità inversamente proporzionale alla grandezza del soma del motoneurone. I motoneuroni delle UM di tipo lento raggiungono prima la soglia di eccitabilità. Dato che la tensione sviluppata da ogni singola fibra muscolare è direttamente proporzionale all'area della sua sezione trasversa, la stimolazione di un’unità motoria di tipo veloce, a parità di numero di fibre muscolari, comporta lo sviluppo di una forza maggiore di quella prodotta dalle UM di tipo lento. Il punto d’innesto o terminazione della fibra nervosa motrice è detto placca motrice o sinapsi neuro muscolare. La placca motrice è
composta di due componenti, una pertinente alla cellula muscolare, l'altra alla fibra nervosa. La componente muscolare risulta di piccole invaginazioni del sarcolemma, dette fessure sinaptiche secondarie. La componente spettante alla fibra nervosa è costituita dalla porzione terminale dell’assone e ramificata nelle fessure sinaptiche primarie. La giunzione neuro muscolare ha dunque l'architettura generale di una comune sinapsi, con l'assolemma come membrana pre-sinaptica, il sarcolemma come membrana pos-tsinaptica e lo spazio intersinaptico contenente materiale glicoproteico. È nell’assoplasma pre-sinaptico che sono presenti le vescicole, contenenti nel caso specifico acetilcolina.
1.4.3 Il potenziale d’azione.
La cellula e il suo ambiente sono assimilabili a due soluzioni ricchissime di ioni, separate da una membrana semipermeabile. Le dimensioni dei pori della membrana cellulare sono tali da lasciar passare liberamente gli ioni Cl-, K+, ostacolare quelli Na+ ed impedire il passaggio degli anioni organici A-; essa è, cioè, selettiva.
Figura 8. La cellula: interno - membrana – esterno.
La non omogenea distribuzione degli ioni determina una differenza di potenziale elettrico ai lati della membrana, con il lato interno negativo e quello esterno positivo. Tale differenza di potenziale è detta “potenziale di membrana” ed ha in tutte le cellule un valore costante, compreso tra 70 e -90 mV. All'interno della cellula gli ioni più abbondanti sono quelli K+ e gli anioni proteici, accompagnati da piccole quantità di ioni Na+ e CI-. Nell’ambiente extracellulare vi è un’elevata quantità di Na+ e CI- e piccole quantità di K+. Esistono due metodi fondamentali mediante i quali i potenziali di membrana prendono origine:
1. la “pompa sodio – potassio” ATP dipendente (meccanismo di trasporto attivo di ioni contro il gradiente elettrico e quello di concentrazione, sostenuta dall'acido adenosin- trifosfato o ATP), che provoca uno sbilanciamento tra cariche negative e positive presenti ai due lati della membrana: gli ioni sodio vengono portati dall'interno verso l'esterno e quelli potassio dall’esterno all’interno;
2. la diffusione di ioni attraverso la membrana, conseguente ad una differenza di concentrazione tra i due lati della membrana stessa.
Le variazioni del potenziale di membrana sono chiamate “potenziali d'azione” (Fig. 9).
Quando varia la tensione al colle dell’assone per effetto delle sinapsi eccitatrici agenti sul neurone si ha una variazione della permeabilità della membrana al sodio e al potassio: un aumento della permeabilità allo ione sodio nello stato di eccitazione, una diminuzione di questa ed un aumento della permeabilità allo ione potassio nel ritorno allo stato di riposo. Il potenziale d'azione è alla base del fenomeno di eccitabilità delle cellule e in particolare di quelle nervose e muscolari, che ne fanno uso rispettivamente per trasmettere messaggi e per rispondere agli stessi. In definitiva, quando uno stimolo adeguato agisce su una cellula nervosa, in quel punto si ha un passaggio libero di ioni attraverso la membrana ed una conseguente brusca variazione del potenziale di membrana che, in un primo tempo si annulla, poi assume valori positivi ed infine ritorna al valore di riposo.
Figura 10. Fibra nervosa: sequenza di depolarizzazione - ripolarizzazione in movimento.
Il fenomeno è detto “depolarizzazione” e si propaga lungo tutta la fibra nervosa, in quanto determina un movimento di ioni dalla regione contigua non stimolata verso quella stimolata, con depolarizzazione della regione non stimolata, che a sua volta stimola la regione adiacente e così via. Lo stimolo si propaga ad un’eventuale cellula muscolare con la quale la fibra nervosa può essere in rapporto.
1.4.4 La curva intensità durata.
L’eccitazione di una fíbra nervosa o muscolare dipende sia dall'ampiezza sia dalla durata dello stimolo. L’attivazione è possibile con un impulso di durata ridotta solo se la sua ampiezza è aumentata e viceversa. Se la durata T dell’impulso permette di avere una differenza di potenziale Ed (differenza tra la soglia e il potenziale di riposo) allora si ha l’eccitazione. Con il termine “soglia” (in genere dell'ordine di 30 mV ma dipendente dal tipo di cellula e dalla sua storia passata) si indica la quantità di depolarizzazione, rispetto al potenziale di riposo, necessaria per iniziare un potenziale d' azione. Soltanto quegli stimoli uguali o superiori al valore di soglia provocheranno il trasferimento dell’informazione, la propagazione, cioè, del potenziale d’ azione per una distanza rilevante lungo la fibra stessa, senza variazione della forma d' onda e ad una velocità praticamente costante (variabile tra 40 - 70 m/s per le fibre nervose, 1.3 - 4.7 m/s per le fibre muscolari). Inoltre due stimoli sublimali possono dar origine ad un potenziale d’azione se si susseguono a breve intervallo (somma temporale) o avvengono contemporaneamente, ma in due punti diversi del neurone (somma spaziale). La corrente di stimolazione minima, che rende possibile l’attivazione, si ha quando la durata T dello stimolo tende all’infinito (stimolazione a corrente continua): questo valore è individuato come “corrente di reobase”. La durata di uno stimolo, la cui ampiezza sia doppia del valore di reobase, è detta “cronassia”. Il tempo di cronassia è dato da:
T
[nel nervo Tc = 0.2 msec., nel muscolo Tc = 2 msec.] dove il prodotto r•Cmm· rappresenta la costante di tempo della membrana, rm la sua resistenza e Cm la sua capacità (resistività = 1000
Ω/cm, capacità specifica = 2 - 5 µFc).
Figura 11. Curva intensità-durata: sulle y l’intensità corrente in unità di reobase, sulle x il tempo in unità pari alla costante di tempo della membrana.
Durante il periodo in cui la membrana dà origine al potenziale d’azione in risposta ad uno stimolo sopraliminare (superiore cioè alla soglia), la capacità della membrana di rispondere ad un secondo stimolo di qualsiasi tipo è notevolmente modificata. Nella parte iniziale dell’impulso la membrana non può rispondere affatto, anche se lo stimolo è molto forte (refrattarietà assoluta); dopo tale intervallo temporale, con uno stimolo forte, prima cioè del riposo completo, si può ottenere un potenziale d’azione (refrattarietà relativa).
1.4.5 Lo scivolamento dei miofilamenti.
La meccanica della contrazione muscolare diviene più chiara se si comprende bene la successione nel tempo delle varie fasi che la caratterizzano. La stimolazione del nervo motorio, seguita da un periodo latente di circa 2 ms prima che inizi la depolarizzazione del sarcolemma, è trasmessa alla fibra muscolare a livello della placca motrice.
Lo stimolo nervoso, arrivato alla parte terminale pre-sinaptica del nervo, libera quanti di acetilcolina (ACH) che si diffondono attraverso lo spazio sinaptico. Questa fase “chimica” della trasmissione neuromuscolare dura 0.3 - 0.5 ms; segue la depolarizzazione della zona pos-tsinaptica motoria. Da qui la depolarizzazione si propaga lungo tutta la fibra muscolare e dà origine alla risposta contrattile. Dopo la depolarizzazione il sarcolemma si ripolarizza gradualmente tornando alla situazione di riposo in 5 - 10 ms, molto prima che sia raggiunto il picco di tensione della contrazione muscolare.
Figura 13. Fibra di un muscolo scheletrico e sua innervazione. In alto gli elettrodi stimolanti e in basso quelli per la registrazione.
In Fig. 14 è rappresentato il muscolo striato in sezioni successive, partendo, cioè, dall’intero muscolo e schematizzando con ingrandimenti graduali le varie componenti fino ai neurofilarnenti di miosina (al centro) e actina (ai lati).
L’accorciamento della fibra muscolare con generazione di forza contrattile è il risultato di uno scivolamento tra loro dei due sets di filamenti di ciascuna metà del sarcomero. Lo scivolamento avviene per un processo ciclico. Durante la contrazione ciascun ponte trasversale di miosina si attacca alle molecole di actina del filamento sottile adiacente, esercita forza fino a quando si distacca, dopo aver tirato un po’ il filamento sottile verso il centro del sarcomero; inizia quindi un nuovo ciclo, in cui esso si riattacca più oltre lungo il filamento sottile.
L’effetto di questi scivolamenti ripetuti conseguenti al ciclico attaccarsi e distaccarsi dei ponti trasversali di actina e miosina è il completo accorciamento del sarcomero (Fig. 15).
Figura 15.
1.4.6 Scarica e reclutamento dei motoneuroni.
La graduazione della contrazione muscolare è ottenuta grazie a due diversi meccanismi: 1. reclutamento di nuove UM all'aumentare dello sforzo;
2. aumento della frequenza di scarica della singola UM.
La stimolazione della fibra muscolare, poco dopo che è stata evocata una precedente contrazione, dà luogo ad una seconda risposta contrattile che si somma alla precedente. Se, infatti, il secondo stimolo arriva alla fibra muscolare prima che la tensione del primo sia decaduta, la seconda contrazione si sommerà alla prima, dando luogo ad un significativo aumento del picco di tensione (per tempo di contrazione si intende l'intervallo di tempo che intercorre tra l’attivazione della fibra muscolare e il raggiungimento durante la contrazione del picco di tensione).
Figura 16.Tempo di contrazione di 3 muscoli: il retto interno dell’occhio a contrazione rapida, il soleo a contrazione lenta e il gastrocnemio che ha picco di contrazione intermedio (le barre nere che precedono i nomi indicano la durata del tempo di picco).
Se una fibra muscolare viene stimolata ripetutamente a brevi intervalli di tempo ne risulterà una fusione delle singole scosse, fino a formare una contrazione continua detta ”tetano muscolare”, di gran lunga maggiore di quella della singola scossa. La tensione del tetano può essere mantenuta ad un livello costante fino a che continua la stimolazione o il muscolo non si affatica. Le fibre muscolari lente dei muscoli rossi richiedono 20 stimoli al secondo per formare il tetano, mentre quelle rapide dei muscoli bianchi da 60 a 100 stimoli al secondo. Per comprendere l'adattabilità delle fibre muscolari nelle varie situazioni di esercizio occorre considerare il funzionamento del motoneurone.
Ci sono motoneuroni a bassa e ad alta frequenza di scarica. I primi controllano le LTM formate da fibre muscolari a contrazione lenta, i secondi quelle con fibre a contrazione rapida. La frequenza di scarica ottimale del motoneurone è quella minima utile perchè le singole scosse muscolari si fondano a formare una contrazione tetanica. La frequenza tetanizzante è intorno ai 20 Hz per le UM di tipo lento e sopra i 50 Hz per quelle di tipo rapido. L'ordine di reclutamento dei motoneuroni risponde al principio della grandezza: minore è il loro diametro e più facile risulta la loro attivazione (più bassa soglia di attivazione).
Le fibre muscolari di tipo lento sono innervate da motoneuroni più piccoli e sono le prime ad essere attivate nel movimento volontario.
Durante le normali attività i motoneuroni più piccoli, a più bassa soglia, scaricano a bassa frequenza per lunghi periodi di tempo, mentre i motoneuroni a più alta soglia, innervanti le fibre di tipo veloce, vengono attivati solo occasionalmente in brevi scariche ad alta frequenza.
Nel caso di esercizi di lunga durata ad intensità massimale (allenamenti di resistenza) tutti i motoneuroni scaricano a frequenza moderata, ma appena l'impegno cessa di essere massimale, i motoneuroni a soglia più elevata smettono di scaricare. Al contrario, durante l'esercizio ad impegno massimo ma di breve durata (allenamenti di forza) tutti i motoneuroni scaricano per lunghe sequenze ad alta frequenza. La scarica sincrona di diverse UM produce tensione massimale, mentre quella asincrona è associata ad un prolungamento massimo della contrazione (resistenza).
1.5 IL SEGNALE MIOELETTRICO SUPERFICIALE. 1.5.1 Genesi elettrica.
Nella trattazione che segue, il riferimento è esclusivamente al meccanismo di formazione del segnale mioelettrico cutaneo in regime di contrazione volontaria e non di contrazione stimolata elettricamente. A partire dal punto di innervazione di ogni fibra muscolare si generano due zone di depolarizzazione che si propagano verso i due estremi della fibra alla velocità di 3-5 m/s. A causa di differenze nel punto di innervazione e nella velocità di conduzione delle fibre di un’unità motoria, queste sorgenti di campo elettrico non sono perfettamente allineate nello spazio e quindi neanche nel tempo di arrivo presso gli elettrodi di registrazione. Il segnale risultante è la somma di questi contributi lievemente sfalsati ed è indicato come Motor Unit Action Potential (MUAP). L’attivazione ripetuta di un’unità motoria genera un treno di MUAP (MUAPT). In Fig. 17 è indicata la distribuzione del potenziale di membrana lungo una delle fibre rappresentate e appartenenti alla stessa unità motoria. Le fibre attivate insieme generano un singolo MUAP. Ciascuna delle tre fibre in figura, facenti parte dell’unità motoria A, genera, come risposta a ciascuna attivazione, due sorgenti di campo elettrico che si propagano in direzioni opposte verso le zone terminali. Ogni sorgente contribuisce al segnale rilevato sulla cute dando origine al MUAP. Forma, ampiezza, durata e spettro di tale potenziale dipendono sia da numerosi fattori geometrici e fisiologici, sia da fattori tecnici inerenti alle modalità di prelievo del segnale, come sarà discusso più avanti[1].
Figura 17.Meccanismo di generazione del segnale mioelettrico.
Quando un muscolo viene a trovarsi in tensione, si configura, pertanto, alla superficie cutanea un segnale elettrico (EMG superficiale), dato dalla somma di segnali, pochi o molto numerosi, provenienti dalla scarica irregolarmente distribuita delle unità motorie. In sostanza, il segnale mioelettrico di superficie, detto anche “tracciato di interferenza” (Fig.18), è costituito dalla sovrapposizione dei contributi dei MUAPT generati dalle unità motorie attive del muscolo osservato localizzate nell’area di prelievo degli elettrodi. Le unità motorie più vicine agli elettrodi danno un contributo maggiore al segnale rispetto a quelle più distanti.
Figura 18.Tracciato di interferenza.
Nel caso di contrazione volontaria, le unità motorie sono attivate a frequenza diversa e i loro contributi al segnale cutaneo si sommano in modo asincrono, generando un segnale casuale, il quale va pertanto inquadrato nell’ambito dei segnali aleatori e studiato con le tecniche relative. Tale segnale ha ampiezza che dipende dall’intensità della contrazione e va da qualche decimo di mV a uno o due mV. Esso presenta armoniche significative tra 10-20 Hz e circa 400-450 Hz (banda del segnale EMG superficiale)[4]. In Fig. 19 è riportato schematicamente il meccanismo di somma di MUAPT durante una contrazione volontaria. I blocchi UM (potenziali di unità motorie) sono sistemi lineari tempo invarianti caratterizzati dalle proprie risposte impulsive e tengono conto, per mezzo di modellizzazioni matematiche, di tutti quei fenomeni che condizionano il potenziale d’azione.
Figura 19.Schema a blocchi della formazione del segnale EMG durante una contrazione volontaria.
1.5.2 Il fenomeno del crosstalk.
Per crosstalk si intende il segnale mioelettrico raccolto sulla cute al di sopra di un muscolo, ma generato da un altro muscolo vicino e diffuso attraverso il volume conduttore del tessuto interposto tra fonte di segnale ed elettrodi. Se ignorato, esso può condurre ad errate conclusioni di coattivazione muscolare. Infatti, è possibile rilevare un segnale su un muscolo non attivo, quando un muscolo vicino è attivato con sufficiente intensità. L’entità del fenomeno dipende dall’entità della sorgente, dalla distanza tra i due muscoli, dalla natura del tessuto interposto e dalla configurazione di prelievo. La quantificazione del crosstalk risulta complicata nell’ambito di contrazioni volontarie, in quanto le tecniche a disposizione non consentono con affidabilità di separare i contributi di muscoli diversi. Una quantificazione è invece possibile ricorrendo alla stimolazione elettrica, nel qual caso si è in grado di attivare un solo muscolo per volta misurando il segnale mioelettrico sui muscoli vicini inattivi. Sistemi di prelievo con piccolo volume di detezione sono meno sensibili al problema del crosstalk di quanto non lo siano sistemi con maggior volume di detezione[1].
1.5.3 Prelievo, amplificazione e condizionamento del segnale.
Al prelievo del segnale mioelettrico sono associati dei concetti fondamentali da cui ricercatori e clinici non possono prescindere e che in letteratura trovano raramente un’adeguata discussione. Come in parte già accennato, per una sorgente di campo elettrico la forma, l’ampiezza e la durata del potenziale raccolto sulla cute dipendono da parametri del sistema di prelievo che si esplicitano in :
1. configurazione degli elettrodi (monopolare, differenziale, doppio differenziale); 2. superficie e forma degli elettrodi;
3. distanza tra gli elettrodi (o interelettrodica);
4. posizione geometrica degli elettrodi in relazione alla zona di innervazione e alle zone terminali delle fibre muscolari;
L’importanza di questi fattori può essere rilevante ed evidenzia la necessità di standardizzare le modalità di prelievo del segnale[1]. Le possibili configurazioni di elettrodi utilizzabili per il prelievo del segnale EMG di superficie sono riassumibili in cinque gruppi e sono:
1. Configurazione monopolare: il segnale è prelevato tra un elettrodo posizionato sul muscolo in esame e uno di riferimento posizionato lontano da sorgenti di segnale (Fig. 20A).
2. Configurazione differenziale o bipolare: il segnale prelevato è la differenza di potenziale tra due elettrodi vicini disposti sul muscolo d’interesse. Anche questa configurazione richiede un elettrodo di riferimento posizionato lontano da sorgenti di segnale (Fig. 20B).
3. Configurazione a due o più canali differenziali: questa modalità richiede tre o più elettrodi equispaziati e consiste in almeno due canali differenziali. Si adopera nei casi in cui si voglia stimare la velocità di conduzione o osservare la propagazione del segnale lungo le fibre (Fig. 20C).
4. Configurazione doppio-differenziale: tale tecnica richiede tre elettrodi equispaziati dai quali si ottengono due segnali differenziali (come nella modalità precedente) e un segnale doppio differenziale, come visibile in Fig. 20D. Due configurazioni identiche, scalate di una distanza interelettrodica, richiedono quattro elettrodi utilizzati in due gruppi di tre (Fig. 20E). La doppio-differenziale è indicata quando si vuole ottenere una maggiore risoluzione spaziale (ossia rilevare un maggior volume di tessuto) o nella stima della velocità di conduzione. Specialmente nel secondo caso, essa ha notevoli vantaggi rispetto alla tecnica differenziale in quanto attenua i segnali dovuti a sorgenti che non traslano (artefatti, effetti di fine fibra).
5. Schiere di elettrodi e filtri spaziali: è la tecnica più recente ed interessante, assicura di ottenere la massima informazione sul segnale, di osservare fenomeni di propagazione, localizzare zone di innervazione e zone di terminazione delle fibre. Essa fa uso di una serie di elettrodi equispaziati e disposti lungo una retta (Fig. 20C), oppure come le righe e le colonne di una matrice bidimensionale. I segnali possono essere monopolari, ossia rilevati tra ciascun elettrodo della schiera e quello di riferimento, bipolari, cioè rilevati tra coppie di elettrodi, o combinazioni lineari, cioè medie pesate, dei segnali ottenuti da diversi elettrodi (Fig. 20F). I pesi utilizzati nella combinazione lineare di più segnali identificano il particolare filtro spaziale che risulta così realizzato e il cui concetto sarà esplicitato di seguito.
Figura 20. Modalità di prelievo del segnale EMG di superficie: A) monopolare, B) differenziale, C) più canali differenziali, D) doppio-differenziale, E) due sistemi doppio-differenziali, F) filtro spaziale monodimensionale con pesi 1, -4, 6, -4, 1.
Qualsiasi configurazione non monopolare, che prevede, quindi, una schiera più meno lunga di elettrodi, costituisce un filtro spaziale in quanto si comporta diversamente per diverse distribuzioni spaziali di potenziali presenti sulla cute sotto gli elettrodi. Ogni amplificatore presente nella configurazione fornisce in uscita un segnale che è la differenza, amplificata, dei due segnali prelevati tra ciascuno dei due elettrodi a monte rispetto a uno di riferimento lontano dalle sorgenti. Se sulla superficie d’appoggio degli elettrodi esiste una distribuzione di potenziale costante nello spazio (rispetto al riferimento) la tensione d’uscita dell’amplificatore è nulla. Tale tensione è nulla anche in una seconda condizione, in corrispondenza, cioè, di una distribuzione di potenziale (nello spazio e lungo l’asse x) periodica con periodo pari alla distanza interelettrodica[4]. Nella Fig. 21 è illustrato meglio questo concetto, per nulla intuitivo, di filtraggio spaziale. Essa descrive il comportamento di una tecnica di prelievo differenziale in presenza di una distribuzione spaziale di potenziale monodimensionale formata da tre componenti e che trasla a velocità v sotto la cute in direzione x. La prima componente (V1) è una tensione continua (o di modo comune, variabile nel
tempo ma contemporaneamente presente su entrambi gli elettrodi), la seconda (V2) è una tensione
sinusoidale con lunghezza d’onda pari a due volte la distanza interelettrodica e la terza (V3) è una
tensione sinusoidale con lunghezza d’onda pari alla distanza interelettrodica. Tutte le componenti e la loro somma V4 sono rappresentate in funzione dello spazio x ad un dato istante di tempo. Soltanto
una di queste tre componenti è sentita dal sistema ed è V2, mentre le altre due, per ragioni diverse,
danno origine a identiche tensioni sui due elettrodi e sono eliminate dall’amplificatore differenziale che costituisce il tipo più semplice di filtro spaziale. Dunque, la tensione d’uscita V(t) del sistema riflette solo una delle tre componenti spaziali su citate.
Figura 21.Concetto di filtro spaziale nel prelievo differenziale del segnale EMG.
La superficie degli elettrodi ha effetto di smussamento sul segnale perché combina i contributi raccolti da ciascun punto dell’area di contatto[1]. La distanza tra gli elettrodi, invece, modifica il filtraggio spaziale implicito nel prelievo differenziale, come appena visto. Una serie importante di caratteristiche del sistema di prelievo riguarda l’amplificatore (o il pre-amplificatore). Tra queste vi sono l’impedenza di ingresso, il coefficiente di reiezione di modo comune (CMRR), il rumore equivalente di ingresso, l’amplificazione differenziale, la banda passante, eventuali capacità o altri accoppiamenti parassiti verso fonti di disturbi e interferenze.