CAPITOLO 1: INTRODUZIONE ALL IDROGENO
L’idrogeno è l’elemento più comune nell’ambiente, circa il 18% atomico, ma a causa del suo basso peso molecolare, in termini di peso il valore si converte in meno di 1%, piazzando l’idrogeno al nono posto. La quantità di idrogeno molecolare presente sulla terra è praticamente insignificante, esso è presente principalmente nell’acqua e negli idrocarburi. L’acqua contiene circa il 12% in peso di H2, carbone 4-6%, gas naturale 25% e benzine circa il 12%.
L’idrogeno è considerato come il vettore energetico del futuro, alternativa all’uso delle benzine, gasoli, gas naturale; nel settore dei trasporti e non. Esso è un vettore energetico secondario che può essere prodotto da fonti energetiche primarie, come carbone, gas naturale, biomasse, rifiuti, energia solare, eolica o nucleare. Un futuro con impiego di idrogeno come fonte principale di energia è la soluzione ideale nel periodo medio lungo per risolvere i problemi ambientali e di sicurezza molto discussi al giorno d’oggi, grazie all’assenza di carbonio, le emissioni dei processi di combustione sono costituite solamente da acqua.
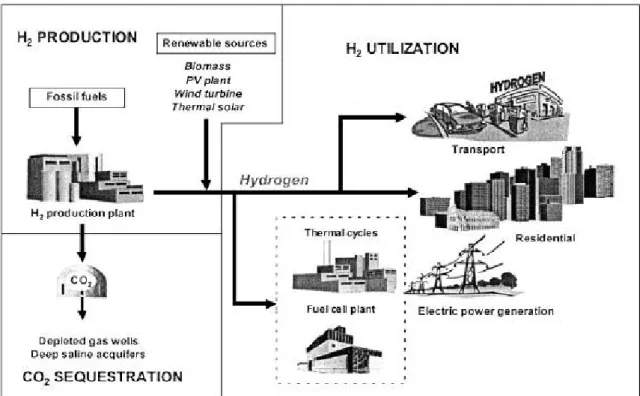
Nonostante gli indiscutibili vantaggi ottenibili impiegando l’idrogeno come vettore energetico, esistono ancora molte problematiche da risolvere riguardanti le tecnologie riguardanti l’intero ciclo di vita del prodotto, in particolar modo le fasi riguardanti la sua produzione, il trasporto, lo stoccaggio e l’utilizzo; ad esempio al contrario dei sistemi di distribuzione di benzina, gasolio e gas naturale, le infrastrutture per la distribuzione su larga scala di idrogeno attualmente non esistono per cui la loro costruzione richiederà investimenti molto elevati. In figura 1.1 è presentato uno scenario futuro ipotetico di ciclo di vita dell’idrogeno in cui esso è utilizzato come vettore energetico principale:
Fig. 1.1: Scenario ipotetico con idrogeno vettore energetico principale
Benché la produzione, stoccaggio e distribuzione di idrogeno siano attualmente utilizzate nel settore chimico e petrolchimico, tali tecnologie sono ancora troppo costose un vasto impiego nel settore energetico. Infine, le politiche economiche attuali non promuovono approcci che considerano anche i risparmi ottenibili dal punto di vista ambientale e della sicurezza, rendendo attualmente l’impiego di idrogeno altamente sfavorevole.
Lo sviluppo di una mentalità collettiva che consideri l’idrogeno come una reale opzione energetica per il futuro, necessita un supporto e un impegno che dovrà coinvolgere tutte le varie classi della società.
1.1 PRODUZIONE DI IDROGENO OGGI
Sebbene l’idrogeno sia l’elemento più abbondante nell’universo, non esiste naturalmente in grandi quantità o concentrazioni sulla terra; deve essere prodotto partendo da altre sostanze come ad esempio combustibili fossili, acqua, biomasse, ecc.
Allo stato attuale della tecnica, la produzione di idrogeno, inquadrata in una proiezione short-term, risulta fattibile solamente utilizzando come materia prima combustibili fossili, mentre in una visione long-term è prevedibile l’impiego di quote sempre più rilevanti di fonti rinnovabili che andranno a sostituire quote dei combustibili fossili.
Attualmente la produzione globale di idrogeno si aggira intorno a 500*10^9 Nm³/anno; le tecnologie commerciali disponibili oggi presentano ampi margini di miglioramenti dal punto di vista delle rese energetiche e degli impatti ambientali
Le principali tecnologie che sono state sviluppate per produrre idrogeno sono [1]: • Reforming termochimico di gas naturale con vapore ad elevate temperature
• Ossidazione parziale di combustibili fossili come carbone, petrolio e derivati ( processi Sheel, Texaco, ecc.)
• Reazione con vapore di coke derivato da carbone o petrolio per ottenere gas di sintesi a basso contenuto energetico
• Pirolisi del carbone
• Gasificazione di carbone con aggiunta di sorbenti, ad esempio lime, per assorbimento di CO2
• Cracking termico, pirolisi o decomposizione di idrocarburi o ammoniaca • Elettrolisi dell’acqua
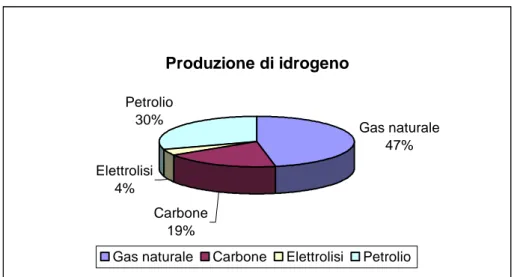
• Altri metodi, come reazione tra metalli fortemente elettronegativi (es. Na) e acqua, reazioni tra alcuni ossidi (es. V2O3) acqua, reazioni di ibridi (es. CaH2) con acqua L’idrogeno, come detto, deve essere generato partendo da fonti di energia primarie, circa il 50% della produzione mondiale deriva da gas naturale, con il processo di reforming. La restante parte viene prodotta per un 30% da petrolio, da carbone per il 19% e il rimanente 4% dal processo di elettrolisi.
Produzione di idrogeno Gas naturale 47% Carbone 19% Elettrolisi 4% Petrolio 30%
Gas naturale Carbone Elettrolisi Petrolio
L’impiego principale dell’idrogeno è nella sintesi di ammoniaca, che assorbe il 49% della produzione, il 37% è impiegato nei processi di raffinazione del petrolio, 8% per la produzione di metano e circa il 6% per la produzione di varie sostanze (Kroschwitz,1995).
Sono state fatte stime della necessità di idrogeno da parte degli Stati Uniti per soddisfare le esigenze energetiche di 25 milioni di abitazioni o di 25 milioni di auto alimentate a fuel cell, arrivando a valutare una necessità di 40 milioni di tonnellate annue. Tali quantità potrebbero essere prodotte ipotizzando diversi scenari [2]:
• Gasificazione carbone/biomasse: 140 impianti di alte potenzialità con tecnologie attuali
• Separazione dell’acqua per via nucleare: 100 impianti che producono solamente idrogeno
• Raffinerie di petrolio e gas naturale: 20 impianti, di media potenzialità che utilizzano i combustibili in gasificatori e reformer.
1.2 PRINCIPALI SISTEMI DI PRODUZIONE DELL’IDROGENO
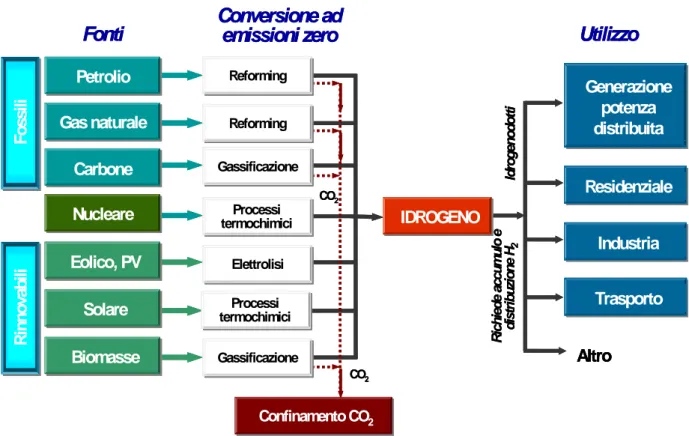
I sistemi principali attualmente in uso per la produzione e il consumo di idrogeno possono essere riassunti nel seguente schema:
Confinamento CO2 Eolico, PV Solare Biomasse Carbone Nucleare Petrolio Gas naturale Fo ss ili R inno vabili Gassificazione Reforming Reforming Elettrolisi Gassificazione Processi termochimici Processi termochimici
Fonti
Conversione ad
emissioni zero
Utilizzo
CO2 CO2 Residenziale Altro Industria Generazione potenza distribuita IDROGENO Id ro ge no do tti Ri chi ed e a cc um ulo e di str ibu zi on e H 2 Trasporto Confinamento CO2 Eolico, PV Eolico, PV Solare Solare Biomasse Biomasse Carbone Nucleare Petrolio Gas naturale Fo ss ili R inno vabili Gassificazione Gassificazione Reforming Reforming Reforming Reforming Elettrolisi Elettrolisi Gassificazione Gassificazione Processi termochimiciProcessi termochimici Processi termochimiciProcessi termochimici
Fonti
Conversione ad
emissioni zero
Utilizzo
CO2 CO2 ResidenzialeResidenziale Altro Altro Industria Industria Generazione potenza distribuita Generazione potenza distribuita IDROGENO IDROGENO Id ro ge no do tti Ri chi ed e a cc um ulo e di str ibu zi on e H 2 Trasporto Trasporto
Fig. 1.3: Schema dei principali processi di produzione di idrogeno
In realtà, allo stato attuale, le tecniche adottate industrialmente per le quali la tecnologia è ormai consolidata, sono quelle collocate nella parte superiore dello schema. Quindi, buona parte dell’intera produzione di idrogeno viene realizzata con processi di conversione che partono da combustibili di tipo fossile. Per questo motivo, gli studi attualmente in corso nella comunità scientifica si concentrano principalmente sull’utilizzo di fonti energetiche rinnovabili come materia prima; ciò comporta sia un riadattamento dei processi esistenti a nuovi tipi di combustibile che lo studio di nuove tecnologie
Riportiamo di seguito una breve descrizione dei processi principali per la produzione di idrogeno utilizzati a livello industriale.
1.2.1 ELETTROLISI DELL’ACQUA
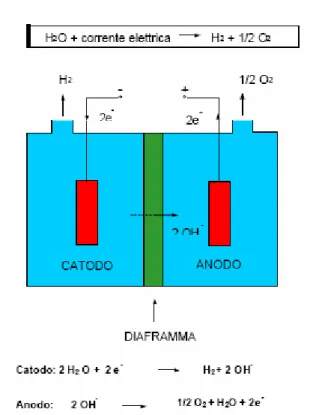
Il processo richiede il passaggio di corrente elettrica attraverso l’acqua, in maniera da far avvenire la reazione 2 1 H O energia elettrica H O 2 + → 2 + 2 (1.1)
Fig. 1.4: Schema di base di una cella elettrolitica
La corrente entra nella cella attraverso un elettrodo caricato positivamente, il catodo, attraversa l’acqua ed esce attraverso un elettrodo caricato positivamente, l’anodo. La differenza di potenziale che viene stabilita tra i 2 elettrodi è in grado di scindere la molecola di acqua.
L’elettrolisi è il modo più semplice di produzione di idrogeno, ma nel contempo è anche quello meno sviluppato (si stima che circa il 4% della produzione mondiale di HB2B provenga
da elettrolisi) data la limitata quantità di gas prodotta, la difficoltà nella loro separazione e i costi elevati dovuti all’uso di energia elettrica.
Le celle elettrolitiche attualmente in commercio permettono di ottenere 1 NmP
3
P di HB2B con
un consumo medio di 4 kWh.
Considerato che il potere calorifico dell’idrogeno è pari a 3kWh3
Nm , risulta evidente come il
processo non sia applicabile per la produzione di idrogeno come combustibile, in quanto il contenuto energetico del gas prodotto è inferiore alla quantità di energia elettrica consumata.
Per risolvere questi inconvenienti sono attualmente allo studio tecniche di applicazione dell’elettrolisi con vapore ad alta temperatura (800-900°C). Ciò consentirebbe di rendere le reazioni più veloci e di ridurre le perdite energetiche dovute alla polarizzazione degli elettrodi, accrescendo quindi l’efficienza complessiva del sistema.
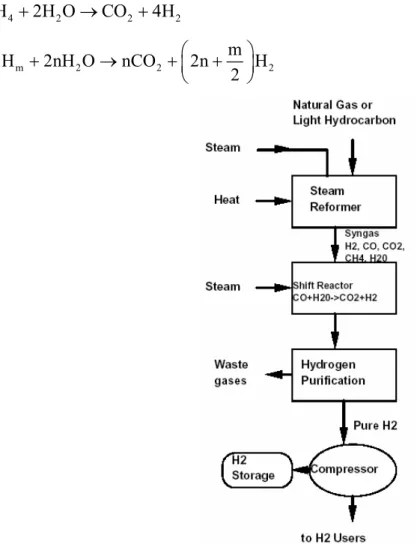
1.2.2 STEAM REFORMING DI METANO
Si tratta di un processo ben sviluppato ed altamente commercializzato, mediante il quale viene prodotto il 48% dell’idrogeno mondiale. Tale metodo può essere applicato anche ad altri idrocarburi leggeri, come la nafta. Non possono essere usati idrocarburi pesanti perché avrebbero bisogno di un processo di depurazione spinto e potrebbero facilmente crackizzare, con conseguente occlusione dei siti attivi del catalizzatore e quindi diminuzione di attività.
Lo Steam Reforming prevede la reazione di metano e vapore in presenza di catalizzatore. Tale processo, su scala industriale, in genere viene realizzato adottando condizioni operative di T=800 900 C÷ ° e P=25 30bar÷ .
La reazione prevede 2 fasi successive:
- la prima fase consiste nella decomposizione dell’idrocarburo in idrogeno e monossido di carbonio, secondo la reazione:
(1.2) 4 2 CH +H O→CO 3H+ 2 n m 2 2 m C H nH O nCO n H 2 ⎛ ⎞ + → +⎜ + ⎟ ⎝ ⎠ (1.3)
- nella seconda fase, detta “shift reaction”, il monossido di carbonio e l’acqua si trasformano in biossido di carbonio e idrogeno:
(1.4)
2 2
2 2
nCO nH O+ →nCO +nH2 (1.5)
Complessivamente, quindi, la reazione di steam reforming è la seguente:
2 4 2 2 CH +2H O→CO +4H n m 2 2 2 m C H 2nH O nCO 2n H 2 ⎛ ⎞ + → +⎜ + ⎟ ⎝ ⎠
Fig. 1.6: Schema dello steam reforming
rburo di partenza, come possiamo vedere confrontando i loro poteri calorifici feriori:
Co PCI (kWh/kg) PCI (kWh/mol)
Il contenuto energetico dell’idrogeno prodotto è più elevato di quello del metano o dell’idroca
in
mposto
Idrogeno 33.33 0.06666 Metano 13.9 0.2224 Tab. 1.1: Poteri calorifici di idrogeno e metano
Quindi, partendo da 1 mol di CHB4B, che equivale a 0.2224 kWh, sulla base della
stechiometria di reazione possiamo ottenere fino a 4 mol di HB2B, equivalenti a
4 0.06666 0.266 kWh⋅ = . Ciò è reso possibile dall’introduzione nel sistema di ulteriori
quantità di calore, sia sotto forma di vapore, che permette di convertire in idrogeno il potere calorifico del carbonio di partenza, che per sostenere le reazioni che hanno luogo. Infatti, dobbiamo avere presente che il processo di steam reforming è complessivamente endotermico, quindi è necessario introdurre ulteriore combustibile per mantenere il sistema
derata. In genere, circa
alla temperatura desi 1 3 del combustibile introdotto viene bruciato p
i si
e materia prima di un combustibile pregiato come il gas naturale; quindi, in genere gli impianti attualmente esistenti si co
er fornire il calore necessario; di conseguenza, il rendimento del processo si abbassa fino a un valore di circa il 65%.
Il gas in uscita dalla sezione di reforming è una miscela composta principalmente da HB2B e
COB2B; quest’ultima deve essere separata, ed in genere la sua rimozione viene effettuata per
mezzo di assorbimento in solventi specifici o separazione con membrane.
Uno degli obiettivi delle ricerche attualmente in corso è quello di migliorare il processo tradizionale tramite la tecnica del Sorption Enhanced Reforming (SER). Il vantaggio di una tecnologia di questo tipo consiste nell’abbinare alle reazione di reforming un processo selettivo di assorbimento della COB2B prodotta, modificando quindi le condizioni di
equilibrio tramite l’eliminazione di uno dei prodotti. Ciò permette di adottare temperature di lavoro notevolmente più basse e di ottenere direttamente dei flussi separati, estremamente puri, sia di idrogeno che di anidride carbonica, senza ricorrere ai costos
stemi di separazione adottati nello steam reforming tradizionali. Le attività di ricerca sono volte principalmente all’individuazione dei materiali più idonei all’assorbimento di COB2B e alla dimostrazione della validità tecnica dei sistemi sperimentali sinora individuati.
Lo steam reforming è una tecnologia ormai consolidata e comporta inoltre un ridotto impatto ambientale, con emissioni di inquinanti secondari molto modeste. Del resto, comporta il grande svantaggio dell’utilizzo com
limitano alla produzione di idrogeno per uso diretto per la produzione di particolari mposti chimici come l’ammoniaca e il metanolo.
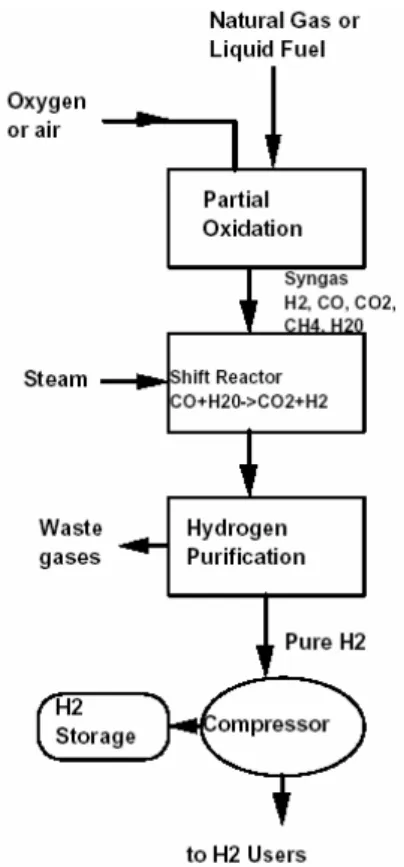
L’idrogeno può essere ottenuto tramite un’ossidazione parziale non catalitica di idrocarburi pesanti, come la nafta. L’operazione viene compiuta ad una temperatura di 1300-1500 °C.
L’efficienza complessiva del processo si aggira attorno al 50%, quindi sensibilmente più bassa di quella dello Steam Reforming. Inoltre, il processo richiederebbe di preferenza l’uso di ossigeno puro. Se infatti forniamo al sistema l’ossigeno contenuto nell’atmosfera, i prodotti di reazione sono fortemente diluiti a causa dell’azoto alimentato, ed è complicato andare a concentrare l’idrogeno così ottenuto.
In sostanza, con questo processo si fa avvenire una reazione controllata tra ossigeno e bustibile, che porta allo sviluppo di CO, HB2B e grandi quantità di calore. L’idrogeno che
può essere ottenuto è al massimo pari a quello contenuto nel combustibile di partenza; a, le rese sono sensibilme
dello steam reforming. Infatti, partendo da 1 mole di un generico idrocarburo di formula
Steam Reforming: com
quindi, a parità di materia prim nte più basse rispetto a quelle CBnBHBmB, otteniamo: n m 2 2 2 m C H 2nH O nCO 2n H 2 ⎝ ⎠ ⎛ ⎞ + → +⎜ + ⎟ (1.7) 1 mol C Hn m 2n H2 2 ⎛ m⎞ → + Ossidazione parziale: ⎜ ⎟ ⎝ ⎠ (1.9) n m 2 2 n m C H O nCO H 2 2 + → + (1.10) 1 mol C Hn m mH2 2 → (1.11)
Lo schema di processo è analogo a quello dello steam reforming, con l’unica differenza che l’agente ossidante utilizzato è OB2B invece di HB2BO.
Fig. 1.7: Schema di ossidazione parziale 1.2.4 GASIFICAZIONE DEL CARBONE
Il processo di gasificazione consiste nella parziale ossidazione non catalitica del carbone per dare un combustibile gassoso, formato principalmente da idrogeno, monossido di
etodi prevedono l’uso di vapore assieme ad aria per ossidare ente il carbone secondo la reazione:
temperature più o meno elevate e il rodotto finale ha diversa composizione. I principali tipi di reattore sono i seguenti:
-
atrame, oli e fenili.
reattori a letto trascinato: si produce gas ad alta temperatura (>1250°C); le energiche ondizioni di lavoro permettono di far reagire quasi interamente i prodotti devolatilizzati e carbonio e metano.
La reazione può essere condotta in diversi tipi di reattore: a letto fisso, a letto fluido o a letto trascinato. Tutti questi m
parzialm
2 2
C H O+ →CO H+ (1.12)
A seconda del tipo di reattore adottato, operiamo a p
reattori a letto fisso: lavorano a basse temperature (400-650°C), il gas prodotto contiene principalmente prodotti devolatilizzati; si ottiene inoltre anche un flusso di idrocarburi liquidi contente nafta, c
- c
gli idrocarburi liquidi prodotti; quindi il gas ottenuto è composto principalmente da rogeno, oltre naturalmente ai prodotti di ossidazione CO e COB2B
-
per la produzione di vapore, ev
ccessivo sistema di abbattimento delle polveri e degli ac
Analogamente a quanto avviene con la gasificazione del carbone, si tratta di un processo 4000 KJ/Nm3.
za di ossigeno fa sì che i componenti più volatili vengano vaporizzati a temperature feriori a 600°C per effetto di una serie complessa di reazioni. Tali componenti volatili
so B2B
ustibili ottenuti dalla biomassa hanno un contenuto di volatili su
(1.12)
id
reattori a letto fluido: lavorano a temperature intermedie di 900-1050°C; agendo opportunamente sulle condizioni operative è possibile indirizzare il sistema verso il prodotto desiderato.
Il calore necessario alla gasificazione è fornito dall’ossidazione parziale del carbone. Generalmente l’operazione di gasificazione nel suo complesso è esotermica, per questo motivo al reattore viene abbinata una caldaia a recupero
entualmente da usare all’interno del sistema stesso.
I gasificatori producono correnti gassose fortemente inquinate da ceneri, ossidi di zolfo e di azoto; è quindi necessario un su
idi volatili prodotti.
1.2.5 PIROLISI E GASIFICAZIONE DELLE BIOMASSE
endotermico in 2 stadi in cui un combustibile solido viene convertito in un gas a basso o medio potere calorifico, in genere compreso tra 4000 e 1 P P
Il primo stadio consiste in una pirolisi del materiale di partenza; l’applicazione di calore in assen
in
no composti da idrocarburi leggeri, idrogeno, CO, CO . Va fatto notare che i comb
periore rispetto a quello del carbone (rispettivamente 70-85% e 30% su base secca); per questo motivo la pirolisi ricopre un ruolo fondamentale nella gasificazione delle biomassa piuttosto che in quella del carbone.
Nel secondo stadio le sostanze carboniose e la cenere, che sono prodotti non vaporizzabili, devono essere gasificate in una reazione con ossigeno e acqua sotto forma di vapore, secondo la reazione già vista in precedenza:
2 2
arbonizzate viene bruciata per fornire il calore ecessario alle reazioni endotermiche di gasificazione.
L
do alternativo per la produzione di idrogeno dalle biomasse è la combinazione di piro i
Tram biomas solidi,
parame omunque, si formano sostanze gassose che possono
esse a sostanza
liqu a acqua.
o così ottenuto può essere sottoposto ad un tradizionale processo di steam reformi
Come
possibi nergia. Del resto,
presenta al momento ancora molti svantaggi.
petto al gas naturale - costi elevati della biomassa a causa della mancanza di un’economia di scala La parte incombusta delle sostanza c
n
a gasificazione viene generalmente realizzata a bassa pressione, in reattori a letto fisso o fluido.
Un meto
lis e steam reforming.
ite una pirolisi condotta a 400-800°C in atmosfera inerte o leggermente ossidante le se vengono decomposte termicamente; i prodotti di reazione possono essere sia sia liquidi, sia gassosi, in proporzioni che dipendono dai metodi di pirolisi e dai tri di reazione. In genere, c
re convertite a idrogeno e ossidi di carbonio in ambiente catalitico e un
id , il “bio-olio”, composta per l’85% da sostanze organiche ossigenate e per il 15% da Il bio-oli
ng per ottenere infine idrogeno.
vedremo, questo tipo di processo è di grande interesse e possiede notevoli lità di sviluppo tra i processi che usano fonti rinnovabili di e
Vantaggi
- la materia prima è una fonte rinnovabile di energia
- il processo è a impatto nullo per quanto riguarda l’emissione di anidride carbonica, uno dei gas responsabili dell’effetto serra; infatti la quantità di COB2B rilasciata in
atmosfera dal processo di conversione delle biomasse è la stessa utilizzata dalla biomassa durante la crescita
- basso impatto ambientale anche per quanto riguarda le emissioni di SOx
- possibilità di adottare sistemi integrati di produzione, con impianti decentralizzati di produzione di bio-olio e un unici impianto centralizzato di reforming
Svantaggi:
- elevato contenuto di umidità della biomassa (fino al 50% nel materiale grezzo), il che rende necessario un trattamento preliminare di essiccamento
1.2.6 PROCESSI AD ENERGIA SOLARE
La produzione di idrogeno ottenuta con processi termochimici o termofisici utilizzando come fonte energetica l’energia solare ad alta o altissima temperatura rappresenta una risorsa di grande valenza in termini di risorse energetiche disponibili, di compatibilità ambientale e di potenziale riduzione dei costi di produzione, dato l’alto rendimento complessivo del processo di trasformazione [3].
L’energia solare, op può essere utilizzata
irettamente in sistemi di tipo fotovoltaico in grado di realizzare la scissione della m
o due cicli che al momento attuale appaiono promettenti dal punto di vista applicativo [4].
C
portunamente raccolta e concentrata, d
olecola di HB2BO, oppure essere utilizzata come fonte energetica in grado di sostenere
l’intero processo di conversione. Riportiamo a titolo di esempi
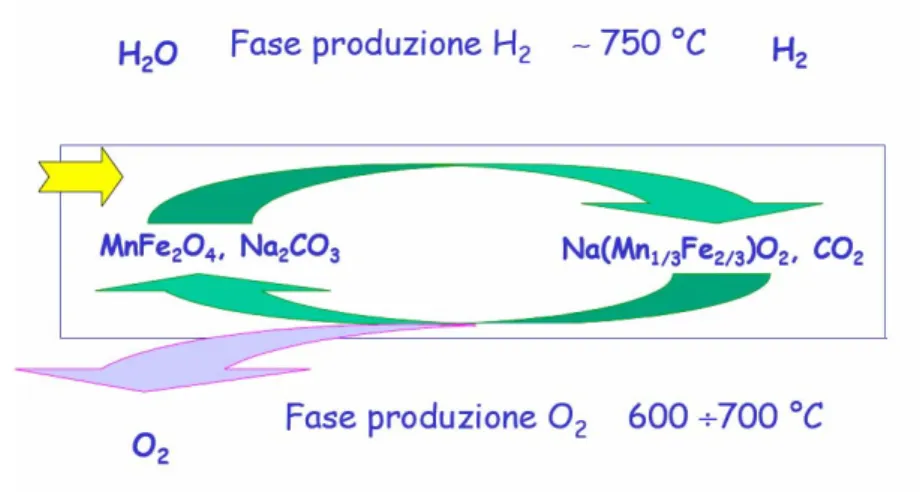
iclo ferriti miste
Fig. 1.9: Schema del ciclo a ferriti miste
Tale ciclo, come rappresentato in figura, si basa su due reazioni il cui risultato netto onsiste nella dissociazione dell’acqua in idrogeno e ossigeno:
c
(
)
2 4 2 3 2 1 3 2 3 2 2 2 2 MnFe O +3 Na CO +H O→6 Na Mn Mn O +3 CO +H (~750°C)(
1 3 2 3)
2 2 2 4 2 3 2 1 6 Na Mn Mn O 3 CO 2 MnFe O 3 Na CO O 2 + → + + (600~700°C)Nella prima reazione, da ferrite di manganese (jacobsite) carbonato di sodio ed acqua, a circa 750°C, si forma ferrimanganite di sodio, idrogeno e anidride carbonica. Alla fine di questa fase l’idrogeno viene separato dal vapore acqueo in eccesso e dalla COB2B, che viene
riciclata nella seconda fase del processo. Nella seconda reazione, variando opportunamente le condizioni di temperatura e pressione, l’anidride carbonica reagisce con la ferrimanganite di sodio e ripristina il materiale di partenza, con produzione di ossigeno.
Il risultato di tale processo consiste nella produzione di idrogeno e ossigeno per scissione mediata della molecola di acqua in due fasi ben distinte. Si evita in tal modo l’arduo problema della contemporanea separazione dell’idrogeno e dell’ossigeno prodotti ad
esempio nei tradizionali processi d B2B ini di
so.
Ciclo z
i elettrolisi dell’H O, con ovvi benefici in term sicurezza del proces
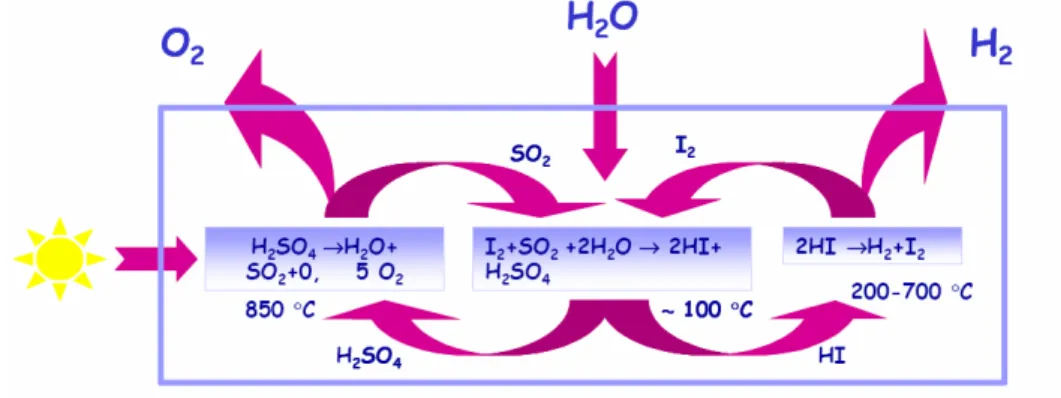
olfo – iodio
Fig. 1.10: Schema del ciclo zolfo-iodio
In questo caso il processo si basa sulle seguenti reazioni:
2 2 2 2 4 2 H O SO+ + →I H SO +2 HI (~100°C) 2 4 2 2 2 2 (200÷700°C) 1 H SO →H O SO+ + O (~850°C) 2 2 I→H + I 2 H
- produzione di acido solforico e acido iodidrico (reazione esotermica, condotta a
catalizzatori e delle condizioni operative).
1.2.7 PROCESSI BIOLOGICI
lo fa. D
idrogeno da processi di fotosintesi. Tutti questi lavor g su scala di laboratorio e la fattibilità su larga scala deve essere ancor i ione biologica di idrogeno può essere suddivisa i 5 gruppi [5]:
Bio-fotolisi indiretta
3. Reazione di water shift biologica 4. Foto-fermentazione
5. Fermentazione dark
nitrogenasi no proteine contenenti Mo e Fe. Questo enzima ha la proprietà di utilizzare il magnesio adenosin trifosfato (MgATP) e elettr vasta quantità di substrati, protoni inclusi. In seguito è schematizzata la reazione di formazione dell’idrogeno:
cono rispettivamente ad adenosin difosfato e fosfati organici.
L’enzima idrogenasi è presente nella maggior parte degli organismi fotosintetici; esistono due categori di questo enzima:
Uptake idrogenasi Idrogenasi inversa bassa temperatura);
- dissociazione dell’acido solforico, con produzione di vapore acqueo, ossigeno ed anidride solforosa, quest’ultima riciclata alla fase di produzione degli acidi;
- dissociazione catalitica dell’acido iodidrico con produzione di idrogeno e iodio; quest’ultimo viene riciclato alla reazione di produzione degli acidi (reazione debolmente endotermica, con temperature variabili in funzione dei
Il fenomeno della produzione di idrogeno da processi biologici fu osservato un seco urante la crisi petrolifera degli anni ’70, la tecnologia iniziò ad attirare le attenzioni degli studiosi, specialmente la produzione di
i ri uardano solo studi a d mostrata. La produz 1. Bio-fotolisi diretta 2.
Tutti i processi sono controllati dagli enzimi che catalizzano la reazione di produzione di idrogeno, come idrogenasi?? e nitrogenasi??. I maggiori costituenti dell’enzima
so
oni per ridurre un
2e- + 2H+ + 4ATP Æ H2 + 4ADP +4Pi dove ADP e Pi si riferis
Uptake idrogenasi agisce come atore nella reazione di consumo di idrogeno come segue:
H2 Æ 2e- + 2H+
Mentre, come suggerisce il nome stesso, l’enzima idrogenasi inversa catalizza sia la reazione di produzione che di consumo a seconda delle condizioni di reazione:
H2 = 2e- + 2H+ K
ssi sono utilizzabili er la produzione di idrogeno. Le proprietà degli enzimi idrogenasi e nitrogenasi sono riportate in tabella 1.2:
catalizz
oku et al. [6] riportano che benché una vasta quantità di substrati siano idonei allo sviluppo e alla crescita del Rhodobacter sphaeroides, solo alcuni di e
p
Tab. 1.2: Caratteristiche degli enzimi
BIOFOTOLISI DIRETTA
La fotolisi diretta biologica che porta alla produzione di idrogeno utilizza alghe che convertono l’energia solare in energia chimica sottoforma di idrogeno:
2 H2O Æ 2 H2 + O2 I due sistemi di fotosintesi responsabili del processo sono:
Fotosistema I (PSI) Fotosistema II (PSII)
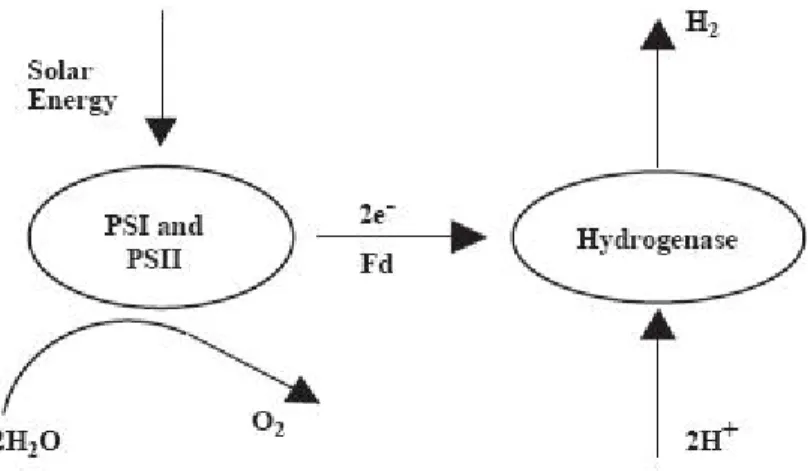
Il PSI produce il riducente responsabile della riduzione della CO2, mentre il PSII separa l’acqua sviluppando ossigeno. Nel processo di biofotolisi, due protoni possono contribuire sia alla riduzione della CO2 da parte del PSI, sia alla formazione di idrogeno in presenza di idrogenasi. Nelle piante, a causa della mancanza di idrogenasi, avviene solamente la riduzione della CO2, mentre nelle microalghe, come ad esempio le alghe verdi o Cyanobacteria (alga blu-verde), in presenza di idrogenasi si ha la reazione che porta alla formazione di idrogeno. Nel processo, degli elettroni sono generati quando il PSII assorbe energia luminosa. Essi sono poi trasferiti alla ferredoxina (Fd) impiegando l’energia solare
assorbita dal PSI. L’e dal Fd per produrre
idrogeno. Il processo appena descritto è schematizzato in figura 1.11: nzima idrogenasi acquista l’elettrone derivante
Fig. 1.11: Schema del processo di bio-fotolisi
A causa della sensibilità dell’enzima idrogenasi verso l’ossigeno, è necessario mantenere livelli di quest’ultimo sotto valori del 0.1% per permettere che la reazione avere luogo [7]. Tale condizione può essere realizzata impiegando l’alga verde Chlamydomonas reihaeditii, la quale esaurisce l’ossigeno durante i suoi processi ossidativi di respirazione [8]. Comunque, a causa delle significanti quantità di sostanze consumate in questo processo, l’efficienza complessiva risultante è bassa. Recentemente sono stati sviluppati microalghe modificate con tolleranze maggiori all’ossigeno che permettono rese di idrogeno più elevate. I lavori riguardanti questo argomento sono riportati in tabella 1.3 [9], in cui si evidenziano i risultati ottenibili con questo genere di alghe:
Tab. 1.3: Confronto produzione di idrogeno tra tipologie di microrganismi
Benemann [10] ha svolto uno studio sulla valutazione economica della produzione di idrogeno in cui si impiegh la fotolisi diretta, ottenendo valori nell’orrdine di 20 €/GJ, assumendo che il costo di investimento sia di circa 55 €/m² con un’efficienza di conversione dell’energia solare pari al 10%. Hallenbeck e Benemann [7] ricavano valori di costo simili.
BIOFOTOLISI INDIRETTA
Il concetto di biofotolisi indiretta, come suggerisce Gaudernack [11], coinvolge quattro passi fondamentali, riportati schematicamente in figura 1.12 e elencati in seguito:
Produzione di biomassa per mezzo di fotosintesi Concentrazione della biomassa
Fermentazione dark e acetati
Conversione degli acetati in idrogeno
Fig1.12: Schema biofotolisi indiretta
C6H12O6 + 12 H2O 12 H2 + 6 CO2
ura da 30 a 40 °C si riesce a ra
In un tipico processo di biofotolisi indiretto sono utilizzati Cyanobacteria, che producono idrogeno secondo la seguente reazione [5]:
12 H20 + 6 CO2 Æ C6H12O6 + 6 O2 Æ
Markov et al. [12] hanno compiuto studi riguardanti il processo utilizzando Cyanobacteria anabena variabilis sottoposto ad esposizione luminosa, ottenendo una produzione di idrogeno di circa 12.5 ml H2/g cdw (peso cella secca). Lo studio di Troshina et al. [13], in cui sono stati impiegati Cyanobacteria gloeocapsa alpicola, ha evidenziato come, mantenendo il pH fra valori in un range di 6.8 e 8.3, si ottengano le rese massime di produzione di idrogeno. Inoltre innalzando la temperat
ddoppiare la produzione. I costi di produzione di idrogeno con il processo di biofotolisi inversa si attestano intorno a 10 €/GJ [6], rendendolo comparabile con il processo in cui si utilizzano alghe verdi di biofotolisi diretta.
La tecnologia di biofotolisi inversa è comunque oggetto di un continuo sviluppo, i costi stimati quindi possono subire significativi cambiamenti grazie agli sviluppi ottenibili negli studi futuri.
REAZIONE DI WATER SHIFT BIOLOGICA
Alcuni batteri fotoeterotrofi, come ad esempio Rhodospirillum rubrum, possono sopravvivere al buio utilizzando CO come fonte di carbonio per la produzione di ATP accoppiando l’ossidazione della CO con la riduzione di H+ a H2 [14]:
CO + H2O = CO2 + H2, ∆G° = -20 kJ/kmol
con l’equilibrio della reazione spostato molto verso i prodotti. Gli organismi che utilizzano questa reazione nella loro ciclo di vita sono i batteri gram-negativi, come R. rubum e Rubrivax ydothermus e i batteri gram-positivi come Carbox-ydothermus
ydrogenoformans [15]. In condizioni anaerobiche, la CO induce la sintesi di alcune a Co-deidrogenasi, proteine Fe-S e CO-tollerante idrogenasi. G
atorio e solo alcuni lavori sono riportati in letteratura. L’obbiettivo comune consiste nell’identificare microrganismi con alte capacità di assorbimento della CO e nella stima del tasso di produzione di idrogeno. Kerby et al. [14] riportano che in condizioni anaerobiche, in assenza di energia luminosa e con quantità sufficienti di nickel, il tempo di duplicazione di R. rubrum diventa meno di 5 ore, in cui si realizza un’alta ossidazione della CO a CO2 associata a produzione di idrogeno. Comunque R. rubrum richiede energia luminosa per crescere e la produzione di idrogeno è inibita da pressioni parziali della CO2 più basse di 0.2 atm. Un’alternativa è l’utilizzo del batterio chemioeterotrofo Citrobacter sp. Y19,
testato da Jung et al. quantificata in 27
mmol/ g cella hr, corrispondente ad un valore triplo della produzione ottenibile con R. ru
evidenziato che la reazione biologica può essere competitiva quando la concentrazione di metano si attesta sotto il 3%. Il costo di produzione si aggira su valori di 14-18 €/GJ (1.75-2.25 €/kg h2) per una concentrazione di metano compresa tra 1 e 10%.
FOTO-FERMENTAZIONE h
protenine ed enzimi, inclusa l
li elettroni prodotti dall’ossidazione della CO sono utilizzati dalle proteine Fe-S e passati all’enzima idrogenasi per la produzione di idrogeno [16].
La reazione di water shift biologica è ancora studiata su scala di labor
[19]. La massima produzione di idrogeno è stata
brum.
Recentemente, Wolfrum et al. [17], hanno condotto studi dettagliati per confrontare la reazione biologica di water shift con quella convenzionale. La loro analisi ha
I batteri fotosintetici hanno la capacità di produrre id
dell’enzima nitrogenasi attivata dell’energia solare che va a reagire co anici o biomasse. Questo processo è schematicamente riportato in figura 1.13:
rogeno attraverso l’azione n acidi org
Fig. 1.13: Schema processo di foto-fermentazione
In questi anni, sono stati realizzati processi di produzione di idrogeno da fotofermentazione, in tabella 1.4 sono riassunti i principali lavori riportati in letteratura [18], in cui si produce idrogeno da biomasse e residui di lavorazione organici:
Tab. 1.4: Processi di foto-fermentazione
Questi processi hanno tre principali limitazioni [18]:
uso dell’enzima nitrogenasi che richiede alte energie di attivazione bassa efficienza di conversione dell’energia solare
necessità di complicati bioreattori anaerobici con elevate superfici esposte ad illuminazion
Alla luce di queste considerazioni e allo stato attuale delle tecnologie, il processo di foto-e
FERMENTAZIONE DARK
La fermentazione di batteri anaerobici, come microalghe verdi su substrati ricchi in arboidrati, a temperature comprese tra 30 e 80°C e in condizioni di oscurità, porta alla
produzione di idro ura 1.14:
c
geno [19]. Il processo è schematicamente illustrati in fig
Fig. 1.14: Schema processo di fermentazione dark
Il processo di fermentazione dark ha come prodotti una fase gassosa contenente principalmente H2 e CO2, ma sono presenti anche quantità non trascurabili di CH4, H2S e altri gas, dipendenti della tipologia di substrato impiegato. Utilizzando glucosio le reazioni possibili sono due:
C6H12O6 + 2 H2O Æ 2 CH3COOH + 4 H2 + 2 CO2 C6H12O6 + 2 H2O Æ CH3CH2CH2COOH + 4 H2 + 3 CO2
I prodotti risultanti sono costituiti da un miscela dei prodotti delle due reazioni [20].
La quantità di idrogeno prodotta nel processo di fermentazione dark dipende fortemente ddal valore del pH a cui si opera, pressione parziale dei gas e tempo di ritenzione in acqua (HRT). Le condizioni ottimali corrispondono a valori di pH compresi tra 5 e 6 [21]; con pressioni parziali di idrogeno elevate, è inibita la produzione dello stesso a favore della riduzione dei substrati come etanolo, acetone o butanolo [21]. Anche il fattore HRT gioca un ruolo chiave nella resa in idrogeno, Ueno et al [22] evidenziano come per tempi di HRT dell’ordine di 0.5 giorni possono portare a produzioni di circa 14 mmol/g carboidrato da acque di scarico per mezzo di microflora anaerobica. Incrementando il valore del HRT da 0.5 a 3 giorni, la produzione di idrogeno cala da 198 a 34 mmol/l giorno, mentre i carboidrati presenti vengono decomposti con efficienze che passano dal 70 al 97%. Grazie
al fatto che non è richiesta energia luminosa, la fermentazione dark non ha bisogno di aree di esposizione elevate come nel caso precedente e inoltre non è significativamente influenzata dalle condizioni climatiche. Per queste ragioni la fattibilità tecnologica del processo sta diventando sempre più interessante e promettente.