Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
I
Introduzione
1.1 Farmacogenetica e SNPs
I Polimorfismi a Singolo Nucleotide, comunemente detti SNPs, sono variazioni che derivano da sostituzioni di una singola base, diffusi nella popolazione con una frequenza superiore all’1-5%. L’interesse per questi polimorfismi nasce dall’idea che queste varianti alleliche siano alla base della variabilità genetica individuale ed in particolare su di essi si è concentrata l’attenzione della farmacogenetica, una branca della genetica che mira a identificare quei polimorfismi potenzialmente responsabili delle differenze interindividuali nella risposta ad una data terapia farmacologica.
Lo scopo di questi studi è quello di poter formulare delle terapie personalizzate in relazione a specifici genotipi, in modo da migliorare l’azione del farmaco e limitarne la tossicità. Questo approccio ha trovato ampio interesse soprattutto per quello che riguarda le terapie antitumorali, partendo dall’osservazione che molti pazienti affetti da neoplasie rispondono in maniera diversa ad uno stesso trattamento farmacologico, che ha indotto a pensare che alla base di queste differenze possa esserci una diversa costituzione genetica.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
1.2 Il Mieloma Multiplo
1.2.1 Eziologia e patogenesi
Il Mieloma Multiplo (MM) è una neoplasia ematologica maligna, caratterizzata dalla proliferazione e dall’accumulo di plasmacellule mielomatose a livello del midollo osseo, generalmente derivanti da un unico clone neoplastico (Figura 1.2.1).
Figura 1.2.1 plasmacellule mielomatose nel midollo osseo
L’aggettivo “multiplo” si riferisce al fatto che le plasmacellule maligne hanno la tendenza a raggrupparsi nel midollo, dando origine a focolai di malattia che possono portare a indebolimento delle ossa; questi focolai furono chiamati mielomi per la loro consistenza molle simile al miele.
Il quadro clinico è dominato dalla malattia ossea, ma può estendersi anche ai linfonodi e a localizzazioni extrascheletriche, determinando l’insorgenza di gravi alterazioni fisiopatologiche che si traducono in sintomi altrettanto gravi. Si osservano nella maggior parte dei casi dolori ossei associati a lesioni osteolitiche; ipocalcemia conseguente al riassorbimento osseo, responsabile di manifestazioni neurologiche quali confusione, debolezza, letargia, stipsi e poliuria; anemia; alterazione della normale produzione di immunoglobuline con conseguente danno renale; suscettibilità alle infezioni e immunosoppressione. Nel 99% dei pazienti affetti da mieloma l’analisi elettroforetica mette in evidenza
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
un aumento dei livelli di immunoglobuline nel sangue e/o di catene leggere (proteine di Bence Jones) nelle urine.
La più frequente Ig monoclonale sierica (proteina M) è di tipo IgM e si osserva nel 55% dei pazienti. Un altro 25% di casi si associa a proteine M di tipo IgA; molto rari sono i mielomi che esprimono IgG, IgD o IgE. L’eccessiva produzione di proteina M porta alla sindrome da iperviscosità in circa il 7% dei casi.
Il Mieloma Multiplo rappresenta l’1% di tutte le neoplasie maligne, e quasi il 10% dei tumori ematologici [1]. La sua incidenza, a livello mondiale, è maggiore negli uomini che nelle donne, nella popolazione africana rispetto a quella bianca, e negli adulti rispetto ai giovani, con un'età di insorgenza media che si attesta attorno ai 60 anni. In Italia, l’incidenza registrata è di 2-4 nuovi casi ogni 100.000 abitanti all’anno, con una frequenza leggermente superiore tra gli uomini. L’età media di insorgenza è intorno ai 60 anni. La prognosi è infausta[2] , anche se con lo sviluppo di nuove terapie si è passati da una sopravvivenza media di 2 anni nel 2002 ai 4-5 attuali.
Il decorso della malattia può procedere attraverso diverse fasi: una fase inattiva in cui le cellule tumorali sono ancora plasmacellule non proliferanti; una fase attiva in cui si registra una percentuale di cellule proliferanti inferiore all’1%; una fase fulminante caratterizzata da un’importante proliferazione e da un notevole incremento di plasmoblasti[3].
Le cause del Mieloma Multiplo sono tuttora sconosciute, ma sono da considerare importanti fattori di rischio sia la componente genetica sia l’esposizione ambientale ed occupazionale a sostanze chimiche tossiche, quali i pesticidi, e alle radiazioni. Nonostante la patogenesi non sia ancora del tutto nota, si ritiene che l’evento che dà inizio allo sviluppo neoplastico sia da ricercare nelle fasi di differenziazione e sviluppo delle cellule B in plasmoblasti a livello dei centri germinativi.
Nel normale sviluppo le cellule B premature, in contatto con gli antigeni, vanno incontro a proliferazione e differenziazione dando origine a due tipi cellulari: le cellule B di memoria e i plasmoblasti; questi ultimi possono completare la fase di differenziazione dando origine a plasmacellule a vita
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
breve secernenti prevalentemente IgM che permangono nel sito locale e muoiono entro 3 giorni; alternativamente le cellule B mature possono entrare nei centri germinativi e andare incontro a un processo di ricombinazione sito-specifica, caratterizzata da riarrangiamenti genici che coinvolgono le catene pesanti delle Ig. I plasmoblasti risultanti dallo switching isotipico migrano nel midollo osseo dove interagiscono con le cellule stromali e si differenziano in cellule a vita lunga, in grado di sopravvivere fino a 30 giorni [4].
Secondo le teorie più recenti, la cellula clonogenica del mieloma multiplo potrebbe essere una cellula della fase differenziativa antigene-dipendente che ha subito selezione antigenica a livello del centro germinativo; i precursori neoplastici migrerebbero nel midollo osseo favoriti dal loro asserto genetico e, in contatto con le cellule stromali, andrebbero incontro a maturazione in plasmacellule. In questi termini lo sviluppo neoplastico deve quindi esser considerato come il risultato di più fattori che comprendono, oltre che alterazioni nel cariotipo, anche l’influenza di fattori di crescita secreti sia direttamente dalla cellula neoplastica sia dalle cellule circostanti e da fattori prodotti nel microambiente del midollo osseo[3,4].
Dati riportati in letteratura mettono in evidenza un’alta frequenza di alterazioni del cariotipo in circa il 30-50% dei casi di mieloma[5-16]; frequenza e tipo di alterazione sono da mettere in relazione con lo stadio, la prognosi e la risposta alla terapia. Almeno un cromosoma risulta triallelico nell’89-96% dei casi di mieloma[17,18]; le alterazioni numeriche caratteristiche sono la monosomia 13 e le trisomie a carico dei cromosomi 3, 5, 7, 9, 11, 15 e 19. Alterazioni strutturali tipiche sono le traslocazioni a carico dei loci 14q32 (locus IgH), riscontrabile nel 20-40% dei casi e 11q13 (locus bcl-1) in circa il 20% dei casi; la delezione interstiziale di 13q14 nel 15% dei casi e il coinvolgimento di 8q24 in circa il 10% dei pazienti[19].
Nel 39% dei pazienti con mieloma multiplo di nuova diagnosi si registra una mutazione del gene Ras e sembra che la frequenza aumenti col progredire della patologia. Mutazioni attivanti di Ras possono portare all’indipendenza ai fattori di crescita e all’inibizione dell’apoptosi dei linfociti B mielomatosi. La traslocazione 14q18 coinvolge la proteina antiapoptotica Bcl-2 che conferisce
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
protezione e resistenza all’apoptosi dagli effetti del desametasone e deprivazione di citochine trofiche e farmaci citotossici. Molto frequenti nel MM sono anche le mutazioni a carico dell’oncogene retinoblastoma (Rb); le cellule tumorali esprimono una proteina Rb iperfosforilata che controlla l’entrata della cellula nel ciclo cellulare; al contrario di quanto avviene nei linfociti B normali, nelle cellule neoplastiche il fattore di crescita trasformante (TGF-β) non sopprime la fosforilazione di Rb, ma stimola la crescita cellulare, nonostante la presenza di una chinasi ciclina-dipendente. Nel 5% dei pazienti, e solo in fase avanzata della malattia, è possibile osservare anche una mutazione a carico dell’oncosoppressore p53[19]. La sopravvivenza, la proliferazione e la differenziazione delle cellule neoplastiche nel midollo osseo durante i diversi stadi della malattia sono strettamente dipendenti dalla presenza di fattori di crescita e citochine[20,21]. È ormai noto da tempo il ruolo dell’interleuchina-6 nella crescita delle cellule mielomatose, che sono in grado di produrre autonomamente la citochina e di esprimere il suo recettore IL-6R[22-24]. Fattori di crescita certamente implicati nel processo proliferativo sono il fattore di crescita ematopoietico (G-CSF), analogo strutturale dell’IL-6, responsabile dell’induzione del fattore di trascrizione implicato nella sintesi della citochina[21,25]; l’interferon-α (INF-α), in grado di stimolare la proliferazione mielomatosa; IL-10, fattore di crescita che aumenta la risposta cellulare all’IL-11 probabilmente regolando l’espressione del suo recettore[26]. Da alcune ricerche effettuate risulta che anche altri fattori, quali il GM-CSF, IL-3, SCF, TNF-α, HGF; IGF-1 e IGF-2 abbiano un ruolo di primaria importanza nella patogenesi del mieloma[27]. La diffusione cellulare risulta invece, in una certa misura, controllata da fattori di inibizione; di grande rilevanza sembrano essere l’interferon-γ, TNF-α e TGF-β, che sembrano agire da inibitori della proliferazione cellulare[21,28].
Un altro fattore che ricopre un ruolo fondamentale nella crescita tumorale è il microambiente del midollo osseo; per proliferare le cellule hanno bisogno di comunicare con l’ambiente esterno, e tale comunicazione è resa possibile dalla presenza di molecole di adesione, espresse sulle stesse cellule mielomatose.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
1.2.2 Le terapie
Il Mieloma Multiplo è una malattia progressiva per la quale una remissione duratura è possibile solo se il tumore è localizzato in un unico punto, il cosiddetto plasmacitoma extramidollare o solitario, e nei pazienti più giovani dopo trapianto allogenico di midollo osseo. Nelle forme gravi di mieloma l’obiettivo della terapia è essenzialmente quello di prolungare la speranza di vita del paziente ottimizzandone la qualità della vita.
Poiché la progressione del tumore allo stadio I non è certa e richiederebbe comunque molti anni, generalmente si preferisce evitare gli effetti collaterali del trattamento farmacologico e quindi non si procede ad una terapia.
Per la cura del mieloma sarebbe ideale il trapianto allogenico, ma l’età del donatore e soprattutto il ridotto numero di donatori compatibili riduce drasticamente il numero di pazienti trattabili ed anche il rischio derivante dal trapianto stesso è elevato. Questo ha fatto si che l’attenzione si concentrasse sul trapianto autologo di midollo con supporto di cellule staminali periferiche.
Nel corso degli anni sono stati sviluppati diversi farmaci e messi a punto diversi protocolli terapeutici basati sulla chemioterapia convenzionale, essendo la malattia disseminata in tutto il corpo già al momento della diagnosi; mentre la radioterapia è riservata ai casi di tumore localizzato e utilizzata prevalentemente a scopo antidolorifico, soprattutto nelle fratture e in caso di intenso dolore. Lo scopo delle moderne terapie per il trattamento del MM mira a ottenere una remissione completa (CR) della malattia, anche in presenza di tracce di proteina M nel siero.
Per molti anni la terapia d’elezione è stata considerata la combinazione Melfalan Prednisone (MP) che dava dei buoni risultati in oltre il 60% dei pazienti trattati, anche se nessuno andava incontro a remissione completa e la sopravvivenza si attestava intorno ai 12-30 mesi. Lo svantaggio di questa terapia, legato all’elevata tossicità per le cellule staminali del midollo osseo, ha portato allo sviluppo di nuovi regimi terapeutici basati essenzialmente sulla combinazione di più farmaci che generalmente includevano infusione continua di vincristina e adriamicina in modo da migliorare la sopravvivenza e il grado di
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
risposta. Tuttavia, la risposta non era significativamente diversa rispetto al trattamento MP.
Nel 1984, per la prima volta, venne impiegata la combinazione vincristina, adriamicina (doxorubicina) e desametasone (VAD) in pazienti refrattari o in ricaduta, osservando un miglioramento della prognosi. Risultati ottenuti da studi clinici mettevano in evidenza una remissione nel 32% dei pazienti resistenti primari e nel 65% dei pazienti recidivanti[29]. Utilizzato come terapia di prima linea mostrava un grado di risposta alto (55-84%) e rapido, ma senza un rilevante prolungamento della sopravvivenza (36-44 mesi). Il trattamento VAD sostituì in poco tempo la terapia MP, non solo per la migliore risposta nel paziente, ma anche perché non danneggiava le cellule staminali sane del midollo osseo. Negli ultimi anni la terapia DAV è stata utilizzata come “terapia d’induzione” preparatoria ad una somministrazione di Melphalan ad alte dosi in quei pazienti candidati a subire un trapianto autologo di cellule staminali di midollo osseo sane (ASCT), precedentemente prelevate.
Un limite di questi agenti chemioterapici deriva dalla loro incapacità di distinguere tra cellule sane e cellule neoplastiche, e quindi la loro azione antiproliferativa si esplica a vari livelli sull’organismo, con la conseguenza che in alcuni casi gli effetti tossici sono così gravi che la terapia deve essere sospesa. D’altra parte non tutti i pazienti rispondono al trattamento e in molti casi si sviluppano fenomeni di resistenza che sono stati messi in relazione con l’alterazione dei sistemi di trasporto dei farmaci attraverso la membrana della cellula bersaglio, con il risultato che la concentrazione del farmaco nella cellula può non raggiungere livelli sufficienti per ottenere l’effetto terapeutico desiderato.
Molti progressi son stati fatti soprattutto nell’ultimo decennio nel trattamento del mieloma con l’introduzione di Talidomide[30], Bortezomib[31,32] e Lenalidomide[33,34], farmaci di ultima generazione utilizzati ad oggi per trattare pazienti che non rispondono alle terapie convenzionali (recidivi o refrattari).
L’azione antitumorale della Talidomide fu scoperta intorno agli anni ’60, ma la teratogenicità ad essa associata pose un limite alla sua immissione sul mercato [35].
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Nel 1994 D’Amato et al[36] descrissero per la prima volta le proprietà antiangiogeniche della talidomide in uno studio sul coniglio; tale osservazione fu confermata da Barlogie[30] che nel 1997 condusse uno studio su un gruppo di 84 pazienti affetti da mieloma; il 32% dei pazienti rispondeva alla terapia con talidomide, che in pochissimi anni è diventato il principale farmaco per il trattamento del mieloma.
Gli studi condotti da Barlogie furono confermati da molti altri ricercatori[37]. L’efficacia della talidomide risultava aumentata in associazione con altri farmaci; in particolare, si osservava una risposta nel 50% dei pazienti sottoposti a trattamento con talidomide e steroidi, e del 65% con terapia basata sull’associazione di talidomide, steroidi e ciclofosfamide.
La teratogenicità della talidomide ha spinto molte case farmaceutiche a sintetizzare analoghi strutturali che presentassero la medesima efficacia terapeutica con minori effetti tossici; questo ha portato, nel 1990, all’introduzione della Lenalidomide.
Richardson et al.[34] condussero uno studio su 102 pazienti con mieloma refrattario; la somministrazione della sola lenalidomide dava una risposta nel 17% dei pazienti; in un secondo studio condotto alla Mayo Clinic, si registrava una risposta in 31 di 34 pazienti (91%) a cui era somministrata l’associazione lenalidomide desametasone[33].
Nel 2006 la FDA ha approvato il protocollo terapeutico lenalidomide/desametasone per il trattamento di pazienti affetti da mieloma risultati refrattari alle terapie convenzionali.
Un protocollo terapeutico di recente introduzione prevede l’utilizzo dell’inibitore proteasomico Bortezomib, o Velcade. L’interesse per questo farmaco nacque dall’osservazione che il blocco del proteasoma, una struttura deputata alla degradazione delle proteine e implicata in numerosi processi fisiologici, induceva apoptosi in cellule tumorali maligne, trasformate e proliferanti.
Furono sviluppati molti inibitori proteasomici, la maggior parte dei quali non furono però ritenuti adatti per scopi clinici. Adams et al[38] disegnarono e svilupparono dei composti derivati dall’acido boronico in grado di inibire in
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
maniera selettiva e specifica il sistema proteasomico; tra questi il bortezomib, un dipeptide di acido boronico fu successivamente selezionato per studi preclinici e clinici[31].
Studi preclinici dimostrarono che il bortezomib aveva potenti effetti citotossici e di inibizione della crescita cellulare. Il primo studio clinico su tumori ematologici maligni, condotto da Orlowski[39] mostrò una potente azione antimielomatosa del farmaco nella fase I dello studio. Importanti risultati furono ottenuti nello stesso periodo da esperimenti condotti da Anderson[40].
Lo studio condotto da Orlowski su pazienti refrattari al trattamento con le terapie convenzionali ottenne una buona risposta in un paziente su tre[31] e portò all’approvazione del Bortezomib da parte della FDA nel 2003 come farmaco di ultima scelta per il trattamento del Mieloma Multiplo.
Gli studi preclinici condotti in vitro sono stati confermati in un trial di fase I su tumori ematologici[39] e successivamente in uno studio di fase II su pazienti recidivi e refrattari. Su 193 pazienti, il 4% raggiunse una remissione completa, il 6% una remissione quasi completa, il 18% una risposta parziale e il 7% una risposta minima. La sopravvivenza media era di circa 16 mesi con risultati migliori nei pazienti in cui si era registrata una remissione completa rispetto agli altri. Di 74 pazienti che non raggiunsero la remissione completa e ricevettero successivamente desametasone in combinazione con bortezomib, il 18% ottenne dei miglioramenti; di questi, sei erano risultati refrattari al trattamento con il solo desametasone mettendo in luce un’azione del bortezomib anche nello sconfiggere la resistenza al desametasone. Effetti collaterali erano essenzialmente nausea, vomito, diarrea, stanchezza, perdita di appetito inclusa anoressia, costipazione, neuropatia periferica, piressia, anemia e trombocitopenia.
Risultati interessanti si ottennero valutando l’effetto della somministrazione di bortezomib insieme a desametasone e adriamicina; la risposta era alta, ma si osservava anche una notevole tossicità mentre la somministrazione del solo bortezomib mostrava una bassa tossicità, ma una minor risposta[53].
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
In un successivo studio randomizzato si osservò che il tempo di progressione tumorale era superiore con bortezomib rispetto al desametasone in pazienti refrattari[32].
Recentemente il bortezomib è stato somministrato in associazione con altri farmaci mettendo in luce una risposta più efficace; in particolare con la somministrazione di Melphalan, Prednisone e Bortezomib (MPV) in pazienti con nuova diagnosi di mieloma di età superiore ai 65 anni si ottenne una risposta nel 89% dei casi con una remissione completa nel 3% dei pazienti[41]. In una fase successiva il protocollo MPV fu confrontato con la terapia MP mettendo in luce una maggior efficacia del nuovo protocollo.
1.3 Il meccanismo d’azione del Bortezomib
Il successo dello sviluppo della terapia basata su bortezomib nel trattamento del mieloma multiplo ha definitivamente accertato l’inibizione del proteasoma come efficace strategia terapautica[40, 42,43].
Figura 1.3.1 Formula di struttuta del bortezomib
Il bortezomib è un potente inibitore proteasomico, altamente selettivo e
reversibile che lega la subunità 26S del complesso inibendone la funzione. Il proteasoma 26S è una proteasi multicatalitica ATP-dipendente che
media la degradazione di proteine intracellulari. La degradazione proteasomica di proteine danneggiate o alterate parte dal riconoscimento delle proteine poliubiquitinate da parte della subunità regolatoria 19S presente sul proteasoma
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
che vengono successivamente idrolizzate a piccoli polipeptidi. Oltre a eliminare le proteine, il proteasoma riveste anche un ruolo chiave in processi cellulari che includono la modulazione di fattori di trascrizione, la progressione del ciclo cellulare, il blocco della crescita e l’apoptosi.
Molti studi hanno mostrato che gli inibitori proteasomici hanno azione citotossica maggiore sulle cellule tumorali rispetto a quelle sane[44,45]; questo potrebbe essere spiegato col fatto che le proteine del ciclo cellulare nelle cellule maligne che determinano un incremento del tasso di proliferazione sono alterate e si accumulano causando un’aumentata dipendenza dai processi di degradazione proteasomica.
È importante notare che il bortezomib attiva l’apoptosi nelle cellule mielomatose a dosi che non alterano la vitalità dei linfociti normali[40]; inoltre, il fattore nucleare NF-kB che è implicato nei processi di proliferazione e resistenza ai farmaci nelle cellule tumorali, incluse quelle mielomatose, è regolato dallo stesso bortezomib, che probabilmente agisce aumentando gli effetti citotossici della chemioterapia[40,46,47].
L’attivazione costitutiva di NF-kB è legata ai meccanismi di crescita, proliferazione e resistenza ai farmaci, e probabilmente conferisce diversa sensibilità agli inibitori del proteasoma nelle cellule cancerose rispetto a quelle sane[47]. L’attivazione del fattore nucleare avviene attraverso diverse fasi che possono essere così riassunte: fosforilazione di IkB a opera della chinasi IkBα; ubiquitinazione e degradazione di IkB fosforilata risultante nei complessi liberi p50/65; traslocazione nucleare e attivazione del complesso p50/65 NF-kB[48]. Una volta nel nucleo, NF-kB si lega alla sua sequenza di consenso presente nella regione promotrice e attiva la trascrizione di molte proteine, tra cui le citochine (IL-6, IL-10, IL-11; IL-1; TNF-α), fattori di sopravvivenza e molecole di adesione cellulare, che facilitano la crescita e la sopravvivenza delle cellule tumorali.
NF-kB media funzioni cellulari importanti per lo sviluppo del mieloma multiplo, incluse la risposta immunitaria, la crescita, la sopravvivenza e l’apoptosi, infatti, l’attivazione intrinseca del fattore nucleare è associata alla proliferazione mielomatosa. L’adesione delle cellule mielomatose allo stroma
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
del midollo osseo attiva la trascrizione e la secrezione di IL-6 e IGF-I[49], entrambi fattori che promuovono la sopravvivenza delle cellule tumorali nel midollo osseo tramite il blocco dell’apoptosi indotta da agenti convenzionali quali il desametasone[43].
Cellule mielomatose resstenti mostrano una sovraespressione di NF-kB rispetto alle cellule normali, mentre cellule sensibili mostrano un’attività più bassa[50].
Il trattamento con bortezomib previene la degradazione di IkB, probabilmente bloccando non soltanto l’attivazione di NF-kB ma anche la produzione delle citochine correlate.
Studi in vitro[51] hanno dimostrato che l’apoptosi indotta dal bortezomib è associata ai seguenti eventi:
• sovraespressione di proteine di risposta allo stress;
• up-regulation di c-jun;
• alterazione del potenziale della membrana mitocondriale e produzione di specie reattive dell’ossigeno;
• induzione di pathway di morte cellulare intrinseci;
• attivazione di segnali di apoptosi estrinseci;
• indebolimento dei meccanismi di riparazione del DNA tramite l’inattivazione di proteine chinasi DNA-dipendenti;
• blocco dell’adesione di cellule mielomatose alle cellule stromali del midollo osseo e della secrezione delle citochine correlate;
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Figura 1.3.2 Meccanismo d’azione del Bortezomib
Studi condotti da Chauchan et al[51] hanno mostrato che il bortezomib innesca l’apoptosi nelle cellule mielomatose in presenza di p53 sia wild-type che mutato, e questo è in accordo con altri studi condotti su altre forme tumorali[51]. Inoltre, l’apoptosi indotta da bortezomib nelle cellule mielomatose correla con la fosforilazione di p53.
Studi in vivo condotti su un modello murino hanno confermato i risultati degli studi condotti in vitro dimostrando un’importante attività antitumorale a dosi ben tollerate dall’animale[51].
Il bortezomib si è dimostrato un buon farmaco antimielomatoso, tuttavia una prolungata esposizione rende il paziente più suscettibile allo sviluppo di resistenza ed è associato ad un certo livello di tossicità. Per superare il problema della resistenza è necessario conoscere i meccanismi con cui essa si manifesta; Chauchan ha dimostrato che la chemioresistenza nelle cellule di mieloma multiplo è associata ai seguenti eventi: sovraespressione di P-glicoproteina; attività di proteine antiapoptotiche; difetti nei meccanismi apoptotici indotti da farmaci; eccessiva espressione di recettori per i fattori di crescita; interazione tra le cellule tumorali e il microambiente midollare. Da ciò deriva quindi l’idea che combinare il bortezomib con altri agenti quali il desametasone, la doxorubicina, il melphalan possa aumentare sinergisticamente o in maniera additiva l’azione antitumorale[40,50].
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Studi recenti hanno provato che alcune proteine, in particolare la Hsp27 (Heat Shock Protein 27) e Bcl2, sono in grado di conferire alle cellule mielomatose resistenza al bortezomib; questa tesi è stata confermata dall’osservazione che la proteina Hsp27 è molti più espressa nelle cellule mielomatose di pazienti refrattari al trattamento e che, bloccandone l’attivazione, è possibile sensibilizzare la cellula all’azione antitumorale del farmaco[53]; è probabile che anche la sovraespressione di inibitori delle proteine apoptotiche, quali XIAP, possano contribuire allo sviluppo della resistenza.
1.4 Il Sistema Ubiquitina- Proteasoma
Il sistema proteasomico rappresenta uno dei principali meccanismi di regolazione della concentrazione proteica, attraverso un processo di degradazione delle proteine danneggiate o non necessarie tramite un processo proteolitico, ovvero una reazione chimica che, tramite l’azione di specifiche proteasi, taglia i legami peptidici. Si tratta di un grosso complesso proteico presente in alcuni batteri e in tutti gli eucarioti dove trova localizzazione sia nel nucleo che nel citoplasma.[54]
Prima di scoprire questo complesso, si pensava che la degradazione proteica fosse legata esclusivamente all’attività dei lisosomi, piccoli organelli citoplasmatici che, con un meccanismo ATP-dipendente, attaccano la proteina scomponendola in piccoli peptidi che vengono riciclati[55].
Studi sulla degradazione proteica nel reticolocita fecero supporre l’esistenza di un meccanismo alternativo[56] che fu confermata fra gli anni settanta e ottanta da Hershko, Ciechanover e Rose, che individuarono il complesso proteico del proteasoma, la cui struttura fu però visibile solo nel 2004 grazie alla cristallografia a raggi X. Per l’importanza di questa scoperta, i tre ricercatori ricevettero, nel 2004, il Premio Nobel per la chimica.
Non è stato ancora del tutto chiarito quali siano gli eventi iniziali della degradazione ma è certo che essa sia il risultato dell’interazione di molti fattori
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
tra cui, di fondamentale importanza, la presenza di specifiche sequenze o residui amminoterminali. Sembra inoltre che proteine vecchie mostrino un residuo idrofobico dovuto alla denaturazione che viene riconosciuto attivando la degradazione proteica e modificazioni post- trasduzionali indotte da segnali cellulari. È proprio questa degradazione selettiva delle proteine che gioca un ruolo fondamentale nel mantenere e regolare la concentrazione delle proteine cellulari[57].
Il rilascio di singoli amminoacidi da una proteina è il risultato di due diverse fasi, una ATP-dipendente e una ATP-indipendente. Nella prima fase le proteine vengono poliubiquitinate e legate a regolatori di proteasi ATP-dipendenti, poi vanno incontro a cambiamenti conformazionali, guidati dall’idrolisi del’ATP che ne determinano l’apertura e sono attivamente traslocate nelle strutture catalitiche presenti nel proteasoma; nella seconda fase i polipeptidi sono degradati in maniera ATP-indipendente da endopeptidasi, amminopeptidasi e carbossipeptidasi.
Le proteine da degradare sono marcate dall’ubiquitina, una proteina costituita da 76 amminoacidi la cui glicina sull’estremità carbossi-terminale lega il gruppo ε- amminico della lisina della proteina bersagli, mentre un legame simile si forma tra il carbossi-terminale dell’ubiquitina con il gruppo ε-amminico di una seconda ubiquitina fino a formare catene poliubiquitinate. In alcune proteine la poliubiquitinazione può avvenire a livello di residui ammino-terminali[58]. La lisina su cui avviene l’ubiquitinazione è importante in quanto il processo di degradazione proteasomica viene avviato dal legame della Lys-48 e della Lys-29 mentre se il legame avviene su altri residui, ad esempio sulla Lys-63, vengono attivati un processo di riparazione del DNA e l’attivazione di fattori di trascrizione[59]. La monoubiquitinazione sembra correlata invece con l’endocitosi, la regolazione istonica e la crescita vitale[60].
Il processo di ubiquitinazione richede l’intervento di tre complessi enzimatici che agiscono in successione: l’enzima di attivazione E1 trasferisce l’ubiquitina sull’enzima carrier E2 che a sua volta marca l’ubiquitina sul substrato prescelto con l’aiuto dell’enzima E3.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
La selettività e la specificità del Sistema Ubiquitina-Proteasoma (UPS) per le proteine poliubiquitinate è aumentata dalle ligasi E3 che riconoscono i substrati e attivano dei segnali di degradazione[58]. Analisi genomiche hanno rivelato l’esistenza di pochi geni codificanti per E1, circa dieci per E2 e centinaia per E3[61].
L’attivazione dell’ubiquitina è mediata dall’enzima E1 in presenza di ATP con conseguente formazione di ubiquitina-AMP come intermedio e l’estere tiolico ubiquitina-E1 come prodotto finale che è riconosciuto dagli enzimi E2 sui quali viene trasferita l’ubiquitina; tutti gli enzimi E2 condividono un core utilizzato per il legame E2-E3. E3 è responsabile della selettività del legame ma esiste un ulteriore enzima, E4, che supporta la formazione di coniugati poliubiquitinati[62].
Una volta che la proteina è stata riconosciuta è necessario rimuovere l’ubiquitina affinchè essa possa entrare nel complesso per essere degradata e questo passaggio è mediato da due famiglie di enzimi proteolitici, enzimi di processamento dell’ubiquitina (UBP) e idrolasi carbossi-terminali (UBH) dei quali UBP rimuove l’ubiquitina dalle proteine mentre UBH genera ubiquitine monomeriche[59].
Figura 1.4.1 Sistema Ubiquitina-Proteasoma
Il proteasoma 26S è costituito da due subunità: una subunità 20S che si sviluppa attorno al core proteolitico e un cappuccio 19S anche conosciuto come
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
PA700; quest’ultimo si lega alla subunità maggiore su entrambe le estremità formando due cappucci che si aprono in presenza di ATP favorendo l’ingresso della proteina nel sito di degradazione. Il complesso 19S può essere scomposto in due piccole strutture, una base e un cappuccio costituite rispettivamente di nove e otto subunità. L’intero complesso proteasomico ha un peso molecolare di 2000 kDa.
Il proteasoma 20S si compone di quattro anelli impilati l’uno sull’altro, ciascuno contenente sette unità: le subunità sono di tipo α negli anelli esterni e di tipo β negli anelli interni. La componente α, molto più conservata rispetto alla
β, forma una barriera selettiva tra il sito catalitico e il citoplasma ed è il sito di legame di diverse particelle regolatorie, ma anche un sito di regolazione dell’ingresso e dell’uscita dei substrati.
Figura 1.4.2 struttura del proteasoma
Molte subunità β hanno delle pro-sequenze che vengono eliminate esponendo il residuo di treonina sull’N-terminale considerato un componente critico nel sito attivo del proteasoma. Negli eucarioti solo tre delle subunità β
(β1, β2 e β5) in ogni anello sono processate per esporre la treonina N-terminale, anche se l’analisi cristallografica ha mostrato che anche la subunità
β7 viene processata[63].
Le tre principali attività peptidasiche ritrovate nei proteasomi eucariotici sono attività caspasi-simile, tripsina-simile e chimotripsina-simile, correlate rispettivamente alle subunità β1, β2 e β5, mentre le altre quattro subunità hanno propeptidi non processati (β3 e β4) o processati solo parzialmente (β6 e
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
β7). Studi sul proteasoma umano hanno dimostrato che esso può rompere legami peptidici in posizione P1 su molti amminoacidi, con preferenza per l’alanina e la leucina; inoltre glutammina, valina, isoleucina, leucina e asparagina influenzano l’attività del proteasoma.
I peptidi che si generano dalla degradazione hanno dimensioni che variano da 3 a 25 amminoacidi; l’idea è che il proteasoma processi i peptidi fino a quando essi sono abbastanza piccoli da diffondere fuori dal sito proteolitico.
Oltre al proteasoma costitutivo, è stata descritta un’ulteriore struttura definita immunoproteasoma, ritrovata prevalentemente nelle cellule ematopoietiche e attivata da infezioni microbiche e da citochine le quali inducono l’espressione di tre subunità, β1i, β2i e β5i[64].
Analisi cristallografiche a raggi X hanno mostrato che i quattro anelli del proteasoma formano una struttura cilindrica con uno stretto canale nel quale è localizzato il sito attivo con un diametro di circa 53Ǻ; l’unità PA700 induce l’apertura dei cancelli degli anelli α consentendo l’accesso dei substrati al sito catalitico.
Il taglio peptidico avviene in seguito a idrolisi dell’intermedio acil-enzima derivante dal legame dell’enzima stesso con il gruppo carbonile del substrato.
Il modello generale che spiega l’assemblaggio del proteasoma implica la formazione di un anello contenente le subunità α seguito dall’incorporazione delle subunità β in un altro anello; questi emiproteasomi vanno incontro a dimerizzazione seguita dal taglio delle prosequenze nelle unità β, molto probabilmente per autocatalisi. Studi hanno dimostrato che le prime subunità β
che vanno a legarsi al complesso sono le unità β3 e β4; probabilmente l’incorporazione della prima subunità facilita l’aggregazione delle successive.
Nelle cellule di mammifero il proteasoma è localizzato prevalentemente nel nucleo, ma è anche associato con strutture citoscheletriche, quali reticolo endoplasmatico e membrana plasmatica, suggerendo che il proteasoma si sposti dal citoscheletro verso il nucleo in maniera molto lenta e unidirezionale.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Oltre che alla subunità 19S, il proteasoma 20S potrebbe essere associato in maniera ATP-indipendente ad altri attivatori, quali PA28 e il regolatore 11S, a formare un complesso che dà il via all’attività proteasomica.
Così come avviene per molte altre strutture presenti nell’organismo, anche il proteasoma può essere inibito; molti inibitori sono dei peptidi che mimano gli enzimi, oppure si tratta di analoghi dello stato di transizione di reazioni catalizzate da enzimi; tutti agiscono inibendo l’enzima in maniera reversibile o irreversibile formando un addotto covalente tra l’inibitore e il sito catalitico dell’enzima. L’importanza che il sistema UPS riveste in molti processi biologici ha fatto si che proprio questi inibitori diventassero degli importanti bersagli farmacologici.
I primi inibitori scoperti furono dei peptidi aldeidici noti come inibitori della calpaina I, che inibivano in maniera reversibile il proteasoma 20S modificando il gruppo catalitico idrossilico. Essi si possono rapidamente dissociare dal proteasoma ed essere ossidati ad acidi inattivi. Inibitori molto più potenti sono i derivati dell’acido boronico, da cui è stato sintetizzato il bortezomib e che agisce in maniera irreversibile sul proteasoma mostrando una marcata azione anti- tumorale.
L’inibizione del proteasoma determina morte cellulare per apoptosi tramite la modulazione dei livelli di diverse proteine a vita breve, l’inibizione dell’attività del fattore nucleare NF-kB e Tp53, bloccando il ciclo cellulare e la riparazione del DNA.
I sistemi in cui UPS è attivo sono:
• regolazione del ciclo cellulare: due classi di ligasi E3 sono attive in questo meccanismo, i complessi SCF e il complesso che promuove il passaggio in anafase;
• cancro e sopravvivenza cellulare: il soppressore tumorale p53 gioca un ruolo chiave nella regolazione dell’arresto del ciclo cellulare;
• risposte infiammatorie: NF-kB è un fattore di trascrizione che, legandosi alla regione promotrice del DNA, induce l’espressione di numerosi geni della risposta infiammatoria;
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
• risposta immunitaria: il sistema UPS degrada molte proteine, self o microbiche, presentate dal complesso MHC di classe I;
• ripiegamento errato delle proteine: UPS interagisce coi membri della famiglia delle proteine di risposta allo shock e con cofattori per eliminare le proteine mal ripiegate;
• degradazione di proteine associate all’ER;
• progressione delle malattie.
1.5 NF-kB: struttura e meccanismo d’azione
NF-kB (Nuclear Factor- kappa B) è un complesso proteico che agisce da fattore di trascrizione ed è stato ritrovato in quasi tutti i tipi cellulari animali. È implicato nelle risposte cellulari a stimoli quali stress, citochine, radicali liberi, radiazioni ultraviolette, LDL ossidati e antigeni virali e batterici[65]. NF-kB gioca un ruolo fondamentale nella regolazione della risposta immunitaria alle infezioni, tanto che una sua alterazione è stata messa in relazione con proliferazioni tumorali, malattie infiammatorie e immunitarie, shock settico, infezioni virali e alterato sviluppo dell’immunità. Sembra che esso sia anche implicato in processi di plasticità sinaptica e memoria[66].
NF-kB fu scoperto nel laboratorio del premio Nobel David Baltimore studiando la sua interazione con una sequenza di 11 paia di basi nell’attivatore della catena leggera delle immunonoglobuline nelle cellule B[67].
I membri della famiglia di NF-kB mostrano omologie strutturali con l’oncoproteina virale v-Rel, risultando nella classificazione come proteine NF-kB/Rel[65].
Nella famiglia NF-kB dei mammiferi sono state identificate cinque proteine:
• NF-kB1, anche noto come p50;
• NF-kB2, chiamato anche p52;
• RelA noto anche come p65;
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
• C-Rel.
Tutte le proteine appartenenti alla famiglia NF-kB presentano un omologo dominio Rel nella porzione N-terminale, mentre sul C-terminale RelA, RelB e c-Rel hanno un dominio di trans attivazione. Le proteine NF-kB1 e NF-kB2 sono sintetizzate come grossi precursori, p105 e p100, che vengono processati generando le subunità mature p50 e p52; il processamento è mediato dal sistema ubiquitina-proteasoma e implica degradazione selettiva delle regioni C-terminali contenenti ripetizioni di anchirine; mentre il processo di formazione di p52 a partire da p100 è finemente regolato, p50 è prodotto in maniera costitutiva a partire da p105.
Figura 1.5.1 Struttura molecolare di NF-kB
L’importanza di NF-kB nella regolazione delle risposte cellulari è in parte legata al fatto che esso appartiene alla categoria dei fattori di trascrizione a rapida attivazione, e non necessita quindi della sintesi di altre proteine per essere attivato; agisce dunque come risposta primaria a insulti cellulari.
Molti batteri possono attivare NF-kB e questo avviene probabilmente perché essi agiscono legandosi ai membri della famiglia dei TLRs (Tall Like Receptors) che svolgono un ruolo chiave nella risposta immunitaria sia innata che adattativa, probabilmente agendo su NF-kB; per esempio, è stato dimostrato che il lipopolisaccaride di batteri Gram negativi è riconosciuto e legato da TLR4.
Diversamente da RelA, RelB e c-Rel, le subunità p50 e p52 di NF-kB non contengono domini di trans attivazione sul C-terminale, ma giocano un ruolo
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
fondamentale nella modulazione delle specifiche funzioni dello stesso fattore nucleare. Benché entrambi gli omodimeri p50 e p52 siano dei repressori di kB, essi partecipano alla trans attivazione formando eterodimeri con RelA, RelB e c-Rel; inoltre formano un complesso con la proteina nucleare Bcl-3 agendo da attivatori della trascrizione.
Nelle cellule non stimolate i dimeri di NF-kB sono sequestrati nel citoplasma da una famiglia di inibitori chiamati Ik-B (Inibitor of kB), proteine contenenti copie multiple di una sequenza ripetuta di anchirine grazie alle quali è in grado di mascherare il segnale di localizzazione nucleare di NF-kB mantenendole in uno stato inattivo nel citoplasma[69].
Le proteine IkB presentano un dominio regolatorio N- terminale seguito da sei o più ripetizioni di anchirine e un dominio PEST vicino alla terminazione C-terminale. Esistono diverse forme, ma la meglio conosciuta è la IkBα, mentre IkBγ è l’unica sintetizzata dal gene NF-kB1 usando un promotore interno, probabilmente risultando in una proteina identica alla regione C- terminale di p105.
L’attivazione di NF-kB è iniziata dalla degradazione di IkB da parte della chinasi IkB (IKK); IKK è costituita da un eterodimero di IKKα e IKKβ e da una proteina regolatoria denominata NEMO (NF-kappa B essential modulator); una volta attivata da segnali, generalmente provenienti dall’esterno della cellula, la chinasi IkB fosforila due residui di serina localizzati su un dominio regolatore di IkB che, a sua volta, viene ubiquitinato e portato nel proteasoma dove sarà degradato.
Dopo che IkB è stato degradato NF-kB è libero di entrare nel nucleo dove, legandosi alla regione promotrice del DNA, attiva la trascrizione di geni fondamentali per molte attività fisiologiche, tra cui le risposte infiammatorie e immunitarie, risposte di sopravvivenza cellulare e proliferazione cellulare. Inoltre, NF-kB attiva l’espressione del suo stesso repressore IkB che nuovamente va a inibire NF-kB in un importante meccanismo a feedback che regola i livelli del fattore nucleare.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Figura 1.5.2 Attivazione di NF-kB
È stato messo in evidenza che molti virus, incluso l’HIV, hanno un sito di legame per NF-kB che controlla l’espressione dei geni virali responsabili della replicazione e della patogenicità virale e che nel caso dell’HIV potrebbe essere responsabile, almeno in parte, dell’attivazione del virus dalla forma latente inattiva.
Le funzioni del fattore nucleare kB nel controllo della proliferazione spiega perché in molti tumori sia costitutivamente attivo: esso accende l’espressione dei geni che codificano per la proliferazione proteggendo le cellule da condizioni che potrebbero ucciderle. Nelle cellule tumorali esso risulta attivo a causa di mutazioni sia dei geni che codificano per il fattore stesso sia di geni che ne controllano l’attività, come IkB; inoltre alcune cellule tumorali secernono fattori che attivano NF-kB.
Il blocco di NF-kB potrebbe arrestare la proliferazione cellulare, determinando la morte delle cellule stesse oppure renderle più sensibili all’azione di agenti antitumorali[70].
Poiché NF-kB controlla le risposte infiammatorie esso risulta cronicamente attivo anche in molte malattie di tipo infiammatorio, infatti molti prodotti naturali
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
di cui è nota l’azione antitumorale e antinfiammatoria, come gli antiossidanti, inibiscono il fattore nucleare.
NF-kB è anche uno dei maggiori fattori di trascrizione che regola i geni responsabili della risposta immunitaria innata e adattativa; legandosi alla regione promotrice del DNA è in grado di regolare i geni responsabili dello sviluppo, della maturazione e della proliferazione dei linfociti T.
Poiché l’attivazione di NF-kB è IKKβ-dipendente, è stata presa in considerazione l’inibizione di IKKβ come bersaglio terapeutico e farmacologico[49].
L’aumentata suscettibilità alle tossine sembra essere associata ad alti livelli di IL-1β nel plasma come risultato di un aumentato processamento di pro-IL1β; nei macrofagi il processamento è attivato da caspasi che risentono dell’azione di IKKβ mentre nei neutrofili non dipende da caspasi ma da serin proteasi la cui attività è inibita da prodotti genici di NF-kB. La prolungata inibizione farmacologica di IKKβ aumenta la secrezione di IL-1β.
Studi condotti da Dinarello et al nel 1997 hanno messo in evidenza un rapido rilascio di IL-1β e TNFα in seguito a shock endotossico (30-90 minuti) con conseguente attivazione di una seconda cascata infiammatoria dipendente da NF-kB. Recentemente è stato scoperto un nuovo sistema definito infiammosoma responsabile del controllo post-trascrizionale dell’infiammazione e dell’immunità innato. Il sistema si basa sull’attivazione ligando-dipendente di caspasi che processano la pro-IL1β e la pro-IL18 citoplasmatiche. Non è ancora chiaro se NF-kB e l’inflammosoma interagiscano fra di loro.
Per inibire l’attivazione di NF-kB si possono sfruttare le proprietà di piccole molecole che inibiscono IKKβ, ma questa inibizione potrebbe aumentare la suscettibilità alle infezioni, intaccando l’attivazione dei meccanismi di difesa.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
1.6 Dai geni alle proteine:Interleuchine e Tumor Necrosis Factor
Le citochine sono molecole proteiche prodotte da vari tipi cellulari, secrete nel mezzo circostante di solito in risposta ad uno stimolo, ed in grado di modificare il comportamento di altre cellule inducendo nuove attività come crescita, differenziamento e morte. Si comportano generalmente da molecole autocrine o paracrine, con azione locale, ma possono a volte avere un effetto su tutto l’organismo agendo da effettori endocrini.
Le citochine prodotte dal sistema immunitario prendono il nome di Interleuchine, e possono essere distinte in quattro gruppi:
• Fattori delle ematopoietine, che includono fattori di crescita come l’Eritropoietina;
• Famiglia dei Tumor Necrosis Factor (TNF);
• Famiglia delle chemochine;
• Famiglia delle Interleuchine.
Le citochine sono messaggeri chimici estremamente potenti nonostante agiscano a concentrazioni molto basse ed abbiano un’emivita di pochi minuti; sono molto specifiche e agiscono sulle cellule bersaglio grazie all’elevata affinità per i recettori di membrana.
I recettori sono glicoproteine di membrana formate da diverse subunità il cui compito è di trasmettere il segnale all’interno della cellula, generando un insieme di reazioni a cascata nelle quali intervengono un gran numero di proteine, tra cui le chinasi della famiglia JAK che reclutano e attivano fattori di trascrizione della famiglia STAT e la via NF-kB.
Oltre ai recettori di membrana sono stati rilevati nel siero anche recettori solubili per le diverse citochine, simili a quelli di membrana, presenti in grandi quantità e che probabilmente hanno il compito di regolare la produzione delle citochine, agendo come antagonisti dei recettori di membrana.
Le citochine agiscono nella risposta immunitaria innata mediante l’attivazione di macrofagi e cellule NK inducendo processi infiammatori e chemiotattici, e anche nella risposta immunitaria acquisita, sia umorale che
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
cellulare, agendo sui linfociti T e B facilitando la comunicazione tra diverse popolazioni cellulari.
Una caratteristica particolare è che una singola cellula può produrre diverse citochine. Nell’uomo sono state fino ad oggi identificate 36 citochine, classificate sulla base del recettore a cui si legano:
• Recettori di fattori di crescita ematopoietica (IL2, IL3, IL4, IL5, IL6, IL7, IL9, IL13, IL15, GM-CSF, G-CSF);
• Recettori di Interferone (IFNα, IFNβ, IFNγ);
• Recettori di Fattori della Crescita Trasformante (TGFα, TGFβ);
• Recettori del Fattore di Necrosi Tumorale (TNFα, TNFβ);
• Recettori della superamiglia delle immunoglobuline (IL1α, IL1β, IL16);
• Recettori di chemochine (IL8, PAF).
Le citochine e le chemochine si ritrovano in grandi quantità nelle masse neoplastiche, e le varianti genetiche di molte di loro possono essere collegate a una diversa suscettibilità individuale al cancro, oppure a forme particolarmente aggressive della malattia. Inoltre la produzione di queste proteine da parte dell’organismo è stimolata da condizioni ambientali simili a quelle che si ritrovano quando si sviluppano molte forme di tumore; viceversa, la loro soppressione ha un significato protettivo nei confronti della formazione delle metastasi e dell’azione di alcune sostanze cancerogene note. Tutto ciò dimostra l’importanza dell’infiammazione e della risposta dell’organismo per quanto riguarda il cancro, anche se non è facile capire fino a che punto una reazione di difesa si trasforma a volte in un meccanismo negativo, che finisce per favorire le cellule cancerose.
Elevati livelli di citochine sono stati riscontrati anche nelle cellule neoplastiche in pazienti affetti da mieloma multiplo. Il ruolo di interleuchine come IL6, IL10 e IL11 e di fattori di crescita nella proliferazione mielomatosa è noto da tempo ma sembra che anche fattori come l’IL1 e il TNF possano rivestire un ruolo nella genesi del tumore; in particolare sembra che essi siano dei potenti fattori di riassorbimento osseo, e quindi possano contribuire allo sviluppo di malattie osteolitiche in individui affetti da mieloma.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
TNF e IL1 agiscono di concerto per regolare la risposta infiammatoria dell’ospite alle infezioni e ad altri stimoli.
La principale sorgente di IL1 e TNF sono i fagociti mononucleati attivati, anche se IL1 è prodotta anche da neutrofili, cellule endoteliali e cellule epiteliali.
IL1 induce i suoi effetti biologici interagendo con un recettore di membrana definito recettore per IL1 di tipo I (IL1R1) che trasduce segnali che attivano NF-kB e AP-1. Il recettore fa parte della famiglia delle proteine integrali di membrana composte da un dominio di tipo Ig e un dominio TIR intracitoplasmatico responsabile della trasduzione del segnale. Dopo il legame di IL1, la proteina adattatrice MyD88 si associa al dominio TIR del recettore per IL1 seguita dalle due chinasi IRAK e IRAK4, e da un’altra proteina adattatrice TRAF-6. I domini a valle di questi eventi comprendono fosforilazione di secondi messaggeri e formazione di ulteriori complessi tra altre chinasi e proteine adattatrici che alla fine inducono l’attivazione di NF-kB.
Se secreta a basse concentrazioni, IL1 agisce da mediatore locale dell’infiammazione inducendo l’espressione di molecole di adesione sulla superficie cellulare delle cellule endoteliali; a concentrazioni più elevate entra in circolo ed esercita un’azione endocrina e, se presente a livello sistemico, induce febbre e sintesi di proteine di fase acuta da parte del fegato, direttamente o indirettamente, attraverso la sintesi di IL6 e la produzione di neutrofili e piastrine da parte del midollo osseo.
I fagociti mononucleati producono un inibitore naturale dell’IL1, strutturalmente simile alla citochina e quindi in grado di legarsi allo stesso recettore ma senza attivarlo che agisce da inibitore competitivo, IL1RA.
TNF induce l’espressione di molecole di adesione sulla superficie delle cellule endoteliali, provocando l’adesione precoce di neutrofili e successivamente di monociti e linfociti; stimola le cellule endoteliali e i macrofagi a secernere chemochine che aumentano l’affinità delle integrine leucocitarie per i loro ligandi e inducono chemiotassi e reclutamento dei leucociti; agisce anche su fagociti mononucleati inducendo la secrezione di IL1; potenzia inoltre l’attività microbicida dei neutrofili e dei macrofagi.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Nel corso di gravi infezioni TNF viene prodotto in grandi quantità, provocando alterazioni anatomo-patologiche e cliniche sistemiche; in particolare, induce febbre agendo sull’ipotalamo, aumenta la sintesi di alcune proteine sieriche agendo sugli epatociti e induce cachessia se prodotto per periodi prolungati. Ad alte concentrazioni è in grado di inibire la contrattilità del miocardio e il tono della muscolatura vascolare causando caduta della pressione arteriosa e shock. Può causare trombosi intravascolare in quanto è un potente attivatore della coagulazione ed è in grado di inibire l’espressione di trombomodulina. È in grado di mediare gravi disturbi metabolici abbassando la glicemia a livelli incompatibili con la vita.
1.7 La farmacogenetica delle interleuchine nel Mieloma Multiplo
L’eterogeneità nella risposta ad un trattamento farmacologico è da mettere in relazione alla differente composizione genetica che caratterizza i singoli individui.
L’interesse della farmacogenetica per le citochine nel Mieloma Multiplo, finora considerate solo in relazione alla suscettibilità, nasce essenzialmente dalla comprensione del loro meccanismo d’azione, dalla funzione biologica e dalla relazione esistente tra citochine e mieloma oltre che tra citochine e bortezomib.
Il bortezomib agisce bloccando l’attivazione, da parte del proteasoma, del fattore di trascrizione nucleare NF-kB, responsabile dell’attivazione di numerosi geni che agiscono nella risposta infiammatoria e immunitaria, tra cui le citochine, il cui ruolo nel mieloma è stato ormai ampiamente dimostrato. Le plasmacellule dipendono fortemente dal microambiente tumorale e dalle citochine; pertanto, regolare la produzione di tali molecole potrebbe significare bloccare la proliferazione e la divisione delle cellule tumorali, e quindi influenzare la risposta al trattamento.
IL1 e TNFα, oltre ad agire da fattori osteolitici, quindi probabilmente responsabili degli effetti lesivi a carico delle ossa, che rappresentano l’aspetto
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
clinico caratterizzante nei pazienti affetti da mieloma, e a stimolare la produzione di IL6, necessaria per la sopravvivenza delle cellule mielomatose, agiscono attivando NF-kB, causando dunque l’ulteriore produzione di citochine, e quindi la stimolazione della proliferazione cellulare. Inoltre, TNFα agisce da potente fattore pro-apoptotico attivando le caspasi, una delle principali famiglie responsabili dell’attivazione di segnali di morte cellulare. L’effetto finale potrebbe dunque essere correlato non soltanto con i livelli di citochine presenti, ma anche con il tipo di citochina e certamente anche dall’interazione fra più proteine.
L’idea che variazioni nei livelli di citochine potessero influenzare la risposta al farmaco ha fatto si che l’attenzione si concentrasse sui polimorfismi al fine di valutare innanzitutto se esistano delle relazioni tra varianti alleliche e livelli di citochine, e conseguentemente se livelli diversi di citochine siano effettivamente responsabili di quadri di risposta differenti.
Non sono stati fatti, ad oggi, studi che valutino la risposta al trattamento in relazione alle varianti genotipiche, ma diversi sono i lavori che hanno cercato di identificare l’esistenza di un’associazione tra variante genotipica ed espressione e funzionalità proteica.
Dati riportati in letteratura, per esempio, mettono in evidenza una maggior espressione della variante T dei polimorfismi IL1A -889 C>T, IL1B -511 T>C e IL1B -31 C>T nei pazienti affetti da mieloma rispetto ai controlli[71], dati che concordano con uno studio condotto da Chen et al[72]in cui la variante IL1B -511T è stata messa in relazione con una maggior attività di trascrizione e quindi con aumentati livelli di citochine.
Dati contrastanti riguardano invece il polimorfismo TNFα -308 A>G: secondo alcuni autori la variante A sarebbe associata ad una maggior attività trascrizionale ed ad un aumento del rischio di cancro[73], secondo altri sarebbe invece associata ad una riduzione dell’attività trascrizionale e ad un minor rischio di sviluppare tumore[74].
Non esistono invece dati significativi riguardanti i recettori dell’interleuchina 1 e del TNFα.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Si può dunque ipotizzare, alla luce di quanto appena detto, che varianti polimorfiche possano essere correlate con differenze nella risposta al bortezomib.
1.8 IL1 e TNF: localizzazione, frequenze e polimorfismi
1.8.1 IL1A e IL1B
L’interleuchina1, prodotta da macrofagi, cheratinociti, linfociti B attivi e fibroblasti, media la risposta di fase acuta nell’immunità.
Esistono due forme strutturalmente distinte di IL1: IL1α, che è la forma acida e IL1β che è la forma neutra; presentano un’omologia del 26% a livello di proteina e del 45% a livello nucleotidico. Entrambe le proteine hanno peso molecolare di 17kD e derivano da precursori di 30-35kD; sono codificate a partire da due geni diversi e sono costituite entrambe da 7 esoni e 6 introni[75]. Entrambe le forme, ma in maniera particolare IL1β, sono trascritte in leucociti polimorfonucleati se stimolate con LPS[76].
Entrambe le forme stimolano l’attività osteoclastica in vitro e sono dei potenti fattori di riassorbimento osseo; Sabatino et al[77]studiarono gli effetti di infusioni sottocutanee per 72 ore di IL1A e IL1B sul plasma, sulla concentrazione del calcio e sulla morfologia ossea; il risultato fu che entrambe le forme causavano un marcato aumento di calcio nel plasma di tipo dose-dipendente dimostrando che l’interleuchina era implicata nella modulazione dell’omeostasi calcica nei fluidi extracellulari. Hogquist et al[78]dimostrarono che IL1 agisce regolando il processo di apoptosi; entrambe le forme sono rilasciate in seguito a insulto cellulare.
Nel 1993 Bailly et al[79] misero in evidenza l’esistenza di un polimorfismo che consisteva di un numero variabile di ripetizioni di 46bp nell’introne 6 del gene IL1A; su 72 soggetti, identificò sei differenti alleli contenenti da 5 a 18bp; gli alleli più frequenti, presenti nel 62% dei casi, conteneva 9 ripetizioni; suggerì quindi che i polimorfismi potessero rivestire un’importante funzione genica.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Tramite studi di ibridazione in situ i geni IL1 furono mappati sul cromosoma 2q14[80]; in particolare, IL1A mappa nell’intervallo tra +0 e +35kb, IL1B tra +70 e +110kb, IL1RN tra +330 e +430kb.
Figura 1.8.1 Localizzazione IL1A e IL1B
Studi condotti su IL1B hanno dimostrato che essa è implicata in numerosi processi fisiologici:
- media, insieme a IL18, lo sviluppo di metastasi epatiche di melanoma in vivo[81];
- causa l’esportazione nucleare del complesso corepressore NCOR, risultando nella derepressione di uno specifico gruppo di geni regolati da NF-kB che regolano funzioni di recettori di membrana[82];
- è richiesto per l’angiogenesi e l’invasività in vivo di diverse cellule tumorali[81];
- danneggia l’attività degli astrociti nel recupero e nel metabolismo del glutammato[83];
- è un potente stimolatore del riassorbimento osseo ed è stato implicato nella patogenesi del turnover osseo e nell’osteoporosi[84];
- regola l’omeostasi del glucosio a livello centrale[85].
Studi interessanti sono stati condotti, negli ultimi anni, sui polimorfismi dell’IL1. Uno dei primi lavori sull’effetto dei polimorfismi dell’IL1β sulla trascrizione dello stesso fu condotto nel 2005 da Chen et al[72]; lo scopo di
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
questo studio era investigare se gli SNPs situati sul promotore di IL1β
potessero influenzare la trascrizione e se tale funzione dipendesse dal contesto aplotipico. Le analisi furono condotte su quattro SNPs scelti su un totale di 20 identificati: IL1B -3737 C>T, IL1B -1464 G>C, IL1B -31 C>T, IL1B -511 T>C.
Furono valutati tre aspetti dell’attività biologica: il legame di proteine nucleari agli SNPs; l’attività di trascrizione allele-specifica dei singoli polimorfismi; l’influenza allele- specifica di un singolo SNP sull’attività trascrizionale negli aplotipi più frequenti nella popolazione.
Il legame alle proteine risultava aumentato per le varianti -3737C, -1464C, -31C e invariati per -511C/T.
L’attività di trascrizione mostrava un decremento per -1464G e -31C, un modesto aumento per -511T e nessuna variazione per -3737G/A.
Il terzo fattore analizzato metteva in evidenza un’azione positiva sulla trascrizione derivante dall’associazione -511T/-31C, -511T/-31T e -511C/-31T e un’azione negativa nell’associazione -511C/-31C. Un’azione minima ed una riduzione marcata derivavano dall’associazione tra 1464G e entrambi gli alleli -511 e -31. L’attività diminuiva per associazione tra -3737C/T e -31T/--511C e si registrava un decremento per -3737C/T e -31C/-511T.
Chen et al[72] genotipizzarono un campione di 1127 individui, 900 Caucasici e 227 Afro-Americani; dei 16 possibili aplotipi, quattro rappresentano >98% in entrambe le popolazioni (Tabella 1.8.1).
APLOTIPI -3737C/T -1464C/G -31T/C -511C/T CAUCASICI (%) AFRO AMERICANI (%) 1 T C T C 44.8 27.3 2 C G C T 27.7 10.6 3 C C T C 20.0 14.7 4 C C C T 6.0 46.7 TOT. 99.4 98.7
Tabella 1.8.1 Distribuzione aplotipi (Chen et al[72])
L’aplotipo meno comune fra i caucasici, ma molto frequente fra gli Afro-Americani, era associato ad un’attività maggiore.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
In particolare, gli studi condotti misero in evidenza una correlazione fra gli SNPs -511T>C/-31C >T e diverse condizioni cliniche.
Analisi effettuate su singoli SNPs mostravano un decremento dell’attività del promotore per l’allele 31T, ma un aumento se questo era associato con -511C, rappresentando un esempio di coevoluzione.
L’ipotesi era che l’influenza della variabile -511T>C sulla trascrizione potesse essere dovuta, oltre che al contatto diretto con proteine trans-attivanti in grado di legare gli elementi regolatori in questa regione, anche a interazioni con fattori diversi.
L’associazione -1464G/-511T/-31C era responsabile di un aumento della capacità di legame alle proteine nucleari e si pensava che l’allele -1464G legasse preferenzialmente un repressore dell’attività del promotore (Tabella
1.8.2).
APLOTIPI CAUCASICI AFRO AMERICANI
-511T/-31C 33.7 56.7
-1464G/-511T/-31C 27.7 10.6
-1464C/-511T/-31C 6.0 46.1
TOT. 67.4
Tabella 1.8.2. Distribuzione aplotipi (Chen et al[72])
Fu ipotizzato che lo SNP -511T>C fosse responsabile di differenze allele-specifiche nel legame a NF-kB, anche se non fu messa in evidenza nessuna variazione nell’attività del promotore negli esperimenti condotti. Anche per l’aplotipo -3737A/ -511T/-31C fu ipotizzata una minor attività del promotore a causa del ridotto legame a fattori di regolazione (forse NF-kB).
Probabilmente NF-kB legava l’allele -3737G aumentando l’attività di trascrizione del promotore IL-1B solo in uno specifico contesto aplotipico, interagendo con gli alleli T e C di -511 e -31.
Nei campioni osservati nessun aplotipo presentava la combinazione -511A/-31T, suggerendo la possibilità di una selezione dovuta, in parte, all’attività di NF-kB nel legare gli alleli.
Ruolo dei polimorfismi delle interleuchine nella farmacogenetica del Mieloma Multiplo
Invece, l’attività non sembrava variare, qualunque fosse la variante per IL1B -3737, in presenza dell’associazione -511T/-31C.
Conclusero quindi che l’azione dipendesse da aplotipi diversi che si estendevano fuori dalla regione promotore/enhancer di IL-1B.
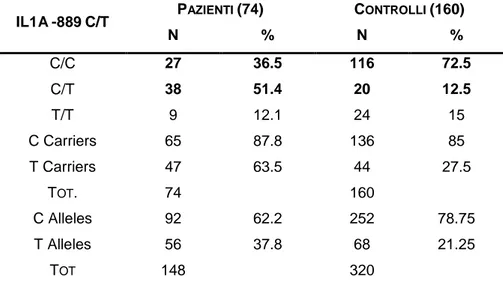
Un recente articolo di Abazis-Stamboulieh[71] ha messo in evidenza l’associazione tra i polimorfismi dei geni IL-1A, IL-1B e IL-1Ra e il mieloma. Lo studio fu condotto su un campione di 74 pazienti (40 uomini e 34 donne) con età media di 65 anni (tra 42 e 80 anni) e 160 controlli (86 uomini e 74 donne) con età media di 65.7 anni (tra 40 e 85 anni) di origine greca; i polimorfismi analizzati erano IL1A -889C>T, IL1B -511T>C e +3954T>C, IL1RN Mspa1 +11100T>C.
I risultati misero in evidenza una differenza significativa nella distribuzione dei genotipi IL1A CC e CT tra pazienti e controlli: la frequenza di CC era circa doppia nei controlli rispetto ai casi (72.5% contro 36.5%) mentre CT era quattro volte più frequente nei casi rispetto ai controlli (51.4% contro 12.5%). Nella
Tabella 1.8.3 sono elencate le frequenze alleliche e genotipiche nei casi e nei
controlli. PAZIENTI (74) CONTROLLI (160) IL1A-889C/T N % N % C/C 27 36.5 116 72.5 C/T 38 51.4 20 12.5 T/T 9 12.1 24 15 C Carriers 65 87.8 136 85 T Carriers 47 63.5 44 27.5 TOT. 74 160 C Alleles 92 62.2 252 78.75 T Alleles 56 37.8 68 21.25 TOT 148 320
Tabella 1.8.3 Frequenze alleliche IL1A -889C/T (Abazis-Stamboulieh[71])
Notevoli differenze si osservavano anche nella distribuzione dei genotipi di IL1B -511 CC e CT: la frequenza di CC era doppia nei pazienti rispetto ai controlli (47.5% contro 24.3%), CT era invece molto più frequente nei pazienti






![Tabella 1.8.2. Distribuzione aplotipi (Chen et al [ 72 ] )](https://thumb-eu.123doks.com/thumbv2/123dokorg/7348743.92861/33.892.272.702.569.695/tabella-distribuzione-aplotipi-chen-et.webp)