1 INDICE
HELICOBACTER PYLORI pag. 3
Epidemiologia pag. 4
Microbiologia pag. 8
Patogenesi pag. 12
Patologie Helicobacter pylori correlate pag. 16 Diagnosi di infezione da Helicobacter pylori pag. 20 PROSPETTIVE TERAPEUTICHE PER L’ERADICAZIONE DI
HELICOBACTER PYLORI pag. 23
Aspetti generali pag. 25
First line therapy pag. 27
Second line therapy pag. 29
Trattamento di recupero pag. 30
Cause per l’insuccesso degli schemi di eradicazione attualmente
Disponibili pag. 31
Nuove ipotesi terapeutiche pag. 35
MECCANISMI DI RESISTENZA DI H.PYLORI ALLA
TERAPIA ANTIBIOTICA pag. 38
HELICOBACTER PYLORI E PROBIOTICI pag. 42
Meccanismo d’azione pag. 45
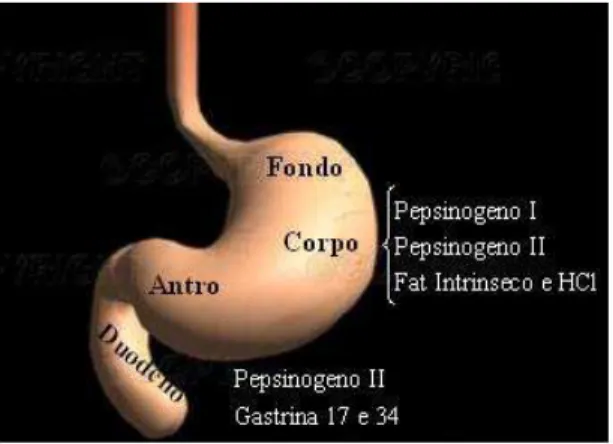
Probiotici e gastrite da Heliucobacter pylori pag. 50 Probiotici ed eradicazione di Helicobacter pylori pag. 54 FISIOLOGIA DELLA SECREZIONE DEI PEPSINOGENI pag. 58
STUDIO CLINICO pag. 64
Scopo della tesi pag. 65
Materiali, pazienti e metodi pag. 66
Risultati pag. 70
Discussione pag. 77
2 Il ventesimo secolo ha vissuto una rapida e radicale rivoluzione nelle conoscenze riguardanti la fisiopatologia della funzione gastrica, nell’approccio diagnostico alle malattie gastriche e, ancor di più nel loro trattamento. Grazie alla scoperta degli antagonisti degli H2, successivamente degli inibitori di pompa protonica e dell’Helicobacter pylori come agente patogeno nello sviluppo e nella recidiva della malattia ulcerosa gastrica e duodenale il trattamento delle malattie acido-correlate è passato dalla sala operatoria alla semplice terapia medica.
Anche se la scoperta e l’identificazione delle caratteristiche morfologiche e biochimiche della regolazione della secrezione acida gastrica ed in particolare della funzione della pompa protonica idrogenionica, il ruolo della medicina di laboratorio è sempre stato secondario o non sviluppato rispetto allo sviluppo delle tecniche endoscopiche sia nella diagnosi che nell’outcome del paziente.
Oggi nonostante l’utilizzo diffuso dell’endoscopia e dell’efficacia dei trattamenti dell’infezione da Helicobacter pylori esiste un forte interesse all’identificazione di un approccio non-invasivo al fine di studiare la dispepsia e di migliorare il monitoraggio dei pazienti. Un profilo biochimico basato sulla determinazione sierica dei pepsinogeni, della gastrina e degli Ab anti-Helicobacter pylori può risultare un metodo efficace e non invasivo che offre informazioni anche sui livelli di trofismo gastrico. Inoltre in un epoca dove è particolarmente importante razionalizzare la spesa del S.S.N. si pone particolare
3 attenzione allo sviluppo di un test-sierologico in grado di ridurre il numero di endoscopie in modo da rendere ancora più selettivo e accurata la scelta di ricorre ad un esame che presenta costi e rischi maggiori.
EPIDEMIOLOGIA
L’infezione da Helicobacter pylori é molto diffusa a livello mondiale, ma la sua prevalenza varia notevolmente: nei Paesi in via di sviluppo l’incidenza media é di 1,5:1 rispetto ai Paesi industrializzati.
Studi condotti nell’Europa Occidentale hanno evidenziato una percentuale media di sieropositività per anticorpi anti-Helicobacter pylori del 5-10% nei bambini e del 30-40% nei soggetti adulti.
Nei Paesi industrializzati la prevalenza dell’infezione é caratterizzata da un incremento proporzionato con l’età; dopo i 60 anni di età si osserva una riduzione dei tassi di infezione probabilmente in relazione alla comparsa della gastrite atrofica che genera un ambiente sfavorevole al microrganismo.
La prevalenza dell’infezione da Helicobacter pylori nella popolazione di razza bianca degli USA e del Sud Africa é sovrapponibile a quella dell’Europa. In questi due Paesi appare differente il tasso d’incidenza in altri gruppi etnici che presentano tassi circa doppi (70% circa contro il 35% dei soggetti di razza bianca). [1]
I tassi di prevalenza dell’infezione nei Paesi in via di sviluppo sono molto più elevati rispetto ai Paesi industrializzati, con valore di sieropositività di circa
4 80-90% nell’età adulta e di 45-55% nell’età compresa fra 0 e 9 anni, come dimostrato da studi condotti sia in Africa che in America Latina. [2]
Uno studio multicentrico italiano ha indagato oltre 900 persone su tutto il territorio nazionale confermando una positività sierologica attorno al 45%. Il tasso di incidenza d’infezione annuo, valutato in soggetti già precedentemente testati e risultati negativi, é stimato attorno allo 0,5-1%. I maggiori tassi di infezione nei Paesi in via di sviluppo sono da accreditarsi alle precarie condizioni igieniche e socio-economiche.
Dati recenti dimostrano, attraverso l’utilizzo della PCR (polymerase chain reaction), la presenza di Helicobacter pylori nelle acque dolci superficiali tuttavia, tranne rarissime eccezioni, è stato molto difficile ottenere delle colture del microrganismo partendo dalle tradizionali riserve ambientali.
La maggior parte delle osservazioni suggerisce la possibilità di trasmissione interumana. A sostegno di tale ipotesi vi sono, ad esempio, studi su bambini che vivono in istituti nei quali la prevalenza di infezioni è maggiore di quella attesa [3] per soggetti della stessa età o appartenenti a famiglie con almeno un figlio. [4]
La via di trasmissione interumana non è conosciuta a pieno. In letteratura vi sono varie ipotesi discordanti fra loro sulle possibili vie di contaminazione. La prima ipotesi è di trasmissione fecale-orale.
Helicobacter pylori è stato ritrovato nelle feci sia utilizzando la PCR [5] che la coltura e l’eliminazione del batterio nelle feci può essere aumentata dalla
5 concomitante presenza di diarrea [6] o dall’impiego di farmaci che innalzano il pH intra-gastrico. Sfortunatamente l’isolamento in coltura da materiale fecale si è rivelato estremamente difficile e, d’altra parte, le evidenze fornite dalla PCR non indicano che i microrganismi nelle feci siano ancora vitali.
Una seconda possibile via di trasmissione è quella oro-orale. Anche in questo caso, sia con la coltura che con la PCR, è stata riscontrata la presenza del germe nella placca dentaria e nella saliva. [7]
Ipotesi contro l’evidenza della trasmissione oro-orale, come fonte di contagio dell’infezione da Helicobacter pylori, derivano da studi effettuati su giovani coppie sessualmente attive che presentano una bassa prevalenza di infezione stessa. [8]
Una terza possibile via di trasmissione è quella gastro-orale. Evidenze in favore di questa ipotesi vengono dalla documentazione di vere e proprie epidemie di gastrite Helicobacter pylori correlata in volontari che si sottoponevano ad esperimenti che prevedevano l’uso di sonde gastriche o, in passato, attraverso l’uso di gastroscopi non ben disinfettati. Un esempio di questo tipo di trasmissione fu identificato nell’alta incidenza di Helicobacter pylori in endoscopisti che erano abituati a lavorare senza guanti. [9]
Sebbene siano necessari ulteriori studi per spiegare i differenti aspetti dell’epidemiologia dell’infezione da Helicobacter pylori, sembra chiaro che qualsiasi mezzo attraverso cui il germe può giungere allo stomaco può rappresentare una via di contagio. Di conseguenza per poter approntare delle
6 adeguate strategie di prevenzione della trasmissione sono necessarie sia una maggiore comprensione delle più comuni vie di infezione nella popolazione infantile che l’identificazione degli anelli più deboli di questa catena di trasmissione.
7
MICROBIOLOGIA
Helicobacter pylori è un organismo mobile Gram negativo, che può essere coltivato in condizioni di microaerofilia con pressione parziale di ossigeno ottimale del 5%: ciò è uno dei fattori limitanti l’allestimento delle colture.
La sua membrana presenta, come foglietto esterno, il lipopolisaccaride (LPS); possiede inoltre una parete cellulare ed uno spazio periplasmatico al quale fa seguito una membrana interna ed il citoplasma.
L’organismo ha una forma elicoidale o spirale, con 6-8 flagelli polari attivati dalla presenza di una forza motrice protonica tra lo spazio periplasmatico ed il citoplasma attraverso la membrana interna. In questo contesto il pH periplasmatico risulta essere essenziale per la sopravvivenza e la crescita del microrganismo. Il batterio riesce a sopravvivere in un ambiente con un pH compreso tra 4,0 e 8,0 anche se il range ottimale per la crescita batterica è compreso tra 6,0 e 8,0.
8 In ambiente acido, la pompa protonica ATP-dipendente, che regola il potenziale trans-membrana del batterio, perde efficacia.
In assenza di un particolare sistema di adattamento, che si identifica principalmente con l’enzima batterico ureasi, l’Helicobacter pylori non potrebbe sopravvivere a livello gastrico.
Fattori di colonizzazione
I fattori di colonizzazione sono proprietà del microrganismo che gli permettono di arrivare e di restare nell’ospite nonostante i tentativi di quest’ultimo di liberarsi dall’infezione.
Tali fattori consentono al germe di stabilire una propria nicchia ecologica in un ambiente fortemente acido che è invece inospitale per ogni altro microrganismo enterico.
Motilità
La forma spirale combinata con la presenza di flagelli ad una estremità permette al germe di muoversi rapidamente per attraversare lo strato mucoso superficiale e passare dal lume gastrico, dove il pH è basso, ad una regione dove il pH è quasi neutro e permettere una crescita ottimale.
9
Ureasi
L’ureasi è un enzima composto da due subunità (ure-A e ure-B) ed è la proteina maggiormente sintetizzata dal batterio. Tale enzima è situato sia a livello citoplasmatico sia strettamente associato alla superficie cellulare, presumibilmente legato al lipopolisaccaride della membrana esterna.
L’ureasi catalizza la reazione di trasformazione dell’urea in ammoniaca ed anidride carbonica:
CO(NH2)2+H2O→NH3+HCO2NH2→NH3+CO2
L’ureasi citoplasmatica presenta un sistema di regolazione correlato al pH mediante l’attivazione di una proteina (ure-I) che riduce l’accesso dell’urea all’interno dello spazio citoplasmatico ed inoltre riduce l’attività dell’ureasi stessa in presenza di un pH superiore a 6,5.
Tale meccanismo entra in funzione per evitare che il batterio produca un’eccessiva alcalinizzazione dell’ambiente esterno.
Ceppi batterici mutanti senza attività ureasica non sono in grado di crescere in vitro a pH inferiore a 4,0.
10 Bisogna però sottolineare che l’idrolisi dell’urea indotta dall’ureasi non fornisce una fonte di azoto essenziale per la sintesi proteica del germe e che l’ureasi non è essenziale per l’aderenza del germe.
È stato infatti dimostrato che non vi è alcuna differenza nella capacità di adesione all’epitelio gastrico tra ceppi ureasi negativi e positivi.
Adesività
L’adesività alle cellule epiteliali gastriche è garantita da componenti batteriche di superficie e viene definita tropismo tissutale. Questa proprietà impedisce che il microrganismo venga spazzato via dal turn-over cellulare o dalla secrezione di muco o ancora dalla motilità gastrica.
È stata descritta la presenza di un’emoagglutinina fibrillare che ha uno specifico recettore glicolipidico presente sulle cellule mucose gastriche. [10]
Il legame dell’adesina fibrillare batterica con il recettore sulle cellule della mucosa porta alla formazione di pedicelli di aderenza e può determinare la polimerizzazione di fibre di actina con distruzione delle cellule epiteliali. [11]
11
PATOGENESI
Lipopolisaccaride di membrana
Noto anche come endotossina, comprende un gruppo di carboidrati batterici di superficie implicati nell’interazione tra i batteri Gram-negativi ed i loro ospiti. Il LPS dell’Helicobacter pylori ha un potere endotossico ed immunostimolante inaspettatamente basso e ciò è in relazione al lento trasferimento del LPS dalla proteina legante il LPS al CD14, che ne costituisce il recettore cellulare finale.
Questo correla dunque con lo scarso potere pro-infiammatorio dell’Helicobacter pylori, paragonato a quello di altri Gram-negativi.
Infine il batterio è in grado di adattare il suo pattern di espressione degli antigeni di Lewis per mimare quello dell’ospite mostrando come esso sia capace di regolare il suo fattore di virulenza.
Citotossina vacuolizzante (Vac-A)
È una sostanza prodotta dal batterio che risulta in grado di indurre la formazione di vacuoli all’interno delle cellule eucariotiche e la cui interazione con esse è mediata da recettore.
Tutti i ceppi di Helicobacter pylori sono in possesso del gene VacA, ma soltanto il 50% di essi risulta in grado di esprimere la tossina. [12]
12 Questa sostanza ha una provata relazione con la patologia peptica, il linfoma MALT ed il carcinoma gastrico.
Il meccanismo con cui il VacA genera vacuoli è da ricondurre alla formazione di pori sulle membrane lisosomiali, aumentando la permeabilità anionica, in un processo richiedente proteine cellulari. [13]
CagA e l’isola di patogenicità cag-associata (cag-PAI)
Il CagA è uno dei più precoci fattori di rischio identificati, prodotto dall’espressione di una sequenza genica appartenente alla cag-PAI.
La cag-PAI costituisce un gruppo di proteine che forma un apparato di secrezione di tipo IV che introduce la citotossina cag nelle cellule ospiti dove viene sottoposta ad una fosforilazione da parte della tirosina chinasi. [14]
Il gene che codifica per questa proteina è presente nel 60% dei ceppi di Helicobacter pylori [12] e la sua espressione sembra essere correlata allo sviluppo di ulcera duodenale, gastrite atrofica e adenocarcinoma gastrico anche se sono necessarie ulteriori validazioni.
I ceppi cagA positivi risultano essere più infettanti, capaci di dare una maggior carica batterica e generare una risposta infiammatoria più decisa.
Ceppi mutanti privi di cagA sono comunque ancora in grado di causare vacuolizzazione cellulare e indurre la produzione di IL-8 anche se in quantità più ridotta. [15]
13
Risposta dell’ospite all’Helicobacter pylori
Un’infezione acuta da Helicobacter pylori è stata documentata in diversi soggetti. [16] La lesione identificata corrisponde ad una gastrite severa caratterizzata da un infiltrato di neutrofili seguito da linfociti B, T, plasmacellule e macrofagi. È stato osservato che la prima fase dell’infezione era correlata con uno stato di ipocloridria documentato dal fatto che il pH si manteneva costantemente per diversi giorni su valori superiori a 7,0. Di fatto l’inibizione della secrezione acida risulta strettamente correlata con una più rapida colonizzazione da parte del batterio.
La risposta dell’ospite all’Helicobacter pylori partecipa all’induzione del danno all’epitelio gastrico. Durante la fase precoce dell’infezione, il legame dell’Helicobacter pylori alle cellule epiteliali gastriche, in particolar modo attraverso i ceppi che possiedono la cag-PAI, conduce alla produzione di interleuchina 8 (IL-8) ed altre chemiochine, come il peptide attivante i neutrofili di derivazione dalle cellule epiteliali (ena-78) e l’oncogene alfa correlato alla crescita delle cellule epiteliali (GRO-α).
Il fattore nucleare kB (NF-kB) ed una proteina di attivazione intracellulare (AP-1) sono i messaggeri intracellulari coinvolti in questo processo.
Tra queste l’IL-8, potente chemiochina attivante i neutrofili espressa dalle cellule epiteliali gastriche, sembra avere un ruolo centrale. [16]
14 Le chemiochine secrete dalle cellule epiteliali legate all’involucro di proteoglicani generano un gradiente attraverso cui avviene un reclutamento di polimorfonucleati.
La fase cronica della gastrite associata ad Helicobacter pylori unisce una risposta adattativa linfocitaria alla risposta iniziale. Il reclutamento linfocitario è facilitato dall’espressione chemiochino-mediata di adesine vascolari note con il nome di VCAM-1 e ICAM-1, rispettivamente vascolare ed intracellulare, necessarie per la chemiotassi specifica di linfociti.
I macrofagi che partecipano alla produzione di IL-8 generano anche citochine pro-infiammatorie coinvolte nell’attivazione delle cellule reclutate, in special modo cellule T-helper (Th0, Th1, Th2) che rispondono con la polarizzazione di una risposta Th1 nei confronti dei batteri. Viceversa le citochine come interferon γ (IFNγ) inducono l’espressione di complessi maggiori di istocompatibilità di classe II e molecole accessorie B7-1 e B7-2 da parte delle cellule epiteliali rendendoli competenti per la presentazione dell’antigene.
L’apoptosi mediata dalla citotossina VacA e dal Fas indotta attraverso il TNFα porta alla distruzione della barriera epiteliale facilitando la traslocazione di antigeni batterici e conducendo ad un’ulteriore attivazione macrofagica. Le citochine prodotte dai macrofagi possono inoltre alterare la secrezione di muco, contribuendo alla distruzione dello strato mucoso Helicobacter pylori mediata.
15 Le citochine prodotte nella mucosa gastrica inducono modificazione della secrezione acida gastrica e dell’omeostasi cellulare.
TNFα, INFγ e IL-1β aumentano il rilascio di gastrina stimolando le cellule parietali ed enterocromaffini e di conseguenza la secrezione acida. Il TNFα, inoltre, induce una riduzione delle cellule D antrali, portando ad una diminuzione della produzione di somatostatina ed indirettamente ad un aumento della produzione acida, generando ipercloridria.
PATOLOGIE HELICOBACTER PYLORI-CORRELATE
Helicobacter pylori è l’agente eziologico di una serie di manifestazioni patologiche a livello gastrico e duodenale. Le patologie che ad oggi sono state strettamente correlate alla presenza del batterio sono le seguenti:
• Gastrite cronica di tipo B, cioè antrale
• Ulcera (gastrica e duodenale)
• Dispepsia
• Cancro gastrico
• Linfoma MALT (mucosa associated lymphoid tissue)
Warren e Marshall, noti come i veri scopritori dell’Helicobacter pylori, per la prima volta nel 1981 pubblicarono sulla rivista Lancet la scoperta dell’associazione diretta tra la presenza del batterio a livello gastrico e lo sviluppo di gastrite cronica. Studi più recenti confermano che l’eradicazione del
16 batterio è in grado di ridurre, in un primo tempo, l’infiltrato infiammatorio sia neutrofilo che di mononucleati che caratterizza la gastrite. [17] Quando il processo infiammatorio progredisce si arriva ad uno stadio caratterizzato da atrofia mucosa, con distruzione delle ghiandole e successiva ipocloridria. Ciò conduce verso una forma di atrofia gastrica con successivo sviluppo di metaplasia intestinale che, a sua volta, risulta strettamente correlata ad un maggior rischio di cancro gastrico. [18]
In tali situazioni è più difficile isolare il germe a livello gastrico, a causa del cambiamento dell’ambiente intragastrico, non più favorevole allo sviluppo del germe, ma la presenza di elevati titoli anticorpali suggerisce la stretta correlazione tra l’atrofia e l’infezione da parte di Helicobacter pylori. [16]
L’associazione risulta più forte con l’ulcera duodenale (85-100)% rispetto a quella gastrica che si aggira intorno al 67-75%. (Figura 2)
Figura 2: meccanismo patogenetico dell’evoluzione in senso neoplastico (Ipotesi di Correa modificato da Cancer Research 1988)
17 L’associazione tra ulcera gastro-duodenale ed infezione da Helicobacter pylori ha condotto ad un’importante rivoluzione nell’approccio terapeutico di tale malattia.
L’importante calo del tasso di recidive ulcerose dopo terapia eradicante ha cambiato la definizione di ulcera, già identificata come processo cronico recidivante a carattere multifattoriale associato alla possibilità di riacutizzazioni stagionali, trasformandola in una vera e propria malattia ad eziologia batterica.
L’infezione da Helicobacter pylori genera a livello gastrico una flogosi di tipo cronico soprattutto a livello antrale (gastrite cronica antrale) che nel tempo si trasforma in gastrite atrofica come risultato dell’inibizione acida ed il suo
18 sviluppo è determinato dal mancato equilibrio tra processi apoptotici e proliferativi cellulari. Secondo una prima teoria, Helicobacter pylori non sarebbe in grado di indurre direttamente l’aumento della proliferazione cellulare che invece potrebbe generarsi in risposta ai fenomeni di morte cellulare programmata.
Un'ulteriore ipotesi imputa lo sviluppo della gastrite atrofica ad un processo multifattoriale dove la componente principale potrebbe essere ambientale poiché la porzione di soggetti infetti che sviluppa una gastrite atrofica varia notevolmente in differenti aree geografiche. Altra possibilità è che vi siano delle differenze nei ceppi di Helicobacter pylori presenti in determinate aree geografiche. L’eradicazione dell’infezione è seguita da guarigione della gastrite suggerendo un ruolo determinante dell’ Helicobacter pylori nella patogenesi mentre i fenomeni correlati alla rispostra dell’ospite (chemochine, autoantcorpi Helicobacter pylori indotti, infiltrazione linfocitaria sottomucosa) amplificano il danno tissutale.
DIAGNOSI DI INFEZIONE DA HELICOBACTER PYLORI
Durante la Consensus Conference tenutasi a Maastricht nell’Ottobre 2000 [19] si è arrivati a definire le linee guida per la diagnosi di infezione da Helicobacter pylori. Si è stabilito che debbano essere screenati per l’infezione tutti i soggetti di età minore di 45 anni che presentino sintomatologia dispeptica,
19 avendo l’accortezza di escludere preventivamente i soggetti con sintomi da riferire a patologia da reflusso gastro-esofageo (GERD) come pirosi e rigurgito, pazienti che facciano uso di farmaci anti-flogistici non steroidei e pazienti con sintomi di allarme (perdita di peso senza causa nota, disfagia, vomito ricorrente, sanguinamento gastro-intestinale o anemia, malassorbimento) che invece devono essere sottoposti ad indagine endoscopica.
Questi test sono classificabili, in base alla metodica di acquisizione, in test di tipo invasivo e non invasivo.
Test invasivi
Esame istologico: Helicobacter pylori è un bacillo che si insedia nella mucosa gastrica e presenta delle caratteristiche morfologiche specifiche. È sempre necessario eseguire un ampio campionamento bioptico mediante l’endoscopia. Per una diagnosi più accurata conviene eseguire minimo 5-6 campionamenti bioptici suddivisi in 2 a livello antrale, 2 a livello del corpo-fondo ed 1 all’angulus dello stomaco. Infatti sono ormai note le capacità del batterio di migrare verso altre porzioni della mucosa gastrica (questo soprattutto in caso di comparsa di gastrite cronica con successiva atrofia gastrica), oppure in seguito ad una terapia eradicante, ove si osserva uno spostamento prossimale del batterio. L’esame istologico oltre al campionamento ed alla ricerca del batterio ci permette di eseguire una tipizzazione istologica del tessuto. Durante un esame bioptico, l’anatomo-patologo valuta i seguenti elementi: la densità di
20 Helicobacter pylori, l’infiltrato infiammatorio, il grado di attività della gastrite, la concomitanza di atrofia gastrica e metaplasia intestinale. La tecnica standard di colorazione del preparato è l’ematossilina-eosina che permette sia la tipizzazione istologica sia il riconoscimento del batterio anche in casi di ridotta densità del microrganismo. Metodiche più specifiche per il puro riconoscimento del batterio sono il metodo Giemsa e l’impregnazione argentica, ma sono metodiche più difficili, di maggiore complessità e costi più elevati. L’istologia, ad oggi, risulta il gold-standard nella diagnostica dell’infezione da H. pylori.
Esame colturale: in molti casi potrebbe essere necessario l’isolamento colturale del batterio e l’esecuzione di un antibiogramma per saggiare la sensibilità a specifici antibiotici. Questo approccio si utilizza, in genere, davanti a ceppi poli-antibiotico resistenti, ovvero in pazienti che hanno eseguito differenti tentativi eradicanti, secondo gli schemi terapeutici standard e non hanno ottenuto l’effetto terapeutico, ovvero l’eradicazione del batterio. L’esame colturale ha una specificità del 100%, ma una sensibilità che varia dal 75% al 94%.
Test rapido all’ureasi: tale test richiede un frammento bioptico e perciò é annoverato tra i test invasivi. Tale frammento viene posto in un brodo o in agar contenenti urea che viene idrolizzata dall’ureasi prodotta dal batterio quando presente. Tale idrolisi provoca una produzione di bicarbonato che innalza il pH e ciò viene rilevato dalla presenza dell’indicatore (il rossofenolo) che colora la
21 soluzione. Tale test presenta una specificità del 100% ed una sensibilità del 70% dopo 1 ora e del 90% dopo 24 ore.
Test non invasivi
Urea Breath test: il C13 Urea Breath Test é considerato il test di riferimento non invasivo per la diagnosi dell’infezione da Helicobacter pylori. Il metodo sfrutta il fatto che il batterio possiede l’enzima ureasi, in grado di scindere l’urea in ammoniaca ed anidride carbonica. Pertanto, somministrando al paziente per via orale una soluzione contenente urea “marcata” con C13, in presenza del batterio, l’urea viene scissa e nell’espirato si può ritrovare l’anidride carbonica “marcata”. Per riconoscere l’isomero 13 del carbonio si utilizza come strumento uno spettrometro di massa. Il test viene eseguito facendo espirare due volte il paziente in due provette di cui una basale a tempo 0 ed una a distanza di 30 minuti. Il prelievo al tempo 0 serve a ricercare la presenza di isomeri di carbonio 13 nell’espirato normalmente (piccolissima quantità). Per eseguire questo test il paziente non deve aver assunto terapia con inibitori di pompa protonica, H2
-antagonisti e sucralfato o antibiotici da almeno un mese. È indicato per il controllo dopo terapia eradicante o come prima diagnosi di infezione. Ovviamente, per le sue caratteristiche, questo test non fornisce informazioni sul tipo e grado di patologia.
Sierologia: definito come test di screening di massa. Il batterio stimola una risposta infiammatoria sia locale che sistemica. Gli anticorpi prodotti sono di
22 classe IgG, ma non sono efficaci nell’eliminazione dell’infezione. Gli anticorpi compaiono dopo circa 20-25 giorni dall’infezione. In genere si utilizza una metodica ELISA; tale metodica può essere affiancata dalla ricerca di anticorpi anti-antigene specifici del batterio (VacA e cagA). Tale test distingue ceppi più citotossici e di solito si esegue nei soggetti già diagnosticati Helicobacter pylori positivi. In questo caso la metodica utilizzata è un Western blotting.
Ricerca di antigeni nelle feci: tale test valuta la presenza di antigeni batterici nelle feci. Si raccolgono piccoli campioni di feci e si pongono a contatto con specifici anticorpi all’interno di pozzetti (metodo EIA). Tale test è comodo per il paziente ed in genere molto utile in pediatria.
23
PROSPETTIVE TERAPEUTICHE PER ERADICAZIONE
24 L’infezione da Helicobacter pylori è diffusa a livello mondiale ed è la causa principale di malattia a carico del tratto gastrointestinale superiore (mucosa gastrica e duodenale). In caso di successo la terapia di eradicazione migliora i sintomi causati dall’infezione da H.pylori, la riduzione del sintomo dispepsia, cicatrizzare l’ulcera peptica ed infine prevenire il cancro gastrico.
Durante la scorsa decade, la percentuale dell’eradicazione è diminuita dal 90% a circa l’80%, soglia critica per l’efficacia della terapia secondo le attuali linee guida.
Questo fenomeno non è ancora conosciuto dal punto di vista fisiopatologico nei dettagli ma può essere causato da una serie di condizioni riguardanti la fisiologia gastrica e batterica di H. pylori.
Secondo i maggiori Autori internazionali l’imperativo è sviluppare un nuovo trattamento di approccio che possa ricondurre i valori di successo ad una percentuale più elevata, in previsione della possibilità di sviluppare vaccino come nuova strategia terapeutica per il futuro.
25 Aspetti generali
La varietà di manifestazioni cliniche, la presenza di un’elevata percentuale di pazienti con sintomi dispeptici e la presenza di severe complicazioni, prima fra tutte l’insorgenza di cancro gastrico, ci induce a proporre un aumento reale della richiesta di interventi terapeutici.
Lo sviluppo di una terapia efficace nei confronti dell’infezione da H.pylori ha condotto ad un importante cambiamento nell’approccio terapeutico alla malattia gastro-duodenale, che fino agli anni ’80 vedeva la chirurgia come una soluzione, riconducendo il trattamento della malattia ulcerosa ad una condizione da gestire ambulatorialmente con l’utilizzo di antibiotico terapia. A tal proposito ancora più importanti sono state le evidenze cliniche in favore della regressione del linfoma gastrico di basso grado sempre mediante l’eradicazione di H.pylori.
L’ampio uso della terapia antibiotica per l’infezione da H.pylori, talvolta anche al di fuori delle linee guida, ha di conseguenza aumentato il numero di fallimenti terapeutici che osserviamo ai nostri giorni. Recentemente è stato dimostrato una riduzione dell’efficacia di questi schemi terapeutici in tutto il mondo. [20]
Questo ha reso necessario l’individuazione di nuove strategie terapeutiche e lo sviluppo di nuovi chemioterapici.
26 Le indicazioni per individuare i pazienti che realmente necessitavano di eseguire una terapia eradicante sono ad oggi motivo di dibattito nel mondo scientifico.
Le prime linee guida che raccomandavano l’eradicazione di H.pylori nell’ulcera peptica sono apparsi circa dieci anni dopo la scoperta del batterio. Tali indicazioni provenivano da numerosi lavori internazionali di confronto fra la sola soppressione acida e la terapia eradicante con antibiotici, dati peraltro nettamente a favore di quest’ultima.
La prima Consensus Conference (Maastricht I) [21] dove sono state proposte delle linee guida che prevedevano l’indicazione al trattamento dell’infezione estendendo l’indicazione al trattamento anche per alcune condizioni al di fuori della malattia gastrointestinale semplice sono arrivate solo nel 1996. (vedi tabella 1)
27 First line therapy
La terapia di prima linea (o first choice treatment) non ha subito importanti cambiamenti rispetto alle scorse decadi.
Come già riportato nella Consensus originale di Maastricht il primo step terapeutico è rappresentato da un inibitore di pompa protonica (PPI) accompagnato dalla somministrazione di claritromicina e un altro antibiotico a scelta fra amoxicillina o metronidazole.
Questo first-line approach può essere efficace in una popolazione con meno di 15-20% di soggetti resistenti alla claritromicina.
Il modello triplice terapia è più efficace se esteso più di sette giorni.
Come stabilito dalla recente Consensus di Maastricht III il modello triplice terapia è più efficace se esteso a più di 7 giorni di trattamento.[22]
Una singola meta-analisi eseguita su studi randomizzati controllati eseguita per valutare la durata ottimale della triplice terapia con utilizzo di inibitori di pompa protonica (IPP) ha dimostrato una minore efficacia legata ad una minore percentuale di eradicazione nei trattamenti della durata si sette giorni comparato ad analoghi trattamenti della durata di 14 giorni (diminuzione del rischio relativo =12%; 95% CI 7-17%). [23] Una recente pubblicazione denominata HYPER Europea comunque non ha riportato differenze tra i trattamenti della durata di una settimana rispetto a quelli di due settimane con schema triplice standard per l’eradicazione di H. pylori in termini di efficacia, rischi e complicanze dei pazienti.[24]
28 A questo punto, secondo i criteri del Maastricht suggeriscono che un trattamento della durata di 7 giorni è sufficiente soprattutto dove studi locali confermano un’efficienza accettabile.
L’aumento di pazienti resistenti alla claritromicina varia significativamente nelle diverse regioni. Questo rappresenta il maggiore fattore di rischio per l’insuccesso del trattamento.[25] In aree con alta percentuale di resistenza alla claritromicina, questa può essere sostituita dall’utilizzo di metronidazolo.
L’opzione alternativa alla prima linea di trattamento, definita triplice, è la terapia quadruplice contenente oltre a 2 antibiotici ed all’inibitore di pompa protonica la ranitidina bismuto citrato.[26]
Un ampio studio randomizzato e controllato ha confrontato la quadruplice terapia contenente bismuto per sette giorni contro la triplice terapia contenente IPP per sette giorni e una triplice senza IPP sostituioti da bismuto per quattordici giorni. Lo studio ha dimostrato un maggior tasso di eradicazione nei gruppi PPI-triplice e quadruplice terapia rispetto alla terapia PPI-triplice effettuata per quattordici giorni contenente bismuto. Inoltre la triplice terapia contenete bismuto della durata di due settimane era meno tollerata che entrambe gli altri due regimi terapeutici effettuati per una settimana.
La quadruplice terapia contenente bismuto può essere considerata come il trattamento di scelta nelle aree con bassa resistenza al metronidazolo, alta resistenza alla claritromicina e nella popolazione dove il costo di spedizione è di
29 primaria importanza. In realtà quest’ultima considerazione riguarda quei paesi dove il bismuto è facilmente reperibile.
Second Line Therapy
In caso di insucceso della terapia di prima linea, riconosciuta con la terapia triplice, la quadruplice terapia basata sul bismuto è il primo trattamento di scelta consigliato, trannei casi in qui questo sia stato utilizzato come first-line.
Il problema maggiore della quadruplice terapia è la necessità di un gran numero di compresse da assumere durante la giornata ed una maggiore standardizzazione degli orari rispetto agli altri regimi disponibili come ad esempio la triplice classica.
Recentemente è stata preparata una singola compressa contenene sali di bismuto citrato, metronidazolo e tetraciclina che viene pertanto somministrata con una dose di omeprazolo, rendendo più semplice la somministrazione dello schema terapeutico.
In due studi multicentrici randomizzati è stata valutata la terapia con questa nuova somministrazione che si è dimostrata comparabile con la terapia triplice classica con IPP, anche se quest’ultima si è dimostrata ancora leggermente superiore in efficacia (percentuale di eradicazione:87,7% contro 83,2%) e sui dati di compliance per i pazienti (eventi avversi: 58,5% contro 59,0%). Sebbene il totale di pillole era ridotto, un gran numero di compresse da assumere complessivamente era ridotto nel calcolo complkessivo, era presente ancora un
30 alto numero di somministrazioni giornaliere (tre compresse quattro volte al giorno, più IPP due volte al giorno).[27] Attualmente questa terapia è disponibile solo nel Nord America.
Nelle regioni dove le terapia basata sul bismuto non è disponibile, la combinazione PPI-amoxicillina-metronidazole è considerata l’alternetiva più valida da attuare.
Trattamento di recupero
In accordo con quanto iondicato dalle Linee Guida Europee questa opzione di trattamento, definita “di recupero” potrà basarsi sui dati dell’antibiogramma eseguito su coltura di helicobacter pylori prelevato da biopsia gastrica, in modo da individuare i tipi di trattamento suscettibili rispetto a quelli disponibili.
I regimi testati possono essere composti da ulteriori combinazioni che includono fluorochinolone o rifabutina.
31 Cause per l’insuccesso degli schemi di eradicazione attualmente disponibili
Alcuni fattori sono responsabili dell’insuccesso dell’eradicazione dell’H.pylori e vi è uno stretto rapporto di correlazione fra l’insuccesso della terapia , le caratteristiche del batterio, le caratteristiche individuali dell’ospite e/o la terapia somministrata.
Dati recenti suggeriscono una diminuzione dell’efficacia della triplice terapia di sette giorni attualmente raccomandata dalle Linee Guida Europee. La percentuale di successo nella maggior parte dell’Europa, Asia e paesi del Nord America sta continuamente declinando ed è stata recentemente riportata la più bassa percentuale di eradicazione registrata che si attesta al 20-45%.[28]
La causa maggiore per questo fenomeno è l’incremento della resistenza antimicrobica registrata in più paesi, in modo particolare nei confronti della claritromicina. [29]
La resistenza dell’H.pylori alla claritromicina in Europa gioca una differenza importane di cui le percentuali più alte si osservano nei paesi del sud (più del 20%).[30] La claritromicina è l’antibiotico chiave nel trattamento dell’infezione da H.pylori ed esiste una buona correlazione tra la resistenza del batterio alla claritromicina e l’insuccesso dell’eradicazione.
32 Una recente review sistematica riporta il 56% di calo nella percentuale di eradicazione se era presente resistenza alla claritromicina.
Ulteriori analisi hanno evidenziato una riduzione pari al 70% nella percentuale di eradicazione se la resistenza alla claritromicina era detenuta ed era usato il regime contenente claritromicina.[30]
Le stime generali della resistenza dell’H.pylori al metronidazolo è molto elevata in differenti paesi (range dal 50% all’80%);[31] un’analisi comparata fra Europa e all’USA si ottengono stime attorno al 15-40%. [32] In Giappone, la percentuale di resistenza all’antibiotico è stata descritta come la più bassa in assoluto attestandosi al 9-12%. [33]
Un abbassamento dell’efficacia di oltre il 50% era stato trovato per la triplice terapia basata sull’utilizzo di bismuto e IPPin caso di presenza di resistenza al metronidazolo. [34]
E’ interessante notare che la maggior parte dei pazienti che hanno osservato unfallimento della first line therapy sono risultati secondariamente resistenti all’antibiotico usato.
Negli studi Irlandesi, dopo il fallimento della terapia di prima linea, la percentuale di resistenza alla claritromicina era aumentata dal 3,4% al 58,3% in linea con il fallimento del trattamento.[35]
Pilotto e coll. hanno descritto che il 70% dei pazienti che hanno fallito la prima terapia antibiotica avevano la percentuale di resistenza alla claritromicina e al metronidazolo di 64% e 35% rispettivamente.[36] Una recente meta-analisi
33 eseguita da Fischbach mostrava che maggiore è la resistenza e più è difficile predire l’efficacia della triplice terapia.[20]
Altri Autori successivamente hanno riportano che in caso sia presente la resistenza alla claritromicina o al metronidazolo, ma non entrambi simultaneamente, può essere utilizzata con successo la quadruplice terapia.
La levofloxacina è recentemente diventata importante nel trattamento dell’H. pylori in caso di fallimento delle terapie standard raccomandate. Comunque questo antibiotico ha un ampio uso per altre infezioni, così la percentuale di resistenza può essere veramente elevata (attorno al 15%). [37]
La prevalenza di resistenza all’amoxicillina e alla tetraciclina è rimasta bassa negli anni. Più studi dimostrano che tale rasso si attesta attorno a valori di circa il 2%.[38]
Altri fattori sono stati valutati fra quelli che possono influire o interferire con l’ eradicazione di H.pylori.[39] Per esempio, una meta-analisi di circa 22 studi ha riportato che il fumo è correlato con una maggiore percentuale di fallimento della terapia eradicante, l’Odd Ratio per il fallimento della terapia eradicante tra fumatori e non fumatori è stato valutato essere 1,95 (CI 95% 1,55-2,55) ed un valore di p<0,1).
La scarsa compliace/adesione alla terapia suggerita è considerato uno dei fattori più importanti per il fallimento della terapia.
Molti studi riportano che l’elevato numero di somministrazioni (tre o quattro volte al giorno) o troppe compresse da assumere per giorno per giorni
34 oltreche la lunga durata complessiva della terapia sono associate con ridotta compliance. [40]
L’insorgenza di eventi avversi durante la terapia come diarrea correalata all’uso di amoxcillina, sapore metallico associato all’uso di metronidazolo e sapore perverso con claritromicina possono giocare un ruolo importante nell’indurre all’interruzione della terapia.[41]
Altro importante fattore in grado di influenzare il successo dell’eradicazione è la presenza di malattie concomitanti o altri tipi di trattamento.
E’ stato suggerito che la percentuale di eradicazione è più bassa nei pazienti con diagnosi di dispepsia non-ulcerosa rispetto a quelli con dispepsia associata ad ulcera.[42]
Gli IPP sono un’elemento fondamentale nei regimi terapeutici eradivanti e l’aumento del pH gastrico ottenuto con l’uso di IPP permette l’attivazione e l’attività della terapia antibiotica. Alcuni IPP sono metabolizzati nel fegato dal citocromo P450, il polimorfismo genetico del citocromo P450 (CYP2C19) può avere effetti nell’eradicazione di H.pylori. I metabolizzatori lenti (determinati geneticamente) presentano una minore eliminazione di IPP dal plasma e di conseguenza ad un’elevata concentrazione plasmatica del farmaco. Tale fenomeno provoca conseguentemente un’attività prolungata di questi farmaci ed è associato con una diminuzione del fallimento terapeutico della terapia eradicante.[43]
35 Nuove ipotesi terapeutiche
Un’innovazione nell’ambito degli schemi terapeutici per ottenere l’eradicazione dall’infezione da H.pylori è definita terapia sequenziale. La terapia sequenziale è una duplice terapia della durata complessiva di circa 10 gg divisa in 2 differenti fasi: una prima fase della durata di 5 giorni eseguita con somministrazione di IPP (bid) ed amoxicillina 1 gr (bid), nei seguenti 5 giorni viene somministrata una terapia triplice con IPP (bid), claritromicina 500mg e tinidazolo 500mg entrambi in doppia somministrazione giornaliera.[44]
Una serie di studi prodotti in Italia hanno dimostrato un’eccellente tasso di eradicazione con la seguente terapia.
Zullo ha eseguito una pooled data-analysis sull’efficacia dell’eradicazione di H.pylori in 1687 di 1805 pazienti trattati, ottenendo una percentuale complessiva di eradicazione pari al 93,5% che fa riferimenmto al dato Intention To Treat (ITT).[45] Un ulteriore analisi di comparazione ha ha confrontato il tasso di eradicazione ottenuto dalla terapia sequenziale (a 10gg) confrontata con la triplice terapia standard estesa a 10gg dimopstrando una efficacia molto superiore della terapia sequenziale (91% versus 78% secondo ITT analisi).[46]
Un’altra analisi di confronto è stata invece proposta tra la terapia sequenziale e la triplice terapia standard a 7gg. L’infezioni da H.pylori è stata trattata nel 93,7% dei pazienti utilizzando la terapia sequenziale comparata al 75,9% dei pazienti sottoposti a triplice standard per sette giorni (ITT analisi;p<0,001).
36 Molto più importante, la terapia sequenziale sembra essere più efficace nei pazienti con resistenza alla claritromicina. In questi pazienti la percentuale di eradicazione arriva all’89% fra i pazienti sottoposti a terapia sequenziale comparata al 29% ottenuta con terapia triplice standard.
A questo punto, osservato che in Italia sono stati eseguiti molti studi utilizzando la terapia sequenziale e se i risultati osservati possono essere confermati in altri paesi, la terapia sequenziale può essere considerata come una nuova e valida opzione come prima linea di trattamento nell’eradicazione dell’infezione da H.pylori. Rimane comunque importante ricordare che sono ad oggi necessari trial randomizzati e controllati da eseguirsi in differenti regioni del mondo per poter raccogliere maggiori informazioni sull’efficacia dei nuovi schemi terapeutici. In un recente testo di Shehada la terapia sequenziale è stata indicata come la terapia da proporre in bambini e giovani adulti che hanno fallito le previsioni del trattamento.
Tra i nuovi antibiotici sviluppati, la finafloxacina un recente fluorochinolone, stato recentemente proposto in monoterapia per l’eradicazione di H.pylori. Dopo promettenti effetti ottenuti da esperimenti in vitro e studi sugli animali, fra breve questa nuova molecola sarà pronta per i test clinici.[47]
H.pylori è storicamente il più importante patogeno per le malattie gastroduodenali e sulla base di dati a livello mondiale è la causa di morbilità e mortalità più alta. Lo sviluppo di un trattamento antibiotico efficace ha cambiato notevolmente il trattamento della malattia dell’ulcera peptica e altre malattie
37 associate ad H.pylori. La prima linea di trattamento corrente è efficace e sicura, ma dalla scorsa decade ci sono dimostrati cali nell’efficacia, in concomitanza all’incremento dell’antibiotico resistenza. La ricerca medica e farmacologica hanno previsto prossimamente risultati e sviluppo di nuovi farmaci per il trattamento dell’infezione.
38
MECCANISMI DI RESISTENZA DI HELICOBACTER
39 L’infezione da H. pylori, pur essendo diffusa in tutto il mondo, presenta sostanziali differenze nei vari paesi. Infatti, in quelli industrializzati la percentuale d’infezione da H. pylori in adulti di mezza età è circa 20-50% contro l’80% o più nei paesi in via di sviluppo.[48] Ci sono poi differenze nei test usati per confermare l’infezione. Si possono scegliere test non-invasivi tra i quali ricordiamo i più usati sono il C13-Urea Breath Test, il test per ricerca degli antigeni fecali (HpSAg) e il test sierologico per ricerca di anticorpi (Ab anti-Hp). Al contrario possiamo utilizzare metodi invasivi tra i quali si ha l’esofago-gastro-duodenoscopia con biopsia, che può essere usata per il test rapido dell’urea, l’esame istologico.[49]
Metronidazolo, claritromicina, amoxicillina, tetraciclina e bismuto sono i farmaci maggiormente usati per il trattamento di eradicazione da H. pylori. [50] Inoltre, il successo del trattamento richiede l’utilizzo di una combinazione di più farmaci, consistente in uno o più antibiotici insieme a farmaci inibitori di pompa protonica o, più raramente, antagonisti del recettore H2 o i sali di bismuto.[51]
Ci sono due terapie più frequentemente utilizzate: una quadruplice basata su PPI, due antibiotici (metronidazolo e tetraciclina) e bismuto, ed una triplice costituita da PPI, amoxicillina e claritromicina.
In pratica, però, nel 20-30% dei casi, queste terapie falliscono o per l’insufficente compliance dei pazienti o per lo sviluppo di resistenza agli antibiotici.
40 Una seconda linea di terapia consiste di bismuto (120 mg quattro volte al dì), metronidazolo (500 mg tre volte al dì), tetraciclina (500 mg quattro volte al dì) e un PPI (dosaggio standard due volte al dì).
In Europa la prevalenza di resistenza alla claritromicina, tende ad essere bassa. Il fattore di rischio essenziale per la resistenza è un precedente utilizzo di macrolidi, e se la resistenza è più alta nei bambini, questo è dovuto all’aumentata prescrizione di questi farmaci, essenzialmente per infezioni del tratto respiratorio. Quindi, aumentando l’uso di claritromicina, aumenta la resistenza e, sebbene la resistenza in vitro è circa uguale per tutti i macrolidi, in vivo cambia in base alla diffusione della mucosa gastrica. La resistenza all’amoxicillina è meno dell’1%, quella della tetraciclina è ancora più bassa in molti paesi.
Metronidazolo e tinidazolo sono più usati rispetto al metronidazolo nel trattamento dell’infezione da H. pylori. Nei paesi industrializzati, circa il 35% dei tipi di H. pylori sono resistenti al metronidazolo (concentrazione minima inibitoria MIC > 8 mg/L), [52] mentre nei paesi in via di sviluppo, la percentuale di resistenza a questi farmaci è più alta e, in questa zona, tutti i tipi di H. pylori sono resistenti al metronidazolo.[48] Inoltre, la prevalenza di macrolidi resistenti all’H. pylori è più bassa della resistenza al metronidazolo.
I meccanismi di resistenza antibiotica sono spesso basati sulla mutazione puntiforme localizzata sul cromosoma batterico.[53]
41 Per quanto concerne la penicillina, la resistenza sembra essere mediata dall’alterazione di proteine leganti la penicillina (PBPs).[54] L’uso di questi farmaci può essere anche usato nell’emergenza di tipi resistenti, come osservato in caso di fallimento del trattamento.
Peptidi antimicrobici, defenzine e porfirine sono altre opsioni, così come diete basate su oli essenziali, o probiotici nel trattamento di eradicazione dell’H. pylori, ma c’è ancora molta strada da fare per poterli usare nella pratica clinica.
42
HELICOBACTER PYLORI E I PROBIOTICI
43 E’ ormai da tempo accertato che H.pylori è la causa eziologica più importante della gastrite cronica; [55] è la prima causa di ulcera peptica [56] e fattore di rischio accertato per il carcinoma gastrico.[57] Ad oggi, la terapia consigliata consiste nell’utilizzo di due antibiotici ed un IPP, tale è considerato il trattamento di scelta per eradicare l’infezione da H.pylori.[58]
Sebbene questa terapia sia efficace nel 90%, ha lo svantaggio di essere gravata dall’aumentare dell’antibiotico resistenza.[59] Per questi motivi, la triplice terapia non è consigliata a tutti i soggetti portatori di infezione,come ad esempio i portatori asintomatici e i soggetti dispeptici senza lesioni ulcerose all’endoscopia .[60]
Un probiotico è definito come una specie microbica vivente che, somministrata, può avere effetti positivi sulla microflora intestinale e migliorare le condizioni di salute. [61] Al momento, i probiotici più studiati sono il batterio produttore di acido lattico, in particolare la specie Lactobacillus. [62] I probiotici hanno dato prova di essere utili nel trattamento di alcune malattie gastrointestinali come la diarrea infettiva acuta o paucisintomatica. [63] Ci sono numerose evidenze che invitano all’utilizzo dei probiotici nell’infeziona da H.pylori per numerose ragioni.
Inizialmente, sebbene la percentuale d’infezione di H.pylori sia tutt’ora alta nei Paesi in via di sviluppo, [64] è diminuita nei paesi industrializzati. [65] Di conseguenza, lo spettro dei disordini gastrointestinali è cambiato.Come primo
44 effetto, l’ulcera peptica e il cancro gastrico sono diminuiti negli ultimi trent’anni. [66] Nel primo follow up il reflusso gastroesofageo e il carcinoma esofageo sono aumentati consistentemente. [67] E’ perciò possibile che l’infezione da H.pylori possa essere di beneficio, per esempio, per proteggere di più dal reflusso esofageo e dalle sue complicanze. [68] Così potrebbe essere che l’approccio nutrizionale o con integratori alimentari possano giocare un ruolo chiave nelle futuire prospettive terapeutiche per l’eradicaszione di H.pylori.
Secondariamente l’efficacia nel trattamento dell’infezione di H.pylori è determinata da vari fattori, includente il tipo di famiglia dip H. pylori, l’estensione dell’ll’infiammazione e la densità di colonizzazione di H. pylori. [69]
Alcuni Autori riportato che il rischio di sviluppo delle malattie dell’ulcera peptica e del cancro gastrico aumenta con l’incremento del livello di infezione [70] viceversa la soppressione a lungo termine di H.pylori potrebbe diminuire il rischio di sviluppare le malattie ad esso correlate. [71]
Attualmente sono state evidenziate considerazioni interessanti sullo sviluppo di soluzioni alternative, per prevenire o diminuire la colonizzazione di H. pylori. In questo contesto i probiotici possono colmare un vuoto nella terapia.
Sono stati condotti alcuni studi clinici che hanno dimostrato gli effetti favorevoli del Lactobacillus johnsonii La1 contro l’H. pylori. [70-72]
45 Attualmente gli effetti dell’aggiunta dei probiotici alla terapia standard di eradicazione di H.pylori è molto dibattuta.
Meccanismo d’azione.
Sono stati evidenziati differenti meccanismi d’azione mediante i quali i probiotici potrebbero svolgere un’azione diretta nei confronti del patogeno gastrico:
1° MECCANISMO NON-IMMUNOLOGICO.
Le barriere non immunologiche così come l’acidità nello stomaco e la barriera costituita dalla mucosa gastrica rappresentano la prima linea di difesa contro batteri patogeni. E’ stato suggerito che l’assunzione di probiotici rafforza queste barriere con produzione di sostanze antimicrobiche, che competono con H. pylori per i recettori di adesione, stimola la produzione di mucina e stabilizza la barriera mucosa intestinale.
2° SOSTANZE ANTIMICROBICHE.
I probiotici possono inibire la crescita di H. pylori secernendo sostanze antibatteriche.
46 Certamente i lattobacilli sintetizzano antimicrobici in riferimento alla famiglia batterica di appartenenza. [72] Altre possibili sostanze secrete con questo batterio sono i prodotti finali della fermentazione di acido lattico, così come lattato, acido acetico e perossido d’idrogeno. [67] La produzione di una grande somma di lattato da parte dei lattobacilli è stata implicata come fattore di inibizione di H. pylori da alcuni autori. [74,75,76] L’acido lattico, insieme a questi effetti antibicrobici risultanti dall’abbassamento del pH, potrebbe inibire l’attività ureasica tipica di H. pylori. Comunque, l’inibizione effettuata dai lattobacilli sull’H. pylori differisce da caso a caso. Per esempio, L. johnsonii La 10 non inibisce H. pylori sebbene produca acido lattico come L. johnsonii La 1.[70] Inoltre è stato evidenziato che altri ceppi batterici (L. acidophilus LB, L. casei, L.johnsonii La 1, e L. lactis) esercitano un effetto inibitorio su H. pylori attraverso la produzione di acido lattico ed un meccanismo pH-indipendente. [69,77-80] Il coinvolgimento di componenti proteici in questo effetto inibitorio è stato dimostrato da vari autori. Comunque, l’esatta natura della sostanza antimicrobica secreta da questi tipi deve essere ancora determinata.
Altri batteri probiotici come Weissella confusa,[81] L. lactis [82] e Bacillus subtilis, [83] hanno dimostrato la capacità di produrre delle batteriocine in grado di inibire la crescita in vitro di H. pylori. Nel caso di B. subtilis queste sostanze erano simili ad animocumacina, parenti del gruppo di antibiotici isocumarinici. [83]
47 In conclusione, gli effetti inibitori in vitro di alcuni batteri probiotici è probabilmente correlato all’acido lattico o ad altre sostanze antimicrobiche ancora da identificare.
3° COMPETIZIONE PER L’ADESIONE
L’adesione di H. pylori a cellule epiteliali è importante nel determinare l’esito delle malattie associate ad esso. [84] Nella mucosa gastrica, l’interazione possibile di H. pylori con le cellule epiteliali avviene attraverso componenti secreti o attraverso l’adesione. [85]
Studi in vitro mostrano che L. johnsonii La 1, L. salivarius, L. acidophilus, e W. confusa inibiscono l’adesione di H. pylori alla cellula intestinale HT 29 [69,79] o alla linea cellulare gastrica MKN 45. [81,86]
Ci sono alcuni possibili meccanismi attraverso i quali i batteri probiotici possono inibire l’adesione di H. pylori. Certamente lattobacilli come L. johnsonii La 1 [69] o L. acidophilus LB [79] possono esercitare la loro attività adesiva attraverso la secrezione di sostanze antimicrobiche. In aggiunta, tipi come L. reuteri [87] o W. Confusa [81] possono inibire la crescita di H. pylori attraverso la competizione con i siti di adesione. Per esempio, è stato dimostrato che L. reuteri inibisce l’adesione di H. pylori al recettore glicolipidico specifico asialo-GMI e sulfatide. [87] Comunque, sia non specificatamente che in modo specifico,il blocco dei siti recettoriali è il meccanismo più probabile attraverso il
48 quale i lattobacilli possono inibire l’adesione di una grande varietà di batteri patogeni, sebbene ognuno aderisca al proprio recettore. [88]
Studi animali dimostrano che la precedente colonizzazione con i probiotici ha evitato [86] o ridotto le infezioni di H. pylori in topi germ-free. [89] Così, i probiotici potranno prevenire la colonizzazione della mucosa gastrica da parte di H.pylori inibendo l’adesione alle cellule epiteliali.
4° BARRIERA MUCOSA.
Riducendo la secrezione mucosa, nel danno o nella proliferazione epiteliale, è stato trovato frequentemente associato H. pylori gastrico.
H. pylori è conosciuto come soppressore dei geni espressi MUCI e MUC5A nella linea cellulare gastrica umana. [90] Questo potrà essere dimostrato in vitro,ovvero che L.plantarum e L. rhamnosus aumentano l’espressione dei geni MUC2 e MUC3 [91] e la secrezione extracellulare seguente di mucina con culture cellulari nel colon. [92] Questa proprietà può mediare l’abilità di questi geni e ripristinare la permeabilità della mucosa gastrica [93]o inibire l’adesione dei batteri patogeni, incluso H. pylori.[90,91]
5° MECCANISMI IMMUNOLOGICI.
La risposta infiammatoria dell’infezione gastrica a H. pylori è caratterizzata dal rilascio di vari mediatori infiammatori come chemochine e citochine. La risposta delle citochine è inizialmente modificata dal rilascio di IL8, che
49 conduce la migrazione dei neutrofili e monociti verso la mucosa. [94] I monociti attivati e le cellule dendritiche nella lamina propria producono fattore di necrosi tumorale alfa (TNFalfa) così come IL-1 e IL-6. [95] A tal proposito bisogna ricordare che IL-1 e IL-6 stimolano le cellule CD4+ T (tipo 1) e queste producono una varietà di citochine includendo IL-4, IL-5, IL-6 e interferone gamma (IFN-γ). [96] Questa risposta è incapace di eliminare l’infezione e sostenere la risposta infiammatoria.
I probiotici potrebbero modificare la risposta immunologica dell’ospite, interagendo con le cellule epiteliali e modulando la secrezione di citochine antinfiammatorie, riducendo l’attività infiammatoria gastrica. [97] Studi in vitro hanno dimostrato che è possibile inibire la secrezione di H. pylori stimolata da IL-8 in cellule epiteliali gastriche con L. salivarius. [86] Studi su animali hanno mostrato che gli effetti “probiotici” dei batteri acido lattico produttori possono essere prodotti attraverso la regolazione della risposta immune, in particolare mediante il controllo del bilancio di pro-infiammatori e citochine antinfiammatorie che a loro volta potrebbero essere il risultato della riduzione dell’attività gastrica e dello stimolo infiammatorio.[98] Una diminuzione della produzione di anticorpi IgG contro l’infezione di H. pylori, in seguito all’assunzione di probiotici, si sviluppa parallelamente a un rimodellamento della risposta infiammatoria gastrica. [74,75,86]
50 Finalmente, l’assunzione dei probiotici si è dimostrata efficace nel rafforzare la barriera mucosale stimolando la risposta locale di IgA, guidando così gli effetti della stabilizzazione della mucosa. [99]
Comunque, gli effetti dei probiotici sulla risposta immune sono difficili da generalizzare. Probiotici distinti appartenenti alla stessa famiglia possono generare differenze a livello della risposta immune che, a volte, dipende solo dallo stato immune dell’ospite.[100]
Probiotici e gastrite da Helicobacter pylori STUDI ANIMALI.
Vari studi sviluppati utilizzando modelli murini hanno dimostrato che il trattamento con diversi tipi di Lattobacilli riduce la colonizzazione di H. pylori o H.felis e diminuisce l’infiammazione gastrica Helicobacter-indotta. [74,76,79,86,89,101]
Nei topi convezionali, questo trattamento con culture di tipi di L. acidophilus umano LB diminuisce la densità di H. felis, né riduce l’attività ureasica e guarisce l’infiammazione mucosale associata adesso associata. [79] La riduzione della densità di H. pylori e l’infiammazione gastrica era stata anche osservata nei topi germ-free trattati con L. casei famiglia Shirota. [76] E’ stato suggerito che il grado di soppressione di H. pylori o H. felis dipende dai tipi di probiotici usati. [74,101] Per esempio, L. salivarius sopprime H. pylori e riduce
51 la risposta infiammatoria nei topi gnotobiotici rispetto a L. acidophilus o L.casei. [74]
Così, era stato dimostrato in studi animali che il trattamento probiotico, sebbene incapace di eliminare H. pylori, è efficiente nel ridurre l’infiammazione gastrica ad esso associata.
STUDI UMANI. Certamente i lattobacilli sono resistenti al pH dello stomaco e possono aderire e, transitoriamente, risiedere nello stomaco umano. [96]
Questo è stato postulato, sulla base dei risultati in vitro e mediante studi animali, ovvero che i probiotici potrebbero potenzialmente competere e regolare l’infezione di H. pylori. [69-71,78,103-107]
Nuovi trials pubblicati in estenso hanno diostrato gli effetti dei probiotici sull’H. pylori gastrico. Il tipo più frequentemente usato era L. johnsonii La1, altri fermenti lattici contenenti preparazioni di batteri vivi [70,71,103] o cellule libere in colture supernatanti. [70] Altri probiotici che sono stati usati sono: L. casei, [80] L. brevis, [104] e L. gasseri OLL2716. [106] Due studi, usando yogurt arricchito da misture di probiotici vivi, hanno esplicato gli effetti del trattamento probiotico su H. pylori gastrico. Non ci sono studi che riportano l’eradicazione dell’infezione di H. pylori con i probiotici. [69-71,103-106]
In molti studi, gli effetti del trattamento probiotico sul livello dell’infezione di H.pylori era stato indirettamente stimato con urea breath test (UBT).
52 [69,78,103-107] Di questi sette studi, due non riportano gli effetti del trattamento probiotico sull’infezione di H. pylori. [78,107] Comunque, entrambi gli studi non erano studi controllati. Nei rimanenti studi, la somministrazione di probiotici perseguiva il fine di descrivere il peso batterico nell’H. pylori. [69,103-106]
Nei primi studi la fornitura di cellule libere supernatanti di L.johnsonii La1 in coltura, guida la soppressione dell’attività ureasica di H. pylori. [69] Questi effetti erano mantenuti per sei settimane dopo la cessazione del trattamento ed erano effetti acido-indipendenti, così come la co-somministrazione di omeprazolo. [69]
In altri quattro studi eseguiti con soggetti trattati l’uno con L. johnsonii La1 yogurt, [103] L. brevis batterio liofilizzato, [104] o yogurt contenente L. acidophilus e B. lactis [105] o L. gasseri, [106] hanno dimostrato una riduzione del’indice Delta nell’ UBT. In aggiunta, i markers dell’infiammazione gastrica, così come il rapporto delle prostaglandine I/II [105] o l’attività decarbossilasica dell’ornitina [104] è diminuita nel gruppo trattato rispetto al gruppo di controllo.
Dei tre studi che direttamente valutavano gli effetti della somministrazione di probiotici in corso di gastrite da H. pylori [70,71,105] con l’esame istologico della biopsia gastrica. [70,71] In diversi studi di Lesbros-Pantoflickova effettuati su soggetti positivi all’H. pylori e trattati con monoterapia di claritromicina, co-sommisistrata con L. johnsonii La1-latte contaminato (LC-1) avevamo
53 dimostrato una riduzione dell’attività e della densità della gastrite da H. pylori. [70]
Gli effetti persistono per varie settimane dopo che LC-1 era stato stoppato. [70] Senza l’aggiunta di antibiotici, abbiamo visto la diminuzione dell’attività della gastrite associata ad H. pylori e della densità del patogeno stesso, in particolare nell’antro. Questi effetti sono stati osservati dopo tre settimane e sono stati mantenuti durante un lungo tempo di ingestione di LC-1. [71]
In aggiunta, una deplezione mucosa meno severa era stata osservata in soggetti positivi ad H. pylori riceventi il trattamento LC-1. Questo ritrovato sembrava confermare gli studi in vitro menzionati, riguardanti l’effetto del L. johnsonii La 1 nel prevenire l’adesione di H. pylori con l’aumento dell’espressione di mucina [91,93] che è usualmente ridotta in corso di infezione da H. pylori. [90]
In conclusione, studi effettuati su animali e sull’uomo dimostrano che i probiotici migliorano la gastrite correlata ad H.pylori e diminuiscono la concentrazione del batterio intragastrica. Questo effetto è statisticamente, ma debolmente,significativo.
Dall’altra parte, pochi studi potrebbero dimostrare l’eradicazione di H. pylori con il solo trattamento probiotico.


![Tabella 1. Effetti delle citochine sulla secrezione gastrica esocrina ed endocrina.[21]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7359196.94179/62.892.114.820.435.645/tabella-effetti-citochine-secrezione-gastrica-esocrina-endocrina.webp)





