DIPARTIMENTO DI FARMACIA
Corso di Laurea Specialistica in
Chimica e Tecnologia Farmaceutiche
TESI DI LAUREA
“Sintesi di nuovi inibitori tirosin chinasici a nucleopirazolopirimidinico
per il trattamento del tumore tiroideo”
Relatori: Candidata:
Prof.ssa La Motta Concettina Currenti Martina
Dott. Coviello Vito
ANNO ACCADEMICO 2013/2014
SSD/CHIM08
1 1.1. Premessa ... 1 1.2. La tiroide ... 2 1.3. Il cancro tiroideo... 4 1.3.1 Epidemiologia ... 4 1.3.2 Fattori di rischio ... 5 1.3.3 Diagnosi ... 6 1.3.4 Trattamento ... 7
1.3.5 Tipi di cancro alla tiroide ... 7
1.3.6 Principali alterazioni molecolari ... 9
1.4. Le proteine chinasi ... 10
1.4.1 Struttura dei recettori tirosina chinasi ... 11
1.4.2 Meccanismo d’azione delle proteine tirosina chinasi ... 14
1.4.3 Inibitori tirosin chinasici e loro meccanismo d’azione ... 15
1.5. Principali chinasi coinvolte nel tumore tiroideo ... 20
1.5.1 Il recettore RET ... 20
1.5.2 Il recettore VEGFR ... 25
1.5.3 Il recettore EGFR ... 26
1.5.4 Aurora chinasi ... 28
2. Introduzione alla parte sperimentale ... 32
3. Parte sperimentale ... 45
1
1. Introduzione
1.1. Premessa
Le proteine chinasi sono enzimi che mediano gran parte delle vie di trasduzione del segnale, svolgendo un ruolo importante in molti processi biochimici. Controllano infatti la crescita, il differenziamento, il metabolismo, la migrazione e la sopravvivenza cellulare. Appare evidente quindi che un’alterazione della loro normale funzionalità può portare allo sviluppo di molte patologie, tra cui il cancro. Nel caso specifico del tumore tiroideo, è stato dimostrato che la sua insorgenza può essere dovuta ad alterazioni geniche delle proteine chinasi RET (REarranged during Transfection), VEGFR (Vascular Endothelial Growth Factor Receptor) e EGFR (Epidermal Growth Factor Receptor). In particolare, il riarrangiamento cromosomico RET/PTC porta alla sintesi di una proteina chimerica attivata costitutivamente che sta alla base della maggior parte dei casi di carcinoma papillare della tiroide. I recettori chinasici EGFR e VEGFR sono coinvolti nella crescita epiteliale e vascolare e favoriscono quindi la proliferazione tumorale. Da qui l’idea di sfruttare queste proteine come target molecolari per il trattamento del carcinoma tiroideo.
In letteratura sono riportati vari inibitori tirosin chinasici multifunzionali, che hanno dimostrato una buona efficacia nel ridurre la progressione tumorale. Tra questi, sono risultati essere efficaci derivati a nucleo pirazolo[3,4-d]pirimidinico, che competono con il sito di legame per l’ATP.
Nel laboratorio in cui ho svolto la mia attività di ricerca sono già stati sintetizzati derivati a nucleo pirazolo pirimidinico, aventi buona attività su RET e VEGFR-2. Lo scopo di questo progetto di tesi sperimentale è stato quello di sintetizzare nuovi analoghi, diversamente sostituiti nelle posizioni 1 e 4 del nucleo eterociclico, allo scopo di approfondire i rapporti struttura-attività di questa classe di inibitori.
2
1.2. La tiroide
La tiroide è una ghiandola endocrina il cui ruolo fisiologico è estremamente importante nello sviluppo scheletrico e cerebrale, nonché nella regolazione del metabolismo corporeo e nello sviluppo di pelle, annessi cutanei e organi genitali. Situata nella parte anteriore del collo, si appoggia anteriormente alla trachea e laringe, posteriormente all’esofago. È costituita da due lobi connessi da un istmo ed è rivestita da una sottile capsula fibrosa ricca di fibre elastiche che la suddivide in lobuli a loro volta costituti da follicoli, strutture sferoidali di dimensioni variabili.
I follicoli rappresentano l’unità funzionale della tiroide e sono formati da un monostrato di tireociti (o cellule follicolari) che delimitano una cavità centrale, in cui è contenuta una sostanza gelatinosa, la colloide, che è costituita principalmente da tireoglobulina (Tg) secreta dalle cellule tiroidee. La Tg è una glicoproteina i cui residui tirosinici vengono iodati dopo ossidazione dello ioduro
3
e condensati a formare gli ormoni tiroidei: T3 (triiodotirosina) e T4 (tiroxina), secreti in seguito all’ idrolisi della Tg. Adiacenti alle cellule follicolari, vi sono rare cellule parafollicolari o cellule C che secernono calcitonina, importante regolatore della concentrazione ematica di calcio, tramite un effetto ipocalcemizzante.
La produzione di ormoni tiroidei è regolata dall’asse ipotalamo-ipofisario attraverso un meccanismo a feedback negativo: la riduzione degli ormoni tiroidei in circolo determina un aumento di un altro ormone stimolante la tiroide, il TSH (tireotropina ipofisaria). Questo a sua volta è sottoposto alla regolazione da parte dell’ipotalamo con il rilascio del TRH, ormone rilasciante la tireotropina.[1]
4
1.3. Il cancro tiroideo
Il cancro alla tiroide è la neoplasia endocrina maligna più diffusa. Tuttavia rappresenta meno dell’ 1% di tutti i tumori diagnosticati ogni anno. Si può manifestare a tutte le età, con massima incidenza tra 25 e 65 anni e maggiore prevalenza nelle donne rispetto agli uomini. In Italia l’incidenza è di 4.1 casi ogni 100.000 abitanti per gli uomini e 12.5 nuovi casi ogni 100.000 abitanti per quanto riguarda le donne; con una aumento di circa il 5% annuo negli ultimi vent’anni.[2]
1.3.1 Epidemiologia
I fattori principali che possono influenzare l’incidenza e la mortalità del carcinoma tiroideo sono l’area geografica, la variabilità inter-individuale e l’isotipo del tumore.
L'incidenza del carcinoma tiroideo è progressivamente aumentata nell'ultimo ventennio, ed è variabile tra le diverse aree geografiche ed etnie. Particolarmente elevata in Islanda, Filippine, Giappone ed Israele, ma l’insorgenza massima si è registrata alle Hawaii, dove i soggetti più colpiti sono uomini di origine cinese e donne di origine filippina. Negli Stati Uniti è più frequente tra gli individui di razza caucasica rispetto a quelli di razza nera, ai portoricani e agli ispanici. Queste differenze sarebbero da imputare a fattori ambientali (ad esempio regioni vulcaniche con alti livelli di radioattività), genetici e ad abitudini alimentari.[3]
Per quanto riguarda il sesso, il cancro alla tiroide è più frequente nella popolazione femminile, anche se la malignità dei noduli è maggiore negli uomini. Si manifesta principalmente tra i 25 e 65 anni, mentre è raro sotto i 16 anni di età. Nonostante l’aumento dell’incidenza, la mortalità per carcinoma tiroideo non è aumentata allo stesso modo, il tasso di mortalità annuo è compreso tra 0.4-2.8 e 0.2-1.2/100.000, rispettivamente per donne e uomini.[4]
5
1.3.2 Fattori di rischio
L’eziologia del tumore tiroideo sembra essere multifattoriale, risultato quindi di un’interazione di fattori genetici ed ambientali nei soggetti a rischio. Gli studi epidemiologici effettuati hanno identificato come principali fattori di rischio:
radiazioni ionizzanti: la precedente esposizione a radiazioni ionizzanti ha
un ruolo nella carcinogenesi tiroidea. Coloro che, soprattutto in età infantile, sono stati sottoposti a trattamenti radioterapici della regione testa-collo, presentano una maggiore probabilità di contrarre carcinoma papillare o follicolare. Inoltre anche elevati livelli di radioattività nell’ambiente, dovuti ad esempio ai disastri nucleari di Fukushima e Chernobyl, hanno portato ad un aumento d’incidenza di neoplasie tiroidee;[5]
fattori genetici: sono responsabili della familiarità che si riscontra in tutte
le forme di cancro della tiroide, con maggiore frequenza nei carcinomi midollari;[6]
preesistente patologia tiroidea benigna: è stato riscontrato un maggiore
rischio di contrarre carcinoma tiroideo nei soggetti affetti da nodulo tiroideo benigno e da gozzo;
fattori ormonali e gravidanze: in gravidanza, sono stati spesso
diagnosticati gozzo e noduli. È stato perciò ipotizzato il ruolo dei fattori ormonali o dei fattori legati alla gravidanza nell’insorgenza del carcinoma tiroideo;[7]
iodio: se l’apporto alimentare di iodio è sufficiente o eccessivo, il tumore
più rappresentativo è il carcinoma papillare; se invece c’è carenza di iodio sono più frequenti gli isotipi follicolare ed anaplastico;[6]
fattori ambientali: è stata riscontrata una maggiore incidenza nelle aree
vulcaniche a causa dell’emissione nell’aria di sostanze contaminanti, che potrebbero portare allo sviluppo di carcinomi tiroidei.
6
1.3.3 Diagnosi
La maggior parte dei tumori tiroidei è asintomatica, ad ogni modo il sintomo più frequente è la presenza di un nodulo a livello del collo. Negli stadi avanzati possono comparire ulteriori sintomi, che includono: tensione a livello del collo, problemi nella deglutizione o respiratori, gonfiore dei linfonodi, raucedine, dolori persistenti di collo e gola.[6] I noduli alla tiroide rappresentano un’entità clinica piuttosto comune. Tuttavia la maggior parte dei noduli tiroidei è di tipo benigno; infatti la percentuale di carcinoma nei noduli palpabili è del 4% e sale all’8% se si considerano le varie casistiche chirurgiche. Questi sintomi compaiono generalmente nelle fasi iniziali della malattia, per cui è possibile avere una diagnosi precoce nel 68% dei casi di tumore alla tiroide. I principali test per valutare la presenza di noduli tiroidei sono:
analisi del sangue, per determinare i livelli ormonali relativi al corretto funzionamento della ghiandola tiroidea (T3, T4, TSH e calcitonina);
tecniche di diagnostica per immagini, quali ecografia e scintigrafia tiroidea. L’ecografia permette di distinguere gli pseudo-noduli dai veri noduli tiroidei. Permette inoltre, una misura precisa delle dimensioni dei noduli e le loro caratteristiche solide, cistiche o miste. La scintigrafia invece valuta l’attività funzionale della ghiandola e dei noduli, permettendo di differenziare i noduli freddi (poco o affatto captanti) dai noduli caldi (ipercaptanti), per lo più benigni.
biopsia, l’unico metodo realmente capace di diagnosticare un tumore tiroideo. Normalmente l’esame viene effettuato tramite ago aspirato, ma nel caso in cui non si riesca ad ottenere una diagnosi certa sulla base del solo ago aspirato, si ricorre alla biopsia chirurgica.
7
1.3.4 Trattamento
La scelta del trattamento più adatto ai vari tipi di tumori tiroidei dipende da vari fattori, tra cui il tipo di tumore, le dimensioni del nodulo, la sensibilità alla radioterapia, l’età del paziente e lo stadio del tumore al momento della diagnosi. Il trattamento generalmente consiste nell’ asportazione chirurgica, nella somministrazione di iodio radioattivo (RAI) e nella terapia ormonale soppressiva. Tipicamente viene raccomandata la tiroidectomia totale, mentre la lobectomia è ritenuta appropriata solo per tumori piccoli, isolati e senza diffusione evidente. Un piccolo quantitativo di tessuto tiroideo viene di norma lasciato in seguito all’intervento chirurgico, per cui la RAI viene somministrata in sede post-operatoria al fine di distruggere le cellule tiroidee rimanenti, sane o tumorali. Infine il paziente dovrà sottoporsi a terapia ormonale soppressiva con levo-tiroxina (L-T4) al fine di mantenere bassi i livelli di TSH che hanno effetto stimolatorio nei confronti della crescita neoplastica.
1.3.5 Tipi di cancro alla tiroide
I tumori tiroidei derivano per il 95% circa dalle cellule follicolari, mentre solo una minoranza prende origine dalle cellule parafollicolari.
Da un punto di vista istologico si distinguono i seguenti isotipi caratterizzati da diversa morfologia, comportamento clinico ed eziologia:
Carcinoma papillare (PTC): è la forma più frequente di carcinoma
differenziato (circa l’80% dei casi). È costituito da papille con nuclei caratteristici (a vetro smerigliato) ed è non capsulato o solo parzialmente capsulato. Spesso il tumore è multifocale, può colpire entrambi i lobi e può dare origine a metastasi che interessano linfonodi regionali;
Carcinoma follicolare (FTC): è abbastanza raro, rappresenta il 5-10% dei
carcinomi tiroidei nelle regioni con apporto di iodio nella norma e il 30-40% nelle aree povere di iodio. È un carcinoma ghiandolare formante follicoli, solitamente è ben differenziato, unifocale, incapsulato e
8
caratterizzato dalla presenza di invasione capsulare, invasione vascolare ed infiltrazione del parenchima adiacente. Nelle forme più gravi, quando il tumore infiltra largamente la tiroide, la capsula può non essere più visibile. Si possono distinguere carcinomi follicolari minimamente invasivi e carcinomi follicolari altamente invasivi, a seconda del grado di invasione dei tessuti circostanti, sia tiroidei che extratiroidei;
Carcinoma midollare (MTC): rappresenta il 5% circa dei tumori tiroidei. Ha
origine dalle cellule parafollicolari ed è caratterizzato da elevati livelli circolanti di calcitonina, che costituisce quindi un vero e proprio marker tumorale. Nel 75% circa dei casi gli MTC sono sporadici, nel restante 25% sono di tipo ereditario. Si tratta di una sindrome a trasmissione autosomica dominante dovuta a mutazioni germinali del proto-oncogene RET. Può manifestarsi solo con la presenza di un MTC, si parla quindi di FMTC (Familial Medullary Thyroid Carcinomas), oppure nell’ambito di una sindrome endocrina multipla di tipo 2 (MEN 2). Esistono due sottotipi di MEN 2 (MEN 2A, MEN 2B). La sindrome MEN 2A comporta oltre a MTC anche tumori delle paratiroidi e feocromocitoma. I pazienti MEN 2B sono soggetti a MTC, feocromocitoma, ganglioneuromatosi, habitus marfanoide e anomalie scheletriche;
Carcinoma delle cellule di Hürtle (HCC): tipo particolare di carcinoma
tiroideo, diverso dal punto di vista istopatologico e per questo classificato a parte. Caratterizzato da cellule poligonali ricche in granuli eosinofili e mitocondri, è considerato una variante del PTC oppure del FTC;[8]
Carcinoma anaplastico (ATC): molto raro (circa l’1% dei tumori tiroidei),
ma particolarmente aggressivo ed altamente indifferenziato. La massa tumorale si sviluppa rapidamente, invadendo le strutture juxtatiroidee vicine causando disfagia e dispnea. Più del 75% dei pazienti presentano già metastasi al momento della diagnosi e la loro sopravvivenza media è di circa 6 mesi. Sono più frequenti in età avanzata e in alcuni casi possono derivare dalla progressione di PTC o FTC già esistenti. Questo perché, in
9
alcuni pazienti, sono state riscontrate aree anaplastiche insieme ad altre più differenziate di tipo papillifero o follicolare.[9]
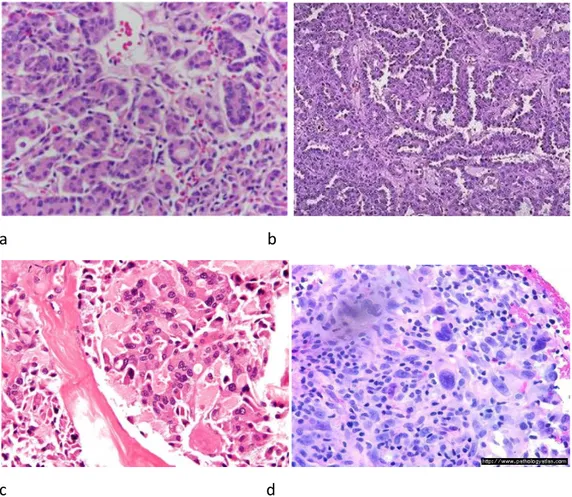
a b
c d
Figura 1.3: Sezioni istologiche dei carcinomi tiroidei: a) Follicolare, b) Papillare, c) Midollare, d) Anaplastico
1.3.6 Principali alterazioni molecolari
Nella comparsa del tumore tiroideo derivante dall’epitelio follicolare sono coinvolte molte alterazioni genetiche e sono rappresentate principalmente da riarrangiamenti e/o mutazioni puntiformi che portano all’attivazione oncogenica di importati vie di trasduzione del segnale, come la MAPK (Mitogen‐Activated Protein Kinase) coinvolta nei processi di proliferazione, differenziamento e
10
apoptosi cellulare, tramite l’attivazione costitutiva di oncogeni, ad esempio RET, BRAF,NTRK‐1, MET e KRAS o il silenziamento di oncosoppressori come p53, PPARγ e PTEN. Alcune di queste alterazioni genetiche sono specifiche di alcuni tipi di carcinoma tiroideo e possono essere utilizzate come strumento diagnostico. Nei PTC le alterazioni più rappresentative sono mutazioni puntiformi nei geni BRAF e RAS (nel 40% e nel 10% dei casi rispettivamente) e riarrangiamenti RET/PTC (nel 10‐20% dei casi), e quelli che contengono il gene
TRK (in circa il 5% dei casi). Negli FTC sono state riscontrate invece mutazioni di
RAS (nel 45% dei casi) o riarrangiamenti PAX/PPAγ (nel 35% dei casi).
In questo studio di ricerca, ci siamo concentrati in particolare sulle mutazioni geniche che riguardano specifici enzimi, le proteine tirosina chinasi.
1.4. Le proteine chinasi
Le proteine-chinasi sono enzimi che svolgono un ruolo chiave nel controllo di numerose funzioni cellulari attraverso la fosforilazione di residui di serina, treonina o tirosina di proteine bersaglio coinvolte nella crescita, nel differenziamento, nel metabolismo, nella migrazione e nell’apoptosi. La fosforilazione avviene mediante il trasferimento di un gruppo fosfato da una molecola donatrice (ATP o GTP) al residuo amminoacidico della proteina bersaglio. Vista l’importanza dell’attività chinasica nell’omeostasi cellulare, una mancata regolazione può essere associata a varie patologie, incluso il cancro. Normalmente le tirosin chinasi prevengono la proliferazione del tumore e contribuiscono ad aumentare la sensibilità a stimoli apoptotici, ma un riarrangiamento e/o una mutazione nel gene che codifica per esse ed una loro sovraespressione, possono portare allo sviluppo di una neoplasia.[10] Per questo motivo sono state scelte come bersagli per la sintesi di nuove molecole potenzialmente utili come agenti antitumorali. Le tirosina chinasi sono divise in due classi:
11
tirosina chinasi recettoriali: recettori transmembrana coinvolti
nella trasduzione del segnale;
tirosina chinasi non recettoriali: proteine trasduttrici del segnale
prive delle porzioni extracellulare e transmembrana.
Attualmente sono stati individuati 58 recettori tirosina chinasi, suddivisi in 20 famiglie, tra cui RET, EGFR e VEGFR.
Le serin-treonina chinasi svolgono un ruolo fondamentale in numerosi processi cellulari tra cui la proliferazione, il differenziamento e l’apoptosi. Notevole interesse si è sviluppato intorno alla famiglia delle chinasi Aurora, cruciale per il controllo del ciclo cellulare.
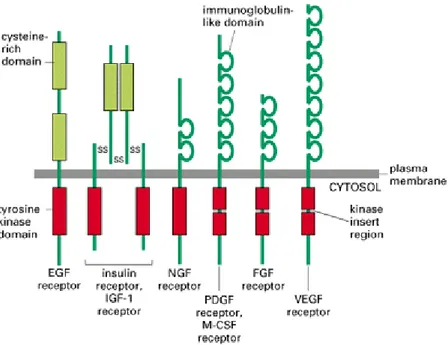
1.4.1 Struttura dei recettori tirosina chinasi
I recettori tirosina chinasi sono di base costituiti da:
regione extracellulare, che coincide con l’estremità N-terminale della
proteina e contiene il sito di interazione con il ligando;
sequenza transmembrana, costituita da una singola α-elica; regione regolatoria juxtamembranale;
regione intracellulare che contiene il sito catalitico ad attività tirosin
chinasica;
12
Figura 1.4: Alcuni esempi di recettori tirosin chinasici.
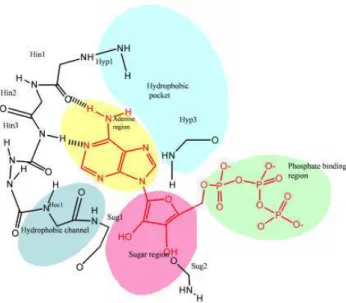
Il dominio catalitico è formato da due lobi: un lobo N-terminale comprendente 5 strutture a foglietto β e una α-elica, e un lobo C-terminale più grande prevalentemente con strutture ad α-elica. Tra i due lobi è presente una profonda inflessione della superficie proteica che va a costituire il sito di riconoscimento per l’ATP.[11] Il sito di legame dell’ATP comprende:
1. Regione dell’adenina. Consiste in un piccolo segmento di connessione tra i due lobi, a cui si lega l’anello imidazolopirimidinico dell’ATP. Si instaurano infatti tre legami idrogeno, in cui sono coinvolti gli atomi di azoto N-1 e N-6 e l’idrogeno legato al carbonio in posizione 2. Sono presenti anche interazioni idrofobiche tra l’anello imidazolopirimidinico ed i residui amminoacidici Ile 10, Val 18, Ala 31, Val 64, Leu 134 dei lobi ammino e carbossi terminali;
2. Regione dello zucchero. È una regione idrofilica dove si lega il ribosio formando, con uno dei suoi gruppi ossidrilici, un legame idrogeno con un residuo amminoacidico polare;
13
3. Regione fosfato. Comprende due zone fondamentali:
- loop ricco di glicine: un residuo altamente conservato del tipo G-X-G-X-X-G-X-V situato a livello del lobo N-terminale. Ha la funzione di ancorare l’ATP alla proteina, grazie ai residui di glicina che conferiscono la giusta flessibilità per l’ancoraggio e per l’esclusione delle molecole d’acqua; - struttura ad α-elica: contenente un residuo formato da
Glu-Lys-Asp che permette il corretto orientamento del gruppo fosfato nel sito attivo.
4. Regione nascosta. Non è occupata dalla molecola di ATP e può avere forma e dimensioni variabili;
5. Regione accessibile al solvente. Anche in questa zona non si inserisce l’ATP e può assumere varie forme in base alla presenza o meno di residui di glicina addizionali, i quali infatti conferiscono una diversa conformazione alla proteina tra la regione dell’adenina e l’inizio del lobo C-terminale. Ciò non permette il legame di tutte quelle molecole che fuoriescono dal sito di legame dell’ATP in modo planare.[12]
14
Tutte le chinasi presentano a livello del lobo C-terminale una porzione addizionale, ”activation loop”, contenente sequenze altamente conservate: inizia con il motivo DFG, costituito dalla tripletta Asp-Phe-Gly e facente parte della regione fosfato, e termina con il motivo APE, formato invece da Ala-Pro-Glu. Il loop di attivazione può assumere diverse conformazioni, è infatti una porzione estremamente flessibile che svolge un ruolo chiave nel trasferimento di un gruppo fosfato dall’ATP al substrato.
Nello stato inattivo il loop di attivazione assume conformazioni compatte, mentre nella forma attiva si trova in una conformazione estesa. La conformazione attiva si ha in seguito alla fosforilazione che blocca conformazionalmente il loop in modo tale da consentire il libero accesso all’ATP a livello del sito catalitico. Il residuo di aspartato del motivo DFG si coordina con lo ione Mg2+, inoltre il resto del loop è posizionato lontano dal centro catalitico in una conformazione estesa in modo che nella porzione C-terminale si crei una tasca in grado di ospitare una molecola di ATP. Nello specifico la fenilalanina si trova al di fuori del binding site, mentre nella conformazione inattiva (non fosforilata) è posizionata all’interno di esso in modo da ostacolare l’ingresso della molecola di ATP. Questo fa sì che si abbia una tasca idrofobica addizionale che possiamo definire sito allosterico, importante per il legame con potenziali inibitori della proteina chinasi.[13]
1.4.2 Meccanismo d’azione delle proteine tirosina chinasi
L’attivazione dei recettori tirosina chinasi si ha in seguito al legame di uno specifico ligando al loro dominio extracellulare. Questa interazione determina la dimerizzazione del recettore, la cui struttura dimerica è mantenuta grazie a legami che si instaurano tra le due unità recettoriali. Differenti ligandi impiegano diverse strategie per raggiungere la conformazione stabile del dimero: un ligando può infatti legarsi a due molecole di recettore, oppure due ligandi si legano simultaneamente a due recettori e solo in un secondo momento si avrà la dimerizzazione (come nel caso di VEGF). Questo permette la trans-fosforilazione
15
dei residui tirosinici di ciascun recettore ad opera del recettore partner, il loop assume quindi la conformazione adatta a far entrare l’ATP nel sito di legame. L’enzima è ora in grado di legare specifiche proteine segnale, sulle quali viene trasferito un gruppo fosfato dall’ATP. Parte così una cascata di segnali biochimici intracellulari, che porta all'attivazione o repressione di vari geni e definisce quindi la risposta biologica. Durante questi processi, i recettori migrano all'interno della membrana plasmatica e sono internalizzati attraverso delle invaginazioni rivestite di clatrina, che formano vescicole endocitotiche. Le vescicole si fondono con i lisosomi così che recettore e ligando possano essere degradati dagli enzimi lisosomiali, ciò comporta il termine della reazione di segnalazione.[10]
1.4.3 Inibitori tirosin chinasici e loro meccanismo d’azione
Gli inibitori delle proteine chinasi rappresentano una classe emergente importante di agenti terapeutici mirati. Ad oggi sono state sviluppate varie molecole con una potenziale azione inibitoria.
Si possono suddividere:
Inibitori di tipo I: sono la maggior parte, si tratta di piccole molecole che
riconoscono la conformazione attiva della chinasi e competono per il sito di legame dell’ATP. Consistono tipicamente in un sistema eterociclico che occupa la regione dell’adenina, andando ad instaurare legami idrogeno e
interazioni idrofobiche tipiche dell’ATP. La selettività d’azione nei confronti di diverse proteine chinasi, è conferita dai legami con le altre
regioni facenti parte del sito di legame dell’ATP: regione idrofobica I (regione nascosta) e II (regione accessibile al solvente), regione fosfato e regione dello zucchero. La maggior parte degli inibitori non sfrutta però il sito di legame del ribosio o del fosfato.
Inibitori di tipo II: riconoscono invece la conformazione inattiva della
16
anche detta DFG-out. Il movimento del loop di attivazione a dare la conformazione DFG-out espone un sito di legame idrofobo addizionale adiacente al sito di legame ATP. Di questa classe fanno parte inibitori come imatinib e sorafenib.
Inibitori allosterici: questa terza classe di composti si lega al di fuori del
sito dell’ ATP, interagisce infatti con il sito allosterico e modula l'attività della chinasi in maniera differente. Inibitori appartenenti a questa categoria presentano un alto grado di selettività, perché sfruttano siti di legame e meccanismi di regolamentazione che sono unici per un particolare tipo di chinasi. Il più rappresentativo è CI-1040, che inibisce MEK1 e MEK2 occupando una tasca adiacente al sito di legame dell’ATP.
Inibitori covalenti: sono in grado di formare un legame covalente
irreversibile nel sito attivo della chinasi, nella maggior parte dei casi reagendo con un residuo cisteina. Ad esempio, gli inibitori del recettore del fattore di crescita dell’epidermide (EGFR), HKI-272 e CL-387785 sono stati sviluppati per colpire un particolare residuo di cisteina situato nel sito di legame dell’ATP. Contengono quindi un gruppo elettrofilo, reattivo verso l’atomo di zolfo elettron ricco presente nel residuo di cisteina. L'inibitore blocca così irreversibilmente l’accesso dell’ ATP alla chinasi, rendendola inattiva.[14]
Molte chinasi hanno un residuo cisteinico situato in prossimità della tasca ATP e potrebbero quindi essere inibite con questo approccio. Tuttavia, la potenziale tossicità di questi inibitori covalenti è molto elevata.
Gli inibitori di tipo II mostrano un’ attività notevole, questo potrebbe essere dovuto al fatto che riconoscono la conformazione inattiva della chinasi che ha una minore affinità per l’ATP rispetto a quella in conformazione attiva. Inoltre, sembra che possano fornire una via nuova per superare le mutazioni che subiscono le chinasi che portano alla resistenza ai farmaci.
17
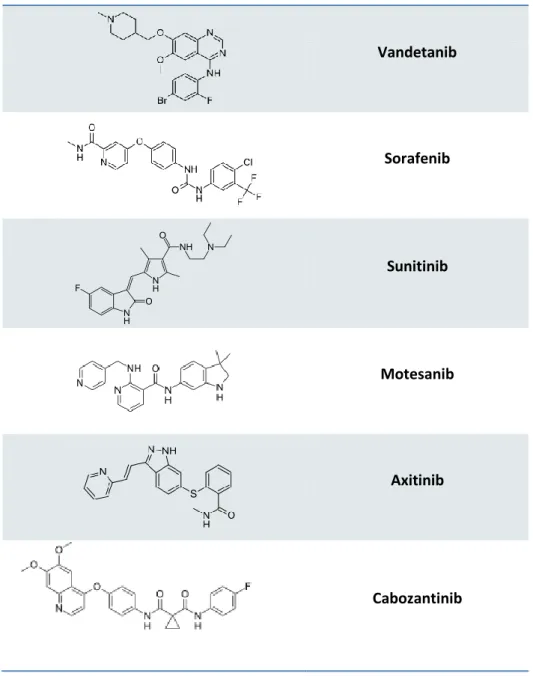
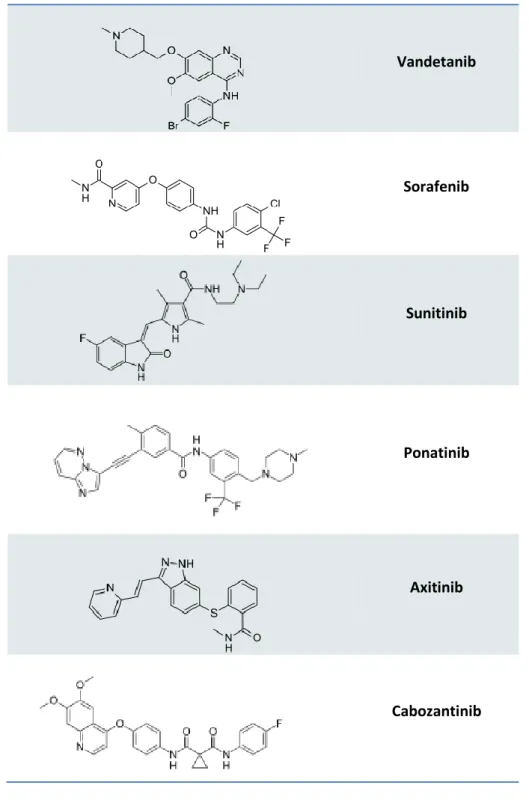
Inibitori della proteina RET mutata vengono usati per il trattamento dei carcinomi tiroidei, i più studiati sono: Vandetanib, Sorafenib, Sunitinib, Motesanib e Axitinib.
Vandetanib (Caprelsa®) è un potente inibitore dei recettori VEGFR-2 e 3, RET e ad
elevate concentrazioni anche EGFR. Inibisce quindi l’angiogenesi tumorale e la proliferazione delle cellule neoplastiche in vari tumori umani. Esiste già prova della sua efficacia nel trattamento del cancro del polmone (NSCLC) in associazione con alcuni farmaci tradizionali citotossici (il docetaxel e il pemetrexed). Per quanto riguarda la tiroide, ha mostrato una buona attività per mutazioni RET/PTC3 presenti in alcuni carcinomi papillari, mutazioni RET associate a MEN2B e in alcuni casi sporadici di MTC. I principali effetti collaterali associati all’assunzione di vandetanib sono: rash ed altre reazioni cutanee (incluse reazioni di fotosensibilità e sindrome da eritrodisestesia palmoplantare), diarrea, prolungamento dell’intervallo QT, crisi ipertensive ed innalzamento di alanina aminotransferasi. Il Vandetanib è stato approvato in America dalla FDA nel 2011 per il trattamento dei pazienti con carcinoma midollare della tiroide (MTC) aggressivo e sintomatico, non asportabile chirurgicamente, localmente avanzato o metastatico. Nel febbraio 2012 è stato approvato anche dall’EMA e dal 17 settembre 2013 è disponibile anche in Italia.
Sorafenib (Nexavar®) è un inibitore dei recettori VEGFR-2 e 3, RET e della serina
chinasi BRAF. È stato approvato per il trattamento dell’epatocarcinoma e del carcinoma a cellule renali avanzato dopo fallimento terapeutico ad una precedente terapia a base di interferone alfa o interleuchina-2, o che sono considerati non idonei a ricevere tale terapia. I pricipali effetti collaterali sono: tossicità cutanea, diarrea, ipertensione, ischemia e/o infarto del miocardio. Nel novembre 2013 la FDA ha ampliato gli usi approvati di sorafenib per il trattamento del carcinoma differenziato della tiroide in fase avanzata (metastatico). Questa nuova indicazione è destinata a pazienti con carcinoma
18
tiroideo differenziato progressivo localmente ricorrente o metastatico, che non risponde più al trattamento con iodio radioattivo.
Sunitinib (Sutent®) Sunitinib è un inibitore orale delle tirosin-chinasi ad attività
multitarget, blocca tutti e tre i recettori VEGFR, RET e RET/PTC-1 e -2. È stato approvato per il trattamento del tumore stromale del tratto gastrointestinale (GIST) non operabile e/o metastatico negli adulti dopo fallimento di un trattamento con imatinib dovuto a resistenza o intolleranza, per il trattamento del carcinoma renale avanzato/metastatico (MRCC) negli adulti e per il trattamento di tumori neuroendocrini pancreatici (pNET) ben differenziati, non operabili o metastatici, in progressione di malattia, negli adulti. Sono attualmente in corso degli studi clinici miranti a verificare l’efficacia del sunitinib per altri tipi di tumore. Può causare: disturbi gastrointestinali, tossicità cutanea, ipertensione,patologie cardiache.
Motesanib è un inibitore di VEGFR-1, 2 e 3, PGDFR e KIT. È stato studiato in
associazione a carboplatino e paclitaxel, per il trattamento di pazienti con NSCLC non squamoso avanzato o nel sottogruppo con adenocarcinoma, ma non ha migliorato significativamente la sopravvivenza globale rispetto al trattamento con solo carboplatino e paclitaxel. Sembra poi che possa indurre risposte parziali in pazienti con tumori tiroidei differenziati in stato avanzato o con metastasi. I principali effetti collaterali comprendono: diarrea, stanchezza, nausea, ipertensione e perdita di peso.
Axitinib (Inlyta®) inibisce selettivamente VEGFR-1, 2 e 3 ed è indicato per il
trattamento del carcinoma renale (RCC) avanzato nei pazienti adulti, dopo fallimento di un precedente trattamento con sunitinib o con una citochina. Ha mostrato inoltre efficacia in tutti i tipi istologici di tumore tiroideo avanzato. I più comuni effetti collaterali sono: diarrea, ipertensione, astenia, perdita di peso.
19
Cabozantinib (Cometriq®) conosciuto anche come XL184, è un inibitore
tirosinchinasico potenzialmente utile per il trattamento del carcinoma midollare tiroideo, glioblastoma multiforme e NSCLC. I principali target molecolari sono MET, VEGFR-2 e RET. I più comuni effetti collaterali sono: diarrea, stanchezza, stomatiti, eritrodisestesia palmo-plantare, nausea e ipertensione.
Nel 2012 è stato approvato dall’FDA per il trattamento di pazienti con carcinoma midollare tiroideo. Vandetanib Sorafenib Sunitinib Motesanib Axitinib Cabozantinib
20
1.5. Principali chinasi coinvolte nel tumore tiroideo
1.5.1 Il recettore RET
Il recettore RET (REarranged during Transfection) è una proteina transmembrana, coinvolta nel controllo della differenziazione cellulare e della proliferazione. È maggiormente espresso a livello delle cellule parafollicolari, delle cellule della midollare del surrene e delle cellule paratiroidali principali, mentre non è espresso nelle cellule follicolari dove viene attivato solo in seguito ad un riarrangiamento del gene RET. Questa proteina è codificata dal proto-oncogene ret, situato sul cromosoma 10, comprendente 21 esoni.
Il gene RET è fondamentale per lo sviluppo di tessuti derivanti dalle creste neurali e durante lo sviluppo embrionale è espresso anche nei precursori delle cellule urogenitali.[15]
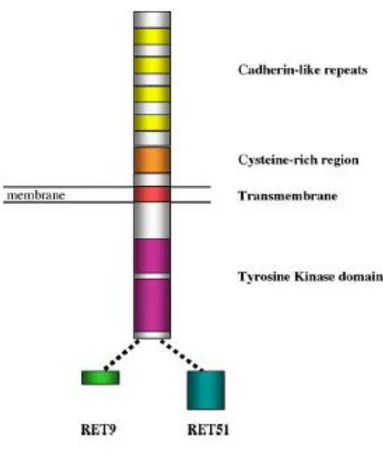
Le principali isoforme proteiche sono RET9 o isoforma corta (1072 aa), RET51 o isoforma lunga (1114 aa) e RET43 (1106 aa), formate in seguito ad un meccanismo di splicing alternativo nella regione 3’ del trascritto e contenenti rispettivamente 9, 51 e 43 amminoacidi nella loro porzione C-terminale, nella quale differiscono tra loro. Le isoforme principali sono RET51 e RET9, che sono altamente conservate in molte specie. Essendo diversa la porzione citoplasmatica coinvolta nella trasduzione del segnale, i processi biologici mediati non saranno gli stessi.[16]
Studi in vivo mostrano che topi deficitati dell’isoforma lunga apparentemente crescono normali, mentre se mancano dell’isoforma RET9 soffrono di ipoplasia del rene e di difetti dell’innervazione enterica. Da qui si è giunti alla conclusione che RET9 è fondamentale per la morfogenesi del rene e per lo sviluppo del sistema nervoso enterico.[17]
Nel complesso sembrerebbe che l’isoforma RET9 sia fondamentale per lo sviluppo iniziale del rene e del sistema nervoso enterico, mentre l’isoforma RET51 sia importante nella fase tardiva dell’organogenesi del rene e a sviluppo
21
ultimato.[18] Il recettore tirosina chinasi RET presenta una regione extracellulare, una transmembranale e una intracellulare.
La porzione extracellulare, che coincide con l’estremità N-terminale della proteina, contiene il sito di ancoraggio del ligando. A questo livello troviamo quattro cadherine like domains, ovvero domini simili alle caderine, proteine che mediano l’adesione cellula-cellula. Come queste RET possiede un sito di legame per il calcio, che induce una modifica conformazionale e conferisce rigidità alla proteina, proteggendola così dalla degradazione proteolitica e garantendo l’adesione cellula-cellula. E’ stato dimostrato che questi quattro domini sono necessari per la corretta maturazione post-trasduzionale del recettore, utile per l’interazione con i ligandi e con i co-recettori. La porzione extracellulare della proteina contiene altri due domini importanti: un leader peptide responsabile del trasporto della proteina sulla membrana e un dominio ricco in residui di cisteina (CRD), situato nella porzione prossimale alla membrana plasmatica. Quest’ultimo, è coinvolto nella formazione e nel mantenimento della struttura terziaria, attraverso la formazione di ponti disolfuro, e nella dimerizzazione indotta dal legame con il ligando.
La regione transmembrana è importante invece per il mantenimento della struttura dimerica, grazie all’instaurarsi di interazioni non covalenti recettore-recettore.
La regione intracellulare comprende un dominio juxtamembranale, una coda terminale e due domini tirosino chinasici (Tk-a e Tk-b) mediante i quali RET, in seguito alla dimerizzazione, è in grado di autofosforilarsi a livello di specifici residui di tirosina, innescando così la cascata intracellulare di trasduzione del segnale .[19]
22
Figura 1.6: Struttura del recettore RET.
I principali ligandi del recettore RET appartengono alla famiglia del GDNF (glial
cell line-derived neurotrophic factor), necessari per la maturazione e la
sopravvivenza di cellule neuronali, la morfogenesi del rene e la divisione degli spermatozooi.[20] Fanno parte di questa grande famiglia il GDNF stesso, la Neurturina (NTN), l’Artemina (ARTN) e la Persefina (PSPN). Per poter interagire con i propri ligandi, la proteina RET necessita che questi si associno a co-recettori, proteine appartenenti alla famiglia del GFRα (growth factor
receptor-alfa), ancorati alla membrana da una molecola di glicosil-fosfatidilinositolo. Ogni
co-recettore presenta maggiore affinità con uno dei ligandi: in particolare GDNF si lega al GFR-α1, la neurturina al GFR-α2, l’artemina al GFR-α3 e la persefina al GFR-α4.[21]
23
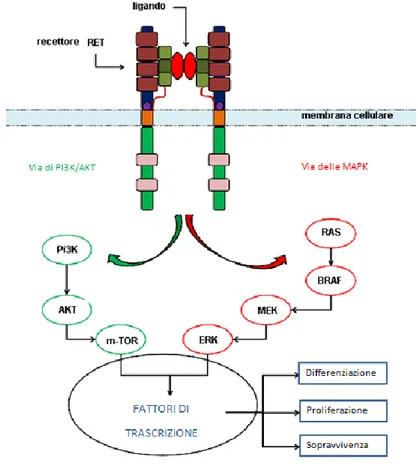
Dopo il legame del ligando con il co-recettore, RET subisce una dimerizzazione e transautofosforilazione a livello di specifici residui di tirosina localizzati nel dominio catalitico intracellulare di RET.
Figura 1.7: Meccanismo d’azione del recettore RET.
La isoforma RET9 contiene 16 residui di tirosina, mentre l’isoforma RET51 contiene due residui di tirosina in più nella coda C-terminale. I residui di tirosina Tyr905, Tyr1015, Tyr1062 e Tyr 1096 diventano siti d’ancoraggio per specifiche proteine intracellulari, come Grb7/10, fosfolipasi Cγ, SHC, le quali una volta fosforilate, danno origine alle cascate di segnali intracellulari che culminano con la trascrizione di geni coinvolti nella differenziazione, proliferazione e sopravvivenza cellulare. Il gene ret venne isolato come forma oncogenica chimerica durante un dosaggio di trasformazione di cellule NIH 3T3,da qui il nome “rearranged during trasfection”.[22] In seguito a mutazioni all’interno del
24
gene, a seconda della regione proteica colpita, si possono ottenere proteine con fenotipo “perdita di funzione” (loss of function) o proteine attivate costitutivamente (gain of function). Mutazioni loss of function inattivano il recettore, e portano allo sviluppo di una patologia, detta malattia di Hirschsprung, caratterizzata dall’assenza dei plessi nervosi intramurali del tratto gastrointestinale. Mutazioni gain of function sono responsabili invece di sindromi tumorali familiari, tra cui MEN 2 e i carcinomi papillare e midollare della tiroide, e possono essere ereditate geneticamente oppure avvenire in cellule somatiche. Le sindromi tumorali ereditarie MEN 2A e FMTC sono dovute a mutazioni localizzate a livello della porzione extracellulare di RET, in particolare sul dominio ricco di cisteine. La sostituzione di un residuo cisteinico con un altro amminoacido, comporta infatti che una cisteina normalmente impegnata in un legame disolfuro intramolecolare resti libera di formare un legame intermolecolare con un’altra presente su un altro monomero di RET mutato. Si formano quindi ponti disolfuro che favoriscono la dimerizzazione del recettore e la conseguente attivazione costitutiva.[23]
Invece, MEN 2B è causata da alterazioni nel dominio tirosin-chinasico, per cui viene codificata una proteina il cui dominio catalitico è attivato costitutivamente anche in assenza di dimerizzazione.
Le mutazioni somatiche del proto-oncogne ret riguardano riarrangiamenti di RET, che comportano la fusione del suo dominio tirosin-chinasico con la regione 5’-terminale di diversi geni eterologhi, ottenendo oncogeni chimerici denominati RET\PTC, proprio per sottolineare la loro presenza selettiva nel PTC e non in neoplasie di altri tessuti nè in altri tumori tiroidei. In seguito alla fusione vengono eliminati il sito di legame al ligando e la regione juxtamembranale della proteina, la quale migra all’interno del citosol. Inoltre, la continua presenza di interazioni recettore-recettore, porta ad una dimerizzazione ligando-indipendente e alla ripetuta fosforilazione delle molecole segnale. I geni RET/PTC sono dei potenti oncogeni,ne esistono molte varianti che differiscono nel gene fuso a RET. I riarrangiamenti più frequenti sono RET/PTC1 (fusione con il gene H4) e RET/PTC3
25
(fusione con il gene RFG). Normalmente RET non viene espresso nelle cellule follicolari tiroidee, essendo di origine neuroectodermica, ma una volta fuso con i geni “partners”, la trascrizione è controllata dai promotori dei geni che si fondono ad esso, che sono invece ubiquitari e che contengono porzioni codificanti per proteine che formeranno domini coiled coil. Si tratta di domini capaci di indurre la dimerizzazione e attivare così la proteina chimerica, che avendo ancora il dominio tirosin chinasico del recettore RET intatto, porta all’attivazione costitutiva della via delle MAPK (Mitogen Activated Protein Kinase). Questo processo determina la proliferazione cellulare incontrollata, l’aumento di invasività, la resistenza all’apoptosi e l’angiogenesi che favorisce lo sviluppo tumorale. Riarrangiamenti del tipo RET/PTC1 si riscontrano con maggiore frequenza nei tumori sporadici MTC e nelle varianti classiche del PTC, al contrario RET/PTC3 è maggiormente espresso nei carcinomi papillari indotti da radiazioni e nelle varianti solide dei PTC.[24]
1.5.2 Il recettore VEGFR
Il fattore di crescita vascolare endoteliale (VEGF) è uno dei principali induttori di proliferazione delle cellule endoteliali e permeabilità dei vasi sanguigni. I recettori che legano VEGF, VEGFR-1, 2 e 3 sono i principali regolatori dell’angiogenesi, fondamentali per lo sviluppo e il mantenimento del tumore. L'espansione di tumori solidi oltre un diametro di 1-2 mm richiede la formazione de novo di una rete vascolare, che favorisce la crescita tumorale con l’apporto di ossigeno e nutrienti. Il tumore secerne il ligando VEGF, che a sua volta attiva il recettore inducendo la dimerizzazione e l’attivazione tramite trans fosforilazione. Della famiglia dei VEGF fanno parte: VEGF-A, B,C,D,E.[25]
VEGF-A sembra essere il principale ligando coinvolto nell’angiogenesi tumorale, attraverso il suo legame con i recettori VEGFR-1 e 2. Entrambi hanno una porzione extracellulare consistente in 7 domini immunoglobulino simili, una singola porzione trans membrana, due domini tirosin chinasici e una coda C-terminale.[26]
26
Figura 1.8: Rappresentazione schematica dei recettori VEGFR e loro ligandi.
Questi recettori rappresentano promettenti target nel trattamento del cancro; l’inibizione dell'angiogenesi ha diversi vantaggi, poiché le cellule endoteliali sono facilmente accessibili tramite flusso sanguigno e non sono suscettibili allo sviluppo di resistenza alla terapia, perché geneticamente stabili rispetto alle cellule tumorali.
1.5.3 Il recettore EGFR
I recettori EGFR sono recettori di membrana ad attività tirosin chinasica, appartenenti alla famiglia dei recettori dei fattori di crescita dell’epidermide ErbB/HER, di cui fanno parte anche ErbB2/HER2, ErbB3/HER3, ErbB4/HER4. Sono tutti costituiti da un sito di legame extracellulare, una regione trans-membrana, un sito citoplasmatico che contiene una regione tirosina-chinasi e una coda
C-27
terminale. I ligandi endogeni dei recettori ErbB sono 12 diversi fattori di crescita, che includono il fattore di crescita dell’epidermide (EGF), il fattore di crescita trasformante (TGF-α) e la neuregulina.[27] In seguito al legame con EGFR, inducono la dimerizzazione del recettore e ne attivano l’attività tirosin chinasica, con successiva fosforilazione dei residui tirosinici della regione C-terminale. Ciò comporta l’attivazione del meccanismo di trasduzione dei segnali che induce la proliferazione cellulare, l’inibizione dell’apoptosi e l’angiogenesi. Una deregolazione di questi processi, dovuta ad una sovraespressione del recettore EGFR, può determinare oncogenesi e progressione del cancro. In molti tumori, come cancro al seno e cancro non a piccole cellule del polmone (NSCLC), è stata riscontrata un’aumentata o alterata espressione del recettore EGFR o dei suoi ligandi. EGFR risulta essere quindi un eccellente target per il trattamento del cancro, in particolare nel caso del carcinoma tiroideo, in cui l’inibizione di questo recettore sembra essere utile se associata ad inibitori RET.
Figura 1.9: Rappresentazione delle vie di segnale attivate in seguito all’interazione tra EGF e EGFR.
28
1.5.4 Aurora chinasi
Le chinasi Aurora rappresentano una nuova famiglia di serina/treonina chinasi, conivolte in vari processi del ciclo cellulare, tra cui il corretto assemblaggio e la stabilità del fuso mitotico, la condensazione cromosomica e l’orientamento dei cromosomi sul piano metafasico. Le sue mutazioni non permettono la corretta separazione del centrosoma, portando alla formazione di fusi mitotici monopolari, da qui il nome Aurora, in ricordo dell’aurora boreale visibile al Polo Nord.[28]
Le chinasi aurora conosciute sono tre (Aurora-A, B, e C) codificate da geni diversi, rispettivamente stk6, stk12 e stk13. Mentre Aurora-A e Aurora-B risultano essere altamente conservate durante l’evoluzione, Aurora-C compare solo nei mammiferi. Inoltre, le isoforme A e B vengono espresse in tutti i tessuti, mentre la C è espressa principalmente nei testicoli e partecipa alla meiosi.
L’Aurora-A è associata ai centrosomi e alle regioni dei microtubuli in prossimità di essi ed è coinvolta principalmente nella corretta separazione e maturazione del centrosoma, nell’assemblaggio del fuso bipolare e nell’entrata e nell’uscita dalla fase mitotica.[29]
L’ Aurora B appartiene ad un gruppo di proteine dette “passeggeri cromosomici” e la sua espressione ed attività sono sotto il controllo del ciclo cellulare. È espressa solo durante la mitosi ed è un componente di un complesso multiproteico comprendente INCENP, survivina e borealina. Aurora B durante la profase si associa ai cromosomi in maniera diffusa e in prometafase confluisce sotto forma di complessi sui centromeri; infine, all’inizio dell’anafase, si stacca dai cromatidi in via di separazione e va a localizzarsi nella regione mediana del fuso, dove rimane fino al completamento della citocinesi.[30]
L’Aurora C è la meno conosciuta della famiglia; ha un’elevata omologia strutturale con l’Aurora-B (83%), mentre l’identità di sequenza con l’Aurora-A è minore (71%). L’Aurora-C è stata individuata unicamente nei mammiferi, in cui viene espressa ad elevati livelli nel testicolo, mentre in altri tipi cellulari, come i fibroblasti, la sua espressione è molto minore di quella di Aurora-B. Sembra che
29
sia implicata nel passaggio ribosomiale e che leghi direttamente la proteina INCENP e la survivina in vitro. Come l’Aurora B quindi può complessarsi con la proteina INCENP e recenti studi hanno mostrato che l’Aurora-C è in grado di associarsi con l’Aurora-B, la INCENP e la survivina a formare dei complessi in grado di fosforilare l’istone H3, contribuendo quindi alla regolazione della segregazione cromosomica e alla citocinesi. Inoltre pare che l’Aurora-C funzionante sia in grado di riportare alla normalità il fenotipo multinucleato causato dal silenziamento di Aurora-B, ciò indica che la sua funzione si sovrappone e completa quella di Aurora-B durante la mitosi.[31]
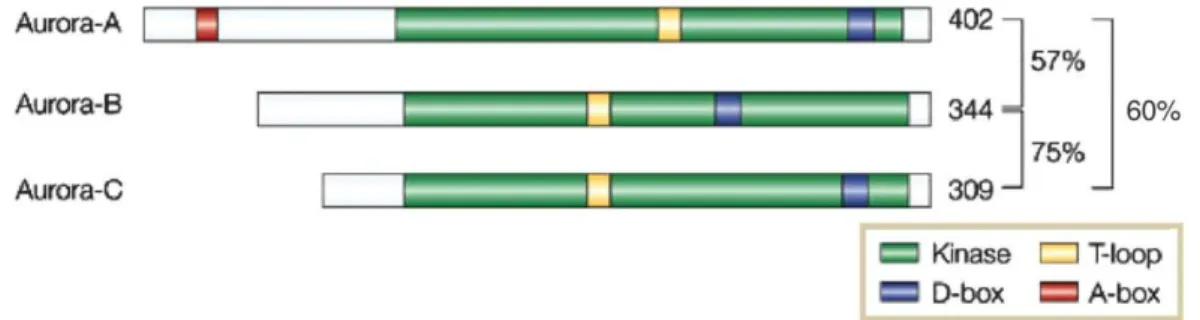
Dal punto di vista strutturale le tre Chinasi Aurora mostrano:
regione N-terminale: coinvolta sia nella localizzazione cellulare sia nel
legame con il substrato. Questa porzione è poco conservata tra le proteine della famiglia ed è responsabile delle differenze nella localizzazione e nelle specificità di substrato. Rappresenta il dominio regolatorio poiché contiene il motivo KEN, che agisce come sito di riconoscimento per il complesso APC/C, e il motivo A-box (motivo attivante D-box), coinvolto nella degradazione della proteina. Questi due motivi sono presenti solo in Aurora-A e B;
regione protein chinasica: mostra più del 70% di omologia fra le 3 chinasi
e contiene il dominio catalitico, che come nelle altre serin-treonin-chinasi è composto da un lobo N-terminale, responsabile dell’interazione con l’ATP e C-terminale, che lega i substrati;
Il dominio C-terminale, comprende il motivo D-box (destruction box), che
viene riconosciuto dal complesso APC/C, il quale induce la degradazione della proteina attraverso il proteosoma.[30]
30
Figura 1.10: Rappresentazione schematica della struttura delle Aurora chinasi.
Le Aurora chinasi sono sovraespresse in numerosi di tumori solidi, tra cui quelli di colon, mammella, prostata, pancreas, tiroide, testa e collo. Inoltre , si è scoperto recentemente che Aurora A e B sono sovraespressi anche in neoplasie ematologiche compresa leucemia mieloide acuta (AML), leucemia mieloide cronica (CML), e la leucemia linfoblastica acuta (ALL).
Nel caso specifico della tiroide, è apparso che si ha un aumento dell’espressione di Aurora-B nelle cellule tumorali e che l’inibizione di essa determina una sensibile diminuzione della proliferazione delle cellule anaplastiche ed una crescita più lenta del tumore.[32]
In seguito è stato anche dimostrato che l’Aurora-A è tra le proteine maggiormente espresse nel carcinoma tiroideo anaplastico.[33]
Da qui l’idea di sviluppare molecole che abbiano come target molecolare le Aurora chinasi, in particolare per i carcinomi tiroidei scarsamente differenziati o indifferenziati, resistenti a molti degli agenti chemioterapici attualmente in uso.
32
2. Introduzione alla parte sperimentale
Il lavoro oggetto di questa tesi di laurea è volto allo sviluppo di molecole a nucleo pirazolo[3,4-d]pirimidinico variamente sostituito, come potenziali inibitori chinasici, sfruttabili per il trattamento di varie forme di carcinoma tiroideo. Ad oggi, il trattamento di scelta per le diverse forme di tumore alla tiroide è la tiroidectomia totale, eventualmente associata a radioterapia esterna. Tuttavia, si ha comparsa di recidive e la malattia può ripresentarsi con metastasi locali e a distanza, spesso associata ad una marcata resistenza alle terapie tradizionali. Per questo motivo l’attenzione si è rivolta verso nuove strategie terapeutiche. Recenti studi sulla patogenesi dei carcinomi tiroidei dimostrano chiaramente che alterazioni genetiche di specifiche proteine chinasi sostengono lo sviluppo e/o la progressione tumorale, individuando così queste proteine come nuovi e promettenti target.
Mutazioni del recettore tirosina chinasi RET sono state riscontrate in circa il 98% dei casi di carcinoma midollare della tiroide (MTC) ereditario e nel 30-50% dei casi di MTC sporadici. Riarrangiamenti RET sono invece la più comune anomalia genetica nel carcinoma papillare della tiroide (PTC). Inoltre, i recettori EGFR e VEGFR sono risultati essere implicati nel mantenimento del tumore tiroideo, evidenziando come l’angiogenesi sia un fattore importante nella crescita tumorale.[34]
Sono stati valutati diversi approcci per l’inibizione di queste proteine chinasi, il più significativo consiste nell’utilizzo di molecole, che vadano a competere con l’ATP per il legame al sito catalitico. Tra queste ricordiamo sorafenib o sunitinib, già approvate in tutto il mondo per il trattamento di altri tipi di tumore, o nuovi derivati come ponatinib o axitinib, in fase di studio clinico per TCs. Ad oggi, gli inibitori tirosin chinasici approvati dalla FDA per il trattamento di MTC avanzato e metastatico sono vandetanib e cabozantinib.
33 Vandetanib Sorafenib Sunitinib Ponatinib Axitinib Cabozantinib
Tabella 2.1: Esempi di inibitori tirosin chinasici.
Tutti questi derivati sono composti multitarget, possono quindi combinare una potente attività antiangiogenica, principalmente dovuta all’inibizione di VEGFR2, con proprietà inibitorie verso altre proteine chinasi. Tuttavia, la loro efficacia è spesso associata a grave tossicità, tra cui osteonecrosi, emorragie fatali,
34
ipertensione, prolungamento dell'intervallo QT e problemi respiratori. Inoltre, per quanto riguarda vandetanib, è stata riscontrata resistenza, imputabile a mutazioni puntiformi delle proteine bersaglio, ciò limita fortemente il suo utilizzo come agente terapeutico. Di conseguenza, la ricerca si è portata verso lo sviluppo di nuovi inibitori delle tirosina chinasi sicuri ed efficaci nel trattamento di questa tipologia di tumore.
Il gruppo di ricerca presso il quale ho svolto il mio progetto di tesi da tempo si occupa della sintesi di nuovi inibitori della tirosina chinasi, sviluppati come potenziali farmaci per il trattamento di TC. In particolare, l’attenzione è stata rivolta verso derivati aventi come nucleo centrale lo scaffold
pirazolo[3,4-d]pirimidinico, eterociclo privilegiato nello sviluppo di inibitori chinasici
competitivi per il sito di legame dell’ATP vista la sua analogia strutturale con il nucleo adeninico del mediatore endogeno. Sulla base di queste osservazioni è stato sintetizzato il derivato (R)-1-fenetil-N-(1-feniletil)-1H-pirazolo
[3,4-d]pirimidin-4-ammina (CLM3), che combina un eccellente efficacia
antiangiogenica con una discreta attività inibitoria verso linee cellulari di cancro della tiroide. In particolare, questo composto ha mostrato attività antiproliferativa e proapoptotica su linee cellulari specifiche, HUVEC e 8305C, tempo e dose-dipendenti.[35,36]
35
Da studi in vitro risulta inoltre che CLM3 è in grado di inibire la proliferazione di linee cellulari ottenute da tessuti tumorali di pazienti affetti da carcinoma papillare dedifferenziato della tiroide (DePTC), incrementando fenomeni apoptotici e inibendo la migrazione cellulare in maniera dose-dipendente. Saggiato in modelli animali di DePTC e ATC, CLM3 ha inibito la crescita della massa tumorale senza determinare effetti tossici apprezzabili.
Figura 2.2: Inibizione della proliferazione di linee cellulari tumorali da parte di CLM3 tempo e dose dipendente 0.01 1 100 10000 1000000 0 50 100 150 8305C IC50=9.20 5.06M A549 IC50= 4.70 1.80M TT IC50=26.93 7.6M HMVEC-d IC50=0.40 0.22 nM * * * * * * * * * * * * * * * * * * * * * *P<0.05 CLM3 [M] 72h % o f c e ll p ro li fe ra ti o n
B
36
Figura 2.3: a) Inibizione significativa della crescita tumorale nel gruppo di animali trattati con CLM3, rispetto ai controlli; b) Gli animali trattati con CLM3 non hanno mostrato tossicità apprezzabili, come dimostrato dai loro pesi.
Rappresenta quindi il “lead compound”ideale per lo sviluppo di nuovi analoghi più attivi ed efficaci.
Sono state ipotizzate quindi due modifiche strutturali, una sull’azoto in posizione 1 e l’altra in posizione 4, basate su studi di modellistica di CLM3 nel sito catalitico delle proteine target, RET e VEGFR-2.
Nel caso di VEGFR2, CLM3 si posiziona nel sito catalitico, in modo che l’azoto in 2 dell’anello pirazolo pirimidinico stabilisca un legame H con il residuo cisteinico C919, che la porzione feniletanamminca sia circondata dai residui V848, K868, A866, L889, L1035 e V916 e che il gruppo feniletilico instauri interazioni idrofobiche con L840 e F918. La sostituzione in 4 del nucleo eterociclico non è però abbastanza lunga da raggiungere il dominio regolatorio juxtamembranale, ciò preclude le interazioni con i residui E885 e D1046, spesso instaurate dagli inibitori di VEGFR2 riportati in letteratura, come il sorafenib. Questa osservazione è importante al fine di migliorare l’attività inibitoria verso VEGFR2, apportando modifiche strutturali in posizione 4.
37
Figura 2.2: Interazioni della molecola CLM3 all’interno del sito attivo di VEGFR-2.
Per quanto riguarda invece il legame nel sito dell’ATP della proteina chinasi RET, è stato evidenziato che l'atomo di azoto in 5 dell'anello pirazolopirimidinico stabilisce un legame ad idrogeno con l’amminoacido A807, il nucleo centrale è circondato dai residui A756, V738, e L881, mentre la porzione feniletilica occupa il lobo N-terminale del dominio catalitico, stabilendo così interazioni idrofobiche con le catene laterali di V804, L802, I788, L779 e K758. La porzione feniletanamminica è piuttosto esposta al solvente e questo potrebbe spiegare la minore attività di CLM3 verso RET.
38
Partendo quindi dall’analisi strutturale della molecola CLM3 e tenendo presenti gli studi preliminari di docking eseguiti sulle proteine bersaglio, sono stati sintetizzati nuovi inibitori tirosin chinasici. Lasciando intatto il core pirazolopirimidinico, essenziale per l’attività, sono state introdotte variazioni a livello dell’azoto esociclico in posizione 4, con sostituenti arilammidici e arilureidici.
Rispetto a CLM3, questi nuovi composti formano un ulteriore legame ad idrogeno con il sito catalitico della proteina chinasi, ciò determina un aumento dell’attività inibitoria, soprattutto nei confronti della proteina chinasi RET.[34]
Composto X R IC50, a μM VEGFR2 IC50, a μM RET 8b 8c 9e CO C6H4-4-Br C6H4-4-F C6H4-4-OCH3 3.48 5.37 2.66 4.26 9.64 24.1 9a 9b 9c CONH C6H5 C6H4-4-Br C6H4-4-F 2.16 3.40 3.17 7.04 9.07 4.80
39
Figura 2.4:Interazioni di legame di 8b (a)e 9c (b) nel sito attivo di RET.
Quindi, dall’analisi delle attività di questi composti si è pensato di andare a sviluppare nuovi derivati, che mantengano la vantaggiosa sostituzione in 4 e che presentino una semplificazione strutturale a livello dell’azoto in posizione 1, visto che le interazioni idrofobiche che instaura la porzione feniletilica non sembrano essere fondamentali ai fini dell’attività. Lo scopo è quello di andare a valutare se l’introduzione di un gruppo meno ingombrante in questa posizione comporti un aumento dell’attività nei confronti delle proteine target, RET e VEGFR-2, ed eventualmente aggiunga una ulteriore attività di inibizione nei confronti delle chinasi Aurora, ugualmente coinvolte nell’eziopatogenesi dei tumori tiroidei.
N N N N R' HN H N X R X: CO;CONH. R: C6H5; C6H4-p-F; C6H4-p-CF3; C6H4-m,p-diOCH3; C6H4-p-Br R’: H, CH3
40
La via sintetica prevede la preparazione degli intermedi chiave 1H-pirazolo[3,4-d]pirimidin-4-ammina 7a e N-(3-amminobenzil)-1-metil-1H-pirazolo[3,4-d]pirimidin-4-ammina 7b, rispettivamente, che dovranno poi essere funzionalizzati.
H N NH2 + EtO H CN CN N N NC H2N R' HCOOH HN N N N O R' N N N N Cl R' N N N N HN R' NO2 NH2 . HCl Et3N NO2 N N N N HN R' NH2 H2 / Pd-C 1 2 3 4 a-b 5 a-b 6 a-b 7 a-b POCl3
Il primo passaggio di questa sintesi consiste nella formazione del derivato pirazolico 3, a partire da metilidrazina 1 e 2-(etossimetilene)malononitrile 2, entrambi prodotti commerciali, usando come solvente etanolo.[37]
H N NH2 + EtO H CN CN N N NC H2N HCOOH HN N N N O 1 3 4 b EtOH 2 R’=CH3 R’=CH3, H R’=CH3, H R’=CH3, H R’=CH3, H
41
Il composto 3 viene quindi messo a reagire con un eccesso di acido formico per ottenere il derivato pirazolopirimidinico 4b.
La formazione del cloroderivato 5a viene realizzata a partire dall’allopurinolo commerciale 4a. Questo passaggio si è rivelato particolarmente problematico, a causa dell’elevata instabilità del prodotto di reazione.
Inizialmente si è deciso di condurre la reazione per via classica, utilizzando il complesso di Vilsmeier, ottenuto a partire da POCl3 e DMF. La reazione giungeva
a completezza, ma non appena veniva trattata si aveva la degradazione del cloro-derivato ritornando al prodotto di partenza.
HN N N H N O POCl3 N N N H N Cl 4 a 5 a DMF/CH2Cl2
Si è allora pensato di ottenere il composto 5a facendo reagire l’allopurinolo con diclorofenilfosfina ossido, anche in questo caso la reazione avveniva completamente, ma in seguito all’aggiunta di una soluzione di idrossido d’ammonio e al lavaggio del solido ottenuto con acqua, è stato recuperato esclusivamente il reagente di partenza.
HN N N H N O N N N H N Cl 4 a 5 a 2. NH4OH 1. C6H5Cl2OP
Infine, si è fatto reagire il prodotto 4a con POCl3 e diisopropiletilammina in
toluene e successivamente, dopo aver evaporato il solvente a pressioni ridotte, è addizionata una soluzione di K2HPO4 2 M. La procedura riportata in letteratura
prevede che a questo punto si lasci la soluzione sotto agitazione tutta la notte a temperatura ambiente e si filtri sotto vuoto il precipitato ottenuto.
42
Successivamente con etile acetato si estrae la soluzione acquosa, in modo da recuperare anche la quantità di prodotto solubilizzata in acqua ed incrementare così la resa. In questo modo però si assisteva nuovamente alla degradazione a reagente di partenza. Abbiamo pensato quindi di filtrare immediatamente la soluzione dopo l’aggiunta di K2HPO4, ottenendo il cloroderivato 5a come
precipitato, che non è soggetto a degradazione dovuta ad un lungo trattamento.[38] Il composto viene poi seccato e prontamente utilizzato nella reazione successiva, data l’elevata instabilità.
HN N N N O R' 1. POCl3, EtN(i-Pr)2/ toluene N N N N Cl R' 4 5 a-b 2.K2HPO4 2M
Allo stesso modo è stato quindi sintetizzato il composto 5b.
A questo punto i derivati 5a-b vengono messi a reagire al microonde con m-nitrobenzilammina, utilizzando trietilammina come base e toluene come solvente, in modo da convertirli nei prodotti 6a-b.
Successivamente si riduce il gruppo nitro in posizione meta, utilizzando palladio su carbone come catalizzatore, ottenendo gli amminoderivati 7a-b. Per quanto riguarda il composto 7a, al termine della reazione si recupera poco prodotto, a causa della formazione nuovamente di allopurinolo. Sono state provate altre vie per l’ottenimento del composto 7a: in un caso è stato fatto reagire il nitroderivato con idrazina, cloruro ferrico esaidrato e carbone, in un altro con cloruro stannoso. In entrambi i casi però veniva recuperato esclusivamente allopurinolo, per questo è stata scelta l’idrogenazione catalitica, pur con rese molto basse (9%).
43 N N N N Cl R' N N N N HN R' NO2 NH2 . HCl Et3N NO2 N N N N HN R' NH2 H2 / Pd-C 5a-b 6a-b 7a-b
Si è passati poi alla funzionalizzazione di questi ultimi, ma il composto 7a è risultato essere molto poco reattivo, con formazione di svariati sottoprodotti di reazione difficili da isolare e quindi da caratterizzare. Dapprima è stato fatto reagire al microonde con l’opportuno isocianato in toluene, dopo controllo con TLC sono risultate numerose macchie, la reazione è stata comunque trattata, ma anche dopo aver provato a cristallizzare il precipitato ottenuto non è stato possibile isolare l’eventuale urea formatasi. È stato pensato quindi di far reagire l’amminoderivato per via classica, solubilizzandolo in THF anidro ed aggiungendo poi l’isocianato. La reazione è lasciata refluire, ma al termine ottengo anche in questo caso numerosi prodotti, che non riesco a separare. Il derivato 7b è stato invece variamente funzionalizzato al fine di ottenere i derivati arilammidico 8 e arilureidici 9a-d. N N N N HN R' NH2 RNCO N N N N HN H N HN O R 7 b 9 a-d 8 Cl O Br N N N N HN H N O Br a: C6H5 b: C6H4-p-F c: C6H4-p-CF3 d: C6H4-m,p-diOCH3
44
La reazione di formazione del composto 8 si ha per trattamento con p-bromo benzoilcloruro in toluene anidro, usando come base trietilammina e come catalizzatore nucleofilo DMAP. Al termine, il solvente viene allontanato e si aggiunge ghiaccio,per poi filtrare il precipitato ottenuto.
N N N N HN NH2 7 b 8 Cl O Br N N N N HN H N O Br Et3N Toluene DMAP
I derivati 9a-d sono stati ottenuti addizionando 7 degli oppurtuni isocianati, utilizzando toluene come solvente e lasciando reagire a microonde. A reazione avvenuta i prodotti sono recuperati per filtrazione, purificati per cristallizzazione da opportuno solvente e caratterizzati mediante dati chimico-fisici e spettroscopici. N N N N HN NH2 RNCO N N N N HN H N HN O R 7 b 9 a-d Toluene a: C6H5 b: C6H4-p-F c: C6H4-p-CF3 d: C6H4-m,p-diOCH3
Tutti i prodotti sintetizzati, 6a-b, 7a-b e 9a-d, sono al momento oggetto di valutazione biologica. Lo studio, condotto presso i laboratori di Medicina Clinica
45
e Sperimentale dell’Università di Pisa utilizzando quattro diverse linee cellulari umane derivate da carcinoma anaplastico della tiroide (CAL-62, 8305C, 8505C E BHT-101), ha lo scopo di verificare l’efficacia delle modifiche strutturali proposte rispetto al composto lead di partenza, CLM3, ed ai composti analoghi precedentemente sintetizzati, 8b-c,e e 9a-c.
I dati preliminari di cui disponiamo attualmente, illustrati nella figura che segue, rivelano che sia il derivato benzamidico 8 (AK89) che il composto ureidico 9b (AK88) mantengono inalterate le proprietà antiproliferative mostrate dai derivati pirazolopirimidinici sintetizzati in precedenza.
Una valutazione funzionale completa di tutti i prodotti sintetizzati, realizzata non solo sulle linee cellulari selezionate ma anche sulle proteine target isolate, VEGFR2, RET ed Aurora Chinasi, consentirà di analizzare i rapporti struttura-attività di questa classe di composti, consentendo lo sviluppo di analoghi strutturali ancora più attivi ed efficaci.
Figura 2.5: Profilo di attività dei composti 8 e 9b su quattro diverse linee cellulari umane derivate da carcinoma anaplastico della tiroide (CAL-62, 8305C, 8505C E BHT-101).
45
3. Parte sperimentale
I composti ottenuti sono stati caratterizzati mediante metodi chimico-fisici e spettroscopici.
I punti di fusione sono stati rilevati con un apparecchio di Reichert Köfler, ma non sempre sono corretti.
Gli spettri di risonanza magnetica di protone (1H-NMR) sono stati eseguiti in soluzione di dimetilsolfossido esa-deuterato (DMSO-d6) con uno spettrometro Bruker Ultrashield 400 (400 MHz). La presenza di protoni scambiabili è stata confermata mediante l’uso di D2O.
Le cromatografie analitiche su strato sottile (TLC) sono state eseguite su fogli di alluminio rivestiti di silice (MERCK 60, F-254, spessore 0,2 mm).
Le cromatografie su colonna sono state effettuate usando un apparecchio “Flashmaster Biotage” e colonne preimpaccate Biotage.
Le reazioni condotte a microonde sono state realizzate usando uno strumento dedicato CEM discover.
Per le idrogenazioni è stato usato l’idrogenatore CLAIND-Hydrogen Generator 2200.