I
NTRODUZIONE1.1 – Formazioni commissurali interemisferiche
Si definiscono formazioni commissurali interemisferiche quelle strutture cerebrali, impari e mediali, costituite da fasci di fibre assonali mielinizzate che interconnettono territori – perlopiù omologhi – dei due emisferi telencefalici (Hellige, 1993).
Costituiscono dunque parte cospicua della sostanza bianca telencefalica, e si portano a cavallo della scissura mediana.
Fra tali strutture si annoverano il corpo calloso, il setto pellucido, il fornice e la commessura anteriore. Possono inoltre essere incluse, sebbene non appartenenti alla sostanza bianca del telencefalo, la commessura abenulare e la commessura posteriore, di pertinenza epitalamica.
Tutte interconnettono morfologicamente, funzionalmente e sempre in senso biunivoco, parti superficiali o profonde dei due emisferi cerebrali.
Le loro agenesie si manifestano spesso in concomitanza di altre importanti alterazioni morfologiche (spina bifida, idrocefalo) in cui costituiscono parte rilevante del quadro clinico.
1.1.1 – Anatomia del Corpo Calloso
La commessura del corpo calloso è costituita da un robusto fascio di fibre assonali (200 – 800 milioni nell’uomo; Banich, 1995a) raccolte in una lamina approfondata nella scissura interemisferica (figura 1.1). Ha decorso sagittale con le estremità rostrali e caudali incurvate verso il basso. Le fibre vi decorrono trasversalmente, tese fra i due emisferi. Descrivendole in direzione anteroposteriore, si individuano le seguenti porzioni:
- il rostro, strutturalmente un cappio che circonda la commessura anteriore; - il ginocchio (genu) che segue il limite inferiore del lobo frontale curvandosi dolcemente;
- il tronco, porzione più cospicua e centrale del fascio, quasi lineare;
- lo splenio, limite caudale, dove la consistenza del fascio aumenta determinando un rigonfiamento piuttosto spesso, poggiato sulla lamina quadrigemina del mesencefalo.
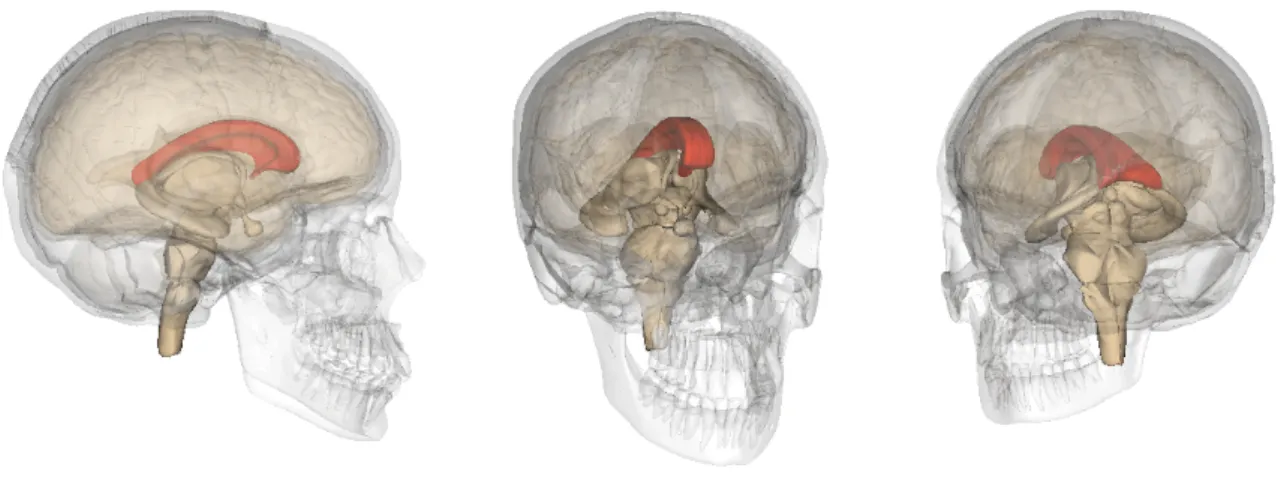
Fig. 1.1: formazione callosale in un encefalo umano. Le tre ricostruzioni
mostrano, evidenziata in rosso, la formazione callosale collocata nella sua sede anatomica in un encefalo umano.
L’immagine di sinistra è una visione laterale, e vi si scorgono le estremità uncinate e i 4 territori descritti, in senso rostro-caudale, del rostro, ginocchio, tronco e splenio. Le ricostruzioni del centro e di destra mostrano la struttura da angolazioni intermedie rispetto agli assi, che consentono di traguardare la porzione rostrale e splenica rispettivamente.
Immagini modificate da Anatomography (Life Science Databases – SDB).
La superficie superiore (dorsale) convessa, si estende in superficie fin quasi a toccare il limite inferiore della grande falce cerebrale (setto foderato di dura madre che separa i due emisferi), ed è ricoperta da uno straterello di sostanza grigia, l’induseum griseum, che costituisce una lamina dell’ippocampo dorsale.
Tale superficie è priva di asperità, ma presenta una cresta mediana, detta rafe, che si intervalla a due solchi, le strie longitudinali mediali, che decorrono parallele per tutta l’estensione della struttura. Due strie longitudinali mediali, a loro volta e con decorrenza analoga, delimitano la superficie laterale.
Il corpo calloso è separato dalla circonvoluzione omonima del lobo limbico da un solco che ospita l’arteria del corpo calloso.
La superficie inferiore (ventrale) è invece concava, e vi si innesta anteriormente il setto pellucido. Posteriormente, è in prossimità con le estremità (gambe) del fornice. La struttura complessiva della commessura è tuttavia più complessa, poiché non si limita alla macrostruttura laminare descritta fin ora.
Le fibre, infatti, si irradiano a raggiungere capillarmente le varie regioni della corteccia telencefalica, ammassandosi solo in corrispondenza della porzione visibile per valicare il punto medio, crociarsi e passare nell’emisfero controlaterale.
Tale radiazione, detta radiazione callosa (figura 1.2), assume un decorso complessivo caratteristico, dando luogo a due formazioni ad arco denominate forceps minor (anteriormente) e forceps maior (posteriormente).
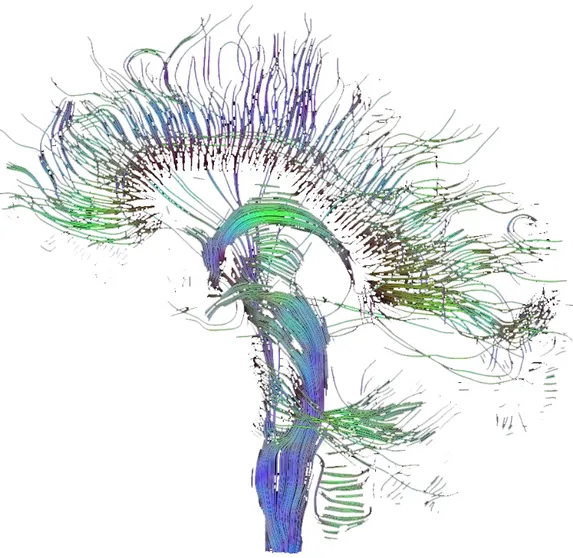
Fig. 1.2: radiazione callosa. L’immagine, ottenuta dall’elaborazione di dati DTI
(Diffusion Tensor Imaging, Mueller et al., 2007) in grado di rilevare il decorso di fibre di sostanza bianca, mostra gli archi anteriori e posteriori della radiazione callosa. È presente anche il decorso delle fibre nel tronco encefalico e nel cervelletto, inferiormente.
Le fibre che costituiscono il corpo calloso possono essere suddivise in 4 gruppi principali, differenziati in base alla posizione nella commessura e ai territori di innervazione:
- fibre superiori esterne, originano dalle porzioni posteriori dei lobi frontale e temporale, nonché estesamente da tutto il lobo parietale;
- fibre superiori interne, originano da formazioni situate nella faccia mediale dei lobi frontale (circonvoluzione frontale interna, lobulo precentrale, circonvoluzione precentrale), e limbico (giro del cingolo);
- fibre medie, originano dai lobi frontale (circonvoluzione frontale media, porzione mediana della circonvoluzione precentrale) e parietale (circonvoluzione parietale inferiore, porzione mediana della circonvoluzione postcentrale);
- fibre inferiori, originano dal lobo dell'insula (opercolo silviano) e in parte dal lobo temporale.
Per concludere, le fibre del ginocchio originano dalle porzioni anteriori ed orbitarie dei due lobi frontali e quelle che passano per lo splenio si dipartono da formazioni temporali (circonvoluzione temporale media), limbiche (giro del cingolo) e, soprattutto, parietali ed occipitali.
Le fibre, in generale, possono essere di tipo a largo diametro (mediano informazioni sensori-motorie) e di piccolo diametro (più numerose, connettono aree associative). La velocità di conduzione richiesta per ciascuna funzione giustifica il calibro.
Il corpo calloso è una formazione filogeneticamente recente, associata alla comparsa del neopallio: animali evoluti da radiazioni molto precoci nella deriva dei mammiferi, come i monotremi ed i marsupiali, non sono provvisti di corpo calloso.
Lesioni a questa formazione encefalica, in organismi che ne sono provvisti, provocano gravi deficit di coordinamento dei movimenti, dovuti al fatto che la parte destra e la parte sinistra del cervello non sono più in grado di comunicare e, quindi, di lavorare sinergicamente.
1.1.2 – Corpo calloso: embriologia
Fibre commessurali di natura callosale si ritrovano in embrioni umani a partire dalla decima/undicesima settimana di gestazione, e alla dodicesima/tredicesima settimana è visibile un rudimentale corpo calloso (Gilles et al., 1983). La struttura si espande prima caudalmente (polo splenico) e poi rostralmente (polo rostrale).
La mielinizzazione delle fibre callosali si completa relativamente tardi nello sviluppo dell’individuo, dato che il processo si ultima nella pubertà (Hellige, 1993). Anche la mielinizzazione segue lo stesso senso caudo-rostrale, in modo sfalsato di qualche anno rispetto alla genesi della struttura (Hynd et al., 1995).
1.1.3 – Corpo calloso: fisiologia e funzioni
Il corpo calloso interconnette aree omologhe telencefaliche, accoppiandone il funzionamento associativo e trasferendo informazioni di natura sensori-motoria (Bloom and Hynd, 2005).
È controversa tuttavia la natura inibitoria o eccitatoria delle vie callosali: per queste ragioni, la visione della struttura come funzionalmente omogenea è stata ormai accantonata, e si dà maggior credito ad una regionalizzazione delle funzioni.
Il gruppo di Banich (1995a) sostiene che differenti tipi di informazione siano veicolate attraverso sezioni differenti del corpo calloso, e che questo sia piuttosto da considerare come un insieme di vie anatomiche aventi la capacità di agire indipendentemente e con funzioni diverse.
D’altra parte, è nota una certa varietà anatomica nella struttura e nella regionalizzazione delle fibre e ciò, se la funzione segue la forma, porta all’assunzione che tale varietà ne rifletta una parimenti assortita di funzioni diverse (Chiarello, 1995).
Fra le prime evidenze sui processi mediati dal calloso, si annoverano gli esperimenti di Sperry (Sperry et al., 1979) su pazienti commessurectomizzati.
Nei soggetti di Sperry, con gli emisferi chirurgicamente separati per ragioni terapeutiche, si osservano comportamenti anomali che chiariscono i processi di interazione interemisferica e l’integrazione tra le funzioni visive e altre funzioni, come il linguaggio. La situazione sperimentale prevede la proiezione di immagini su uno schermo davanti all’osservatore, che il paziente deve puntare, presentate nell’emicampo visivo destro o nel sinistro in maniera casuale. Se l’immagine è proiettata nell’emicampo destro, l’informazione è processata nell’emisfero cerebrale sinistro ove risiede anche l’area del linguaggio e il contenuto dell’immagine stessa può essere pronunciato. Se l’immagine, invece, è presentata nell’emicampo sinistro e processata quindi nell’emisfero destro, il riconoscimento verbale non è possibile: la trasmissione delle informazioni alla corteccia controlaterale non avviene, e le aree del linguaggio non possono essere coinvolte.
In soggetti normali gli stessi esperimenti sono utili allo studio dei tempi di reazione. Fra la proiezione di immagini nell’emicampo sinistro e il loro riconoscimento verbale passa un tempuscolo (10-20 ms) superiore rispetto a quelle proiettate nell’emicampo destro: il tempo necessario per il transito delle informazioni attraverso le fibre commessurali. È interessante notare come questa situazione si inverta nel caso di immagini di volti, normalmente riconosciuti nell’emisfero destro e non nel sinistro: in questo caso il tempo necessario per la pronuncia verbale è inferiore per immagini proiettate nell’emicampo visivo di sinistra.
Studi più recenti condotti da Gazzaniga e collaboratori (2005) su pazienti callosectomizzati, hanno evidenziato come gli aspetti cognitivi di relazione fra causa ed effetto riguardino aree delle cortecce di entrambi gli emisferi: in questi pazienti la percezione diretta delle cause di un fenomeno e la speculazione sulle possibili cause del fenomeno stesso avvengono ciascuna in un emisfero, ed il corpo calloso consente normalmente di accoppiare i due processi (Roser et al., 2005).
Molti aspetti concernenti lo studio del corpo calloso riguardano l’asimmetria corticale: differenze macroscopiche sono state trovate in uomini e primati (persino in crani di antenati fossili, Corballis, 1983), e differenze microscopiche sono comprovate in molte strutture cerebrali (LeMay, 1984; Hellige, 1993; Galaburda, 1995; Buono, 1997) e si acuiscono nelle importanti aree di specializzazione funzionale del telencefalo, come le aree del linguaggio, della fonazione, della visione, dell’udito, ecc.
È stato notato che esiste anche una differenza di genere: nelle femmine umane, il corpo calloso ha dimensioni maggiori in relazione alla taglia corticale (Oka et al., 1999). Ciò è in parte giustificato dall’asimmetria nella regionalizzazione delle aree del linguaggio: negli individui di sesso maschile queste sono molto più asimmetriche – e quindi meno cooperative – rispetto a quelle degli individui di sesso femminile.
Dati derivanti da risonanze magnetiche funzionali (fMRI) mostrano attivazione unilaterale nei maschi e attivazione più bilaterale nelle femmine (Shaywitz et al., 1995). Tali differenze si riflettono nella struttura e nella funzione delle fibre commessurali che interconnettono le aree coinvolte.
Nel corso degli ultimi anni si sono accumulate una serie di prove a favore della natura prevalentemente eccitatoria o inibitoria delle fibre callosali.
Le teorie che propendono per la natura inibitoria, formulate – fra gli altri – da Cook (1984) e Kinsbourne (1975), suggeriscono che il corpo calloso consenta, nel corso dello sviluppo, l’asimmetria degli emisferi grazie all’azione inibitoria delle aree dominanti sulle controlaterali omologhe (Hellige, 1993; Lassonde, 1986).
A favore della natura eccitatoria, invece, giungono gli studi che indicano come il corpo calloso promuova lo sviluppo di aree non stimolate durante il consolidamento della regionalizzazione dell’encefalo, e che quindi rafforzi le integrazioni fra ciascuna emicorteccia (Galaburda, 1984; Galaburda and Geschwind, 1984; Lassonde, 1986; Lezak, 1995; Yazgan et al., 1995).
Inoltre, sono efficaci i casi di trattamento di forme epilettiche particolarmente severe, ricorrenti ed invalidanti con la callosotomia, laddove terapie farmacologiche risultino inadeguate o insufficienti.
A ulteriore conferma della natura eccitatoria giungono le evidenze che i cervelli più simmetrici presentano in genere interconnessioni callosali più marcate, suggerendo che un aumento dell’asimmetria sia la causa di una perdita di controllo eccitatorio sulle aree meno stimolate (Hopkins and Rilling, 2000; Preis et al., 2000).
La natura delle informazioni veicolate dalle fibre callosali è stata estesamente investigata in diverse specie animali, compresi primati non umani e cetacei.
Questi ultimi offrono un’opportunità di studio ulteriore del silenziamento interemisferico poiché sperimentano fasi di addormentamento parziale ove il cervello “dorme” con un emisfero per volta.
Dallo studio dell’asimmetria cerebrale nei delfini e altri cetacei ci si aspetterebbe che, se il corpo calloso veicolasse ingressi inibitori, dovrebbe essere più corposo per silenziare un intero emisfero. Si osserva il viceversa: in questi animali la commessura callosale è ridotta, lasciando trasparire una sua funzione eccitatoria (Marino, 1996).
Lo studio biochimico, nel caso della commessura callosale, risulta poco indicativo nel dirimere la questione poiché, se è vero che la quasi totalità delle fibre è neurochimicamente eccittatoria, non è detto che lo sia anche l’effetto fisiologico risultante (Yazgan et al., 1995).
Questo è lo stesso motivo per cui risulta poco dirimente lo studio dell’attivazione delle aree interconnesse dalla radiazione callosa con la tomografia a emissione di positroni (PET).
In conclusione, ci sono sicuramente più evidenze a favore della natura eccitatoria delle fibre callosali, nonostante sia accertato che l’inibizione occorra in certi fenomeni interemisferici.
1.2 – Le vie visive
L’evoluzione di strutture deputate alla raccolta e alla codifica di radiazioni elettromagnetiche provenienti dall’ambiente si è ripetuta diverse volte nel corso dell’evoluzione. Gli zoologi hanno individuato tali processi morfogenetici distinti, ma tutti conducono ad un numero minore di strutture morfologicamente e funzionalmente convergenti.
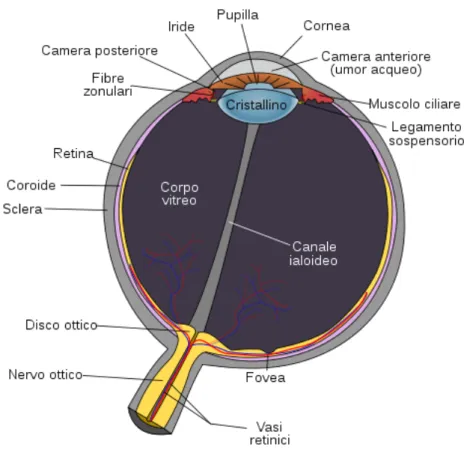
Fig. 1.3: struttura dell’occhio di mammifero. Lo schema illustra in maniera
esemplificata le componenti di un occhio a camera stenopeica provvisto una lente a indice di rifrazione variabile, tipico dei mammiferi. Da Rhcastilhos, 2007.
In particolare, la struttura dell’occhio nei mammiferi (figura 1.3) risulta estesamente conservata. Ciò che varia è la sensibilità a porzioni diverse dello spettro elettromagnetico, e l’acuità visiva. La trattazione riguarderà dunque l’occhio dei mammiferi.
La luce emessa o riflessa dagli oggetti è raccolta nella camera globulare del bulbo oculare attraverso un foro anteriore a diametro variabile (pupilla). È collimata e concentrata da una lente a geometria variabile (cristallino) che la fochetta su uno strato multilaminare fotosensibile (retina) che tappezza la superficie interna posteriore dell’occhio.
La retina, funzionalmente e morfologicamente un avamposto dell’encefalo, è una struttura complessa costituita da una sovrapposizione di strati di cellule nervose di vario tipo, interconnesse a vari livelli. Appartengono al tessuto, organizzate con precisa stratificazione, cellule bipolari, amacrine, orizzontali e ganglionari, oltre a quelle propriamente recettoriali.
Quelle deputate alla raccolta dei fotoni (coni e bastoncelli) sono curiosamente situate negli strati più lontani rispetto al verso di provenienza della luce. Questa disposizione consente tuttavia il costante rifornimento energetico dei dischi contenenti l’apparato biochimico per la fototrasduzione da parte dell’epitelio che riveste il fondo della camera oculare. In certe specie animali tipicamente notturne, roditori inclusi, un tapetum lucidum consente in questa sede la raccolta per riflessione di ulteriori fotoni sfuggiti al primo passaggio attraverso lo strato di recettori. Ciò aumenta la capacità di visione notturna, a scapito della definizione della visione degli oggetti.
La fototrasduzione consente l’accoppiamento fra il fenomeno fisico dell’emissione luminosa e quello elettrico, in grado di essere ritrasmesso ad elaborato dal cervello.
Le informazioni di natura elettrica così raccolte vengono elaborate dal tessuto retinico e convogliate nel nervo ottico, che abbandona l’occhio. L’elaborazione al livello retinico in certe specie di vertebrati (anfibi) è straordinariamente sofisticata, compensando in parte la relativa semplicità delle cortecce visive di questi animali.
Il nervo ottico di ciascun occhio è, in ogni sezione, topograficamente organizzato secondo la disposizione retinotopica e dunque vi si distingue una metà nasale e una temporale. Al livello del chiasma ottico avviene una parziale decussazione degli assoni del nervo ottico che riguarda solo le componenti nasali.
L’entità di tale decussazione varia a seconda delle specie, ed è del 50% nell’uomo, e del 90-95% nel ratto e nel topo.
In questi roditori, quindi, la parte più cospicua delle fibre provenienti dagli occhi si fa controlaterale.
Superato il chiasma, i tratti ottici si dirigono a due strutture deputate alla visione: il collicolo superiore (SC) e la parte dorsale del nucleo genicolato laterale (dLGN). Il genicolato, struttura talamica, è deputato alla ritrasmissione dei segnali alle cortecce visive, situate posteriormente nei lobi occipitali.
Nei primati è organizzato tipicamente in sei strati strettamente non sovrapposti, ciascuno dei quali riceve le afferenze di un solo occhio. Ancora a questo livello le informazioni provenienti da ciascun organo della visione sono segregate (Hickey and Guillery, 1974).
Le proiezioni delle fibre provenienti da questi strati giungono in corteccia visiva primaria (V1), situata caudalmente nel lobo occipitale.
Anche le cortecce visive adulte, in quanto neocortecce, sono organizzate in sei strati sovrapposti. La maggior parte delle afferenze talamiche proietta nello strato IV, e i neuroni ivi presenti ritrasmettono agli strati II e III, che sinaptano a loro volta in quelli V e VI. In tutti i primati, e negli altri mammiferi con attitudini carnivore predatorie, le afferenze talamiche raggiungono lo strato IV organizzate in aree contigue alternate, le colonne di dominanza oculare (LeVay et al., 1975). Colonne non contigue e omologhe comunicano fra loro mediante ponti orizzontali, che consentono l’integrazione su ampi territori di corteccia (Gilbert, 1992).
Hubel e Wiesel (1962), nel loro studio pionieristico delle classi di dominanza oculare, hanno effettuato registrazioni elettrofisiologiche in corteccia visiva individuando cellule che rispondono con intensità diversa a stimoli provenienti da ciascun occhio. Sulla base di questi dati hanno proposto la suddivisione delle cellule piramidali in 7 classi di dominanza, modus operandi poi tradizionalmente entrato nell’uso dell’attività sperimentale, per l’analisi di molti fenomeni diversi.
La scala prevede che le cellule di classe 1 siano monoculari, e rispondano agli stimoli provenienti dall’occhio controlaterale, quelle in classe 4 siano binoculari, e quelle in classe 7 siano responsive solo all’occhio ipsilaterale. Le classi 1-2 e 5-6 rappresentano le situazioni intermedie.
A vari livelli di integrazione, i due scienziati hanno isolato per primi singole cellule che rispondevano in maniera esclusiva a particolari caratteristiche dello stimolo visivo, passando dal riconoscimento di semplici caratteristiche degli oggetti, alla loro estensione, alle loro proprietà estensive (cellule semplici, complesse e ipercomplesse).
Studi successivi hanno corroborato le prime osservazioni, mostrando come i neuroni corticali (V1) rispondano in maniera selettiva a stimoli con particolari caratteristiche come orientamento, direzione, velocità di movimento, frequenza spaziale e temporale (Maffei and Fiorentini, 1973; Fregnac and Imbert, 1984).
A seguito di una prima elaborazione nella corteccia visiva primaria le informazioni passano nella corteccia visiva secondaria (V2), situata tutt’attorno.
In questa sede vengono conferiti all’informazione aspetti più attinenti alla visione che alla semplice percezione di stimoli, e l’ulteriore gradino nell’elaborazione è costituito dalle cortecce associative, che interconnettono, del resto, tutte le aree sensoriali.
1.2.1 – Le vie visive del ratto
Le nozioni fin qui esposte, riguardanti le vie visive dei primati e dei più evoluti mammiferi carnivori, valgono in generale anche per i ratti, modelli sperimentali dello studio oggetto di questa tesi.
Si tratta di roditori prettamente notturni con occhi posizionati piuttosto lateralmente sul capo, e un campo visivo binoculare relativamente ristretto. Ciò determina un crociamento piuttosto marcato delle fibre assonali, con una risultante esigua porzione di fibre che si mantengono omolaterali: il 3-5% in ratti normali e addirittura 1,5% in ratti albini (Ahmed et al., 1996; Dreher et al., 1985; Lund, 1965).
La maggior parte delle fibre del tratto ottico proiettano al collicolo superiore (SC), e solo il 40% sinapta nel nucleo genicolato laterale dorsale (dLGN).
Il quale, a sua volta, è privo della organizzazione citoarchitettonica laminare tipica di altri mammiferi: è costituito da un nucleo interno avente ingressi ipsilaterali, circondato da un’area competente agli gli stimoli controlaterali (Godement et al., 1984; Reese, 1988).
Un’organizzazione più semplice si ritrova anche nelle strutture corticali dell’area visiva primaria, non essendoci colonne di dominanza oculare; le fibre talmo-corticali sinaptano tutte nello strato IV ma non ci sono evidenze di marcate segregazioni fra le due vie ipsilaterale e controlaterale (Antonini et al., 1999).
Le proprietà fisiologiche proprie dei neuroni corticali sono immature al momento dell’apertura degli occhi dopo la nascita (P15), e si sviluppano gradualmente nel corso del primo mese.
Nello specifico, la selettività all’orientamento e alla direzione del movimento sono ancora assenti a P17, per svilupparsi e completarsi fino a P30 (Fagiolini et al., 1994). Anche la binocularità risulta immatura alla nascita, e una normale distribuzione delle classi di dominanza oculare non si riscontra che a partire da P30-P35 (Fagiolini et al., 1994).
È stato stimato che nel segmento laterale della V1, dov’è mappata la parte centrale del campo visivo, l’80% dei neuroni corticali è binoculare (Fagiolini et al., 1994; Caleo et al., 1999a; Caleo et al., 1999b; Di Cristo et al., 2001; Caleo et al., 2007).
Questa percentuale può sembrare alta considerando l’asimmetria cospicua degli ingressi talamici e una possibile spiegazione a tale fenomeno, è stato proposto, è ricercabile nell’attività del corpo calloso, che accoppierebbe retinotopicamente aree omologhe delle cortecce visive primarie dei due emisferi (Jacobson, 1970; Cusick and Lund, 1981; Mizuno et al., 2007).
1.3 – Corpo calloso e binocularità
Le connessioni callosali che interconnettono le vie visive maturano relativamente tardi nell’uomo, nel giro di un anno di vita nel gatto e a P15 nei roditori.
La rappresentazione corticale del campo visivo è separata dal meridiano verticale con gli emisferi destro e sinistro che processano, rispettivamente, l’emicampo di sinistra e di destra. E’ presente una zona di sovrapposizione centrale, la cui entità è specie-specifica, che assicura la visione binoculare. Nel corso dell’evoluzione, specie animali hanno sviluppato porzioni binoculari più o meno estese del loro campo visivo in risposta ai peculiari adattamenti cui sono andate incontro.
La visione binoculare, infatti, garantisce una percezione spaziale analitica con la valutazione precisa della posizione reciproca degli oggetti a scapito di una visione estesa di campo. Nei roditori, tale regione di sovrapposizione (campionata in entrambi gli emisferi) si estende per circa 10 gradi attorno al meridiano verticale.
La continuità e la sovrapposizione sono conferite in misura variabile dalle fibre interemisferiche che connettono le zone della corteccia visiva primaria dove è localizzata la rappresentazione del meridiano verticale centrale.
A questo proposito, studi anatomici ed elettrofisiologici condotti in modelli felini hanno indicato una densa rete di connessioni callosali lungo il bordo fra l’area 17 e 18 (Payne, 1994).
Neuroni situati in quell’area hanno campi recettoriali proprio in corrispondenza del meridiano verticale, incluse piccole porzioni del campo recettoriale dell’emicampo ipsilaterale: la zona di sovrapposizione dei due emicampi visivi (Blakemore et al., 1983; Payne, 1990; Payne and Siwek, 1991; Payne, 1994).
In quest’area, che rappresenta l’intorno del meridiano verticale, confluiscono massicciamente le afferenze callosali e genicolo-corticali (Berlucchi and Rizzolatti, 1968).
Nei roditori le proiezioni delle fibre callosali sembrano coinvolgere aree più estese della corteccia visiva rispetto ad altri mammiferi, gatto incluso (Olavarria and Van Sluyters, 1985; Lewis and Olavarria, 1995; Houzel and Milleret, 1999).
L’intera estensione mediolaterale della corteccia striata contiene cellule callosali, tuttavia le loro terminazioni nella corteccia controlaterale sembrano concentrate al bordo fra le aree V1 e V2 nel ratto e nel topo (Cusick and Lund, 1981; Mizuno et al., 2007; Olavarria and Van Sluyters, 1983).
A questo proposito, assoni callosali marcati con GFP in un emisfero (elettroporazione in utero del soma delle cellule callosali) confluiscono densamente in una regione ben delimitata, corrispondente proprio al bordo fra le aree 17 e 18 dell’emisfero controlaterale, dove terminano negli strati II-III e V (Mizuno et al., 2007, figura 1.4).
Un’altra cospicua proiezione di fibre callosali interconnette zone mediali dell’area 17 con aree che rappresentano zone periferiche del campo visivo (Houzel et al., 2002). Questo secondo genere di proiezioni sembrano coinvolte in processi di integrazione su larga scala, probabilmente consentendo di percepire fenomeni simmetrici nell’ambito dell’intero campo visivo.
Le connessioni callosali giocano altresì un ruolo cruciale in alcuni fenomeni che sono manifestazione della binocularità, come la percezione della profondità spaziale (Berardi et al., 1988).
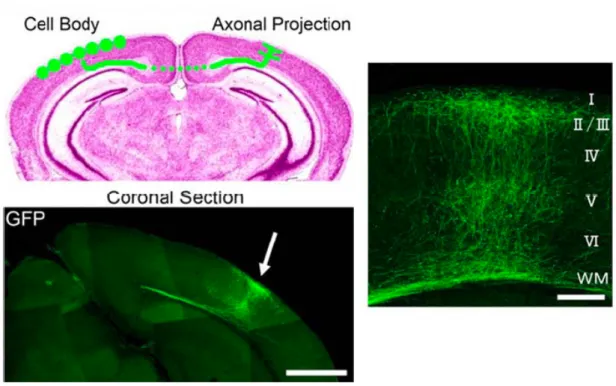
Fig. 1.4: fibre callosali confluenti al bordo V1 – V2. Le immagini a sinistra
mostrano la distribuzione delle connessioni interemisferiche nella corteccia visiva di ratto, evidenziate con la GFP. Si nota la loro confluenza in un territorio ristretto, evidenziato dalla freccia, corrispondente al bordo fra le aree 17 e 18. Il riferimento è di un millimetro.
L’immagine di sinistra mostra invece gli strati coinvolti da tale innervazione, rivelando che si tratta di quelli II-III e V. Il riferimento è di 200 micrometri.
Altre occorrenze mediate dal calloso ampiamente dimostrate sono l’estensione dei campi recettoriali oltre il meridiano verticale (Antonini et al., 1983), la fusione dei due emicampi visivi (Hubel and Wiesel, 1967), l’allineamento interoculare (Elberger, 1979) e lo sviluppo dell’acuità visiva (Elberger, 1985).
Per queste ragioni ci si aspetta che il corpo calloso influisca notevolmente sulla binocularità dei neuroni piramidali del bordo fra le aree 17 e 18, ed esperimenti di sezione chirurgica del chiasma ottico sono stati condotti per indagare tale contributo.
Una delle prime evidenze che il corpo calloso veicoli impulsi per la binocularità viene dagli esperimenti di Berlucchi e Rizzolatti del 1968. Essi trovarono che, effettivamente, alcuni neuroni nella zona del bordo 17/18 rimanevano binoculari anche a seguito del taglio medio-sagittale inferto al chiasma ottico e le informazioni a sostegno della binocularità, in quelle cellule e in quel preparato, non potevano che essere veicolate dal corpo calloso.
Altri studi riportano che, a seguito dell’interruzione chirurgica di un tratto ottico in modello di gatto, la corteccia ipsilaterale alla lesione poteva ancora essere attivata mediante stimolazione visiva, attraverso la commessura callosale (Choudhury et al., 1895; Vesbaesya et al., 1967). Tuttavia tale attivazione indiretta di una corteccia visiva deafferentata è modesta, come indicato da studi effettuati sempre sul gatto (Podell et al., 1984; Yinon et al., 1982).
Una dimostrazione diretta arriva dagli studi sulla callosectomia, che dimostrano come la rimozione delle afferenze callosali induca una riduzione del numero di cellule guidate dalle afferenze di entrambi gli occhi, con campi recettoriali semplici sia complessi (Payne et al., 1980, Yinon et al., 1992). L’interruzione delle fibre callosali induce quindi una riduzione della binocularità.
Parimenti, l’inibizione di una corteccia visiva mediante raffreddamento, con conseguente cessazione degli ingressi callosali da essa provenienti, causa nella corteccia controlaterale alla lesione una riduzione della binocularità (Blackmore et al., 1983).
Tutti questi dati sono però in contraddizione con gli esiti di altri studi (Minciacchi and Antonini, 1984; Elberger, 1985) che indicano come, in gatti adulti, la callosectomia non alteri sostanzialmente la binocularità.
Indizio importante per la comprensione dell’apparente contraddizione giunge dal lavoro di Elberger e Smith del 1985. È da questi riportato che la callosectomia esercita un effetto sulla variazione della binocularità solo se effettuata in un periodo finestra durante le prime fasi dello sviluppo dell’occhio. La lesione dunque ha effetto solo se precoce.
Le discrepanze sono quindi dirimibili tenendo conto degli aspetti tecnici dell’attività sperimentale, come l’epoca della lesione e il tempo trascorso fra questa e la misurazione della binocularità.
I riarrangiamenti e la plasticità del sistema nervoso, unitamente agli esiti cicatriziali e infiammatori che la lesione comporta, possono influire sulle registrazioni in vivo dell’attività neuronale.
Gli esperimenti fin qui riportati sono stati condotti in gatto, mammifero col sistema visivo assai affine a quello umano per la sua natura di carnivoro cacciatore. Ma risultati del tutto comparabili sono stati ottenuti, più tardivamente, in roditori, modelli oggi d’elezione per lo studio della plasticità neuronale.
Anche in questi modelli il ruolo delle connessioni callosali è riportato come controverso (Drager, 1975; Diao et al., 1983; Coleman et al., 2009). Infatti, studi elettrofisiologici di Diao e collaboratori hanno dimostrato l’influenza del corpo calloso nella distribuzione delle classi di dominanza oculare (OD; Coleman et al., 2009; Diao et al., 1983).
Tuttavia, studi anatomici indicano che la binocularità della corteccia visiva primaria (V1) del roditore possa essere determinata dalle sole fibre talamiche, visto che la componente controlaterale presenta un grado di convergenza più elevato sulle cellule del genicolato laterale (Coleman et al., 2009).
Scopo di questa tesi è di aggiungere un ulteriore tassello per la comprensione del fenomeno, indagando il ruolo del corpo calloso della binocularità.
1.4 – Le classi di dominanza oculare per lo studio della plasticità del sistema nervoso
Lo studio della variazione delle classi d dominanza oculare (OD) è un utile parametro per sondare la distribuzione della responsività delle cellule corticali agli stimoli provenienti da ciascun occhio.
D’altro canto, diversi fenomeni sono in grado di perturbare tale distribuzione, modificando la struttura e l’efficacia delle sinapsi che la determinano. Ne deriva che uno studio della dominanza oculare sia un classico paradigma per investigare la plasticità del sistema visivo e, più in generale, del sistema nervoso.
Il cambio repentino nella circuiteria della corteccia visiva primaria porta, infatti, ad uno sbilanciamento degli ingressi dai due occhi (Tropea et al., 2009).
I primi a studiare quantitativamente il fenomeno della dominanza oculare sono stati Hubel e Wiesel (1963), come già discusso, che hanno anche introdotto l’ormai consueto modello delle 7 classi.
Bloccando in gatti l’ingresso proveniente da un occhio mediante una sutura dei margini ciliari dopo rimozione delle rime ciliari (protocollo della deprivazione monoculare, MD), durante lo sviluppo, si determina una perdita delle risposte fisiologiche a quell’occhio e un importante aumento nel numero dei neuroni che rispondono preferenzialmente all’occhio rimasto aperto (Hubel and Wiesel, 1963; figura 1.5). La variazione della distribuzione delle classi di dominanza oculare è quindi da intendersi come riflesso del fenomeno della plasticità presente nei circuiti corticali, soprattutto nel periodo critico (CP).
Fig 1.5: spostamento delle classi di dominanza oculare a seguito della deprivazione monoculare (MD). L’istogramma di sinistra mostra la distribuzione normale
delle classi di dominanza in ratto, con un netto spostamento verso la classe 1. Le classi intermedie 2 e 3, 5 e 6 sono riunite a formare due sole classi.
L’istogramma di sinistra mostra la stessa distribuzione a seguito della deprivazione monoculare dell’occhio controlaterale effettuata suturando le palpebre durante il periodo critico. Si nota lo spostamento delle colonne a favore dell’occhio ipsilaterale, che in condizioni fisiologiche non ottiene risposte così marcate.
Di contro, tale capacità di riarrangiamento – e con essa la variazione delle classi di dominanza – in seguito a deprivazione monoculare, si modifica con l’età: comincia 5 – 10 giorni dopo l’apertura degli occhi, perdura per tutto il periodo critico, e finisce per declinare o scomparire nell’età adulta (Wiesel and Hubel, 1963; Fagiolini et al.,1994; Gordon and Stryker, 1996).
Tale fenomeno è stato osservato anche in altri mammiferi come primati e ratti (Horton and Hocking, 1997; Dräger, 1978; Maffei et al., 1992; Fagiolini et al., 1994) e la durata del periodo critico sembra correlata con la durata media della vita di ciascuna specie (periodo di maturazione del sistema visivo).
Per quanto riguarda i ratti, la loro corteccia visiva primaria non presenta colonne di dominanza oculare tipiche di gatti, primati e altri mammiferi carnivori. Né i territori competenti a ciascun occhio sono strettamente segregati nell’ambito dello strato IV della corteccia. Tuttavia gli esiti degli esperimenti sono i medesimi, e la deprivazione monoculare (MD) durante il periodo critico induce un consistente spostamento delle classi di dominanza oculare a favore dell’occhio non deprivato.
Sono stati investigati anche i cambiamenti anatomici che occorrono durante tali cambiamenti: si assiste ad un’espansione dei territori corticali guidati dall’occhio aperto, e una conseguente riduzione di quelli responsivi all’occhio deprivato (Katz and Shatz, 1996).
Ripercussioni analoghe si osservano a livelli più precoci nell’elaborazione delle informazioni sensoriali visive: i territori del corpo genicolato laterale dorsale (dLGN) innervati dall’occhio rimasto aperto si ipertrofizzano (del 10-15%) a discapito di quelli coinvolti dall’occhio deprivato, che si rinvengono atrofizzati (20-25%; Sherman and Spear, 1982; figura 1.6).
Fra le altre conseguenze della deprivazione monoculare si annoverano una diminuzione dell’acuità visiva da parte dell’occhio deprivato, e affezioni alla visione stereoscopica (Medini and Pizzorusso, 2008).
Fig. 1.6: cambiamenti nell’arborizzazione delle fibre genicolo-corticali.
L’immagine di sinistra mostra un’arborizzaione normale, quella a destra in caso di occhio deprivato nel periodo critico. Da Antonini e Stryker, 1993.
Le modificazioni a livello anatomico e funzionale si instaurano in tempi diversi dalla lesione: le prime, che riguardano l’arborizzazione talamocorticale, si ritrovano non prima di 4 giorni; le seconde, concernenti la variazione nelle classi di dominanza oculare, si riscontrano già al primo giorno (in generale, 1-3 giorni; Antonini and Stryker, 1993, 1996; Antonini et al., 1998).
1.5 – Il fenomeno della Rivalità Oculare
È esperienza comune che l’attività visiva fornisca, attraverso le immagini simili ma non identiche provenienti dai due occhi, una prospettiva unica e coerente degli oggetti e dell’ambiente. Tuttavia, vi sono delle condizioni, fisiologiche o patologiche, in cui la visione binoculare viene meno e le due immagini appaiono non sovrapposte (diplopia), percepite alternativamente (percezione multistabile), o una delle due viene soppressa (visione monoculare).
Situazioni fisiologiche e comuni di rivalità binoculare sono costituite dagli inganni prospettici di alcune figure ambigue (rese famose da Edgar Rubin nel 1915), di fronte alle quali individui umani sperimentano una competizione fra due percezioni diverse dello stesso oggetto non compatibili e pertanto non sovrapponibili. I soggeti sperimentano un’alternanza di decodifica dell’immagine.
Per lo studio sistematico del fenomeno dioptico, si presentano ai due occhi (con particolari occhiali) immagini che via via differiscono l’una dall’altra fino ad individuare il grado di diversità per cui la fusione binoculare viene meno.
Leopold e Logothetis hanno utilizzato dei reticoli di stimolazione a linee parallele, e riferiscono che la stereoscopia viene meno quando queste differiscono per un’inclinazione di 20-30° (Leopold and Logothetis, 1995, 1996). Lo stesso effetto si ottiene mostrando un’immagine complessa – ad esempio un volto – che viene privilegiata, ed una dal contenuto informativo minore, che viene elisa.
Un primo resoconto dettagliato sulla rivalità interoculare ci giunge dagli studi di Breese (1899, 1909), e studi successivi hanno apportato ulteriori dettagli promuovendo teorie sui possibili meccanismi alla base del processo e, soprattutto, sulla sede nelle vie visive in cui questi avvengono (Blake, 1989; O’Shea, 1983; Walker, 1978). In particolare, questi studi hanno determinato che la predilezione per una delle due immagini è casuale in riferimento al tipo di stimolo presentato ma spesso individuo-specifica, e soprattutto sembra aver sede nelle vie visive superiori (cortecce) e non nel talamo.
Altra condizione, questa volta patologica, importante per lo studio del fenomeno della rivalità oculare e, in definitiva, dei meccanismi della inibizione interoculare, è lo strabismo (cfr. paragrafo 5.2.2).
In individui strabici, la diplopia e la confusione sono evitate in due modi: mediante l’oscillazione del punto di fissazione, o grazie alla soppressione della visione di un occhio.
Nel primo caso, i pazienti sperimentano una visione alternata dall’uno o l’altro occhio che premia quello con la prospettiva migliore (contenuto informazionale ritenuto più utile) o quello dominante, a seconda della gravità del disallineamento (Siretenau and Fronius, 1981; Siretenau, 1982).
Nel secondo caso, si assiste ad una vera e propria cecità intenzionale di un occhio, il cui contributo alla visione è completamente soppresso.