Deposizione e caratterizzazione del sistema a
rilascio di farmaco
4.1 Sistemi a rilascio controllato di farmaco
Tra i fattori principali da prendere in considerazione durante la progettazione di un sistema a rilascio controllato, teoricamente di tipo impiantabile, vi è la biocompatibilità con l’organismo umano. Il materiale, infatti, deve essere chimicamente inerte, non cancerogeno, ipoallergenico e meccanicamente stabile presso il sito di impianto. Inoltre, il sistema non dovrebbe essere modificato chimicamente e fisicamente dal tessuto locale e non dovrebbe provocare alcuna reazione infiammatoria nel sito di impianto [32]. Se il requisito della biocompatibilità non viene soddisfatto, si possono presentare molti fenomeni indesiderati, quali l’incapsulamento dell’impianto, un rilascio inaspettato del farmaco, il danneggiamento del tessuto o un’infezione presso l’area circostante l’impianto [33].
Candidati preferenziali per la realizzazione di sistemi di rilascio sono i materiali polimerici, in quanto, data la loro versatilità, oltre alla biocompatibilità sono in grado di offrire varie caratteristiche importanti, quali l’inerzia chimica, l’assenza di impurità, un’appropriata struttura fisica e la processabilità in un’ampia varietà di forme [34]. Negli ultimi anni, il successo maggiore è stato riscosso da polimeri biodegradabili studiati inizialmente per applicazioni mediche. Si tratta di poliesteri alifatici sintetici, quali l’acido poliglicolico (PGA), l’acido polilattico (PLA) e i copolimeri polilattico-poliglicolico (PLGA). L’enorme vantaggio di questi polimeri è la loro biodegradabilità in vivo: all’interno del corpo umano essi vengono ridotti, mediante processi enzimatici o non enzimatici, in molecole biocompatibili e non tossiche, che sono facilmente smaltite attraverso le normali vie metaboliche.
I polimeri biodegradabili sono preferibili rispetto a quelli non biodegradabili in quanto non richiedono l’intervento chirurgico per la rimozione dell’impianto una volta che esso ha svolto la sua funzione, e scongiurano il rischio di problemi tossicologici, aumentando così il gradimento da parte dell’organismo ospite.
La ricerca sui polimeri naturali come matrici per i sistemi di rilascio controllato si è focalizzata sulle proteine, quali il collagene, la gelatina e l’albumina e sui polisaccaridi, come l’amido, la cellulosa, il destrano, il chitosano, l’acido ialuronico e l’acido alginico.
I polimeri naturali, svolgono un ruolo chiave nel rilascio controllato di farmaci e nel rilascio presso un sito bersaglio. I sistemi polimerici per il rilascio controllato si dividono in sistemi fisici e sistemi chimici [35].
Fra i primi si distinguono:
− i sistemi a riserva, dove un nucleo compatto di farmaco è circondato da una membrana polimerica permeabile, la cui proprietà di permeabilità controlla la diffusione del farmaco;
− i sistemi monolitici, nei quali il farmaco è disciolto o disperso, in maniera omogenea, all’interno di una matrice polimerica: la lenta diffusione del farmaco attraverso la matrice consente il rilascio controllato (Fig. 4.1).
Fig4.1 Principali tipologie di sistemi a rilascio controllato di farmaco
Tra i sistemi fisici vanno inoltre annoverati i dispositivi funzionanti a seguito di un gradiente di pressione ai lati di una membrana (pompe osmotiche).
Nei sistemi chimici il farmaco è legato chimicamente ad uno scheletro polimerico. I meccanismi attraverso i quali il principio attivo viene reso disponibile dal sistema a rilascio, sia esso di tipo fisico oppure di tipo chimico,
sono principalmente due: la diffusione del farmaco e la degradazione del polimero. Tali meccanismi possono agire separatamente o in concomitanza.
La diffusione si ha quando il farmaco passa attraverso il polimero che costituisce il sistema [36]. La diffusione può avvenire su scala macroscopica, attraverso i pori della matrice polimerica, o su scala microscopica, passando attraverso le catene di polimero.
Il meccanismo di diffusione è descritto dalla legge di Fick:
f
C
D
J
=
−
⋅
∇
(4.1)Dove J è il flusso, D il coefficiente di diffusione del farmaco attraverso la membrana polimerica e Cf la concentrazione del farmaco.
Integrando opportunamente questa funzione si ottengono, per i vari sistemi, equazioni che danno la quantità di sostanza rilasciata in funzione del tempo. In genere si ricava un andamento della quantità rilasciata di farmaco in funzione del tempo, del tipo:
) 1 ( ) (t qeq e kt q = ⋅ − −⋅ (4.2)
con q(t) funzione monotona crescente nulla nell’origine e tendente asintoticamente al valore di equilibrio.
Nei sistemi a riserva, il farmaco diffonde attraverso lo strato di polimero che lo circonda. Se il flusso di sostanza rilasciata è costante allo stato di equilibrio la velocità di rilascio è costante e indipendente dal tempo. Applicando la legge di Fick a questi sistemi si ottiene una cinetica di rilascio di ordine zero.
Anche se all’equilibrio il rilascio è costante, nella fase iniziale si possono registrare un rilascio maggiore o minore rispetto a quello di equilibrio, in dipendenza della “storia” passata del dispositivo; per questo motivo e per il fenomeno del “drug dumping” (la rottura della membrana polimerica ed un conseguente burst di sostanza attiva) i sistemi monolitici vengono preferiti.
Dal momento che i materiali privilegiati per la realizzazione di sistemi a rilascio controllato sono i polimeri biodegradabili, l’altro meccanismo che contribuisce alla cinetica di rilascio e che risulta opportuno analizzare è la
degradazione. Si ricordi che i materiali biodegradabili degradano all’interno del corpo come conseguenza di processi biologici naturali, eliminando così la necessità di rimuovere il sistema a rilascio controllato dopo che il rilascio dell’agente attivo è stato completato.
Ovviamente, nel caso in cui si abbiano processi degradativi a carico della membrana polimerica con tempi paragonabili a quelli diffusivi, le cinetiche di rilascio si complicano rispetto a quelle prima analizzate.
Fra le tipologie di sostanze immobilizzabili nei sistemi a rilascio controllato annoveriamo le proteine.
Queste sono tra le sostanze chimiche più importanti negli esseri viventi, dal momento che svolgono un ruolo fondamentale in tutti i processi biologici.
Paragonate con i farmaci tradizionali, le proteine presentano una maggiore complessità biochimica e strutturale: la progettazione di un sistema a rilascio controllato risulta quindi più difficoltosa. Sono infatti molecole relativamente grandi con una complessa architettura: possiedono una struttura secondaria, terziaria e talvolta quaternaria con deboli legami e catene laterali dotate di gruppi chimicamente reattivi. La rottura di queste strutture o la modifica delle catene laterali, fenomeni che possono verificarsi facilmente per molte proteine, possono portare alla riduzione o addirittura alla perdita dell’attività proteica.
A causa della stretta correlazione tra l’efficacia della proteina e la sua struttura tridimensionale, è essenziale mantenerne l’integrità strutturale durante i vari passi della produzione del sistema di rilascio e nel passaggio dalla forma di dosaggio al sito d’azione. Nella fase di progettazione del sistema di rilascio è inoltre opportuno porsi come obiettivo quello di creare un sistema in grado di proteggere la proteina, ovvero di massimizzare la stabilità fisica e chimica, prolungare la semivita e minimizzare il metabolismo causato dalla degradazione enzimatica.
Oltre a fungere da farmaci, le proteine vengono impiegate ampiamente in ingegneria tessutale.
Per gli scopi dell’ingegneria tessutale, i principi attivi da rilasciare sono essenzialmente i fattori di crescita, proteine solubili che funzionano come messaggeri chimici intercellulari, necessari per i normali processi di sviluppo, crescita e proliferazione cellulare. I fattori di crescita si legano a specifici recettori presenti sulla superficie delle cellule bersaglio e sono in grado di indurre o
dirigere l’azione di specifici geni in tali cellule, assumendo un ruolo chiave nei processi di riparazione tessutale.
Le sostanze più frequenti impiegate sono fattori di ricrescita ossea, angiogenetici (VEGF, vascular endothelial cell growth factor), fattori di ricrescita fibroblastica (FGF, fibroblast growth factor) e fattori di ricrescita ed indirizzamento nervoso [37].
4.2 Deposizione dell’alginato e cinetica di rilascio
Per la realizzazione del sistema a rilascio di farmaco, basato sull’impiego di array di CNT, è stato necessario condurre prove preliminari, in cui il film di polimero, in questo caso l’alginato, caricato con la proteina (inizialmente l’albumina), è stato deposto sulla superficie di una petri.
La caratteristica principale, su cui si basa la modellazione matematica del film, è lo spessore del film stesso.
Il limite massimo di altezza per il film di alginato e albumina deve essere inferiore all’altezza dei CNT ed è stato perciò imposto essere di 5µm. Tuttavia, tenendo conto della densità superficiale di CNT (grado di vuoto dell’array del 70%), cautelativamente, lo spessore effettivo da considerare è 2µm.
Studi in letteratura riferiscono che sistemi a rilascio basati su alginato, possono essere ottenuti con soluzioni di alginato≥ all’1% (10 mg/ml) [38].
Allo scopo di realizzare un film sottile di2µm si è partiti da una soluzione iniziale molto diluita, alla concentrazione 200µg /ml
.
La superficie su cui è stata deposta la soluzione è circolare, avente un diametro di D0 5,5 cm e quindi un’areacomplessiva S0 di 23,74 cm . Supponendo di voler ottenere un film con 2
un’altezza h di 2µm il volume complessivo V0 risulta
3 2 10 19 , 1 ⋅ − cm che espressi in ml corrisponde ad un volume di circa 1,2 ml. A questo punto, conoscendo il volume e la concentrazione di alginato da cui si vuole partire è possibile ricavare il quantitativo in grammi di alginato: M0 =0,7mg/ml⋅ .I dati disponibili riferiscono una densità dell’alginatoρ, non reticolato di0,7g/cm3 [39]. Tenendo conto che l’alginato reticolato ha un grado di vuoto intorno al 25%, è possibile
considerare una densità effettiva intorno a 0,55g/cm3. In tabella 1 sono riportati i dati relativi alle dimensioni del substrato e alle concentrazioni utilizzate.
h (µm) 2 D0 (mm) 55 S0 (cm ) 2 23.74 V0 (cm ) 3 1,19⋅10−2 ρ (g/cm3) 0.55 M0 (mg) 0.7 Vsol (ml) 3.4 Ma (mg) 1.4 C0 (mg/ml) 0.2 Ca (mg/ml) 0.49
Tabella 4.1 Caratterizzazione del film di alginato
deposto
Definite perciò le concentrazioni e il quantitativo in grammi da utilizzare per ottenere un film di alginato, con intrappolata l’albumina10 di circa 2µm di spessore, è stata preparata la seguente soluzione:
o 4,4 ml di soluzione di alginato 0,2 mg/ml o 5,6 ml di soluzione di albumina 0,88 mg/ml
Della soluzione descritta sopra, solo 3 ml andranno a ricoprire la superficie della petri e questa verrà lasciata evaporare a temperatura ambiente per circa un giorno. Al termine delle 24 ore il film di alginato sarà sottoposto a reticolazione tramite una soluzione di calcio al 30% [40] [41]. Circa 2 ml di soluzione di ioni
+ 2
Ca verranno sparsi sulla superficie dove è deposto il film e dopo mezzo minuto la soluzione sarà aspirata (non è necessario che intercorra troppo tempo poiché la reticolazione degli ioni calcio è immediata) [42] [43].
10
Albumin from bovine serum ≥96%, Sigma approfondimento in Appendice pag 104
4.2.1 Prove di rilascio dal film di alginato
Dopo che il film di alginato adeso sulla superficie della petri è ultimato, è possibile procedere alla caratterizzazione del rilascio, finalizzata a testare l’efficacia del sistema creato. Si tratta di valutare nel tempo l’assorbanza della proteina rilasciata nel mezzo, quindi tramite la legge di Lambert-Beer ricavare la concentrazione della stessa. Al fine di ottenere dei risultati quanto più realistici e affidabili, le prove di rilascio sono state ripetute più volte ottenendo comunque risultati sempre piuttosto simili. Le prove sono state ripetute sempre nelle stesse condizioni effettuando l’analisi allo spettrofotometro del mezzo di rilascio, sempre negli stessi istanti di tempo t=0 min, t=15 min, t=45 min, t=105 min, t=325 min, t=475 min.
In particolare, l’analisi all’istante t=0 è finalizzata a rilevare quanta albumina è stata rilasciata immediatamente dal film, quando viene messo in contatto con il mezzo di rilascio. Durante la reticolazione con gli ioni calcio, infatti, parte dell’albumina rimane intrappolata sulla superficie del film, cosicchè questa, a contatto con l’acqua, viene rilasciata immediatamente diminuendo perciò il contenuto che è possibile rilasciare nel tempo. È necessario sottrarre ai valori trovati, il valore di assorbanza iniziale rilevata con lo spettrofotometro.
A questo punto, applicando l’equazione di Lambert-Beer, sulla base delle calibrazioni fatte precedentemente, è possibile ricavare la concentrazione di albumina rilasciata nel tempo (Fig.4.2):
C A= 59250, ⋅
Fig4.2 Andamento della concentrazione di albumina nel volume di rilascio in
funzione del tempo
Dividendo poi il valore di concentrazione ai vari istanti di tempo, per la concentrazione nominale, che si calcola dividendo la massa di albumina (Tabella 1) per il volume di rilascio (4 ml) si ottiene l’andamento delle concentrazioni normalizzate al variare del tempo (Fig.4.3). Da questo grafico si evince che dopo
min 500
≈ si ha il rilascio del 20% della concentrazione totale di albumina e quindi si presume che la completa diffusione della proteina si abbia dopo circa due giorni.
Questi dati saranno utilizzati nei paragrafi successivi per estrapolare la cinetica di rilascio.
Fig4.3 Andamento della concentrazione normalizzata di albumina in
funzione del tempo
4.3 Deposizione del collagene e cinetica di rilascio
Come detto già precedentemente, il collagene è la proteina più abbondante presente nel nostro organismo, ed essendo totalmente biocompatibile garantisce una perfetta adesione cellulare. Il collagene renderebbe possibile, non introdurre un ulteriore strato per permettere l’adesione sulla superficie delle cellule. La procedura seguita per la formazione del film di collagene con la proteina intrappolata è essenzialmente uguale a quella utilizzata per l’alginato ed anche in questo caso preliminarmente, per testare la cinetica di rilascio, è stata utilizzata l’albumina come agente intrappolato
È necessario preparare quindi una soluzione di collagene in acqua; il collagene utilizzato è collagene di tipo 1 di coda di topo ed il valore di densità è circa : 3 3 / 10 5 , 0 ⋅ g dm = ρ
Anche in questo caso, lo spessore h del film che si vuole ottenere è dell’ordine dei micron. Considerando di voler lasciare le “punte” dei CNT scoperte, si impone che lo spessore del film sia 5µm. In questo caso, rispetto a quello analizzato precedentemente per l’alginato, si vuole creare uno spessore più alto. Questo perché, nel caso in cui la cinetica di rilascio fosse ottimale, sarebbe possibile impiegare il collagene sia come polimero per il rilascio che come
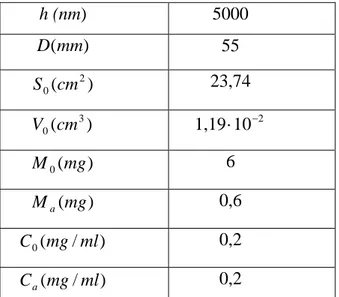
h (nm) 5000 ) (mm D 55 ) ( 2 0 cm S 23,74 ) ( 3 0 cm V 1,19⋅10−2 ) ( 0 mg M 6 ) (mg Ma 0,6 ) / ( 0 mg ml C 0,2 ) / (mg ml Ca 0,2
Tabella 4.2 Caratterizzazione del film di collagene deposto
Il collagene disponibile in laboratorio non è puro bensì in soluzione; tuttavia non essendo nota la densità della soluzione, è stato pesato 1 ml della soluzione ed il valore ottenuto ha dato 0,81 g/ml che corrisponde al valore di densità cercato.
È possibile quindi calcolare la concentrazione di collagene nella soluzione.
Definendo: C(x)= 0,81 g/ml C(H2O)= 0,97 g/ml C(coll)= 0,5 g/ml
Indicando con x la quantità di collagene ed (1-x) la quantità di acqua e ragionando in termini di frazioni volumetriche, si ottiene che:
) ( ) 1 ( ) ( 1 ) (x x C coll x C H2O C ⋅ = ⋅ + − ⋅
Da cui risulta che la quantità di collagene necessaria è:
34 . 0 )] ( ) ( [ )] ( ) ( [ − 2 − − 2 = = C x C H O C coll C H O x
Quindi in percentuale si avrà:
• 34% di collagene • 66% di acqua
La massa di collagene che si vuole ottenere è 6 mg, quindi è necessario ottenere una soluzione di collagene composta da:
mg 7 , 17 34 / 100 6⋅ =
Dividendo il risultato ottenuto per la densità della soluzione di collagene definita precedentemente si ottiene:
l ml g mg/0,81 / 21,8µ 7 , 17 =
E’ necessario che la quantità di soluzione di collagene trovata sia disciolta in 3 ml, volume che, rappresenta il giusto quantitativo per coprire interamente una petri di diametro 5,5 cm, utilizzata come substrato.
Definite dimensioni e concentrazioni da impiegare è possibile procedere alla deposizione del film:
o step1: sciogliere 22 mg di albumina in 100 ml di H2O;
o step2: prendere 10 ml della soluzione precedente e aggiungere 82µgdi soluzione di collagene;
o step3: agitare con ancoretta magnetica per 30 min; o step4: versare 3 ml sulla superficie della petri;
Come già fatto precedentemente nel caso dell’alginato, la soluzione viene esposta all’aria e lasciata ad evaporare per circa 24 ore, al fine di ottenere un film secco.
4.3.1 Prove di rilascio dal film di collagene
Trascorse le 24 ore, tempo necessario per far aderire e seccare contemporaneamente il film, è possibile procedere alle prove di rilascio, testare quindi il materiale come sistema a rilascio di farmaco, e valutare quindi la cinetica di rilascio della proteina utilizzata.
Tutte le prove sono state condotte più volte per verificare la ripetibilità dei risultati. Il volume di rilascio è stato scelto in accordo alle dimensioni della cuvetta dello spettrofotometro; sono stati deposti sulla superficie 4 ml di acqua e quindi effettuate le prove di rilascio seguendo esattamente le stesse modalità e precauzioni usate nel caso dell’alginato. Le misure sono state eseguite a intervallo
Poiché l’efficacia di un sistema di rilascio è valutata in base alla cinetica di rilascio (in un buon sistema è necessario che il farmaco diffonda molto lentamente), risulta fondamentale conoscere la quantità rilasciata all’istante 0, (ossia la quantità rilasciata dalla superficie).
Sottraendo il valore iniziale a tutti i valori di assorbanza nel tempo ed applicando l’equazione di Lambert-Beer, otteniamo il grafico di Fig.4.4.
Fig4.4 Andamento della concentrazione dell’albumina in funzione del tempo
Dividendo poi il valore di concentrazione ai vari istanti di tempo per la concentrazione nominale (cioè la massa di albumina utilizzata sul volume di rilascio) si ottiene l’andamento delle concentrazioni normalizzate al variare del tempo; riportato in Fig.4.5.
Fig4.5 Andamento della concentrazione normalizzata dell’albumina in funzione del
tempo
I dati fornirebbero all’istante t = 500 min un rilascio del 300%. Tale valore è ovviamente imputabile al fatto che il collagene stesso entra in soluzione interferendo pertanto con la misura dell’albumina. È evidente che il collagene, ai fini della progettazione di un sistema a rilascio stabile per giorni, risulta inadatto e pertanto non sarà preso in considerazione nel seguito di questo lavoro di tesi.
4.4 Deposizione del polipirrolo e cinetica di rilascio
La deposizione del polipirrolo è finalizzata, come già detto in precedenza, al miglioramento delle capacità elettriche e meccaniche dei CNT. Da un punto di vista elettrico, infatti, aumenta notevolmente la conducibilità, mentre da un punto di vista meccanico aumenta la resistenza dei nanotubi permettendo loro di mantenere l’allineamento verticale anche dopo essere stati immersi in soluzione. Per gli scopi previsti, infatti, l’array deve essere in contatto con liquido sia nel caso in vivo (impianto neurale), sia nel caso in vitro (per il rilascio nel mezzo di coltura delle cellule).
La deposizione del polipirrolo è effettuata tramite elettrodeposizione, cioè all’interno di una cella elettrochimica viene posta una soluzione salina nella quale è disciolto il monomero (il pirrolo).
Di seguito il PPy è stato testato come sistema di rilascio. A tale scopo è stato deposto un film spesso su vetrini sputterati di cromo e oro.
La deposizione è stata eseguita utilizzando due diversi tipi di soluzioni: una soluzione 0,1 MNaDBS (dodicil benzene sulfonato) e 0,1 M di monomero di pirrolo, oppure una soluzione 1M KCl (cloruro di potassio) e 50 mM di monomero di pirrolo.
Inizialmente è stata valutata la tensione necessaria perché avvenisse la deposizione. Il valore di tensione ottimale è stato definito in base a valori di correnti significativi, considerando che l’andamento della corrente in funzione del tempo dovrebbe essere come in Fig. 4.6.
Fig4.6 Andamento della corrente durante la deposizione di
PPy in funzione del tempo
Quando è applicata una tensione, inizialmente si ha un picco in cui si raggiunge il massimo valore di corrente, che decade poi, lentamente, fino a raggiungere un minimo. Dopo il minimo la corrente aumenta e si assesta quando la polimerizzazione ha inizio: questo andamento è associato alla nucleazione e alla crescita. Se la corrente invece decade semplicemente, allora la tensione applicata è troppo bassa. Dopo il periodo di nucleazione la corrente raggiunge il plateau: il PPy è conduttivo e dopato quando depositato e lo spessore del film cresce linearmente nel tempo.
Sperimentalmente si è osservato che applicando una tensione di 0,5 V per circa tre minuti, l’andamento della corrente non rispettava quello del grafico in Fig.4.6 con un valore di corrente rilevato molto basso (solo 0,2 mA). A questa prova nesono seguite altre in cui è stata man mano aumentata la tensione e a cui è
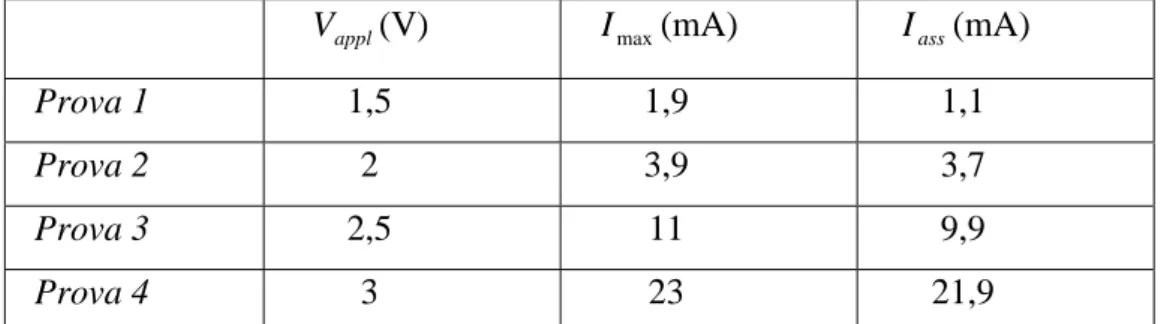
corrisposto un aumento di corrente. Nelle prove riportate in Tab.4.3 sono riportati il valore di tensione applicato, il valore di corrente massimo Imax e il valore di corrente al plateau Iass.
appl
V (V) Imax(mA) Iass(mA)
Prova 1 1,5 1,9 1,1
Prova 2 2 3,9 3,7
Prova 3 2,5 11 9,9
Prova 4 3 23 21,9
Tabella 4.3 Prove di deposizione del PPy su vetrini sputterati d’oro utilizzando una soluzione di
NaDBS 0,1 M
Tramite osservazioni al microscopio FIB, si è osservato che al diminuire della tensione applicata si ottengono film più uniformi.
Per valutare la cinetica di deposizione, sono stati valutati gli spessori del polimero al FIB. Sono stati deposti spessori di pirrolo ottenuti in tempi diversi, (a 1 min, 5 min e 15 min) alla tensione di 2,5 V.
Fig4.7 Immagini al FIB di una sezione di film di polipirrolo su
vetrino sputterato d’oro con una soluzione di NaDBS 0,1 M
Fig4.8 Andamento degli spessori dei film di PPy deposti con una soluzione di NaDBS in
funzione del tempo
I dati precedenti sono relativi alla deposizione di polipirrolo, utilizzando la soluzione di NaDBS; di seguito gli stessi dati saranno ricavati utilizzando la soluzione di KCl, che sarà quella utilizzata per la deposizione sui CNT. Al variare delle tensioni sono stati rilevati i valori di corrente riportati in Tab 4.4:
appl
V (V) Imax(mA) Iass(mA)
Prova 1 1,5 3,9 2,7
Prova 2 2 8 5
Prova 3 2,5 12 6,5
Tabella 4.4 Prove di deposizione del PPy su vetrini sputterati d’oro utilizzando una soluzione di
Fig4.9 Immagine al FIB di un film di PPy deposto su un vetrino sputterato d’oro da una soluzione di KCl 1 M
Allo scopo di caratterizzare la cinetica di deposizione sono stati deposti film di polipirrolo per 30 sec, 1 min e 2 min, applicando una tensione di 2,5 V. In Fig. 4.10 sono riportati gli spessori dei film in funzione del tempo:
Fig4.10 Andamento degli spessori dei films di PPy deposti con una soluzione di
KCl in funzione del tempo
Poiché la natura della soluzione impiegata per deporre il polipirrolo, influenza, probabilmente, le caratteristiche di biocompatibilità dello spessore di
polimero utilizzato successivamente, per effettuare il rilascio di proteina, la soluzione salina impiegata nella cella elettrochimica è stata quella a basa di KCl.
4.4.1 Prove di rilascio dal film di polipirrolo
Successivamente alla deposizione del polipirrolo (tensione applicata 2,5 V) sono state effettuate delle prove finalizzate alla caratterizzazione del film di polimero conduttivo come sistema a rilascio di farmaco [44] [45].
L’obiettivo è stato quello di testare il polipirrolo, proprio come fatto precedentemente nel caso del collagene e dell’alginato, cioè incorporando la proteina, anche in questo caso l’albumina, all’interno della soluzione salina di KCl e pirrolo. Una volta deposto il film è necessario valutare se, immerso in un mezzo acquoso, la cinetica di rilascio della proteina è tale da poter impiegare il film di polipirrolo, oltre che per le buone caratteristiche elettriche e meccaniche, anche come sistema a rilascio di farmaco.
Alla soluzione di KCl utilizzata prima sono stati aggiunti 0,1 g di albumina. L’idea è che, durante la polimerizzazione del pirrolo, la proteina venga intrappolata, e che successivamente, in contatto con il mezzo acquoso, questa venga rilasciata.
Fig4.11 Andamento della concentrazione dell’albumina rilasciata dal film di
Come è evidente dalla Fig.4.11 cinetica di rilascio non è buona soprattutto se la si confronta con i dati ottenuti nel caso del collagene o dell’alginato.
Il grafico evidenzia che la proteina non è inglobata nel film, ma solo adsorbita in superficie. Inoltre è evidente che dopo circa 300 min il film di PPy comincia a diffondere in soluzione. Anche ad una ispezione visiva dopo tante ore in mezzo acquoso, il film spesso di pirrolo risulta rigonfio, caratteristica questa incompatibile con gli scopi finali di questo lavoro di tesi: infatti, è necessario che il film di polimero sia resistente e stabile per giorni ad ambienti acquosi.
4.5 Analisi dei dati di rilascio
Dall’analisi della cinetica di rilascio dei tre materiali analizzate in precedenza, risulta evidente che il polipirrolo non ha le caratteristiche ottimali, per gli scopi di interesse, mentre l’alginato ed il collagene possono essere ritenuti dei buoni sistemi di rilascio di farmaco. Tuttavia ad una prima analisi , l’alginato sembrerebbe il sistema ottimale per il rilascio stabile e prolungato (anche giorni) mentre il collagene sembrerebbe più idoneo per rilasci a breve termine(qualche ora). Di seguito la cinetica di rilascio è caratterizzata dettagliatamente [46].
Il sistema che è stato finora considerato, non prende in considerazione l’utilizzo dei nanotubi, perciò l’analisi dei dati ottenuti, sarà riferito alla deposizione del film di polimero su una superficie circolare di una petri .
Sia C1 la concentrazione della sostanza all’interno del film, in questo caso l’albumina intrappolata, e C2 la concentrazione della medesima sostanza del bulk di rilascio, S e V1 rispettivamente la superficie ed il volume del film ed infine V2 il volume del bulk di rilascio
Da un bilancio di massa si ottiene:
)) ( ) ( ( ) ( 2 1 1 1 h S C t C t t t C V =− ⋅ ⋅ − ∂ ∂ ⋅ (4.3) )) ( ) ( ( ) ( 2 1 2 2 h S C t C t t t C V = ⋅ ⋅ − ∂ ∂ ⋅ (4.4)
Dove h è il coefficiente di scambio massico. Si assuma ora l’ipotesi di quasi stazionarietà cioè hd/D < 1 con d spessore del film di polimero:
Sottraendo le due equazioni si ha:
) 1 1 ( ) ( ) ( 2 1 V V t C S h t t C =− ⋅ ⋅∆ ⋅ + ∂ ∆ ∂ (4.5)
dove è stato posto ∆C=C1-C2; integrando con condizioni al contorno:
C1(0) = C10 e C20 = 0 (B.C.) si ottiene: t V V S h
e
C
t
C
⋅ + ⋅ ⋅ −⋅
∆
=
∆
) 1 1 ( 0 2 1)
(
(4.6)Esplicitando C1(t) e sostituendolo nella 4.4 ricaviamo:
t V V S h
e
C
V
S
h
t
t
C
=
⋅
⋅
∆
⋅
− ⋅ ⋅ + ⋅∂
∂
(1 1) 0 2 2(
)
1 2 (4.7)che integrata con le precedenti condizioni al contorno darà la seguente espressione per la concentrazione nel bulk:
) 1 ( 1 ) ( ) 1 1 ( 1 2 10 2 2 1 t V V S h e V V C t C ⋅ + ⋅ ⋅ − − ⋅ + = (4.8)
Conoscendo il coefficiente di diffusione dell’albumina nell’alginato e considerando l’ipotesi di quasi stazionarietà, è possibile ricavare il coefficiente di scambio massico h e fittare i dati ottenuti dalle prove di rilascio, confrontandoli con il modello ricavato dall’equazione (4.8).
Il programma utilizzato per il fitting dei dati è il Toolbox Curve Fitting del MATLAB.
I dati presi in considerazione in Fig 4.12 sono relativi al rilascio di albumina dal film di alginato riportati in Fig 4.2, mentre nel caso del fitting dei dati del collagene (Fig.4.13)i valori delle concentrazioni sono relativi alla Fig 4.4.
Fig4.12 Fitting dei dati relativi al rilascio dal film di alginato
Tali dati sono in accordo con la cinetica di rilascio riportata in letteratura per microsfere di alginato [47].
Fig4.13 Fitting dei dati relativi al rilascio dal film di collagene
Sebbene anche il collagene mostri buone caratteristiche per gli scopi di sistemi di rilascio di farmaco, poiché nel caso di crescita cellulare, è necessario attendere almeno sei ore perchè le cellule aderiscano e crescano almeno sei ore, e poiché il collagene dopo qualche ora entra in soluzione, l’unico sistema di rilascio utilizzato nell’ambito di questo lavoro di tesi sarà l’alginato. Esso come
tutte le caratteristiche necessarie per il rilascio controllato di farmaci e ben si presta alla nostra applicazione.