19
Capitolo 2: Risultati e discussioni
2.1 IMMOBILIZZAZIONE DELLA MAO-A
2.1.1 La fase stazionaria IAM
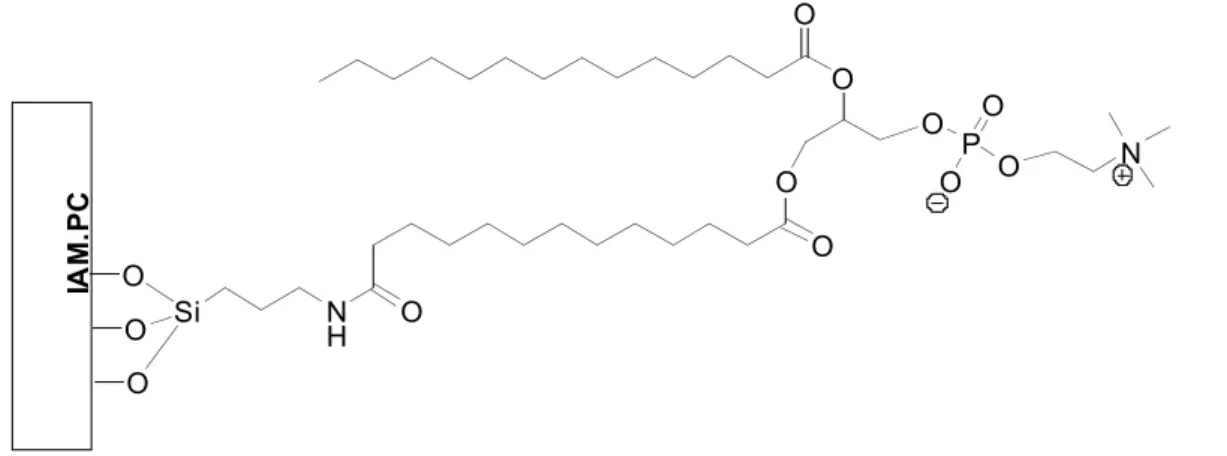
Tra i numerosi metodi utilizzati per l’immobilizzazione non covalente di enzimi, particolarmente interessante risulta l’uso di membrane artificiali immobilizzate (“Immobilized Artificial Membrane”, IAM). Queste membrane derivano dall’immobilizzazione covalente di molecole fosfolipidiche su particelle di silice derivatizzata con gruppi amminopropilici e possono essere utilizzate come fase stazionaria per HPLC.
O O O Si N H O O O O O O P O O O N IA M .P C
20
Colonne impaccate con IAM sono state recentemente utilizzate per numerose applicazioni, tra cui analisi chirali e farmacologiche, la purificazione del citocromo P450, l’isolamento di proteine di membrana e lo studio del trasporto di soluti attraverso la pelle umana1,2.
La presenza dei gruppi fosfolipidici e della catena alifatica laterale causa la formazione di cavità idrofobiche tra le teste polari e la silice derivatizzata. Questa struttura, che è simile alla membrana cellulare, permette all’enzima di interagire con ogni combinazione di gruppi polari e catene lipofile.
Questa tecnica di immobilizzazione offre il vantaggio di non interferire con la struttura terziaria dell’enzima e, contemporaneamente, di creare un forte legame tra l’enzima e la fase stazionaria, paragonabile al legame covalente.
2.1.2 Preparazione dell’IMER contenente MAO-A
In letteratura3 l’uso delle MAO immobilizzate è stato riportato principalmente in biosensori ed elettrodi, utilizzati per la determinazione di substrati dell’enzima o per la rivelazione di catecolammine e indolammine.
Recentemente4 è stato riportato l’uso di MAO-A e MAO-B immobilizzate su fasi stazionarie a base di membrane artificiali (IAM) ed è stato mostrato che questi bioreattori possono essere utilizzati per lo “screening” di substrati dell’enzima. Tale metodo è stato quindi scelto in questo lavoro di tesi per l’immobilizzazione della MAO-A.
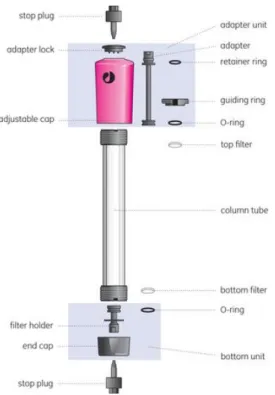
Per la preparazione dell’IMER contenete MAO-A è stata utilizzata la tecnica “in situ”. La fase stazionaria IAM.PC è stata lasciata in agitazione per circa 6 ore in tampone fosfato (PBS) La sospensione così ottenuta è stata lentamente inserita nella colonna (Amersham Tricorn 5/50, Figura 2.2, diametro interno 5mm, lunghezza massima 50mm) e lasciata decantare. Quando la fase stazionaria si è completamente depositata sul fondo e non erano più presenti bolle d’aria, è stata montato ed avvitato il meccanismo superiore che permette l’impaccamento. Successivamente è stato fatto circolare PBS per circa 45 min (flusso 0.5 mL/min, P 3-5 Kg/cm2).
È stata quindi preparata una soluzione di MAO-Ai in PBS (50mM, pH=7.5) e dalla soluzione ottenuta è stata prelevata un’aliquota da utilizzare successivamente per la determinazione delle concentrazioni mediante analisi UV. La soluzione contenente l’enzima è stata quindi lasciata a ricircolo nella colonna per 24 ore a flusso 0.1 mL/min.
21
Figura 2.2 – Schema di montaggio della colonna Amersham Tricorn.
2.1.3 Valutazione della resa di immobilizzazione
La determinazione della quantità di enzima adsorbito in colonna è stata effettuata per via indiretta, valutando tramite il metodo di Bradford la differenza tra la quantità di enzima inizialmente presente nella soluzione e quella rimasta dopo l’immobilizzazione nelle acque di lavaggio.
Il metodo di Bradford è un metodo per la determinazione della concentrazione delle proteine in soluzione che sfrutta la formazione di un addotto tra un colorante (Coomassie Brilliant
Blue G-250 dye) e la proteina; il colorante esiste in tre forme: cationica (rossa, λmax=470nm),
neutra (verde, λmax=650nm) ed anionica (blu, λmax=595nm).
Quando il colorante si lega alla proteina viene completamente convertito nella forma non protonata5 ed il complesso può essere analizzato tramite uno spettrofotometro, alla lunghezza d’onda di 595nm.
È stata realizzata una retta di taratura utilizzando una proteina standard (sieroalbumina bovina, BSA).
22
Grafico 2.1 - Retta di taratura per il saggio di Bradford.
Sono state quindi analizzate la soluzione madre, la soluzione rimanente dopo l’immobilizzazione ed i successivi lavaggi della colonna (Tabella 2.1). Dai risultati ottenuti è stato possibile determinare una resa di immobilizzazione (percentuale di enzima legato al supporto) del 66.5%, pari a 1.23µg/mg di supporto.
Tabella 2.1 - Determinazione della resa di immobilizzazione dell'enzima.
campioni UVii concentrazione (µg/mL) volume (mL) µg enzima contenuto % enzima
soluzione madre 200.00 2.3 460.00 100.00
residuo di imm. 22.53 3.017 67.97 14.78
lavaggio 1 41.23 1 41.23 8.96
lavaggio 2 25.61 1 25.61 5.57
lavaggio 3 19.53 1 19.53 4.25
lavaggio 4 non rilevabile 1 --- ---
ii per soluzione madre si intende la soluzione di enzima che è stata fatta fluire all’interno dell’IMER; per residuo di immobilizzazione si intende la soluzione rimasta dopo le 24 ore di ricircolo; per lavaggio si intende l’eluato
23
2.2 ATTIVITÀ DELLA MAO-A NON IMMOBILIZZATA
2.2.1 Valutazione dell’attività enzimatica
L’attività di un enzima indica la concentrazione dell’enzima cataliticamente attivo e viene espressa solitamente mediante una unità standard6 per agevolare i confronti. L’unità più comunemente usata è l’Unità (U), definita anche come Unità Internazionale (IU) o Unità Enzimatica (UE). Una Unità di attività enzimatica è definita6 come la quantità di enzima che catalizza la conversione di 1 µmole di substrato (o la formazione di 1 µmole di prodotto) in 1 minuto, in condizioni di substrato saturanti l’enzima secondo la legge di Michaelis & Menten. In generale l’attività di un enzima può essere misurata determinando la velocità di formazione del prodotto (o di consumo del substrato) durante la reazione catalizzata dall’enzima stesso. Infatti, in condizioni ben definite di pH, temperatura e concentrazione dei reagenti, esiste una proporzionalità diretta tra la velocità iniziale della reazione e la concentrazione dell’enzima cataliticamente attivo, in altre parole il loro rapporto è costante6. L’andamento tipico di una reazione catalizzata da un enzima è mostrato in Grafico 2.2.
Grafico 2.2 - Curva tipica (linea intera) relativa al progredire di una reazione catalizzata da un enzima nel caso in cui venga seguita la formazione del prodotto. La linea tratteggiata indica l’andamento lineare teorico.
24
La variazione nel tempo della concentrazione del prodotto formato (oppure del substrato consumato) con il progredire della reazione, come è evidenziato nel Grafico 2.2, dopo alcuni istanti si discosta dalla linearità. Questo fenomeno è dovuto a molteplici fattori quali, ad esempio, l’inibizione dell’enzima da parte del prodotto che si va a formare o l’instabilità dell’enzima nelle condizioni di reazione (progressiva denaturazione dell’enzima). È quindi evidente la necessità di misurare la velocità della reazione solo fino a quando è mantenuta la linearità nel tempo, cioè nei minuti iniziali, non superando di solito il 10-20% di conversione6.
Per determinare la velocità delle reazioni enzimatiche6, la variazione della concentrazione del prodotto (oppure del substrato) può essere seguita direttamente nel tempo con il progredire della reazione (metodo in continuo). Questo metodo, che permette inoltre di verificare l’esistenza di eventuali deviazioni dalla linearità, richiede che vi sia una qualche differenza tra le proprietà del substrato e del prodotto, tale da poter essere misurata direttamente. Sono state per esempio utilizzate le variazioni di assorbanza, fluorescenza, pH, rotazione ottica, conduttività, entalpia, viscosità o volume. Tra queste, la differenza di assorbanza, valutata mediante spettrofotometria ad una determinata lunghezza d’onda, è sicuramente la più usata. In mancanza di differenze di proprietà significative tra substrato e prodotto, è possibile misurare la velocità di una reazione enzimatica lasciando progredire la stessa per un tempo determinato, al termine del quale la reazione viene fermata e la miscela di reazione analizzata per valutarne il grado di conversione e misurare così le µmoli di prodotto formato nel tempo (metodo a punto fisso). Naturalmente è necessario avere la certezza di fermare la reazione all’interno della zona lineare del Grafico 2.2. Per controllarne la zona di linearità, si può eseguire un set di reazioni che, interrotte a tempi diversi, forniscono una serie di punti con cui accertare l’andamento della curva. Le tecniche più usate per analizzare le miscele di reazione dopo un tempo fissato sono la cromatografia e la spettrofotometria6.
2.2.2 Studio dell’attività della MAO-A con il substrato chinuramina (2)
Allo scopo di valutare la variazione delle proprietà catalitiche della MAO-A dopo l’immobilizzazione, l’attività è stata studiata utilizzando la chinuramina (2) come substrato (Schema 2.1). Questo è il metodo standard per la valutazione dell’attività enzimatica delle MAO7.25 NH2 NH2 O MAO NH2 O O N OH 2 8
Schema 2.1 – Ossidazione enzimatica della chinuramina (2).
L’analisi e la quantificazione del prodotto della reazione può essere effettuata mediante analisi HPLC sia con rivelazione UV che con rivelazione fluorimetrica. Infatti il prodotto della reazione, la 4-idrossichinolina 8, è fluorescente.
È stato messo a punto un metodo cromatografico per l’analisi in tempi brevi delle reazioni enzimatiche. L’analisi è stata effettuata tramite una colonna C18 lavorando in fase inversa utilizzando come eluente una miscela 70:30 di PBS e metanolo. In questo modo si ottiene l’eluizione dei due composti entro 10 min.
Grafico 2.3 - Cromatogramma di una miscela di chinuramina (2) e 4-idrossichinolina (8). — UV (λ=224nm);
— fluorescenza (λex=314nm, λem=350nm).
Inizialmente è stata controllata la linearità della reazione, effettuando varie prove con le stesse concentrazioni di substrato ed enzima, ma in tempi di incubazione diversi.
26
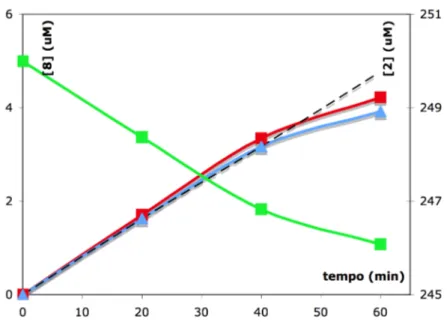
Figura 2.3 – concentrazione µM di 4-idrossichinolina (8) formata in funzione nel tempo (scala sulla sinistra), —
quantificazione mediante fluorescenza, —quantificazione mediante UV; —concentrazione µM di chinuramina (2) rimanente in funzione del tempo, quantificata tramite UV (scala sulla destra).
Da queste curve è stato possibile ricavare una attività per la deamminazione della chinuramina di 41 nmol/(min*mg proteina).
Allo scopo di calcolare le costanti cinetiche per l’enzima libero sono state effettuate prove catalitiche con diverse concentrazioni di substrato.
Grafico 2.4 – Velocità di formazione di 4-idrossichinolina (8) in funzione della concentrazione di chinuramina (2). La velocità è stata normalizzata rispetto ad un µg di enzima. La linea tratteggiata reppresenta la curva calcolata con il fitting dei punti sperimentali.
27
Dai risultati ottenuti è stato possibile ricavare un valore di KM pari a 35.86±4.30 µM ed un
valore di Vmax di 0.290±0.010 µM/(µg*min); R2=0.9972.
È stata inoltre valutata la stabilità della soluzione di enzima nel tempo. I risultati ottenuti sono riportati nel Grafico 2.5.
Grafico 2.5 - Attività della soluzione di enzima nel tempo.
Dopo due giorni, si osserva un’attività residua pari 70% circa; dopo 4 giorni l’attività è solo del 31% rispetto a quella iniziale.
2.2.3 Studio dell’attività della MAO-A con il substrato adrenalina (6)
L’attività dell’enzima MAO-A è stata valutata anche nella reazione di ossidazione dell’adrenalina (Schema 2.2). HO HO OH H N HO HO OH O MAO 6 9
Schema 2.2 - Ossidazione enzimatica dell'adrenalina (6) catalizzata dalla MAO-A
L’adrenalina, la nor-adrenalina e la dopamina, chiamate complessivamente catecolammine, costituiscono una classe di neurotrasmettitori ed ormoni che occupano una posizione chiave nella regolazione di processi fisiologici e nello sviluppo di disturbi neurologici, psichiatrici, endocrini e cardiovascolari8.
28
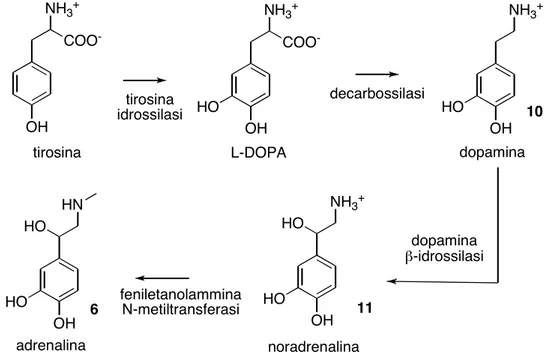
La biosintesi delle diverse catecolammine è sequenziale e comincia dalla tirosina (Figura 2.4).
COO -NH3+ OH tirosina idrossilasi COO -NH3+ OH HO decarbossilasi NH3+ OH HO NH3+ OH HO HO HN OH HO HO dopamina !-idrossilasi feniletanolammina N-metiltransferasi
tirosina L-DOPA dopamina
noradrenalina adrenalina
10
11 6
Figura 2.4 - Schema biosintetico delle catecolammine a partire dall'amminoacido tirosina.
La catecolammine provocano effetti mirati ad adeguare l'organismo ad improvvisi aumenti di esigenze metaboliche tipici delle situazioni d'allarme come la lotta o la fuga, tali modificazioni sono mirate ad aumentare l'energia disponibile tramite la glicogenolisi nel fegato e la mobilitazione dei grassi tramite la lipolisi. Esse inoltre incrementano l'attività dell'apparato cardiovascolare, aumentano l'efficienza del sistema nervoso e di quello muscolare. L'effetto delle catecolamine è però ridotto a pochi secondi in quanto vengono rapidamente degradate nel fegato dalle MAO. È stato inoltre dimostrato che carenze di dopamina sono associate al morbo di Parkinson9.
La reazione di ossidazione dell’adrenalina è stata seguita nel tempo, analogamente a quanto effettuato con la chinuramina. Il comportamento dell’enzima è stato osservato sia con l’enantiomero (-) dell’adrenalina che con la miscela racema, per valutare una eventuale influenza sull’attività enzimatica in funzione della chiralità in β rispetto al gruppo amminico. Nei grafici 2.6 e 2.7 è riportato l’andamento della concentrazione di adrenalina nel tempo.
29
Grafico 2.6 - Andamento cinetico della concentrazione di adrenalina racema nel tempo.
Grafico 2.7 – Andamento cinetico della concentrazione di (-)-adrenalina nel tempo.
Nei due casi sono state calcolate le attività enzimatiche (U): per la miscela racema è stato ottenuto un valore di 1502 nmol/(min*mg proteina), mentre per l’adrenalina enantiopura è stato ottenuto un valore di 324 nmol/(min*mg proteina).
L’andamento della reazione di ossidazione è stato inoltre studiato al variare della concentrazione di substrato, mantenendo il tempo di reazione costante. I risultati sono riportati nel Grafico 2.8 e nel Grafico 2.9.
30
Grafico 2.8 – Andamento della velocità di scomparsa della (±)-adrenalina in funzione della sua concentrazione.
Grafico 2.9 - Andamento della velocità di scomparsa della (-)-adrenalina in funzione della sua concentrazione.
Dall’andamento osservato sembra che in entrambi i casi ci sia una co-operatività positiva6, ovvero quando la molecola di substrato entra e viene convertita, facilita l’ingresso nel sito attivo della seconda molecola di substrato. In questo caso non è stato quindi possibile calcolare le costanti cinetiche mediante il metodo già utilizzato per la chinuramina.
31
2.3 STUDIO DELL’ATTIVITÀ DELLA MAO-A IMMMOBILIZZATA
Per studiare l’attività dell’enzima immobilizzato è stato utilizzato un sistema accoppiato costituito dall’IMER e da una strumentazione per HPLC. Come già detto nel capitolo 1 (paragrafo 1.2.2), con questo sistema si possono effettuare reazioni nell’IMER e raccogliere i prodotti di reazione eluiti nella colonna.2.3.1 Studio dell’attività catalitica con il substrato chinuramina (2)
L’attività della MAO-A immmobilizzata è stata studiata valutando inizialmente la conversione di chinuramina in funzione del flusso nella colonna IMER e quindi del tempo di contatto.
Sono state iniettate ripetutamente nell’IMER soluzioni di chinuramina con concentrazione costante, variando il flusso di lavoro da 0.1mL/min a 0.4mL/min, corrispondenti ad un tempo di contatto da 1.82min a 0.45min. La conversione è stata valutata raccogliendo l’eluato ed analizzandolo mediante una colonna analitica C18 sia con rivelazione UV che con rivelazione fluorimetrica.
32
Grafico 2.11 - 4-idrossichinolina (8) formata in funzione del tempo di contatto, ovvero del tempo di permanenza all'interno dell'IMER (— fluorescenza, —UV).
Tabella 2.2 - moli di 4-idrossichinolina raccolte in funzione del flusso e del tempo di contatto nell'IMER
flusso (mL/min) tempo di contatto (min) [8] (µM)
0.10 1.82 1,33 0.15 1.21 0,90 0.20 0.91 0,66 0.25 0.73 0,55 0.30 0.61 0,475 0.35 0.52 0,44 0.40 0.45 0,355
Dai risultati ottenuti è stato quindi scelto come flusso di lavoro 0.1mL/min, al quale si ha la massima conversione di substrato.
Le costanti cinetiche sono state calcolate preparando soluzioni a diversa concentrazione del substrato e iniettandole in duplicato nell’IMER. Dall’analisi dei cromatogrammi dell’eluato dell’IMER, costruendo la curva di Michaelis-Menten (Grafico 2.12), è stato possibile ricavare il valore di Km=137.7±8.0 µM ed il valore di Vmax=0.230±0.003 µM/(mg*min); R2=0.9996.
33
Grafico 2.12 – Velocità della formazione di 4-idrossichinolina (8) in funzione della concentrazione di chinuramina (2) iniettata nell'IMER. La velocità è stata normalizzata rispetto ad un µg di enzima. La linea tratteggiata reppresenta la curva calcolata con il fitting dei punti sperimentali.
Come si può osservare dal confronto con i dati ottenuti per l’enzima libero il valore di Km è
maggiore per la MAO-A immobilizzata, mentre il valore di Vmax è più basso. Questo è
perfettamente in accordo con quanto riportato per lo stesso enzima e per enzimi diversi immobilizzati su fasi stazionarie IAM4.
È noto infatti10 che l’immobilizzazione di un enzima su un supporto cromatografico costringe
la proteina in una situazione che può modificare la velocità con la quale il substrato raggiunge il sito attivo. In aggiunta, l’inserimento in un sistema in flusso, rispetto all’enzima immobilizzato in un sistema statico, influenza la cinetica di distribuzione del substrato dalla fase mobile alla fase stazionaria.
2.3.1.1 Studio dell’attività catalitica con il substrato adrenalina (6)
Lo studio dell’attività della MAO-A nell’IMER è stata effettuato anche con il substrato adrenalina (6), raccogliendo l’eluato ed iniettandolo in una colonna C18.
Sono di seguito riportati i grafici ottenuti nella reazione con adrenalina enantiopura (-) e con adrenalina racema.
Il sistema è stato studiato osservando la scomparsa del substrato, in quanto alcuni tentativi di sintesi del prodotto 9 effettuati durante il lavoro di tesi, non hanno avuto esito positivo.
34
dell’adrenalina è diversa da quella ottenuta con l’enzima in forma nativa.
Grafico 2.13 – Andamento della velocità di scomparsa dall'adrenalina racema in funzione della sua concentrazione.
Grafico 2.14 – Andamento della velocità di scomparsa dall'adrenalina enantiopura in funzione della sua concentrazione.
35
2.3.1.2 Studio della stabilità del bioreattore
Per poter caratterizzare l’IMER sono stati effettuati anche dei controlli giornalieri per osservare l’eventuale diminuzione dell’attività enzimatica e confrontarla con quella dell’enzima nativo.
Grafico 2.15 – Stabilità dell'IMER nel tempo.
Dal Grafico 2.15 si può osservare la variazione di attività relativa all’iniezione di soluzioni a diversa concentrazione di chinuramina. Dopo 4 giorni l’attività è maggiore del 70% e dopo 11 è ancora maggiore del 50%, dimostrando che, a differenza dell’enzima libero, con questo metodo è possibile l’uso ripetuto della stessa quantità di enzima per un tempo più lungo.
2.3.1.3 Studio del consumo di ossigeno
Come mostrato dallo schema Schema 1.3 per l’ossidazione mediante l’enzima è necessaria una molecola di ossigeno; nel sistema IMER-HPLC l’enzima sfrutta a questo scopo l’ossigeno disciolto nell’eluente (PBS).
Durante le prove catalitiche effettuate con l’IMER era stata inizialmente evidenziata una perdita dell’attività catalitica apparentemente non motivata. È stato quindi ipotizzato che il sistema di degasaggio della pompa HPLC eliminasse dall’eluente la quantità di ossigeno necessaria all’enzima per potersi rigenerare.
36
determinazione dell’ossigeno disciolto in soluzione, modificato per poter misurare “on-line” l’ossigeno in uscita dal sistema cromatografico HPLC.
Schema 2.3 - Funzionamento del coperchio a tenuta per l'analisi on-line dell'ossigeno consumato.
È stata in questo modo osservata una variazione della concentrazione nell’eluato da 5.7mg/L di O2 senza degasaggio della fase mobile ad una concentrazione di 0.9mg/L di O2 con
degasaggio. Sono state quindi effettuate delle iniezioni nell’IMER, seguendo “on-line”, oltre alla produzione di 4-idrossichinolina tramite fluorescenza, anche il consumo di ossigeno.
Grafico 2.16 - Andamento della concentrazione dell’ossigeno in uscita dall’IMER durante un'iniezione di chinuramina.
37
Si può osservare come, contemporaneamente all’uscita del prodotto dall’IMER (Grafico 2.16), si ha anche una variazione dell’ossigeno disciolto nell’eluato, a dimostrazione dell’effettivo consumo dell’ossigeno molecolare da parte dell’enzima per rigenerare la molecola di FAD presente nel sito attivo.
2.3.2 Studio dell’inibizione della MAO-A immobilizzata
In letteratura, sono stati riportati degli studi di questo tipo in cui il sistema IMER è collegato ad un sistema HPLC.
Per il montaggio di questo sistema sono necessarie due pompe HPLC ed una “switching-valve” (Schema 2.4); la presenza della “switching-“switching-valve” permette il funzionamento separato dei due sistemi e quindi l’utilizzo di condizioni diverse per la reazione enzimatica e per l’analisi cromatografica in modo da prevenire la denaturazione dell’enzima nelle condizioni di analisi (pH, solvente, flusso).
Mediante questo sistema sono facilmente analizzabili matrici complesse, come ad esempio l’urina o tessuti biologici, perché, nel passaggio nell’IMER, gli analiti vengono modificati e quindi successivamente possono essere separati o rilevati più facilmente nella colonna cromatografica. pompa 1 IMER pompa 2 colonna analitica detector iniettore switching valve Schema 2.4 – Sistema accoppiato IMER-colonna analitica
Questo tipo di approccio può essere molto utile nei casi di sintesi organica “on-line”, per la purificazione di molecole chirali o per una veloce stima delle condizioni più adeguate per eseguire una reazione enantioselettiva. Attualmente alcuni enzimi come la lipasi, la penicillina G acilasi e la chimotripsina, sono stati utilizzati in questo ambito11 in quanto la loro abilità di idrolizzare stereoselettivamente alcuni legami permette l’ottenimento di miscele enantiomericamente arricchite all’uscita della colonna.
38
2.3.3 Studio dell’inibizione con il substrato chinuramina (2)
In questo studio, la particolare scelta del substrato, la chinuramina, permette di seguire l’attività enzimatica direttamente utilizzando un detector a fluorescenza in quanto solo il prodotto è fluorescente. Questo quindi elimina la necessità del sistema accoppiato con una colonna cromatografica.
Quello che si ottiene iniettando una soluzione di chinuramina ed osservando l’eluato dell’IMER in fluorescenza è quindi un classico cromatogramma, dal quale si possono trarre le informazioni relative alla quantità di 8 presente e quindi all’andamento del processo enzimatico, senza dover effettuare una separazione.
Grafico 2.17 - Cromatogramma ottenuto iniettando una soluzione di chinuramina, registrato in fluorescenza all'uscita dell'IMER
Studi precedenti4 hanno mostrato che gli IMER possono essere usati per valutare “on-line” gli effetti di inibitori sull’attività enzimatica.
Alcune prove preliminari sono state effettuate per valutare l’effetto del DMSO come inibitore per l’enzima. La maggior parte degli inibitori infatti non è molto solubile in acqua e per poter utilizzare delle concentrazioni più elevate è stato necessario preparare soluzioni madre in DMSO. I risultati sono riportati nel Grafico 2.18.
39
Grafico 2.18 - Diminuzione dell'attività dell'IMER in funzione della percentuale di DMSO nel campione.
Si può osservare che fino all’1% di DMSO nel campione, si osserva una diminuzione dell’attività al di sotto del 10% (Grafico 2.18). In tutti i campioni iniettati nell’IMER usati per le curve di inibizione è stata comunque mantenuta una percentuale di DMSO inferiore allo 0.2%.
Sono stati quindi valutati alcuni inibitori conosciuti dell’enzima. Studi precedenti4 hanno dimostrato che la (D)-anfetamina, la (1S,2S)-(+)-pseudo-efedrina e la (1R,2R)-(-)-pseudo-efedrina sono inibitori reversibili, dipendenti dalla concentrazione, per la A e la MAO-B. NH2 12 OH NH OH NH 13 14
Figura 2.5 - Inibitori utilizzati in questo lavoro di tesi. (D)-anfetamina (12), (+)-pseudo-efedrina (13), (-)-pseudo-efedrina (14).
Tali inibitori sono stati studiati utilizzando il sistema IMER-HPLC descritto; sono state costruite curve concentrazione inibitore/inibizione, riportate nei grafici 2.21 e 2.21. Per quanto riguarda la (D)-anfetamina lo studio di inibizione è stato effettuato sia con l’enzima libero che con l’IMER.
40
Grafico 2.19 - Curva di inibizione della (D)-anfetamina ottenuta tramite l'IMER.
Grafico 2.20 - Curva di inibizione della (D)-anfetamina ottenuta con l’enzima libero.
Come si può osservare, l’andamento della curva di inibizione è paragonabile per l’enzima libero e per l’IMER; i valori di IC50iii calcolati sono pari a 17.50 µM per l’enzima libero, 7.1 µΜ per l’enzima immobilizzato.
41
Grafico 2.21 - Curva di inibizione della (+)-pseudo-efedrina ottenuta tramite l'IMER.
Grafico 2.22 - Curva di inibizione della (-)-pseudo-efedrina ottenuta tramite l'IMER.
Per quanto riguarda gli altri inibitori, dai dati ottenuti è possibile confermare un andamento nelle prove di inibizione in accordo con quello già riportato in letteratura4: (D)-anfetamina > (-)-pseudo-efedrina > (+)-pseudo-efedrina.
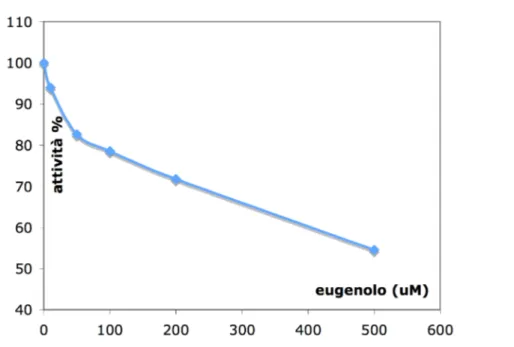
È stato infine valutato l’effetto dell’eugenolo (Figura 2.6, 15), recentemente riportato in letteratura come inibitore della MAO-A.
42
O
HO 15
Figura 2.6 - Struttura dell'eugenolo (15).
Grafico 2.23 - Curva di inibizione dell'eugenolo ottenuta tramite l'IMER.
Anche in questo caso è stato possibile costruire una curva concentrazione/inibizione (Grafico 2.23).
Questi risultati confermano che il sistema MAO-A.IMER.HPLC utilizzato permette di studiare le proprietà catalitiche e l’inibizione di un enzima utilizzando lo stesso campione per numerose prove.
43
2.4 BIBLIOGRAFIA DEL CAPITOLO 2
1 Liu H., Ong S., Glunz L., Pidgeon C. Anal. Chem., 1995, 67, 3550-3557. 2 Ong S., Liu H., Pidgeon C. Journal of Chromatography A, 1996, 728, 113-128.
3 (a) Bundantsev A. Yu. Analytica Chimica Acta, 1991, 249, 71-76; (b) Vela M. H., de Jesus
D. S., Couto C. M. C. M., Araujo A. N., Montenegro M. C. B. S. M. Electroanalysis, 2003,
15, 133-138; (c) Medyantseva È. P., Varlamova R. M., Gimaletdinova D. A., Fattakhova
A. N., Budnikov G. K. Pharmaceutical Chemistry Jurnal, 2007, 41, 341-344.
4 Markoglou N., Hsuesh R., Wainer I. Journal of Chromatography B, 2004, 804, 295-302. 5 Reisner et al., 1975; Fazekes de St. Groth et al. 1963; Sedmack and Grossberg, 1977.
6 Tipton K. F., John R. A. Enzyme Assay, Eisenthal R. and Danson M. J. Ed., Oxford
University Press, New York, 1993.
7 Scheda tecnica Gentest “Human Monoamine Oxidase A (MAO-A) SUPERSOMESTM” 8 Eisenhofer G., Kopin I. J., Goldstein D. S. Pharmacological Reviews, 2004, 56, 331-349 9 Voet, Voet, Pratt Fondamenti di Biochimica.
10 Girelli A. M., Mattei E. Journal of Chromatography B, 2005, 819, 3-16.
11 (a) Bertucci C., Petri A., Felix G., Perini B., Salvadori P., Tetrahedron Asym., 1999, 10,
4455. (b) Calleri E., Temporini C., Furlanetto S., Loiodice F., Fracchiolla G., Massolini G.,
J. Pharm. Biomed. Anal., 2003, 32, 715. (c) Massolini G., Calleri E., Lavecchia A.,
Loiodice F., Lubda D., Temporini C., Fracchiolla G., Tortcialanza P. Anal. Chem., 2003,