Introduzione
I tannini sono composti polifenolici di origine vegetale largamente distribuiti in natura. Si ritrovano nella corteccia di molti alberi (quercia, castagno, mimos a) ed in molti frutti. Bate-Smith1ha definito i tannini come “composti fenolici solubili in acqua, con massa molecolare compresa tra 500 e 3000, che forniscono le reazioni classiche dei fenoli ed hanno proprietà di precipitare gli alcaloidi, la gelatina e altre proteine”. L’uso tradizionale dei tannini per convertire le pellicce animali in pelle (“concia” delle pelli) riflette la proprietà principale dei tannini, cioè quella di precipitare le proteine, come quelle presenti nelle pelli animali (ad es. il collagene). Il termine “tannino” deriva dall’antica traduzione celtica per “quercia”, la cui corteccia era uno degli agenti più diffusi all’epoca per la concia delle pelli. Questa proprietà ci permette di distinguere i tannini dagli altri composti polifenolici presenti nel mondo vegetale (flavonoidi, derivati dell’acido benzoico, etc.), che invece ne sono privi. Ad ogni modo, anche altre caratteristiche riguardanti la reattività chimica (capacità di legare ioni Fe2+) e l’attività biologica (l’alto potere antiossidante) sono caratteristiche di questa classe di polifenoli2.
Dal punto di vista chimico, i tannini sono polifenoli che si possono distinguere in due grandi famiglie: i tannini idrolizzabili ed i tannini condensati.
I tannini idrolizzabili sono derivanti dell’acido gallico (acido 3,4,5 triidrossibenzoico, fig. 1).
fig. 1
L’acido gallico vieneesterificatocon i gruppi ossidrile di uno zucchero o di un polialcool, che costituisce il nucleo centrale, e i residui galloilici possono essere ulteriormente esterificati o legati ossidativamente per fornire tannini idrolizzabili ulteriormente complessi. Il termine “idrolizzabili” deriva dal fatto che l’idrolisi in condizioni fortemente acide rompe i legami esterei, producendo acido gallico ed il poliolo centrale.I gallotannini, che costituiscono i tannini idrolizzabili più semplici, sono esteri poligalloilici del glucosio (o, più raramente, di altri polialcoli). Il gallotannino prototipo è rappresentato dal pentagalloil-glucosio o PGG (fig. 2), presente in grandi quantità nella galla turca (galle di Quercus infectoria L.).
fig. 2
Gallotannini semplici, con un numero di gruppi galloilici fino a 12 ed il glucosio centrale, si ritrovano nei tannini della galla turca, della galla cinese (galle di Rhus semialata) e della galla sumac (foglie di Rhus coriaria), che vengono impiegate per la concia3. Miscele di gallotannini di questo tipo prendono il nome, in generale, di acido tannico. Nonostante alcune fonti commerciali indichino una massa molare di riferimento (1294 g/mole) per l’acido tannico, tali preparati sono spesso campioni eterogenei costituiti da miscele di gallotannini.
L’accoppiamento ossidativo di due gruppi galloilici converte i gallotannini nei relativi ellagitannini. Due molecole di acido gallico producono l’acido esaidrossidifenico tramite legame C-C intermolecolare, che lattonizza spontaneamente in acido ellagico (fig. 3).Esempi di ellagitannini semplici sono l’eugeniina, la casuarictina, etc. Gli ellagitannini possono subire rottura ossidativa degli anelli formatisi, oppure andare incontro a polimerizzazione, e fornire ulteriori derivati. La corteccia di quercia (Quercus ruber L.) e di castagno (Castanea sativa L.) contiene grandi quantità di ellagitannini.
Diverse fonti naturali di tannini utilizzati per la concia contengono principalmente ellagitannini (tannini di quercia, castagno, myrobalan)3-5.
I tannini condensati (o proantocianidine) sono polimeri di flavanoidi, composti fenolici con struttura a tre anelli (fig. 4) appartenenti alla famiglia dei flavonoidi. I tannini condensati maggiormente studiati e diffusi sono costituiti dai flavan-3-olimonomeri (-)-epicatechina e (+)-catechina.
fig. 4
L’addizione di un terzo gruppo fenolico sull’anello B, invece, fornisce la (-)-epigallocatechina e la (+)-gallocatechina. I tannini condensati più caratteristici si formano tramite il legame C4-C8 intermolecolare, anche se nei tannini di diverse specieè presenteil legame C4-C6. Il termine proantocianidinerisulta più corretto dal punto di vista strettamente chimico poiché tali polifenoli condensati, in seguito a rottura ossidativa in presenza di acidi minerali, forniscono i pigmenti antociani. Tale reazione può avvenire a caldo, come ad esempio
nella reazione con butanolo-HCl. Questa reazione costituisce un saggio per la determinazione dei tannini condensati totali in un campione contenente polifenoli(fig. 5).
I tannini condensati di origine vegetale che vengono utilizzati nell’industria conciaria sono quelli ricavati da mimosa, quebracho, gambier, etc3. Le proantocianidine sono metaboliti secondari molto diffusi nel regno vegetale, e se ne trovano quantità anche significative in molte piante alimentari come il cacao, il caffè, il tè verde, le olive, i frutti minori (more, lamponi, ribes, uva) ed altri frutti (mela, banana), nonché in alimenti derivati, quali il vino e l’olio. Hanno attività antiossidante piuttosto pronunciata, agendo come molecole “radical scavenging” grazie all’equilibrio redox molto favorevole, e l’importanza di questi costituenti e l’attenzione nei loro confronti è aumentata sensibilmente negli ultimi anni grazie all’evidenza che la loro assunzione nella dieta è in correlazione con diversi effetti terapeutici o preventivi sull’organismo umano, quali:l’abbassamento dei livelli di colesterolo sanguigno, la protezione dei vasi, il trattamento delle infezioni delle vie urinarie, la conservazione dell’acuità visiva, la prevenzione di ictus o infarti6-9. Alcuni farmaci e integratori presenti sul mercato contengono frazioni di proantocianidine (o altri polifenoli di tipo flavonoidico) derivanti da mirtillo rosso, mirtillo nero, vite ed altri.
I tannini costituiscono una famiglia ampia ed eterogenea di composti polifenolici; inoltre, la loro ampia distribuzione nel regno vegetale e l’importanza che rivestono nell’industria conciaria così come nell’alimentazione, nella nutraceutica e nell’industria di produzione di derivati quali il vino, che talvolta possiedono un valore commerciale rilevante, sono riportati in letteratura. Questo presuppone lo sviluppo di metodiche analitiche che consentano, nei diversi ambiti ed a seconda della necessità, la determinazione del maggior numero possibile di componenti polifenolici presenti nella matrice analizzata, o viceversa, il riconoscimento dei componenti caratteristici e/o fondamentali tramite un approccio semi-quantitativo di tipo “fingerprinting”. L’elevato numero di composti polifenolici, presenti anche in forma di isomeri, che sirileva negli estratti contenenti tannini idrolizzabili o proantocianidine, rende spesso complicate le analisi e comporta l’applicazione di ulteriori frazionamenti , generalmente di tipo cromatografico, per la caratterizzazione approfondita di una matrice naturale ma anche sintetica, come quella rappresentata da alcuni tannini sintetici che si sono diffusi nel mercato come alternativa a basso costo dei tannini da concia na turali. Come esempio di tale complessità, si consideri che un estratto di mirtillo nero ha mostrato la presenza di
proantocianidine con grado di polimerizzazione fino a 120 unità; inoltre, si ritiene che la buccia d’uva, i vinaccioli ed il vino rosso contengano proantocianidine con grado di polimerizzazione anche superiore a 200 unità.
Introduzione ai metodi analitici per i tannini
L’interesse verso lo sviluppo di metodiche analitiche per la determinazione dei tannini idrolizzabili e delle proantocianidine può trovare applicazione nel campo della fitochimica, ad esempio per lo studio dei tannini presenti in piante non ancora studiate, nel campo della chimica alimentare, per verificare la qualità di un tè o effettuare la caratterizzazione di un vino rosso, e nel campo dell’industria conciaria, per stabilire la qualità di un tannino da concia ed, eventualmente, consentire il riconoscimento di un tannino sintetico.
La letteratura riporta molti esempi di determinazione dei tannini idrolizzabili e delle proantocianidine da estratti naturali. Le tecniche maggiormente utilizzate in questo ambito sono la cromatografia liquida ad alta prestazione (HPLC), con applicazioni in fase diretta, in fase inversa ed in modalità HILIC, e la cromatografia su strato sottile (TLC), ma sono state riportate determinazioni anche tramite NMR.
Ziwicki e colleghi hanno utilizzato l’HPLC in fase inversa (C18) accoppiata alla spettrometria di massa con ionizzazione electrospray (ESI-MS/MS) per l’analisi di due agenti di concia commerciali (canniccio, contenente tannini condensati, e castagno, contenente tannini idrolizzabili) e delle acque di scarico della conceria dove sono stati utilizzati5. Le analisi sono state effettuate su colonna a fase inversa Hypersil ODS (125 x 3 mm, granulometria 3 μm) con flusso della fase mobile di 0.5 ml/min e temperatura della colonna 40°C, utilizzando un eluizione in gradiente binario costituito da acqua (A) e metanolo(B), entrambi con aggiunta di acido formico 0.1 %. La rivelazione MS viene effettuata da detector a triplo quadrupoloin modalità MRM (“multiple reactionmonitoring”). L’analisi per infusione diretta ha permesso il riconoscimento, nel tannino di canniccio, di proantocianidine oligomeriche (fino al pentamero) basate sullo scheletro della catechina e della gallocatechina, mentre il tannino di castagno ha rivelato la presenza di acido gallico, mono-, di- e tri-galloil-glucosio, acido ellagico e gli ellagitanninicastalagina, vescalagina, castalina e vescalina. Nell’analisi cromatografica accoppiata alla spettrometria di massa, gli autori sottolineano come la mancanza di separazione cromatografica che si osserva per entrambi gli estratti analizzati è compensata dall’alta selettività che fornisce la rivelazione in modalità MRM.
Romani e collaboratori hanno descritto l’analisi di un estratto di corteccia di pino (Pinus Maritima L.) e di un estratto di acido tannico tramite HPLC utilizzando sia la fase normale che la fase inversa10. L’analisi in fase normale è stata condotta su colonna Supelcosil LC -Si (250 x 4.6 mm) con eluizione in gradiente composto da due fasi, la fase A (MeOH/HCOOH/H2O 97:2:1) e la fase B(CH2Cl2/MeOH/HCOOH/H2O 83:14:2:1) al flusso di 0.75 ml/min (durata 50 min). L’analisi in fase inversa è stata effettuata su colonna Li Chrosorb RP-18 (250 x 4.6 mm, granulometria 5 μm) con eluizione in gradiente composto da H20 acidificata (pH 3.2 per H3PO4) e acetonitrile al flusso di 1.0 ml/min (durata 106 min). La rivelazione avviene con detector DAD e detector di massa ESI-MS. Gli autori sottolineano come l’analisi in fase invers a produca cromatogrammi complessi per entrambi gli estratti che non consentono la separazione dei tannini idrolizzabili e gli oligomeri dei tannini condensati maggiori del trimero. L’analisi in fase diretta ha consentito la separazione dei monomeri e degli oligomeri delle proantocianidine(fino all’eptamero) nell’estratto di pino in base al peso molecolare (o grado di polimerizzazione), mentre ha permesso la separazione dei galloil-esteri del glucosio nel campione di acido tannico in base al grado di galloilazione.
Lea e colleghi hanno determinato la presenza di proantocianidine oligomeriche in due campioni di vino bianco (Seyval, Muller-Thurgau) tramite cromatografia su strato sottile ad alta prestazione (HP-TLC)11. Le analisi sono state effettuate su lastrine in gel di silice già pronte, utilizzando una miscela eluente toluene/acetone/acido formico (30:30:10). La separazione ottenuta viene visualizzata all’UV e con vapori di iodio, e parallelamente, con una soluzione di diazo-p-nitroanilinafluoroborato o di ferricianuro di potassio. L’analisi porta al riconoscimento di proantocianidine oligomeriche con grado di polimerizzazione fino all’esamero, con separazione in base al grado di polimerizzazione, ma si nota la presenza di strutture a grado di polimerizzazione superiore.
Un'alternativa alla cromatografia in fase diretta ed in fase inversa che negli anni si è dimostrata molto utile per la separazione delle molecole organiche polari o molto polari è rappresentata dalla “cromatografia ad interazioni idrofiliche” o HILIC (“HydrophylicInteraction Liquid Chromatography”). Il termine fu coniato da Alpert, che utilizzò questa modalità cromatografica per la separazione di peptidi, oligonucleotidi, aminoacidi e carboidrati12. Concettualmente, il meccanismo della cromatografia ad interazioni idrofiliche è ”la ripartizione
di analiti polari tra la fase mobile e uno strato di fase mobile arricchito di acqua e parzialmente immobilizzato sulla fase stazionaria”. Nella pratica, la separazione in modalità HILIC si realizza con l'interazione tra una fase stazionaria polare, costituita da silice semplice o diversamente funzionalizzata (con gruppi aminopropile, ciano, diolo o altri) e una fase mobile anch’essa polare, costituita da una componente acquosa e una componente organica; una parte della componente acquosa viene “immobilizzata” sulla fase stazionaria, e costituisce lo strato attivo ai processi di ripartizione con la fase mobile; la ritenzione di un composto in colonna aumenta all'aumentare della sua polarità, grazie ad una maggiore interazione con lo strato acquoso adsorbito sulla fase stazionaria. In contrasto con la cromatografia in fase inversa, l'eluizione dei composti è facilitata dall'aumento della frazione acquosa nella fase mobile; il meccanismo di separazione si basa su interazioni di tipo opposto a quelle che caratterizzano la fase inversa, offrendo pertanto una selettività complementare a quest'ultima. Tipicamente, infatti, l'ordine di eluizione è opposto a quello che si ottiene con la fase inversa. Essa differis ce anche dalla cromatografia in fase diretta, poiché nella cromatografia HILIC vengono utilizzate quantità di acqua nella fase mobile relativamente alte (5 – 50 %), che risultano incompatibili con la silice non funzionalizzata che normalmente si utilizza come materiale adsorbente nella cromatografia in fase diretta.
La ripartizione liquido/liquido tra fase mobile “libera” e fase mobile “intrappolata” come sopra descritta è stata proposta come fattore principale per la ritenzione degli analiti nella cromatografia HILIC: le molecole non interagirebbero direttamente con la fase stazionaria, nonostante ci sia evidenza che i fenomeni di adsorbimento superficiale abbiano un ruolo nel trattenere i composti. Inoltre i composti basici, ionizzabili a pH acido, possono partecipare allo scambio cationico, aumentando la loro ritenzione (fig. 1). Ad ogni modo, il meccanismo di ritenzione in HILIC non è ancora stato chiaramente stabilito, a causa delle interazioni che si vengono a creare tra gli analiti e gli ioni presenti nelle fasi mobili tamponate, il solvente organico, i residui silanolici e le funzioni presenti sulla fase stazionaria, etc.13.
L'ambiente acquoso presente nella modalità HILIC può costituire un vantaggio per la solubilità di molte sostanze biologicamente importanti. Inoltre, le molecole dotate di scarsa polarità e idrofilicità non vengono trattenute dalla fase stazionaria, pertanto gli analiti polari di interesse del ricercatore possono essere separate e quantificate senza l'applicazi one di fasi preliminari di pulizia del campione (ripartizione liquido/liquido, estrazione in fase solida o SPE, cromatografia semi-preparativa, etc.) che necessariamente comportano un minor recupero degli analiti e una maggiore durata dell'intero processo analitico.
Alcune pubblicazioni riportano applicazioni della cromatografia HILIC all'analisi di composti polari quali catechine e proantocianidine, vitamine, peptidi, carboidrati, etc.; le ditte produttrici di colonne cromatografiche HILIC forniscono proce dure di sviluppo del metodo e note applicative riguardanti la separazione di diverse famiglie chimiche di composti polari (Phenomenex, SUPELCO)14-16.
Yanagida e colleghi hanno effettuato la separazione delle proantocianidine presenti nella buccia di mela in funzione del grado di polimerizzazione tramite cromatografia liquida ad interazioni idrofiliche (HILIC)14. L’analisi avviene con un sistema HPLC con colonna TSK-gel
Fig. 1: rappresen tazione sch ema tica della ripartizione dei composti tra fase mobile e fase stazionaria nella
Amide (250 x 4.6 mm, granulometria 5 μm) sia con eluizione isocratica, utilizzando una miscela eluente acetonitrile/acqua (84:16) sia con eluizione in gradiente composto da acqua (A) e acetonitrile (B); la rivelazione dei composti avviene tramite detector UV-DAD. Entrambe le metodiche utilizzate consentono il riconoscimento delle proantocianidine oligomeriche con grado di polimerizzazione fino a 20, che eluiscono in base al peso molecolare ed al grado di polimerizzazione.
Scopo del lavoro
La complessità delle componenti fenoliche presenti in un campione vegetale e la difficoltà nei processi di estrazione e purificazione di queste frazioni rende conto della complessità che spesso caratterizza questi estratti. Da questo nascono problematiche di tipo analitico, tra cui la possibilità di conferire un’impronta digitale (“fingerprinting”) agli estratti in esame. Lo sviluppo di metodiche analitiche semplici e che consentano la valutazione, ad esempio, di un tannino da concia naturale o sintetico, così come la caratterizzazione o l’eventuale sofisticazione di un vino rosso, potrebbe essere di grande aiuto a certi settori dell’industria conciaria o alimentare, ed avere delle implicazioni commerciali ed economiche importanti.
Lo scopo di questo lavoro è stato quello di verificare la possibilità di stabilire la composizione di alcuni tannini commerciali sia di tipo idrolizzabile che condensati tramite l’uso della tecnica HPLC. Lo sviluppo del metodo sarebbe stato condotto tramite l’uso di differenti fasi stazionarie, in particolare attraverso la cromatografia ad interazioni idrofiliche (HILIC) e la cromatografia di adsorbimento in fase inversa (RP-HPLC). L’obiettivo è stato quello di analizzare le suddette matrici attraverso un approccio analitico di tipo “fingerprinting” e, ove fosse possibile, l’identificazione dei singoli componenti.
I tannini commerciali in nostro possesso sono stati:
Galla Turca Galla Cinese Castagno Quercia Catechu Gambier Mimosa Vinaccioli Buccia d’uva
Quebracho
Secondo quanto indicato dalla letteratura, i campioni di Galla Turca e Galla Cinese contengono principalmente acido gallico e gallotannini, mentre Castagno e Quercia contengono principalmente acido gallico, acido ellagico ed ellagitannini; Catechu, Gambier, Mimosa, Quebracho, Vinaccioli e Buccia d’Uva esprimono principalmente catechine monomere e tannini di tipo condensato.
Sviluppo dei metodi cromatografici HPLC per i tannini
Cromatografia HILIC
Nello studio effettuato si è cercato di valutare il comportamento in cromatografia ad interazioni idrofiliche (HILIC) di alcuni composti di riferimento per i tannini idrolizzabili e condensati, utilizzando la colonna Luna HILIC 5 µm (150 x 4.6 mm).
I composti di riferimento utilizzati sono:
1) acido gallico 2) (+)-catechina 3) acido tannico
E’ stata preparata una soluzione madre di ogni composto di riferi mento e relative diluizioni, in acetonitrile/acqua 90:10:
acido gallico 1040 ppm (diluizioni 104 ; 10.4 ppm)
(+)-catechina 2130 ppm (diluizioni 213 ; 21.3 ppm)
acido tannico 3688 ppm (diluizioni 922 ; 92.2 ppm)
Nelle fasi iniziali, sono state effettuate alcune prove sui composti standard secondo le condizioni applicate da Yanagida e coll.1, che nello studio hanno usato, in modalità HILIC, una colonna TSKgel Amide-80; 250 x 4.6 mm, 5 um. Nel lavoro citato, vengono riportate due diverse condizioni di separazione dei composti (proantocianidine monomeriche e oligomeriche): tramite eluizione isocratica con miscela acetonitrile/acqua 84:16 e tramite gradiente lineare (da una miscela acetonitrile/acqua 90:10 ad una 50:50 in 60 min), entrambe con flusso 1.0 ml/min. Entrambe le eluizioni consentono la separazione delle proantocianidine in base al grado di
polimerizzazione. Un gradiente lineare analogo (miscele acetonitrile/acqua, da 90:10 a 50:50 in 7.5 min) viene proposto anche da PHENOMENEX come gradiente di riferimento per la valutazione del grado di ritenzione degli analiti nella colonna HILIC di sua produzione.
Nel nostro studio, il comportamento dei tre standard di riferimento è stato valutato tramite eluizione isocratica con miscele acetonitrile/acqua 84:16, 90:10 e con percentuale di acqua inferiore (92:8, 93:7, 94:6, 95:5), sempre con flusso di 1.0 ml/min. Inoltre, è stato applicata anche un eluizione tramite il gradiente suggerito da Phenomenex, che risulta così costituito:
Tab. 1
Tempo (min) Flusso (ml/min) %fase organica % fase acquosa
0,00 1.0 90 10
2,50 1.0 90 10
10,00 1.0 50 50
12,50 1.0 50 50
15,00 1.0 90 10
Rispetto alle condizioni proposte1, della durata complessiva di 1 h, è stato scelto di lavorare inizialmente con un gradiente di durata più breve per consentire risparmio di tempo (il gradiente adottato è corrispondente alle condizioni suggerite da Phenomenex).
Infine, va detto che gli standard di acido gallico e catechina dovrebbero fornire un solo picco, mentre l’acido tannico dovrebbe fornire più picchi, relativi a composti costituiti da diversi gradi di galloilazione del glucosio, e quindi a composti con diverso numero di gruppi ossidrile e dotati di tempo di ritenzione, almeno ipoteticamente, significativamente diverso.
Nel corso dello studio, sono stati analizzati anche alcuni campioni di tannini commerciali di origine vegetale. Tra questi, alcuni sono costituiti prevalentemente da componenti
idrolizzabili (Galla turca, Galla cinese), mentre altri esprimono prevalentemente componenti condensati (Vinaccioli, Gambier). Nei primi, quindi, è lecito ipotizzare la presenza di acido gallico, acido ellagico ed acido tannico, mentre nei secondi la presenza di proantocianidine, di cui la (+)-catechina (e le relative forme galloilate) costituisce il monomero. Questi campioni, come i composti standard, sono stati disciolti in una miscela acetonitrile/acqua 90:10.
I tannini commerciali in nostro possesso sono stati:
Galla Turca Galla Cinese Catechu Gambier Mimosa Castagno Vinaccioli Buccia d’uva Quercia Quebracho
Vediamo il comportamento dei composti di riferimento nelle diverse condizioni cromatografiche adottate.
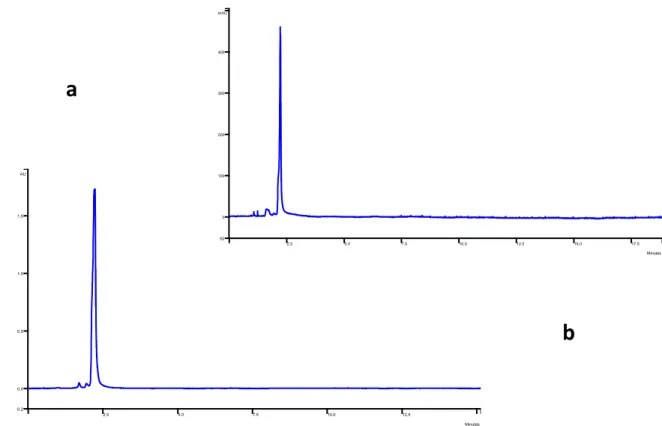
Applicando l’eluizione isocratica con miscela eluente acetonitrile/acqua 84:16, l’analisi dell’acido gallico 104 ppm mostra due picchi parzialmente s ovrapposti (Rt = 1.7 e 2.1 min), mentre la soluzione 10.4 ppm mostra un picco a Rt = 1.7 ed un picco sovrapposto a Rt = 2.2 min che tende a scodare (fig. 1 a – b).
La catechina, sia nella soluzione 21.3 ppm che in quella 213 ppm, mos tra un picco unico a Rt = 2.2 min (fig. 2 a - b) dopo eluizione isocratica con miscela acetonitrile/acqua 84:16.
2.5 5.0 7.5 10.0 12.5 Minutes -0.2 0.0 0.5 1.0 1.5 AU 1 2 3 4 5 6 7 Minutes -27 0 50 100 150 200 mAU 2.5 5.0 7.5 10.0 12.5 Minutes -11 0 25 50 75 100 125 150 mAU
Fig. 1: cromatog rafia HILIC di una soluzione standard di acido gallico 10.4 ppm (a) e 104 ppm (b) tramite
eluizione in isocratica ACN-H2O (84:16)
a
b
Fig. 2: cromatog rafia HILIC di una soluzione standard di (+)-catechina 21.3 ppm (a) e 213 ppm (b). eluizione in isocratica ACN-H2O (84:16)
a
b
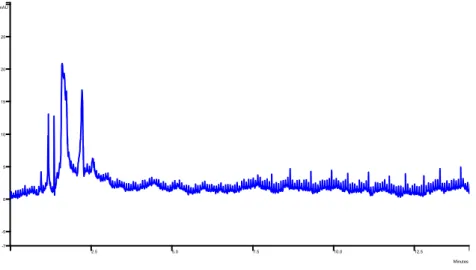
2.5 5.0 7.5 10.0 12.5 15.0 17.5 Minutes -52 0 100 200 300 400 mAUL’acido tannico (soluzione 92.2 ppm) mostra una serie di picchi, alcuni dei quali non completamente risolti, con Rt compresi tra 1.2 min e 2.2 min, quando analizzato in condizioni isocratiche con miscela eluente acetonitrile/acqua 84:16 (fig. 3); non si notano altri picchi, o perché rimasti in colonna o perché la soluzione risultava troppo diluita.
L’analisi in eluizione isocratica con percentuale di acqua del 16 % mostra tempi di ritenzione molto bassi per i composti standard considerati; per questo motivo, si è cercato diaumentare il grado di ritenzione e separazione dei composti diminuendo la percentuale di acqua al 8 %.
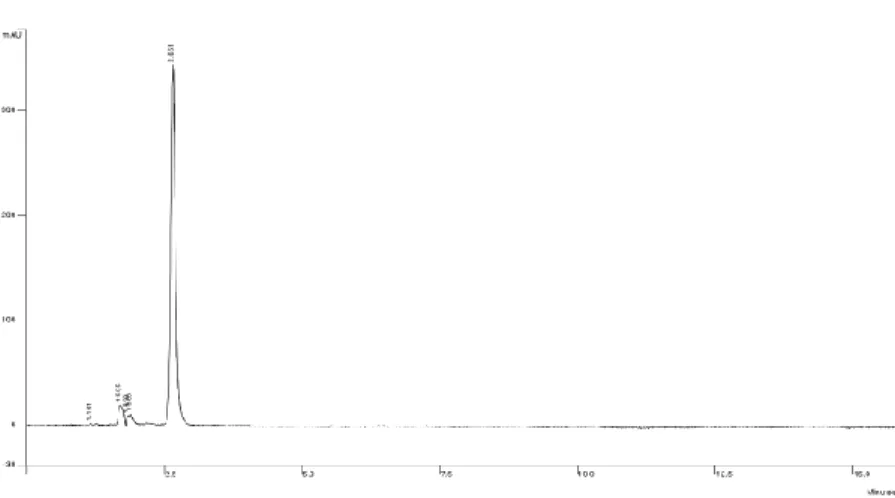
L’eluizione isocratica con la miscela 92:8 dell’acido gallico comporta la formazione di un picco a Rt = 2.6 min (fig. 4).
Fig. 3: cromatog rafia HILIC, di una soluzione standard di acido tannico 92.2 ppm, eluizion e in isocratica ACN-H2O
(84:16). 2.5 5.0 7.5 10.0 12.5 Minutes -7 -5 0 5 10 15 20 25 mAU
Con la miscela eluente acetonitrile/acqua 92:8, invece, la catechina presenta un picco a Rt = 2.7 min (fig. 5).
Fig. 4: cromatog rafia HILIC di una soluzione standard di acido gallico 104 ppm. tramite eluizione in isocratica
ACN-H2O (92:8)
Fig. 5: cromatog rafia HILIC di una soluzione standard di (+)-catechina 213 ppm, eluizione in isocratica
L’analisi dell’acido tannico nella soluzione a 3688 ppm con miscela acetonitrile/acqua 92:8 mostra un gruppo di picchi compresi tra Rt = 1.7 e 4.6 min, un picco a Rt = 17.2 min, un picco poco risolto a Rt = 23.5 min e due gruppi di picchi sovrapposti, uno con tempi compresi tra 32.1 e 35.0 min, ed uno con tempi tra 46.0 e 54.3 min (fig. 6 a). Questo sembrerebbe confermare i presupposti della separazione in base al grado di “polimerizzazione” (ossidrilazione). La stessa eluizione è stata effettuata successivamente con flusso aumentato a 1.5 ml/min, allo scopo di diminuire i tempi e ottenere una risoluzione accettabile dei picchi presenti nell’acido tannico. Infatti, iniettando una soluzione 922ppm, tutti i picchi corrispondenti a quelli osservati nelle condizioni precedenti escono entro i 35 minuti, anche se a tempi ulteriormente maggiori si osservano altri due “picchi” dal profilo molto slargato (fig. 6 b). Aumentando ulteriormente il flusso a 2.0 ml/min, tutti i picchi suddetti escono entro i 25 min, e a tempi di ritenzione maggiori si nota l’eluizione di altri componenti (fig. 6 c).
a
b
c
Fig. 6: cromatog rafia HILIC di una soluzione standard di acido tannico 4160 ppm (a) e 2080 ppm (b), eluizione in isocratica ACN-H2O (92:8) a flusso 1.0 ml/min(a), 1.5 ml/min (b) e 2.0 ml/min .(c).
Inoltre, in seguito all’eluizione in gradiente, l’acido gallico mostra un picco principale a Rt = 2.6 min, preceduto da uno più piccolo a Rt = 1.8 min (fig. 7).
Con l’eluizione in gradiente, la catechina 21.3 ppm mostra un picco unico a Rt = 2.5 min (fig. 8).
Fig. 7: cromatog rafia HILIC di una soluzione standard di acido gallico 104 ppm, eluizione in gradiente
Iniettando la soluzione madre più concentrata (3688 ppm) con l’eluizione in gradiente, l’acido tannico mostra 6 picchi parzialmente sovrapposti, con tempi di ritenzione compresi tra 7.4 e 10.2 min (fig. 9).
La separazione dei componenti dell’acido tannico che si ottiene sia con le eluizioni isocratiche sia con l’eluizione in gradiente può effettivamente riflettere la presenza di composti a diverso grado di polimerizzazione dei residui galloilici, e la parziale capacità della colonna di risolvere tale miscela.
Come si può vedere dalle prove effettuate finora sui composti standard, l'utilizzo di una percentuale inferiore di acqua nella porzione iniziale del metodo cromatografico (8 % invece che 16 %) consente una maggiore, seppur esigua, ritenzione dell'acido gallico e della catechina; l'effetto è molto più marcato, invece, per l'acido tannico, poiché aumenta in modo notevole la ritenzione dei propri componenti,consentendo una loro migliore, seppur parziale, separazione.In altre parole, è possibile modulare significativamente la ritenzione dei
componenti dell'acido tannico variando la percentuale di acqua da 16 a 8 %, mentre per l'acido gallico e la (+)-catechina l’effetto è molto minore.
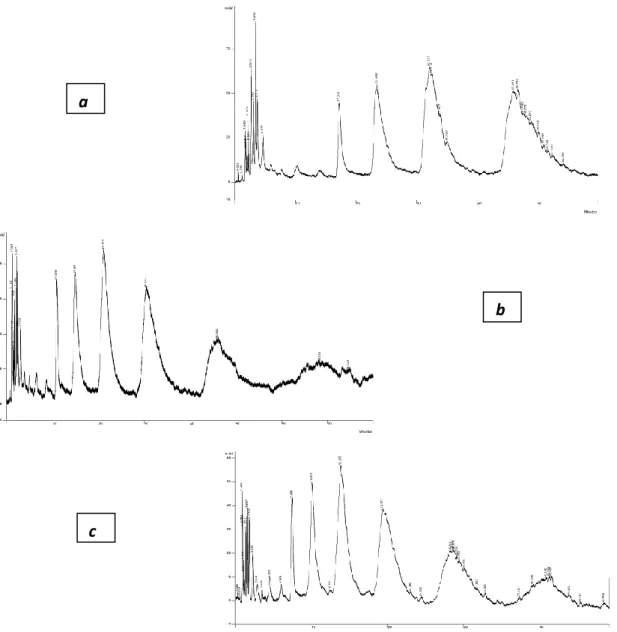
I campioni di tannini commerciali in nostro possesso sono stati analizzati in condizioni isocratiche, utilizzando le miscele eluenti acetonitrile/acqua 84:16 (flusso 1.5 ml/min), 90:10 (flusso 1.0 e 1.5 ml/min), 92:8 (flusso 1.5 ml/min) e 95:5 (flusso 1.0 ml/min). Le figure 10-12 mostrano i cromatogrammi relativi alle analisi dei campioni di galla turca, mimosa e gambier, rispettivamente, a flusso 1.5 ml/min.
Fig. 10: cro matografia HILIC di una soluzione di tannino commerciale “Galla Tu rca ” (498 ppm), eluizione in isocratica a flusso 1.5 ml/min con miscela ACN-H2O 84:16 (a), con miscela ACN-H2O 90:10 (b) e con
miscela ACN-H2O 92:08 (c).
a
c
b
2.5 5.0 7.5 10.0 12.5 15.0 17.5 Minutes -8 0 10 20 30 40 50 60 mAU2.5 5.0 7.5 10.0 12.5 15.0 17.5 Minutes -5 0 5 10 15 20 mAU
Fig. 11: cro matografia HILIC di una soluzione di tannino commerciale “Mimosa ” (491 ppm), eluizione in isocratica a flusso 1.5 ml/min con miscela ACN-H2O 84:16 (a), con miscela ACN-H2O 90:10 (b) e con miscela
ACN-H2O 92:08 (c).
a
b
Fig. 12: cromatog rafia HILIC di una soluzione di tannino commerciale “Gambier” 555 ppm eluizione in isocratica a flusso 1.5 ml/min con miscela ACN-H2O 84:16 (a), con miscela ACN-H2O 90:10 (b) e con miscela
ACN-H2O 92:08 (c).
a
c
b
2.5 5.0 7.5 10.0 12.5 15.0 17.5 Minutes -0.11 0.00 0.25 0.50 0.75 1.00 AULa diminuzione della percentuale di acqua dal 16 all’8 % comporta un aumento significativo della ritenzione di alcuni componenti per il tannino di mimosa e di galla turca: questo induce a ipotizzare la presenza di acido tannico al loro interno, oltre a componenti a bassa ritenzione come, per esempio, l’acido gallico o l’acido ellagico. Questo è coerente con quanto riportato in letteratura per tali estratti tannici.
Un aumento di ritenzione così marcato non si osserva per i componenti del tannino di gambier. Tale comportamento è coerente con la presenza di catechine libere o galloilate (gallocatechina, epigallocatechina), come riportato dalla letteratura. La diminuzione del flusso dell’eluente comporta, in tutti i casi, un aumento dei tempi di ritenzione.
Utilizzando, invece, il valore di flusso di1.0 ml/min e l’eluizione isocratica con miscela acetonitrile/acqua 90:10 il cromatogramma mostra una migliore separazione dei picchi presenti (fig. 13).
a
b
c
Fig. 13: cromatog rafia HILIC di una soluzione di tannino co mmerciale “Galla Turca” 498 ppm (a) , “Mimosa”
491 ppm (b) e “Gambier” 555 ppm (c) tramite eluizione in isocratica a flusso 1 .0 ml/min con miscela ACN-H2O
Diminuendo ulteriormente la percentuale di acqua nella fase mobile al 5 %, si ottiene un aumento dei Rt, che comporta una migliore separazione dei composti con Rt bassi ma provoca una perdita di selettività per quelli con Rt via via superiori, che tendono a strisciare e produrre picchi molto slargati (fig. 14)
a
b
c
Fig. 14: cromatog rafia HILIC di una soluzione di tannino co mmerciale “Galla Turca” 498 ppm (a) , “Mimosa”
491 ppm (b) e “Gambier” 555 ppm (c) tramite eluizione in isocratica a flusso 1 .0 ml/min con miscela ACN-H2O
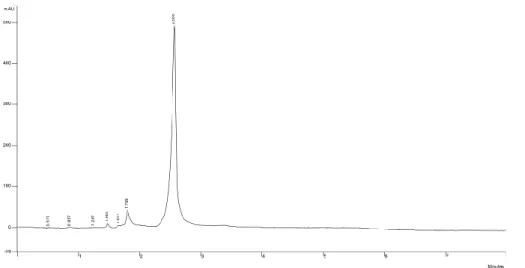
L'eluizione con H2O al 10 % a fl. 1.0 ml/min è stata utilizzata per verificare la solubilità dell'estratto di buccia d'uva, che tra i campioni in nostro possesso aveva evidenziato problemi di solubilità in ACN/H2O 90:10. Sono state preparate soluzioni 1000 ppm in MeOH, H2O e dimetilsolfossido (DMSO), tutte caratterizzate dalla presenza di un residuo insolubile, e centrifugate; le analisi dei surnatanti ottenuti sono riportate in figura 15, e si apprezza come il DMSO fornisce l'assorbanza maggiore nella prima porzione del tracciato.
Fig. 15: cro matografia HILIC, eluizione in isocratica ACN-H2O (90:10) di soluzioni di tannino commerciale
“Buccia d’uva”, 1000 ppm in diversi solven ti.Blu: ACN-H2O 90-10; Rosso: MeOH; Verde: H2O;
La fase mobile acetonitrile/acqua 90:10 con flusso 1.0 ml/min si è rivelata la migliore per ottenere una risoluzione sufficiente dei picchi principali presenti nei tre estratti analizzati, in modo da ottenere un profilo che possa costituire un valido fingerprint dell’estratto. In queste condizioni è stato verificato il comportamento di tutti gli estratti in nostro possesso, e le analisi sono monitorate a 230 nm (fig. 16-22).
Fig. 16: croma tografia HILIC di una soluzione di tannino commerciale “Quercia ” 463 ppm tramite eluizione in isocratica a flusso 1.0 ml/min con miscela ACN-H2O 90:10.
Fig. 17: cro matografia HILIC di una soluzione di tannino co mmerciale “Queb racho ” 534 ppm tramite eluizione
in isocratica a flusso 1.0 ml/min con miscela ACN-H2O 90:10.
Fig. 18: cromatog rafia HILIC di una soluzione di tannino commerciale “Buccia d’uva ” 514 ppm tramite
Fig. 19: croma tografia HILIC di una soluzione di tannino commerciale “Catechu” 534 ppm tramite eluizione in isocratica a flusso 1.0 ml/min con miscela ACN-H2O 90:10.
10 20 30 40 50 Minutes -46 0 50 100 150 200 250 300
mAU c:\star\data\enrico\tannini\ii° set - marzo (tannini comm.)\25-03\castag534 90-10 1.0.run
Fig. 20: croma tografia HILIC di una soluzione di tannino commerciale “Castagno” 534 ppm tramite eluizione in isocratica a flusso 1.0 ml/min con miscela ACN-H2O 90:10.
5 10 15 20 25 30 Minutes -18 0 25 50 75 100
mAUc:\star\data\enrico\tannini\ii° set - marzo (tannini comm.)\25-03\gallaci484 90-10 1..run
WI:32 WI:64
Fig. 21: cromatog rafia HILIC di una soluzion e di tannino co mmerciale “Galla cinese” 484 ppm tramite eluizione
in isocratica a flusso 1.0 ml/min con miscela ACN-H2O 90:10.
Fig. 22: cromatog rafia HILIC di una soluzion e di tannino co mmerciale “Galla cinese” 484 ppm tramite eluizione
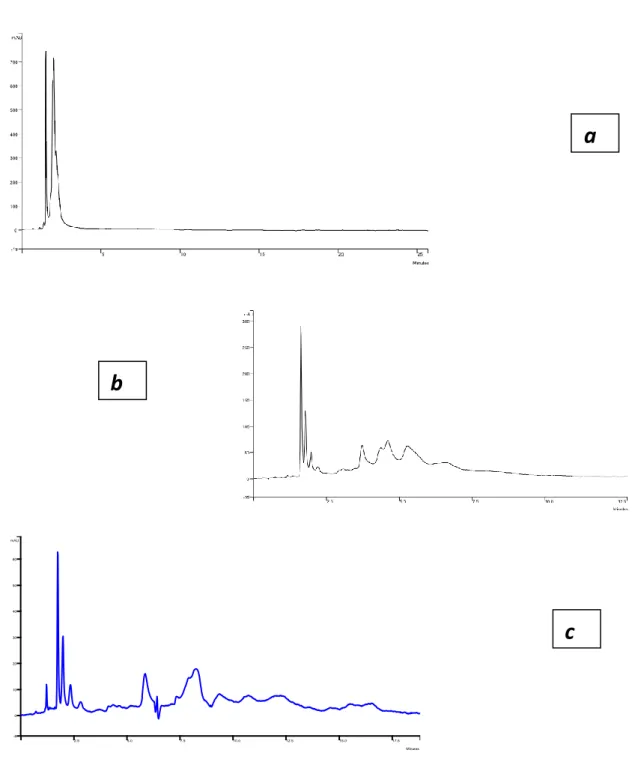
Infine, sono state effettuate alcune prove utilizzando, come componente acquosa, il tampone ammonio fosfato 50 mM (pH = 3.2) e applicando un gradiente lineare che porta la percentuale della componente acquosa dal 10 al 20 % in 23 min. La presenza del tampone aumenta la ritenzione dei composti rispetto all'uso dell'acqua, ma l’efficienza separativa è inferiore ed il condizionamento della colonna prevede periodi più lunghi (nella fig. 23 viene mostrato il profilo ottenuto per galla turca su tre corse ripetute).
Molti di questi esperimenti sono stati ripetuti successivamente a causa della comparsa, nel periodo tra maggio e giugno 2010, di problematiche strumentali relative all'HPLC utilizzato per le analisi. Data la particolarità della colonna HILIC, è stato deciso di ripetere molte delle analisi citate in seguito all'intervento tecnico necessario.
Fig. 23: cromatog rafia HILIC di una soluzione di tannino co mmerciale “Galla cinese” 484 ppm tramite eluizione
Cromatografia in fase inversa (C
18)
Durante lo studio con la colonna HILIC, non avendo ottenuto informazioni chiare sul fingerprint degli estratti in oggetto, sono state condotte alcune analisi con una colonna C18 (250 x 4.6 mm., 5 µm) sui tannini naturali da noi studiati, utilizzando un gradiente di riferimento indicato da uno studio svolto da colleghi di un altro laboratorio (con alcune modifiche; i dettagli sono riportati in tab. 2).
Tempo Flusso (ml/min) % fase acquosa % ACN % MeOH
Inizio 1.0 95 5 0 8,00 1.0 95 5 0 25,00 1.0 35 65 0 30,00 1.0 5 95 0 34,00 1.0 5 95 0 35,00 1.0 0 0 100 40,00 1.0 0 0 100 41,00 1.0 95 5 0 45,00 1.0 95 5 0 Tab. 2
In particolare, si è voluto verificare l'effetto dell'uso di due diversi tamponi a pH acido (ammonio acetato 5 mM e ammonio fosfato 5 mM) e dei relativi modificatori di pH (acido acetico e acido fosforico, rispettivamente). Le figure 24 e 25 mostrano quanto ottenuto per i campioni di galla turca (498 ppm) e gambier (555 ppm) alla lunghezza d'onda di 210 nm. L’aggiunta di acido acetico comporta un aumento di assorbanza nel range 200 – 220 nm; nel relativo intervallo di tempo del gradiente, si genera un rialzo della linea di base che abbassa il rapporto segnale-rumore e rende invisibili i campioni.
Fig. 24: cromatog rafia RP-C18 di una soluzione di tannino commerciale “Galla turca” 498 ppm tramite eluizione
Questo effetto non si manifesta a lunghezze d'onda superiori (es. a 270 nm), come mostrato in fig. 26 per l'estratto di gambier (555 ppm) e rende possibile la lettura dei cromatogrammi, anche se l'assorbanza in quel caso è molto inferiore.
Fig. 26: cromatog rafia RP-C18 di una soluzione di tannino commerciale “Gambier” 555 ppm tramite eluizione in
gradiente a flusso 1 .0 ml/min con tampone a mmonio a ceta to.UV@270 nm. Blu: p H 5.45; rosso: pH 4.20;
verde: pH 3.15
Fig. 25: cromatog rafia RP-C18 di una soluzione di tannino commerciale “Gambier” 555 ppm tramite eluizione in
Con l'uso del tampone fosfato, invece, tale fenomeno si osserva solo in piccolissima entità per l'estratto di gambier (fig. 27), mentre l'estratto di galla turca vede addirittura aumentare la propria assorbanza col tampone acidificato rispetto al tampone tal quale o a semplice acqua MilliQ (pH 6.8; fig. 28); pertanto, i campioni di galla turca e gambier possono essere analizzati a 210 nm, dove l'assorbanza è maggiore.
Fig. 27: cromatog rafia RP-C18 di una soluzione di tannino commerciale “Gambier” 555 ppm tramite eluizione in
L'assorbanza a pH acido è maggiore anche per lo standard di acido tannico e di acido gallico, ma non per la (+) catechina (fig. 29-31).
Fig. 28: cromatog rafia RP-C18 di una soluzione di tannino commerciale “Galla turca” 498 ppm tramite eluizione
in gradiente a flusso 1.0 ml/min con tampone sodio fosfa to. Blu : pH 4.50; rosso: pH 3.10 ; verd e: pH 6 .80.
Fig. 29: cromatog rafia RP-C18 di una soluzione di acido tannico 498 ppm tramite eluizione in gradiente a flusso
Fig. 30: croma tografia RP-C18 di una soluzione di catechina 213 ppm tramite eluizione in gradiente a flusso 1.0
ml/min con tampone sodio fosfato. Rosso : pH 3.10; verde: pH 6.80.
Fig. 31: croma tografia RP-C18 di una soluzione di catechina 213 ppm tramite eluizione in gradiente a flusso 1.0
Conclusioni
La cromatografia HILIC applicata all’analisi dei composti standard considerati ha permesso il riconoscimento di acido gallico e catechina tramite eluizione isocratica ed in gradiente utilizzando acqua e acetonitrile come componenti della fase mobile. Per quanto riguarda l’applicazione ai tannini commerciali in nostro possesso ha fornito risultati accettabili, in termini di una certa chiarezza cromatografica, utilizzando l’eluizione isocratica con miscela acetonitrile/acqua 90:10 a flusso 1.0 ml/min. In queste condizioni è stato possibile ottenere un fingerprint riconoscibile per i tannini commerciali, fornendo così uno strumento in più per la valutazione della composizione di queste miscele di polifenoli nei relativi ambiti di utilizzo.
I campioni studiati sono stati analizzati anche tramite cromatografia liquida in fase inversa su colonna C18, (RP-HPLC) e questo ha permesso, in particolare, la valutazione degli effetti del tipo di tampone e del relativo pH sull’assorbanza dei composti e la loro rilevabilità durante l’analisi.
In base alle condizioni indicate dalla letteratura ed in collaborazione con la Facoltà di Farmacia dell’università di Pavia, lo studio di queste strutture chimiche particolarmente idrofile proseguirà in futuro, per avere ulteriori verifiche delle potenzialità della tecnica HILIC o per ottenere una separazione migliore tramite cromatografia in fase inversa (C18) e conferire agli estratti analizzati un fingerprinting ripetibile.
Bibliografia
1. Bate-Smith E.C. e Swain, T.: “Flavonoids compounds” (p.705-809) in “Comparative biochemistry – vol. 3 A” (Mason and Florkin eds.), Academic press (1962).
2. Hagerman A.E.: “Tannin chemistry”, on-line press, 2002.
3. Covington A.D.: “Modern tanning agents” Chem. Soc. Rev.26(1997), 111-126.
4. Fernandez de Simon B., Sanz M. et al.: “Chemical characterization of oak heartwood from Spanish forests of Quercus pyrenaica (Wild.). Ellagitannins, low molecular weight phenolic, and volatile compounds” J. Agric. Food Chem.54 (2006), 8314-21.
5. Zywicky B., Reemtsma T. et al.: “Analysis of commercial vegetable tanning agents by reversed-phase liquid chromatography-electrospray ionization-tandem mass spectrometry and its application to wastewater” J. Chromatography A970 (2002), 191-200.
6. Kohler N., Wray V. et al.: “Preparative isolation of procyanidins from grape seed extracts by high-speed counter-current chromatography” J. Chromatogr. A1177 (2008), 114-125. 7. Hammerstone J.F., Lazarus S.A. et al.: “Identification of procyanidins in cocoa (Theobroma cacao) and chocolate using high-performance liquid chromatography/mass spectrometry” J. Agric. FoodChem.47 (1999), 490-496.
8. Gu L., Kelm M. et al.: “Fractionation of polymeric procyanidins from lowbush blueberry and quantification of procyanidins in selected foods with an optimized normal-phase HPLC-MS fluorescent detection method” J. Agric. FoodChem.50 (2002), 4852-4860. 9. ShojiT., Masumoto S. et al.: “Apple (Malus pumila) procyanidins fractionated according
to the degree of polymerization using normal-phase chromatography and characterized by HPLC-ESI/MS and MALDI-TOF/MS” J. Chromatography A1102 (2006), 206-213.
10. Romani A., Ieri F. et al.: “Analysis of condensed and hydrolysable tannins from commercial plant extracts” J. Pharm. Biomed. Anal.41 (2006), 415-420.
11. Lea A.G.H., Bridle P. et al.: “The procyanidins of whitegrapes and wines” Am. J.Enol.Vitic.30 (1979), 289-300.
12. Alpert A.J.: “Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds” J. Chromatogr. A499 (1990), 177-196.
13. Karatapanis A.E., Fiamegos Y.C. et al.: “Study of the behaviour of water-solublevitamins in HILIC on a diol column” Chromatographia71 (2010), 751-759.
14. Yanagida A., Murao H. et al.: “Retention behavior of oligomeric proanthocyanidins in hydrophilic interaction chromatography” J. Chromatogr. A1143 (2007), 153-161.
15. Karatapanis A.E., Fiamegos Y.C. et al.: “HILIC separation and quantitation of water-soluble vitamins using diol column” J. Sep.Sci.32 (2009), 909-917.