1
Capitolo 2
“Organs-on-chip”: stato dell’arte
La fisiologia è la scienza che indaga le funzioni degli organismi viventi e mira a conoscere le cause, le condizioni e le leggi che determinano e regolano i fenomeni vitali. Le funzioni vitali sono molto complesse perché dipendono dall’interazione tra componenti biologici diversi sia per livello di organizzazione che per ordine di grandezza. La fisiologia, quindi, è una scienza integrata in quanto studia il funzionamento a vari livelli di complessità, dallo studio delle interazioni tra molecole nell’ambito della cellula, che è la più piccola unità strutturale in grado di realizzare tutti i processi vitali, all’organismo in toto. La piena comprensione dei processi fisiologici è di fondamentale importanza nell’ambito della patologia clinica, dell’innovazione farmaceutica e della tossicologia.2.1 Dalle colture cellulari 2D alle colture 3D
La maggior parte dei ricercatori valida le proprie ipotesi cliniche su modelli bidimensionali (2D) di tessuti biologici in vitro. Questi solitamente consistono di uno strato di cellule dello stesso tipo coltivate su piastre di Petri in condizioni statiche. Il vantaggio di questo approccio è la semplicità dei modelli ottenuti e il basso costo. Tuttavia, le colture 2D, non tenendo conto delle complesse interazioni alla base dei meccanismi fisiologici, non riescono a riprodurre gli aspetti chiave del funzionamento degli esseri viventi [17]. Infatti, considerando l’utilizzo di questi modelli in studi tossicologici, ad esempio, emerge che la
Capitolo 2: “Organs-on-chip”: stato dell’arte
2
risposta tossica indotta in vitro dai farmaci richiede dosi maggiori e periodi di tempo più lunghi per manifestarsi rispetto alla reazione tossica in vivo [69].
Gli sforzi per affrontare queste limitazioni hanno portato allo sviluppo di modelli di colture tridimensionali (3D), dispositivi microfabbricati in vitro, costituiti di matrice extracellulare e/o polimeri biocompatibili, che replicano la micro-architettura di organi e/o tessuti [69]. L’organizzazione delle cellule seminate su questi supporti è molto simile a quella in vivo.
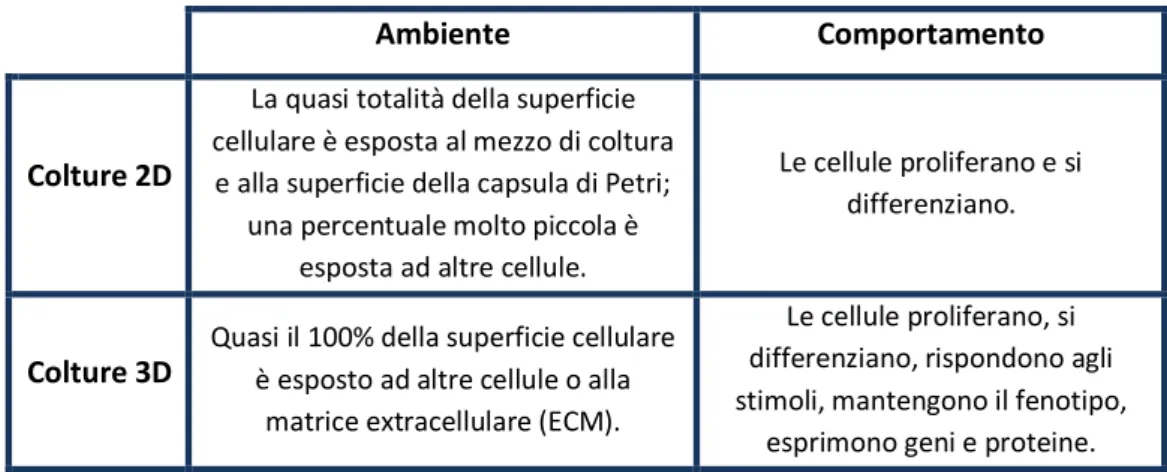
La tabella di seguito riportata riassume alcune differenze, in termini di ambiente e comportamento, tra le colture 2D quelle 3D.
Tabella 2.1: Tabella riassuntiva delle principali differenze tra colture cellulari bidimensionali e tridimensionali
Ambiente Comportamento Colture 2D
La quasi totalità della superficie cellulare è esposta al mezzo di coltura
e alla superficie della capsula di Petri; una percentuale molto piccola è
esposta ad altre cellule.
Le cellule proliferano e si differenziano.
Colture 3D
Quasi il 100% della superficie cellulare è esposto ad altre cellule o alla
matrice extracellulare (ECM).
Le cellule proliferano, si differenziano, rispondono agli stimoli, mantengono il fenotipo,
esprimono geni e proteine.
La particolarità delle colture cellulari 3D è la presenza della matrice extracellulare (ECM), costituita di proteine complesse in grado di fornire “istruzioni biologiche” alle cellule e che consente alle cellule di muoversi, migrare e interagire tra di loro. Le interazioni cellula-cellula nelle colture cellulari 3D, garantite dalle molecole di adesione e dai recettori di membrana, includono lo scambio di ioni e piccole molecole. La comunicazione intercellulare, quindi, nelle colture 3D rispetto a quelle 2D è migliorata e può essere anche di natura elettrica. Questo garantisce che le cellule in colture 3D, rispetto a quelle coltivate in supporti 2D, mantengano per un più lungo il fenotipo in modo che le loro funzioni siano più simili a quelle esplicate dal tessuto nativo [17]. Ad esempio, gli epatociti
Capitolo 2: “Organs-on-chip”: stato dell’arte
3
sono in grado di esibire un maggior numero di funzioni epatiche se seminate su supporti 3D rispetto a quelli 2D [17].
Le colture 3D riescono, inoltre, a simulare condizioni patologiche come il cancro. Ad esempio, le cellule di carcinoma mammario coltivate in 2D possono essere facilmente uccise da basse dosi di farmaci chemioterapici o basse dosi di radiazioni . Se queste stesse cellule sono coltivate su supporti 3D, risultano resistenti alle stesse dosi di farmaci chemioterapici o radiazioni, a cui resistono le cellule in vivo nei pazienti. La diffusione dei farmaci in colture 3D multistrato, rispetto ai monostrati delle colture 2D, è ostacolata da barriere naturali, quali le strette giunzioni tra le cellule, come quelle presenti in vivo. È per queste ragioni che le colture cellulari 3D sono sistemi validi per testare nuovi farmaci per il trattamento del cancro e di altre patologie [17].
2.2 Dalle colture cellulari 3D agli “organs-on-chip”
Lo sviluppo di microambienti tridimensionali può portare, quindi, al miglioramento delle condizioni delle colture cellulari rendendole più realistiche, senza aumentarne la complessità. La sfida è di individuare i fattori - geometrici, meccanici e biochimici - propri dei microambienti in vivo, che possono essere mimati in vitro con l’ausilio di tecniche ingegneristiche. Queste permetterebbero di modellare delle superfici relativamente grandi con una risoluzione subcellulare per un controllo preciso di tutti i parametri del microambiente cellulare [15-16].
Le piattaforme che permettono di integrare in vitro microambienti ingegnerizzati e colture di tessuti biologici prendono il nome di “organs-on-chip”.
La tecnologia “organs-on-chip” mette insieme il campo dei sistemi biologici microelettromeccanici (bioMEMS), della microfluidica, della biomimetica e della biologia. Il termine “chip” si riferisce ai principi di progettazione e alle tecniche di microfabbricazione usati per realizzare canali microfluidici, pompe, valvole e sensori biochimici ed elettrici integrati. Il termine “organs” deriva dal fatto che gli stimoli del microambiente ingegnerizzato si ispirano alle funzionalità in vivo degli
Capitolo 2: “Organs-on-chip”: stato dell’arte
4
organi, come ad esempio lo sforzo di taglio indotto da un fluido sulle cellule vascolari [15].
La ricerca nell’ambito degli “organs-on-chip” si è focalizzata prevalentemente sull’aspetto ingegneristico e tecnologico. Negli ultimi anni, però, la scelta della sorgente cellulare da destinare per queste applicazioni ha assunto un ruolo cruciale. Le linee cellulari immortalizzate, le cellule primarie, le cellule staminali e le cellule staminali pluripotenti indotte hanno tutte dei pro e dei contro da valutare accuratamente nello sviluppo di questa nuova tipologia di modelli in vitro [17]. Le linee cellulari immortalizzate sono sorgenti cellulari ampiamente disponibili e ben consolidate, ma risultano leggermente diverse in termini di fenotipo dalle cellule in vivo; sono inoltre geneticamente omogenee e non paziente-specifiche. Le cellule primarie sono difficilmente reperibili ed è arduo mantenerle in coltura per lunghi periodi di tempo. Anche le cellule staminali e le staminali pluripotenti indotte sono poco disponibili; inoltre, indurle a differenziarsi e a mantenere il fenotipo desiderato può essere difficile. Poiché tutte le sorgenti cellulari di cui si è discusso presentano dei vantaggi e degli svantaggi, la scelta dipende dalla specifica applicazione [19].
La fase preliminare nello sviluppo di “organs-on-chip” consiste nell’identificare gli aspetti geometrici, meccanici e biochimici del microambiente del tessuto di interesse. Ci sono numerose tecniche di microfabbricazione che ben si adattano a ricreare strutture con forma ben definita e dimensioni precise alla micro-scala, tra le quali, ad esempio, la fotolitografia, il “replica molding” e la stampa per microcontatto [17].
Negli ultimi anni, molti organi sono stati riprodotti in vitro utilizzando un approccio di questo tipo. Tra questi, ad esempio, ci sono i reni [20, 36], il pancreas [21], i polmoni [23-25], i vasi sanguigni [26], il sistema nervoso [22] e il fegato [27-35, 42-49]. Di seguito ne saranno discussi alcuni più nel dettaglio.
Capitolo 2: “Organs-on-chip”: stato dell’arte
5 2.2.1 “Liver-on-chip”
Da un punto di vista tossicologico e farmaceutico, il fegato è uno dei più interessanti organi da studiare. La tossicità epatica, infatti, è il problema più grande riscontrato nello sviluppo clinico di un farmaco ed è una delle principali ragioni del ritiro dello stesso dal mercato [10].
Negli ultimi anni sono stati sviluppati numerosi modelli microfabbricati che mimano il tessuto epatico, sia per studiarne le capacità rigenerative e metaboliche che per lo screening ad alto rendimento di tossicità dei farmaci [15]. Gli aspetti principali dell’ambiente microfabbricato, sui quali si sono focalizzati i vari gruppi di ricerca, sono la geometria e l’organizzazione del tessuto da replicare, poiché entrambe molto complesse, come già discusso nel Paragrafo 1.3 del presente lavoro di tesi.
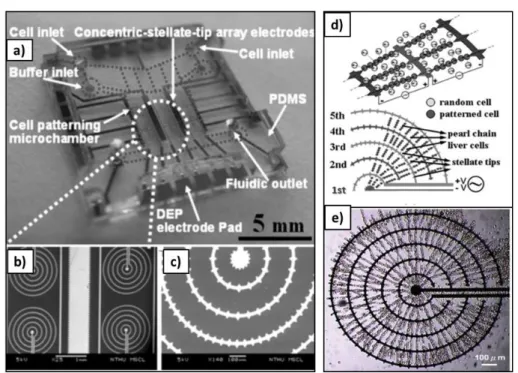
Il principale vantaggio di sistemi di colture di cellule epatiche in ambiente microfabbricato è che permettono la formazione di clusters cellulari capaci di agire come lobuli epatici (Paragrafo 1.3) e mantenere il loro fenotipo per un lungo periodo di tempo. Un esempio di questo fenomeno è dato dagli studi condotti da Liu et al. [27, 42-46] nei quali è stato dimostrato che, tramite dielettroforesi (DEP), è possibile riprodurre su chip una struttura organizzata e biomimetica di cellule epatiche ed endoteliali, partendo da una distribuzione casuale di queste cellule in una camera microfluidica. Questi studi hanno portato all’implementazione di una matrice di elettrodi stellati concentrici [42], realizzati in titanio su un substrato di vetro, ognuno dei quali genera un campo elettrico radiale se è applicata una forza dielettroforetica (Figura 2.1 a-c). Sotto l’azione del campo elettrico, quindi, le cellule epatiche e quelle endoteliali, inizialmente distribuite in maniera casuale nella camera microfluidica, si allineano secondo il modello progettato (Figura 2.1 d). La configurazione radiale ottenuta riproduce bene la morfologia lobulare (Figura 2.1 e). Gli autori affermano che la dielettroforesi è una buona tecnica per riprodurre in vitro il comportamento fisiologico delle cellule epatiche.
Capitolo 2: “Organs-on-chip”: stato dell’arte
6
Figura 2.1: Dispositivo microfluidico per la manipolazione delle cellule epatiche ed endoteliali da Liu et al. [42]. a) Immagine complessiva del chip; b-c) immagini SEM che mostrano la geometria degli elettrodi concentrici stellati; d) semina di cellule epatiche ed endoteliali nella camera di coltura e successivo allineamento di queste sotto l’azione del campo elettrico indotto da DEP; e) configurazione finale delle cellule che mima l’organizzazione del lobulo epatico.
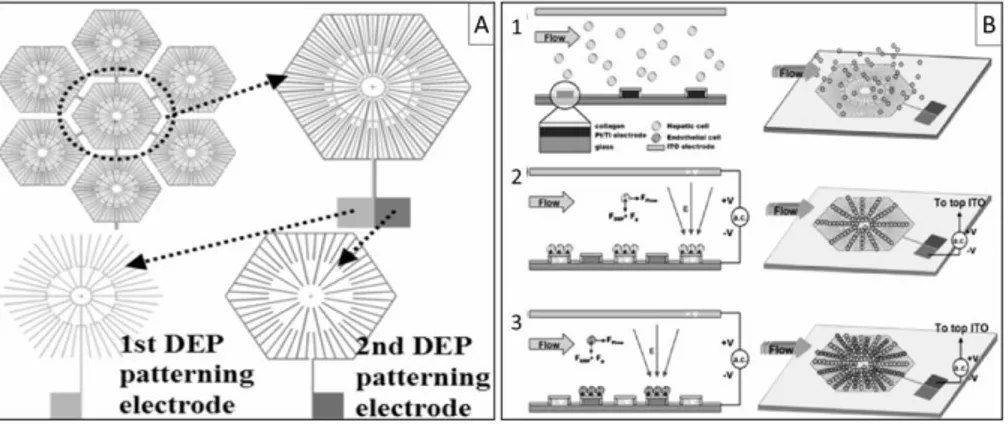
Per rendere cellula-specifica l’azione di controllo sulla manipolazione, Liu et al. hanno realizzato, in uno studio successivo [27], un sistema microfluidico che implementa una matrice di elettrodi stellati ognuno dei quali ottenuto dalla sovrapposizione di due diverse configurazioni elettriche: la prima realizzata per guidare l’allineamento degli epatociti, la seconda per orientare le cellule epiteliali (Figura 2.2 a). I diversi tipi di cellule, risentendo del campo elettrico indotto dall’applicazione della forza dielettroforetica, tendono ad allinearsi secondo la corrispondente configurazione degli elettrodi (Figura 2.2 b). Lo studio ha dimostrato che le cellule si dispongono radialmente riproducendo una struttura lobulare. Gli autori affermano, inoltre, che l’ambiente microstrutturato ne migliora la vitalità.
Gli elettrodi stellati [27] sono stati inoltre implementati su piattaforme diagnostiche per test di tossicità farmacologica [43-45]. L’integrazione di un generatore di gradiente ha permesso l’utilizzo di questi dispositivi nella
Capitolo 2: “Organs-on-chip”: stato dell’arte
7
valutazione, in parallelo, dell’effetto di diverse dosi di farmaco su colture di epatociti.
Figura 2.2: a) Configurazione della matrice di elettrodi stellati realizzati per riprodurre
in vitro la struttura lobulare da Liu et al. [27]. b) Principio di funzionamento della
manipolazione cellulare con dielettroforesi: 1) gli epatociti sono caricati nella camera microfluidica con una distribuzione casuale; 2) l’applicazione della forza dielettroforetica induce gli epatociti ad orientarsi secondo la prima delle due configurazioni di elettrodo; 3) le cellule endoteliali, caricate successivamente nella camera, si dispongono seguendo la seconda configurazione dell’elettrodo dopo una nuova applicazione della DEP.
La capacità delle cellule di auto-organizzarsi sotto l’azione di stimoli elettrici è stata studiata anche da Stelzle et al. [28], i quali hanno ideato un chip microfluidico costituito da camere di coltura cellulare con muri paralleli in PDMS (Poli-dimetilsilossano) che formano microcanali (Figura 2.3). Gli elettrodi in titanio integrati alle estremità di ogni camera, tramite dielettroforesi, inducono le cellule epatiche ad allinearsi sui muri paralleli, precedentemente trattati con proteine della matrice extracellulare (Figura 2.3 a-b). La presenza di microcanali permette la perfusione dei cordoni epatici assemblati. La geometria del sistema realizzato riproduce bene in vitro l’architettura lobulare in vivo.
Capitolo 2: “Organs-on-chip”: stato dell’arte
8
Figura 2.3: A sinistra, dispositivo microfluidico per l’assemblaggio di cordoni di epatociti tramite dielettroforesi da Stelzle et al. [28]. A destra, schematizzazione del chip: a) principio di assemblaggio delle cellule sotto l’azione di una forza dielettroforetica; b) celle organizzate in cordoni, perfuse con mezzo di coltura
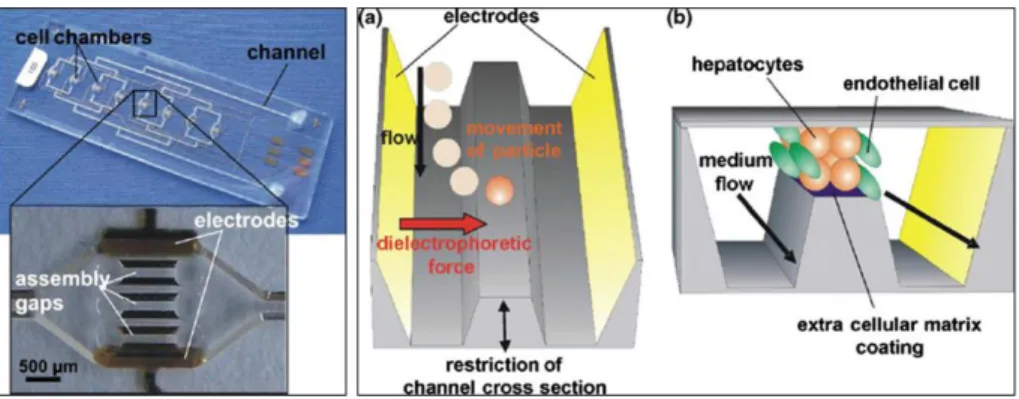
Dopo aver ampiamente dimostrato che è possibile riprodurre su chip in vitro, tramite dielettroforesi, l’architettura tipica del comparto epatico, Liu et al. [46] hanno realizzato un sistema in grado di mimare la diffusione di ossigeno e nutrienti dallo spazio sinusoidale ai cordoni epatici (Paragrafo 1.3.1). Il sistema integra, su un substrato di vetro, degli elettrodi in configurazione lobulare sui quali sono state depositate delle micropareti in Poli-etilenglicol-diacrilato [PEG-DA] (Figura 2.4 a) che riproducono le pareti dei sinusoidi. L’applicazione di una forza dielettroforetica induce gli epatociti e i fibroblasti seminati ad aderire sulle micropareti. La configurazione ottenuta (Figura 2.4 b) mima con successo la morfologia del lobulo epatico. Per garantire il flusso diffusivo di ossigeno e nutrienti esclusivamente dal comparto sinusoidale a quello cellulare, sono state introdotte delle valvole tra le micropareti polimeriche.
Capitolo 2: “Organs-on-chip”: stato dell’arte
9
Figura 2.4: Dispositivo tridimensionale che mima il lobulo epatico da Liu et al. [46]. a) Schema di assemblaggio del dispositivo; b) Raffigurazione schematica della morfologia del sistema finale, dopo la semina in vitro.
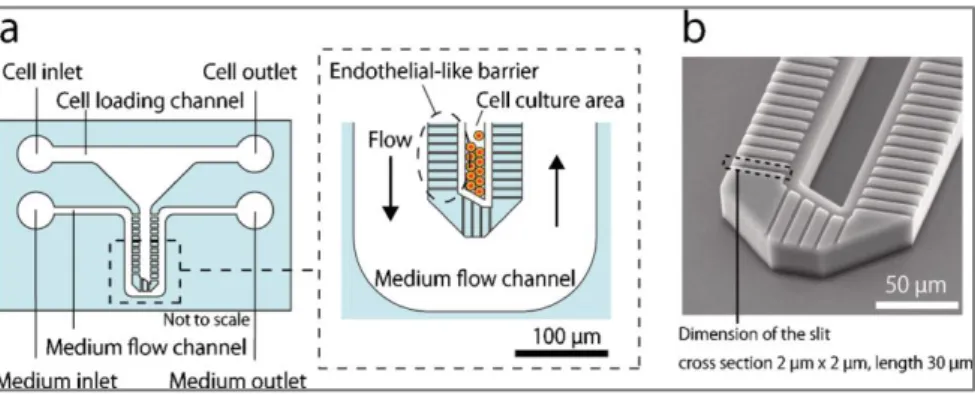
Emulare il trasporto di sangue e plasma dal sinusoide ai cordoni epatici è stato l’obiettivo anche di Lee et al. [29]. Il dispositivo, fabbricato su un substrato di vetro, è caratterizzato da un’area di coltura cellulare per gli epatociti, circondata da un canale microfluidico a flusso continuo (Figura 2.5). La densità di semina delle cellule epatiche è molto alta. La comunicazione tra questi due compartimenti avviene attraverso una barriera microfluidica microporosa che simula lo spazio di Disse. La barriera, realizzata in PDMS con tecniche di “laser cutting”, svolge due funzioni principali: concentrare le cellule nell’area di coltura e minimizzare il flusso convettivo nella stessa regione permettendo solo quello diffusivo di nutrienti, che avviene in un tempo dell’ordine dei secondi. La compartimentalizzazione della componente cellulare e di quella vascolare, però, non mima solo il trasporto di massa nel sinusoide, ma protegge anche gli epatociti da un elevato sforzo di taglio, che sarebbe loro fatale. È noto, infatti, che i valori di sforzo di taglio cui sono sottoposte le cellule nel comparto epatico (0.1-0.5 dyne/cm2) sono cento volte inferiore rispetto a quello rilevato negli altri distretti corporei (10 dyne/cm2) [7]. La formazione di sferoidi di epatociti consente il mantenimento della vitalità e dell’attività metabolica delle cellule per diverse settimane. Questo sistema, però, sembra fornire una distribuzione omogenea di nutrimento e ossigeno senza la formazione dei gradienti che sarebbero, invece, fondamentali per replicare in vitro la suddivisione in zone dei cordoni epatici.
Capitolo 2: “Organs-on-chip”: stato dell’arte
10
Figura 2.5: Struttura del dispositivo microfluidico che riproduce il sinusoide epatico da Lee et al. [29]. Il canale centrale e quello esterno misurano 50 µm di larghezza e 30 µm di altezza; la barriera che simula lo spazio di Disse consiste di una serie di canali paralleli larghi 2 µm e alti 1 µm.
Per migliorare questo dispositivo, Fujii et al. [30] hanno introdotto sul chip un microcanale per la semina e l’allineamento cellulare. Inoltre, per agevolare l’allineamento degli epatociti su due file, la base della camera di coltura è stata realizzata in una configurazione asimmetrica (Figura 2.6). Questo studio ha dimostrato che gli epatociti allineati progressivamente si auto-organizzano, già dopo tre giorni, per formare canalicoli biliari.
Figura 2.6: Dispositivo microfluidico che mima la struttura del sinusoide epatico. a) Il sistema implementa quattro canali di flusso, una zona di coltura cellulare e una barriera che replica le funzioni fisiologiche dello spazio di Disse; la larghezza dell’area di coltura è progettata per essere 37 µm, dimensione che garantisce l’allineamento degli epatociti su due file. b) Immagine SEM di una sezione del dispositivo.
Capitolo 2: “Organs-on-chip”: stato dell’arte
11
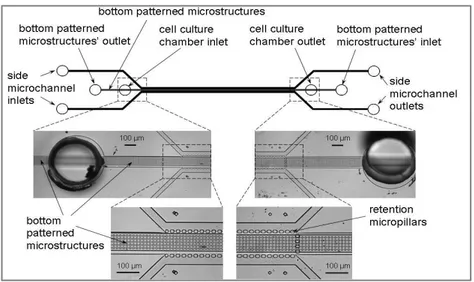
Sono stati realizzati numerosi canali microfluidici per organizzare e mantenere gli epatociti in una configurazione che mimi i cordoni, tipici dell’unità lobulare, e la loro suddivisione in zone (Paragrafo 1.3) [31-42, 47-48]. Yu et al. [31], basandosi su questo principio, hanno realizzato un sistema molto interessante che integra una matrice di micro-pilastri in un canale microfluidico. Per garantire un’elevata interazione cellula-cellula, hanno imposto una perfusione con flusso continuo della struttura, che ha portato benefici in termini di vitalità, pari a circa 90% dopo 72 ore. Questo dispositivo ha permesso anche la combinazione delle cellule epatiche con altri tipi cellulari attraverso un’unica circolazione del mezzo di coltura. Goral et al. [32] hanno ideato un dispositivo simile, nel quale una serie di pilastri di ritenzione è utilizzata per formare un microcanale, centrato tra due canali laterali, su un substrato di PDMS. A differenza degli altri dispositivi di perfusione, però, la superficie sulla quale sono seminate le cellule è microstrutturata, con lo scopo di migliorare l’adesione e la proliferazione cellulare (Figura 2.7).
Figura 2.7: Schema del canale microfluidico con micropilastri integrati per la perfusione di colture di epatociti da Goral et al. [32]
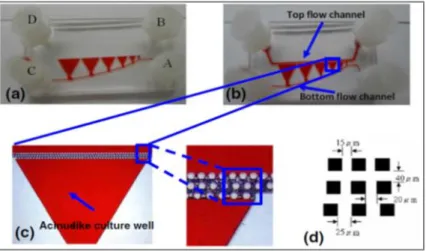
Liu et al. [33] hanno cercato di riprodurre i gradienti che caratterizzano l’acino epatico (Paragrafo 1.3), realizzando una matrice di piastre di coltura collegate tra di loro da un canale microfluidico. Il dispositivo è stato fabbricato
Capitolo 2: “Organs-on-chip”: stato dell’arte
12
con tecniche di tipo “replica molding” su un substrato di PDMS. Una matrice di pilastri a sezione quadrata, organizzati su tre file, separa la regione di coltura dal comparto di flusso (Figura 2.8). La presenza dei micro-pilastri ha lo scopo di bilanciare la pressione di perfusione del mezzo di coltura per minimizzare lo sforzo di taglio indotto sulle cellule. Il vantaggio di questo dispositivo risiede nella possibilità di regolare i gradienti di concentrazione di ossigeno e nutrienti in un tempo relativamente breve (10 secondi). L’analisi delle colture, con l’ausilio di tecniche fluoroscopiche, ha messo in evidenza che, all’aumentare delle distanza delle cellule dai micropilastri, la loro vitalità aumenta poiché risentono sempre meno dello sforzo di taglio indotto dal mezzo di coltura perfuso.
Figura 2.8: Dispositivo microfluidico che riproduce in vitro i gradienti che caratterizzano l’acino epatico da Liu et al. [33]
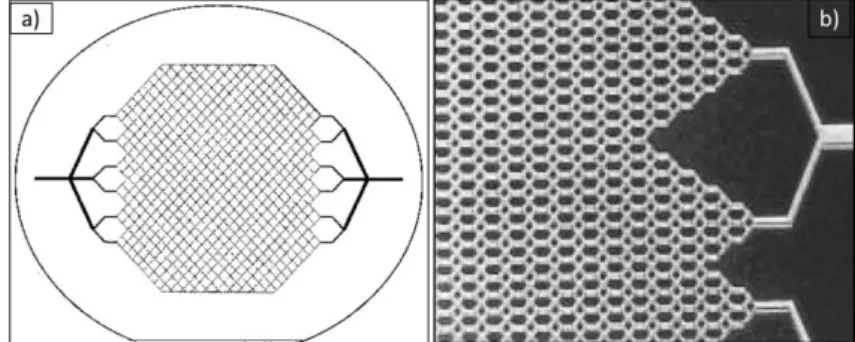
In letteratura, inoltre, sono descritti sistemi per la coltura di epatociti realizzati su substrati di silicio [34-35, 49]. Per riprodurre le geometrie desiderate, sono state utilizzate diverse tecniche di micromachining del silicio. Vacanti et al. [34] hanno fabbricato, con la tecnica del plasma etching isotropico, dei microcanali la cui architettura ramificata si inspira alla natura frattalica della rete dei capillari epatici (Figura 2.9). Gli autori affermano che l’ambiente microstrutturato di questo supporto favorisce la vitalità e la proliferazione delle cellule epatiche in coltura, che sono in grado di mantenere il loro fenotipo e di produrre quindi albumina fino a cinque giorni dalla semina.
Capitolo 2: “Organs-on-chip”: stato dell’arte
13
Figura 2.9: a) Rappresentazione schematica della rete di canali microfluidici fabbricata sul silicio con tecniche di micromachining; b) Immagine ottica di una porzione della rete di microcanali, da Vacanti et al. [34]
2.2.2 “Lung-on-chip”
Il sistema respiratorio è responsabile dello scambio di gas tra aria e sangue. L’unità elementare del polmone è uno strato di cellule epiteliali ed endoteliali in corrispondenza del quale avviene lo scambio [18]. La componente di cellule epiteliali è a contatto con l’aria, mentre l’endotelio si interfaccia con il sangue. La geometria dell’interfaccia epitelio-endotelio è importante poiché le forze meccaniche che agiscono sui due tipi di cellule sono diverse. Questa geometria è relativamente semplice da riprodurre in vitro [15]. Esistono, infatti, molti modelli nei quali le cellule epiteliali ed endoteliali crescono ai lati opposti di una sottile membrana porosa, in assenza, però, degli stimoli meccanici propri del comparto polmonare.
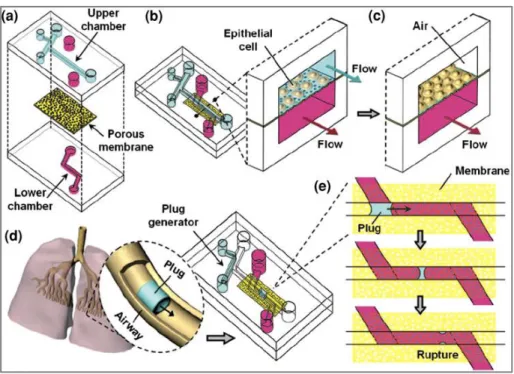
Recentemente, sono stati sviluppati modelli microfluidici per il trattamento di monostrati epiteliali delle piccole vie aeree, nei quali si tiene conto degli stress meccanici fisiologici cui sono sottoposte le cellule, degli sforzi di taglio indotti da occlusioni causati da versamenti patologici di liquido o di entrambi i parametri. Per comprendere gli effetti della propagazione e della rottura di un versamento di liquido, Takayama et al. [23] hanno sviluppato un dispositivo multistrato (Figura 2.10 a) nel quale le cellule epiteliali sono coltivate sia in ambiente acquoso (Figura 2.10 b) che all’interfaccia aria-liquido (Figura 2.10 c). Per simulare l’occlusione polmonare si sono avvalsi di un generatore di goccioline di liquido
Capitolo 2: “Organs-on-chip”: stato dell’arte
14
posto all’estremità di un canale microfluidico (Figura 2.10 d). Dai test effettuati sul dispositivo, hanno osservato che la rottura delle gocce di liquido causa un rantolo crepitante simile a quello auscultato in pazienti con patologie polmonari. La rottura ripetuta di goccioline, inoltre, causa la morte cellulare (Figura 2.10 e). Ciò dimostra che l’utilizzo di modelli di tipo “organs-on-chip” può permettere di rilevare fenomeni fisiologici e patologici che altrimenti rimarrebbero sconosciuti.
Figura 2.10: Sistema microfluidico compartimentalizzato per l’ingegnerizzazione delle piccole vie aeree da Takayama et al. [23]
La struttura alveolare dei polmoni presenta delle caratteristiche diverse da quelle individuate nelle piccole vie aeree, ma gli stimoli meccanici continuano a rivestire un ruolo fondamentale. Douville et al. [24] hanno provato a riprodurne la complessità realizzando un dispositivo microfluidico multistrato, che lavora in condizioni di vuoto, usato per coltivare cellule epiteliali su una membrana flessibile (Figura 2.11). Questa deforma meccanicamente le cellule e le espone al movimento di un’interfaccia aria-liquido. Il vantaggio di questo dispositivo è la sua capacità di riprodurre in vitro una condizione alveolare patologica, la polmonite. Questa malattia, infatti, è caratterizzata dall’infiammazione degli
Capitolo 2: “Organs-on-chip”: stato dell’arte
15
alveoli polmonari, i quali si riempiono di liquido, che impone una deformazione meccanica sulle cellule e ostacola il normale espletamento della funzione respiratoria.
Figura 2.11: “Alveolo-on-chip” da Douville et al. [24]. Una camera alveolare e un canale di attuazione, separati da una membrana porosa in PDMS, sono assemblati per realizzare un dispositivo microfluidico.
Come discusso finora, le colture di cellule epiteliali su un’interfaccia aria-liquido riproducono meglio il tessuto epiteliale in vivo. Questa condizione è difficile da riprodurre quando le colture cellulari hanno bisogno di un substrato flessibile e allo stesso tempo permeabile. Per risolvere questo problema, Huh et al. [25] hanno sviluppato una membrana porosa in PDMS da integrare in un dispositivo di tipo “alveolo-on-chip” (Figura 2.12). In questo modo è possibile coltivare le cellule epiteliali su una faccia della membrana, all’interfaccia aria-liquido, e le cellule endoteliali dall’altra parte. Per replicare sulla membrana il profilo di sforzo di taglio tipico della condizione fisiologica degli alveoli, è sufficiente applicare il vuoto nelle camere laterali. Utilizzando questo dispositivo hanno misurato la risposta infiammatoria indotta dall’inalazione di nanoparticelle, che non è possibile misurare avvalendosi di colture endotelio-epitelio statiche.
Capitolo 2: “Organs-on-chip”: stato dell’arte
16
Questo dimostra, ancora una volta, l’utilità dei microambienti ingegnerizzati nello studio della fisiologia degli esseri viventi.
Figura 2.12: Microdispositivo per la co-coltura di cellule epiteliali ed endoteliali, in condizioni di flusso e sforzo di taglio fisiologici, che mima il microambiente alveolare, da Huh et al. [25]
2.2.3 “Kidney-on-chip”
Lo studio di nuovi modelli che mimino il comportamento del tubulo renale è di particolare importanza nel campo della nefrotossicità, poiché il riassorbimento o l’accumulo interstiziale locale di medicinali avviene principalmente in questa sezione del rene.
La caratteristica più importante, da tenere in considerazione per riprodurre in vitro il tubulo renale, è che le cellule epiteliali che lo compongono sono esposte a elevati gradienti osmotici trans-epiteliali e a un elevato sforzo di taglio. Suh et al. [36], prima, e Ingber et al. [20], dopo, hanno realizzato dispositivi microfluidici multistrato che incorporano microcanali e pozzi di coltura in PDMS, separati da una membrana porosa di Poliestere (Figura 2.13). La struttura tridimensionale di questo supporto fornisce un ambiente di coltura, per le cellule epiteliali renali, simile all’ambiente fisiologico. Fornisce, inoltre, un controllo preciso sui flussi e una selettiva esposizione della parte apicale e basale delle cellule a sforzi di taglio, ormoni e gradienti chimici. Gli studi condotti hanno dimostrato che le cellule epiteliali seminate su questo substrato sono in grado di mantenere il loro fenotipo per un tempo sufficientemente lungo per eseguire dei test di tossicità. Mostrano,
Capitolo 2: “Organs-on-chip”: stato dell’arte
17
inoltre, un significativo riassorbimento di glucosio e trasporto di albumina, entrambi indici di vitalità cellulare.
Figura 2.13: Modello microfluidico di tubulo renale da Suh et al. [34]
2.2.4 Altri organi
Negli ultimi anni sono stati sviluppati anche modelli ingegnerizzati di altri organi.
Per l’ingegnerizzazione del microambiente del tessuto cardiaco, la maggior parte degli studi ha focalizzato l’attenzione sulla stimolazione meccanica delle colture, attraverso sforzi di taglio indotti da fluidi, e sulla stimolazione elettrica, attraverso elettrodi integrati [37]. Entrambi i parametri contribuiscono alla differenziazione delle cellule cardiache, al loro allineamento, all’espressione di proteine e alla loro contrazione/dilatazione. Per approfondire l’argomento si rimanda alla seguente review [55].
Sono stati studiati anche sistemi microfluidici per la coltura delle isole di Langerhans, cluster di cellule pancreatiche che svolgono un’importante funzione endocrina. Queste piattaforme ingegnerizzare generalmente includono tecniche di misura per l’analisi della cinetica di secrezione degli ormoni [15, 56-59].
I dispositivi microstrutturati si sono rivelati utili anche nella realizzazione di modelli neurali in vitro [38, 60-65]. Sono stati ideati substrati per la crescita
Capitolo 2: “Organs-on-chip”: stato dell’arte
18
guidata degli assoni in due o tre dimensioni attraverso l’applicazione di gradienti biochimici, in cui sono stati integrati anche degli elettrodi per la stimolazione elettrica.
Recentemente, sono stati condotti i primi studi per realizzare un ambiente microstrutturato in grado di mimare la geometria dei villi intestinali [15, 66-68].
2.3 “Human-on-chip”
Questa prima generazione di “organs-on-chip” ha dimostrato che è possibile unire semplicità e realismo in un unico modello in vitro con l’ausilio delle microtecnologie. Ciò significa che questi dispositivi hanno il potenziale per migliorare gli studi fisiologici, farmaceutici e tossicologici.
I successi ottenuti dai modelli di tessuti microfabbricati hanno portato i ricercatori a pensare di accoppiare due o più “organs-on-chip” in un singolo dispositivo. L’obiettivo è di riprodurre il metabolismo e la fisiologia dell’intero corpo umano in un dispositivo “human-on-chip”, che consiste di compartimenti interconnessi, ognuno dei quali contiene le cellule di uno specifico organo, collegati tra di loro attraverso un sistema circolatorio microfluidico (Figura 2.14) [17].
Capitolo 2: “Organs-on-chip”: stato dell’arte
19
Figura 2.14: “Human-on-chip”. Rappresentazione di un dispositivo microfluidico che consiste di compartimenti interconnessi, ognuno dei quali contiene le cellule di uno specifico organo, collegati tra di loro attraverso un sistema circolatorio microfluidico. Sono implementati anche sensori, sistemi per la rimozione di feci e urine ed escrezione di bile, attuatori per l’attivazione del battito cardiaco, del movimento peristaltico intestinale, dell’immissione di aria nei polmoni. Tratto da Marx et al. [10].
L’idea è rivoluzionaria poiché, grazie alle sue piccole dimensioni, il dispositivo “human-on-chip” potrebbe essere utilizzato non solo in ambito farmaceutico, ma potrebbe essere integrato in una piattaforma di analisi portatile, detta anche “lab-on-chip” [39], per lo screening sul campo di sostanze tossiche o di fattori ambientali inquinanti.
Analizzando l’idea della realizzazione di un dispositivo “human-on-chip” da un punto di vista esclusivamente biologico, verrebbe da chiedersi se aggiungere sempre più tipi di tessuti a un modello microfabbricato non equivalga a complicare le condizioni di coltura delle cellule di interesse. Se così fosse, sarebbero vanificati tutti i miglioramenti, in termini di semplicità e realismo di cui si è discusso in precedenza, apportati nell’ambito delle colture cellulari dall’introduzione di microambienti ingegnerizzati.
Capitolo 2: “Organs-on-chip”: stato dell’arte
20
Questo timore si rivela infondato se si analizzano i sistemi anche da un punto di vista ingegneristico. La filosofia alla base della realizzazione di questi dispositivi prevede, infatti, che solo gli organi di interesse principale siano inclusi in forma biologica e che gli stimoli indotti su questi da altri organi siano ingegnerizzati. In altre parole, se oltre alle colture di interesse si vuole implementare, ad esempio, un sistema che mimi il flusso sanguigno, si realizza una pompa; se lo stimolo da riprodurre è quello indotto dal sistema respiratorio, si includono sistemi meccanici di compressione/dilatazione. La complessità introdotta nei dispositivi “human-on-chip” risulta, quindi, di natura non-biologica e, in quanto tale, può essere quantificata e controllata dai ricercatori. I modelli realizzati, in questo modo, diventano più realistici senza alterare i risultati degli esperimenti [15].
I molti casi, però, gli stimoli fisiologici necessari alle cellule in coltura per il mantenimento delle proprie funzionalità sono troppo complessi per essere riprodotti ingegneristicamente. Ad esempio, alcune interazioni tra le cellule immunitarie e quelle di altri distretti corporei non sono chiare al punto che un insieme di parametri ingegneristici possa mimarli. In questi casi, è necessario includere nella coltura anche questo tipo di cellule, a discapito ovviamente della robustezza delle misure.
In letteratura si trovano studi che mostrano i primi tentativi dei ricercatori di integrare, su un unico chip, organi e/o tessuti diversi. Liu et al. [40], ad esempio, hanno integrato in un dispositivo mioblasti ed epatociti, le cui camere di coltura sono collegate da canali microfluidici, per studiare gli stimoli indotti dalle cellule cardiache sul parenchima epatico. Dall’analisi dei risultati, hanno osservato un miglioramento della vitalità cellulare epatica in termini di produzione di urea. Shuler et al. [41] hanno ideato un sistema microfluidico che incorpora colture 2D e 3D di adipociti, cellule cancerogene e cellule staminali di midollo osseo per studiare l’accumulo, la distribuzione, il metabolismo e la tossicità di alcuni farmaci. Approcci simili hanno portato allo sviluppo di modelli microfluidici di interazione multi-organo, utili per lo studio dell’assorbimento intestinale, del metabolismo epatico e dell’attività dei farmaci per il tumore al seno [17].
Capitolo 2: “Organs-on-chip”: stato dell’arte
21
In conclusione, lo sviluppo di dispositivi di tipo “organs-on-chip”, e quindi “human-on-chip”, vedrà un sempre più ampio utilizzo di componenti microelettroniche, micromeccaniche e microfluidiche. In questo modo, il microambiente fisiologico riprodotto sarà dinamico e farà affidamento anche su concetti propri della teoria del controllo. I dispositivi, così ottenuti, diventeranno standardizzati, modulari e automatizzati [15]. Lo sviluppo di questi modelli dovrà, inoltre, focalizzare l’attenzione sull’aumentarne la compatibilità con le tecniche biochimiche attuali e integrare tecnologie analitiche, allo scopo di renderli semplici per gli utilizzatori finali, i biologi.
![Figura 2.4: Dispositivo tridimensionale che mima il lobulo epatico da Liu et al. [46]](https://thumb-eu.123doks.com/thumbv2/123dokorg/8008487.121424/9.892.256.679.124.342/figura-dispositivo-tridimensionale-mima-lobulo-epatico-liu-et.webp)