1
CAPITOLO 1
INTRODUZIONE
2
Il presente lavoro ha come obiettivo lo studio della struttura genetica di tre specie di invertebrati marini appartenenti alle comunità del fouling di ambiente portuale: il cirripede Amphibalanus amphitrite (Darwin, 1854), il polichete Hydroides elegans (Haswell, 1883) e l’ascidia Styela plicata (Lesueur,1823).
Tutte e tre le specie sono ermafrodite, sessili nella fase adulta e conducono vita libera durante lo sviluppo larvale, che, a seconda della specie, può durare da 24 ore (S. plicata) a 21 giorni (A. amphitrite). Le tre specie possono essere oggetto di trasporto passivo: sotto le chiglie delle navi allo stadio adulto e nelle acque di zavorra allo stadio larvale.
Lo studio è stato condotto mediante l’amplificazione ed il sequenziamento di una porzione del gene mitocondriale Citocromo Ossidasi subunità 1 (COI) di: 581 bp in Amphibalanus amphitrite e 613 bp in Styela plicata. H. elegans non ha purtroppo fornito amplificati utili al sequenziamento ed è perciò stato successivamente escluso dallo studio.
1.1 Diversità genetica
"Biodiversity may be defined as the totality of different organisms, the genes they contain, and the ecosystems they form", questa fu la prima definizione di biodiversità coniata da Wilson nel 1986. In seguito, in occasione della Conferenza Internazionale sulla Biodiversità di Rio de Janeiro del 1992 la biodiversità fu definita come: "the variability among living organisms from all sources including, inter alia, terrestrial, marine and other aquatic ecosystems and the ecological complexes of which they are a part; this includes diversity within species and of ecosystems" (ISCBD, 1994). Convenzionalmente, la diversità biologica di un’area viene descritta attraverso tre principali livelli di organizzazione, diversità ecosistemica, diversità specifica e diversità genetica (Redford & Richter, 1999; Féral, 2002).
La diversità ecosistemica è data dal numero di ecosistemi che coesistono in una determinata area (Gray, 1997), dove per ecosistema si indica "un complesso dinamico di comunità vegetali, animali, di microrganismi e del loro ambiente, che interagiscono come un'unica unità funzionale" (ISCBD, 1994).
3
La diversità specifica è data dal numero di specie presenti in una determinata area, dalla loro abbondanza e dalle relazioni tra specie presenti in un ecosistema (Féral, 2002). La gran parte delle specie è suddivisa in popolazioni; la popolazione può essere definita come la più piccola unità di individui conspecifici, e quindi interfecondi, che occupa un areale definito per un tempo sufficientemente lungo, in termini evolutivi, da costituire un’unità genetica indipendente. Non è però necessario che l’isolamento riproduttivo tra popolazioni sia totale, infatti è sufficiente che lo scambio genetico sia sotto la soglia del 5% perché due popolazioni rimangano distinte (Hickman et al., 2003). Ad un livello organizzativo più fine, si può parlare di diversità genetica come la si trova all’interno di una popolazione o tra popolazioni di una stessa specie. Essa, dato che gli individui di una stessa specie non sono tutti geneticamente identici, può essere definita come “materiale grezzo” utile per i cambiamenti evolutivi (ad es. adattamento e speciazione) (Templeton et al., 2001). Inoltre tale variabilità permette alle popolazioni di rispondere efficacemente alle variazioni degli ambienti che occupano (Cognetti et al., 2002), dato che popolazioni con un'elevata variabilità genetica hanno più probabilità di avere al loro interno individui in grado di rispondere a tali cambiamenti e, quindi, di trasmettere i loro geni alle generazioni successive.
Perché le specie e le comunità naturali possano sopravvivere, la biodiversità deve essere conservata a tutti i suoi livelli, incluso quello genetico. Infatti, la variabilità genetica può essere utilizzata come importante “biomarcatore” per valutare gli effetti dell’impatto antropico a livello intraspecifico (Cognetti & Maltagliati, 2004).
Và specificato che la diversità genetica è indotta da mutazioni che possono interessare cambiamenti a livello dei singoli nucleotidi, fino ad arrivare a modificazioni del cariotipo. Le mutazioni non deleterie creano nuovi alleli i cui destini evolutivi sono governati da tre forze: selezione, migrazione e deriva genetica (Hartl & Clark, 1989). La selezione naturale è un concetto introdotto da Darwin nel 1859. Descrive l’interazione tra la variazione di caratteri individuali e l’ambiente che determinano differenze nel tasso di sopravvivenza e riproduzione tra individui diversi di una popolazione, porta al cambiamento evolutivo se la variazione su cui agisce è ereditaria. Essa tende a migliorare la fitness della specie in relazione all'habitat di appartenenza e può essere
4
stabilizzante se favorisce i caratteri medi sfavorendo gli estremi, oppure direzionale se tende a favorire un carattere estremo facendo slittare la media della popolazione verso questo carattere (Hickman et al., 2003). La migrazione, cioè lo spostamento di individui da una popolazione ad un’altra, crea flusso genico in caso di successo riproduttivo dei migranti. Tale flusso tende a rendere omogenee le frequenze geniche e ad eliminare le differenze locali tra le due popolazioni, sia diffondendo varianti favorevoli, sia opponendosi al differenziamento dei pool genici delle popolazioni. Nel caso degli organismi del benthos, la migrazione e il flusso genico avvengono generalmente grazie alle fasi larvali pelagiche. Infine la deriva genetica, cioè l'insieme di tutti quei cambiamenti casuali delle frequenze geniche di una popolazione, è il processo che regola la fluttuazione casuale delle frequenze alleliche da una generazione alla successiva. Normalmente un certo grado di deriva genetica è sempre presente nelle popolazioni naturali, ed il suo impatto è legato alle dimensioni della popolazione stessa (Féral, 2002), perchè la deriva non agisca la popolazione dovrebbe avere dimensioni estremamente estese. Sul lungo periodo la deriva genetica tende ad erodere la variabilità genetica di una popolazione (Hickman et al., 2003). In conclusione, l'effetto della deriva genetica è di aumentare la differenziazione fra le popolazioni e, nello stesso tempo, di diminuire la variabilità genetica presente in ciascuna popolazione. In piccole popolazioni la perdita di variabilità genetica implica la perdita di alleli (detta "fissazione") con conseguente riduzione del potenziale di adattamento.
La diminuzione della variabilità genetica delle popolazioni naturali può essere naturale o antropica, cioè indotta delle attività antropiche come l’inquinamento e lo sfruttamento delle specie. La diminuzione della variabilità genetica può essere causata da modificazioni del flusso genico dovute a depressione da inbreeding (diminuzione della fitness dovuta ad accoppiamenti tra consanguinei), depressione da outbreeding (diminuzione della fitness causata da accoppiamenti tra individui di una specie provenienti da diverse popolazioni) o da un "collo di bottiglia". Quest’ultimo consiste in una drastica diminuzione del numero di individui di una popolazione in seguito ad un evento catastrofico durante il quale alcuni geni possono andare perduti in modo casuale, provocando, come anche negli altri fenomeni citati, un impoverimento del pool genico che a sua volta può determinare una diminuzione del potenziale
5
evolutivo di una specie o addirittura l'estinzione di intere popolazioni (Cognetti & Maltagliati, 2004). Pertanto il mantenimento dell’integrità genetica a livello di popolazioni e di specie è essenziale per la sopravvivenza delle stesse.
In ambiente marino la diversità genetica è distribuita su scale spaziali diverse, che vanno da pochi millimetri a migliaia di chilometri. I pattern di diversità genetica variano in rapporto ai cicli vitali ed alla capacità di dispersione delle specie: specie con elevate capacità dispersive tendono ad essere meno strutturate geneticamente (grazie all’azione omogeneizzante del flusso genico), mentre le specie con capacità dispersive ridotte tendono ad essere maggiormente strutturate. È stato visto che anche in specie dotate di un elevato potenziale dispersivo possono esistere importanti strutturazioni (Zane et al., 2000). Per esempio, popolazioni localizzate su frammenti di habitat separati e dotate di larve ad ampia dispersione, si possono trovare parzialmente o totalmente isolate l’una dall’altra a causa di correnti locali, che tendono a ritenere le larve in una zona specifica, o a causa di correnti superficiali che comportano dispersione direzionale (Wares et al., 2001). Questo non è però sempre vero infatti vi sono altri esempi che fanno eccezione (Edmands et al., 1996; Jones et al., 1999; Swearer et al., 1999; Luttikhuizen et al., 2003; Taylor & Hellberg, 2003; Becker et al., 2007).
1.2 Ambiente portuale e fouling
L’ambiente portuale è generalmente caratterizzato da un forte impatto antropico. Infatti, sebbene spesso sia situato in zone naturalmente riparate quali baie o golfi (Chiswell & Rickard, 2011) viene poi ulteriormente fortificato da moli, muri di sostegno, frangiflutti e varie altre importanti costruzioni, che possono alterare pesantemente l’ambiente originario. L’ambiente che ne deriva è fortemente alterato nella sua struttura e composizione chimica, fisica, biologica, ed è caratterizzato da un rinnovo minimo dell’acqua (Antoniadou et al., 2011); l’azione antropica disturba perciò l’equilibrio delle interazioni ecologiche dell’ecosistema.
Va notato che nel Mediterraneo la crescita costante del traffico marittimo, lo sviluppo del turismo costiero e la prospettiva della creazione delle “autostrade del mare”, implicano un’estensione ed un aumento dei porti commerciali e la creazione di nuovi porti turistici (Cognetti & Maltagliati, 2005;
6
Ščančar et al., 2007; Antoniadou et al., 2011). Va inoltre aggiunto che recentemente la conservazione della biodiversità in aree economicamente importanti, come i porti, ha preso rilievo a livello comunitario a causa di una più rigida interpretazione delle leggi sulla protezione della natura (Snep & Ottburg, 2008).
All’interno dei porti il traffico navale, più o meno intenso, e le acque di scarico che vi si riversano, non facilitano il ricambio di acqua già difficoltoso data la conformazione semi-chiusa di questi ambienti. In queste zone esiste una notevole diversità nella composizione della comunità dovuta sia ad un’elevata eterogeneità spaziale e temporale, sia alla specificità delle situazioni locali quali forma e dimensioni dell’area portuale, tipo di attività e livelli di inquinamento (Cognetti, 1992). Per quanto riguarda le comunità portuali, esse sono formate da specie marine con vari gradi di opportunismo, che reagiscono ai differenti tipi di inquinamento sulla base del loro grado di adattabilità e della loro capacità di sviluppare sistemi di detossificazione adattandosi all’alterazione dei parametri chimico-fisici delle acque (Cognetti, 1992; Cognetti & Maltagliati, 2005; Antoniadou et al., 2011).
Un esempio di comunità di ambiente portuale è costituito dall’insieme di organismi che fanno parte del fouling, cioè quelle specie che colonizzano tutte le superfici artificiali rigide sommerse; questo tipo di colonizzazione è chiamato anche biofouling. La formazione delle comunità del fouling è un processo dinamico e casuale. Vi sono diverse forze che guidano questo processo, di cui la primaria è la presenza nella colonna d’acqua di larve delle specie caratteristiche. Solitamente la sequenza di insediamento delle specie del biofouling (in ordine di colonizzazione: molecole disciolte, batteri, diatomee e invertebrati) è una conseguenza della forza primaria. Le forze secondarie sono fisiche, chimiche e relative alle interazioni comportamentali tra le specie del fouling. Le interazioni tra i batteri associati alla superficie e le larve che cercano una superficie idonea all’insediamento sono un esempio ben conosciuto e documentato di forza motrice secondaria (Lau et al., 2002). Alcuni studi (Carpizo-Ituarte & Hadfield, 1998; Huang & Hadfield, 2003) hanno messo in evidenza che il biofilm presente sulla superficie del substrato innesca nel polichete Hydroides elegans lo stimolo all’insediamento ed alla metamorfosi.
7
Studi svolti in ambiente portuale hanno individuato come taxa dominanti delle comunità del fouling i policheti, i briozoi, i cirripedi e gli ascidiacei (Khandeparker et al., 1995). Studi condotti nel porto di Genova hanno evidenziato come la presenza di tali organismi vari con il passare del tempo e con il succedersi degli eventi di colonizzazione (Mor et al., 1970; Relini & Relini Orsi, 1970; Montanari & Relini, 1975; Gariglio, 1999). Un altro lavoro (Currie & Parry, 1999) svolto a Port Philip Bay, in Australia, ha mostrato come cambiamenti in tali popolamenti si possano avere anche su archi di tempo più estesi.
Lo studio delle popolazioni della comunità portuale può essere d’aiuto per valutare lo stato di salute dell’ambiente preso in esame, oppure per determinare la reazione fisiologica degli organismi esposti a sostanze inquinanti. I porti costituiscono un punto d’osservazione da cui è possibile determinare il tipo e la concentrazione degli inquinanti, osservare le reazioni individuali o delle colonie di organismi, e così formulare un piano di azione rivolto all’eliminazione dell’inquinamento e alla conservazione della biodiversità (Cognetti & Maltagliati, 2005).
1.3 Portualità e conseguenze sul pattern genetico
Le specie che vivono in ambiente portuale, a causa della particolarità di questi ambienti, subiscono modifiche a livello di pattern genico. Di seguito vengono approfondite le conseguenze sul pattern genetico di alcuni fenomeni comuni nelle aree portuali.
1.3.1 Ritenzione larvale
La gran parte dei gruppi di invertebrati marini che compongono il benthos hanno uno stadio larvale planctonico, che può vivere nella colonna d’acqua per un periodo che và da poche ore a mesi, prima di insediarsi in un habitat adeguato (Yoshinaga et al., 2010). La capacità di dispersione intrinseca alla specie influisce molto sulla vulnerabilità a fenomeni di frammentazione dell’habitat, infatti specie ad ampia dispersione larvale mostrano, in genere, condizioni tendenti alla panmissia, con livelli di strutturazione genetica molto bassi, mentre specie a bassa dispersione larvale sono comunemente caratterizzate da maggiore strutturazione (Cognetti & Maltagliati, 2004). Oltre
8
alla struttura genetica della specie, la dispersione delle larve planctoniche influenza la distribuzione delle popolazioni adulte (Hellberg et al., 2002; Yoshinaga et al., 2010), la loro persistenza (James et al., 2002), la distribuzione geografica delle specie (Strathmann et al., 2002), la risposta delle popolazioni ai disturbi locali (Steneck, 2006; van Oppen & Gates, 2006) ed il potenziale per l’adattamento locale (Cetina-Heredia & Connolly, 2011). Infine, il pattern di distribuzione spaziale e temporale delle larve può essere spiegato da un gran numero di processi diversi, come i meccanismi fisici di trasporto delle larve e la produzione locale del cibo di cui esse si nutrono (Yoshinaga et al., 2010).
La ritenzione degli stadi larvali planctonici in molti casi è essenziale per il mantenimento delle popolazioni bentoniche che vivono in ambienti isolati o frammentati. Il ruolo dei fattori idrodinamici in questi processi di ritenzione è stato molto studiato negli estuari, dove un’azione combinata dei pattern di circolazione, della stratificazione e del comportamento delle larve previene la perdita nell’oceano aperto delle larve di bivalvi, crostacei, e di altri taxa (Mullineaux & Mills, 1997). La presenza di specie endemiche con larva pelagica in molte piccole isole oceaniche mostra inoltre che la ritenzione può verificarsi abbastanza comunemente grazie ai pattern di circolazione, anche in specie a stadio larvale planctonico non breve (Mullineaux & Mills, 1997; Warner et al., 2000). Inoltre gli spostamenti verticali delle larve, scarsamente importanti in mare aperto, sono importanti negli ambienti costieri dove sono presenti gradienti molto forti di luce, temperatura e salinità (Mullineaux & Mills, 1997).
Nei casi in cui la portata della dispersione viene limitata, come nel caso della frammentazione dell'habitat (piccole isole) o della presenza di barriere come negli ambienti portuali, il flusso genico tende a diminuire (Doak et al., 1992; Warner et al., 2000). Infatti anche in specie con ampia dispersione larvale sono stati registrati apprezzabili livelli di strutturazione (Zane et al., 2000) soprattutto come conseguenza di pattern locali di circolazione che possono confinare le larve, che avrebbero un potenziale dispersivo maggiore, in aree di dimensioni ridotte (Wares et al., 2001). Il flusso genico è infatti direttamente correlato, oltre che con la fitness che i singoli individui hanno rispetto all'ambiente circostante, anche con il livello di migrazione tra popolazioni. Quindi, in assenza di un comportamento delle larve specializzato, i processi fisici presenti vicino alle coste possono causare la ritenzione di un significativo
9
numero di larve (Black et al., 1991; Porch, 1998; Warner et al., 2000). Inoltre un reclutamento più intenso e/o una maggiore abbondanza di larve possono essere associate a processi fisici che possono aumentare la ritenzione larvale (Boehlert et al., 1992; Cowen & Castro, 1994; Milicich, 1994; Warner et al., 2000).
1.3.2 Trasporto passivo
Il traffico marittimo assume un ruolo fondamentale nella dispersione degli organismi marini quando si pensa alla comunità del fouling. I natanti infatti sono stati identificati come uno dei più importanti vettori nella traslocazione di organismi (trasporto passivo) da una regione biogeografica ad un’altra, causando anche bioinvasioni. In questo contesto i porti servono da siti chiave per l’introduzione di specie aliene (Gaonkar et al., 2010; Pineda et al., 2011; Sylvester et al., 2011).
Il potenziale degli adulti di viaggiare per lunghe distanze trasportati da oggetti naturali (rafting) o artificiali, come ad esempio le chiglie delle imbarcazioni o all’interno delle acque di zavorra, rappresenta infatti un ulteriore meccanismo di migrazione (Ruiz et al., 1997; Pettengill et al., 2007; Davidson et al., 2009; Gaonkar et al., 2010; Sylvester et al., 2011). Tali meccanismi di trasporto sono riconosciuti come i principali vettori per l’introduzione accidentale di molti organismi bentonici ed anche di specie non indigene in tutti gli oceani e gli estuari (Ruiz et al., 1997; Farrapeira et al., 2010; Condie et al., 2011), e sono importanti per determinare il bilancio fra la ritenzione e la dispersione larvale delle larve costiere (Condie et al., 2011).
L’introduzione di specie aliene oltre ad essere una delle maggiori minacce alla biodiversità globale, comporta anche un impatto economico: infatti molte di queste specie sono alghe o animali sessili, che vivono nella fascia intertidale e in quella subtidale. Esse posseggono una larva pelagica che promuove la dispersione della specie e che può durare da alcune ore ad alcune settimane (Lee & Chown, 2009; Chiswell & Rickard, 2011; Sylvester et al., 2011). È più probabile che l’introduzione di queste specie avvenga nei maggiori porti commerciali, sia attraverso lo scarico delle acque di zavorra sia attraverso la colonizzazione degli scafi, tale processo include tre fasi: dispersione, introduzione e insediamento. L’espansione e la sopravvivenza di queste specie
10
in un nuovo habitat dipendono da molti fattori fra cui la disponibilità di habitat, il tasso di successo riproduttivo e la risposta ai predatori (Chiswell & Rickard, 2011; Lasso-Alcalá et al., 2011).
L’iniziativa più importante abbracciata da molti stati e dall’International Maritime Organization (IMO), per ridurre il rischio dell’introduzione di specie non indigene, è l’instaurazione di strategie di gestione delle acque di zavorra. Si è però visto che anche il fouling insediato sulle chiglie delle imbarcazioni gioca un ruolo assai importante ed in certi casi dominante nella diffusione delle specie non indigene (Ruiz et al., 1997; Davidson et al., 2009; Lee & Chown, 2009).
Una specie che si è diffusa in tutti i mari del mondo tramite trasporto passivo è l’ascidia Styela plicata. Sia le larve che gli adulti di questa specie possono essere trasportati per lunghe distanze dalle navi, infatti, tale specie è stata trovata sullo scafo di un’imbarcazione nel porto di Philadelphia sebbene risultasse assente dai substrati naturali di quella regione e fosse stata invece osservata nell’Oceano Atlantico, nel Mar Mediterraneo e lungo la costa orientale del Nord America (de Barros et al., 2009). Larve di S. plicata non ancora metamorfosate sono state raccolte anche nelle acque di zavorra (Svane e Young, 1989) ma si ritiene che il trasporto più probabile sia in qualità di organismo del fouling nella sua fase adulta. Adulti di questa ascidia sono infatti stati trovati insediati sugli scafi delle imbarcazioni o sui lati degli scompartimenti di zavorra (Monniot & Monniot, 1994; Lambert & Lambert, 1998).
1.3.3 Inquinamento
L’inquinamento marino può essere definito come: “l’introduzione, diretta o indiretta, da parte dell’uomo di sostanze o energie nell’ambiente marino che si manifestano con effetti deleteri come: il danneggiamento delle risorse utili, i rischi per la salute umana, ostacolo delle attività marine, tra cui la pesca, ed il deterioramento della qualità dell’acqua di mare” (Bat et al., 2009). Gli habitat bentonici nei porti delle regioni temperate sono considerati hot-spot di inquinamento poiché sottoposti alla diffusione di metalli pesanti, di idrocarburi e di materia organica (Boudouresque & Verlaque, 2002; Antoniadou et al., 2011). Un rischio per la sicurezza dell’ambiente marino (biosicurezza) è associato alle misure antifouling, quali ad esempio le vernici che vengono applicate sulle chiglie delle imbarcazioni ed utilizzate per limitare la crescita degli organismi del
11
fouling. In passato tali vernici utilizzavano come copolimero il tri-butil-stagno
(TBT), tuttavia a causa del suo carico tossico sull’ambiente marino l’utilizzo di questo biocida è stato interdetto dal gennaio 2008 (Ščančar et al., 2007; Srinivasan & Swain, 2007; Hopkins & Forrest, 2008). Da allora sono state impiegate vernici contenenti altri biocidi, anch’essi in grado di inquinare l’ambiente e, in alcuni casi, di alterare il ciclo riproduttivo di alcune specie. Un esempio di questi biocidi è il rame, di cui tali vernici sono la maggior fonte in mare (Ščančar et al., 2007; Srinivasan & Swain, 2007; Hopkins & Forrest, 2008; Cognetti et al., 2012).
Altre fonti di inquinamento in aree costiere ed estuari sono l’agricoltura, l’industria ed i rifiuti domestici. Uno degli inquinanti più importanti che ne derivano è il mercurio che normalmente si ritrova associato al particolato in sospensione che in natura è essenzialmente composto da materiale organico (Cairrão et al., 2007).
Lo studio delle popolazioni presenti nell’ambiente portuale può essere d’aiuto per valutare lo stato di salute dell’ambiente preso in esame, oppure per determinare la reazione fisiologica degli organismi esposti a sostanze inquinanti. I porti costituiscono un punto d’osservazione da cui è possibile determinare il tipo e la concentrazione degli inquinanti, osservare le reazioni individuali o delle colonie di organismi, e così formulare un piano di azione rivolto all’eliminazione dell’inquinamento e alla conservazione della biodiversità (Cognetti & Maltagliati, 2005).
Gli adattamenti che le specie portuali adottano per sopravvivere possono essere di due tipi, non genetici, come lo sviluppo di tolleranza ad un inquinante (acclimatazione fisiologica) e genetici (adattamento genetico) (Kostamo et al., 2011). I primi coinvolgono meccanismi fisiologici finalizzati a sviluppare sistemi di resistenza alla tossicità dei contaminanti. I secondi comportano un costo che si può quantificare nella perdita di alleli o nella modificazione della struttura genetica della popolazione e possono essere indagati attraverso analisi molecolari (Kovatch et al., 2000). La riduzione della diversità genetica nelle popolazioni naturali è spesso dovuta ad inquinanti di origine antropica che possono causare effetti genetici quali colli di bottiglia e alterazioni nei modelli di flusso genico. Questi ed altri fattori possono portare al declino del potenziale evolutivo complessivo delle specie tramite erosione genetica attribuibile ad una
12
riduzione nella dimensione della popolazione, o possono, in ultima analisi, portare all’estinzione della popolazione stessa (Cognetti & Maltagliati, 2004). La presenza di contaminanti può agire sulla struttura genetica delle popolazioni naturali in due modi: 1) aumentando la variabilità genetica attraverso l’apparizione di nuove forme grazie all’elevato tasso di mutazione, oppure 2) diminuendo la variabilità genetica complessiva, in seguito a colli di bottiglia demografici che avvengono per l’accresciuto tasso di mortalità. Entrambi questi effetti possono essere accompagnati dall’alterazione delle frequenze alleliche e dalla selezione di genotipi importanti per la sopravvivenza in acque inquinate o dalla fissazione di alleli deleteri (Bickham et al., 2000).
Quindi la totalità della diversità genetica in una specie rappresenta un bilancio dinamico fra mutazioni, deriva genetica e selezione (Templeton et al., 2001). Inoltre l’acquisizione della resistenza agli stress derivati dall’inquinamento può avere un effetto negativo sulla fitness, infatti, secondo la teoria dell’allocazione delle energie, il mantenimento delle difese da stress consuma energie che l’organismo potrebbe, in assenza di questi stress, utilizzare per l’accrescimento o la riproduzione (Xie & Klerks, 2004). Alcuni esperimenti suggeriscono che il costo iniziale per l’acquisizione dell’adattamento diminuisce gradualmente o per la sostituzione dei geni ad alto costo di fitness con altri geni resistenti all’inquinamento a minor costo, o perché la selezione naturale interviene contro la perdita di fitness (Carrière & Roff, 1995; Xie & Klerks, 2004). Lo stress può essere definito come un evento di grande impatto sui processi evolutivi ed ecologici e può causare cambiamenti irreversibili a prescindere dalla densità del popolamento dell’organismo (Parsons, 1991).
Si è visto che il balano Amphibalanus amphitrite predilige gli ambienti portuali e sembra persino essere favorito dall’inquinamento, vista la sua rarità o addirittura assenza in ambienti non impattati (Calcagno et al., 1998). L’azione dei metalli pesanti ad esempio, secondo uno studio effettuato sull’eterozigosità di A. amphitrite da Patarnello et al. (1991), opera un’importante selezione nel periodo immediatamente successivo all’insediamento di questa specie in ambienti inquinati. Infatti, i campioni raccolti nell’area industriale di Porto Marghera (laguna di Venezia) mostrano una significativa riduzione del polimorfismo genetico rispetto a quelli campionati in due siti non impattati: uno
13
situato vicino allo scarico delle acque del sistema di raffreddamento della centrale elettrica di Marghera e uno a Chioggia. Gli effetti genetici dell’inquinamento sono stati dimostrati in studi precedenti effettuati nella laguna di Venezia (Battaglia et al., 1980) ed in una popolazione di A. amphitrite della Baia di Haifa (Israele) (Nevo et al., 1978). In entrambi i casi è stata riscontrata un significativa riduzione del polimorfismo genetico, in accordo con i risultati ottenuti da Patarnello et al. (1991).
La selezione operata dai metalli pesanti sembra agire direttamente sulle proteine, modificandone le caratteristiche e l’efficienza degli enzimi (Nevo et al., 1983) ed influenzando la fitness dell’organismo. Ciò è in accordo con lo studio precedente condotto nella baia di Haifa, in Israele, sempre su A. amphitrite da Nevo et al. (1978), in cui è stato rilevato come tra i 15 loci polimorfici identificati tramite elettroforesi degli alloenzimi, almeno 10 mostrassero differenze nelle frequenze alleliche tra i tre siti presi in esame, con un significativo aumento di particolari alleli nei siti inquinati ed un sostanziale decremento dell’eterozigosità procedendo verso le zone più inquinate.
1.4 Scelta e descrizione delle specie bersaglio
L’individuazione delle specie bersaglio per il presente studio ha previsto un campionamento pilota volto ad identificare quali fossero le specie più adatte alle indagini. Le caratteristiche che sono state ritenute fondamentali per la selezione delle specie sono: l’appartenenza al fouling, l’abbondanza, la facilità di campionamento all’interno delle aree portuali e le diverse durate della fase di dispersione larvale. Lo studio pilota si è svolto nei porti di La Spezia e Viareggio e sotto la chiglia di un’imbarcazione. Ciò ci ha permesso di individuare quali fossero le specie più comuni in ambiente portuale ed in particolar modo quali facessero parte del fouling e fossero quindi passibili di trasporto passivo. Le tre specie alla fine prescelte ed impiegate in questo studio sono: il crostaceo cirripede Amphibalanus amphitrite (Darwin, 1854), il polichete Hydroides elegans (Haswell,1883) e l’ascidia Styela plicata (Lesueur, 1823).
14
1.4.1 Amphibalanus amphitrite
1.4.1.1 Morfologia dei Cirripedi
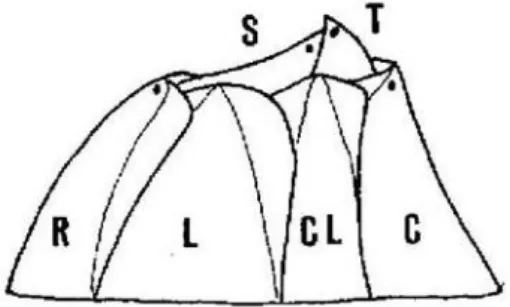
Il termine Cirripedi che identifica la classe deriva dalla presenza in questi organismi dei caratteristici cirri, appendici bifide multiarticolate (Relini, 1980). Tali animali allo stadio adulto possono essere sessili, peduncolati o meno, oppure parassiti di altri organismi. I Cirripedi peduncolati hanno il corpo diversificato in un lungo peduncolo, che l'animale usa per fissarsi al substrato, ed in un capitolo rappresentato dal resto del corpo (Riedl, 1991), mentre le forme prive di peduncolo sono caratterizzate dalla presenza di un esoscheletro secreto dal mantello, una struttura che avvolge il corpo dei Cirripedi, ed è flessibile a livello delle giunture dei somiti (Stubbings, 1975). Tale esoscheletro è formato da tre parti: la muraglia, la base e l’apparato opercolare, le prime due parti sono fuse insieme a formare la conchiglia mentre la terza è l’unica parte mobile. La muraglia circonda l’animale e comprende sei piastre calcaree (rostro, carena, due piastre laterali e due careno-laterali) (Fig. 1.1) (Relini, 1980) che si sovrappongono l’una all’altra e sono tenute insieme da tessuto vivente, da denti che si incastrano o da vere e proprie fusioni. La base è la parte che aderisce al substrato ed è di natura calcarea, essa è collegata alla muraglia tramite una particolare articolazione che conferisce solidità e consente l’accrescimento di entrambe le parti. L’opercolo infine è composto da quattro piastre mobili: due scuta (dalla parte del rostro) e due terga (dalla parte della carena) (Fig. 1.1) (Relini, 1980), di forma triangolare. Gli scuta sono di dimensioni maggiori e i terga presentano, nel margine basale, una protuberanza chiamata sperone, di dimensioni molto variabili (Relini, 1980).
Fig. 1.1: Schema delle piastre di A. amphitrite. S=Scuta, T=Terga, C=Carena, R=Rostro, L=Laterali, CL=Careno-Laterali (da Relini, 1980).
15
Ogni piastra presenta una parte centrale detta parete e due prolungamenti, grazie ai quali i vari pezzi si incastrano tra loro, detti ali quando vengono coperti e radii quando ricoprono. I tubuli delle pareti sono privi di setti traversi, mentre ali e radii sono paralleli alla base ed i secondi sono larghi e con le estremità crenulate. Gli scuta muniti di una banda trasversale colorata, sono percorsi da coste trasversali; il rilievo articolare si estende per i tre quinti della lunghezza del margine tergale ed il rilievo dell’adduttore è moderatamente lungo e ben separato dal rilievo articolare. I terga non sono acuminati, il loro sperone è molto variabile, dista dal lato basi-scutale per più della metà della sua lunghezza e quest’ultima è pressoché uguale alla larghezza. Il margine basale è dritto o leggermente concavo sul lato carenale. Il labrum è munito di numerosi dentelli che si spingono fino all’intaccatura centrale.
I sei cirri sono arti bifidi presenti sui primi 6 segmenti del tronco; ciascun segmento possiede un paio di cirri. Ogni cirro a sua volta è costituito da 2 segmenti basali (pedicelli) e da due lunghi rami (uno interno o posteriore ed uno esterno o anteriore) formati da numerosi segmenti. Pedicelli e segmenti dei rami sono muniti di setole e talora anche di spine e/o denti. Questi cirri sono utilizzati dall’animale per l’alimentazione e vengono estroflessi per catturare il cibo dall’acqua e riportati all’interno del guscio per convogliare il cibo alla bocca (Relini, 1980; Riedl, 1991).
La bocca è situata in una grande protuberanza chiamata cono orale immediatamente davanti al primo paio di cirri ed è formata da un pezzo impari anteriore sub triangolare, il labrum, ai lati del quale si trovano i palpi, le mandibole ed infine due paia di mascelle. Il canale alimentare è costituito da tre parti fondamentali: stomaco, intestino ed ano. Inoltre le ghiandole digestive sboccano nella parte mediana e l’ano si apre dorsalmente presso l’estremità posteriore del corpo (Relini, 1980).
Il sistema circolatorio nei Cirripedi è formato dalla cavità celomatica, senza vasi sanguigni. All’interno di questa cavità la circolazione sanguigna è generata dall’apparato muscolare che funziona come una pompa-sanguigna (Stubbings, 1975).
La respirazione avviene in particolare attraverso la superficie interna del mantello e dei suoi diverticoli chiamati branchie ed è facilitata dal movimento dell’acqua prodotto dal battito dei cirri (Relini, 1980).
16
I muscoli più importanti, che assicurano il movimento delle parti mobili, sono i muscoli opercolari ed in particolare gli adduttori degli scuta ed i depressori degli scuta e dei terga (Relini, 1980).
Il sistema nervoso dei Cirripedi è composto da gangli subesofagei e sopraesofagei collegati da commessure e da un nervo principale ventrale simile a quello degli Anellidi (Stubbings, 1975; Relini, 1980).
Per quanto riguarda l’apparato riproduttore i testicoli sono molto ramificati e si estendono dalla regione cefalica a quella del tronco, mentre i deferenti si riuniscono in un canale impari che percorre un lungo pene situato all’estremità posteriore del corpo. Il pene può allungarsi al di fuori delle valve fino a raggiungere un individuo vicino per fecondarlo. L’apparato riproduttivo femminile è costituito da un paio di ovari, che sono alloggiati nel tessuto del mantello sovrastante la base dagli ovidotti e le ghiandole dell’ovidotto. Le uova vengono depositate in particolari sacchetti in cui sono fecondate, quindi subiscono una segmentazione totale ineguale. Quando i nauplii sono formati vengono liberati nell’acqua ed ha inizio la fase planctonica (Relini, 1980).
1.4.1.2 Inquadramento sistematico di A. amphitrite
I Cirripedi erano stati inizialmente classificati come Molluschi per la presenza della conchiglia e soltanto nel 1830, successivamente all'identificazione degli stadi larvali, sono stati riconosciuti come appartenenti all’ordine dei Crustacea. La loro forma aberrante rispetto agli altri membri del subphylum è stata attribuita ad un adattamento alla vita sessile piuttosto che all'appartenenza ad un'altra divisione.
I Cirripedi sono ascrivibili al phylum degli Arthropoda per caratteristiche tipiche del taxon come la respirazione acquatica, la presenza di antenne sul secondo e terzo segmento e di mandibole sul quarto nonché di uno stadio larvale naupliare (Stubbings, 1975).
Le linee della sistematica dei Cirripedi sono state stabilite da Darwin tra il 1851 ed il 1854 e sono state successivamente revisionate ed ampliate da Pilsbry nel 1916 e, per i Balanoformi, da Newman e Ross nel 1976. Successivamente Pitombo (2004) ha effettuato un’importante revisione filogenetica dei Balanidae inserendo una nuova famiglia: Amphibalanidae. Di
17
conseguenza, Balanus amphitrite è stato rinominato Amphibalanus amphitrite (Pitombo, 2004; Anil et al., 2010).
Di seguito viene riportato l’inquadramento sistematico di A. amphitrite:
PHYLUM Arthropoda SUBPHYLUM Crustacea CLASSE Maxillopoda SOTTOCLASSE Thecostraca INFRACLASSE Cirripedia SUPERORDINE Thoracica ORDINE Sessilia SUBORDINE Balanomorpha SUPERFAMIGLIA Balanoidea FAMIGLIA Amphibalanidae GENERE Amphibalanus
SPECIE Amphibalanus amphitrite (Darwin 1854)
1.4.1.3 Morfologia di A. amphitrite
Amphibalanus amphitrite è riconoscibile per il guscio liscio, striato longitudinalmente in bianco, rosa o porpora, che presenta una forma conica o tubuloso-conica. Le placche abbastanza sottili presentano le bande colorate raggruppate in maniera tale che il centro della placca stessa appaia bianco (Fig. 1.2) (Stubbings,1975). Il diametro basale massimo di A. amphitrite registrato nei nostri mari è di 18-20 mm (Relini, 1980).
18
1.4.1.4 Biologia e ciclo vitale di A. amphitrite
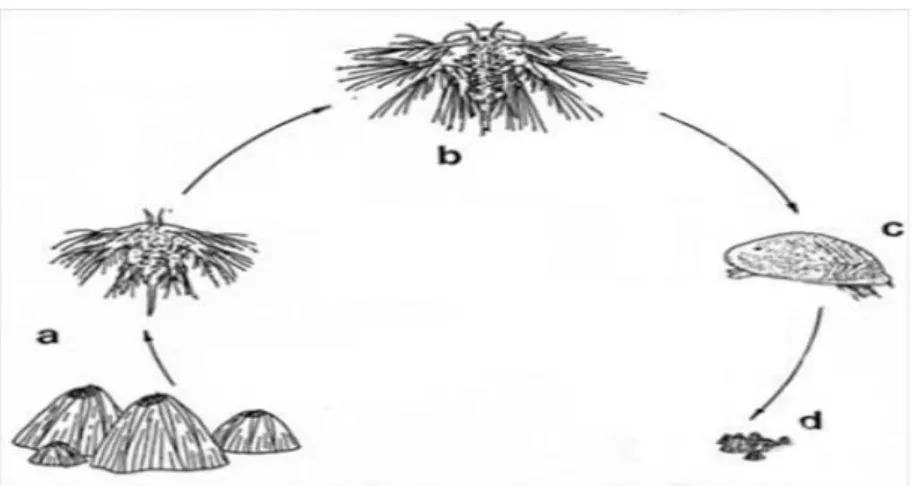
La dispersione di A. amphitrite, che è una specie ermafrodita a fecondazione incrociata, dura circa 20 giorni (Raimondi, 1992) ed avviene tramite i suoi sette stadi larvali che si sviluppano dalle uova fecondate custodite nella cavità del mantello. Alla schiusa delle uova viene rilasciata in acqua una larva planctonica chiamata nauplius. Dei sette stadi larvali i primi sei sono stadi naupliari, essi sono liberamente natanti a partire dal secondo stadio e si alimentano nella colonna d’acqua. Questi, successivamente, evolvono nello stadio finale, la cipride che sopravvive per circa una settimana, non alimentandosi e sfruttando le riserve di cibo accumulate in precedenza, questa larva è quella che si insedia e metamorfosa nella forma adulta (Fig. 1.3) (Raimondi, 1992) dopo aver trovato un substrato idoneo che cerca con le antennule (Lagersson & Høeg, 2002).
Fig. 1.3: Rappresentazione del ciclo vitale di un balanomorfo. (a) balani che liberano naupli, (b) 6° stadio naupliare, (c) cipride, (d) piccoli balani da poco metamorfosati (da Relini, 1980).
L’insediamento avviene maggiormente nel periodo estivo, sebbene avvenga in piccola parte anche in autunno, mentre la longevità media stimata è di 22 mesi (Calcagno et al., 1998). È stato inoltre dimostrato che l’insediamento è influenzato da vari fattori quali la presenza di conspecifici, le proprietà del substrato, l’ambiente in cui le larve si sviluppano, le condizioni fisiologiche della larva e le comunità microbiche. Uno studio condotto da Qian et al. (2003) ha mostrato che cambiamenti delle comunità batteriche presenti nel biofilm possono modificare la capacità di insediarsi delle larve dei balani, è stato inoltre visto che in presenza di inquinamento l’accrescimento dell’animale si riduce (Relini & Relini Orsi, 1970).
19
La metamorfosi della larva in un individuo giovanile è un processo molto costoso dal punto di vista energetico. Inoltre è stato visto che nella cypris di A. amphitrite è molto abbondante una proteina di riserva detta CMP (Cyprid Major Protein), simile al vitello, che viene accumulata durante i vari stadi naupliari e diminuisce drasticamente nel periodo che và dalla metamorfosi al giovane adulto. Si pensa che dopo la trasformazione in cipride, la CMP venga usata nel periodo in cui la larva si prepara all’insediamento. Inoltre lo studio di Tremblay et al. (2007) mette in evidenza l’importanza delle condizioni fisiologiche della cipride durante l’insediamento, in questo studio viene messo in evidenza il ruolo dei livelli lipidici (soprattutto del TAG, triacilglicerolo) nella selezione dell’habitat su piccola scala temporale. Per la cipride di A. amphitrite infatti, insediarsi quando il contenuto energetico è alto non significa solo aumentare le possibilità di portare a termine la metamorfosi con successo, ma anche aumentare il potenziale di crescita giovanile (Thiyagarajan et al., 2005; Emlet & Sadro, 2006). Siccome i primi giorni successivi alla metamorfosi sono solitamente considerati critici, la condizione fisiologica delle larve prima dell’insediamento è importante per il reclutamento (Gosselin & Qian, 1997; Tremblay, 2007).
Lungo le coste mediterranee Amphibalanus amphitrite ha una vita alquanto breve che và dai 77 giorni circa fino anche a 15 - 17 mesi, mentre nella zona intertidale di Quequén la durata stimata della vita di questa specie è di 22 mesi,e la massima longevità attesa è di 5-6 anni (Calcagno et al., 1998).
1.4.1.5 Ecologia di A. amphitrite
I Cirripedi sono una delle maggiori componenti del fouling delle zone portuali e delle chiglie delle imbarcazioni (Calcagno et al., 1998). Tra questi la specie maggiormente rappresentata è Amphibalanus amphitrite che ha un’amplissima distribuzione geografica (Khandeparker et al., 1995). È infatti presente dall’Africa sud-orientale alla Malesia; dalle Hawaii al Giappone e all’Australia; sulla costa orientale dell’Asia dalla Cina a Vladivostok; dalle Bermuda al est degli Stati Uniti, al Brasile; dalla California centrale al sud-ovest del Messico; dal sud Africa alle coste occidentali dell’Europa fino all’Inghilterra. Si ritrova inoltre nel Mediterraneo, nel Mar Nero e nel Mar Rosso. In Italia è comune in tutti i mari. In genere questa specie è facilmente osservabile soprattutto nei porti e negli ambienti marini ad elevato grado di
20
antropizzazione. Essendo una specie eurialina è presente anche nelle lagune come quelle di Venezia e di Orbetello. In Italia si trova dal limite superiore dell’infralitorale fino a circa 65-70 metri di profondità. Si insedia preferibilmente nei mesi estivi, durante i quali effettua un accrescimento rapido (Relini & Relini Orsi, 1970; Relini, 1980). Questi animali vivono attaccati a superfici dure come, ad esempio, rocce, conchiglie, banchine, cime d’ormeggio, boe o chiglie delle imbarcazioni.
1.4.2 Hydroides elegans
1.4.2.1 Morfologia dei Serpulidi
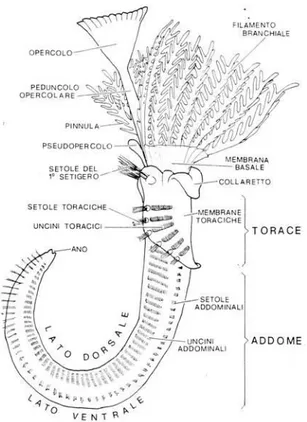
I policheti serpuloidei sono un gruppo di anellidi essenzialmente marini che vivono in un caratteristico tubo calcareo, che può essere liscio o ornato di creste, ed hanno un corpo vermiforme caratterizzato come in tutti gli anellidi dal fenomeno della metameria, per il quale si presenta suddiviso in una serie di segmenti, i metameri. I segmenti però non sono tutti uguali tra loro nelle diverse zone del corpo che appare diviso in 3 parti: la regione cefalica, il torace e l’addome. La regione cefalica porta la corona branchiale che serve all’animale per le funzioni nutritizie e respiratorie ed è costituita da un certo numero di filamenti (Fig. 1.4).
Nella maggior parte delle specie il primo o il secondo filamento dorsale da uno dei due lati porta un opercolo terminale, che è la struttura adibita a richiudere l’animale nel suo tubulo, e si chiama peduncolo opercolare. In alcuni casi il filamento corrispondente al peduncolo dal lato opposto è di lunghezza ridotta e prende il nome di pseudo-opercolo, in caso di necessità esso può rigenerare un opercolo funzionale, non è raro per esempio vedere esemplari di Hydroides provvisti di due opercoli completi. L’opercolo è composto da due parti: l’ampolla opercolare vescicolosa e una parte terminale cornea chiamata placca o calotta (Fig. 1.4).
21
Fig. 1.4: Principali tratti dell’organizzazione esterna di un Serpulide (da Bianchi, 1981).
I serpuloidei mancano di occhi ma presentano talvolta delle sorte di ocelli, semplici macchie pigmentate che possono essere situate sul prostomio, sui lobi branchiali, sui filamenti branchiali o sul primo segmento toracico.
L’apparato digerente è costituito da un tubo pressoché rettilineo privo di cellule ghiandolari. Alla bocca seguono l’esofago, lo stomaco, l’intestino ed il retto che sbocca con l’ano in posizione terminale.
L’apparato circolatorio è di tipo chiuso ed è composto da due grossi vasi longitudinali, uno dorsale ed uno ventrale collegati da anse trasversali in ogni metamero, mentre altri vasi irrorano le branchie, l’opercolo e le membrane toraciche. Non esiste il cuore e la circolazione del sangue è assicurata dalle contrazioni dei vasi stessi.
Il sistema respiratorio è costituito dalle branchie, ma la respirazione è in parte anche cutanea, favorita dalla circolazione attiva dell’acqua nel tubo e dalla ricca irrorazione sanguigna delle membrane toraciche.
La muscolatura è di tipo circolare e longitudinale. La prima a causa dell’habitat sedentario è poco sviluppata, mentre la seconda che permette all’animale di ritirarsi rapidamente nel tubo è molto sviluppata. Comunque tutta la muscolatura è composta da fibre lisce.
22
Il sistema nervoso è formato da più gangli fusi insieme situati nel prostomio (regione cefalica) e di due grossi cordoni nervosi longitudinali ventrali, in corrispondenza di ogni metamero esistono fibre nervose trasversali che connettono fra di loro le precedenti, mentre altre importanti fibre innervano le branchie e l’opercolo.
Per quanto riguarda l’apparato riproduttore le cellule germinali si originano dai gonociti ed a maturità vengono estromesse tramite i gonodotti. Và detto che molte specie sono ermafrodite e solo alcune hanno forse sessi separati, e solitamente si tratta di ermafroditi proterandrici a fecondazione incrociata, inoltre nella maggior parte delle specie la fecondazione è esterna ed avviene nell’acqua. La larva che ne deriva è una trocofora che poi evolve in una metatrocofora pronta per l’insediamento.
1.4.2.2 Inquadramento sistematico di H. elegans
Il gruppo Annelida è molto diversificato e comprende circa 16,500 specie (Zhong et al., 2008). La più grande fra le classi degli anellidi è quella dei Polychaeta che contiene 71 famiglie (Castelli et al., 2008) con più di 5,300 specie; al suo interno troviamo l’ordine Sabellida con la superfamiglia Serpuloidea che a sua volta si divide in 2 famiglie quella degli Spirorbidae e quella dei Serpulidae.
PHYLUM Annelida CLASSE Polychaeta SOTTOCLASSE Canalipalpata ORDINE Sabellida FAMIGLIA Serpulidea GENERE Hydroides
SPECIE Hydroides elegans (Haswell 1883)
1.4.2.3 Morfologia di H. elegans
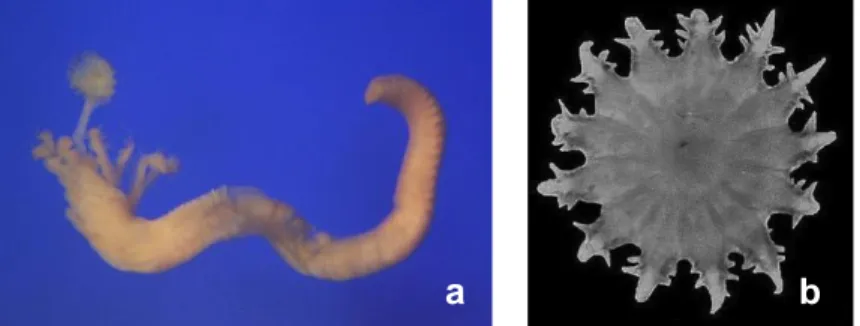
Hydroides elegans (Fig. 1.5.a) vive in un tubo calcareo, cilindrico o leggermente appiattito nella sua superficie superiore, liscio, senza carene e nel caso di aggregazioni di individui ad elevata densità, i tubi possono presentare l’estremità distale sollevata (Bianchi, 1981). La lunghezza del tubo varia tra i 20
23
e 25 mm, la velocità di crescita è normalmente di 6-10 mm/mese e di 10-14 mm/trimestre, fino a superare i 20 mm dopo un anno (Bianchi, 1981). Presenta un opercolo con simmetria radiale, la cui parte inferiore presenta un bordo suddiviso in circa 30 denti marginali corti e arrotondati. Il verticillo superiore è composto da 10-20 spine uguali, scarsamente cornificate, disposte a cerchio attorno ad una zona centrale che può essere piatta e liscia o occupata da una spina centrale più o meno sviluppata (Fig. 1.5.b); le spine periferiche presentano alcuni denti laterali ed un’estremità distale corta e tozza. Ha inoltre setole speciali provviste di una zona sub-apicale fittamente denticolata, terminante in due o più denti superiori leggermente più grossi. Per quanto riguarda la colorazione, il tubo è bianco, il corpo è rossastro con le branchie anellate di rosso e l’opercolo è giallastro. Gli esemplari di questo polichete possono raggiungere una lunghezza di 20-25 mm (Bianchi, 1981).
Fig. 1. 5: a) Hydroides elegans (Haswell 1883) privo di tubo calcareo e b) opercolo con verticillo inferiore e superiore.
1.4.2.4 Biologia e ciclo vitale di H. elegans
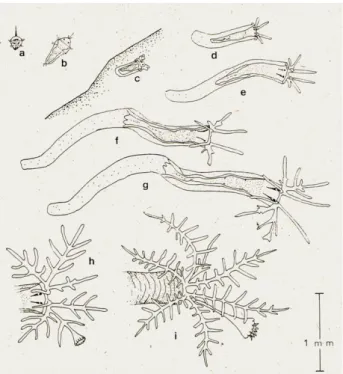
Molti invertebrati marini bentonici hanno un ciclo vitale complesso che consiste di uno o più stadi larvali planctonici e uno stadio adulto. In H. elegans è stato visto che la maggior parte degli individui in attività riproduttiva ha una lunghezza del tubo uguale o maggiore ai 12 mm ed in media la fecondità oscilla fra 1100-9050 oociti per femmina (Qiu & Qian, 1998). La transizione dallo stadio larvale a quello adulto include l’insediamento della larva e la sua metamorfosi nella forma giovanile (Huang & Hadfield, 2003). H. elegans si riproduce durante tutto l’anno, primavera esclusa, con un massimo tardo-estivo. La vita larvale è planctonica ed ha una durata relativamente breve che può variare da 6 giorni a 3 settimane. Lo sviluppo dell’animale durante la fase planctonica può essere diviso in 6 diversi stadi che comprendono l’uovo
24
fecondato, la blastula ciliata e 2 larve: la prima è una trocofora che durante lo sviluppo si allunga nella sua parte posteriore, appare poi segmentata e metamorfosa in metatrocofora (Fig. 1.6) (Bianchi, 1981; Cognetti et al., 2002; Seaver et al., 2005).
In laboratorio, le uova di H. elegans fertilizzate si sviluppano in trocofora in 12 ore e la larva può svilupparsi completamente in 4-5 giorni e divenire pronta per insediarsi e metamorfosare nello stadio giovanile (Wang & Qian, 2010).
Fig. 1.6: Rappresentazione del ciclo vitale di Hydroides elegans. a) trocofora; b) metatrocofora; c) stadio immediatamente post metamorfico; d-g) l’animale ed il suo tubulo dopo 1, 2, 3, e 4 giorni dalla fissazione; h,i) estremità anteriore dello stesso, dopo 9 e 16 giorni dalla fissazione (Bianchi, 1981).
Inoltre il picco dell’insediamento si verifica in estate o in autunno quando la temperatura dell’acqua è più elevata. Qiu e Qian (1997) hanno rilevato che ad Hong Kong l’insediamento di questi organismi è maggiore dall’inizio della primavera all’inizio dell’estate, quando la temperatura dell’acqua è ancora bassa e la salinità è alta. Successivamente Qiu e Qian (1998) hanno suggerito che le condizioni necessarie per la riproduzione sono una salinità superiore al 25‰ ed una temperatura maggiore di 20°C Lau et al. (2002). L’insediamento avviene solo a temperature maggiori di 15°C raggiungendo la punta massima oltre i 18°C (Bianchi, 1981). Dagli studi effettuati da Carpizo-Ituarte e Hadfield
25
(1998), Huang e Hadfield (2003) e Huang et al. (2007) appare evidente che il biofilm presente sulla superficie del substrato inneschi in H. elegans lo stimolo all’insediamento ed alla metamorfosi in larve di cinque giorni (80%) e in larve di quattro giorni (39%), inoltre è stato visto che il batterio Pseudoalteromonas spongiae può formare un biofilm che induce l’ancoraggio di H. elegans. Dopo cinque minuti dall’esposizione al biofilm la larva secerne un muco appiccicoso dalla porzione posteriore del corpo e inizia a formare il tubo primario. Dopo 10-15 minuti dall’esposizione al biofilm la formazione del tubo primario è completa rendendo l’insediamento permanente.
La metamorfosi ha inizio con la secrezione del tubo primario, il prototroco viene riassorbito, il corpo si allunga e la regione del collare si riduce. La secrezione del tubo calcareo secondario ha inizio 102 minuti dopo l’induzione della metamorfosi e l’iniziale accrescimento dei radioli branchiali segna il principio dello sviluppo giovanile (Carpizo-Ituarte & Hadfield,1998). Il biofilm batterico, che modifica le caratteristiche chimico-fisiche del substrato, può rafforzare l’insediamento iniziale delle larve e serve da nutrimento per i giovani e gli adulti. L’insediamento è ridotto o eliminato quando il biofilm è distrutto dalla bollitura, dai raggi UV o dall’esposizione a formaldeide, glutaraldeide, etanolo o metanolo (Unabia & Hadfield, 1999). In alcuni casi H. elegans può vivere fino a 4-8 anni (Bianchi, 1981)
1.4.2.5 Ecologia di H. elegans
Hydroides elegans è una specie comune del fouling della fascia intertidale e di quella subtidale che si insedia su una grande varietà di substrati naturali ed artificiali, quali ad esempio rocce, pezzi di legno, carene di imbarcazioni, colonie di briozoi, come Bugula neritina, o gabbie per l’acquacoltura, ed è diffusa nelle baie e nei porti delle acque tropicali e temperate (Bryan et al.,1998; Huang & Hadfield, 2003). H. elegans è una specie cosmopolita di mari caldi e temperato-caldi, diffusasi grazie al trasporto passivo sulle chiglie delle navi ed introdotta nel Mediterraneo. Rara all’esterno dei porti all’interno di essi può proliferare fino a formare spessi ammassi di tubi, può comunque essere raccolta in biotopi infralitorali, generalmente a bassa profondità. Tollera sia l’inquinamento che le ampie variazioni di salinità e può quindi vivere in ambienti salmastri quali lagune ed estuari (Bianchi, 1981).
26
Dallo studio condotto da Cole et al. (2005) è stato visto come la struttura costituita dai gusci dei mitili favorisce l’insediamento da parte di Hydroides elegans, non semplicemente per l’aumento di superficie fornito dalla presenza dei gusci, ma perché essi alterano i modelli dei flussi che influiscono sull’insediamento delle larve. Inoltre la sopravvivenza delle larve sulle chiglie delle imbarcazioni durante il reclutamento può essere aumentata dai rifugi creati dai gusci. Fattori importanti nel determinare la distribuzione di H. elegans sulle chiglie delle imbarcazioni sono la predazione, la competizione e il sovrasviluppo degli organismi sessili, è inoltre possibile che in caso di una scarsa presenza di mitili le larve siano soggette ad una maggiore predazione (Cole et al., 2005).
I radicali dell’ossigeno prodotti dal biofilm secondo uno studio condotto da Wang e Qian (2010) possono indurre la metamorfosi delle larve.
H. elegans si nutre, attraverso la filtrazione dell’acqua, di particelle organiche e microrganismi planctonici. Le ciglia presenti sui tentacoli fanno circolare l’acqua e un sottile strato di muco intrappola le particelle alimentari che sono trasportate e convogliate verso la bocca. H. elegans, però, può all’occorrenza divenire batterivoro; infatti, il plancton costituisce una risorsa di cibo caratterizzata da ampie variazioni di abbondanza. Grosselin e Qian (2000) hanno dimostrato la capacità dei giovani di Hydroides elegans, del briozoo Bugula neritina e del cirripede Amphibalanus amphitrite di utilizzare i batteri per garantire la sopravvivenza e la crescita quando il fitoplancton scarseggia. Alla concentrazione batterica di circa 2 o 3.5 x 106 cellule/ml, intervallo di valori realmente osservati sul campo, i giovani di B. neritina e H. elegans diventano effettivamente batterivori (Grosselin & Qian, 2000).
Va detto anche che questa specie è resistente nei confronti dell’impiego di trattamenti antifouling e nella colonizzazione si comporta da specie pioniera (Bianchi, 1981).
1.4.3 Styela plicata
1.4.3.1 Morfologia dei Tunicati
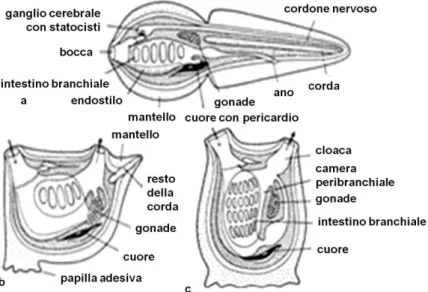
I tunicati sono per la maggior parte animali marini fissi, che appartengono al Phylum dei Cordati. La loro appartenenza ai Cordati è motivata
27
dalla larva. Infatti delle cinque principali caratteristiche dei cordati, le ascidie adulte ne possiedono solo due: le fessure branchiali faringee e l’endostilo. Mentre le larve le possiedono tutte: la notocorda, il cordone nervoso dorsale cavo, la coda post-natale propulsiva ed il faringe con fessure branchiali e endostio. Le prime tre caratteristiche però vengono perse dalla larva al momento della metamorfosi (Riedl, 1991; Cognetti et al., 2002; Hickman et al., 2003).
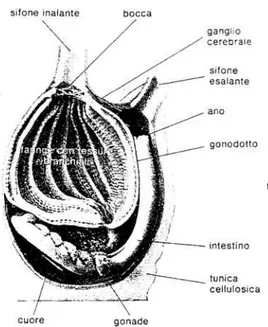
Nei Tunicati il corpo è rivestito da un mantello gelatinoso denso detto tunica, la cui composizione è singolare: è composta infatti da un prodotto dello strato ectodermico in cui prevale la tunicina, una sostanza simile alla cellulosa, ed in cui migrano le cellule, per lo più mesodermiche, che gli conferiscono un carattere di tessuto connettivale (Fig. 1.7).
Fig. 1.7: Modello in sezione di un’ascidia adulta (da Weisz, 1978).
L’apparato digerente è formato da un’ampia bocca, o sifone inalante, che conduce ad un intestino branchiale (o cestello branchiale), composto da barre branchiali interconnesse disposte longitudinalmente e trasversalmente munite di cilia (Armsworthy, 1993), si ottengono così migliaia di fessure o stigmi, che vanno a formare un fitto setaccio. Il faringe oltre agli stigmi possiede in posizione ventrale l’endostilo ed in posizione dorsale una serie di lobi sporgenti nella cavità branchiale. L’intestino è piuttosto corto e spesso ed è formato da un breve esofago, dallo stomaco, dal quale si dipartono i ciechi pilorici, e dall’intestino terminale che sbocca nella cloaca, o sifone esalante.
28
Nei tunicati il cuore giace ventralmente dietro l’intestino branchiale nel quale spinge il sangue. Nelle ascidie si verifica un mutamento ciclico della direzione della circolazione sanguigna, infatti il cuore pompa il sangue prima in una direzione con una serie di battiti, poi dopo un periodo di stasi, nella direzione opposta. Sopra il cuore corrono 2 vasi (epicardici) che si originano a livello dell’intestino branchiale e possono inoltrarsi profondamente nel corpo.
La respirazione avviene tramite il cestello branchiale, infatti l’acqua passa attraverso i fori ciliati presenti in questa struttura e và ad ossigenare il sangue presente nei vasi che la irrorano.
I muscoli di questi animali sono longitudinali e circolari e nelle specie sessili servono per la contrazione e la distensione dell’animale, specialmente dei suoi due sifoni.
Dato che i Tunicati sono organismi sessili, gli organi di senso sono ridotti o semplificati. La larva inizialmente presenta un cervello “sensoriale” comprendente un ganglio ed un organo statico nella parete, ed una parte di cervello “viscerale”; questi vengono persi con la metamorfosi ed al loro posto negli adulti si forma un nuovo piccolo ganglio cerebrale ed, adiacente ad esso, una ghiandola neuronale che sbocca nel faringe.
I Tunicati sono per la maggior parte ermafroditi, i testicoli e gli ovari impari si trovano separati sull’ansa intestinale, mentre più raramente sono uniti a formare una gonade ermafrodita. I dotti genitali sia maschili che femminili sboccano nella cloaca. La fecondazione è esterna, avviene dopo il rilascio degli elementi germinali, ed il successivo sviluppo delle uova avviene in acqua, anche se una minore percentuale di specie fa sviluppare le uova dentro una tasca incubatrice che deriva dall’allargamento del gonodotto.
1.4.3.2 Inquadramento sistematico di S. plicata
L’interesse nelle ascidie inizialmente nacque nel 1867 quando gli studi anatomici ed embriologici stabilirono la loro posizione filogenetica. Le ascidie sono ritenute un organismo di transizione fra i vertebrati e gli invertebrati perché gli adulti sono privi di colonna vertebrale come tutti gli invertebrati, ma la larva mostra caratteristiche inconfondibilmente appartenenti ai cordati: un tubo neurale dorsale, una notocorda, una coda post-anale e fessure branchiali
29
faringee. Per questi motivi le ascidie sono state inserite nel phylum dei Chordata assieme ai vertebrati.
Il phylum dei cordati si divide in Tunicati, Copelati, Acrani e Vertebrati (Remane & Storch, 1978). Il sub phylum dei Tunicati, o Urocordati, a sua volta si divide in 3 classi: quella dei Taliacei, quella dei Larvacei e quella degli ascidiacei. Le ascidie si distinguono dai membri delle altre due classi principalmente perché sono sessili. Inoltre gli ascidiacei in base alla posizione delle gonadi e alla formazione di un sifone esalante si dividono a loro volta in due ordini Pleurogona ed Enterogona. Il secondo ordine si divide nuovamente in 2 subordini Aplousobranchia e Phlebobranchia mentre il primo comprende gli Stolidobranchia, questa divisione si basa sulle strutture dell’apparato digerente. I membri del subordine Aplousobranchia mostrano la struttura branchiale più semplice in cui i filamenti branchiali longitudinali e trasversali sono muniti di ciglia laterali e frontali che creano una corrente d’acqua per muovere il muco. Nei Phlebobranchia questa struttura è arricchita da filamenti branchiali longitudinali interni, inoltre, dove si incontrano i filamenti branchiali longitudinali e trasversali i filamenti branchiali longitudinali interni possono sostenere delle papille che sporgono nella cavità branchiale. La struttura interna del faringe degli Stolidobranchia è simile a quello dei Phlebobranchia ma è ripiegato dalle quattro alle nove volte per lato. La piegatura branchiale è considerata come condizione evolutivamente più avanzata (Kott, 1989; Armsworthy, 1993). Questa differenza morfologica provoca delle modifiche nel processo di alimentazione delle ascidie, gli strati di muco dei Phlebobranchia e degli Stolidobranchia sono tenuti lontani dalla superficie perforata del cestello branchiale, in modo che il trasporto del muco e dell’acqua avvenga separatamente. Inoltre nelle ascidie del subordine Stolidobranchia, l'ondeggiamento trasversale dei filamenti longitudinali sulle creste delle pieghe branchiali facilita il movimento del muco carico di cibo (Armsworthy, 1993).
30 PHYLUM Cordata SUBPHYLUM Tunicata CLASSE Ascidiacea ORDINE Stolidobranchia FAMIGLIA Styelidae GENERE Styela
SPECIE Styela plicata (Lesueur, 1823)
1.4.3.3 Morfologia di S. plicata
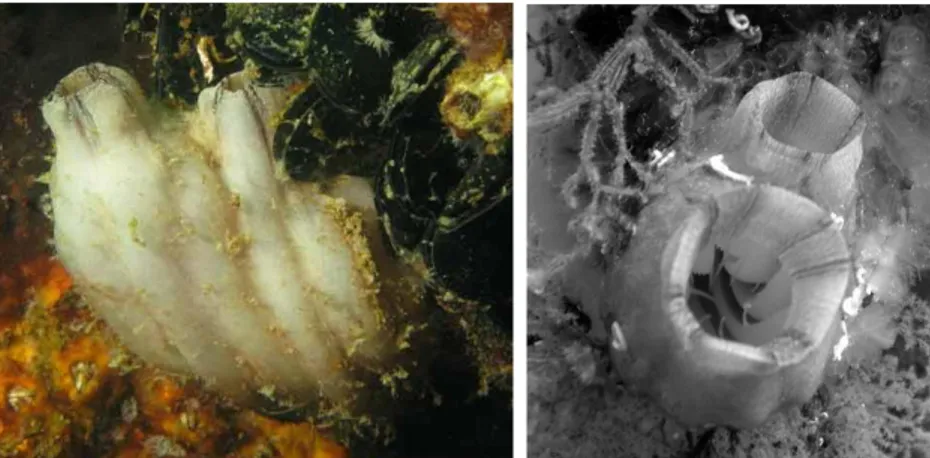
Styela plicata (Fig. 1.8) è un tunicato con la fase adulta sempre sessile che crea formazioni bulbose, incrostanti o a grappolo, con un rivestimento esterno più o meno spesso che prende il nome di mantello o tunica. Quest’ultima ha una consistenza cartilaginea o coriacea e appare con una forma ovoidale o claviforme di colore bianco sporco (Riedl, 1991) o rosa scuro che in ambiente acquatico può assumere una colorazione bruno verdastra, in quanto ricoperta da materiale particellato in sospensione. Gli ascidiacei possono essere coloniali o solitari, in queste due forme ciascun individuo possiede la propria tunica, mentre nelle forme composte più individui possono condividere la medesima tunica con un sifone inalante ‘privato’ e un sifone esalante comune. S. plicata è un’ascidia solitaria.
Fig. 1.8: Foto di Styela plicata (Lesueur 1823).
Styela plicata è caratterizzata dalla presenza di un disegno nero a forma di croce sull’apertura dei due sifoni (Lambert & Lambert, 1998), quello inalante (o boccale) e quello esalante, i quali permettono il movimento di acqua e di particelle alimentari (Cognetti et al, 2002). L’acqua ricca di cibo penetra dal
31
primo sifone e attraversa il sacco branchiale costituito da 5-7 coste longitudinali, dotato sul lato medio ventrale di una doccia tappezzata da cellule ciliate e ghiandolari che prendono il nome di endostilo ed hanno il compito, mediante la secrezione di muco, di intrappolare le particelle alimentari. Il cibo intrappolato verrà direzionato sulla superficie interna del sacco branchiale e in seguito verso la parte dorsale convogliandolo nella zona posteriore all’esofago che lo intrappolerà. In questo modo l’acqua ripulita dalle particelle in sospensione verrà spinta, dall’azione di ciglia, dapprima nella cavità atriale e poi infine all’esterno dal sifone esalante che al proprio interno racchiude la parte terminale dell’intestino, l’ano.
La lunghezza degli adulti varia dai 70 agli 80 mm (Capocaccia, 1964).
1.4.3.4 Biologia e ciclo vitale di S. plicata
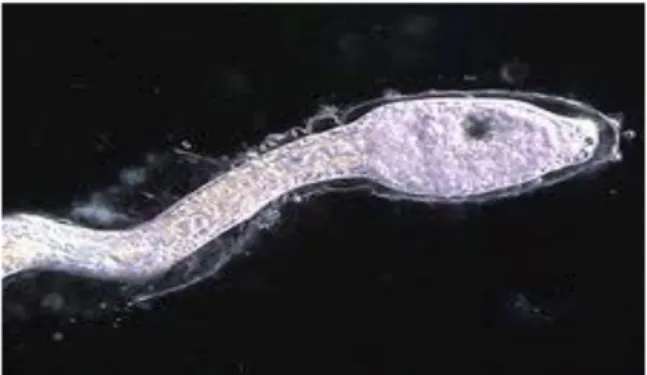
Questa ascidia è un ermafrodita proterandrico, a fecondazione esterna, che rilascia uova e spermi nella colonna d’acqua (Silva & Smith, 2008). Le uova risultano circondate da un involucro che fornirà alle larve il giusto apporto nutrizionale (Pisut & Pawlik, 2002) e, una volta schiuse, le larve cercheranno un substrato adatto per insediarsi (Fig. 1.9). La vita della larva (Fig. 1.10) ha una durata che varia da poche ore ad un giorno, anche se può nuotare per più di due giorni senza compromettere la sua capacità di metamorfosare o lo sviluppo post-larvale (de Barros et al., 2009).
Fig. 1.9: Metamorfosi di un Tunicato a) stadio larvale con corda nel segmento codale, b) stadio di trasformazione (fissato, coda in via di atrofizzazione, c) stadio adulto (da Remane & Storch, 1978).
32
Fig. 1.10: larva di Styela plicata.
Subito dopo l’adesione al substrato la larva inizia la metamorfosi, durante cui vengono riassorbiti il tubo neurale dorsale, la notocorda e la coda post-anale, mentre il faringe si espande e diventa l’organo più importante e più grande dell’animale (Armsworthy, 1993).
La breve durata della vita della larva favorisce l’insediamento intenso e rapido in prossimità delle popolazioni adulte dalle quali la larva è stata rilasciata. A volte l’insediamento avviene in mezzo agli adulti, sopra la tunica di essi o in luoghi vicini (Montanari & Relini, 1975). In generale S. plicata preferisce substrati già colonizzati da altri organismi (Montanari & Relini, 1970). La breve vita larvale indica che questa specie non può migrare lontano da dove è stata rilasciata, perciò gli spostamenti avvengono soprattutto allo stadio adulto, mediante trasporto passivo sotto le chiglie delle imbarcazioni (Lambert & Lambert, 1998; de Barros et al., 2009).
In questa specie lo sviluppo delle uova e il reclutamento larvale dipendono dalla temperatura e dalla salinità dell’acqua (Thiyagarajan & Qian, 2003). Alla temperatura di 24-25 °C, per svilupparsi completamente, all’ascidia sono necessari solo quattro giorni a partire dal momento dell’insediamento che avrà maggior successo in primavera rispetto all’autunno. La maturità sessuale viene raggiunta a 40 mm di lunghezza; la specie risulta però sessualmente inattiva durante i mesi più freddi, sebbene in Giappone siano stati registrati fino a due o tre eventi riproduttivi in un anno (de Barros et al., 2009). Secondo Yamaguchi (1975), Styela plicata raggiunge la maturità sessuale in 2 mesi durante l’estate e in 5 mesi durante l’inverno, inoltre i 20°C sarebbero la temperatura ottimale per il rilascio delle uova. La durata della vita media và dai cinque ai nove mesi.