Sezione 1
INTRODUZIONE
1.1: Caratteristiche generali dell’ambiente salmastro
Gli ambienti salmastri possono essere genericamente definiti come specchi d’acqua nei quali l’incontro fra le acque marine e acque dolci, di origine continentale o piovana, determina una condizione di grande instabilità dei parametri chimicofisici (salinità, temperatura, concentrazione di DOM, POM, ossigeno disciolto) 1. In termini geomorfologici, si tratta di strutture temporanee, la cui formazione geologica è generalmente recente (si ritiene che i più antichi risalgano a circa 10000 anni fa). I meccanismi che contribuiscono alla creazione di tali ambienti sono di solito connessi all’accumulo di sedimenti lungo le coste, con la conseguente formazione di barriere sabbiose in grado di isolare uno specchio d’acqua dal mare aperto; fenomeni di subsidenza e/o di innalzamento del livello del mare possono ugualmente generare tali strutture. In base al tipo di formazione geomorfologica, gli ambienti salmastri possono essere suddivisi in relitti di antichi mari, mari diluiti, estuari, lagune e stagni salmastri. I primi due tipi originano da bacini marini molto vasti: nel primo caso, la mancanza di un emissario ed il forte tasso di evaporazione hanno determinato un ambiente iperalino (es. Mar Morto); nel secondo, l’assenza di contatto con mari limitrofi e la continua diluizione data dall’apporto di acque continentali ha reso oligoalina l’acqua del bacino (es. Mar Baltico, Mar Bianco). Negli estuari, la salinità dell’acqua marina è modificata dal continuo rimescolamento con acque dolci provenienti da un fiume: le caratteristiche di tale ambiente risultano pesantemente influenzate da fattori quali la portata d’acqua del fiume stesso, dalla stagione e dalla forza locale delle maree. Anche lagune e stagni costieri sono ambienti salmastri localizzati tipicamente lungo le coste, presso la foce di fiumi: in questo caso, il materiale di trasporto depositato dal fiume lungo la riva ed accumulato presso la foce ha isolato un braccio di deflusso proveniente dal fiume stesso, oppure ha modificato il cordone litoraneo in modo da circoscrivere una massa d’acqua marina. In entrambi i casi, si viene a creare una zona più o meno chiusa, influenzabile dalle precipitazioni e da emissari dulciacquicoli, così come da mareggiate ed aerosol marino. La differenza fra lagune e stagni costieri risiede nel fatto che le prime risultano grandemente influenzabili dalle maree, che
1
non hanno invece effetti significativi sugli stagni costieri, anche se connessi stabilmente al mare aperto. Esempio di laguna propriamente detta è, in Italia, la lagune di Venezia; la “laguna” di Orbetello è invece uno stagno costiero.
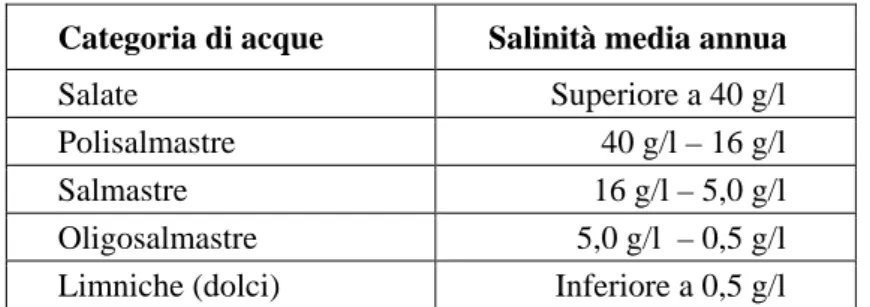
Per quanto riguarda i parametri chimicofisici, come precedentemente accennato, unica caratteristica comune a tali ambienti è, paradossalmente, l’estrema variabilità ed instabilità di tali parametri, i cui valori medi e le cui oscillazioni sono però peculiari ai singoli ambienti e difficilmente generalizzabili. I range di tali valori sono quasi sempre più ampi a quelli registrabili in mare aperto. La salinità può variare da valori superiori al 40‰ (nella stagione calda, con scarse precipitazioni e molta evaporazione) a meno del 20‰, sino a risultare praticamente dolce in caso di piogge abbondanti e scarsa evaporazione (la salinità media del Mediterraneo è invece di circa 36-38‰, oscillante di alcuni punti per millesimo a seconda della stagione e delle zone del bacino). Il cosiddetto “Sistema di Venezia”, proposto nel 1958 durante un congresso internazionale sullo studio degli ambienti salmastri, ha costituito per lungo tempo un criterio di classificazione applicato a tali ambienti, basato proprio sulla diversa quantità di sali presenti in acqua. Punto debole di tale sistema è il valore limitato nel tempo della classificazione ottenuta: il parametro scelto, come già ricordato, può variare grandemente nel corso dell’anno, facendo perciò cambiare più volte la definizione dell’ambiente stesso (Stoch, 2006). Versioni semplificate di questo tipo di classificazione sono tuttavia utilizzate ancora oggi, principalmente a ragione della loro utilità pratica come sistema di riferimento. La Tabella 1.1 riporta i valori-soglia riconosciuti in una versione semplificata di tale sistema e le corrispondenti categorie di attribuzione.
Categoria di acque Salinità media annua
Salate Superiore a 40 g/l
Polisalmastre 40 g/l – 16 g/l
Salmastre 16 g/l – 5,0 g/l
Oligosalmastre 5,0 g/l – 0,5 g/l
Limniche (dolci) Inferiore a 0,5 g/l
Tabella 1.1: Classificazione della acque salmastre secondo una versione semplificata del “Sistema di
Venezia” (da Stoch, 2006; modificato).
La temperatura risulta anch’essa maggiormente variabile rispetto alle medie misurabili in mare, in virtù della minore capacità termica complessiva di un ambiente come quello salmastro, solitamente caratterizzato da acqua bassa ed elevata superficie esposta all’irradiazione solare, e dello scarso ricambio. La bassa salinità talvolta presente nella stagione invernale può rendere possibile la formazione di ghiaccio durante la stagione fredda, mentre la bassa profondità impedisce la formazione di termoclini stagionali durante quella calda. Tali caratteristiche hanno importati ripercussioni a livello biologico (vd. oltre). L’accumulo di detrito organico è un fenomeno frequente negli ambienti salmastri di tipo estuarino, nelle lagune e negli stagni costieri: la successiva decomposizione delle masse
organiche così accumulate influenza profondamente parametri abiotici quali l’ossigeno disciolto e la concentrazione di acido solfidrico, sia nella colonna d’acqua che, in misura anche maggiore, nei sedimenti.
Le caratteristiche biologiche di simili ambienti sono di difficile generalizzazione, a causa della grande variabilità dei parametri abiotici da cui esse dipendono. La maggior parte delle specie alolimnobie (in grado di completare l’intero ciclo vitale in ambiente salmastro: Bacci, 1954; in Cognetti et al., 2002) risulta pertanto eurialina ed euriterma, nonché, in alcuni casi riguardanti organismi prettamente sapropelici (vd. oltre), in grado di resistere ad elevate concentrazioni di H2S nel mezzo (Fenchel et al., 1977). L’ambiente salmastro è inoltre
considerato come un complesso di ambienti di transizione (ecotoni) fra il mare e le acque dolci. In generale, i popolamenti presente in questi ambienti, per quanto riguarda i metazoi, appaiono composti da poche specie, in grado di sopportare le fluttuazioni dei parametri ambientali, rappresentate da un gran numero di individui. La situazione dei popolamenti di protisti e/o della batterioflora non è nota, dal momento che lavori di tipo descrittivo su tali popolamenti non sono ancora stati compiuti. Alcuni studi, concernenti le dinamiche delle popolazioni di protozoi ciliati interstiziali non sapropelici (Santangelo and Lucchesi, 1992; Lucchesi and Santangelo, 1997) suggeriscono tuttavia che tali organismi rispondano in modo diverso dai metazoi alle sollecitazioni ambientali; i risultati del presente studio sembrano inoltre indicare che la diversità specifica presente negli ambienti di stagno costiero possa essere maggiore di quella documentata per i metazoi.
Non sono ancora stati del tutto chiariti i meccanismi attraverso i quali le specie alolimnobie colonizzino gli ambienti salmastri: è plausibile che la maggior parte degli organismi vi sia trasportata dai fiumi immissari (provenienza dulciacquicola) o da mareggiate (provenienza marina); lo scarso flusso genico rilevato fra popolazioni di organismi alolimnobi proveniente da ambienti diversi (Abbiati and Maltagliati, 1989; in Cognetti et al., 2002) suggerisce l’ipotesi che il reclutamento di queste specie avvenga su bassa scala spaziale, ed i contatti fra popolamenti diversi siano sporadici. Alcune evidenze sperimentali suggeriscono che l’aerosol marino possa essere un vettore per alcune specie di batteri e protisti (Aubert, 1976), che sarebbero così in grado di colonizzare anche ambienti privi di contatto col mare. Diverse specie di metazoi, generalmente r-strateghe, opportuniste e ben adattabili, risultano essere comuni a quasi tutti gli ambienti salmastri; altre, viceversa, possono essere presenti solo in alcuni di tali ambienti, oppure limitatamente a determinati periodi dell’anno. Il quadro potrebbe essere il medesimo anche per quanto riguarda i protozoi ciliati, come sembrano suggerire i risultati di alcuni studi compiuti su specie saprobionti (es. Kahl, 1930-35; Kirby, 1934). Tuttavia, come precedentemente accennato, sono necessarie ulteriori indagini per chiarire ulteriormente la struttura e le dinamiche del popolamento microbico degli ambienti salmastri.
- Gli ambienti di stagno costiero salmastro
Come precedentemente accennato, gli stagni costieri sono un particolare tipo di ambiente salmastro, simile a quello lagunare, dal quale si differenzia per il fatto che non risente dell’influenza della marea, nonostante possa essere collegato permanentemente al mare aperto. La sua formazione è spesso causata dall’accumulo di detrito, prevalentemente di origine terrigena, lungo la linea di costa. Tale accumulo può dare origine nel tempo ad un cordone litoraneo stabile, che, formandosi, isola permanentemente una striscia di mare (da cui l’aspetto allungato, in direzione parallela alla costa, di alcuni stagni costieri). Possono contribuire alla formazione di cordoni costieri anche fenomeni eolici o geodinamici. Rispetto ad altri ambienti salmastri, lo stagno costiero presenta un basso o nullo idrodinamismo: l’effetto selettivo di tale fattore sulla fauna bentonica, in altri ambienti determinante, è qui estremamente ridotto. L’ambiente è invece decisamente selettivo per quanto riguarda la salinità e la temperatura.
Essendo ininfluente l’azione delle maree, il contatto con il mare, se presente, non garantisce comunque un ricambio d’acqua tale da garantire l’equalizzazione della salinità dello stagno con quella marine. L’evaporazione può pertanto rendere l’ambiente iperalino, mentre, all’opposto, le immissioni sporadiche di acqua dolce di origine fluviale o piovana possono diluire i sali disciolti rendendo l’acqua oligoalina; l’effetto tamponante del mare è nullo in entrambi i casi. La salinità degli stagni costieri può pertanto assumere indifferentemente valori molto al di sopra o molto al di sotto di quelli registrati in mare aperto: l’aumento può sfiorare i 10-15 punti per millesimo rispetto al mare in caso di elevate temperature e siccità, mentre piogge abbondanti possono diluire l’acqua sino a renderla praticamente dolce. La temperatura costituisce un secondo parametro estremamente variabile. La conformazione tipica di questi stagni, con un rapporto profondità/superficie esposta all’irraggiamento solare decisamente sbilanciato a favore di quest’ultima, favorisce in estate il rapido riscaldamento della massa d’acqua, ed al contempo impedisce la formazione di termoclini fra masse d’acqua a diversa temperatura. Ciò impedisce la segregazione delle sostanze nutrienti inorganiche nelle masse d’acqua profonde, come invece accade in mare aperto, rendendo possibile una elevata produzione primaria: se il sistema non è in grado di incanalare la materia così prodotta in reti trofiche articolate, l’ambiente va incontro a fenomeni di eutrofizzazione (vd. sotto).
Il sedimento presente in questi ambienti è di solito estremamente fine, fangoso: tale caratteristica è tipica degli ambienti a basso idrodinamismo. La materia organica presente in tale sedimento può essere di origine terrigena, trasportato dalle acque degli immissari fluviali, oppure derivante da eventi di mortalità massiva a carico dei popolamenti alolimnobi stessi (es. in coincidenza di crisi distrofiche dovute ad eutrofizzazione: cfr. Genovese, 1974).
La decomposizione del detrito organico da parte di batteri aerobi causa la diminuzione della quantità di ossigeno presente nella colonna d’acqua: si crea così una situazione di anossia più o meno estesa, talvolta limitata allo strato dei sedimenti in cui è maggiore la concentrazione di materia in decomposizione; nei casi più gravi essa può però estendersi sino agli strati più superficiali. La circolazione ed il ricambio dell’acqua interstiziale è fortemente impedita, ed una condizione di anossia permanente si ritrova appena pochi centimetri al di sotto della sua superficie. Fra gli strati superficiale del sedimento, contenenti ossigeno, e quelli più profondi, privi di esso, si trova una sottile fascia nella quale la concentrazione di O2, CO2,
nitrati, nonché il pH e l’Eh (potenziale redox) cambiano rapidamente. Tale discontinuità, denominata RPD layer (Redox Potential Discontinuity Layer) è facilmente individuabile ad occhio nudo come un sottile strato grigio interposto fra il sedimento ossigenato, chiaro o brunastro, e quello ridotto sottostante, tipicamente nero a causa della presenza di solfuri derivanti dal metabolismo dei batteri anaerobi, e causa primaria dell’acidità di tale strato (Lenihan and Micheli, 2001). Lungo tale fascia sono abitualmente concentrate molte specie di organismi microaerofili, che sfruttano l’ambiente di transizione per cibarsi di solfobatteri anaerobi (es. Fenchel and Finlay 1991; in Embley and Finlay, 1994; Dragesco, 1999). In alcuni stagni salmastri si verifica un continuo apporto di materia organica, di origine prevalentemente vegetale, che, venendo decomposta in prossimità della superficie del sedimento, innalza la fascia RPD sino al livello della superficie dello stesso. La zona anossica inizia pertanto in coincidenza della superficie del sedimento, e l’intero ambiente diviene estremamente riducente a causa del rilascio di idrogeno solforato da parte dei solfobatteri. L’habitat peculiare così creato, inizialmente noto come “Faulschlamm” e successivamente denominato “Sapropel” (Lauterborn, 1901; in Görtz, 2003), ospita numerose specie di protozoi ciliati, specificamente adattate per tollerare pH bassi e condizioni di microaerofilia o completa anaerobiosi. Tali organismi formano un popolamento caratteristico di tali ambienti, tanto da essere state definite in passato “sapropelobionti” o “saprobionti” (il fatto che la maggior parte di esse sia stata successivamente ritrovata in ambienti con parametri chimicofisici simili, ma non sapropelici, ha portato alla nuova denominazione di “sulfide fauna”: Fenchel et al., 1977).
Infine, le crisi distrofiche possono risultare frequenti in ambiente di stagno costiero. La causa più frequente di tali crisi sono i fenomeni di eutrofizzazione che, in misura più o meno estesa e ad intervalli di tempo variabili, sono comuni in simili ambienti. L’origine di tali crisi è legata alla presenza di forti concentrazioni di nutrienti inorganici (provenienti principalmente dal dilavamento del terreno circostante: l’inquinamento antropico di origine agricola, o l’immissione di scarichi urbani, possono incrementare ulteriormente tale apporto), non segregati in masse d’acqua profonda dalla formazione di termoclini. Durante la stagione calda, l’elevato irraggiamento solare e la presenza dei nutrienti favoriscono un abnorme
sviluppo della produzione primaria (principalmente alghe uni- e pluricellulari). La biomassa così prodotta supera invariabilmente la quantità che i consumatori primari presenti nel sistema possono rimuovere. Il detrito vegetale non consumato precipita sul fondo, dove i batteri saprofagi ne iniziano la decomposizione: tale processo consuma l’ossigeno presente nell’ambiente, determinando, nei casi più gravi, una condizione di anossia generalizzata all’intero sistema. La frequenza e la portata di tali eventi variano a seconda del sistema in questione: negli stagni costieri di piccole-medie dimensioni e/o soggetti a forte inquinamento possono portare alla periodica scomparsa degli organismi strettamente aerobi. È possibile che una parte del popolamento di protozoi ciliati presente in tali ambienti (es. la cosiddetta “sulfide fauna” anaerobia) possa non risentire delle conseguenze di tali eventi, se non addirittura trarne dei vantaggi: studi specifici al riguardo sono tuttavia assenti in letteratura.
1.2: Associazioni simbiotiche
2fra protozoi ciliati e procarioti
La presenza di batteri simbionti all’interno delle cellule di protozoi ciliati, o sulla loro superficie, è un fenomeno noto da più di cento anni: tali associazioni sono state tuttavia a lungo considerate transitorie e accidentali (Fokin, 2004). Le prime descrizioni sistematiche di un batterio vivente esclusivamente all’interno di un ospite ciliato (il peniculide
Paramecium caudatum) furono pubblicate verso la fine del secolo XIX (Hafkine, 1890; in
Fokin, 2004): si trattava di batteri endosimbionti obbligati appartenenti al genere Holospora. Durante gli anni successivi, la scoperta di rapporti simbiotici mutualmente necessari fra ciliati ipotrichi del genere Euplotes ed alcuni β-proteobatteri (Heckmann 1975; Schmidt, 1982; Heckmann et al., 1983; Fujishima and Heckmann, 1984; Heckmann and Schmidt, 1987), così come lo studio del cosiddetto “killer-effect” conferito ad alcuni ceppi di
Paramecium spp. da simbionti del genere Caedibacter (Preer, 1950; in Fokin, 2004), nonché
l’enunciazione della “symbiogenesis theory” come possibile spiegazione dell’origine delle cellule eucariotiche (Margulis, 1970) hanno contribuito a mutare l’opinione corrente riguardo agli eventi di simbiosi. Attualmente, essa è considerata in generale come un fenomeno estremamente importante dal punto di vista evolutivo e adattativo; riguardo, in particolare, alla maggior parte dei gruppi tassonomici dei protozoi ciliati, l’assenza di simbionti in tutte le specie comprese in essi è considerata un’eccezione piuttosto che la regola (Fokin, 2004). La notevole diffusione di tali rapporti nei protozoi ciliati è imputabile a caratteristiche intrinseche di tali organismi, quali in primo luogo l’assunzione del cibo tramite fagocitosi e lo status di “filter feeders” comune alla maggior parte delle specie
2
Il termine “simbiosi” è qui inteso nell’accezione generica, definita da De Bary nel 1879, di “associazione relativamente intima fra due o più organismi non implicante necessariamente una relazione mutualistica” (De Bary, 1879; in Fenchel and Finlay, 1977).
(Fokin, 2004). Tali caratteristiche portano a frequenti contatti con batteri (in alcune specie la nutrizione batterivora è quella dominante), che vengono normalmente inclusi in vacuoli alimentari, successivamente acidificati mediante contatto con lisosomi. Alcuni batteri hanno tuttavia la capacità di sfuggire ai fagosomi o di dirottarli verso regioni della cellula prive di lisosomi (mitocondri, periplasma nucleare, nucleoplasma): tali batteri possono quindi sopravvivere e riprodursi all’interno della cellula, contenuti in apposite vescicole o liberi (Görtz, 2003). Questo meccanismo è ritenuto essere il modo più comune in cui vengano a crearsi relazioni di simbiosi intracellulare (Skovorodkin et al., 2001; Fokin, 2004; Görtz, 2003). È stato supposto che la localizzazione nucleare o mitocondriale dei batteri infettanti rappresenti un adattamento che facilita la trasmissione dell’infezione alle cellule figlie (Fokin, 2004). Batteri simbionti possono anche trovarsi sulla superficie esterna del ciliato (in tal caso si parla di “ectosimbiosi”). Tale collocazione è apparentemente meno specifica e maggiormente “casuale” rispetto ad un rapporto di tipo endosimbiotico (batteri all’interno della cellula ospite). Studi compiuti su ciliati provvisti di ectosimbionti hanno però rivelato la specie-specificità di tali associazioni (Fenchel et al., 1977) nonché, in alcuni casi, un vantaggio per l’ospite (Rosati et al., 1999) o una dipendenza mutualistica per entrambi gli organismi coinvolti (Görtz, 2003), mentre, al contrario, alcuni batteri a vita libera sono in grado di generare endosimbiosi stabili se messi a contatto con differenti specie di ciliati (Görtz, 2003). È quindi possibile che altre relazioni ectosimbiotiche possano rivelarsi selettivi e specifici al pari di alcune delle associazioni endosimbiotiche meglio conosciute. Studi ulteriori sono comunque necessari per chiarire l’effettiva specificità e selettività di gran parte delle simbiosi, dell’uno e dell’altro tipo, descritte in passato.
Per quanto riguarda la natura di tali associazioni, negli studi sin qui compiuti tale aspetto non è sempre stato indagato, ma esse sembrano coprire tutte le gradazioni possibili fra il parassitismo e la simbiosi mutualistica sensu stricto (Fokin, 2004). Sulla base del tipo di rapporto intercorrente fra ospite e simbionte, è possibile classificare le relazioni simbiotiche in tre gruppi distinti, come proposto da Fokin nel 2004 (la classificazione è stata stilata avendo come principale riferimento i rapporti di tipo endosimbiotico: essa è tuttavia applicabile anche per quanto riguarda gli ectosimbionti):
• Gruppo A – Invasioni Accidentali:
Tale raggruppamento eterogeneo comprende le associazioni fra protisti e batteri registrate solo occasionalmente e prevalentemente dovute a cause accidentali ed apparentemente non spiegabili in termini di vantaggio-svantaggio per l’ospite. I batteri simbionti non vengono generalmente mantenuti a lungo nel citoplasma dell’ospite o a contatto con esso, specialmente in condizioni di laboratorio. In questa categoria rientrano anche le infezioni da batteri patogeni, necessariamente “accidentali” e instabili in quanto, determinando la morte dell’ospite, il rapporto
simbiotico viene inevitabilmente a dissociarsi. Questa categoria comprende le simbiosi meno studiate e caratterizzate, e quelle molto rare (benché sia possibile che alcune associazioni siano ritenute “rare” o “accidentali” soltanto perché non sufficientemente indagate: Fokin, 2004). Il mantenimento in laboratorio di tali infezioni è, come accennato, generalmente difficile: tale fattore ha indubbiamente contribuito a limitare la quantità di dati accumulati nel tempo. In generale, lo studio di esemplari prelevati direttamente dall’ambiente, dopo breve tempo dal campionamento, consente di osservare tali associazioni non stabili. Artefatto frequente, come ricordato, è la perdita della simbiosi in condizioni di allevamento: sono tuttavia segnalati casi in cui infezioni accidentali, non presenti in natura, sono state contratte in colture mantenute in laboratorio (Görtz, 1982; in Fokin, 2004). • Gruppo B – Simbiosi Permanenti:
In questo gruppo sono comprese sia le associazioni ospite-simbionte che ricorrono invariabilmente in tutte le popolazioni analizzate (sistemi obbligatori) e quelle osservabili con una certa frequenza in un gran numero di popolazioni, anche geograficamente distanti, ma occasionalmente assenti (sistemi facoltativi). In nessun caso i simbionti danneggiano direttamente l’ospite – sono anzi segnalati casi di reciproco mutualismo (es. Heckmann, 1974; Heckmann et al., 1983; Rosati et al., 1999): in generale, un certo grado di adattamento reciproco appare sempre presente. Alcune fra le simbiosi maggiormente conosciute e descritte in ambito protistologico rientrano in questa categoria (Fokin, 2004): ciò è probabilmente dovuto alla presenza costante dei batteri nelle varie popolazioni della specie ospite (nei sistemi obbligatori, la percentuale di infezione è invariabilmente del 100%).
• Gruppo C – Simbiosi Altamente Infettive:
Come per le simbiosi permanenti di tipo facoltativo, anche queste associazioni si ritrovano con frequenza relativamente alta nelle popolazioni naturali. La contemporanea esistenza di popolazioni della specie ospite prive di simbionti e di popolazioni infette suggerisce che il batterio simbionte abbia la capacità di infettare organismi ospiti precedentemente privi di batteri: nel caso dei sistemi permanenti facoltativi, l’infettività del batterio è però piuttosto bassa, e nuovi infezioni sono generalmente impossibili da ottenere in condizioni di laboratorio. I batteri coinvolti in associazioni simbiotiche del “Gruppo C” sono invece altamente infettivi per l’ospite sia in condizioni naturali che di allevamento: presentano talvolta specifici adattamenti (es. stadi del ciclo vitale modificati) atti a favorire la propria dispersione nell’ambiente e la successiva penetrazione in un nuovo ospite. Il tasso di infezione delle popolazioni mantenute in condizioni di laboratorio può essere persino più elevato di quello osservato in natura, potendo raggiungere il 100% (Görtz, 2003). Il
danneggiamento o la morte dell’ospite in seguito all’infezione sembrano essere eventi fortuiti, sebbene la cellula infetta possa perdere parte della propria funzionalità (Görtz, 1996). In certi casi è inoltre possibile che l’ospite ricavi un certo vantaggio dalla presenza del simbionte (Hori and Fujishima, 2003) Le infezioni batteriche comprese in questo gruppo sono per lo più causate da batteri appartenenti al genere Holospora (Fokin, 2004).
Sebbene i casi di simbiosi descritti in letteratura siano numerosi (es. Kirby, 1934; Heckmann, 1975; Fenchel et al., 1977; Goosen et al., 1988; Sola et al., 1989 ; Amann et al., 1991; Fenchel and Finlay, 1991; Berger and Lynn, 1992 ; Finlay et al., 1993; review: Görtz, 2003; Fokin, 2004), sono pochi i lavori in cui sia stata effettuata una caratterizzazione morfologica e/o molecolare specifica di ospite e simbionte, ed in cui sia stata chiarita la natura del rapporto. Le tecniche molecolari attualmente in uso hanno di recente consentito la caratterizzazione molecolare dei simbionti (es. Amann et al., 1991; Finlay et al., 1993; Springer et al., 1996; Vannini et al., 2004; Vannini et al., 2005a). La caratterizzazione della sequenza del 16S rDNA consente infatti di indagare le relazioni filogenetiche eventualmente esistenti fra i vari gruppi di organismi simbionti (nonché degli ospiti) conosciuti (Embley and Finlay, 1994). Inoltre, la procedura sviluppata da Amann et al. nel 1991 (vd. oltre) può essere efficacemente utilizzata per riconoscere possibili artefatti dovuti alle metodologie utilizzate ed associare con esattezza una sequenza caratterizzata ad un determinato organismo simbionte.
1.3: Scopo della tesi
La letteratura protistologica, come precedentemente accennato, non manca di titoli riguardanti i rapporti simbiotici fra protisti ciliati e procarioti. Ciò è particolarmente vero per quanto concerne alcune simbiosi, obbligatorie e permanenti, ormai molto conosciute e studiate, presenti in organismi comuni e facilmente coltivabili. Sono state occasionalmente svolte delle indagini anche su organismi di difficile allevabilità, ed in certi casi è stata ottenuta la caratterizzazione (rispettivamente morfologica e molecolare) dell’ospite e del simbionte: simili studi sono tuttavia decisamente più rari dei precedenti.
I lavori sinora svolti sono accomunati dal fatto di essere estremamente specifici: viene in genere caratterizzata una singola associazione, più raramente due; poiché lo scopo della ricerca si limita alla descrizione della simbiosi in esame, non vengono prese in considerazione le altre specie presenti nel medesimo ambiente ed eventualmente associate esse stesse a batteri simbionti. Più in generale, l’indagine riguardante le associazioni simbiotiche è stata sinora limitata ad alcuni sistemi di simbiosi permanente, sia di tipo obbligatorio (es. Polynucleobacter Euplotes spp.) che facoltativo (es. Paramecium
spp.-Caedibacter spp.), nonché alcune simbiosi altamente infettive (es. gli studi concernenti Holospora spp.). Ad oggi, il numero di dati raccolti su tali sistemi è indubbiamente notevole,
ed in alcuni casi sono parimenti noti i meccanismi generali che sovrintendono a tali associazioni. Simbiosi di tipo “accidentale” sono state occasionalmente descritte (per review: Görtz, 2003): i dati raccolti durante tali studi sono tuttavia informazioni puntuali, limitati alla descrizione della specie ospite e del simbionte nonché, più raramente, alla loro caratterizzazione morfomolecolare. Infine, la ricerca di uno stesso tipo di batterio simbionte in ospiti ciliati di specie diverse è stata intrapresa raramente e comunque in modo “mirato”, selezionando a priori determinate specie da sottoporre ad indagine (es. Heckmann et al., 1983; Vannini et al., 2005a). La realizzazione di questo tipo di studi si è rivelata utile per ampliare la conoscenza sulla simbiosi e sulle specie coinvolte in tali fenomeni; essi non hanno tuttavia fornito alcun quadro complessivo della situazione generale delle simbiosi presenti in ambiente naturale, né hanno fornito descrizioni dell’andamento temporale della simbiosi osservata. Simili informazioni appaiono invece indispensabili per poter inquadrare il fenomeno in un’ottica ecologica e funzionale, invece di giungere unicamente ad una mera descrizione e caratterizzazione delle specie coinvolte. Possedere un quadro quanto più completo possibile delle associazioni simbiotiche fra ciliati e procarioti rappresenterebbe il primo passo per inquadrare la simbiosi come processo significativo dal punto di vista funzionale, ecologico e, possibilmente, evolutivo.
Lo scopo del presente lavoro consiste nell’analizzare l’intero popolamento di protozoi ciliati presenti in un unico ambiente, identificando e, ove possibile, caratterizzando morfomolecolarmente le specie che risultano coinvolte in associazioni di tipo simbiotico con organismi procariotici; la caratterizzazione del simbionte è altresì prevista e necessaria alla realizzazione del progetto. È possibile ottenere in tal modo un quadro generale delle associazioni simbiotiche concernenti i protozoi ciliati presenti nello stesso ambiente, non limitandosi all’analisi di un’unica specie; in futuro, un monitoraggio regolare del medesimo sito fornirà ulteriori dati relativi alle fluttuazioni temporali delle simbiosi in esame. Un simile approccio, “non mirato”, consente inoltre di individuare simbiosi in specie di ciliati per le quali tali associazioni sono ritenute “rare” o “accidentali” (vd. sopra) semplicemente perché poco indagate, nonché di individuare simbionti secondari eventualmente presenti in specie già note per possedere un simbionte primario. Allo stesso modo, l’assenza di una scelta ad hoc di specie da sottoporre ad indagine permette di valutare l’effettiva specificità d’ospite di una determinata simbiosi (magari precedentemente descritta come gruppo-specifica semplicemente perché rappresentanti di altri gruppi tassonomici in cui essa è presente non sono stati inclusi nella selezione di specie oggetto di analisi). La creazione di sonde oligonucleotidiche specie-specifiche, basate sulle sequenze di rRNA caratterizzate, rappresenta inoltre uno strumento diagnostico di facile applicazione per il riconoscimento
delle specie in studi successivi; esse potranno essere impiegate anche nelle future indagini, di tipo ecologico, mirate a chiarire l’andamento spaziale e temporale delle infezioni individuate (cfr. Sezione 5: Conclusioni e Prospettive Future).
1.4: Approccio sperimentale utilizzato
Sono qui di seguito riportate le fasi principali dell’approccio utilizzato nel presente lavoro per la caratterizzazione morfologica e molecolare delle specie di protozoi ciliati oggetto di studio e degli eventuali procarioti loro simbionti. Il procedimento riportato prevede l’individuazione dei simbionti mediante ibridazioni in situ, la cartterizzazione del gene codificante per il 16S rRNA e la successiva ibridazione di conferma, con sonde specie-specifiche disegnate sulla base della sequenza stessa, allo scopo di confermare l’attribuzione della sequenza ottenuta all’organismo oggetto di indagine. La relativa semplicità delle prime fasi di tale procedura consentono di sottoporre a screening numerose popolazioni di ciliati in tempi relativamente contenuti; le sequenze di rDNA caratterizzate sono inoltre utilizzabili per analisi di tipo filogenetico al fine di determinare la collocazione tassonomica dell’organismo ed il suo grado di parentela con altri precedentemente caratterizzati. È altresì prevista la caratterizzazione morfologica e molecolare dell’ospite.
Sono di seguito riportati i dettagli relativi a ciascun passaggio del metodo adottato.
- Osservazione preliminare in vivo dei ciliati ritrovati nei campioni
Le principali caratteristiche osservate al microscopio binoculare sono la forma e le dimensioni delle cellule, nonché alcuni dettagli del comportamento (prevalenza di creeping o di fase natante, verso di rotazione sull’asse anteroposteriore durante il nuoto). Ad eccezione delle specie appartenenti a gruppi tassonomici molto conosciuti e dalle caratteristiche facilmente individuabili, durante questa fase non è in genere possibile determinare con sicurezza la specie in esame. È stato solitamente possibile identificare la classe d’appartenenza; più raramente l’ordine.
La successiva osservazione viene effettuata al microscopio a contrasto interferenziale. Singole cellule sono prelevate dal campione tramite micropipetta capillare, poste su vetrino portaoggetti in un piccolo volume d’acqua e coperte con un vetrino coprioggetti, tenuto leggermente sollevato mediante l’applicazione di piccoli spessori di plastilina ai bordi. Il movimento cellulare è ridotto o azzerato effettuando una leggera pressione sul coprioggetti stesso. In questa fase vengono ricercate le caratteristiche difficilmente osservabili al binoculare quali: struttura e collocazione del citostoma, struttura e collocazione del vacuolo contrattile (se presente), caratteristiche dell’apparato nucleare (in part. forma, dimensioni, numero dei frammenti macronucleari, numero e collocazione dei micronuclei). Nel caso dei
ciliati ipotrichi, viene osservato sommariamente il pattern dei cirri. Tale osservazione consente, nella maggior parte dei casi, la collocazione tassonomica dell’organismo sino al livello di genere.
A questo livello si effettua inoltre un’indagine preliminare riguardo alla presenza di batteri simbionti all’interno del citoplasma o dell’apparato nucleare del ciliato. La superficie esterna è osservata ad alto ingrandimento (400x), in modo da individuare eventuali episimbionti. Aumentando la pressione sul coprioggetto viene quindi provocata la lisi cellulare: il materiale fuoriuscito è osservato a 1000x onde identificare i batteri endosimbionti (distinguibili dagli organelli cellulari in quanto generalmente non soggetti a lisi se non dopo periodi di tempo abbastanza lunghi – la maggior parte degli organuli citoplasmatici scompare o si deforma vistosamente nell’arco di due-tre minuti). Il risultato di tale indagine preliminare non fornisce la prova definitiva dell’assenza o della presenza di batteri simbionti (nel primo caso potrebbero essere sfuggiti all’osservazione; nel secondo, potrebbero provenire da vacuoli alimentari, o dalla superficie del ciliato ma non essere stabilmente associati ad esso). In alcuni casi è tuttavia possibile individuare in vivo la presenza di alcuni batteri simbionti dotati di particolari caratteristiche (es. grandi dimensioni, numerosità elevata all’interno dell’ospite).
- Caratterizzazione morfologica e molecolare dell’ospite
Ove possibile, parte delle cellule di ciascun gruppo morfologico individuato mediante l’osservazione in vivo viene impiegata per eseguire tecniche di colorazione cellulare. Obiettivo di tali colorazioni è la visualizzazione di caratteri morfologici tassonomicamente significativi, quali forma e dimensioni, dell’apparato macronucleare, numero dei frammenti macronucleari, numero e collocazione dei micronuclei, distribuzione della ciliatura somatica e orale, pattern dei cirri (nel caso di ciliati ipotrichi). I dati così ottenuti consentono, nella maggior parte dei casi, l’identificazione della specie d’appartenenza del ciliato. In taluni casi, l’identificazione può risultare dubbia a causa della scarsa quantità (o della cattiva qualità) dei dati morfologici relativi alla specie in questione disponibili in letteratura.
Viene quindi caratterizzata la sequenza del gene codificante per il 18S rRNA per tutte le specie di ciliati oggetto di studio. Tale marcatore molecolare è stato scelto per i seguenti motivi:
1. È un gene omologo in ogni forma di vita cellulare.
2. Codificando per un RNA strutturale, non è soggetto ai vincoli evolutivi tipici dei geni codificanti per le proteine; in particolare, sono presenti regioni ampiamente conservate, dalla lunghezza sufficiente per consentire la realizzazione di primer teoricamente ad ampio spettro di copertura (simili regioni non sono presenti in geni codificanti per proteine a causa delle
posizioni ipervariabili in terza base secondo la griglia di lettura, dovute alla degenerazione del codice).
3. Presenta una struttura evolutiva cosiddetta “a mosaico”: regioni molto conservate si alternano ad altre ipervariabili. L’analisi filogenetica di tale marcatore consente di acquisire informazioni relative a più livelli evolutivi, evidenziando tanto le differenze arcaiche quanto quelle, più recenti, genere-specifiche o specie-genere-specifiche.
4. La sua lunghezza (ca. 1600 pb.) consente di ottenere una discreta quantità di informazione filogenetica, ed è inoltre relativamente semplice amplificare e caratterizzare l’intero gene. Ciò ha fatto sì che in passato tale marcatore sia stato più utilizzato, in virtù della semplicità di caratterizzazione, rispetto ad altri rRNA. I data base oggi disponibili per tale gene sono pertanto molto ricchi di dati rispetto ad altri marcatori (benché sia oggi possibile caratterizzare senza difficoltà anche altre sequenze di rDNA).
5. L’RNA codificato da tale gene è presente in grande quantità e ben distribuito all’interno della cellula: costituisce pertanto un substrato evidenziabile mediante ibridazioni DNA-RNA effettuate con sonde oligonucleotidiche complementari a specifiche regioni della sequenza caratterizzata.
Il confronto di tale sequenza con sequenze di 18S rDNA presenti nel data base utilizzato permette di confermare l’appartenenza dell’organismo ad una determinata specie. Per eseguire tale confronto fra specie di protozoi ciliati è in genere sufficiente caratterizzare solo una parte, comprendente alcune regioni ipervariabili, delle sequenza genica: tale procedura è stata in questi casi preferita perché più rapida ed economica (il sequenziamento parziale potrebbe tuttavia non risultare sufficiente per la discriminazione fra due specie di metazoi, in quanto il marcatore molecolare utilizzato è in genere meno variabile all’interno di tale gruppo). Viceversa, ove non fossero disponibili dati molecolari relativi alla specie in questione, l’intera sequenza viene caratterizzata ed utilizzata per analisi di tipo filogenetico, allo scopo di determinarne le relazioni di parentela con altre specie precedentemente caratterizzate.
- Applicazione del “Full-Cycle rRNA Approach” (Amann et al., 1995) per la caratterizzazione dei procarioti simbionti
L’utilizzo di questa procedura (Amann et al., 1995; modificato) consente l’individuazione e la caratterizzazione del 16S rDNA dei batteri simbionti associati ai ciliati oggetto di indagine, nonché di verificare la corretta attribuzione delle sequenze caratterizzate mediante
ibridazioni con sonde oligonucleotidiche specificamente disegnate. Tale approccio fu originariamente concepito per l’identificazione in situ e la caratterizzazione filogenetica di batteri endosimbionti di Paramecium caudatum (Amann et al., 1991); la procedura, leggermente modificata, è stata in seguito formalizzata ed ottimizzata per la caratterizzazione ed il riconoscimento in situ di procarioti non coltivabili a vita libera (Amann et al., 1995). Il metodo utilizzato nel presente lavoro prevede l’individuazione preliminare dei batteri simbionti mediante ibridazione in situ con sonde oligonucleotidiche, complementari a determinate regioni della sequenza del 16S rRNA e marcate con fluorocromi. Inizialmente sono state impiegate sonde ad ampio spettro di copertura, quali la sonda Eub338, teoricamente in grado di legarsi a quasi tutti gli organismi appartenenti al gruppo Eubacteria, e la sonda Archaea915, che copre la quasi totalità degli archeobatteri. In caso di esito positivo di tale ibridazione, sono state successivamente impiegate sonde specifiche per quattro classi (Alpha-, Beta-, Gamma-, Delta-) appartenenti alla divisione Proteobacteria, nella quale risultano comprese la maggior parte delle specie di procarioti simbionti di ciliati ad oggi conosciute (Görtz, 2003): scopo di tale ulteriore ibridazione è l’identificazione preliminare del gruppo tassonomico di appartenenza dell’organismo, in modo da poter ottimizzare i passaggi successivi di amplificazione dell’rDNA batterico.
La prima fase della procedura prevede quindi una estrazione di DNA genomico da cellule di ciliati contenenti simbionti, e l’amplificazione del 16S rDNA batterico. Nel caso sia noto il gruppo tassonomico d’appartenenza del batterio stesso, tale amplificazione viene condotta impiegando primer specifici per tale gruppo ed alte condizioni di stringenza, e la sequenza del 16S rRNA del simbionte viene ottenuta tramite sequenziamento diretto del prodotto di reazione. In caso contrario, sono impiegate tecniche molecolari finalizzate all’ottenimento di una library di cloni (cfr. Sezione 2: Materiali e Metodi). Lo screening dei cloni così ottenuti è effettuato mediante amplificazione e digestione dell’inserto tramite endonucleasi di restrizione (cfr. Sezione 2: Materiali e Metodi): sono caratterizzate le sequenze di DNA quantitativamente più rappresentate all’interno della library. Viene quindi effettuata l’analisi filogenetica dei geni caratterizzati allo scopo di determinarne la collocazione filogenetica e le relazioni di parentela con sequenze geniche affini già presenti in data base.
Il passaggio successivo (seconda fase) è volto a dimostrare che le sequenze ottenute con le modalità precedentemente descritte appartengano effettivamente ai procarioti simbionti e non derivino da contaminanti (naked DNA, batteri a vita libera o comunque non associati al ciliato in esame, batteri contenuti nei vacuoli alimentari) eventualmente presenti nel campione. Vengono pertanto disegnate sonde oligonucleotidiche a fluorescenza complementari alle sequenze ottenute, in modo tale che esse si leghino specificamente a tali sequenze, mentre l’ibridazione con altri 16S rRNA (presenti in data base) risulti il più possibile sfavorita (per i dettagli di tale procedura, cfr. Sezione 2: Materiali e Metodi). Dopo
aver verificato sperimentalmente la loro effettiva funzionalità ed individuato le condizioni sperimentali ottimali per la reazione, tali sonde sono impiegate per eseguire una ibridazione
in situ su cellule infette del ciliato ospite. La positività del risultato di tale ibridazione
consente di associare la sequenza precedentemente caratterizzata, sulla base della quale è stata disegnata la sonda, ad un determinato organismo simbionte; viceversa, un risultato negativo classifica la sequenza stessa come non appartenente al batterio simbionte oggetto di indagine. E’ inoltre possibile, in caso di positività dell’ibridazione, localizzare la sede dell’infezione (macronucleo – citoplasma – superficie esterna della cellula), calcolare approssimativamente il numero medio di organismi infettanti ciascuna cellula ospite nonché, dopo un congruo numero di osservazioni, stimare la percentuale di cellule infette sulla popolazione totale.