4. Risultati
4.1 Struttura demografica
È stato misurato un totale di 4919 individui, di cui 2385 femmine, 1451 maschi e 1083 indeterminati. La taglia minima osservata è stata di 10 mm di lunghezza del carapace (LC), in un esemplare su cui non è stato possibile determinare il sesso. Le taglie minime osservate per i maschi e per le femmine sono state rispettivamente, di 11 e 10 mm LC; la taglia massima è stata di 26 mm LC per i maschi e di 29 mm LC per le femmine.
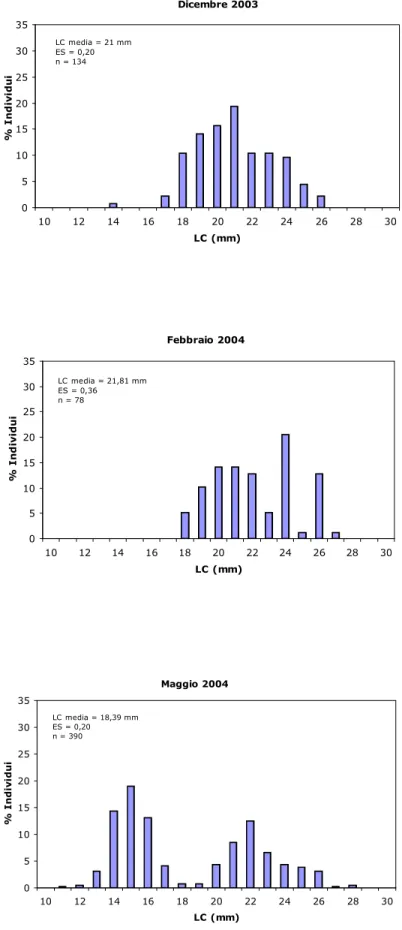
L’evoluzione della struttura di taglia nei diversi mesi di studio è riportata in Fig. 4.1.1. Il numero di individui campionati in ogni mese ha mostrato una spiccata variabilità. Le catture di questa specie sono state caratterizzate da ampie fluttuazioni, anche tra giorni consecutivi. Questo è dovuto principalmente alle caratteristiche biologiche di P. edwardsii, come il comportamento gregario e gli spostamenti lungo la colonna d’acqua, che fanno sì che la disponibilità della specie all’attrezzo di cattura sia estremamente variabile.
Dagli istogrammi di Fig. 4.5.1 si può notare che gli organismi catturati sono caratterizzati da ampi intervalli di taglia, compresi tra 10 e 30 mm LC, in particolare nei mesi di maggio, giugno e luglio (2004-2005).
Nei mesi invernali (da dicembre a marzo) la struttura demografica è caratterizzata da una sola moda, tra 20 e 22 mm LC, appartenente ad individui adulti. Nei mesi primaverili ed estivi, invece, è possibile osservare due mode; la prima va attribuita ad una nuova coorte che
Risultati
55
entra nella popolazione sfruttata (reclutamento all’attrezzo). Le reclute sono risultate particolarmente abbondanti in primavera, sia nel 2004 che nel 2005; gli esemplari di dimensioni più piccole sono stati catturati nel mese di maggio di entrambi gli anni.
A maggio le reclute sono caratterizzate da una classe modale compresa tra 13 e 15 mm LC; nei mesi successivi è possibile apprezzare l’accrescimento di questa componente demografica.
Nel mese di settembre è ancora possibile osservare due mode; la prima è ora costituita da individui più grandi con picco a 18-19 mm LC e comincia a ravvicinarsi a quella degli adulti. Da ottobre a marzo è presente una sola moda.
Dicembre 2003 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 21 mm ES = 0,20 n = 134 Febbraio 2004 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 21,81 mm ES = 0,36 n = 78 Maggio 2004 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 18,39 mm ES = 0,20 n = 390
Fig. 4.1.1 - Composizione in classi di taglia di tutto il campione analizzato da dicembre 2003 ad aprile 2006.
Risultati 57 Giugno 2004 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 17,89 mm ES = 0,42 n = 97 Luglio 2004 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 20,96 mm ES = 0,12 n = 694 Ottobre 2004 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 21,44 mm ES = 0,10 n = 768 Fig. 4.1.1 – (Continua).
Marzo 2005 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 23,85 mm ES = 0,15 n = 156 Maggio 2005 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 15,10 mm ES = 0,15 n = 552 Giugno 2005 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 19,51 mm ES = 0,55 n = 51 Fig. 4.1.1 – (Continua).
Risultati 59 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 17,34 mm ES = 0,11 n = 490 Luglio 2005 Novembre 2005 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 20,65 mm ES = 0,15 n = 313 Settembre 2005 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 21,96 mm ES = 0,22 n = 172 Fig. 4.1.1 – (Continua).
Febbraio 2006 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 21,18 mm ES = 0,10 n = 306 Marzo 2006 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 22,72 mm ES = 0,12 n = 284 Aprile 2006 0 5 10 15 20 25 30 35 10 12 14 16 18 20 22 24 26 28 30 LC (mm) % I n d iv id u i LC media = 22,19 mm ES = 0,12 n = 228 Fig. 4.1.1 – (Continua).
Risultati
61
4.2 Rapporto sessi
La proporzione dei sessi è, come la fecondità, un parametro biologico caratteristico della specie, le cui variazioni sono talvolta in relazione con l’ambiente. Per la diversità dei loro meccanismi di adattamento e delle risposte alle variabili condizioni di vita, questi due parametri contribuiscono a mantenere, entro certi limiti, la capacità riproduttiva della specie e la sua continuità. Nello studio della dinamica delle popolazioni, la conoscenza del rapporto sessi di uno stock riproduttore è importante per la valutazione della fecondità potenziale.
Il rapporto sessi può essere espresso come tasso di mascolinità o femminilità, ma comprende sempre il rapporto fra il numero di maschi e di femmine in una popolazione o in un campione. Nel corso di questo studio è stato possibile effettuare la determinazione del sesso su tutto il campione disponibile a partire da 15 mm LC; al di sotto di questa taglia, la distinzione tra i sessi è risultata difficoltosa, poiché i caratteri sessuali secondari dei maschi non erano presenti o erano poco sviluppati. Pertanto, per non incorrere in errori sia sistematici che casuali nella determinazione del rapporto sessi, è stato deciso di utilizzare solo gli esemplari con LC > 14 mm.
Nel corso dello studio sono stati identificati 1451 maschi e 2385 femmine con una sex ratio (percentuale di femmine) del 62%; le femmine sono risultate statisticamente molto superiori ai maschi (chi quadro = 167; p < 0,001). In Tab. 4.2.1. sono mostrati gli esemplari campionati in ciascun mese, suddivisi in maschi e femmine. I confronti con il test chi quadro hanno confermato che il rapporto sessi è spostato a favore delle femmine; solo in tre mesi il test non ha dato differenze significative, in
tutti gli altri mesi le femmine sono risultate statisticamente maggiori ai maschi.
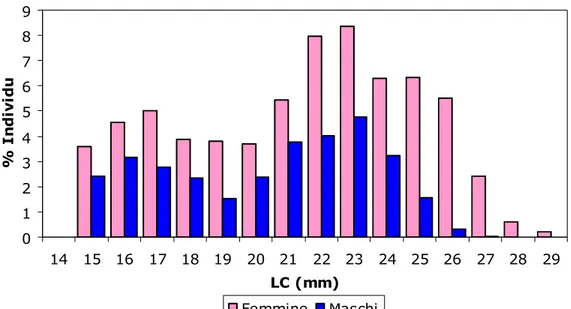
Gli individui più grandi sono risultati quasi sempre di sesso femminile ed inoltre, come si può notare dalla Fig. 4.2.1, la percentuale di femmine è stata sempre al di sopra del 50 % per tutte le classi di taglia. Confrontando la composizione in classi di taglia sia dei maschi che delle femmine (Fig. 4.2.2) si può osservare un andamento simile nei due sessi, con la differenza che le femmine sono presenti con un numero di individui più cospicuo. Inoltre i maschi sono compresi in un intervallo di taglia compreso tra 15 e 26 mm LC e le femmine tra 15 e 29 mm LC, confermando che quest’ultime raggiungono dimensioni maggiori rispetto all’altro sesso.
In Fig. 4.2.3 è mostrato l’andamento della taglia media per mese su tutto il campione ed anche per maschi e femmine separatamente. La taglia media dell’intero campione è risultata di 20,50 mm LC, quella delle femmine di 20,80 mm LC e quella dei maschi di 19,26 mm LC. Anche in questi grafici si possono osservare differenze stagionali: le taglie medie più piccole sono state ottenute nei mesi di maggio, giugno e luglio, quelle più grandi nei mesi invernali. Questo è dovuto al reclutamento degli individui giovani, incentrato nei mesi primaverili.
Risultati
63
Tab. 4.2.1 – Numero di maschi e di femmine campionati in ciascun mese; è riportato inoltre il rapporto sessi con il relativo test del chi quadro (N.S. = non significativo; S. = significativo). Il test del chi quadro non è stato effettuato per i campioni al di sotto di 50 esemplari.
Fig. 4.2.1 – Percentuale di femmine per classe di taglia (2003-2006). = Differenze non significative dal rapporto sessi 1.(test del chi-quadro). Campione Maschi Femmine Totale Sex ratio
(%F)
χ
2 Livello di probabilità dic-03 56 70 126 56 1,55 p > 0,05 N.S. feb-04 23 48 71 68 8,8 p < 0,005 S. apr-04 3 4 7 57 / / / mag-04 113 174 287 61 12,97 p < 0,001 S. giu-04 24 35 59 59 2,05 p> 0,05 N.S. lug-04 175 193 368 52 0,88 p > 0,05 N.S. ott-04 153 258 411 63 26,8 p < 0,001 S. mar-05 48 108 156 69 23,8 p < 0,001 S. mag-05 68 266 334 80 117 p < 0,001 S. giu-05 29 22 51 43 0,96 P > 0,05 N.S. lug-05 195 292 487 60 19,32 p < 0,001 S. ago-05 77 122 199 61 10,18 p < 0,005 S. set-05 44 108 152 71 26,95 p < 0,001 S. nov-05 125 185 310 60 11,61 p < 0,005 S. feb-06 109 197 306 64 25,31 p < 0,001 S. mar-06 107 177 284 62 17,25 p < 0,001 S. apr-06 102 126 228 55 2,53 p > 0,05 N.S. Totale 1451 2385 3836 62 167 p < 0,001 S. 0 20 40 60 80 100 14 16 18 20 22 24 26 28 30 LC (mm) % F e m m in eFig. 4.2.2 – Composizione in classi di taglia di maschi e femmine di P. edwardsii. 0 1 2 3 4 5 6 7 8 9 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 LC (mm) % I n d iv id u i Femmine Maschi
R is u lt a ti 6 5 F ig . 4 .2 .3 – R a p p re s e n ta z io n e d e lla t a g lia m e d ia ( ± d e v ia z io n e s ta n d a rd ) p e r o g n i m e s e d i c a m p io n a m e n to ( 2 0 0 3 -2 0 0 6 ) d e l to ta le d e g li in d iv id u i, d e lle fe m m in e e d e i m a s c h i. T O T A L E P O P O L A Z IO N E 0 5 10 15 20 25 30 dic-03 gen-04 feb-04 marzo aprile maggio giugno luglio agosto settembr ottobre novembr dicembre gen-05 febbraio mar-05 aprile maggio giugno luglio agosto settembr ottobre novembr dicembre gen-06 feb-06 marzo aprile M e s i LC (mm) F E M M IN E 0 5 10 15 20 25 30 dic-03 gen-04 feb-04 marzo aprile maggio giugno luglio agosto settembr ottobre novembr dicembre gen-05 feb-05 mar-05 aprile maggio giugno luglio agosto settembr ottobre novembr dicembre gen-06 feb-06 marzo aprile M e s i LC (mm) M A S C H I 0 5 10 15 20 25 30 dic-03 gen-04 feb-04 marzo aprile maggio giugno luglio agosto settembr ottobre novembr dicembre gen-05 feb-05 mar-05 aprile maggio giugno luglio agosto settembr ottobre novembr dicembre gen-06 feb-06 marzo aprile M e s i LC media (mm)
4.3 Evoluzione della maturità sessuale delle
femmine di P. edwardsii
Nei modelli di valutazione delle risorse ed ancora di più in quelli rivolti alla gestione delle stesse è di primaria importanza la conoscenza del ciclo biologico di una specie, che permette sia di modulare meglio l’uso di questi modelli, sia di pianificare meglio eventuali interventi gestionali. Per questo risulta prioritario lo studio di alcuni aspetti riproduttivi, come ad esempio il periodo riproduttivo, la taglia di prima maturità sessuale, la fecondità e il rapporto sessi. A tale scopo è stato determinato macroscopicamente, per le femmine con lunghezza del carapace maggiore o uguale a 15 cm (taglia al di sotto della quale è risultato difficoltoso determinare il sesso del singolo individuo), lo stadio maturativo della gonade e l’eventuale presenza di uova sulle appendici addominali.
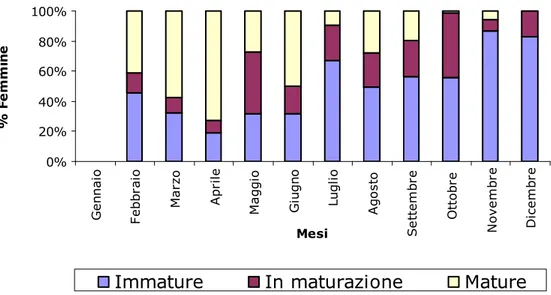
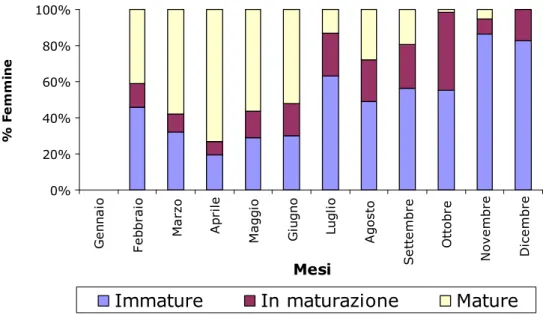
Lo studio del ciclo riproduttivo della specie si è basato sull’analisi dell’evoluzione mensile della proporzione di femmine nei tre stadi maturativi (immaturo, in maturazione, maturo). Nella Fig. 4.3.1 si osserva la percentuale di femmine nei tre stadi maturativi per mese da dicembre 2003 a aprile 2006. Esemplari nei tre stadi maturativi sono stati osservati in ogni mese, anche se in percentuali variabili, ad eccezione di dicembre 2003; la maturazione delle gonadi ha mostrato un certo andamento stagionale, seppure con percentuali differenti, nonostante la variabilità dei campioni. È stato osservato un picco di femmine mature in aprile, mentre la presenza di femmine immature è risultata notevole nei mesi invernali, in particolare in dicembre 2003, dove non è stata catturata nessuna femmina in stadio 3 (gonadi mature) e la percentuale
Risultati
67
delle femmine in stadio 1 (gonadi immature) è risultata superiore dell’ 80%. Per osservare meglio l’andamento annuale dello sviluppo delle femmine del campione in esame, sono stati accorpati tutti i mesi, in modo da ottenere un cosiddetto “anno ideale” (Fig. 4.3.2). In questo istogramma, infatti, l’andamento è più chiaro, anche se conferma quanto già detto precedentemente ed evidenziato dalla Fig. 4.3.1. In particolare viene confermato il picco di femmine mature nei mesi primaverili, la cui presenza tende a diminuire nei successivi mesi estivi e autunnali, fino a scomparire nei mesi invernali. Questi dati evidenziano un periodo di maggiore attività riproduttiva nel periodo compreso tra febbraio ed agosto. Nei mesi successivi l’attività riproduttiva va rapidamente riducendosi.
Per studiare al meglio l’evoluzione della maturità sessuale di P. edwardsii, è stato deciso di utilizzare solo femmine adulte, pronte cioè a riprodursi e quindi con ovari in grado di iniziare la maturazione sessuale. Queste femmine sono state identificate in base ai risultati ottenuti con lo studio della taglia di prima maturità (che verrà descritta nei prossimi paragrafi) e dai dati provenienti dalla letteratura: è stata individuata una taglia maggiore o uguale a 17 mm LC per identificare gli individui adulti di P. edwardsii. Nella Fig. 4.3.3 si osserva la percentuale delle femmine adulte nei tre stadi maturativi, accorpata nell’anno ideale. L’andamento è più o meno lo stesso della Fig. 4.3.2, anche il picco di maturità risulta ancora meglio definito, incentrato tra marzo e giugno.
Fig. 4.3.1 - Percentuale di femmine nei tre stadi maturativi nei differenti mesi di campionamento dal 2003 al 2006.
Fig. 4.3.2 – Percentuale di tutte le femmine nei tre stadi maturativi accorpata in un “anno ideale”.
0% 20% 40% 60% 80% 100% d ic -0 3 g e n -0 4 fe b b ra io m a rz o a p ri le m a g g io g iu g n o lu g li o a g o s to s e tt e m b re o tt o b re n o v e m b re d ic e m b re g e n -0 5 fe b b ra io m a rz o a p ri le m a g g io g iu g n o lu g li o a g o s to s e tt e m b re o tt o b re n o v e m b re d ic e m b re g e n -0 6 fe b b ra io m a rz o a p ri le Mesi % F e m m in e
Immature In maturazione Mature
0% 20% 40% 60% 80% 100% G e n n a io F e b b ra io M a rz o A p ri le M a g g io G iu g n o L u g li o A g o s to S e tt e m b re O tt o b re N o v e m b re D ic e m b re Mesi % F e m m in e
Risultati
69
Fig. 4.3.3 – Percentuale delle femmine adulte (LC ≥ 17 mm) nei tre stadi maturativi accorpata in un “anno ideale”.
0% 20% 40% 60% 80% 100% G e n n a io F e b b ra io M a rz o A p ri le M a g g io G iu g n o L u g li o A g o s to S e tt e m b re O tt o b re N o v e m b re D ic e m b re Mesi % F e m m in e
5.4 Femmine ovigere
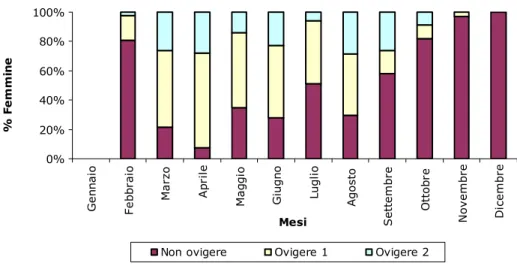
L’evoluzione temporale della presenza di femmine ovigere è mostrata in Fig. 4.4.1. Le più alte percentuali di femmine adulte con uova sono state osservate in primavera e in estate (92% in aprile e 70% a giugno). La frazione delle femmine ovigere si è ridotta nei restanti mesi ed è risultata assente nel mese di dicembre. La presenza di femmine con uova con all’interno embrioni in stadio di sviluppo avanzato (ovigere stadio 2) non hanno mostrato sostanziali differenze nei vari mesi, anche se le percentuali sono sempre inferiori a quelle delle femmine ovigere con uova in uno stadio di sviluppo meno avanzato (ovigere stadio 1).
Fig. 4.4.1 – Percentuale mensile di femmine adulte(stadio 1 e stadio 2 delle uova) e non ovigere; sono rappresentati solo gli esemplari adulti
(LC ≥ 17 mm). 0% 20% 40% 60% 80% 100% G e n n a io F e b b ra io M a rz o A p ri le M a g g io G iu g n o L u g li o A g o s to S e tt e m b re O tt o b re N o v e m b re D ic e m b re Mesi % F e m m in e
Risultati
71
4.5 Taglia di prima maturità sessuale
La taglia di prima maturità sessuale e la taglia minima di maturità sono altri importanti parametri da tenere in considerazione per stimare la frazione riproduttrice di una popolazione e per individuare misure gestionali da applicare alla gestione degli stock sfruttati. La taglia di prima maturità può variare in risposta a cambiamenti della densità di popolazione (Hislop, 1984) conseguenti a sfruttamento eccessivo della risorsa, ma anche bassi livello di cibo possono influenzare tale parametro (Wotton, 1984). Tutti questi aspetti, insieme alla fecondità e al periodo riproduttivo, costituiscono le basi della strategia riproduttiva di una specie e interagiscono tra loro per assicurare la sopravvivenza di questa.
La taglia di prima maturità è definita (Holden & Raitt, 1974) come la taglia alla quale il 50% degli individui di una popolazione è maturo. Per la specie P. edwardsii sono stati individuati due tipi di maturità: la taglia di prima maturità fisiologica, cioè la taglia alla quale il 50% delle femmine ha ovari maturi e la taglia di prima maturità funzionale, cioè la taglia alla quale il 50 % delle femmine presentava uova sui pleopodi.
Le più piccole femmine con gonadi mature e ovigere, osservate nel corso del presente studio, misuravano rispettivamente 13 e 15 mm LC. Oltre 27 mm LC tutte le femmine avevano gonadi mature, oltre 26 mm LC tutte le femmine erano ovigere.
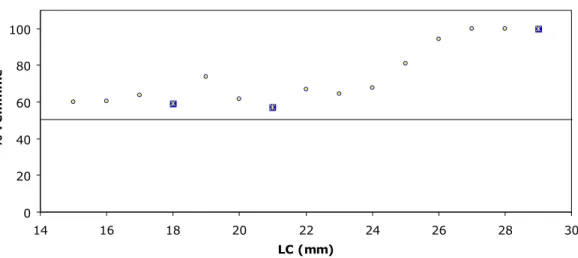
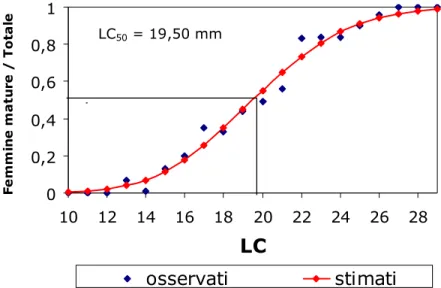
Come si può osservare dalla Fig. 4.5.1, i dati osservati sulla proporzione di femmine mature sul totale delle femmine per classi di taglia si adatta bene alla curva sigmoide stimata. La taglia di prima maturità fisiologica è risultata 19,50 mm LC.
La maturità funzionale è stata invece calcolata usando come criterio la presenza di uova sotto l’addome. Come si può vedere dalla Fig. 4.5.2, anche in questo caso i dati osservati delle femmine ovigere sul totale per classi di taglia si adattano bene alla curva sigmoide stimata. La taglia di maturità funzionale è risultata 20,13 mm LC; questa taglia risulta maggiore, seppure di poco, della taglia di maturità fisiologica, come da attendersi poiché la maturazione dell’ovario deve precedere l’emissione delle uova.
Fig. 4.5.1 – Taglia di prima maturità fisiologica di P. edwardsii (2003-2006).
Fig. 4.5.2 – Taglia di prima maturità funzionale di P. edwardsii (2003-2006).
0 0,2 0,4 0,6 0,8 1 10 12 14 16 18 20 22 24 26 28
LC
F e m m in e m a tu re / T o ta leosservati
stimati
LC50 = 19,50 mm 0 0,2 0,4 0,6 0,8 1 10 12 14 16 18 20 22 24 26 28 LC F e m m in e o v ig e re / T o ta le osservati stimati LC50 = 20,13 mmRisultati
73
4.6 Ciclo riproduttivo delle femmine di P.edwardsii
Le caratteristiche riproduttive di P. edwardsii si trovano in molte altre specie di crostacei decapodi: la presenza di più deposizioni nel corso del ciclo vitale e l’incubazione di uova, trattenute dalle appendici addominali. Queste caratteristiche fanno sì che si possano ritrovare femmine con tutte le combinazioni possibili di maturazione degli ovari e di sviluppo delle uova.Al fine di dare un senso biologico ai risultati ottenuti attraverso le osservazioni e le analisi accurate degli aspetti riproduttivi della specie, è stata condotta un’analisi congiunta dei risultati provenienti dall’esame macroscopico degli ovari e considerando anche la taglia di prima maturità sessuale. In questa valutazione sono risultate utili anche le considerazioni sulla presenza di femmine ovigere.
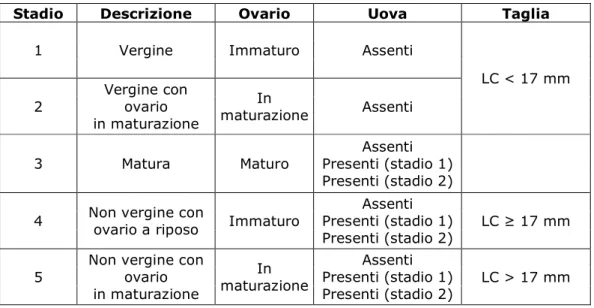
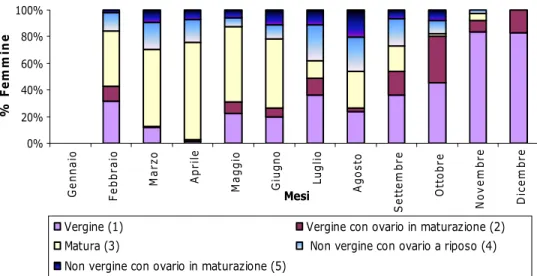
La Tab. 4.5.1 mostra gli stadi maturativi rielaborati dopo l’analisi congiunta. Sono stati individuati cinque possibili stadi di maturità: al primo stadio appartengono le femmine immature, che non si sono mai riprodotte (“vergini”), essendo al di sotto della taglia di maturità sessuale; nel secondo stadio troviamo femmine ancora vergini, ma con ovario in maturazione; nel terzo stadio sono raggruppate le femmine con ovario maturo, che possono avere assenza o presenza di uova nei due stadi sviluppo; nel quarto stadio gli ovari sono immaturi, ma appartengono a femmine adulte e possono essere presenti uova sull’addome (“femmine non vergini con gonadi a riposo”); il quinto stadio racchiude le femmine adulte con ovario in maturazione, che possono possedere uova nei due differenti stadi di sviluppo (“femmine non vergini con ovario che inizia un’altra maturazione”).
In Fig. 4.5.1 sono stati riportati i dati riguardanti le femmine adulte nei cinque stadi “combinati”. L’andamento conferma quanto già detto nei grafici precedenti: si ha un picco pronunciato di femmine mature nel mese di aprile, che si mantiene elevato per tutta la primavera e metà estate. A luglio/agosto si osserva il picco delle ovigere, sia in stadio 1 che in stadio 2, per diminuire fino a scomparire a dicembre. Un numero elevato di femmine ovigere si nota anche nei mesi primaverili. Questo grafico dà un’ulteriore conferma del fatto che le femmine ovigere sono presenti tutto l’anno, ad eccezione del mese di dicembre, anche se con percentuali differenti. Questo vale anche per i tre stadi maturativi delle gonadi.
Tab. 4.5.1 – I cinque stadi combinati di sviluppo di uova e ovari di P. edwardsii.
Stadio Descrizione Ovario Uova Taglia
1 Vergine Immaturo Assenti
2 Vergine con ovario in maturazione In maturazione Assenti LC < 17 mm 3 Matura Maturo Assenti Presenti (stadio 1) Presenti (stadio 2) 4 Non vergine con
ovario a riposo Immaturo
Assenti Presenti (stadio 1) Presenti (stadio 2)
LC ≥ 17 mm
5
Non vergine con
ovario in maturazione In maturazione Assenti Presenti (stadio 1) Presenti (stadio 2) LC > 17 mm
Risultati
75
Fig. 4.5.1 – Stadi di sviluppo combinati di uova e ovari, per le femmine adulte di P. edwardsii, accorpati in un anno ideale.
0% 20% 40% 60% 80% 100% G e n n a io F e b b ra io M a rz o A p ri le M a g g io G iu g n o L u g li o A g o s to S e tt e m b re O tt o b re N o v e m b re D ic e m b re Mesi % F e m m in e
Vergine (1) Vergine con ovario in maturazione (2) Matura (3) Non vergine con ovario a riposo (4) Non vergine con ovario in maturazione (5)
4.7 La fecondità
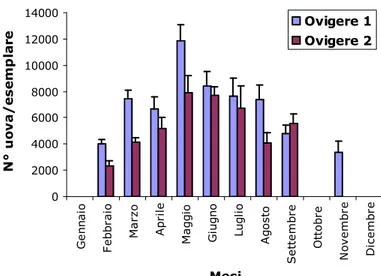
- Fecondità assolutaLo fecondità individuale o assoluta è definita come il numero di ovociti presenti nell’ovario appena prima della deposizione o rilascio (Bagenal, 1973). La stima della fecondità delle femmine di P. edwardsii, espressa come numero di uova prodotte, è stata stimata su un totale di 267 femmine ovigere, di cui 137 con uova in stadio 1 e 130 in stadio 2. E’ stata osservata un’estrema variabilità per quanto riguarda il numero di uova prodotto; il numero minimo di uova stimato è stato di 920 per una femmina di 21 mm LC, mentre il numero massimo è stato di 19.792 per una femmina di 25 mm LC.
In Fig. 4.7.1 è mostrata l’evoluzione temporale del numero medio di uova per femmina. Dall’istogramma si può osservare una marcata stagionalità: la potenzialità riproduttiva, espressa in questo caso dal numero di uova, è risultata sensibilmente superiore nel mese di maggio (valori di circa 12.000 uova in stadio 1) rispetto a febbraio e a novembre (circa 4000 uova in stadio 1).
Fig. 4.7.1 – Numero medio di uova prodotte per ogni individuo nei mesi di studio (+ errore standard).
0 2000 4000 6000 8000 10000 12000 14000 G e n n a io F e b b ra io M a rz o A p ri le M a g g io G iu g n o L u g li o A g o s to S e tt e m b re O tt o b re N o v e m b re D ic e m b re Mesi N ° u o v a / e s e m p la re Ovigere 1 Ovigere 2
Risultati
77 - Fecondità relativa
La fecondità relativa è stata studiata valutando il numero di uova secondo la classe di taglia e come numero di uova per grammo di peso individuale. In Tab. 4.7.1 sono riportati i valori di fecondità espressi come numero di uova/ g di peso individuale per le femmine suddivise in quattro classi di taglia; sono state considerate solo le femmine ovigere con le uova in stadio 1, in fase iniziale di sviluppo, e sono stati considerati gli esemplari provenienti sia dalla pesca con le nasse che dalla pesca a strascico di fondo. Si può notare che il numero medio di uova per grammo rimane sostanzialmente costante nelle quattro classi di taglia, come tra l’altro confermato dai test statistici (test ANOVA, P = 0,589). Questi risultati sono evidenti anche dal diagramma Box-Whisker, riportato in Fig. 4.7.2; si può notare infatti solo un leggero aumento del numero di uova medio per grammo con la taglia.
Tab. 4.7.1 - Numero medio di uova per grammo di peso individuale, per classe di taglia. ES = errore standard.
classi di taglia (LC mm) n° medio uova/g ES n 15 - 18 615 46,790 9 19 - 22 632 49,512 37 23 - 25 697 54,662 37 > 25 711 40,477 38
Fig. 4.7.2 – Numero medio di uova per grammo per le femmine ovigere in stadio 1 di P. edwardsii, suddivise in classe di taglia. I = (15–18 mm LC), II = (19-22 mm LC), III = (23-25 mm LC), IV = LC > 25 mm.
Al fine di valutare la rappresentatività delle stime effettuate secondo i due metodi di campionamento (pesca a strascico e nasse sperimentali) sono state messi a confronto i valori di fecondità per classe di taglia provenienti da campioni differenti. Dalla Fig. 4.7.3 si vede con chiarezza che le stime provenienti dai campioni pescati con nasse sono sensibilmente superiori a quelle dei campioni pescati con rete a strascico, in tutte le classi di taglia. E’ stata quindi presa la decisione di valutare la fecondità relativa solo per le femmine campionate con le nasse sperimentali, al fine di ottenere una stima ancor più rappresentativa e di non incorrere in errori di sottostima.
Media Errore Standard Deviazione Standard
I II III IV Classi di taglia (mm LC) 200 300 400 500 600 700 800 900 1000 1100 n ° m e d io d i u o v a /g d i p e s o i n d iv id u a le
Risultati
79
Fig. 4.7.3 – Fecondità media per classe di taglia di tutti gli individui di P. edwardsii catturati con la pesca a strascico e con le nasse
(+ errore standard).
In Fig. 4.7.4 e 4.7.5 sono mostrati rispettivamente gli andamenti delle fecondità relativa per taglia e per grammo di peso individuale. Si nota un andamento simile per le uova nei due diversi stadi di sviluppo, anche se le curve relative alle uova in stadio 2 hanno un esponente leggermente più alto. La relazione della fecondità con la taglia tende alla linearità, mentre quella con il peso individuale è risultata di tipo esponenziale. Confrontando l’equazione della relazione lineare relativa allo stadio 1 con quella dello stadio 2, si può osservare che, a parità di taglia, il coefficiente angolare è diminuito di circa il 18%. Questa diminuzione può essere correlabile alla perdita di uova che si verifica passando dallo stadio 1 allo stadio 2. 0 2000 4000 6000 8000 10000 12000 14000 16000 18000 20000 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 LC (mm) N ° u o v a / n Nasse Strascico
Fig. 4.7.4 – Fecondità per classe di taglia per le femmine di P. edwardsii catturate con le nasse nei diversi mesi di campionamento, rispettivamente con
uova in stadio 1 e 2. y = 1365,2x - 20987 R2 = 0,7371 0 5000 10000 15000 20000 25000 12 14 16 18 20 22 24 26 28 30 LC (mm) N ° u o v a ( S t. 1 ) y = 1172,2x - 18804 R2 = 0,7131 0 5000 10000 15000 20000 25000 12 14 16 18 20 22 24 26 28 30 LC (mm) N ° u o v a ( S t. 2 )
Risultati
81
Fig. 4.7.5 - Fecondità per grammo di peso individuale per le femmine di P. edwardsii catturate con le nasse nei diversi mesi di campionamento,
rispettivamente con uova in stadio 1 e 2.
y = 290,72x1 ,4 8 9 7 R2 = 0,8758 0 5000 10000 15000 20000 25000 0 2 4 6 8 10 12 14 16 18 P.Tot (g) N ° u o v a ( S t. 1 ) y = 109,72x1 ,7 7 2 4 R2 = 0,8609 0 5000 10000 15000 20000 25000 0 2 4 6 8 10 12 14 16 18 P.Tot (g) N ° u o v a ( S t. 2 )
Sviluppo delle uova
Ceccaldi (1966), sulla base di accurate osservazioni al microscopio di uova e ovari, individuò otto stadi di sviluppo delle uova (Fig. 4.7.6): Stadio A: le uova si trovano all’inizio dello sviluppo e sono di colore blu scuro. L’uovo contiene all’interno una massa vitellina di globuli sferici di taglia diversa.
Stadio B: l’uovo comincia ad essere differenziato nella parte inferiore della massa vitellina. Si formano cellule più rifrangenti dei globuli, costituite da numerose granulazioni (sarà la futura regione cefalica o parte anteriore). La moltiplicazione più importante avviene nella parte ventrale, quando le piccole cellule hanno raggiunto una distanza tale, pari alla metà della larva e cominciano a dividere il polo superiore dal posteriore con un’incisura nella massa cellulare in via di divisione. Si avranno così 2 regioni, costituite da una regione posteriore che diventerà la regione addominale della larva e da una regione anteriore, contenente il vitello, che darà la regione cefalotoracica della larva.
Stadio C: l’incisura aumenta e diviene una vera fessura visibile. L’estremità posteriore cresce in lunghezza e lo sviluppo di tale regione addominale avverrà lungo la parte ventrale della larva: la “forca caudale” si troverà poi contro la parte ventrale del cefalotorace, poi a livello delle mandibole, poi degli occhi ed infine sulla parte dorsale del cefalotorace, subito prima della schiusa. Evolve la massa vitellina e quindi i globuli aumentano di taglia e di conseguenza anche il volume occupato da essi, a scapito della soluzione blu.
Risultati
83
Stadio D: in questo stadio compaiono “gemme”, sono abbozzi delle future appendici. È a questo punto che il colore blu delle uova comincia ad impallidire.
Stadio E: nel futuro cefalotorace (regione anteriore) compaiono piccoli punti rossi, rapportabili ad un’altra carotenoproteina, ma non costituiscono obbligatoriamente i primi abbozzi oculari. Persistono nella regione cefalotoracica e nelle appendici anche quando gli occhi larvali sono ben differenziati.
Stadio F: gli abbozzi oculari sono evidenti quando le uova sono di colore verde-grigio. Vicino alla base delle due appendici più anteriori compaiono due masse nella massa stessa delle cellule in differenziazione; queste masse sono costituite da granuli di color rosso-vino all’interno e marrone all’esterno. Ci sono 8 paia d’appendici, di cui le ultime 3 biramose. La forca caudale ha 6 paia di spine e quando questa si trova di fronte agli abbozzi oculari, questi sono più scuri e più grandi.
Stadio G: gli occhi sono ben individuabili, quando le uova sono rosso-marroni; L’addome si è allungato e la forca si trova nella parte anteriore. I punti rossi sono più grandi e più numerosi soprattutto sulle appendici. Stadio H: prima della schiusa delle uova, il cefalotorace si è allargato nella parte posteriore; l’addome si è ispessito ed allungato ed è diventato più muscoloso. È apparso il futuro tubo digerente. La forca caudale ben ispessita si trova nella parte dorsale anteriore del cefalotorace.
Fig. 4.7.6 - Schema rappresentativo degli otto stadi di sviluppo delle uova di P. edwardsii (da Ceccaldi, 1966).
Le analisi sulla morfologia delle uova effettuate nell’ambito di questo lavoro di tesi, hanno permesso di accorpare gli 8 stadi proposti da Ceccaldi (1966) in 4 stadi di più facile individuazione.
Risultati
85
STADIO 1 – Uova di colore azzurro intenso. Non sono presenti abbozzi oculari (uova senza occhi); gli ovociti sono ben uniti fra di loro, si vede bene il futuro embrione, che occupa il centro dell’uovo (Fig. 4.7.7). Questo stadio corrisponde agli stadi A-B-C- di Ceccaldi (1966).
Fig. 4.7.7 – Immagine di uova in stadio 1 di P. edwardsii. 0,50 mm
STADIO 2 – Uova senza abbozzi oculari di colore blu pallido. Il futuro embrione occupa ora tutto il volume e compaiono gemme sulla parte ventrale della futura regione cefalotoracica, gli abbozzi delle future appendici; sono inoltre visibili minuscoli punti rossi nel futuro cefalotorace (Fig. 4.7.8). Questo stadio corrisponde gli stadi D-E di Ceccaldi (1966).
Fig. 4.7.8 – Immagine di uova in stadio 2 di P. edwardsii. 0, 50 mm
Risultati
87
STADIO 3 – Uova di colore grigio-verde con abbozzi oculari ben sviluppati (uova con occhi) e con embrione in sviluppo. Si ha la comparsa di granuli di colore arancio (Fig. 4.7.9). Questo stadio corrisponde allo stadio F di Ceccaldi (1966).
Fig. 4.7.9 – Immagine di uova in stadio 3 di P. edwardsii. 0, 70 mm
STADIO 4 – Uova di colore marrone chiaro con abbozzi oculari ben sviluppati. Sono presenti embrioni ben sviluppati contenuti nell’uovo, e alcune larve cominciano a fuoriuscire dall’uovo (Fig. 4.7.10). Questo stadio corrisponde agli stadi G-H di Ceccaldi (1966).
Fig. 4.7.10 – Immagine di uova in stadio 4 di P. edwardsii. 0,70 mm
Risultati
89
Inoltre, è stato possibile individuare un quinto stadio, che non corrisponde a nessuno stadio descritto precedentemente da Ceccaldi (1966): si tratta delle larve completante formate, uscite dall’uovo e pronte ad essere rilasciate nella colonna d’acqua (Fig .4.7.11).
Fig. 4.7.11 – Immagine di larve (stadio 5) di P. edwardsii. 0, 50 mm
Come si può osservare dai grafici della Fig. 4.7.12, le uova appartenenti a ciascuno stadio di sviluppo (stadi da 1 a 4) hanno dimensioni molto simili. La struttura in taglia della popolazione ovocitaria, rappresentata essenzialmente da 4-5 classi di taglia, presenta sempre una classe modale ben distinta; questo è testimonianza di uno sviluppo sincrono delle uova. Passando dallo stadio 1 al 4, la classe modale degli ovociti misurati è rimasta sostanzialmente simile; si può apprezzare solo un leggero incrementi delle dimensioni degli ovociti (la moda delle distribuzioni di taglia è passata da 0,6 a 0,7 mm).
Un quadro nettamente differente è invece stato osservato per lo stadio 5 (uova schiuse, larve pronte ad essere emesse); le larve misurate erano comprese tra un intervallo di taglia molto ampio, da 0,8 a 2,4 mm e, dal grafico, non è individuabile nessuna classe modale. Questo può essere dovuto al fatto che, appena dopo la fuoriuscita dall’uovo, la larve si distendono e si accrescono molto rapidamente.
Risultati
91
Fig. 4.7.12 – Struttura in taglia di uova e larve nei differenti stadi di sviluppo.
Stadio 1 0 10 20 30 40 0,00 0,50 1,00 1,50 2,00 2,50 Diametro (mm) % Stadio 2 0 10 20 30 40 0,00 0,50 1,00 1,50 2,00 2,50 Diametro (mm) % Stadio 3 0 10 20 30 40 0,00 0,50 1,00 1,50 2,00 2,50 Diametro (mm) % Stadio 4 0 10 20 30 40 0,00 0,50 1,00 1,50 2,00 2,50 Diametro (mm) % Stadio 5 0 10 20 30 40 0,00 0,50 1,00 1,50 2,00 2,50 Diametro (mm) %
Alcuni campioni di uova sono stati misurati sia a fresco che in formalina, al fine di stimare le differenze dimensionali in seguito alla fissazione. Dagli istogrammi di Fig. 4.7.13 si può notare che la fissazione in formalina ha prodotto un restringimento delle dimensioni delle uova, in tutte le fasi di sviluppo. Il restringimento è stato dell’ordine di una-due classi di classi di taglia (da 0,06 a 0,13 mm) per le uova negli stadi da 1 a 3, mentre per le uova in stadio 4 il restringimento osservato è stato ancora più sensibile (intorno a 0,2 mm). Anche le larve pronte ad essere liberate (stadio 5) hanno mostrato un restringimento nelle loro dimensioni, prodotto dalla fissazione in formalina, tra 0,1 e 0,2 mm, a seconda della classe modale. (Tab. 4.7.2).
Tab. 4.7.2 – Differenze osservate tra le uova misurate a fresco e conservate successivamente in formalina, per ogni stadio di sviluppo.
Moda a fresco (mm) Moda in formalina (mm) Differenza dimensionale (mm) stadio 1 0,68 0,55 0,13 stadio 2 0,68 0,61 0,07 stadio 3 0,8 0,74 0,06 stadio 4 0,93 0,74 0,19 stadio 5 1,23 (1° moda) 0,99 0,24 stadio 5 2,03 (2° moda) 1,91 0,12
Risultati
93
Fig. 4.7.13 – Struttura in taglia di uova e larve nei diversi stadi di sviluppo, rilevata nei campioni a fresco e successivamente fissati in formalina.
0 10 20 30 40 0,30 0,60 0,90 1,20 1,50 1,80 2,10 2,40 2,70 3,00 Diametro (mm) % A fresc o (n = 460) In formalina (n = 470) Stadio 1 0 10 20 30 40 0,30 0,60 0,90 1,20 1,50 1,80 2,10 2,40 2,70 3,00 Diametro (mm) % A fresco (n = 103) In formalina (n = 103) Stadio 3 0 10 20 30 40 0,30 0,60 0,90 1,20 1,50 1,80 2,10 2,40 2,70 3,00 Diametro (mm) % A fresc o (n = 51) In formalina (n = 52) Stadio 4 0 10 20 30 40 0,30 0,60 0,90 1,20 1,50 1,80 2,10 2,40 2,70 3,00 Diametro (mm) % A fresc o (n = 153) In formalina (n = 156) Stadio 5 0 10 20 30 40 0,30 0,60 0,90 1,20 1,50 1,80 2,10 2,40 2,70 3,00 Diametro (mm) % A fresc o (n = 157) In formalina (n = 161) Stadio 2
4.8 Relazione taglia-peso
La relazione taglia-peso di P. edwardsii è stata analizzata sia per il totale della popolazione campionata, sia per i due sessi separatamente (Fig. 4.8.1).
Per tutta la popolazione e per entrambi i sessi il parametro b è risultato significativamente inferiore a 3, a testimonianza di una crescita di questi organismi di tipo allometrico negativo, che spiega l’aumento della taglia rispetto al peso (test t, p<0,001, sia per la popolazione che per i due sessi separati). In Fig. 4.8.1 è anche stata osservata una differenza statisticamente significativa nel confronto di b tra maschi e femmine (test t, p<0,01), con il valore di b maggiore per le femmine; questo significa che a parità di taglia le femmine incrementano di peso più rapidamente rispetto ai maschi.
Per le femmine è stata fatta un’ulteriore suddivisione in base alla maturità sessuale, suddividendole nei 5 stadi maturativi definiti in questo lavoro e in ovigere e non ovigere (Tab. 4.8.1). I valori di b non hanno mostrato differenze sostanziali in funzione dello stadio maturativo, né in funzione della presenza di uova sui segmenti addominali.
Risultati
95
Fig. 4.8.1 – Relazione taglia-peso del totale della popolazione campionata, dei maschi e delle femmine di P. edwardsii.
Tabella 4.8.1 – Parametri riguardanti l’equazione della taglia-peso per le femmine ovigere e non ovigere e per le femmine nei cinque stadi di sviluppo.
A b R 2 Stadio 1 0,003 2,536 0,728 Stadio 2 0,009 2,151 0,715 Stadio 3 0,004 2,507 0,831 Stadio 4 0,001 2,826 0,914 Stadio 5 0,002 2,675 0,919 Ovigere 0,003 2,63 0,893 Non ovigere 0,003 2,564 0,955 Totale popolazione y = 0,0022x2 ,6 6 4 7 R2 = 0,9566 0 3 6 9 12 15 18 8 11 14 17 20 23 26 29 LC (mm) P T O T ( g ) Maschi y = 0,0034x2 ,5 0 0 9 R2 = 0,9476 0 3 6 9 12 15 18 8 11 14 17 20 23 26 29 LC (mm) P T O T ( g ) Femmine y = 0,002x2 ,6 9 9 R2 = 0,958 0 3 6 9 12 15 18 8 11 14 17 20 23 26 29 LC (mm) P T O T ( g )