5
Materiali e Metodi
5.1 Biologia Cellulare e Molecolare
5.1.1 Linea Cellulare
La linea cellulare utilizzata per la produzione delle particelle virali è la linea HEK293T (293T). Queste cellule sono costituite da fibroblasti embrionali renali umani trasformati con l’adenovirus umano 5 (Graham, Smiley et al. 1977) e con l’antigene T del virus della scimmia 40 (SV40).
Le cellule sono state mantenute in coltura a 37°C e 5% di CO2 in terreno Dulbecco
Modified Eagle’s Medium High Glucose (DMEM-Hi-Glu, Sigma Aldrich, Milan, Italy) addizionato con il 10% di siero fetale bovino scomplementato (FCS, Gibco, Invitrogen, Paisley, UK), 100 U/ml di pennicillina, 100 µg/ml di streptomicina ed L-glutammina 2 mM (Sigma Aldrich).
5.1.2 Produzione del vettore mediante trasfezione
I vettori utilizzati per la vaccinazione sono stati prodotti in cellule 293T. Ventiquattro ore prima della trasfezione 3x106 cellule sono state seminate in piastre Petri da 10 cm. Il giorno seguente le cellule sono state trasfettate con 20 µg di costrutto vettore (LAW-GFP, LAW-gB1 o LAW), 10 µg di costrutto di packaging pΔenv1 e 5 µg di costrutto envelope VSV-G. Per la trasfezione è stato utilizzando il polimero polietilenimmina 10 µM (PEI, Sigma Aldrich); brevemente, il DNA è stato mescolato con una soluzione di NaCl 150 mM fino ad un volume di 700 µl, allo stesso modo 100 µl di PEI sono stati portati a 700 µl con NaCl 150 µM. Le due soluzioni sono state mescolate ed incubate a temperatura ambiente (TA) per 15 minuti in seguito ai quali la nuova soluzione è stata delicatamente aliquotata sulle cellule. Prima di procedere alla trasfezione, il terreno presente sulle cellule è stato sostituito con 5 ml di DMEM Hi-Glu privo di antibiotici ed FBS, mentre 6 ore dopo la trasfezione il terreno è stato sostituito con 10 ml di DMEM Hi-Glu completo.
Il sovranatante contenente le particelle vettore è stato collezionato a 48 ore dalla trasfezione e l’efficienza di trasfezione è stata valutata mediante western blot, saggio di attività dell’RT, saggio di misurazione della proteina capsidica p25, trasduzione e, nel caso
di trasfezione con il costrutto esprimente GFP, contando le cellule GFP-positive con il citofluorimetro (FACS, FACScan and CELLQuest, BD Biosciences, Milan, Italy).
Il vettore raccolto è stato chiarificato a 1800 rpm per 5 minuti, filtrato con filtri da 22 µM ed ultracentrifugato in appositi tubi da 27 ml (Quick-Seal Ultra Clear Tubes, Beckman Coulter, Fullerton, CA, USA) a 40000 rpm per 2 ore. Dopo ultracentrifugazione, il campione è stato risospeso in un volume che varia da 250 µl a 500 µl in soluzione fisiologica.
5.1.3 Lettura al citofluorimetro
Per potere valutare l’efficacia di trasfezione prima di ultracentrifugare il campione, in parallelo ed allo stesso modo delle trasfezioni per la produzione del vettore, è stata anche effettuata la trasfezione del vettore LAW-GFP. A 48 ore dalla trasfezione, le cellule sono state staccate e, dopo centrifugazione a 1200 rpm per 5 minuti, sono state risospese in 500 µl di FACS buffer (0.2% BSA, 0.1% sodio azide, PBS) per la lettura. La percentuale di cellule fluorescenti è stata calcolata rispetto a cellule non trasfettate di controllo.
5.1.4 Trasduzione
Il giorno precedente alla trasduzione, 6x104 cellule 293T sono state seminate in piastre da 24 pozzetti. Il giorno seguente, una aliquota del surnatante ottenuto dalla trasfezione e contenente le particelle virali, è stata utilizzata per trasdurre le cellule seminate andando a sostituirla al terreno di coltura. Dopo 6 ore il terreno è stato nuovamente sostituito con terreno fresco e dopo 48 ore di incubazione si è proceduto all’analisi.
Per valutare l’efficienza di trasduzione, le cellule trasdotte con il vettore esprimente GFP sono state analizzate al FACS (§ 5.1.3) mentre le cellule trasdotte con LAW-gB1, non essendo fluorescenti, sono state analizzate mediante western blot.
5.1.5 Western Blot
Per valutare l’espressione di gB1 da parte del costrutto vettore, è stato effettuato un western blot sulle cellule trasfettate e trasdotte. Circa 105 cellule trasfettate o trasdotte sono state risospese in 20 µl di buffer di lisi (10 mM Tris, 2 mM EDTA, 0.15 mM NaCl, 0.5% Nonidet P-40) addizionati con 20 µl del colorante SDS sample buffer 2X (0.5 M Tris HCl pH 6.8, 10% glicerolo, 10% SDS, 0.05% β-mercaptoetanolo, 0.05% blu di bromo fenolo). I campioni così preparati sono stati bolliti 7 minuti e caricati su un gel di
acrilamide/bis-acrilammide costituito da uno stacking gel (30% Acrilammide/Bis Solution 29:1, Bio-Rad, Hercules, CA, USA; 0.5 mM Tris HCl pH 6.8, 10% SDS, 10% APS, 10% TEMED) e da un resolving gel (30% Acrilammide/Bis Solution 29:1, 1.5 mM Tris HCl pH 8.8, 10% SDS, 10% APS, 10% TEMED ). La corsa è stata effettuata in tampone di corsa 1X (25 mM Tris, 0.1% SDS, 1.44% glicina, pH 9.0) ad una differenza di potenziale di 80-100 volt per 1-2 ore.
Il trasferimento delle bande sulla membrana di nitrocellulosa (Amersham Pharmacia Biotech, Orsey, Francia) è stato effettuato in presenza del buffer di trasferimento (0.3% Tris, 1.44% glicina, 20% metanolo) ad una differenza di potenziale di 100 volt per 1 ora e mezza.
In seguito è stato effettuato il bloccaggio dei siti sulla membrana con l’utilizzo di PBS con lo 0.05% di Tween (PBS-T) e skim-milk al 3%, lasciato overnight (ON) in agitazione. Il giorno seguente, dopo 3 lavaggi con PBS-T/skim-milk, la membrana è stata ibridata con l’anticorpo policlonale anti-gB ottenuto da siero di coniglio diluito 1:500 in PBS-T/skim-milk all’1%. Dopo un’ora e mezza sono stati effettuati 3 lavaggi con PBS-T per togliere l’anticorpo non legato ed è stato aggiunto l’anticorpo secondario anti-rabbit coniugato con l’enzima perossidasi diluito 1:1000 in PBS-T/skim-milk allo 0.5%.
La rivelazione delle bande è stata effettuata con il kit Horseradish Peroxidase Conjugate Substrate Kit (Bio-Rad).
5.1.6 Saggio ELISA p25
Per la quantificazione della p25 è stato effettuato un saggio immunoenzimatico (ELISA) a sandwich.
L’anticorpo anti-p25 DF3 è stato incubato ON a TA in piastre Probind (Falcon, Italia), alla concentrazione di 0.25 µg/pozzetto in 100 μl di tampone sodio carbonato a pH 9.6 (1,59 g/l Na2CO3, 2,93 g/l NaHCO3,0,2 g/l NaN3). Il giorno successivo è stato effettuato il
post-coating per saturare la superficie del pozzetto aggiungendo 100 μl/pozzetto di skim milk al 1% in PBS ed incubando per 1 ora a TA.
Dopo l’incubazione, sono stati fatti 6 lavaggi in PBS e, ad ogni pozzetto, sono stati aggiunti 100 μl di campione e 10 μl di tampone di lisi (0,5% Tween 20, 5% Triton, PBS) e sono stati incubati 2 ore a TA. In seguito in ogni pozzetto sono stati aggiunti 100 μl di anticorpo DF10 biotinilato diluito 1:4000 in PBS-Tween con skim milk 1% e 0,5% di FCS inattivato. Dopo 1 ora di incubazione a TA sono stati aggiunti 100 μl di anticorpo
anti-biotina (Sigma Aldrich) coniugato con l’enzima perossidasi, diluito 1:1000 in PBS-Tween ed 1% di skim milk. Dopo un’ulteriore incubazione di 1 ora, per la rivelazione sono stati aggiunti 100 μl di substrato tetrametilbenzedina (TMB)-H2O2in rapporto 1:1. Dopo 7 minuti
la reazione è stata bloccata mediante aggiunta di H2SO41 N (50 μl/pozzetto) ed è stata
effettuata la lettura in un lettore ELISA (Dade Behring, Newark, Del.) a 450 nm.
5.1.7 Saggio ELISA RT
Un saggio ELISA a sandwich è stato utilizzato per quantificare l’attività dell’enzima RT sul surnatante della trasfezione, contenente le particelle virali.
Il giorno precedente all’effettuazione del test, i campioni, costituiti da 150 µl di surnatante di trasfezione, sono stati addizionati con 100 µl di 4 M NaCl/20% PEG, e sono stati conservati a 4°C ON, come controllo positivo sono stati utilizzati 150 µl di surnatante di cellule cronicamente infettate con FIV (FL-4). Allo stesso tempo, ciascun pozzetto di una piastra Probind è stato coattato con 100 µg di EDC (Thermo Scientific, IL, USA), 5 mM Sulfo-NHS (Thermo Scientific), 4 µg di Poly-A (Amersham Pharmacia Biotech) , in 100 µl di H2O. La
piastra è stata incubata ON a TA.
Il giorno seguente, i campioni sono stati pellettizzati per 20 minuti a 10000 rpm ed il pellet di ciascun campione è stato poi risospeso in 50 µl di lysis buffer (0.25% Triton X-100, 12 mM DTT, 50 mM Tris HCl pH 8).
La piastra è stata lavata 5 volte con washing buffer (1% Tris HCl pH 7.5, 3.75% NaCl 4 M, 0.1% EDTA 1 M, 0.01% Tween-20) utilizzando un lettore ELISA Behring ELISA processor II (BEPII, Dade-Behring).
In seguito, 12 µl di ciascun campione sono stati aliquotati in ogni pozzetto e a ciascuno sono stati aggiunti 50 µl di RT MIX (6.25% Tris HCl 1M pH 7.8, 0.62% MgCl2 1 M, 6.25% KCl 1
M, 7.5% DTT 0.2 M, 125 µg oligo dNTP, 0.2 µM dTTP, 1 mM dUTP biotinilato [Amersham Pharmacia Biotech]).
Dopo 2 ore di incubazione a 37°C sono stati effettuati 6 lavaggi e sono stati aggiunti in ogni pozzetto 100 µl di extravidina perossidata 1:5000 (Sigma-Aldrich), la piastra è stata quindi incubata per 8 minuti e poi lavata 6 volte.
La rivelazione è stata effettuata con il kit TMB substrate (Pierce, Thermo Scientific) e, dopo 6 minuti dall’inizio della reazione, questa è stata fermata con l’aggiunta di H2SO4 1N.
5.1.8 Quantificazione dell’RNA del vettore
Il titolo del vettore è stato determinato andando ad analizzare le copie di RNA nel surnatante delle cellule trasfettate mediante Real-Time PCR.
Brevemente, è stato estratto l’RNA presente in 140 μl di surnatante chiarificato mediante il kit di estrazione QIAamp Viral RNA Mini Kit (Qiagen gmbH, Hilden, Germania) e questo è stato trattato 30 minuti a 37°C con DNAsi RNAsi-free (Ambion, Foster City, USA) per rimuovere la possibile contaminazione da parte dei plasmidi utilizzati per la trasfezione; l’enzima è stato poi inattivato a 65°C per 30 minuti.
Il prodotto dell’estrazione è stato quindi retrotrascritto utilizzando l’enzima retrotrascrittasi (RT) del virus della mieloblastosi aviaria (AMV) (Finnzymes, Oy, Finlandia), il primer della reazione è stato disegnato nella regione WPRE (WPRE AS, Tabella 3) poichè, essendo questo un elemento eterologo, si è cercato di ridurre al minimo le possibilità di contaminazione. La reazione è stata effettuata a 42°C per 1 ora e l’enzima è stato poi inattivato a 95°C per 5 minuti.
Tabella 3 - Primer e sonda utilizzati per la quantificazione
Primer Sequenza 5’→3’
WPRE S gcttcccgtatggctttcatt
WPRE AS tgacaacgggccacaact
WPRE probe FAM-tctcctccttgtataaatcctggttgctgtctc-TAMRA
La Real-Time PCR è stata effettuata utilizzando sia il prodotto di retrotrascrizione, sia il materiale non retrotrascritto, ma trattato con DNAsi, come controllo, inoltre, come standard per la titolazione, è stato utilizzato un vettore contenente la regione WPRE a concentrazione nota, questo è stato diluito da 108 a 103. Per la reazione sono stati disegnati due primer ed una sonda sulla regione WPRE (Tabella 3). La miscela di reazione è stata effettuata utilizzando 2X TaqMan universal PCR Master Mix (Applied Biosystem, Roche, New Jersey, USA), primer senso alla concentrazione di 300 nM e primer antisenso alla concentrazione di 900 nM, sonda 0,1 µM ed aggiungendo 5 µl di campione, infine il volume è stato portato a 25 µl con H2O.
La reazione è stata effettuata nel ciclizzatore BioRad IQ5 (Bio-Rad Laboratories S.r.l., Milano, Italia), il ciclo di amplificazione prevede una prima fase di 2 minuti a 50°C per
l’attivazione dell’enzima uracil-N-glicosilasi (AmpErase UNG), necessario per distruzione di qualsiasi traccia di DNA contaminante, una seconda fase di 10 minuti a 95°C per denaturare l’UNG ed attivare la AmpliTaq Gold Polimerasi e poi una successione di 50 cicli, costituiti da 15 secondi di denaturazione a 95°C e da una fase di appaiamento ed estensione di 1 minuto a 60°C, nei quali contestualmente avviene anche la misurazione della fluorescenza emessa dalla sonda.
Il numero di copie di vettore sono state calcolate grazie alla comparazione del ciclo soglia ottenuto rispetto ai cicli soglia ottenuti dagli standard.
5.1.9 Produzione di HSV-1 ed HSV-2
Il virus utilizzato per la sfida degli animali è stato prodotto su cellule Mink Lung (ML, cellule epiteliali di visone). Queste sono state messe in coltura in fiasche da 175 cm2 e, al raggiungimento della confluenza, sono state mantenute per 2 ore in Minimum Essential Eagle’s Medium (MEM, Sigma Aldrich) completo con il 2% di FCS prima di essere infettate con una aliquota di HSV-1 (ceppo LV) o HSV-2 (ceppo G).
Una volta raggiunta la lisi cellulare, che si completa usualmente in 2-3 giorni, il surnatante è stato raccolto e chiarificato a 1800 rpm per 10 minuti.
Il pellet ottenuto è stato sottoposto a 3 cicli di congelamento in metanolo ghiacciato a -80°C e scongelamento a 37°C per recuperare il virus presente all’interno delle cellule non lisate, che è stato raccolto mediante chiarificazione ed aggiunto al surnatante ottenuto in precedenza.
Il tutto è stato quindi filtrato con filtri da 45 µm ed ultracentrifugato a 25000 rpm per 1 ora e mezza. Il pellet è stato risospeso in 1/100 del volume iniziale in soluzione fisiologica e conservato a -80°C fino all’utilizzo.
5.1.10 Titolazione in vitro del virus
Per la titolazione in vitro del virus sono state utilizzate multiwell da 48 pozzetti nelle quali sono state seminate 1.2x105 cellule ML per pozzetto. Il giorno seguente le cellule sono state infettate in triplicato con 200 µl di diluizioni seriali (da 10-3 a 10-10) dell’isolato virale di partenza. Dopo un’incubazione di 6 ore a 37°C, i pozzetti sono stati lavati con PBS e sono stati ricoperti con 200 µl di una soluzione di MEM con il 5% di FBS e 3% di
metilcellulosa (Sigma Aldrich). Le cellule sono state incubate per 48-72 ore, in seguito alle quali sono state fissate per 1 ora a TA con 1 ml di formalina al 10% che è stata poi rimossa.
La colorazione delle cellule è stata effettuata con 200 µl di blu di metilene 1:10 che dopo 5 minuti è stato rimosso per contare le placche al microscopio.
5.2 Esperimenti in vivo e saggi correlati
5.2.1 Protocollo vaccinale
Per l’esperimento di vaccinazione sono stati utilizzati topi C57BL/6 di 5 settimane mantenuti secondo un ciclo luce:buio di 12 ore in opportune condizioni di sterilità presso il nostro stabulario.
I topi sono stati divisi in due gruppi: i topi nel primo gruppo sono stati vaccinati con il vettore LAW-gB1 mentre quelli del secondo con il vettore LAW.
I topi di entrambi i gruppi sono stati vaccinati secondo la seguente schedula vaccinale: al giorno zero gli animali sono stati vaccinati nel cuscinetto plantare della zampa posteriore con 106 copie di vettore in un volume finale di 50 μl di soluzione fisiologica. Una settimana dopo gli animali sono stati vaccinati nello stesso cuscinetto plantare con 106 copie di vettore. A due settimane dal secondo inoculo, i topi sono stati inoculati per via intradermica alla base della coda con 106 copie di vettore in un volume finale di 100 μl.
Al giorno 7, 14 e 42, corrispondente a tre settimane dall’ultimo inoculo, almeno 3 topi per ciascun gruppo sono stati sacrificati ed è stato prelevato loro il sangue, la milza, il midollo osseo e i linfonodi inguinali per i successivi test immunologici.
Nel protocollo di vaccinazione che ha previsto anche l’utilizzo di un vettore ricombinante dal virus vaccinico modificato Ankara (MVA), invece del terzo inoculo per via intradermica con il vettore FIV è stato effettuato un inoculo intramuscolare con 2x107 copie del vettore MVA-gB1 o MVA nei topi di controllo.
5.2.2 Intracellular Staining (ICS)
I linfonodi inguinali e la milza di ciascun topo sono stati prelevati e lavati con soluzione fisiologica sterile, gli organi stati quindi incisi e le cellule sono state fatte uscire mediante l’ausilio di un bisturi. Le cellule sono state raccolte, centrifugate a 1800 rpm per otto minuti e, una volta risospese in 10 ml di terreno RPMI 1640 (Sigma Aldrich) addizionato con il 10%
di FCS (Gibco), 100 U/ml di pennicillina, 100 µg/ml di streptomicina ed L-glutammina 2 mM (Sigma Aldrich), sono state contate. Il midollo osseo è stato raccolto facendo fluire 1 ml di soluzione fisiologica attraverso i femori incisi degli animali. Una volta raccolte le cellule, queste sono state trattate come gli altri campioni.
Le cellule di ciascun campione sono state contate, portate alla concentrazione di 3x106/ml ed aliquotate in 4 tubini da FACS in un volume finale di 500 µl. Uno dei campioni non è stato trattato (NT), un altro è stato stimolato con la mix di PMA/Ionomicina (Sigma Aldrich) (10 ng PMA, 2 µg Ionomicina in 25 µl di RPMI completo) mentre gli altri due campioni sono stati trattati con un peptide immunodominante di gB (SSIEFARL) o con un corrispondente peptide scramble (ASFLRSEI) (Università di Firenze) questi sono stati aggiunti ai rispettivi tubini alla concentrazione di 1 µg/ml. I campioni sono stati incubati a 37°C per un’ora, trascorsa la quale in ciascuno sono stati aggiunti 5 µg/ml di Brefeldina A (Sigma Aldrich) e si è quindi proceduto ad ulteriori 5 ore di incubazione a 37°C.
I campioni sono stati quindi fissati per 1 ora in ghiaccio con 1 ml di FACS FIX (1 g formaldeide, 100 ml FACS buffer) e, dopo un lavaggio in FACS buffer, sono stati risospesi in 100 µl di FACS buffer e mantenuti a 4°C ON.
Il giorno seguente i campioni sono stati lavati con 1 ml di FACS buffer e sono stati risospesi in 100 µl di FACS buffer/0.1% saponina (Sigma Aldrich). Ogni campione è stato quindi marcato con 50 ng/µl di anticorpo anti-CD8a FITC e con 50 ng/µl anticorpo anti-IFNγ PE (eBioscience, San Diego, CA, USA) ed è stato mantenuto al buio per 1 ora a TA.
In seguito i campioni sono stati lavati con 1 ml di FACS buffer/0.1% saponina e risospesi in 300 µl di FACS buffer per la lettura.
5.2.3 IgG ELISA
In seguito al prelievo, il sangue di ciascun animale è stato collezionato in Multivette per siero con fondo in gel da 0.6 ml (Sarstedt, Nümbrecht, Germania), le provette sono state centrifugate a 8000 rpm per 8 minuti per permettere la separazione del siero e il tutto è stato conservato a -20°C fino al successivo utilizzo.
I campioni di siero sono stati diluiti 1:20 in tampone POD (Tris HCl 0.3 M pH 8.0, 0.1% Tween 20, 1% poligelina, 5% FBS) e 20 µl di ciascuna diluizione sono stati seminati in duplicato in pozzetti coattati con antigeni derivati da cellule renali di scimmia permanentemente infettate con HSV, o, come controllo, con antigeni derivati da cellule
non infette (Enzygnost Anti-HSV/IgG Test Plate, Dade Behring). I pozzetti erano stati precedentemente rigenerati con 200 µl di tampone POD.
La piastra è stata incubata a 37°C per 1 ora e si è quindi proceduto a 4 lavaggi con soluzione di lavaggio POD (PBS/0.05% Tween 20), si è quindi proceduto alla distribuzione dell’anticorpo secondario anti-mouse IgG biotinilato 1:1000 (eBioscience) in tampone POD che è stato incubato per 1 ora a 37°C.
In seguito a 4 lavaggi, in ciascun pozzetto è stata aliquotata extravidina perossidata 1:5000 (Sigma Aldrich) diluita in tampone POD , la piastra è stata quindi incubata per 30 minuti a 37°C.
Dopo 4 lavaggi la piastra è stata rivelata con il kit TMB substrate (Pierce, Thermo Scientific) e la reazione è stata fermata dopo 6 minuti con l’aggiunta di H2SO4 1N.
Si è proceduto quindi alla lettura a 450/650 nm utilizzando il lettore BEPII.
5.2.4 Saggio di neutralizzazione
I campioni di siero sono stati utilizzati per valutare la presenza di anticorpi neutralizzanti effettuando un saggio di neutralizzazione su cellule ML.
Ciascun siero, una volta scomplementato, è stato preassorbito per 1 ora su 105 cellule ML, seminate il giorno prima in una multiwell da 48 pozzetti.
Il test viene effettuato su cellule ML seminate in multiwell da 48 pozzetti, il giorno precedente all’esecuzione del test, in ciascun pozzetto vengono seminate 105 cellule in 100 µl di MEM con FBS al 10%. Per ciascun campione di siero sono stati preparati 3 pozzetti per effettuare il saggio in triplicato.
Il siero è stato quindi diluito in MEM con FBS al 10%, secondo diluizioni 1:10, 1:20 ed 1:40 e 20 µl di ciascuna diluizione sono stati incubati per 1 ora a 37°C in una provetta contenente 100 µl di una preparazione di HSV-1 o HSV-2 precedentemente titolato in vitro e diluito in modo tale da potere ottenere, nelle cellule di controllo senza siero, un numero sufficiente di placche.
In seguito, ciascun campione è stato aliquotato sulle cellule, precedentemente lavate con PBS e la piastra è stata quindi incubata per 6 ore, in seguito alle quali si è proceduto a ricoprire ciascun pozzetto con 200 µl di una soluzione di MEM con il 5% di FBS e 3% di metilcellulosa; la piastra è stata quindi incubata per 48-72 ore a 37°C.
Quando nelle cellule di controllo incubate con il solo virus, le placche sono diventate visibili, tutte le cellule della piastra sono state fissate per 1 ora a TA con 1 ml di formalina al 10% che è stata poi rimossa.
La colorazione delle cellule è stata effettuata con 200 µl di blu di metilene 1:10 che dopo 5 minuti è stato rimosso per contare le placche al microscopio.
La percentuale di neutralizzazione è stata calcolata rispetto alle cellule incubate con il solo virus.
5.2.5 Titolazione in vivo del virus
Il virus prodotto e titolato in vitro, è stato quindi titolato in vivo su topi femmina C57BL/6 di 11 settimane divisi in gruppi di almeno 5 animali per diluizione del virus. Cinque giorni prima dell’infezione a ciascun topo sono stati somministrati per via sottocutanea 2 mg di medrossiprogesterone acetato (depo-provera, Pfizer Italia, Latina, Italia). Al momento dell’infezione ciascun topo è stato trattato a livello vaginale con un tampone per creare una piccola zona di infiammazione, e, solo a questo punto, 10 µl di virus sono stati inoculati per via vaginale secondo diluizioni scalari.
I topi sono stati seguiti giornalmente e la comparsa e l’entità dei sintomi sono stati valutati secondo una scala di 5 punti: il valore 0 corrisponde all’animale sano, 1 rappresenta l’animale con lievi segni di infezione e arrossamento a livello locale, 2 indica la comparsa di lesioni e pustole mentre 3 rappresenta la fase più avanzata della malattia con ampie zone di infezione, fusione delle pustole e paralisi degli arti inferiori, infine 4 rappresenta la morte dell’animale. Come titolo virale da utilizzare per il challenge è stato scelto quello che ha causato una letalità del 50% (DL50).
5.2.6 Challenge
A 3 settimane dal terzo inoculo, i topi femmina sono stati trattati con 2 mg di depo-provera. Cinque giorni dopo ciascun topo è stato trattato a livello vaginale con un tampone ed è stato inoculato con una DL50 di HSV-1 o HSV-2.
Giornalmente i topi sono stati controllati e lo score delle lesioni è stato registrato secondo la scala di valori descritta al §5.2.4.
5.2.7 PCR su tampone vaginale
Due settimane dopo il challenge, a tutti i topi è stato effettuato un tampone vaginale. Una volta effettuato, questo è stato subito trattato con 600 µl di soluzione fisiologica e da una aliquota da 200 µl è stato estratto il DNA utilizzando il QIAamp DNA mini kit (Qiagen).
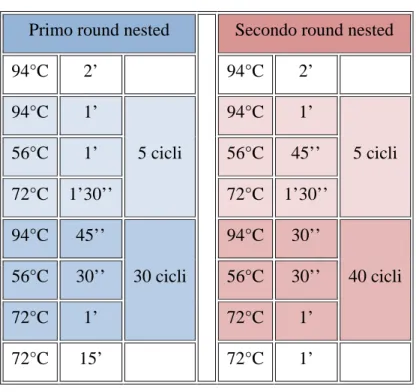
Il DNA estratto è stato amplificato mediante una nested PCR utilizzando primer e condizioni specifiche per HSV-2 (Coyle, Desai et al. 1999).
Nel primo round di PCR sono stati utilizzati i primer HSV-2 6AF ed HSV-2 6 BR, mentre nel secondo i primer HSV-2 6CF e HSV-2 6DR riportati in tabella 5 secondo i cicli riportati in tabella 4.
Gli amplificati di PCR sono stati poi separati e visualizzati su gel di agarosio all’1% ed è stata valutata la presenza di una banda di 100 bp.
Tabella 4 – Condizioni HSV-2 nested PCR
Primo round nested Secondo round nested
94°C 2’ 94°C 2’ 94°C 1’ 5 cicli 94°C 1’ 5 cicli 56°C 1’ 56°C 45’’ 72°C 1’30’’ 72°C 1’30’’ 94°C 45’’ 30 cicli 94°C 30’’ 40 cicli 56°C 30’’ 56°C 30’’ 72°C 1’ 72°C 1’ 72°C 15’ 72°C 1’
Tabella 5 –Primer utilizzati nella nested PCR
Primer Sequenza 5’→3’
HSV-2 6AF TCAGCCCATCCTCCTTCGGCAGTA
HSV-2 6BR GATCTGGTACTCGAATGTCTCCG
HSV-2 6CF AGACGTGCGGGTCGTACACG
5.2.8 Western Blot siero post-challenge
Per la preparazione delle cellule infettate con HSV, il lisato di ML è stato ottenuto seminando 5x107 cellule ML in una fiasca T175 ed infettandole con il virus, il giorno seguente le cellule sono state staccate e, in seguito a centrifugazione a 1200 rpm per 8 minuti, sono state risospese in 400 µl di buffer di lisi, incubate per 1 ora in ghiaccio e congelate a -80°C in aliquote da 20 µl ciascuna.
Il western blot è stato effettuato come descritto al §5.1.5 preparando un gel di poliacrilammide all’8% su cui sono stati fatti correre i campioni di cellule ML infettate preparati in precedenza, una volta effettuata la corsa ed il trasferimento su membrana, questa è stata tagliata in modo da ottenere singoli blot da trattare con sieri di topi diversi; il siero dei topi, prelevato a 26 giorni dal challenge, è stato utilizzato come anticorpo secondario ad una diluizione 1:100 in PBS-T/skim-milk all’1%, è stato poi utilizzato un anticorpo secondario anti-mouse perossidato diluito 1:1000 in PBS-T/skim-milk allo 0.5%. La rivelazione delle bande è stata effettuata con il kit Horseradish Peroxidase Conjugate Substrate Kit (Bio-Rad).
5.2.9 Immunosoppressione
L’esperimento di immunosoppressione dei topi ha richiesto una prova preliminare per determinare la dose più appropriata di ciclofosfamide (Endoxan Baxter, Baxter Oncology GmbH, Halle, Germania).
Due gruppi di topi sono stati trattati per via intraperitoneale con 400 mg/kg in una sola dose o con 200 mg/kg di farmaco somministrato in 2 dosi separate a distanza di 3 giorni l’una dall’altra. All’interno di ciascun gruppo erano presenti sia topi naïve che topi provenienti dagli esperimenti di titolazione del virus, ma privi di segni di infezione.
Il giorno successivo alla somministrazione del farmaco, per il secondo gruppo il giorno successivo alla seconda dose, ai topi trattati e a 4 topi non trattati è stato prelevato il sangue retro-orbitale ed è stata effettuata la conta delle cellule CD4+ e CD8+.
Brevemente 30 µl di sangue intero sono stati incubati per 30 minuti a 4°C con 50 ng/µl di anticorpo FITC anti-mouse CD4 o CD8 (eBioscience). Ai campioni sono stati quindi aggiunti 30 µl di OptiLyse B Lysing Solution (Beckman Coulter) e sono stati incubati per 10 minuti a TA. Trascorso questo tempo sono stati aggiunti 300 µl di acqua deionizzata e 30 µl
di biglie FLOW -COUNT Fluorospheres (Beckman Coulter). A questo punto i campioni sono stati letti al citofluorimetro ed è stata determinata la percentuale di cellule CD4+ e CD8+.
Una volta determinata la dose ideale, ai topi che hanno superato il challenge sono stati somministrati 400 mg/kg di ciclofosfamide in una singola dose.
Il giorno successivo è stata determinata la percentuale di cellule CD4+ e CD8+ per verificare l’efficacia del trattamento. La comparsa di lesioni è stata quindi controllata giornalmente e registrata secondo lo score descritto al §5.2.4.
Per l’esperimento di immunosoppressione effettuato sui topi sopravvissuti al challenge con HSV-2, i topi sono stati trattati con 400 mg/kg di ciclofosfamide per via intraperitoneale. Il giorno seguente, agli animali è stato prelevato il sangue ed è stata effettuata la conta delle cellule CD8+ per verificare l’efficacia del farmaco. Nei giorni successivi, i topi sono stati controllati giornalmente per valutare la comparsa di lesioni erpetiche in seguito ad immunosoppressione.