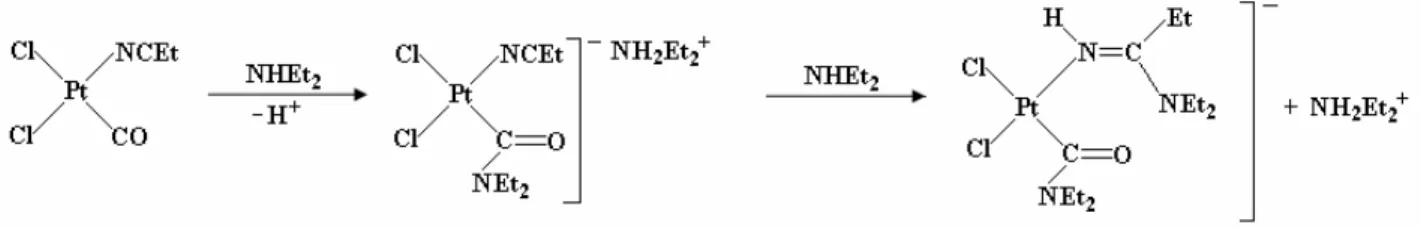Risultati e discussione
1. Parte prima: sintesi dei precursori
1.1 Sintesi di cis-[PtCl2(NCEt)(PPh3)] e cis-[PtCl2(NCMe)(PPh3)]
Per quanto concerne la preparazione dei precursori, il primo problema che è stato affrontato riguarda la sintesi di complessi di Pt(II) contenenti sia un legante ancillare al fosforo sia un legante nitrilico. Il legante contenente fosforo è stato individuato nella trifenilfosfina, che è una fosfina solida facilmente trattabile e purificabile; la scelta del legante nitrilico si è orientata verso l’acetonitrile ed il propionitrile.
In letteratura sono riportate due preparazioni di complessi di platino(II) contenenti un legante fosfinico ed uno nitrilico (figura 1).
Figura 1. Rappresentazione del complesso generico PtCl2(NCR’)(PR3).
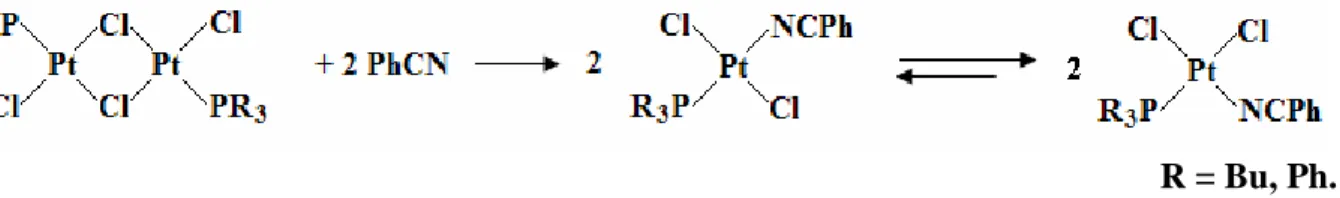
Un metodo di sintesi, descritto da Al-Najjar[1], realizza la preparazione del composto desiderato per reazione tra l’opportuno complesso fosfinico dinucleare a ponti di cloro e il benzonitrile (schema 1).
R = Bu, Ph.
Schema 1. Rappresentazione della reazione di apertura del dimero Pt2Cl4(PR3)2 ad opera di PhCN
e successiva isomerizzazione del prodotto cinetico trans-PtCl2(NCPh)(PR3) all’isomero cis-
PtCl2(NCPh)(PR3).
In questo caso, sebbene il prodotto cinetico atteso sia il complesso in configurazione trans-[2, 3], il prodotto isolato ha configurazione cis-, come indicato dall’analisi spettroscopica IR[1].
In un altro lavoro, invece, nel quale è descritta la struttura di cis-[PtCl2(NCMe)(PPh3)][4], gli
autori non riportano né un metodo generale di sintesi, né una caratterizzazione completa del prodotto, che si forma accidentalmente per sostituzione durante un tentativo di ricristallizzazione di cis-[PtCl2(C2H4)(PPh3)] in acetonitrile (schema 2).
Schema 2. Rappresentazione della reazione tra cis-PtCl2(C2H4)(PPh3) e un eccesso di MeCN.
Poiché la sintesi dei precursori necessari per le preparazioni delineate negli schemi 1 e 2 non è banale[4,5,6,7] e tenendo presente che complessi diclorobis-(alchilnitrilici) di Pt(II) sono facilmente accessibili, si è ritenuto interessante tentare una via sintetica che, a partire da questi ultimi complessi, prevedesse la sostituzione di un solo legante nitrilico da parte di una quantità strettamente stechiometrica di PPh3 (R1).
[PtCl2(NCR)2] + PPh3 [PtCl2(NCR)(PPh3)] + RCN (R1)
L’aggiunta di un equivalente di PPh3 (in soluzione diluita di diclorometano) ad una soluzione del
complesso PtCl2(NCEt)2 (in miscela dei due isomeri geometrici in rapporto molare cis-/trans-
circa 6) nello stesso solvente a temperatura ambiente ha condotto all’immediata formazione di un precipitato giallo pallido. Il solido, separato per filtrazione, mostrava un segnale 31P NMR a 21,1 ppm in CDCl3 (200 MHz,(nota 1) propionitrile, 1JP-Pt = 2615 Hz), mentre lo spettro 1H NMR in
CDCl3 mostrava solo i segnali dei nuclei di idrogeno della fosfina; nello spettro IR allo stato
solido (ATR) non erano presenti bande dovute alle vibrazioni del legame N
≡
C. Il confronto con i dati riportati in letteratura[8] ha permesso di identificare il solido formato con trans-PtCl2(PPh3)2. Il dato è stato confermato dalla presenza, nella fase liquida, di PtCl2(NCEt)2 nonreagito, identificato tramite la banda dovuta alla vibrazione del legame N
≡
C, a 2308 cm-1. Il risultato è stato confermato ripetendo la prova a 0 °C.Se invece la miscela viene riscaldata alla temperatura di riflusso del solvente (propionitrile, 97 °C), si ottiene una sospensione gialla, che accanto ad un segnale del fosforo attribuibile a cis-PtCl2(PPh3)2, mostra nello spettro 31P NMR (200 MHz) un segnale attribuibile alla specie
desiderata, PtCl2(NCEt)(PPh3) (isomero cis-, come vedremo in seguito), 6,0 ppm, 1JP-Pt = 3560
Hz, in propionitrile come solvente.
La velocità e l’avanzamento della reazione dipendono dalla temperatura del sistema: a riflusso del solvente (T = 97 °C) la reazione è lenta e non giunge a completezza in tempi ragionevoli (28 ore di riscaldamento complessivo); in tubo chiuso a 145 °C, invece, il sistema reagisce completamente in 12 ore, dando una soluzione gialla limpida da cui, a temperatura ambiente, precipita come solido giallo cristallino cis-PtCl2(NCEt)(PPh3). Il prodotto è stato caratterizzato
dallo spettro 31P NMR (200 MHz, CDCl3) da un segnale a 5,8 ppm (1JP-Pt = 3560 Hz) e dalla
presenza nello spettro 1H NMR dei segnali dovuti ai gruppi CH2 (2,14 ppm, q, 2JH-H = 7,5 Hz,
2H) e CH3 (0,87 ppm, t, 2JH-H = 7,5 Hz, 3H) del propionitrile coordinato. Da notare la presenza,
nello spettro 13C NMR, di un segnale a 118 ppm, dovuto al nucleo di carbonio del gruppo N
≡
C. Lo spettro 195Pt, infine, mostra un doppietto a -3595 ppm (1JPt-P = 3560 Hz). La natura delcomplesso cis-PtCl2(NCEt)(PPh3) è stata confermata anche dalla risoluzione della struttura
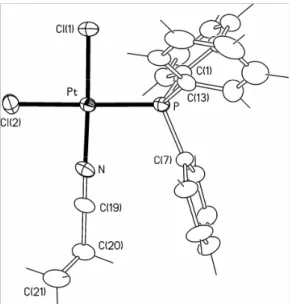
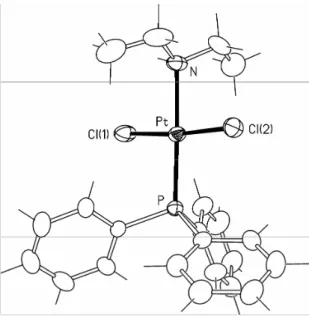
tramite diffrazione ai raggi X; la struttura molecolare del complesso è riportata in figura 2, mentre una selezione delle distanze e degli angoli di legame più significativi è riportata rispettivamente nelle tabelle 1 e 2.
Figura 2. Struttura molecolare di cis-PtCl2(NCEt)(PPh3) (planit).
Tabella 1. Distanze di legame [Å] in cis-PtCl2(NCEt)(PPh3).
Legame Distanza (Å) Legame Distanza (Å)
Pt – N 1,976(6) N – C(19) 1,120(10)
Pt – P 2,2355(19) C(19) – C(20) 1,464(11) Pt – Cl(1) 2,2832(19) C(20) – C(21) 1,451(13) Pt – Cl(2) 2,342(2)
Tabella 2. Angoli di legame in cis-PtCl2(NCEt)(PPh3). Angolo [°] Angolo [°] N-Pt-P 92,9(2) P-Pt-Cl(2) 178,70(8) N-Pt-Cl(1) 176,7(2) Cl(1)-Pt-Cl(2) 90,10(8) P-Pt-Cl(1) 89,24(7) C(19)-N-Pt 174,3(6) N-Pt-Cl(2) 87,8(2) N-C(19)-C(20) 177,6(9)
I valori cristallografici delle lunghezze di legame e degli angoli sono in buon accordo con quelli riportati per il complesso cis-PtCl2(NCMe)(PPh3)[4] e mostrano che il nitrile è coordinato in
maniera terminale, mantenendo una geometria lineare tra l’azoto coordinato, il carbonio nitrilico e il primo carbonio del gruppo etilico. Il legame Pt-Cl(2), in trans rispetto al legante fosfina, risulta significativamente più lungo di quello Pt-Cl(1), in trans rispetto al legante nitrilico.
Il filtrato della soluzione mostrava, analizzato tramite spettroscopia 31P NMR (200 MHz, propionitrile), la presenza del segnale a 6,0 ppm dovuto al complesso cis-PtCl2(NCEt)(PPh3) ed
un segnale a 3,4 ppm (1JP-Pt = 4100 Hz), che è stato attribuito al complesso
trans-PtCl2(NCEt)(PPh3) e di cui si discuterà più approfonditamente nel paragrafo 1.2.
Il complesso cis-PtCl2(NCEt)(PPh3) in fase solida risulta stabile per prolungato trattamento sotto
vuoto (10-3 Torr). Tuttavia, sue soluzioni in assenza di nitrile in eccesso, dopo circa 2 giorni a temperatura ambiente, separano un precipitato arancione, caratterizzato tramite spettroscopia 31P NMR da un segnale a 5,1 ppm (1JP-Pt = 4100 Hz, 400 MHz, CDCl3) che, in base ai dati presenti
in letteratura, lo identifica come il dimero trans-[Pt2Cl4(PPh3)2][4, 6].
Anche il complesso PtCl2(NCMe)2 ha mostrato comportamento analogo: per aggiunta di un
equivalente di fosfina in acetonitrile è stato possibile ottenere cis-[PtCl2(NCMe)(PPh3)]
riscaldando la miscela in tubo chiuso a T = 150 °C per 24 ore e poi lasciandola raffreddare fino a temperatura ambiente, ottenendo dei cristalli gialli.
In letteratura è riportata la caratterizzazione cristallografica di cis-PtCl2(NCMe)(PPh3)[4], ma non
la caratterizzazione spettroscopica NMR. D’altra parte, sono noti dati spettroscopici IR ed NMR di analoghi complessi cis-PtCl2(NCPh)(PR3)[1]. Riteniamo che l’isomero geometrico ottenuto
nella nostra prova sia il cis-, per analogia con i dati ottenuti con il derivato propionitrilico e con i dati di letteratura, che indicano una maggiore stabilità dell’isomero cis- rispetto al trans- in complessi analoghi.[2, 3]
Lo spettro 31P NMR (200 MHz, CDCl3) del nostro derivato mostra un segnale a 5,8 ppm, 1JP-Pt =
3580 Hz, mentre lo spettro 195Pt NMR (CDCl3) presenta un doppietto a -3606 ppm, 1JPt-P = 3580
cis-PtCl2(NCEt)(PPh3). La spettroscopia 1H NMR mostra un segnale per i nuclei di idrogeno del
metile nitrilico a 1,80 ppm, mentre il nucleo di carbonio del gruppo N
≡
C mostra nello spettro13
C NMR un segnale a 114,4 ppm. Lo spettro IR allo stato solido (ATR), infine, mostra una banda debole a 2327 cm-1, dovuta alla vibrazione di stiramento del legame N
≡
C.Il complesso cis-[PtCl2(NCMe)(PPh3)], pur essendo stabile in fase solida anche se sottoposto a
vuoto meccanico (10-3 Torr), sciolto in solventi clorurati, mostra lo stesso comportamento osservato per l’analogo complesso con propionitrile, dando, dopo alcuni giorni, un precipitato arancione, identificato tramite spettroscopia 31P NMR come trans-[Pt2Cl4(PPh3)2][4, 6].
Un controllo 31P NMR su di una soluzione del complesso cis-[PtCl2(NCMe)(PPh3)] in
acetonitrile ha mostrato, dopo due giorni a temperatura ambiente, la comparsa, insieme al segnale del complesso di partenza, a 6,4 ppm (1JP-Pt = 3580 Hz, 200 MHz, acetonitrile), di un
segnale a 3,2 ppm (1JP-Pt = 4100 Hz); quest’ultimo può essere ragionevolmente attribuito
all’isomero trans-[PtCl2(NCMe)(PPh3)], di cui si tratterà più approfonditamente nel paragrafo
1.2. Dopo sette giorni circa a temperatura ambiente si raggiunge l’equilibrio tra i due isomeri (88 % cis-, 12 % trans-, valutato tramite l’integrazione delle aree sottese ai segnali al 31P NMR).
1.2 Sintesi di trans-[Pt2Cl4(PPh3)2]
I complessi dinucleari a ponti di cloro sono particolarmente interessanti soprattutto per la loro capacità di reagire con vari leganti con rottura dei ponti di cloro, dando complessi del tipo PtCl2(PPh3)L. La sintesi di trans-[Pt2Cl4(PPh3)2] era stata realizzata in letteratura riscaldando
PtCl2 a riflusso in clorobenzene o p-clorotoluene con un equivalente di fosfina[5, 9, 10] oppure
riscaldando il complesso mononucleare PtCl2(PPh3)2 con PtCl2 in 1,1,2,2-tetracloroetano[4, 11].
La reazione spontanea di formazione del dimero a partire da cis-[PtCl2(NCR)(PPh3)] (R = Me,
Et) sciolto in assenza di nitrile è apparsa una buona via per la preparazione del dimero con alte rese ( > 80 %); le preparazioni riportate in letteratura, infatti, coinvolgono PtCl2, di non facile
preparazione[12]. Abbiamo osservato che, sciogliendo cis-[PtCl2(NCR)(PPh3)] in un solvente
sufficientemente altobollente (toluene) e riscaldando a temperatura di riflusso (T = 110 °C) si ottiene, nel giro di qualche ora, un precipitato arancione, corrispondente a quello isolato nelle prove precedentemente discusse.
Il dimero, sciolto in propionitrile, reagisce formando una soluzione gialla contenente trans-PtCl2(NCEt)(PPh3), come evidenziato da uno spettro 31P NMR, che mostra un segnale a 3,4 ppm
-3620 ppm (1JPt-P = 4100 Hz, 200 MHz, propionitrile). Dopo circa un’ora a temperatura ambiente
si è notata la comparsa di un segnale a 6,0 ppm (1JP-Pt = 3560 Hz), dovuto all’isomero cis-
PtCl2(NCEt)(PPh3). Il dimero quindi ha reagito con il propionitrile per dare inizialmente
l’isomero cinetico trans-[PtCl2(NCEt)(PPh3)], che a temperatura ambiente isomerizza
parzialmente a cis-, dando una miscela di equilibrio. Questo esperimento conferma quindi la presenza degli isomeri trans-PtCl2(NCR)(PPh3) (R = Me, Et) in soluzione in equilibrio con gli
isomeri cis-PtCl2(NCR)(PPh3). D’altra parte, gli isomeri cis-PtCl2(NCR)(PPh3), meno solubili
dei rispettivi isomeri trans-, possono essere facilmente isolati. La presenza dei due isomeri geometrici in equilibrio in soluzione ci fa ipotizzare che la formazione di Pt2Cl4(PPh3)2 a partire
da cis-PtCl2(NCR)(PPh3) proceda attraverso la formazione intermedia di
trans-PtCl2(NCR)(PPh3), dato che si presume che il legante nitrilico sia più labile in questo isomero,
come in effetti verificato in seguito (par. 3.2).
1.3 Sintesi di [PtCl2(CO)(NCEt)]
La procedura per la sintesi di [PtCl2(CO)(NCEt)], a partire da [PtCl2(NCEt)2] in atmosfera di
CO, era già stata propostain letteratura[13, 14]. La reazione del complesso bis-nitrilico con il CO coinvolge una prima sostituzione non reversibile di uno dei due nitrili coordinati (R2) ed una seconda reazione di equilibrio che riguarda la sostituzione del secondo nitrile (R3).
(cis-, trans-)PtCl2(NCEt)2 + CO → (cis-, trans-)PtCl2(CO)(NCEt) + NCEt (R2)
(cis-, trans-)PtCl2(CO)(NCEt) + CO cis-PtCl2(CO)2 + NCEt (R3)
La seconda reazione, a temperatura ambiente e pressione di CO di 1 atm, risulta spostata verso i prodotti (K = 48 ± 6 in CDCl3 a T = 23,4 °C)[14]. Per limitare la formazione di cis-PtCl2(CO)2 è
possibile utilizzare un eccesso di propionitrile, in modo da cercare di spostare l’equilibrio verso PtCl2(CO)(NCEt). Poiché le reazioni sono lente a temperatura ambiente, è conveniente operare
riscaldando la miscela di reazione. Al termine della conversione del precursore, l’eventuale cis-PtCl2(CO)2 formatosi può essere convertito in PtCl2(CO)(NCEt) per trattamento sotto vuoto della
soluzione in presenza di eccesso di nitrile, favorendo lo spostamento dell’equilibrio R3 verso sinistra.
La sintesi di PtCl2(CO)(NCEt) in questo lavoro di Tesi è stata quindi eseguita riscaldando a 65
°C una soluzione di PtCl2(NCEt)2 in 1,2-DCE con un eccesso di propionitrile (10 equivalenti) in
atmosfera di CO per 2 giorni, controllando tramite spettroscopia 195Pt NMR la scomparsa dei segnali del precursore presente in miscela cis- + trans- (-2253 ppm, isomero cis-; -2342 ppm, isomero trans-)[13, 14] e la comparsa dei segnali dei prodotti cis- e trans-PtCl2(CO)(NCEt)
(rispettivamente a -3280 ppm e -3430 ppm) e del cis-PtCl2(CO)2 (-3910 ppm) [13, 14].
La soluzione è stata quindi portata a secco, recuperando un solido arancione, che l’analisi spettroscopica IR allo stato solido (ATR) ha mostrato essere l’isomero cis- (vibrazione di stiramento del legame C
≡
O 2125 cm-1)[13, 14]. In soluzione di CDCl3 a temperatura ambiente ilcomplesso isomerizza a trans- completamente in 24 ore,[13, 14] come osservabile tramite spettroscopia 195Pt NMR (scomparsa del segnale a -3280 ppm, dovuto all’isomero cis-, e comparsa del segnale a -3430 ppm, dovuto all’isomero trans-).
I complessi cis-[PtCl2(CO)2] e (cis-, trans-)[PtCl2(CO)(NCEt)] sono altamente sensibili
all’umidità e possono reagire con l’acqua per dare miscele di riduzione del metallo a Pt(I) e Pt(0),[15, 16] come ad esempio mostrato nella reazione R4.
PtCl2(CO)2
→
O H
2
Pt0 + 2 HCl + CO2 + CO (R4)
Per questa ragione è necessario lavorare in atmosfera rigorosamente anidra e nel corso di questo lavoro si è operato sotto argon.
2. Parte seconda: reattività del complesso cis-[PtCl
2(NCEt)(PPh
3)] e del
dimero trans-[Pt
2Cl
4(PPh
3)
2]
Vista la tendenza dei complessi PtCl2(NCR)(PPh3) a rilasciare il nitrile per dare il dimero
Pt2Cl4(PPh3)2, si è ritenuto interessante controllare se essi potessero essere utilizzati come
equivalenti sintetici del dimero nella sintesi di derivati PtCl2(PPh3)L.
2.1 Reazione di cis-[PtCl2(NCEt)(PPh3)] con CO
La reazione del complesso con CO è veloce e procede fino a completezza anche in propionitrile come solvente. Lo spettro 31P NMR (200 MHz) effettuato sulla soluzione dopo 2 ore in
atmosfera di CO, ha mostrato la scomparsa del segnale del precursore (6,0 ppm, 1JP-Pt = 3560 Hz,
propionitrile) e la comparsa di un segnale a 10,9 ppm (1JP-Pt = 3044 Hz), attribuibile al
complesso cis-[PtCl2(CO)(PPh3)]. Il complesso solido, recuperato per evaporazione del solvente
a pressione ridotta, può essere identificato anche tramite spettroscopia IR allo stato solido, che mostra una banda intensa a 2103 cm-1 dovuta al carbonile coordinato, in accordo con i dati presenti in letteratura[17].
Il complesso cis-[PtCl2(CO)(PPh3)] è stato da noi preparato anche per altra via, in accordo con il
metodo riportato in letteratura[17], facendo reagire cis-PtCl2(PPh3)2 in CH2Cl2 come solvente,
sotto atmosfera di CO ed in presenza di SOCl2. Lo svolgimento della reazione è stato seguito
tramite spettroscopia 31P NMR, che ha mostrato dopo 5 ore di reazione la completa scomparsa del segnale del cis-PtCl2(PPh3)2 (16,9, 1JP-Pt = 3660 Hz, CH2Cl2) e la comparsa del segnale del
prodotto.
2.2 Reazione di cis-[PtCl2(NCEt)(PPh3)] con alcheni
La reazione del complesso cis-[PtCl2(NCEt)(PPh3)] con etilene procede con sostituzione del
legante nitrilico ad opera dell’olefina. La prova di reazione è stata condotta sciogliendo il precursore in 1,2-DCE e mantenendo la soluzione in agitazione a temperatura ambiente sotto etilene. Dopo 2 giorni l’analisi spettroscopica 31P NMR (200 MHz) di un campione di soluzione ha mostrato la comparsa di un nuovo segnale (13,6 ppm, 1JP-Pt = 3210 Hz), attribuibile al
composto desiderato. Tuttavia, in queste condizioni la reazione è risultata molto lenta (88 % di conversione dopo 15 giorni, valutata tramite l’integrazione delle aree sottese ai segnali principali nello spettro 31P NMR). La prova di reazione è stata ripetuta alla temperatura di 0 °C, per aumentare la solubilità dell’etilene gassoso nel mezzo di reazione, ma ha fornito gli stessi risultati.
Noi supponiamo che la sostituzione del legante nitrilico in cis-PtCl2(NCEt)(PPh3) da parte
dell’etilene proceda attraverso l’isomerizzazione da cis- a trans- del precursore, l’eventuale formazione del dimero Pt2Cl4(PPh3)2 ed infine la reazione con etilene, per dare
cis-PtCl2(C2H4)(PPh3).
Al fine di corroborare questa ipotesi, in un altro esperimento cis-PtCl2(NCEt)(PPh3) è stato
riscaldato in toluene alla temperatura di riflusso del solvente (110 °C) fino alla completa precipitazione del trans-Pt2Cl4(PPh3)2; il residuo solido è stato recuperato e quindi sospeso in
ottenuta una soluzione limpida incolore, contenente cis-PtCl2(C2H4)(PPh3) come unico prodotto,
che è stato recuperato con buona resa (49 % complessivo).
La reattività di cis-PtCl2(NCEt)(PPh3) è stata controllata anche nei confronti dell’1-ottene,
alchene liquido a temperatura ambiente (b.p. = 122 – 123 °C) e ben solubile nel mezzo di reazione (1,2-DCE). La reazione (rapporto molare 1-ottene/Pt = 5), condotta per 6 ore a temperatura ambiente, ha mostrato tramite l’analisi 31P NMR sulla soluzione una modesta conversione (7 % circa) del complesso di partenza in un prodotto caratterizzato da un segnale a 14,0 ppm (1JP-Pt = 3290 Hz, 1,2-DCE, 400 MHz), attribuito al complesso cis-PtCl2
(1-ottene)(PPh3). In analogia con la procedura precedentemente descritta nel caso dell’etilene, la
soluzione è stata scaldata a T = 80 °C ed il colore è passato da giallo chiaro ad arancione. Dopo circa 2 ore di riscaldamento l’analisi 31P NMR (400 MHz) sulla soluzione ha mostrato la presenza del segnale del prodotto (14,0 ppm, 80 %), insieme al segnale del precursore a 4,8 ppm (1JP-Pt = 3580 Hz, 1,2-DCE) e due segnali poco intensi a 5,0 ppm (trans-Pt2Cl4(PPh3)2) e 2,3 ppm
(quest’ultimo segnale ragionevolmente imputabile al trans-[PtCl2(NCEt)(PPh3)]). Dopo 5 ore
complessive di riscaldamento il rapporto prodotto/precursore ha raggiunto il valore 85:15. L’aggiunta di altri 5 equivalenti di 1-ottene a T ambiente non riesce a spostare l’equilibrio, probabilmente per ragioni cinetiche. Per aggiunta di eptano precipita un solido incolore, i cui dati spettroscopici 1H NMR e 31P NMR corrispondono con i valori riportati in letteratura[7] per il complesso cis-[PtCl2(1-ottene)(PPh3)].
I complessi cis-PtCl2(alchene)(PPh3) hanno mostrato, in assenza di un eccesso dell’olefina, la
tendenza a rilasciare l’alchene coordinato: in entrambi i casi, infatti, sono state preparate soluzioni in CDCl3 che, analizzate tramite 31P NMR, hanno dato origine in tempi relativamente
brevi (2-8 giorni) al segnale del composto dinucleare trans-Pt2Cl4(PPh3)2. Poiché questo
comportamento poteva essere imputato all’effetto dell’esposizione alla luce visibile[18], l’esperimento è stato anche ripetuto conservando le soluzioni al buio ed ha fornito gli stessi risultati.
3. Parte terza: reazioni con dietilammina
Come già discusso nell’introduzione, i complessi di Pt(II) contenenti leganti nitrilici e/o carbonilici coordinati possono reagire, nei confronti di opportuni nucleofili, secondo un cammino di reazione che evolve verso la sostituzione ovvero verso l’addizione. Per verificare la
possibilità di individuare dei percorsi di reazione chemioselettivi, in questo lavoro di Tesi è stata studiata la reattività verso la dietilammina dei complessi sintetizzati. Lo studio di reattività è stato condotto inizialmente sui complessi cis-PtCl2(NCR)(PPh3) e cis-PtCl2(CO)(PPh3); in
seguito sono state effettuate alcune prove preliminari di reattività sui complessi cis- e trans-PtCl2(CO)(NCEt), con l’obiettivo di controllare quale dei due leganti insaturi sia per primo
implicato nella reazione e quanto influisca sull’esito della reazione stessa la stereoisomeria del complesso di partenza. In questo capitolo verranno presentati e discussi i dati più significativi ottenuti nel corso di questa indagine.
3.1 Reazione di cis-PtCl2(NCMe)(PPh3) a bassa temperatura (-30 °C)
Come già anticipato nell’Introduzione, i complessi di Pt(II) contenenti alchilnitrili coordinati al metallo reagiscono in genere nei confronti delle ammine secondarie fornendo i prodotti ammidinici di addizione dell’ammina al gruppo nitrilico[19, 20]. I corrispondenti derivati ammidinici sono stati oggetto di numerosi studi ed in letteratura sono disponibili molti dati spettroscopici di confronto (cfr. Introduzione, pag. 12)[19].
Su questa base, è sembrato ragionevole iniziare lo studio di reattività oggetto di questo lavoro scegliendo come primo substrato cis-PtCl2(NCMe)(PPh3). Questo complesso, infatti, oltre ad
essere caratterizzato da un legante al fosforo, che avrebbe permesso di seguirne la trasformazioni tramite spettroscopia 31P NMR, presenta il vantaggio di essere caratterizzato da uno spettro 1H NMR più semplice rispetto all’analogo sistema contenente il propionitrile. In particolare, in un eventuale prodotto ammidinico derivante dall’addizione della dietilammina, i residui alchilici del nucleofilo sarebbero stati ben distinguibili da quello del nitrile coordinato.
In un primo esperimento, quindi, cis-PtCl2(NCMe)(PPh3) è stato disciolto in MeCN e trattato,
alla temperatura di -30 °C, con un leggero eccesso di dietilammina (rapporto molare NHEt2/Pt =
1,20). L’andamento della reazione è stato seguito tramite spettroscopia 31P NMR, effettuata su campioni prelevati dalla miscela di reazione. Nel giro di 24 ore l’analisi spettroscopica ha evidenziato la scomparsa del segnale del precursore e la comparsa di due nuovi segnali, uno a 6,7 ppm (1JP-Pt = 3950 Hz, 400 MHz, acetonitrile) e l’altro a 5,4 ppm (1JP-Pt = 3580 Hz, 400
MHz, acetonitrile), che verranno discussi di seguito (il rapporto tra i due segnali è stato valutato dall’integrazione delle aree sottese ai segnali principali al 31P). Poiché, in linea di principio, i due segnali potevano essere attribuiti ai prodotti di addizione e di sostituzione, la miscela di reazione, dopo essere stata riportata a temperatura ambiente, è stata concentrata fino a secchezza ed il residuo è stato sciolto in 1,2-DCE per ulteriori indagini spettroscopiche. E’ interessante notare
che, a questo punto, l’analisi 31P NMR mostrava un solo segnale a 7,0 ppm (1JP-Pt = 3950 Hz,
200 MHz, 1,2-DCE). Poiché sia la dietilammina, sia le ammidine formano legami forti nei confronti con Pt(II), questo comportamento ci indirizzava ad escludere la formazione contemporanea dei prodotti originatisi dai due diversi cammini di reazione. In seguito, le usuali operazioni di recupero effettuate sulla soluzione dicloroetanica hanno permesso di ottenere la precipitazione di un unico composto con buona resa (>70%), che è stato completamente caratterizzato (1H, 13C, 31P, 195Pt NMR, diffrattometria ai raggi X su cristallo singolo, spettroscopia IR allo stato solido) ed identificato con il derivato ammidinico cis-PtCl2
[(E-)HN=C(NEt2)Me](PPh3) (figura 3).
Figura 3. Rappresentazione del derivato ammidinico cis-PtCl2[(E-)HN=C(NEt2)Me](PPh3).
Inoltre, nelle acque madri della cristallizzazione di questo derivato non sono stati identificati complessi di natura diversa da quello schematizzato in figura 3, che quindi rappresenta, in queste condizioni, l’unico prodotto di un percorso completamente chemio- e stereoselettivo di addizione della dietilammina al nitrile coordinato. La formazione dell’ammidina è stata confermata tramite spettroscopia IR allo stato solido, che ha mostrato una banda intensa a 1592 cm-1, dovuta alla vibrazione di stiramento del legame C=N, e una banda di media intensità a 3298 cm-1, dovuta alla vibrazione di stiramento del legame N–H.
Lo spettro 1H NMR del derivato ammidinico isolato è stato registrato, oltre che a temperatura ambiente, anche alla temperatura di 50 °C, per verificare se vi fossero differenze nei segnali dovute alla presenza di eventuali isomeri rotazionali del complesso a temperatura ambiente ed eventualmente ridurre, a temperatura maggiore, i problemi di interpretazione dei segnali dovuti a questo effetto. Lo spettro a 50 °C ha mostrato una maggiore risoluzione del segnale a 2,88 ppm attribuibile ai protoni dei gruppi CH2 e di seguito si discuterà di quest’ultimo. Sono presenti
alcune caratteristiche tipiche dei derivati ammidinici: l’idrogeno ammidinico risuona a 4,36 ppm ed è caratterizzato da un segnale di singoletto largo, mentre i segnali dovuti ai nuclei di idrogeno
dei gruppi CH2 del residuo ammidinico NEt2 si mostrano come un segnale singolo slargato e
risuonano a 2,88 ppm; il segnale di singoletto attribuibile al gruppo metilico originariamente appartenente al nitrile coordinato è ben riconoscibile a 2,30 ppm, mentre i gruppi CH3 del
residuo NEt2 sono caratterizzati da un tripletto a 0,91 ppm (2JH-H = 7,2 Hz).
La caratterizzazione spettroscopica 13C NMR mostra il segnale dovuto al carbonio del gruppo N=C a 162,6 ppm, mentre i segnali dei nuclei di carbonio dei CH2 del residuo NEt2 risuonano a
43,7 ppm, il nucleo di carbonio del gruppo metilico originariamente appartenente al nitrile coordinato (più schermato) mostra un segnale a 22,6 ppm e invece quelli del carbonio dei gruppi metilici del residuo NEt2 risuonano a 13,0 ppm.
Lo spettro 195Pt NMR mostra un segnale di doppietto a -3421 ppm (1JP-Pt = 3950 Hz).
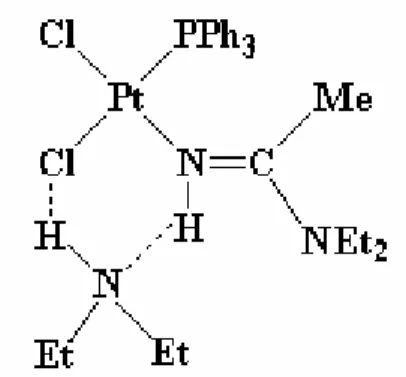
In accordo con quanto previsto dagli studi circa gli ammidino-complessi derivanti da ammine secondarie (cfr. Introduzione, pag. 19)[21, 22] e come confermato (vd. infra) dalla determinazione della struttura, il complesso mantiene la stessa isomeria geometrica del precursore (cis-) e la configurazione del legante ammidinico è E-. La struttura molecolare del complesso è riportata in figura 4. Una selezione delle distanze e degli angoli di legame più significativi è riportata rispettivamente nelle tabelle 3 e 4.
Figura 4. Struttura molecolare di cis-PtCl2[(E-)HN=C(NEt2)Me](PPh3) (PLAMMID2).
Tabella 3. Distanze di legame [Å] in cis-PtCl2[(E-)HN=C(NEt2)Me](PPh3).
Legame Å Legame Å
Pt-N(1) 2.016(6) Pt-Cl(2) 2.3540(18)
Pt-P 2.2069(17) N(1)-C(1) 1.316(9)
Tabella 4. Angoli di legame [°] in cis-PtCl2[(E-)HN=C(NEt2)Me](PPh3). Angolo [°] Angolo [°] N(1)-Pt-P 94.11(17) C(1)-N(1)-Pt 126.5(5) N(1)-Pt-Cl(1) 178.32(18) C(1)-N(1)-H(1) 116.7 P-Pt-Cl(1) 87.57(6) Pt-N(1)-H(1) 116.7 N(1)-Pt-Cl(2) 87.69(18) N(1)-C(1)-N(2) 122.4(7) P-Pt-Cl(2) 175.52(7) N(1)-C(1)-C(2) 118.5(6) Cl(1)-Pt-Cl(2) 90.64(7) N(2)-C(1)-C(2) 119.0(7)
Il complesso ha una geometria planare quadrata, come confermato dagli angoli dei leganti attorno al platino. La leggera distorsione che riduce leggermente gli angoli N(1)-Pt-Cl(2) e P-Pt-Cl(1) è probabilmente dovuta all’ingombro sterico del legante fosfinico e di quello ammidinico, in posizione relativa cis.
Gli atomi N(1), C(1), N(2) e il carbonio metilico C(2) giacciono tutti su uno stesso piano, come è lecito aspettarsi considerando il doppio legame tra N(1) e C(1). I valori ottenuti sono in accordo con quelli di analoghi complessi ammidinici, ad esempio cis-PtCl2[(E)-HN=C(NEt2)Me]2[20].
Il complesso solido è stato sciolto in CDCl3 e controllato nel tempo tramite spettroscopia 31P
NMR, per studiarne il comportamento in analogia con i complessi cis-PtCl2(NCR)(PPh3). Dopo
circa 7 giorni si è osservata la comparsa, oltre al segnale del prodotto (6,4 ppm, 1JP-Pt = 3950 Hz,
400 MHz), di un segnale a 3,5 ppm (1JP-Pt = 3550 Hz), ragionevolmente attribuibile all’isomero
trans-PtCl2[(E-)HN=C(NEt2)CH3](PPh3). Dopo 22 giorni è stato raggiunto un equilibrio tra le
due specie, in rapporto molare 60 % cis- e 40 % trans- (i rapporti sono valutati in base alle aree sottese ai picchi principali nello spettro 31P NMR).
Una volta stabilito che, nelle condizioni sperimentali descritte, la reazione tra cis-PtCl2(NCMe)(PPh3) e NHEt2 è completamente chemioselettiva (addizione), avviene con
ritenzione di configurazione ed è stereoselettiva (configurazione (E-) dell’ammidina coordinata), sono state effettuate alcune ulteriori indagini per cercare di attribuire completamente i segnali osservati tramite spettroscopia 31P NMR nel corso della reazione (cfr. pag. 44). Dei due segnali osservati in acetonitrile, quello a 6,7 ppm (400 MHz) è stato attribuito al prodotto isolato, mentre quello a 5,4 ppm poteva, in linea di principio, essere attribuito a:
a) l’isomero geometrico del prodotto;
b) un addotto formato dal prodotto di reazione con la dietilammina, usata in leggero eccesso.
L’ipotesi a) sembra poco probabile, considerando che l’equilibrio di isomerizzazione cui è soggetto il derivato ammidinico in soluzione è lento. Per controllare la validità della seconda ipotesi, un campione isolato di derivato ammidinico è stato trattato con un equivalente di NHEt2
in acetonitrile come solvente; questo ha causato la rapida e totale scomparsa del segnale a 6,7 ppm e la comparsa del segnale a 5,4 ppm. Questo esperimento ha quindi corroborato l’ipotesi b). Purtroppo ripetuti tentativi di cristallizzazione effettuati sulle soluzioni impiegate per le misure NMR non hanno mai permesso di isolare l’addotto, che risulta osservabile solo in soluzione, nelle condizioni sperimentali suddette. Se la soluzione, infatti, viene concentrata a secchezza, il residuo, riportato in soluzione, mostra nello spettro 31P NMR la presenza di un unico segnale a 6,4 ppm (400 MHz, CDCl3).
Un modello ragionevole di addotto tra l’ammina e l’ammidino-complesso potrebbe essere quello riportato in figura 5, nel quale le interazioni a idrogeno generano un anello a 6 termini.
Figura 5. Ipotesi di addotto tra l’ammina e il complesso ammidinico in soluzione.
Il complesso ammidinico risulta stabile per prolungato trattamento sotto vuoto. Per verificare se, in eccesso di ammina e in condizioni di riflusso del solvente, l’ammina sostituisca il legante ammidinico, è stata condotta una prova di reazione su una soluzione del complesso ammidinico in 1,2-DCE riscaldata a T = 83 °C per sei giorni in eccesso di ammina (rapporto molare NHEt2/Pt = 15). Lo spettro 31P NMR eseguito su una porzione di soluzione ha tuttavia mostrato
solamente il segnale attribuito all’addotto del complesso ammidinico con ammina, confermando quindi la stabilità del complesso ammidinico anche in queste condizioni.
3.2 Reazione del complesso cis-PtCl2(NCMe)(PPh3) ad alta temperatura (T = 82 °C) e a
temperatura ambiente
Per verificare la dipendenza della reattività di cis-PtCl2(NCMe)(PPh3) dalla temperatura, il
complesso, sciolto in acetonitrile, è stato trattato alla temperatura di riflusso del solvente (82 °C) con un lieve eccesso di dietilammina (rapporto molare NHEt2/Pt = 1,20). La reazione è stata
quindi seguita tramite spettroscopia 1H NMR su campioni di soluzione portati a secco e ridisciolti in CDCl3. Era stato osservato che in questo caso la spettroscopia 31P NMR non
permetteva di differenziare il precursore e il prodotto. Le analisi NMR spettroscopiche sul prodotto, precipitato per aggiunta di eptano, e l’analisi strutturale eseguita per diffrazione di raggi X su cristallo singolo hanno permesso di stabilire che si è avuta sostituzione del nitrile da parte dell’ammina. Lo spettro 1H NMR (400 MHz, CDCl3) mostra, oltre ai segnali fosfinici
(7,8-7,4 ppm), un segnale slargato a 3,63 ppm, attribuibile all’idrogeno legato all’azoto dell’ammina coordinata, due multipletti a 3,34 e 2,83 ppm, dovuti ai nuclei di idrogeno diasterotopici dei CH2
dell’ammina e un tripletto a 1,59 ppm, dovuto ai nuclei di idrogeno dei gruppi CH3.
L’integrazione delle aree sottese ai segnali citati è in accordo con il numero di atomi di idrogeno stimati per ciascuno di questi segnali. Anche lo spettro 13C NMR supporta questa ipotesi, mostrando segnali di singoletto a 47,4 (CH2), 43,5 (CH2) e 14,9 ppm (CH3). Il segnale 31P NMR
in solvente nitrilico risulta molto simile a quello del precursore cis-PtCl2(NCMe)(PPh3), sia nella
posizione (5,4 ppm, 400 MHz) che come costante di accoppiamento (1JP-Pt = 3560 Hz). In
soluzione di CDCl3 o di 1,2-DCE, tuttavia, i segnali relativi ai due complessi si differenziano e
risultano quindi più facilmente riconoscibili. Lo spettro IR in fase solida mostra una banda di media intensità a 3219 cm-1, attribuibile alla vibrazione di stiramento del legame N–H.
L’analisi cristallografica ai raggi X conferma la geometria trans- del complesso. In figura 6 è riportata la struttura molecolare del complesso, mentre una selezione delle distanze e degli angoli di legame più significativi è riportata rispettivamente nelle tabelle 5 e 6.
Infine, da una prova di reazione condotta a temperatura ambiente, è stata ottenuta una miscela circa 1:1 dei prodotti di sostituzione del nitrile da parte dell’ammina e di addizione dell’ammina al nitrile coordinato.
Figura 6. Struttura molecolare di trans-PtCl2(NHEt2)(PPh3) (PLAMFOS).
Tabella 5. Distanze di legame [Å] in trans-PtCl2(NHEt2)(PPh3).
Legame Distanza [Å]
Pt-N 2.133(9)
Pt-P 2.236(3)
Pt-Cl(2) 2.289(3) Pt-Cl(1) 2.304(4)
Tabella 6. Angoli di legame [°] in trans-PtCl2(NHEt2)(PPh3).
Angolo [°] N-Pt-P 177.1(3) N-Pt-Cl(2) 88.4(3) P-Pt-Cl(2) 94.41(12) N-Pt-Cl(1) 86.2(3) P-Pt-Cl(1) 90.93(12) Cl(2)-Pt-Cl(1) 174.64(13)
Il complesso ottenuto può essere confrontato con il trans-{PtCl2[NH2CH(CH3)2](PPh3)},
riportato in letteratura[23]. La geometria planare quadrata in entrambi i casi presenta delle distorsioni rispetto agli angoli ideali, forse per motivi di ingombro sterico. I valori delle distanze di legame sono in buon accordo tra loro.
Poiché era stato precedentemente verificato (cfr. par. 1.1) che, in soluzione di MeCN, il cis-PtCl2(NCMe)(PPh3) isomerizza parzialmente all’isomero trans- (88 % cis-, 12 % trans-), si è
anche voluto verificare se la chemioselettività del processo fosse legata alla stereochimica del precursore. Infatti, in linea di principio ed in accordo con quanto osservato per la reattività dei sistemi cis- e trans-PtCl2(NCMe)(C2H4) con la dietilammina[24], è possibile che l’isomero
cis-PtCl2(NCMe)(PPh3) in soluzione di acetonitrile isomerizzi all’isomero trans- con una velocità
dipendente dalla temperatura del sistema e che tale isomerizzazione possa risultare bloccata a bassa temperatura. La reazione dell’isomero cis- condurrebbe al prodotto di addizione, mentre quella del trans- a quello di sostituzione. Queste ipotesi sono state rafforzate da una prova di reattività tra il complesso trans-PtCl2(NCMe)(PPh3) e la dietilammina a -30 °C in acetonitrile. Il
complesso di partenza è stato preparato “in situ”, sciogliendo il dimero trans-Pt2Cl4(PPh3)2 in
acetonitrile.
Schema 3. Rappresentazione della reazione fra trans-Pt2Cl4(PPh3)2 ed acetonitrile.
Dopo una notte a temperatura ambiente, la miscela, inizialmente arancione e torbida, è apparsa gialla e limpida e i dati spettroscopici 31P NMR (200 MHz, acetonitrile) hanno mostrato la presenza in soluzione dell’isomero trans- (85 %) e dell’isomero cis- (15 %). La miscela è stata raffreddata a -30 °C ed è stato quindi aggiunto un leggero eccesso di dietilammina. La soluzione è stata fatta tornare lentamente a temperatura ambiente. I dati spettroscopici raccolti dopo che la soluzione è stata portata a secco e ripresa in CDCl3, hanno mostrato che la maggior parte del
prodotto ottenuto corrispondeva al trans-PtCl2(NHEt2)(PPh3) (85%), confermando quindi
l’ipotesi fatta.
3.3 Reazione di cis-PtCl2(NCEt)(PPh3) a temperatura ambiente e a bassa temperatura
(- 30 °C)
La reazione con dietilammina è stata effettuata anche su cis-PtCl2(NCEt)(PPh3), per verificare se
la natura del nitrile coordinato potesse influenzare l’andamento della trasformazione.
La reazione effettuata a temperatura ambiente in propionitrile o in 1,2-DCE ha condotto alla formazione in poche ore del prodotto di sostituzione trans-PtCl2(NHEt2)(PPh3), come
confermato dall’analisi dei dati spettroscopici NMR e dal confronto con un campione del complesso trans-PtCl2(NHEt2)(PPh3), precedentemente discusso (cfr. par. 3.2).
D’altra parte, la reazione di cis-PtCl2(NCEt)(PPh3) a bassa temperatura (-30 °C) in propionitrile
come solvente ha portato ad una miscela di due prodotti, di cui uno è quello di sostituzione del legante nitrilico e l’altro quello di addizione dell’ammina al nitrile coordinato, con formazione di ammidina. Il complesso cis-PtCl2[HN=C(NEt2)Et](PPh3) non è stato isolato, ma è possibile
assegnare i segnali 1H e 31P NMR dagli spettri eseguiti, dato che sono noti i segnali del prodotto di sostituzione trans-PtCl2(NHEt2)(PPh3) presente in miscela. Si osservano: un segnale di
singoletto a 3,62 ppm, attribuibile all’idrogeno legato all’azoto ammidinico; due quartetti, a 2,92 (2JH-H = 7,2 Hz) e 2,37 ppm (2JH-H = 7,6 Hz), imputabili ai nuclei di idrogeno del CH2
rispettivamente dell’ex- gruppo propionitrilico e del residuo amminico legato al carbonio ammidinico; 2 tripletti, a 1,35 ppm (2JH-H = 7,1 Hz) e 1,32 ppm (2JH-H = 7,7 Hz) attribuibili ai
nuclei di idrogeno dei gruppi metilici dovuti rispettivamente all’ex-gruppo nitrilico e al residuo dell’ammina.
Lo spettro 31P NMR (200 MHz, propionitrile) mostra il segnale del complesso ammidinico (67%) e quello del prodotto di sostituzione (33 %).
L’ipotesi fatta per la reattività degli isomeri cis- e trans-PtCl2(NCMe)(PPh3) con dietilammina
(cfr. pag. 16) può essere estesa anche agli analoghi cis- e trans-PtCl2(NCEt)(PPh3): è ragionevole
supporre che cis-PtCl2(NCEt)(PPh3), a temperatura ambiente, isomerizzi all’isomero trans- e che
sia quest’ultimo a dare la reazione di sostituzione. Il fatto che, a temperatura ambiente, per PtCl2(NCEt)(PPh3) si ottenga interamente prodotto di sostituzione, mentre per l’analogo
complesso con acetonitrile sia necessario operare a temperatura più alta per ottenere lo stesso risultato può essere spiegato da una maggiore velocità di isomerizzazione del complesso propionitrilico rispetto a quella dell’analogo complesso con acetonitrile. La reattività del cis-PtCl2(NCEt)(PPh3) con dietilammina è stata studiata sia in propionitrile che in 1,2-DCE come
solventi ed è ragionevole ipotizzare che il cammino di reazione, in quest’ultimo caso, possa coinvolgere anche la formazione del dimero trans-Pt2Cl4(PPh3)2, che reagisce con le ammine per
dare complessi trans- del tipo PtCl2(ammina)(PPh3)[25].
3.4 Reazione di cis-PtCl2(CO)(PPh3)
La reazione tra il complesso metallico e la dietilammina è stata condotta in toluene a temperatura ambiente e con un rapporto NHEt2/Pt = 4. Ci si attende che l’ammina si addizioni al carbonile,
dando il complesso carbamoilico anionico cis-[PtCl2{C(O)NEt2}(PPh3)]– dopo aver ceduto uno
ione H+ ad un secondo equivalente di ammina presente in soluzione, con formazione dello ione ammonio NH2Et2+. Un terzo equivalente di ammina potrebbe sostituire uno ione cloruro, con
conseguente precipitazione del sale NH2Et2Cl, insolubile in toluene. In effetti, è stato ottenuto
come prodotto PtCl{C(O)NEt2}(NHEt2)(PPh3) e la reazione è riassunta nello schema 4.
Schema 4. Rappresentazione dei processi coinvolti nella reazione tra cis-PtCl2(CO)(PPh3) ed ammina in
eccesso.
La stechiometria della reazione prevede quindi l’impiego di 3 equivalenti di dietilammina per giungere al prodotto finale, per cui si è deciso di utilizzarne un leggero eccesso (4 equivalenti). Poco dopo l’aggiunta dell’ammina si è notata la formazione di un precipitato incolore, che è stato filtrato ed identificato tramite spettroscopia IR allo stato solido (ATR) come NH2Et2Cl. Il
completo svolgimento della reazione è stato invece verificato tramite spettroscopia 31P NMR, che ha mostrato la scomparsa del segnale del precursore (200 MHz, toluene, 10,9 ppm, 1JP-Pt =
3044 Hz) e la comparsa di un segnale a 10,5 ppm (1JP-Pt = 4310 Hz). La reazione è stata seguita
anche tramite spettroscopia IR sulla soluzione, che ha mostrato la scomparsa del segnale dovuto alla vibrazione di stiramento del legame C
≡
O carbonilico (2103 cm-1) e la comparsa di un segnale a 1556 cm-1, dovuto alla vibrazione di stiramento del legame C=O carbamoilico. Il completo svolgimento della reazione è stato accertato dopo due ore dall’aggiunta dell’ammina, quindi il prodotto solido è stato recuperato.Lo spettro 1H NMR del derivato carbamoilico isolato registrato a temperatura ambiente si mostrava molto complicato, probabilmente a causa dell’ingombro sterico della trifenilfosfina e della rigidità del legante carbamoilico, come verrà discusso in seguito. E’ stato allora eseguito uno spettro 1H NMR alla temperatura di 50 °C, per semplificare i segnali dovuti alla presenza di isomeri rotazionali del complesso; di seguito si discuterà quindi di quest’ultimo. Oltre ai segnali dovuti ai protoni aromatici (7,80-7,20 ppm, 15H), è presente un segnale slargato centrato a 3,78 ppm (1H), attribuibile all’idrogeno legato all’azoto dell’ammina coordinata; sono presenti anche
3 multipletti, centrati a 4,30 ppm (1H), 3,11 ppm (6H) e 2,41 ppm (1H), che possono essere attribuiti ai nuclei di idrogeno dei gruppi CH2 del carbamoile e dell’ammina coordinata; a 1,64 e
1,52 ppm si osservano invece due tripletti (6H) che possono essere attribuiti ai nuclei di idrogeno dei metili del carbamoile (più schermati), mentre i due tripletti a 0,82 e 0,78 ppm (t, 2JH-H = 7,3
Hz, 6H) sono attribuibili ai nuclei di idrogeno dei metili dell’ammina. Lo spettro 13C NMR mostra, oltre ai segnali dei nuclei di carbonio degli anelli benzenici, un segnale a 167,7 ppm, dovuto al carbonio del CO carbamoilico; due segnali a 48,5 e 47,7 ppm, attribuibili ai nuclei di carbonio dei CH2 del raggruppamento carbamoilico (più schermati); due segnali a 43,5 e 38,7,
dovuti ai CH2 dell’ammina coordinata al platino; due segnali a 15,0 e 14,0 ppm, dovuti ai nuclei
di carbonio dei metili del gruppo carbamoilico ed un segnale a 13,8 ppm, assegnabile ai nuclei di carbonio dei metili amminici.
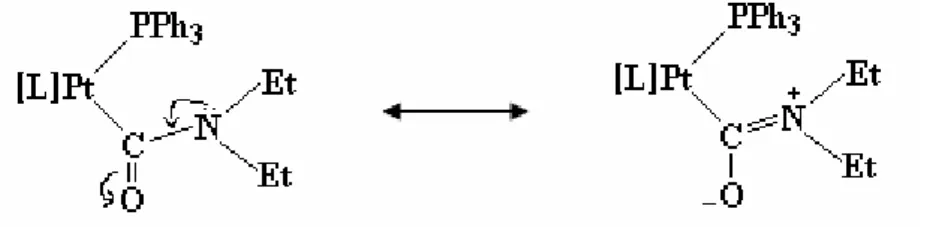
La complessità degli spettri 1H e 13C NMR può essere dovuta alla rigidità del legante carbamoilico, a causa della delocalizzazione del legame π nel raggruppamento O-C-N (figura 7) e all’ingombro sterico dovuto alla vicinanza del legante carbamoilico con la fosfina.
Figura 7. Strutture di risonanza per il legante carbamoilico coordinato.
Lo spettro IR in fase solida (ATR) è caratterizzato da una banda intensa a 1556 cm-1, dovuta alla vibrazione di stiramento del legame C=O, e da una banda debole a 3211 cm-1, dovuta alla vibrazione di stiramento del legame N-H dell’ammina coordinata.
Il complesso è stato caratterizzato anche tramite risoluzione della struttura con metodi diffrattometrici ai raggi X. In figura 8 è riportata la struttura molecolare del complesso, mentre una selezione delle distanze e degli angoli di legame più significativi è riportata rispettivamente nelle tabelle 7 e 8.
Figura 8. Struttura molecolare di PtCl[C(O)NEt2](NHEt2)(PPh3) (PLACAR).
Tabella 7. Distanze di legame [Å] in PtCl[C(O)NEt2](NHEt2)(PPh3).
Legame Å Legame Å Pt(1)-C(19) 1.999(4) N(2)-C(19) 1.377(5) Pt(1)-N(1) 2.120(3) N(2)-C(20) 1.453(7) Pt(1)-P(1) 2.2301(9) N(2)-C(22) 1.466(6) Pt(1)-Cl(1) 2.4188(10) N(1)-C(26) 1.473(5) O(1)-C(19) 1.234(5) N(1)-C(24) 1.498(5)
Tabella 8. Angoli di legame [°] in PtCl[C(O)NEt2](NHEt2)(PPh3).
Angolo [°] Angolo [°] C(19)-Pt(1)-N(1) 90,97(14) P(1)-Pt(1)-Cl(1) 92,98(4) C(19)-Pt(1)-P(1) 92,72(10) O(1)-C(19)-N(2) 119,1(4) N(1)-Pt(1)-P(1) 175,38(10) O(1)-C(19)-Pt(1) 119,1(3) C(19)-Pt(1)-Cl(1) 172,69(12) N(2)-C(19)-Pt(1) 121,7(3) N(1)-Pt(1)-Cl(1) 83,13(10)
La struttura cristallina risolta per il complesso PtCl(CONEt2)(NHEt2)(PPh3) può essere
confrontata con quella del complesso trans-PtCl[C(O)NEt2](PPh3)2, ottenuto per reazione di CO
ed NHEt2 con cis-PtCl2(PPh3)2[26]. Le due strutture, per quanto riguarda la lunghezza dei legami
è simile a quella osservata nel complesso trans-PtCl2(NHEt2)(PPh3), precedentemente riportata.
Le distanze di legame tra l’azoto e gli atomi di carbonio del residuo NR2 carbamoilico
(N(2)-C(20) e N(2)-C(22)) sono leggermente minori delle analoghe distanze N-C dell’ammina coordinata (N(1)-C(26) e N(1)-C(24)). Gli angoli di legame attorno al carbonio carbamoilico (C(19)) sono in accordo con un carbonio ibridizzato sp2, con un doppio legame C=O. La distanza di legame Pt-Cl è più lunga di quanto non si misuri normalmente (2,419 Ǻ contro, ad esempio, 2,30 Ǻ come media del legame Pt-Cl nel complesso trans-PtCl2(NHEt2)(PPh3)), mentre è simile
a quella del legame Pt-Cl in trans- al gruppo carbamoilico nel complesso anionico cis-[PtCl2{C(O)NiPr2}(CO)]– [27] e nel complesso neutro trans-PtCl[C(O)NEt2](PPh3)2 sopra
citato[26].
3.5 Reazione di trans- e cis-PtCl2(CO)(NCEt)
La reazione dei complessi trans- e cis-PtCl2(CO)(NCEt) con dietilammina è stata studiata con
l’intento di osservare quale dei due leganti insaturi reagisse per primo, se la reazione fosse di addizione al legante insaturo o di sostituzione da parte dell’ammina e se la stereochimica del precursore potesse influenzare la reattività, come già visto nel caso dei complessi cis- e trans-PtCl2(NCMe)(C2H4)[24]. Le reazioni sono state quindi condotte inizialmente con un equivalente
di dietilammina, aggiungendone poi progressivamente altri per vedere le successive variazioni sul complesso ottenuto.
Il complesso cis-PtCl2(CO)(NCEt), in soluzione di 1,2-DCE, isomerizza completamente a trans-
in 24 ore[13, 14] a temperatura ambiente; la completa isomerizzazione è stata verificata tramite spettroscopia 195Pt (scomparsa del segnale a -3280 ppm, dovuto all’isomero cis-, e comparsa del segnale a -3430 ppm, dovuto all’isomero trans-). La reazione con un equivalente di dietilammina ha portato ad un prodotto che è stato identificato, tramite spettroscopia 1H NMR con il trans-PtCl2(CO)(NHEt2), per confronto con i dati presenti in letteratura[24]. Lo spettro mostra: un
segnale slargato centrato a 3,65 ppm, attribuibile all’idrogeno legato all’azoto dell’ammina coordinata; due multipletti a 3,16 e 2,80 ppm, dovuti ai nuclei di idrogeno diasterotopici dei CH2
dell’ammina coordinata; un tripletto a 1,46 ppm (2JH-H = 7,3 Hz), dovuto ai nuclei di idrogeno
dei metili dell’ammina. Lo spettro 195Pt mostra un segnale a -3421 ppm, in accordo con quanto riportato in letteratura[24]. Lo spettro IR allo stato solido (ATR) mostra una banda intensa a 2128 cm-1, dovuta alla vibrazione di stiramento del legame CO ed una banda debole a 3226 cm-1, dovuta alla vibrazione di stiramento del legame N-H dell’ammina coordinata.
Si può concludere quindi che la reazione dell’isomero trans- con un equivalente di ammina conduce alla sostituzione del nitrile coordinato.
La reazione dell’isomero cis- conduce invece a prodotti di riduzione del platino non identificati, anche operando in tubo chiuso alla fiamma, per minimizzare l’ingresso fortuito di umidità nell’ambiente di reazione. I dati preliminari raccolti indicano che il sistema di reazione è piuttosto complicato e non si offrono le basi per presentare ipotesi solide.
Da notare che la reazione è stata condotta con un rapporto molare ammina/Pt uguale a 3, supponendo che il sistema potesse evolvere con un attacco iniziale dell’ammina al legante carbonilico, seguito da trasferimento del protone ad un secondo equivalente di ammina e successivo attacco di un terzo equivalente di ammina al legante nitrilico (figura 9).
Figura 9. Ipotetica evoluzione della reazione tra cis-PtCl2(CO)(NCEt) e 3 equivalenti di dietilammina.
4. Parte quarta: conclusioni
Nel corso del presente lavoro di Tesi è stato messo a punto un metodo di sintesi per complessi
cis-PtCl2(NCR)(PPh3) (R = Me, Et), che sono stati caratterizzati interamente. Queste specie
hanno mostrato in soluzione un equilibrio di isomerizzazione cis-/trans-; la specie trans-, in cui si suppone che il nitrile sia più labile, in assenza di eccesso di nitrile, conduce al dimero a ponti di cloro trans-Pt2Cl4(PPh3)2[4, 5, 9, 10, 11], che rappresenta un interessante precursore nella sintesi di
complessi mononucleari fosfinici [PtCl2(PPh3)L][28, 29, 30]. La sintesi del dimero è stata quindi
ottimizzata attraverso un nuovo percorso ad alte rese e a partire da precursori facilmente accessibili e trattabili.
Lo studio della reattività del complesso cis-PtCl2(NCEt)(PPh3) con leganti come CO e alcheni ha
mostrato che la reazione avviene con sostituzione del legante nitrilico, ottenendo i complessi cis-PtCl2(CO)(PPh3), cis-PtCl2(C2H4)(PPh3) e cis-PtCl2(1-ottene)(PPh3) con una via sintetica
attraverso l’isomerizzazione del complesso a trans- e la successiva formazione del dimero. Infatti, accelerando la conversione del precursore a Pt2Cl4(PPh3)2 per riscaldamento in solvente
non nitrilico e poi utilizzando la specie dinucleare come reagente diretto con le olefine utilizzate, è stato possibile ottenere i prodotti più rapidamente.
La reazione dei complessi cis-PtCl2(NCMe)(PPh3) con dietilammina in solvente nitrilico ha
mostrato prodotti diversi a seconda della temperatura a cui è stata condotta: addizione al nitrile da parte dell’ammina a bassa temperatura, sostituzione ad alta temperatura. La reazione con l’ammina a bassa temperatura è stata condotta anche sul complesso trans-PtCl2(NCMe)(PPh3),
ottenendo il prodotto di sostituzione. Questo effetto è stato attribuito alla differente reattività degli isomeri cis- e trans-, in cui quest’ultimo, più labile, conduce alla sostituzione, mentre il cis- all’addizione. La temperatura a cui viene condotta la reazione influenza la velocità della reazione di isomerizzazione cis/trans, che risulta bloccata a bassa temperatura, mentre procede rapidamente per riscaldamento della miscela di reazione. E’ stato possibile ottenere quindi l’ammidino-complesso cis-PtCl2[(E-)HN=C(NEt2)Me](PPh3) e il prodotto di sostituzione
trans-PtCl2(NHEt2)(PPh3); entrambe le specie sono state isolate e caratterizzate.
Queste prove sono state condotte anche sul complesso cis-PtCl2(NCEt)(PPh3), da cui non è stato
possibile isolare il complesso ammidinico, che è stato ottenuto in miscela con il prodotto di sostituzione anche lavorando a bassa temperatura. La reazione a temperatura ambiente ha dato invece come unico prodotto il complesso di sostituzione trans-PtCl2(NHEt2)(PPh3).
Dai dati raccolti e dal comportamento fin qui descritto, è possibile ipotizzare che l’isomerizzazione cis → trans del complesso propionitrilico sia più rapida rispetto a quella dell’analogo complesso con l’acetonitrile. La differente reattività degli isomeri cis- e trans-PtCl2(NCR)(PPh3) rispecchia la maggiore labilità del legante nitrilico in trans- ad un legante con
un forte effetto trans come la trifenilfosfina[31].
La reattività con dietilammina è stata studiata anche nei confronti della specie cis-PtCl2(CO)(PPh3), che ha dato come prodotto la specie carbamoilica
PtCl[C(O)NEt2](NHEt2)(PPh3), che è stata caratterizzata spettroscopicamente e
cristallograficamente. La reazione in questo caso prevede l’impiego di tre equivalenti di ammina: il primo attacca il carbonile coordinato, cedendo un protone ad un secondo equivalente di ammina, che forma il catione NH2Et2+; un terzo equivalente di ammina sostituisce quindi uno
ione cloruro in modo completamente stereoselettivo, dando come unico prodotto PtCl[C(O)NEt2](NHEt2)(PPh3), con formazione del sale NH2Et2Cl. In questo caso viene
Infine, è stata messa a punto una sintesi con alte rese del complesso PtCl2(CO)(NCEt) e sono
state condotte reazioni preliminari con la dietilammina. La reazione dell’isomero trans- ha permesso di ottenere selettivamente la sostituzione del legante nitrilico, ottenendo il complesso
trans-PtCl2(CO)(NHEt2) e confermando la labilità del legante nitrilico in posizione trans ad un
legante con un forte effetto trans.
Bibliografia Risultati e discussione
[1] I. M. Al-Najjar, Inorg. Chim. Acta (1987) 134, 1.
[2] G. K. Anderson, R. J. Cross, Inorg. Chim. Acta (1980) 44, L21.
[3] D. Belli Dell'Amico, F. Calderazzo, C. A. Veracini, N. Zandonà, Inorg. Chem. (1984) 23, 3031. [4] R. S. Pryadun, O. O. Gerlits, J. D. Atwood, J. Coord. Chem. (2006) 59, 85.
[5] F. R. Hartley, G. W. Searle, Inorg. Chem. (1973) 12, 1949 & notes. [6] N. M. Boag, M. S. Ravetz, J. Chem. Soc. Dalton Trans. (1995) 3473.
[7] R. Pryadun, D. Sukumaran, R. Bogadi, J. D. Atwood, J. Am. Chem. Soc. (2004) 126, 12414 e supplementary information.
[8] L. Rigamonti, C. Manassero, M. Rusconi, M. Manassero, A. Pasini, Dalton Trans. (2009) 1206. [9] W. Baratta, P. S. Pregosin, Inorg. Chim. Acta (1993) 209, 85 e rif.
[10] V. K. Jain, L. Jain, Coord. Chem. Rev. (2005) 249, 3075. [11] K. A. Jensen, Z. Anorg. Allgem. Chem. (1936) 229, 225.
[12] D. Belli Dell’Amico, F. Calderazzo, F. Marchetti, S. Ramello, S. Samaritani, Inorg. Chem. (2008) 47, 1237.
[13] S. Libri, Tesi di Laurea in Chimica, Università di Pisa, A.A. 2003/2004.
[14] D. Belli Dell’Amico, F. Calderazzo, L. Carbonaro, L. Labella, S. Libri, F. Marchetti, Inorg.Chim.
Acta (2007) 360, 3765.
[15] T. Theophanides, P. C. Kong, Inorg. Chim. Acta (1971) 5, 485.
[16] L. Armelao, D. Belli Dell’amico, R. Braglia, F. Calderazzo, F. Garbassi, G. Marra, A. Merigo, Dalton Trans. (2009) 5559.
[17] D. Belli Dell’Amico, F. Calderazzo, G. Dell’Amico, Gazzetta Chimica Italiana (1977) 107. [18] P. Courtot, R. Rumin, A. Peron, J. Organom. Chem. (1978) 144, 357.
[19] U. Belluco, F. Benetollo, R. Bertani, G. Bombieri, R. A. Michelin a, M. Mozzon, A. J. L. Pombeiro,
F. Costa Guedes da Silva, Inorg. Chim. Acta (2002) 330, 229.
[20] A. Bacchi, D. Belli Dell’Amico, F. Calderazzo, L. Labella, G. Pelizzi, F. Marchetti, S. Samaritani, Inorg. Chim. Acta, (2010) 363, 2467.
[21] P. Uguagliati, U. Belluco, R. A. Michelin, P. Guerriero, Inorg. Chim. Acta (1984) 81, 61.
[22] V. Y. Kukushkin, A. J. L Pombeiro, Chem. Rev. (2002) 102, 1771.
[23] F. J. Ramos-Lima, A. G. Quiroga, B. Garcìa-Serrelde, F. Blanco, A. Carnero,C. Navarro-Ranninger, J. Med. Chem. (2007), 50, 2194.
[24] C. Broglia, “Tesi di Laurea in Chimica”, A. A. 2009/2010, Università di Pisa. [25] J. R. Briggs, C. Crocker, B. L. Shaw, Inorg. Chim. Acta (1980) 40, 245.
[26] U. Abram, D. Belli Dell’Amico, F. Calderazzo, L. Marchetti, J. Strähle, J. Chem. Soc., Dalton
Trans. (1999) 4093.
[27] D. Belli Dell'Amico, F. Calderazzo, G. Pelizzi, Inorg. Chem (1979) 18, 1165. [28] A. C. Smithies, M. Rycheck, M. Orchin, J. Organomet. Chem. (1968) 12, 199.
[29] J. Chatt, N. P. Johnson, B. L. Shaw, J. Chem. Soc. (1964) 1662.
[30] G. K. Anderson, H. C. Clark, J. A. Davies, Inorg. Chem. (1983) 22, 434.
[31] J. L. Huheey, E. A. Keiter, R. L. Keiter, “Inorganic Chemistry”, Cap. 13, 4th Ed. (1993) Harper Collins College Publishers.
![Tabella 2. Angoli di legame in cis-PtCl 2 (NCEt)(PPh 3 ). Angolo [°] Angolo [°] N-Pt-P 92,9(2) P-Pt-Cl(2) 178,70(8) N-Pt-Cl(1) 176,7(2) Cl(1)-Pt-Cl(2) 90,10(8) P-Pt-Cl(1) 89,24(7) C(19)-N-Pt 174,3(6) N-Pt-Cl(2) 87,8(2) N-C(19)-C(20) 1](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373311.95697/4.892.182.737.118.249/tabella-angoli-legame-ptcl-ncet-pph-angolo-angolo.webp)
](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373311.95697/11.892.339.571.447.600/figura-rappresentazione-derivato-ammidinico-cis-ptcl-net-pph.webp)
 (PLAMMID2).](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373311.95697/12.892.253.662.637.900/figura-struttura-molecolare-cis-ptcl-net-pph-plammid.webp)
(PPh 3 ) (PLACAR).](https://thumb-eu.123doks.com/thumbv2/123dokorg/7373311.95697/21.892.276.641.105.423/figura-struttura-molecolare-ptcl-net-nhet-pph-placar.webp)