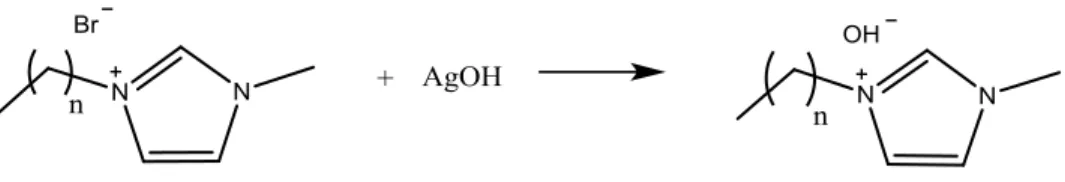Capitolo due
Questa tesi, che rientra nell’ambito di un Progetto di Ricerca Europeo, SWAN-iCare, che mira a sviluppare un sistema integrato di nanosensori per il monitoraggio e la gestione delle ferite cutanee croniche, aveva lo scopo di valutare la possibilità di ”sfruttare” alcune proprietà peculiari dei liquidi ionici per sviluppare nuovi sensori di pH in cui il liquido ionico poteva funzionare da semplice additivo, in grado di implementare le proprietà del sistema di rivelazione, e/o, poteva essere esso stesso parte integrante del sistema di rivelazione, contenendo una o più funzioni sensibili ad eventuali variazioni di pH.
2.1 Selezione dei liquidi ionici
L’elevata modulabilità strutturale dei liquidi ionici ed alcune loro proprietà peculiari ci offrivano a nostro avviso, almeno in linea di principio, la possibilità di progettare e sintetizzare composti salini multifunzionali in grado di fungere sia da sonde idrogenioniche che da additivi per implementare i sistemi di rivelazione. I liquidi ionici presentano infatti alcune proprietà che possono risultare utili per la progettazione e realizzazione di un buon sensore di pH :
Ogni liquido ionico può essere modificato in modo tale da divenire un potenziale monomero per la produzione di membrane sensibili al pH e di polimeri aventi buone capacita conduttive.
É possibile introdurre sulla porzione cationica e/o anionica gruppi funzionali sensibili alle variazioni di pH.
Sulla base delle conoscenze della chimica dei liquidi ionici, sviluppate negli ultimi anni nell’ambito del gruppo di ricerca in cui è stata condotta questa tesi di laurea, sono state selezionate tre classi di composti ionici con potenziali proprietà da sfruttare nell’ambito dei sensori di pH:
Liquidi ionici con anioni benzenpolicarbossilati
Liquidi ionici portanti un gruppo N-ossido protonato o meno (zwitter ione).
Liquidi ionici aventi sulla pozione cationica un azoto amminico protonabile.
2.2 Liquidi ionici con anioni benzenpolicarbossilati
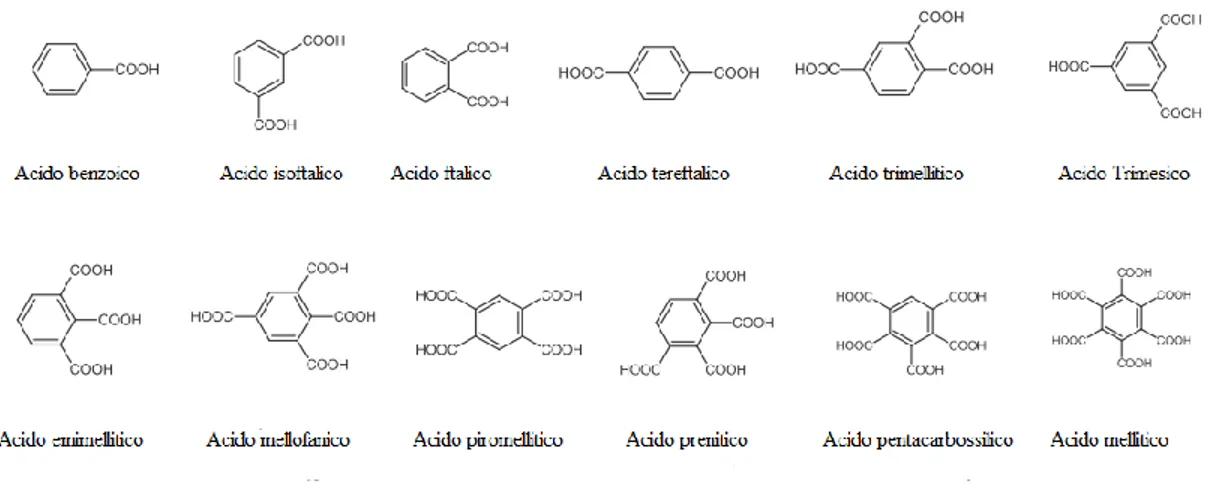
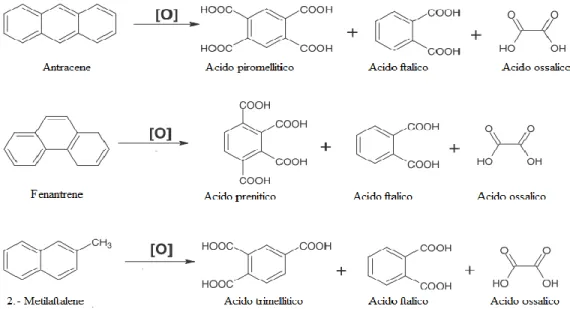
Dagli acidi benzenpolicarbossilici, sotto riportati, è possibile ottenere un’ampia gamma di anioni poliprotici: Tre anioni derivanti dalla deprotonazione di acidi dicarbossilici (acido ftalico, isoftalico e tereftalico)
Due anioni derivanti dalla deprotonazione di acidi tricarbossilici (acido trimellitico e trimesico)
Quattro anioni derivanti dalla deprotonazione di acidi tetracarbossilici (acido emimellitico, mellofanico, piromellitico e prenitico)
L’anione derivante dalla deprotonazione dell’acido ipentacarbossilbenzene (acido 1,2,3,4,5 benzenpentacarbossilico)
L’anione derivante dalla deprotonazione dell’acido esacarbossilbenzene, noto come acido mellitico.
Figura 1. Policarbossilbenzeni e relativa nomenclatura
Tra gli acidi sopra descritti, quelli più utilizzati sono l’acido trimesico, l’acido piromelitico e l’acido mellitico, probabilmente a causa del loro basso costo e della geometria. L’acido trimesico è infatti impiegato nella sintesi industriale di polimeri, come agente indurente per collanti di natura epossidica, nei materiali adesivi e di
Le motivazioni che ci hanno indotti verso questa classe di composti sono principalmente tre:
di natura chimica. Gli anioni benezenpolicarbossilici hanno valori di pKa
compresi in un intervallo ampio. Ad esempio, l’acido mellico ha sei centri ionizzabili e valori di pKa compresi tra 1.40 e 6.96.
di natura economica. I liquidi ionici, essendo dei solventi, devono avere dei costi contenuti e il moderato costo di questi anioni non incide negativamente sul costo totale del prodotto.
di natura ambientale. Gli acidi benzenpolicarbossilici si possono ottenere dalle biomasse.
Per quanto concerne le loro proprietà chimico-fisiche è interessante notare come la geometria del sistema influenza i valori di pKa: prendendo in esame i più semplici acidi dicarbossilici, si può notare che le pKa dell’acido ftalico (2.98 e 5.98) sono significativamente differenti da quelle dell’ acido isoftalico (3.46 e 4.46) e tereftalico (3.51 e 4.82), che invece hanno pKa molto più simili tra loro.
Questo particolare comportamento viene spiegato sulla base dell’ingombro sterico dovuto alla presenza di due gruppi carbossilici in orto tra di loro.
Tabella 1. Le pKa dei carbossilbenzeni
pKI pKII pKIII pKIV pKV pKVI
Benzoico 4.17 Ftalico 2.98 5.28 Isoftalico 3.46 4.46 Tereftalico 3.51 4.82 Emimellitico 2.80 4.20 5.87 Trimellitico 2.52 3.84 5.20 Trimesico 3.12 3.89 4.70 Mellofanico 2.06 3.25 4.73 6.21 Prenitico 2.38 3.51 4.44 5.81 Piromellitico 1.92 2.87 4.49 5.63 Benzenepentacarbossilico 1.80 2.73 3.97 5.25 6.46 Mellitico 1.40 2.19 3.31 4.78 5.89 6.96
Ma è anche interessante notare come i valori di pK1 e pK2 variano al variare del numero di gruppi carbossilici presenti sull’anello benzenico.
Calcoli teorici ab initio23, effettuati sugli acidi sotto riportati, dimostrano gli unici composti totalmente planari, e quindi con i gruppi carbossilici coniugati con l’anello aromatico, sono l’acido benzoico, l’acido isoftalico, l’acido tereftalico e l’acido trimesico, che non hanno gruppi carbossilici su carboni adiacenti.
Figura 2. Rappresentazione dei rotameri dei tricarbossilbenzeni
Mentre gli isomeri degli acidi tetracarbossilici, pentacarbossilici, e dell’acido esabenzencarbossilico sono non planari, a causa dell’ingombro dato dai gruppi in orto.
La mancata coplanarità tra anello benzenico e i gruppi carbossilici, negli isomeri aventi due o più gruppi COOH in posizioni adiacenti, determina un aumento nell’acidità di questi composti che si evidenzia facilmente confrontando la prima costante di dissociazione.
Sulla base dei valori delle costanti di dissociazione sopra riportate, tenendo conto del range di pH che intendevamo monitorare, abbiamo scelto, come composti da utilizzare quali anioni di potenziali liquidi ionici, l’acido trimesico e l’acido piromellitico, che hanno rispettivamente 3 pKa (3.12, 3.89 e 4.70) e da 4 pKa (1.92, 2.87, 4.49 e 5.63) e possono coprire un range abbastanza ampio di valori di pH.
Per quanto riguarda l’ecosostenibilità di questi prodotti, è stata recentemente dimostrata24 la possibilità di ottenere acidi benzenpolicarbossilici a partire da composti naturali e, più in particolare, da materiali di scarto quali la lignina. La lignina è un polimero organico complesso ad elevato peso molecolare, costituito principalmente da composti fenolici, che si trova principalmente nella parete cellulare di alcune cellule vegetali.
Figura 3. Lignina naturale
Sebbene i primi lavori di ossidazione della lignina avessero portato a rese relativamente basse in acidi benzenpolicarbossilici, a causa del basso contenuto di anelli aromatici nelle sue strutture utilizzate, più recentemente dell’intera classe di acidi benzencarbossilici è stata ottenuta a partire da lignine selezionate, Xiaolongtan lignite (XLT), Huolinhe lignite (HLH) and Shengli lignite (SL), utilizzando ossidanti eco-compatibili, come l’O2 atmosferico, in presenza di un catalizzatore basico. In
della lignina e della variabilità della struttura, la via sintetica è stata ipotizzata utilizzando alcuni scaffold generici come possibili molecole di partenza:
Figura 4. Possibili scaffold generici adatti alla sintesi dei policarbossilbenzeni
2.3 Progettazione e sintesi di potenziali liquidi ionici
con anioni benzenpolicarbossilati
Poiché in letteratura non era riportato alcun dato circa la sintesi di liquidi ionici con anioni benzenpolicarbossilati, era necessario mettere a punto un’adeguata
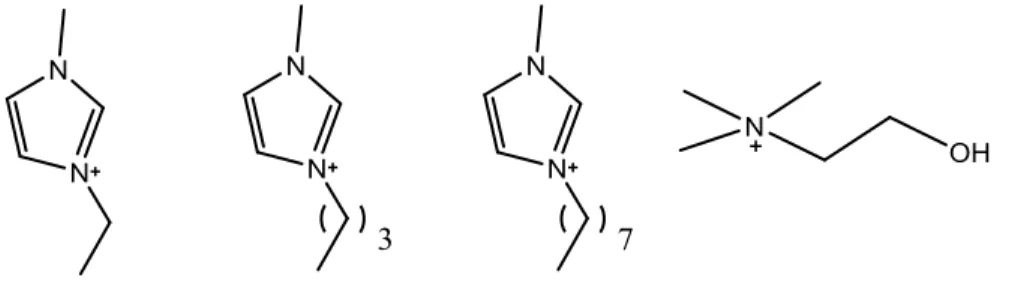
Per ampliare quanto più possibile il range di investigazione strutturale, abbiamo deciso di associare a questo tipo di anioni alcuni cationi organici, normalmente utilizzati per preparare liquidi ionici, quali l’1,3 dialchilimidazolio e la colina, ed alcuni derivanti dalla semplice protonazione di basi forti come la DBU e la tetrametilguanidina.
In particolare, come dialchilimidazolio abbiamo utilizzato l’1-etil-3-metilimidazolio, 1-butil-3-metilimidazolio e l’1-ottil-3-metilimidazolio.
Figura 5. Tipi di mono-cationi utilizzati
Abbiamo inoltre sintetizzato alcuni sistemi dicationici, costituiti da due teste cationiche eterocicliche, 1-metilimidazolio e N-metilpirrolio legate tra di loro da una catena alchilica a 3 o a 6 atomi di carbonio.
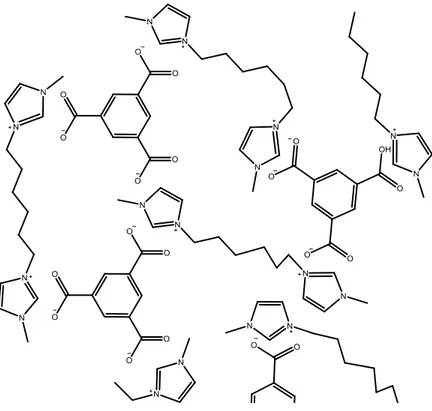
L’associazione di un sistema dicationico ad un polianione aveva il fine di cercare di ottenere un network sovramolecolare cross-linked tenuto insieme da interazioni elettrostatiche.
Figura 8. Possibile reticolazione
Per quanto concerne la sintesi, i liquidi con catione protonato sono stati ottenuti mediante una semplice reazione acido-base, aggiungendo una quantità
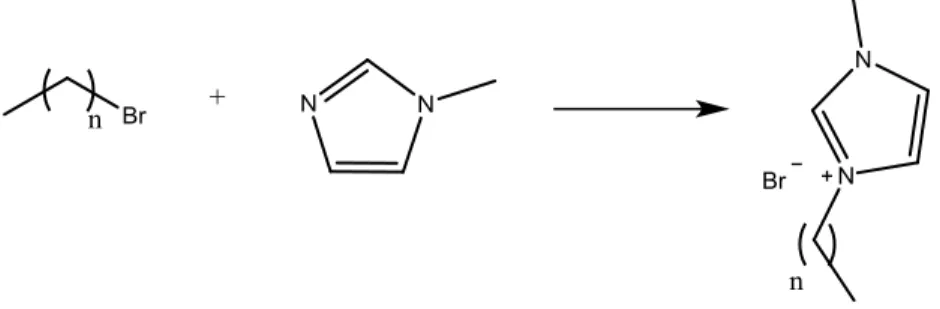
Per quanto concerne gli altri liquidi ionici, portanti come catione un sale di -onio quaternario, questi sono generalmente sintetizzati attraverso una strategia di sintesi a due stadi. Inizialmente si effettua la quaternarizzazione dell’ammina (1-metilimidazolo o N-metilpirrolidina) con l’opportuno alogenuro alchilico (generalmente un bromuro) mediante una semplice reazione di sostituzione nucleofila, e il sale di imidazolio o pirrolidinio ottenuto, viene sottoposto ad una reazione di scambio anionico.
Figura 9. Classica sintesi di liquidi ionici a con nucleo imidazolico
I tentativi di applicare questa strategia a partire dagli opportuni sali bromuro alla sintesi dei composti di nostro interesse hanno dato tuttavia risultati deludenti, non è stato infatti possibile ottenere una buona separazione del bromuro inorganico.
Abbiamo quindi deciso di seguire una strada più lunga che passa attraverso l’iniziale trasformazione del liquido ionico con anione bromuro nel corrispondente idrossido, per reazione con una quantità stechiometrica di Ag(OH). I liquidi ionici con anione idrossido non sono stati isolati, a causa dell’instabilità, in particolare dei sali di imidazolio, che in condizioni fortemente basiche vanno incontro a deprotonazione al carbonio in posizione 2, con formazione della corrispondente specie carbenica.
Figura 11. Sintesi dell'idrossido del liquido ionico attraverso l'uso del AgOH
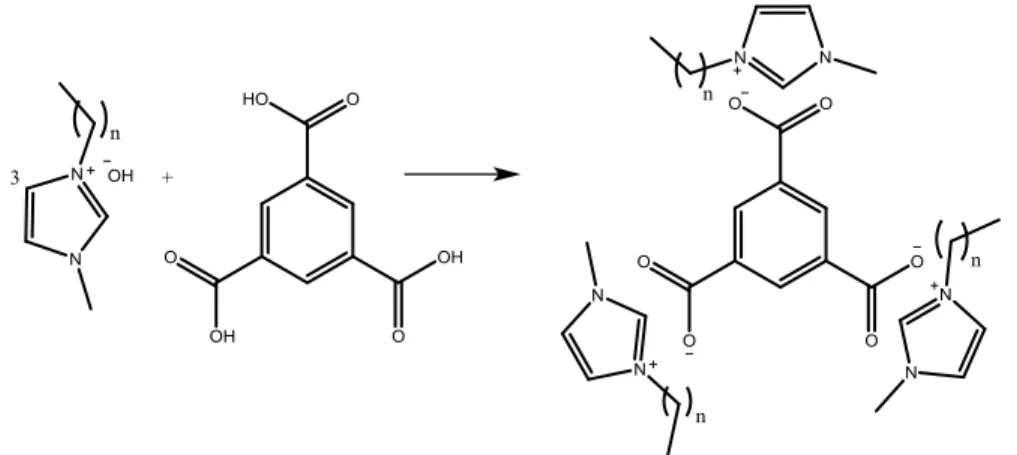
Alla miscela di reazione, dopo allontanamento del formatosi alogenuro di argento (AgBr) per filtrazione è stata quindi aggiunta l’opportuna quantità di acido benzepolicarbossilico. Nel caso dell’acido trimesico, la scarsa solubilità di questo composto in acqua ha reso necessario l’utilizzo di una miscela metanolo/acqua 1:1 p/p. In tutti i casi, le reazioni acido-base sono state effettuate utilizzando diversi rapporti molari dei due componenti in maniera tale da deprotonare una o più funzioni carbossiliche.
Figura 12. Reazione tra l'idrossido del liquido ionico e del policarbossilbenzene
Come prevedibile, considerando le molteplici interazioni che si possono avere all’interno di questi sistemi, interazioni elettrostatiche che nel caso dei composti dianionici e dicationici portano a veri e propri cross-linking, e π-π , tutti i composti sintetizzati erano dei solidi cristallini, a temperatura ambiente, con punti di fusione compresi tra 112 e 247.
2.4 Progettazione e sintesi di potenziali liquidi ionici
basati su N-ossidi
Tra i possibili liquidi ionici sensibili alle variazioni di pH abbiamo preso in considerazione anche una classe di composti molto differente dalla precedente, sia per quanto concerne le proprietà chimico-fisiche che la strategia di sintesi, ovvero gli
sali interni, zwitterioni, generalmente utilizzati come reagenti in reazioni classiche della chimica organica quali la reazione di Cope, per la sintesi di alcheni. La basicità di questi composti dipende dalla struttura dell’ammina, aromatica o alifatica, aciclica o ciclica, più o meno tensionata. Generalmente, tuttavia, gli ossidi di ammine sono basi deboli, con un pKa di circa 4,5.
Recentemente, è stata riportata la sintesi di alcuni N-ossidi26,27 derivanti da ammine alifatiche ed aromatiche e la loro applicazione come tensioattivi sensibili al pH26, variando il pH del mezzo da neutro ad acido si osservava infatti una variazione significativa della concentrazione micellare critica. É infine da sottolineare che questi composti sono praticamente non-tossiciti e biodegradabili, sia in ambiente aerobico o anaerobico. 28
Figura 13. N-ossidi sintetizzati
In entrambi i casi sono state scelte delle catene alchiliche sufficientemente lunghe, così da ridurre la capacità di impacchettamento in un reticolo cristallino, ma non troppo per evitare la formazione di un composto troppo idrofobico. Nel caso dell’eptilesametilenammina mancando l’atomo di ossigeno sul sistema ciclico, abbiamo ridotto la lunghezza della catena alchilica per garantire una sufficiente idrofilicità.
Le reazioni di alchilazione delle opportune ammine (morfolina e eptilesametilenammina) sono state effettuate in acetonitrile per trattamento dell’ammina con l’opportuno bromuro alchilico. In particolare, mentre per la sintesi dell’N-decilmorfolina è stato scelta una procedure one-pot, aggiungendo alla soluzione acquosa di reazione una quantità equimolare di NaOH, in grado strappare il protone al sale di ammonio inizialmente formate per ottenere direttamente l’ammina terziaria, nell’alchilazione della più reattiva esametilenammina, al fine di evitare la superalchilazione, non è stata aggiunta la base ed è stato isolato il prodotto protonato.
Questo è stato purificato per cristallizazione in acetone a basse temperature ed identificato sulla base dello spettro NMR. Dopo deprotonazione per trattamento con NaOH in acqua è stato possibile isolare l’attesa ammina terziaria.
Figura 14. Sintesi delle amine terziarie di partenza
Per quanto concerne l’ossidazione, sulla base di quanto riportato in letteratura, era possibile utilizzare come reagenti l’acido perossimonosolforico, l’acido metacloroperbenzoico (mCPBA) il perossido di idrogeno (acqua ossigenata).
Nell’ottica di lavorare nell’ambito della Green Chemistry e con l’obiettivo di incrementare la sostenibilità del processo, tra i tre ossidati è stato scelto il perossido di idrogeno al 35%.
Figura 15 Sintesi di N-Ossidi
Le reazioni sono state effettuate a 70 ° e dopo 12 ore è stato possibile isolare i corrispondenti N-ossidi identificati sulla base degli spettri NMR. Entrambi i composti erano dei liquidi molto viscosi a temperatura ambiente.
2.5 Progettazione e sintesi di potenziali liquidi ionici
con cationi portanti una funzionalità basica
L’1,4-diazabiciclo[2.2.2]ottano (DABCO) è un composto chimico ampiamente utilizzato nella sintesi organica sia come catalizzatore metal-free, in
reazioni di coupling o reazioni particolari come la Baylis-Hillman, che come ligando complessante, e base di Lewis o superbase di Bronsted.
Più recentemente, la DBCO è stata utilizzata per ottenere liquidi ionici basici da utilizzare come mezzi di reazione e catalizzatori. Presentando infatti due azoti terziari la DABCO può essere quaternarizzata su un solo atomo di azoto, lasciando quindi una funzione amminica terziaria, o su entrambi gli atomi di azoto per dare dei di cationi.
Figura 16. 1,4-diazabiciclo[2.2.2]ottano o DABCO
Nell’ambito di questa tesi abbiamo preparato alcuni prodotti di monoalchilazione per reazione della DABCO con l’opportuno bromuro alchilico.
Per evitare la formazione del prodotto di dialchilazione la reazione è stata effettuata in acetato di etile a temperatura inferiore a 50° C usando piccolo un eccesso (circa 10%) di DABCO. L’utilizzo di un eccesso di bromuro alchilico, o di alte temperature (maggiori di 100°), favoriscono infatti la formazione del prodotto bialchilato.