MATERIALI E METODI
I. Animali
Tutti gli animali utilizzati in questo lavoro sono stati generati nel laboratorio di Neurobiologia della Scuola Normale Superiore presso l’Istituto di Neurofisiologia del Consiglio Nazionale delle Ricerche di Pisa. Per quanto riguarda i topi, gli accoppiamenti sono stati eseguiti con topi C57BL/6 (“linea genetica pura”), mentre nel caso dei ratti sono stati utilizzati ratti pigmentati Long Evans. Nel complesso gli animali utilizzati negli esperimenti sono tutti di età comparabile.
Normalmente gli animali sono stabulati in condizioni di temperatura e umidità costanti, con cicli di luce/buio di 12 ore ciascuno e inizio della fase di luce alle 6:00 A.M.; acqua e cibo sono a disposizione ad libitum. I protocolli sperimentali e di stabulazione sono stati condotti in linea con quanto approvato dal Ministero Italiano per la Ricerca Scientifica.
II. Deprivazione monoculare
I ratti utilizzati per le registrazioni elettrofisiologiche in vivo sono stati sottoposti a deprivazione monoculare mediante sutura della palpebra all’inizio del periodo critico (P21). Per effettuare la deprivazione, l’animale viene anestetizzato con avertina [Preparazione: 100 ml di fisiologica sterile, 8 ml di alcol assoluto e 2 ml di soluzione concentrata (3,22 gr di tribromo etanolo e 2 ml di alcol terziario isoamilico); Dose: 1 ml/hg], monitorando lo stato di veglia tramite il controllo dei riflessi.
L’operazione consiste nel taglio delle rima palpebrale e nella successiva cucitura con normale filo da sutura chirurgica dei due lembi rimasti; questi ultimi vanno poi incontro a cicatrizzazione, impedendo il passaggio di stimoli luminosi strutturati. Durante la sutura l’occhio viene pulito con soluzione salina (NaCl allo 0,9%) e, successivamente, viene trattato con neomicina e cortisone per evitare eventuali infezioni. L’operazione è interamente condotta sotto un microscopio chirurgico per evitare danni permanenti alla cornea, che potrebbero comportare ipervascolarizzazione a livello del sito di lesione e conseguente opacizzazione della cornea stessa. Generalmente l’occhio che viene chiuso è sempre il destro.
Dal momento che una delle conseguenze principali dell’anestesia è l’abbassamento della temperatura corporea, l’animale viene tenuto sotto una lampada fino al completo risveglio.
III. Iniezioni corticali
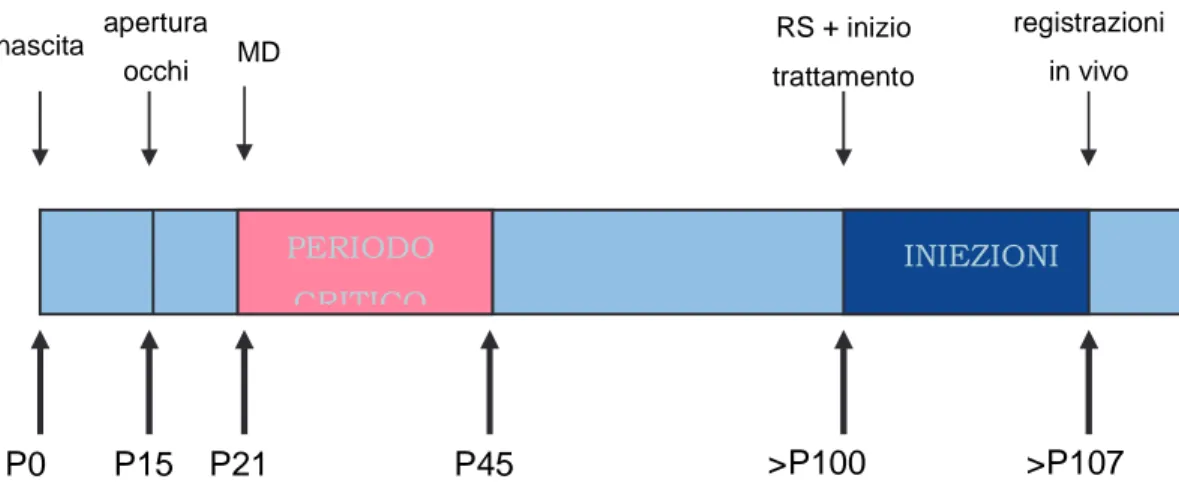
Diventati adulti (> P100), i ratti deprivati hanno subito la riapertura della palpebra suturata e la chiusura dell’occhio rimasto precedentemente aperto (sutura inversa); durante questa fase sono stati scartati tutti quei ratti che presentavano una sutura non perfetta della palpebra. Nei primi tre giorni di sutura inversa (RS), inoltre, gli animali sono stati trattati due volte al giorno con applicazioni topiche di antibiotico e cortisone, in modo da prevenire eventuali infezioni e la conseguente opacizzazione della cornea (fig. 4).
Fig. 4: Protocollo di trattamento dei ratti usati per le registrazioni elettrofisiologiche in vivo
Con lo scopo di valutare l’effetto del trattamento enzimatico durante il periodo di RS, gli animali sono stati separati in tre gruppi:
• adulti non sottoposti a nessun trattamento ulteriore
• adulti sottoposti a iniezioni corticali di condroitinasi ABC
• adulti sottoposti a iniezioni corticali di penicillinasi
La condroitinasi ABC senza proteasi (Seikagaku) è un enzima batterico derivato da Proteus vulgaris che catalizza la rimozione delle catene laterali dei CSPG, senza arrecare danno al core proteico della molecola. L’enzima viene venduto in un kit con 4 vial contenenti una polvere liofilizzata da 20 µg l’una a una concentrazione di 120 U/mg; il contenuto di ciascuna vial viene disciolto in 50 µl di soluzione fisiologica, resa sterile grazie al passaggio attraverso un filtro a 0,22 µm. Questa soluzione viene poi suddivisa in aliquote da 7 µl, che, riposte a -80°C, si conservano in forma stabile per almeno tre mesi. La concentrazione finale ottenuta è pari a 48 U/ml.
La penicillinasi è un enzima batterico privo di substrato endogeno, pertanto viene utilizzato come controllo per verificare che gli effetti osservati siano legati all’azione specifica della condroitinasi e non a quella di un enzima qualunque.
Sono state effettuate due iniezioni per ogni animale: la prima in concomitanza alla riapertura della palpebra, e la seguente a tre giorni di distanza, secondo il protocollo di efficacia della condroitinasi già testato da esperimenti precedenti
P0 P15 P21 P45 >P100 >P107 nascita apertura occhi RS + inizio trattamento registrazioni in vivo MD
(Pizzorusso et al., 2002). Gli aghi impiegati per l’iniezione vengono preparati a partire da un capillare in borosilicato senza filamento (diametro 1 mm) che, sottoposto a tiratura a caldo con un normale puller da elettrofisiologia, si separa in due metà con la punta a cono. Prima di essere impiegata, la punta di ciascuna metà viene spezzata mediante un paio di apposite pinzette, in modo da ottenere un diametro di circa 30 µm. L’ago viene quindi montato su un micromanipolatore meccanico collegato a un iniettore Na-Sutter utile a controllare l’iniezione: la via viene caricata con olio e successivamente viene fatta salire la sostanza in questione; in questo modo tra i due liquidi immiscibili si crea un menisco il cui livello può essere usato per monitorare la regolare discesa della sostanza. Il micromanipolatore è programmato in modo da effettuare movimenti di 0,1 µm per ogni step.
Per effettuare l’iniezione, l’animale viene montato su un apparecchio stereotassico sopra una copertina termostatata, che permette di mantenere costante la temperatura corporea (≈37°C) monitorata attraverso un sondino intrarettale . L’ossigeno viene fornito per mezzo di un bubbolatore. Dopo aver effettuato il taglio della cute, si prosegue con l’incisione di un solco a forma di U nella regione dello scalpo attorno all’area della corteccia visiva primaria (fig. 5), lungo tale solco si praticano poi cinque fori fino ad ottenere la rottura della dura madre sottostante. Da questi punti il capillare caricato con la sostanza da iniettare. Questo particolare schema di iniezione consente all’area corticale di interesse di venire raggiunta dall’enzima grazie a normali processi di diffusione molecolare, ma contemporaneamente evita che la zona vada incontro a fenomeni infiammatori legati all’inserimento dell’ago.
Fig. 5: Schema seguito per effettuare le iniezioni
Oc
Per individuare gli esatti siti di iniezione, si sfrutta un sistema di coordinate centrato sulla scissura lambda, a partire dalla quale si misurano gli spostamenti in direzione mediolaterale e anteroposteriore. I cinque siti individuati sono così collocati: 1)3,8 mm laterale e 1 mm posteriore, 2)3,8 mm laterale e 1 mm anteriore, 3)6,2 mm laterale e 1 mm posteriore, 4)6,2 mm laterale e 1 mm anteriore, 5)5 mm laterale e 2 mm posteriore.
Per ciascun sito si effettuano due iniezioni a profondità diversa, una a 350 µm e una a 750 µm, e per ogni iniezione si rilasciano tre pulse distinti di soluzione, ciascuno da 125 nl. In conclusione per ogni sito di iniezione si forniscono 375 nl di enzima, e quindi 750 nl per ogni punto individuato inizialmente sullo scalpo. Poiché l’occhio deprivato è sempre quello destro, le iniezioni e le successive registrazioni sono effettuate nell’emisfero sinistro, cioè quello controlaterale alla palpebra suturata.
IV. Registrazioni in vivo di potenziali visivi evocati
Per valutare l’acuità visiva degli animali trattati si è fatto ricorso alla misurazione dei potenziali corticali evocati da una stimolazione visiva (potenziali visivi evocati, VEP); tale sistema è di nota efficacia nell’uomo (Teller et al., 1986), nella scimmia (Boothe e al., 1988), nel gatto (Teller e al.,1986), nel ratto (Fagiolini e al., 1994) e nel topo (Porciatti e al., 1999; Huang e al., 1999; Gianfranceschi e al., 1999).
Per effettuare le registrazioni l’animale viene anestetizzato con uretano (0,7 ml/hg; 20% in soluzione salina) e montato su un apparecchio stereotassico, durante l’esperimento vengono fornite dosi aggiuntive di anestetico se necessario. La
temperatura corporea viene monitorata e mantenuta costante con il sistema descritto per le iniezioni, l’ossigeno viene garantito tramite continua ventilazione. Dopo aver scoperto lo scalpo, si pratica un tassello nel cranio in corrispondenza della zona di trattamento, facendo particolare attenzione alla rimozione della dura madre, in modo da evitare la rottura dei vasi sanguigni corticali.
L’elettrodo usato per la registrazione è costituito da un capillare di vetro con filamento, tirato con un puller a caldo e spezzato in modo da ottenere una punta di circa 4 µm di diametro (circa 2 MΩ di impedenza); la micropipetta viene riempita con soluzione 3 M di NaCl e posizionata sfruttando il sistema di coordinate centrato su lambda (4,9 mm laterale). Prima di inserire l’elettrodo, gli occhi vengono fissati e mantenuti aperti con degli appositi anellini metallici (Parnavelas). Si effettuano almeno tre penetrazioni ben separate per ogni animale, e ogni volta si registrano segnali lungo l’intera profondità corticale, per essere certi che tutti gli strati contribuiscano allo stesso modo alla definizione del risultato finale.
Il pattern di stimolazione è generato da un apposito software con scheda VSG2\2, messo a punto da C. Orsini, e ha una frequenza costante di inversione delle bande bianche e nere pari a 0,5 Hz. Viene presentato su un monitor di cm 20x22 e luminanza pari a 15 cd/m2, la distanza dagli occhi del ratto è fissata a 20-30 cm in modo da esser sicuri che lo stimolo cada nella porzione binoculare di campo visivo.
Quello che si misura alla fine è la media dell’ampiezza dei potenziali transienti e la loro latenza, ottenuta dalla sommazione di almeno 128 eventi. I segnali registrati dalla corteccia controlaterale all’occhio deprivato sono filtrati (0,1-100 Hz) e amplificati. La profondità a cui si effettua la registrazione è di circa 450 µm poiché qui è massima la risposta dei VEP.
L’acuità visiva viene misurata come la più alta frequenza spaziale in grado di evocare una risposta al di sopra del livello di rumore, al massimo contrasto; tale frequenza si ricava per interpolazione dal punto in cui il livello di rumore incrocia la retta di regressione lineare ricavata dagli ultimi 4-5 punti del grafico costruito riportando l’ampiezza dei VEP (normalizzata al valore registrato per la più bassa frequenza spaziale impiegata, 0,2 cicli\deg) in funzione del logaritmo decimale della
frequenza spaziale. La dimensione delle barre del pattern può variare da 0,1 a 1,2 cicli\deg.
V. Perfusione
Dopo la valutazione dell’acuità visiva, i cervelli dei ratti trattati sono stati sottoposti ad analisi istochimica, con lo scopo di verificare l’effettiva digestione della matrice extracellulare. In generale, per effettuare una qualunque analisi anatomica, il cervello deve essere fissato tramite l’uso di una soluzione che, diffondendo attraverso i vasi sanguigni, blocchi l’attività delle proteine, chelandone i gruppi reattivi. Per questo motivo, successivamente alle registrazioni elettrofisiologiche, gli animali sono stati perfusi con una soluzione di paraformaldeide al 4% (ottenuta a partire da una stock di paraformaldeide all’8% diluito in tampone fosfato 0,2 M).
L’animale viene sacrificato con una dose aggiuntiva di uretano e quindi sottoposto a chirurgia: una volta aperta la cassa toracica, si clampa l’aorta discendente (per evitare che la paraformaldeide si diriga verso le regioni inferiori del corpo), si fora l’atrio destro (per permettere la fuoriuscita della soluzione che viene immessa in circolo), e si inserisce nel ventricolo sinistra l’ago collegato alla pompa peristaltica. Man mano che la soluzione fluisce dalla pompa all’animale, essa andrà a sostituire gradualmente il sangue e giungerà direttamente al cervello irrorando il tessuto in maniera capillare. Prima di far scorrere la soluzione fissativa (velocità 25 ml/min), si effettua un lavaggio dei vasi con PBS.
Dopo la perfusione, l’animale viene decapitato e si procede all’estrazione del cervello tramite appositi strumenti mangiaosso; quest’ultimo viene successivamente lavato in tampone fosfato 0,1 M e lasciato un paio di giorni in una soluzione di saccarosio al 30% in PBS (salina con tampone fosfato). Qualora si voglia conservare più a lungo il campione, è possibile aggiungere a questa soluzione sodio azide allo
0,05%, per evitare fenomeni di marcescenza. Il passaggio in soluzione iperosmotica di saccarosio è fondamentale per permettere la disidratazione del campione e prevenire la formazione di cristalli di ghiaccio durante il processo di congelamento precedente al taglio (crioprotezione).
Per procedere al taglio delle fettine, il cervello viene congelato in pochi secondi impiegando CO2 e quindi tagliato al microtomo congelatore. Le fettine cerebrali dello spessore di 50 µm vengono disposte all’interno di piastre contenenti PBS (una per pozzetto), e le analisi istochimiche vengono condotte entro tre giorni dal taglio, per evitare la distruzione dei determinanti antigenici.
paraformaldeide all’8% (p/V)
Dopo aver pesato la paraformaldeide, si scioglie in una frazione di volume di acqua distillata (0,2 µS\cm di conducibilità) in una beuta e si porta fino alla temperatura di 50°C su uno stirrer che permetterà d i agitare la soluzione in cui è immersa un’ancorina magnetica. La soluzione, dapprima lattiginosa, deve divenire trasparente; con il calore la soluzione si acidifica perché i gruppi aldeidici della para divengono carbossilici. È necessario basificare il tutto con alcune gocce di NaOH 1N. Si esegue una filtrazione dopo aver portato a volume e si mette la beuta pronta in frigo a 4 °C. Gli scarti di lavorazione vanno getta ti nel contenitore per rifiuti tossici.
Tampone fosfato (0,2 M)
Creato a partire da 57,67 g di Na2HPO4*2 H2O a 10,48 g di NaH2PO4 * H2O; la soluzione dovrà avere un pH=7,4.
VI. Analisi istochimiche
L’analisi istochimica delle fettine permette di rilevare la presenza o l’assenza di determinate molecole, mediante il legame di reagenti che ne riconoscono gli antigeni specifici. Nel nostro caso è stata un’agglutinina estratta da Wisteria floribunda (WFA), che come lectina è in grado di legarsi specificamente alle catene laterali dei CSPG di matrice. Tutte le reazioni di legame della WFA e di rivelazione tramite fluorofori vengono svolte in modalità free-floating, cioè ponendo la piastra contenente le fettine su una bascula che permette loro di muoversi liberamente all’interno del pozzetto. Questa operazione dovrebbe favorire la penetrazione dei reagenti.
Dalla soluzione di PBS in cui sono state immerse dopo il taglio, le fettine vengono trasferite in altri pozzetti contenenti la soluzione di blocking, necessaria per saturare i siti di legame aspecifici. Dopo aver effettuato gli opportuni lavaggi in PBS (tre da 5’ ciascuno), le fettine possono venire immerse nella soluzione di incubazione contenente la WFA (O/N 4°C); in questo passaggio è necessario riempire uno dei pozzetti rimasti vuoti con un velo d’acqua, e sigillare la piastra con parafilm, in modo da creare una sorta di camera umida che impedisca l’evaporazione della soluzione. Il giorno seguente si procede coi lavaggi e, poi, direttamente con la rivelazione della WFA, dal momento che essa è già biotinilata; la rivelazione viene fatta utilizzando un fluoroforo che riconosce specificamente la biotina ed emette luce rossa se opportunamente stimolato (extravidina). Alternativamente sono state anche usate molecole di streptavidina coniugate a fluoresceina.
Terminata la reazione di rivelazione, le fettine vengono montate su vetrino per poter essere analizzate in fluorescenza; tra la superficie del vetrino e il coprioggetto viene posto uno specifico montante (Vectashield) utile a preservare la fluorescenza per mesi. A tal fine è inoltre opportuno sigillare i vetrini con dello smalto e conservarli in frigo a 4°C.
Blocking solution
Soluzione di incubazione
1% albumina di siero bovino, WFA biotinilata 1:100 in PBS over night. Soluzione di rivelazione
extravidina 1:500 in PBS per 1 ora.
VII. Analisi in microscopia
I preparati istologici sono stati osservati mediante microscopia confocale in fluorescenza per stabilire l’efficacia del trattamento enzimatico ed effettuare un’analisi qualitativa della fettina. Il grosso vantaggio di questo tipo di microscopia è che consente analisi tridimensionali del preparato.
Il microscopio confocale utilizzato è dotato di due laser, in grado di stimolare il campione a due lunghezze d’onda diverse: un laser ad argon (λecc= 488 nm), per eccitare i fluorocromi che emettono nel verde e assorbono nel blu, e uno a kripton
(λecc= 532 nm), per quei fluorocromi che, come nel nostro caso, emettono nel rosso
ed assorbono nel verde. La potenza del laser può essere regolata in base al livello del segnale.
Dopo aver messo a fuoco il preparato, l’acquisizione delle immagini viene condotta tramite un apposito programma sul PC che permette di variare una serie di parametri di acquisizione sulla base della risoluzione e dell’ingrandimento richiesti. Generalmente, per acquisire una buona immagine, si mediano tra loro n scansioni effettuate su più piani focali attraverso tutto lo spessore della fettina; in questo modo vengono eliminati i pixel di fluorescenza generati casualmente dal rumore di fondo dello strumento.
VIII. Preparazione del campione per elettrofisiologia in vitro
Per analizzare la risposta di singole popolazione neuronali al trattamento con condroitinasi, sono state preparate fettine di encefalo prelevato da topi adulti wt (40-60 giorni). Al fine di diminuire al minimo il numero di animali utilizzati e la loro sofferenza, il prelievo dell’encefalo è stato effettuato seguendo tutte le precauzioni indicate dai protocolli del Ministero della Sanità.
I topi sono stati anestetizzati mediante inalazione di isofluorane e, dopo la decapitazione, il cervello viene estratto il più velocemente possibile, in modo da ridurre al minimo il tempo di anaerobiosi. Successivamente i due emisferi vengono squadrati a livello della porzione rostrale e incollati su una piastra, che è poi fissata meccanicamente sul fondo della vasca del vibratomo. Per evitare che la deformazione del cervello dovuta al contatto con la lama del vibratomo infici la buona riuscita delle fettine, sulla stessa piastra viene incollato un cubetto 1x1x1 cm di gel di Agar 1,5%, in modo che alla fine il cervello sia compreso tra la lama del vibratomo da un lato e il gel dall’altro.
La vasca di taglio è raffreddata con ghiaccio, ventilata con O295%/CO25%, e riempita di una soluzione simile, in composizione, al liquido cerebrospinale. A differenza di quest’ultimo, però, la soluzione di taglio ha una concentrazione di Ca2+ lievemente inferiore e le viene aggiunto acido chinurenico 1 mM (bloccante dei recettori glutammatergici), al fine di ridurre l’attività necrotica del tessuto; per riequilibrare lo squilibrio ionico dovuto alla diminuzione del calcio, è stata aumentata la concentrazione del magnesio. Le porzioni di encefalo contenenti la corteccia visiva primaria vengono tagliate in fettine dello spessore di circa 300 µm. Ogni fettina tagliata è messa in un apposito becker riempito di soluzione di taglio senza acido chinurenico, ventilato con ossigeno e immerso in un bagnetto termostato che lo mantiene alla temperatura di 30°C. Dopo circa venti minuti dalla fine del taglio, i becker vengono tirati fuori dal bagnetto e lasciati a temperatura ambiente per circa un’ora prima di procedere con le registrazioni.
KCl 3,1 mM NaHCO3 4 mM HEPES\NaOH 10 mM K2HPO4 1 mM CaCl2 1 mM MgCl2 2 mM d-glucosio 5 mM Acido ascorbico 1 mM myo inositolo 0,5 mM piruvato 2 mM pH 7,3
IX. Registrazioni elettrofisiologiche in vitro
Le fette di cervello vengono messe una alla volta in apposite camerine predisposte alla registrazione dei segnali nervosi. Grazie all’utilizzo di una pompa, attraverso queste camerine fluisce di continuo una soluzione di registrazione molto simile al liquido cerebrospinale (1,5 ml/min); tale soluzione viene riscaldata in modo da garantire una temperatura di 32°C all’interno de lla camerina, che è un buon compromesso tra una temperatura che consenta alla fetta di sopravvivere e una che rallenti il più possibile i fenomeni necrotici. La soluzione di registrazione viene inoltre ventilata con ossigeno al 95% e anidride carbonica al 5%.
L’elettrodo di registrazione è ottenuto da un capillare di vetro con filamento mediante tiratura a caldo con un puller da elettrofisiologia, viene poi riempito di soluzione di registrazione e collocato negli strati II/III della corteccia. L’elettrodo di
stimolazione, invece, è posizionato in corrispondenza dello strato V. In questo modo sono state effettuate registrazioni extracellulari di potenziali di campo.
Una volta ottenuto un buon segnale, è necessario innanzitutto costruire una curva di saturazione, aumentando gradualmente l’intensità di stimolazione: inizialmente il potenziale di campo varia proporzionalmente all’intensità di stimolazione, fino a raggiungere un valore massimo di saturazione. Riportando questi dati in un sistema di assi si ottiene un grafico sigmoidale, da cui è possibile ricavare il valore massimo di corrente di stimolazione oltre il quale non si osserva più alcun aumento del potenziale neurale. Questo è utile per stabilire il valore di potenziale a cui condurre l’esperimento: per garantire alla risposta la massima libertà di fluttuazione sia verso l’alto che verso il basso, si sceglie un valore di potenziale compreso tra la metà e i tre quarti del segnale di saturazione. Il valore massimo e minimo del field potential sono in genere ottenibili con un range di intensità di stimolazione compreso tra 0,1 e 0,8 mA; tutte le registrazioni sono state effettuate prendendo in considerazione segnali di field con una latenza maggiore di 3 ms e un’ampiezza maggiore di 0,3 mV. Le stimolazioni di base vengono date ogni 30 secondi, frequenza che permette di monitorare le caratteristiche funzionali delle popolazione neurale senza indurre fenomeni di potenziamento o assuefazione.
Prima di procedere col protocollo sperimentale è necessario verificare che il segnale abbia raggiunto la stabilità. Pertanto, ci si assicurava che l’ampiezza della risposta rimanesse costante per un periodo di venti minuti. Quando ciò accade, è possibile costruire una base line da usare come riferimento per la valutazione della variazione delle proprietà neuronali in seguito al trattamento. Dopo venti minuti di stabilità del valore di base line, alla soluzione di registrazione è stata aggiunta la condroitinasi (0,007 U/ml).
Non avendo osservato variazioni rilevanti dell’attività neurale in seguito al trattamento con condroitinasi, nella seconda fase sperimentale viene effettuata sulle fettine una stimolazione ad alta frequenza, la theta burst stimulation (TBS), trenta minuti dopo la somministrazione dell’enzima. I controlli sono stati fatti utilizzando la penicillinasi al posto della condroitinasi e seguendo gli stessi protocolli sperimentali.
Terminata la fase di osservazione finale, la fettina è stata perfusa per 10 minuti con una soluzione di registrazione contenente 1 mM di acido chinurenico. Sono state escluse dai dati:
-le registrazioni in cui l’artefatto elettrico o la componente presinaptica (latenza< 2 ms) subivano un cambiamento d’ampiezza maggiore del 20%
-le registrazioni in cui la stima della componente postsinaptica era minore del 70% dell’onda registrata
Soluzione di registrazione: NaCl 132,8 mM KCl 3,1 mM NaHCO3 4 mM HEPES/NaOH 10 mM K2HPO4 1 mM CaCl2 2 mM MgCl2 1 mM d-glucosio 5 mM Acido Ascorbico 1 mM myo inositolo 0,5 mM Piruvato 2 mM pH 7,3
X. Analisi statistiche
I dati sperimentali ottenuti sono stati controllati mediante impiego di opportuni test statistici utilizzando il programma SigmaStat2.0; il livello di significatività è stato sempre fissato a 0,05.
t test per dati appaiati: utilizzato per confrontare i valori di acuità visiva dell’occhio deprivato e dell’occhio rimasto aperto, negli animali trattati con condroitinasi o con penicillinasi. L’ipotesi nulla valutata dal test è che la differenza tra i due occhi sia semplicemente legata al caso.
t test per dati non appaiati: utilizzato per confrontare l’acuità visiva dell’occhio deprivato degli animali trattati con condroitinasi, con quella degli animali trattati con condroitinasi. L’ipotesi nulla valutata dal test è che la differenza tra i due occhi sia semplicemente legata al caso.
analisi della varianza a due vie per dati ripetuti: per questo test parametrico abbiamo assunto l' omogeneità delle varianze e la normalità per tutti i gruppi da cui sono stati estratti i campioni. Tale analisi è stata utilizzata al fine di verificare se le differenze tra i valori medi per ogni gruppo di trattamento sono maggiori di quanto atteso se fossero dovute solamente al caso. Nel nostro caso è stato usato per valutare la differenza di risposta a stimoli ad alta frequenza nelle fettine trattate rispetto ai controlli. Si considerano come livelli di variabilità il trattamento con condroitinasi e il procedere della stimolazione.