21
4 Approccio alla modellazione
Il modello matematico sviluppato descrive le varie fasi del processo (essiccamento, pirolisi, gassificazione e combustione) dal punto di vista chimico-fisico considerando la cinetica dell’essiccamento, della devolatilizzazione che porta il carbone a convertirsi in volatili e char e delle reazioni omogenee in fase gas ed eterogenee gas/solido consentendo così di valutare nel tempo i profili di concentrazione delle specie che prendono parte alle diverse reazioni e i profili di temperatura della fase solida e della fase gas nel tempo e lungo il reattore. Dal punto di vista fluidodinamico il modello è in grado di valutare i profili di velocità della fase solida e gassosa nel tempo lungo il reattore.
4.1 Impostazione modello
Il gassificatore, di geometria cilindrica, è stato discretizzato in una serie di celle cosi da poter applicare le equazioni costitutive ad un volume di controllo V e avere la possibilità di monitorare e analizzare variabili quali: temperatura, velocità e composizione sia della fase gas che di quella solida lungo il gassificatore, vedi Fig. 4.1. Ogni cella, di altezza z e di sezione pari a quella del gassificatore, viene trattata come un reattore agitato continuo perfettamente miscelato (CSTR) e le variabili di stato (temperatura e composizione) nella cella saranno quelle in uscita dalla cella stessa. Il grado di vuoto del letto e la pressione presente nel reattore sono parametri di input del sistema e vengono considerati costanti.
Per ciascuna cella sono state scritte le equazioni di bilancio di massa (globale e parziale) e di energia in regime transitorio.
La fluidodinamica viene considerata solo con flusso di tipo convettivo in direzione assiale mentre viene trascurato il flusso in direzione radiale, quindi i profili di concentrazione e temperatura variano solo in funzione dell’altezza del letto.
22 Figura 4.1 Suddivisione del reattore in celle e singola cella.
A causa del fatto che alcune reazioni avvengono in fase gas ed altre in fase solida e le due fasi si muovono in controcorrente nel reattore, le temperature delle due fasi non sono uguali, pertanto sono stati effettuati due bilanci termici: uno per la fase gas e uno per la fase solida all’interno dei quali compare anche il termine dello scambio di calore tra le due fasi e di calore disperso alla parete.
Il carbone alimentato viene caratterizzato attraverso l’analisi immediata sul tal quale e l’analisi elementare su base daf (dry ash free). Fissata la portata di carbone in alimentazione, la portata di aria da alimentare, la cui composizione viene fornita in percentuali volumetriche, viene calcolata all’interno del modello attraverso il parametro ER (rapporto equivalente).
23 Dal punto di vista granulometrico il modello considera un solo diametro medio delle particelle di carbone alimentato. Per la descrizione dei vari fenomeni che avvengono nel reattore il modello prevede due fasi: una fase solida e una fase gassosa.
La fase solida è costituita da 4 componenti:
carbone privo di ceneri e umidità
umidità
ceneri
char
La fase gassosa è costituita da 9 componenti:
ossigeno O2 azoto N2 vapor acqueo H2O anidride carbonica CO2 idrogeno H2 monossido di carbonio CO metano CH4 idrogeno solforato H2S TAR (CmHn)
Tali specie gassose sono quelle maggiormente presenti nei gas di sintesi e si assume abbiano un comportamento ideale.
Analisi del carbone
Di seguito si riportano le rielaborazioni tese a valutare i parametri di ingresso del modello relativi alla composizione del carbone:
Analisi immediata (carbone tal quale)
Umidità U0 %
Materia Volatile MV0
Ceneri A0
Carbonio fisso CF0 (x differenza)
24 Analisi immediata (carbone secco, dm)
Materia Volatile MV % Ceneri A Carbonio fisso CF 100 con 0 0 100 100 MV MV MV 0 0 100 100 U C C F F 0 0 100 100 U A A
Analisi elementare (carbone secco e senza ceneri, daf)
Carbonio C % Idrogeno H Azoto N Zolfo S Ossigeno O (x differenza) 100 0 0 0 100 100 A U MV MVdaf
Con i parametri così ottenuti è possibile ricavare la formula di struttura del carbone utilizzando come base 100 g di carbone tal quale:
C0H0O0N0S0 ∙ A0 ∙ zH2O dove: C A U 1200 100 0 0 0 U A H 100 100 0 0 0 O A U 1600 100 0 0 0 U A N 1400 100 0 0 0 S A U 3200 100 0 0 0 18 0 U z
Riferendoci a 100 g di carbone secco: CHONS ∙ A
25 dove: AC 1200 100 1 AH 100 100 1 AO 1600 100 1 AN 1400 100 1 AS 3200 100 1 Essiccamento
Durante l’essiccamento il carbone, ad opera dai gas caldi prodotti nella zona di gassificazione/combustione, viene riscaldato in modo da allontanare l’umidità presente. L’essiccamento viene rappresentato come segue:
C0H0O0N0S0 ∙ A0 ∙ zH2O C0H0O0N0S0 ∙ A0 + zH2O Rdry 100 g 100-Uo g Uo g CHONS ∙ A ∙ U H O U 2 0 0 ) 100 ( 18 100 CHONS ∙ A + H O U U 2 0 0 ) 100 ( 18 100 100g
A causa di tale fenomeno la particella può subire una leggera contrazione, ma in questo modello tale fenomeno verrà trascurato, quindi la particella manterrà la forma sferica con un diametro costante (dp=dp0).
Sono riportati in letteratura diversi modelli per valutare la velocità di rimozione dell’umidità. Alcuni considerano il fenomeno estremamente veloce e legato alla quantità di calore assorbito dalla fase solida che viene utilizzato per vaporizzare l’acqua interstiziale contenuta nelle particelle di carbone [Yang et al., 2006]. Altri descrivono il flusso di acqua dalla particella solida verso il gas circostante attraverso un processo di diffusione [Smoot e Smith, 1979; Teislev, 2006]. Altri, ancora, descrivono il fenomeno mediante una cinetica del 1° ordine la cui costante cinetica è legata alla temperatura della fase solida secondo il modello di Arrhenius [Mandl et al., 2009].
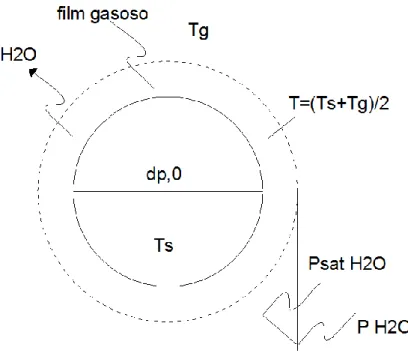
26 Modello diffusionale
Figura 4.2 Schematizzazione modello diffusionale
La velocità di rimozione dell’umidità dalle particelle risulta:
H O H Og sat O H O H diff dry Ts R M p k r 2 2 2 , 2 , 2 s) (kg/(m
[Smoot e Smith, 1979; Teislev, 2006]
,g densità dell’acqua in fase gas kg/m3
R = 0.0821 m3∙atm/(kmol∙K) MH2O = 18.015 kg/kmol
k diff,H2O (m/s) 0 2 2 dp DHO DH2O = [10-7∙T1.75(1/18 + 1/28)1/2]/[(13.101/3 + 18.501/3)]2 m2/s con T = (Ts + Tg)/2 in K 13 . 46 44 . 3816 3036 . 18 exp 760 1 2 s sat O H T p atm
27 per unità di volume di letto:
dry dry a r
R kg/(s∙m3bed)
a = 6∙(1 - )/dp,0 area superficiale specifica m2/m3bed
Modello con cinetica del I° ordine
Questo è il modello seguito per la modellazione dell’essiccamento.
Rdry = kH2O∙ kg/(s∙m3bed) [Patisson et al., 2000 ; Mandl et al., 2009]
densità dell’acqua nella fase solida nel letto kg/m3bed
kH2O = AH2O∙exp
Ts EHO 31 , 8 2 s-1
AH2O = 3.11 s-1 [Patisson et al., 2000]
EH2O= 2.77∙104 J/mol
Calore di essiccamento
Il calore relativo a tale processo endotermico è:
Hdry = -2446368 J/kgH2O calore di evaporazione a 25°C
da cui il calore sottratto alla fase solida per unità di volume di letto: Qdry =Rdry
Hdry
J/(s∙m3 bed)
Pirolisi
Per il carbone secco la reazione di devolatilizzazione può essere scritta nel seguente modo: CHONS ∙ A CHONS ∙ A + aH2 + bCH4 + cCO + CmHnOpNqSr + dH2O
+ eCO2 + fH2S + gN2
char
28 Si assume che la distribuzione dei prodotti volatili resti costante all’avanzare della reazione di pirolisi.
In questo modello si adotta l’ipotesi che il char sia costituito solo da carbonio dato che le analisi mostrano solo la presenza di piccole quantità di idrogeno e ossigeno presenti al suo interno, inoltre si considera che p = q = r = 0 [Wen e Chaung, 1979; Govind e Shah, 1984]; pertanto la reazione di devolatilizzazione diventa:
CHONS ∙ A C∙ A + aH2 + bCH4 + cCO + CmHn + dH2O + eCO2 + fH2S + gN2
Durante la pirolisi avvengono fenomeni in cui le particelle di carbone si contraggono e si frantumano, ma nel presente lavoro non saranno considerati. Pertanto si assume che le particelle mantengano la forma sferica con diametro costante (dp,0) anche se la loro porosità
aumenterà.
Per valutare i 10 coefficienti stechiometrici della reazione sopra, si utilizzano i bilanci materiali ed informazioni sulle rese dei prodotti (volatili e char).
Bilanci materiali C: + b + c + m + e H: 2a + 4b + n + 2d + 2f O: c + d + 2e N: 2g S: f Rese
Peso dei prodotti (g) su 100 g di carbone secco: A: mA = A Char: mchar = H2: mH2 = 2a CH4: mCH4 = 16b CO: mCO = 28c Tar: mTAR = 12m + n H2O: mH2O = 18d CO2: mCO2 = 44e H2S: mH2S = 34f char tar
29 N2: mN2 = 28g
V0(peso prod volatili sul secco) = mH2 + mCH4 + mCO + mTAR + mH2O + mCO2 + mH2S +mN2
mchar + A + V0 = 100 V0 = MV (materia volatile su 100 g di carbone secco)
In termini di rese si ha:
char (daf) = mchar/(100-A) = fchar (MVdaf)
H2 (daf) = mH2/(100-A) = fH2 (MVdaf)
CH4 (daf) = mCH4/(100-A) = fCH4 (MVdaf)
CO (daf) = mCO/(100-A) = fCO (MVdaf)
H2O (daf) = mH2O/(100-A) = fH2O (MVdaf)
In letteratura sono disponibili dati che mostrano la resa dei prodotti volatili su carbone secco e senza ceneri (base daf) in funzione del tenore di materia volatile su base secca e priva di ceneri, MVdaf.
30 Tabella 4.2 Prodotti di pirolisi [Loison e Chauvin, 1964].
Tabella 4.3 Rese dei prodotti di pirolisi [Loison e Chauvin, 1964].
Le curve delle rese su base daf riportate in Fig. 4.3 sono state valutate algebricamente in funzione di MVdaf come segue:
char (daf) =
0,0238MVdaf2 2,1959MVdaf 105,89
/100H2 (daf) =
0,0007MVdaf2 0,0258MVdaf 0,9117
/100CH4 (daf) =
0,0002 MV 0,0203 MVdaf2 0,6539 MVdaf 3,5836
/100 3daf
31
CO (daf) =
0,0096MVdaf2 0,3701MVdaf 4,9825
/100H2O (daf) =
0,0023MVdaf2 0,0017MVdaf 1,7445
/10032 Pertanto, per determinare i 10 coefficienti stechiometrici della reazione di pirolisi sono stati utilizzati i 5 bilanci materiali e le 5 equazioni delle rese di pirolisi riportate sopra.
Mettendo a sistema tali equazioni si ottengono le seguenti espressioni per il calcolo dei coefficienti della reazione di pirolisi:
char(daf)(100A)/12 2 / ) A 100 ( aH2(daf) 16 / ) A 100 ( bCH4(daf) 28 / ) 100 ( ) ( A cCOdaf 18 / ) A 100 ( dH2O(daf)
c d
/2 e 1 1 f 1 2 / 1 g
c d
/2 c b m12 1 f 2 d 2 b 4 a 2 n 1 Cinetica di pirolisiIn questo modello la reazione di pirolisi viene descritta con una cinetica del 1° ordine come segue:
rdev = dt dV
= kdev∙V [Wen e Chang, 1979; Teislev, 2006]
con V ≡ MV del carbone secco di partenza.
kdev = s RT E K exp0 s-1
Valori di E e K0 proposti da diversi autori sono riportati in Tab. 4.4. Nel modello è stata
testata la cinetica adottata da Wen e Chaung (1979) e quella di Govin e Shah (1984):
K0 = 1.14∙105 s-1 E/R = 8900 K
33 Tabella 4.4 Proprietà di carboni e parametri cinetici di devolatilizzazione [Antony e Howard,
1976].
Viene introdotto il grado di avanzamento di devolatilizzazione d:
V = V0(1-d)
-dV = kdev∙V∙dt -dV = V0∙ dd
da cui dd /dt = kdev∙ (1-d)
Pertanto a fronte di un rilascio in peso (g) di –dV volatili in dt si avrà per 100g di carbone secco un rilascio di:
a∙dd moli H2
b∙dd moli CH4
34 dd moli CmHn d∙dd moli H2O e∙dd moli CO2 f∙dd moli H2S g∙dd moli N2
e formazione di 2dd moli di C (char) e scomparsa di dd moli di CHONS (carbone
secco privo di ceneri).
Pertanto, se coal è la densità del carbone secco e privo di ceneri in kg/m3bed e V densità di
materia volatile secco in kg/m3bed la relazione che lega le due densità sulla base della reazione
di devolatilizzazione è la seguente:
V = (Mcoal - 2MC)/(Mcoal)∙coal
dove Mcoal = (100 – A) peso molecolare del carbone secco e privo dei cenere in kg/kmole e
MC peso molecolare del char (12 g/mole). Pertanto la velocità di pirolisi del carbone sarà:
Rdev = kdev∙ coal kgcoal/(m3bed∙s)
Da cui, sulla base della stechiometria della reazione di devolatilizzazione, le velocità con cui si formano i prodotti di pirolisi (char e composti volatili) saranno:
Rchar = 2∙MC/Mcoal∙Rdev kg/(m3bed∙s)
RH2 = a∙MH2/Mcoal∙ Rdev
RCH4 = b∙MCH4/Mcoal∙ Rdev
RCO = c∙MCO/Mcoal∙ Rdev
Rtar = MCmHn/Mcoal∙ Rdev
RH2O = d∙MH2O/Mcoal∙ Rdev
RCO2 = e∙MCO2/Mcoal∙ Rdev
RH2S = f∙MH2S/Mcoal∙ Rdev
RN2 = g∙MN2/Mcoal∙ Rdev
Calore di devolatilizzazione
Il calore di devolatilizzazione è dato da:
1 1 1 1 1 2 2 2 4 ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( 0 298 , 0 298 , 0 298 , ) ( 0 298 , 0 298 , 0 298 , 0 298 , 0 298 , 2 0 298 , S N O H C f S H f CO f g O H f CO f CH f H C f C f dev H H f H e H d H c H b H H H n m
35 4 ) (H0f,298 CH =- 74883 J/mole CO f H ) ( 0,298 =- 110577 J/mole ) ( 0 298 , ) 2 (Hf HOg =-241942 J/mole 2 ) (H0f,298 CO =- 393702 J/mole S H f H 2 ) ( 0,298 = -19967 J/mole
I calori di formazione del carbone, del char e del tar possono essere calcolati dai rispettivi calori di combustione: 2 2 2 1 1 1 1 1 ) ( ) ( 2 ) ( ) ( ) ( 0 298 , 1 ) ( 0 298 , 1 0 298 , 1 0 298 , 0 298 , SO f g O H f CO f coal comb S N O H C f H H H H H 2 2 2 2 2 2 2 2 ) ( ) ( 2 ) ( ) ( ) ( 0 298 , 2 ) ( 0 298 , 2 0 298 , 2 0 298 , 0 298 , SO f g O H f CO f char comb S N O H C f H H H H H
Nel caso in cui il char si considera costituito totalmente da carbonio:
2 ) ( ) ( ) (H0f,298 char Hcomb0 ,298 C H0f,298 CO ) ( 0 298 , 0 298 , 0 298 , 0 298 , 2 ( ) 2 2 ) ( ) ( ) ( f C H comb tar f CO Hf HOg n H m H H n m 2 ) (H0f,298 SO = - 296955 J/mole
I calori di combustione del carbone, del char e del tar possono essere calcolati mediante la formula di Dulong [PCI = 80.8 C + 292 (H-O/8) + 22.5 S kcal/kg]:
coal comb H ) ( 0 ,298 =(96.961 + 29.2 (1-21) + 721) ∙4186 J/mole C comb H ) ( 0 ,298 =96.96 ∙4186 = 405875 J/mole tar comb H ) ( 0 298 , =(96.96∙m + 29.2∙n) ∙4186 J/mole
I calori di formazione del carbone, char e tar e il calore di devolatilizzazione diventano :
1 1 1 1 1 ) ( 0,298 H O N S C f H = 121731 + 12601 – 2444621 + 44371 J/mole
36 Char f H ) ( 0,298 = 12173 J/mole Tar f H ) ( 0,298 = 12173m + 1260n 0 298 , dev H = 12173(2 + m - 1) + 1260(2 + n - 1) + 2444621 ─ 44371 ─ 74883b ─ 110577c ─241942d ─ 393702e ─ 19967f
Sulla base di valutazioni effettuate utilizzando vari tipi di carbone i calori di de volatilizzazione sono risultati molto bassi; pertanto tale calore è stato considerato trascurabile ai fini della modellazione [Wei, 1979; Teislev, 2006].
Dipendenza di V0 dalla pressione
La dipendenza di V0 dalla pressione totale P può essere espressa nella forma [Wen e Chaung, 1979] come segue:
1 lnP
V
VP0 10atm
con = 0.066 per carbone bituminoso e 0.1 ≤ P ≤ 50 atm.
Pertanto, con P = 20 atm si ha che MV20atm = MV1atm(1 - 0.066∙ln20),
All’aumentare di P aumenterà la resa in char e si ridurranno le rese dei componenti volatili.
Combustione e gassificazione Reazioni in fase gas
In fase gas sono state considerate le seguenti reazioni di combustione e water gas shift: Reazioni di combustione: 1. CO + ½ O2 kg1 CO2 HRg1 = - 283000 J/mole (Rg1) 2. H2 + ½ O2 kg2 H2O HRg2 = - 241700 J/mole (Rg2) 3. CH4 + 2 O2 kg3 CO2 + 2H2O HRg3 = - 802702 J/mole (Rg3) 4. CmHn + (m/2 + n/4) O2 kg4 mCO2 + n/2 H2O (Rg4) HRg4 (J/mol) = - 393702∙m - 120971∙n – (H0f,298)CmHn (J/mole)
Reazione water-gas shift
37 Cinetica delle reazioni in fase gas
Di seguito vengono illustrate le espressioni cinetiche proposte in letteratura per le reazioni in fase gas considerate nel presente modello. Di seguito con [X] si indica la concentrazione della generica specie X in kmol/m3gas che risulta legata alla densità della generica specie X in fase
gas X,g come segue: [X] = X,g/MX.
1. rg1 (kmol/m3s) = kg1∙[CO][H2O]0.5[O2]0.5 [Yang, 2006]
con kg1 = 1.3∙1014exp(-62700/Tg) m3/(s∙kmole)
Rg1 (kmol/m3beds) = ∙rg1
2. rg2 (kmol/m3s) = kg2∙[H2] [O2] [Mandl et al., 2009]
con kg2 = 8,83∙1011exp(-12005/Tg) m3/(s∙kmole)
Rg2 (kmol/m3beds) = ∙rC2
3. rg3 (kmol/m3s) = kg3∙[CH4] [O2] [Di Blasi., 2004]
con kg3 = 9.2∙106exp(-9650/Tg) Tg m3/(s∙kmole)
Rg3 (kmol/m3beds) = ∙rg3
4. rg4 (kmol/m3s) = kg4∙[CmHn]0,5[O2] [Yang et al., 2006]
con kg4 = 1891.04∙Tg∙exp(-12200/Tg) (m3)0.5/(s∙K∙kmole0.5)
Rg4 (kmol/m3beds) = ∙rg4 5. rwg (kmol/m3s) = kwg∙
eq , wg 2 2 2 K H CO O H COkwg = 2.778∙103∙exp(-1511/Tg) m3/(s∙kmole) [Petersen e Werther, 2005]
Kwg,eq = 0.0265∙exp (3966/Tg) [Di Blasi, 2004; Teislev, 2006,]
38 Reazioni di conversione del char
Nel modello verranno considerate le seguenti reazioni eterogenee: C + (1/)O2 2(1-1/)CO + (2/ - 1)CO2 (Rs1)
è un parametro dipendente dalla temperatura di combustione e può essere valutata con la seguente espressione: s cc cc cc T 6420 exp 2500 k con k 2 2 k 2
[Yang et al.,2006 ;Mandl et al.,2009]
C + CO2 2CO (Rs2)
C + 2H2 CH4 (Rs3)
C + H2O H2 + CO (Rs4)
Le reazioni eterogenee tra la fase solida (char) e quella gas (O2, H2O, H2 e CO2) possono
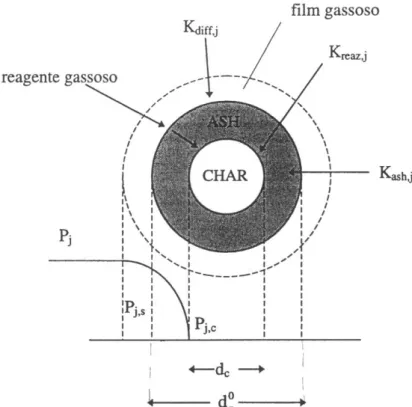
essere descritte mediante due differenti modelli di reazione: Shell Progressive (SP) model e Ash Segregation (AS) model. Il modello scelto per questo modello è lo Shell Progressive (SP)
MODELLO SP
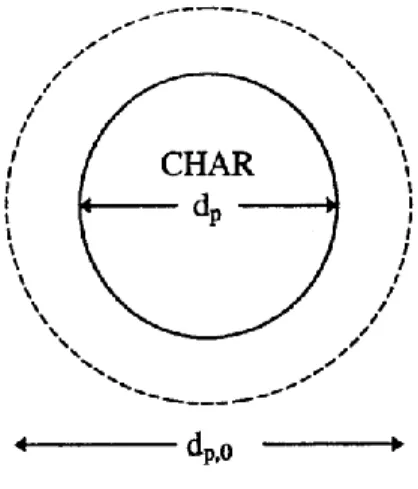
39 Il modello SP prevede che lo strato di cenere formatosi con il procedere delle reazioni eterogenee, char/gas, rimanga aderente alla particella e, pertanto, il diametro esterno della particella rimane costante e uguale a dp0 mentre il diametro del cuore di char, dc, si riduce
all’avanzare delle reazioni. Vengono utilizzate le espressioni cinetiche proposte da Hobbs et
al. (1992) per le 4 reazioni eterogenee considerate e l’ipotesi di esprimere Kash,j = Kdiff,j ∙ash2.5
proposta da vari autori [Wen, 1972; Wen e Chaung, 1979; Hobbs et al., 1992; Monazam e Shadle, 1998].
Pertanto le espressioni della generica reazione Rs,j risulterà in forma generale:
2 j , reaz j , ash j , diff j 2 C j , s K 1 1 1 K 1 K 1 P )) m s /( kg ( r con j = O2, H2O, H2, CO2
dove Pj è la pressione parziale del componente j e =
0 , p c d d p 2 0 , p j , s 3 bed C j , s (kg /(s m )) r d N R Con Np = 3 0 , p d ) 1 ( 6
numero di particelle solide per unità di volume di letto in m-3
si ottiene: 0 , p 2 j , reaz j , ash j , diff j j , s d ) 1 ( 6 K 1 1 1 K 1 K 1 P R
con Kash,j = Kdiff,j ∙ash2.5
dove ash è il grado di vuoto dello strato di cenere, Wang e Wen (1972) suggeriscono valori
compresi tra 0.4 - 0.6. Nel modello è stato adottato un valore intermedio di 0.5.
Si rappresenta con char la densità del char nella particella solida di diametro dc in
kg/m3solido, qundi la massa di una singola particella solida si può esprimere nel seguente
40 mchar (kg) = char∙ d3c 6 con 100 MV A 100 100 U 100 0 0 p char * kg char/m3 e 0 p
densità del carbone tal quale (con umidità).
Nel volume di controllo della cella la quantità totale di char risulta pertanto:
3 0 , p 3 c char * 3 0 , p 3 c char * p char bed 3 char d d ) 1 ( d ) 1 ( 6 d 6 N m ) m / kg ( da cui segue:
)
1
(
d
d
)
1
(
d
d
1/3 char * char p,0 c 1/3 char * char 0 , p c
dc e verranno riaggiornati perché, con il passare del tempo, varia la densità di char presente
nel letto, che viene calcolata tramite l’equazione di continuità del char (vedi equazioni costitutive del modello) la quale compare nelle due equazioni sopra.
Le pressioni parziali dei vari componenti gassosi, Pj (atm), vengono espresse in funzione delle
loro concentrazioni in fase gas, J (kg/m3gas), utilizzando la legge dei gas perfetti.
La viscosità della miscela gassosa è stata calcolata utilizzando la seguente correlazione [Teislev, 2006]: 3 / 2 7 2 g(Ns/m )4.4110 T con T in K.
Per calcolo della diffusività del generico componente j, Dj (m2/s), nella miscela gassosa si può usare la seguente correlazione [Bird, 1998]:
jm m j D x ) x 1 ( Dj con m ≠ j41
B m , c j , c 5 , 0 m j 4167 , 0 m , c j , c 3 / 1 m , c j , c jm T T T A M / 1 M / 1 T T p p D dove x (kmol/kmol), Djm (m2/s), pc (atm), Tc (K) rappresentano rispettivamente, la frazione
molare della specie gassosa nella miscela, interdiffusività per la coppia di gas j e m, la pressione critica, la temperatura critica per i due gas j e m, rispettivamente.
A e B risultano essere:
coppia di gas non polari H2O con gas non polare
A = 2.745∙10-8 3.640∙10-8
B = 1.823 2.334
I risultati ottenuti con questo tipo di calcolo non differiscono molto dai valori medi proposti da Kayal et al. (1997) per sistemi di gassificazione, quindi per evitare complesse correlazioni all’interno del modello e appesantirne i calcoli, si sono adottati i seguenti valori:
4 2 2 O (m /s) 7.22 10 D DCO2(m2/s)6.16104 4 2 O 2 H (m /s) 9.63 10 D 4 2 2 H (m /s) 28.89 10 D MODELLO AS
A titolo informativo riporto anche il modello AS.
42 In questo modello, durante le reazioni di combustione solido/gas e quelle di gassificazione delle particelle di carbone essiccato e devolatilizzato, il diametro della particella dp (= dc) si
riduce e può essere calcolato dall’osservazione che la quantità di cenere in una singola particella rimane costante.
In termini di frazioni in massa (kg/kgsolido): Xcoal + XU + XA + XC = 1 e grado di vuoto del
letto , si hanno le seguenti relazioni: coal = Xcoal∙s; U = XU∙sA = XA∙s; C = XC∙s
con s densità del solido nel letto (kg/m3bed volume), cioè s = p∙(1-) dove:
p densità della particella solida (kg/m3):
0 C C 0 A A 0 U U 0 coal coal p X X X X 1 0 i
densità specifiche delle singole specie (kg/m3); si possono assumere per carbone secco privo di cenere 0coal= 1600 kg/m3; 0U= 1000; 0A= 2000; 0C(carbonio poroso) = 120.
Quindi sulla base della composizione del carbone è possibile valutare p.
Combinando le equazioni sopra si ha:
0 C C 0 A A 0 U U 0 coal coal ) 1 (
con questa equazione algebrica per costante è possibile calcolare di A nel modello AS. Il diametro della particella sarà dato da:
s A A 3 p s A 3 p p A 3 0 , p 0 p 0 A X 6 d 1 X 6 d X 6 d X da cui segue:
1/3 A 0 p 0 A 0 , p p c 1 X d d d 100 0 0 AXA :frazione della cenere nel carbone tal quale (kg/kg)
0 p
:densità della particella di carbone tal quale (kg/m3solido)
In questo caso l’espressione della velocità superficiale deriva dall’espressione vista per il modello SP ponendo = 1 e ponendo nelle equazioni per il calcolo delle Kdiff,j :il diametro
43 La scelta del modello da utilizzare per le reazioni del char (SP o AS) si basa sull’evidenza sperimentale, Hobbs et al. (1992) consigliano di utilizzare il modello SP. Hobbs et al. (1992) osservano che il modello SP, applicato al processo di gassificazione su letto fisso di varie tipologie di carbone, porta a profili di temperatura in fase solida, lungo il reattore, più vicini a quelli sperimentali con temperature massime più basse rispetto al modello AS. Inoltre osservazioni sperimentali condotte da Park e Edgar (1987) sulla combustione di particelle di carbone di dimensione tipiche dei letti fissi mostrano la presenza di uno strato di cenere a supporto del modello SP.
Per le ragioni riportate sopra, la scelta è caduta sul modello SP. Inoltre, attraverso prove preliminari sono state scelte le cinetiche delle varie reazioni sia omogenee che eterogenee.
![Tabella 4.1 Caratteristiche dei carboni [Loison e Chauvin, 1964].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7549259.109192/9.892.164.769.720.1067/tabella-caratteristiche-carboni-loison-chauvin.webp)
![Tabella 4.3 Rese dei prodotti di pirolisi [Loison e Chauvin, 1964].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7549259.109192/10.892.191.754.152.460/tabella-rese-prodotti-pirolisi-loison-chauvin.webp)
![Figura 4.3 Rese dei prodotti di pirolisi [Loison e Chauvin, 1964].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7549259.109192/11.892.200.684.103.1099/figura-rese-prodotti-pirolisi-loison-chauvin.webp)