dedicato a
Chiara, mia Moglie.
Abstract
L’Artroprotesi totale di anca è una procedura di chirurgia ortopedica maggiore molto comune per il trattamento delle patologie degenerative dell’articolazione coxo-‐femorale. L’elevato numero di pazienti coinvolti, il grande impatto della procedura sulla qualità della vita e la gravità delle conseguenze del fallimento, rendono ragione degli sforzi ancora oggi intensamente eseguiti per lo sviluppo di protesi sicure e durature nel tempo. Il successo a lungo termine di un impianto protesico è frutto di delicati meccanismi che si creano tra osso e protesi “interazione osso-‐protesi favorevole”. L’impianto della protesi altera sempre la biomeccanica e la fisiologica trasmissione dei carichi a livello articolare, con conseguente adattamento dell’osso, il quale è sottoposto ad una perdita intraoperatoria acuta e ad una perdita cronica che si manifesterà tardivamente dall’atto chirurgico quale adattamento morfostrutturale alla nuova biomeccanica. Quando gli “adattamenti” sono sfavorevoli e abnormi, la sorte della protesi è segnata e si sviluppa il graduale fallimento dell’impianto. Quindi, il riassorbimento osseo periprotesico che si realizza a medio-‐lungo termine dopo l’impianto della protesi totale di anca, rappresenta l’evento che ne condiziona maggiormente il successo e la “longevità” 1 . Questo rimodellamento è il risultato di una complessa interazione tra fattori meccanici intrinseci (caratteristiche meccaniche e qualità dell’osso prima dell’impianto, forma delle componenti scheletriche che dovranno ospitare la protesi e iper o ipo-‐reattività individuale), estrinseci (materiali di costruzione specialmente in termini di modulo di elasticità, il design, il tipo di fissazione e la presenza di rivestimenti bioattivi) e fattori fisiologici biologici. La perdita ossea periprotesica può essere quindi considerata come un evento inevitabile che condiziona la durata dell’impianto e appare riconducibile principalmente a due meccanismi d’azione distinti ma collegati tra loro: la mobilizzazione asettica per attivazione di processi infiammatori indotta da piccole particelle derivanti dell’usura dei materiali e l’alterazione del normale trasferimento dei carichi che porta al fenomeno dello stress-‐schielding2-‐3. Pur riconoscendo che tali fattori determinanti sono differenti, i due fenomeni presentano, probabilmente,
un denominatore comune, l’osteolisi indotta dalla stimolazione
dell’osteoclastogenesi. Il rimodellamento osseo, che si realizza nei primi mesi successivi all’intervento, è fondamentale per la fissazione e la stabilità
dell’impianto, e rappresenta le fondamenta della possibilità di sopravvivenza a lungo termine della protesi4-‐5-‐6. Ripetuti esami radiografici vengono normalmente
eseguiti per valutare la stabilità di un impianto e per verificare la risposta dell’osso che lo ospita, ma per rilevarne i piccoli cambiamenti, la Rx non è così tanto sensibile7. Lo studio in vivo dei fenomeni di rimodellamento periprotesico vede la
Dexa come la metodica migliore per valutare variazioni di densità ossea in tale sede già in fasi precoci8-‐9. La Dexa (Dual energy X-‐ray absorptiometry) che normalmente è
utilizzata per determinare la densità di massa ossea nella colonna lombare e nella regione prossimale del collo del femore per diagnosticare i disordini metabolici ossei10 , in questi casi è sfruttata ed eseguita con un software di rimozione del metallo “hip prosthesis metal removal” per quantificare le variazioni di massa ossea nelle zone circostanti l’impianto protesico. Negli studi periprotesici, la Dexa si è rivelata quindi l’esame più sensibile e preciso nel quantificare la densità minerale ossea, con un accettabile coefficiente di variabilità, legato alla posizione e alla rotazione dell’anca, inferiore a 3-‐4%. Questo significa che variazioni di densità ossea superiori, in plus o in minus, del 3-‐4% sono legate al processo di rimodellamento. Tenendo presente che l’occhio umano riesce a identificare variazioni di densità radiografica quando queste superano il 30-‐40% della densità iniziale, fatta salva la perfezione tecnica dell’esecuzione della radiografia, ben si comprende come la Densitometria ossea sia la metodica di scelta per valutare il rimodellamento periprotesico. Sulla base di queste conoscenze infatti, abbiamo eseguito, in collaborazione con l’Istituto di Fisiologia Clinica (CNR -‐ Consiglio Nazionale della Ricerca) “G.Monasterio” e dopo approvazione del comitato etico, uno studio prospettico per valutare e quantificare gli effetti a lungo termine che lo stelo protesico (stelo corto a presa metafisaria – modello Metha® BBraun) ha provocato nell’osso circostante. Metodo: in accordo con i criteri di inclusione e di esclusione prestabiliti, 20 pazienti (10 uomini e 10 donne) con età media di 59 anni (range 43-‐74), sono stati arruolati nello studio. Tutti sono stati valutati clinicamente (Harris Hip Score e Womac Score), radiograficamente (Rx in AP e in LL) e tramite Dexa (7 zone di Gruen) secondo un protocollo definito: a T0 (entro sei mesi dall’impianto), a T12 (dopo 12 mesi dall’impianto) a T24 (dopo 24 mesi dall’impianto) a T36 (dopo 36 mesi dall’impianto) a T48 (dopo 48 mesi dall’impianto). Risultati: Harris hip score (HHS) e il Womac score sono migliorati significativamente. Radiograficamente non si sono verificate aree di radiolucenza in tutti i controlli. Abbiamo avuto 2 casi di calcificazioni visibili radiograficamente, ma clinicamente non rilevanti. Nessuno stelo è stato revisionato. Non si sono verificati episodi di lussazione. Non sono state
documentate infezioni. Tutti i pazienti sono stati operati dal solito chirurgo e con la medesima via d’accesso (Accesso postero-‐laterale secondo Gibson-‐Moore). Il BMD periprotesico da T0 a T48 ha mostrato il seguente andamento: (R1 aumentato da 0.73 g/cm2 a 0.73 g/cm2; R2 aumentato da 1.3 g/cm2 a 1.49 g/cm2; R3 aumentato da 1.57 g/cm2 a 1.64 g/cm2; R4 aumentato da 1.57 g/cm2 a 1.59 g/cm2; R5 aumentato
da 1.52 g/cm2 a 1.68 g/cm2; R6 aumentato da 1.29 g/cm2 a 1.52 g/cm2; R7 è lievemente calato da 1.07 g/cm2 a 1.02 g/cm2). Conclusioni: dopo un follow-‐up a
lungo termine di 48 mesi è possibile affermare che il trend del BMD periprotesico è stato positivo in tutte le aree di Gruen ad eccezione della zona del Calcar (R7), evitando il riassorbimento delle aree prossimali metafisarie che potrebbe a lungo, minare la stabilità e la longevità dell’impianto stesso. Si evidenzia inoltre che i cambiamenti della densità ossea periprotesica si sono verificati principalmente dal 24 mese in poi. Risultati statisticamente significativi (Wilcoxon signed-‐ranks test, P<0.05) si sono documentati nelle regioni R5 e R6 a 24, 36 e 48 mesi. Lo stelo Metha® quindi, grazie alla sua presa metafisaria con conservazione del collo, riesce a ridurre il riassorbimento periprotesico prossimale tipico degli steli lunghi tipo Zwiemuller, prospettando una maggior longevità dell’impianto stesso. Purtroppo però, è stata verificata una discreta variazione dei risultati densitometrici in base all’orientamento dello stelo (in varo e in valgo), evidenziandosi una variabilità dei risultati operatore dipendente. Secondo il nostro studio, quindi si può concludere che lo Stelo Metha® BBraun dopo 48 mesi di follow-‐up ha influenzato positivamente il riassorbimento osseo periprotesico specialmente nelle aree più prossimali anche se i valori Dexa possono essere influenzati dal diverso orientamento dello stelo operatore dipendente. Quindi, si dimostra una protesi sicura e presumibilmente longeva, ma difficile e variabile in base alle capacità del chirurgo.
Capitolo 1
Artroprotesi totale di anca
1.1 Introduzione
La protesi d’anca rappresenta uno dei maggiori successi della moderna ortopedia, in quanto questo intervento consente ai pazienti affetti da numerose patologie invalidanti di migliorare la loro qualità di vita ripristinando la funzionalità articolare ed abolendo la sintomatologia dolorosa. In oltre il 70% dei casi, l’indicazione per questo intervento è un processo artrosico-‐degenerativo in fase avanzata, ragione per cui i pazienti principalmente operati sono anziani e l’intervento è per la maggior parte dei casi programmato in elezione11. Infatti, il forte dolore e la conseguente riduzione funzionale dell’articolazione causato dalla coxartrosi, refrattari a misure conservative e farmacologiche, riducono così drasticamente la qualità della vita (in una popolazione sempre più longeva) da spingere paziente e chirurgo ad eseguire la protesi. È quindi ampiamente dimostrato in letteratura che l’artrosi dell’anca rappresenta la maggior causa di dolore e di disabilità nella popolazione anziana e che l’artroprotesi totale ne rappresenta il trattamento più utilizzato ed efficace12-‐13-‐14. L’intervento di sostituzione protesica dell’anca costituisce inoltre una soluzione sempre più diffusa anche per altre numerose patologie invalidanti quali l’artrite reumatoide, la displasia congenita, il morbo di Paget, il trauma, le metastasi, l’osteonecrosi della testa femorale, alcune ripercussioni scheletriche di malattie del collagene e lupus etc. Il paziente trae generalmente notevoli benefici dall’intervento chirurgico, che risolve la sintomatologia dolorosa, restituisce autonomia di movimento e conduce ad un sensibile miglioramento della qualità di vita 15. La chirurgia protesica articolare è fondata sul concetto elementare di sostituire le superfici articolari danneggiate con un nuovo rivestimento, costituito da materiale non biologico (materiali metallici, plastici e ceramici). L’articolazione che storicamente ha aperto l’era della protesica in ortopedia è la coxo-‐femorale e il primo versante articolare su cui è stata progettata una protesi è stato quello femorale (Endoprotesi d’anca). Il vero fondatore della protesica dell’anca è stato il chirurgo inglese Sir John Charnley, che all’inizio degli anni ’60 sviluppò e introdusse i primi modelli di artroprotesi. Il suo contributo scientifico,
assieme alla lungimiranza delle sue intuizioni rimangono tuttora ineguagliate. Egli elaborò studi per il miglioramento dei materiali (scoperta del Polietilene a basso peso molecolare UHMWPE che tutt’oggi è ampiamente utilizzato)16, delle tecniche chirurgiche, della biomeccanica e delle norme da applicare in sala operatoria. Il suo modello era dotato di testina fissa monoblocco da 22 mm, ossia molto piccola rispetto ad una testa femorale umana, in modo tale che il piccolo diametro della testa diminuisse l’usura del polietilene. Per tale motivo chiamò la sua tecnica “Low Friction Arthroplasty”17
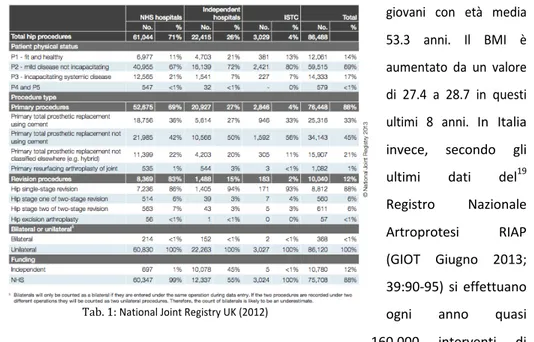
ossia protesi a bassa usura. Pur se con alcune modifiche, questo modello è ancora oggi in uso ed ha quindi il registro e i risultati più lunghi disponibili in letteratura. Berry et al. (2002) hanno pubblicato i dati dopo 25 anni di utiizzo di queste protesi in 461 pazienti impiantati negli anni 1969-‐1971 , e i risultati sono stati abbastanza soddisfacenti. Grazie al continuo perfezionamento della tecnica chirurgica, delle caratteristiche degli impianti e dell’esperienza degli operatori, il numero di interventi è tutt’oggi in continuo aumento e tale tendenza sembra essere destinata ad evolvere ulteriormente18 (PNLG-‐ Revisione sistematica sulle protesi d’anca: affidabilità dell’impianto Programma nazionale per le linee guida Ministero della Salute-‐Pubblicazione Settembre 2004, Aggiornato Settembre 2007). Analizzando infatti i dati più recenti dal National Joint Registry-‐UK (2012) emergono valori che evidenziano in maniera sinificativa l’importanza socio-‐economica che la coxartrosi e l’impianto di PTA hanno nella popolazione. Infatti, il numero totale di procedure chirurgiche eseguite in UK durante il 2012 è stato di 86.488 (Tab. 1), valore in aumento del 7% rispetto al 2011. Di questi, 76.488 sono stati interventi di primo impianto di protesi d’anca e 10.040 sono state revisioni (che sono aumentato rispetto al 2011 passando da 1% a 12%). Di tutti gli interventi di PTA del 2012, 33% sono stati impianti cementati, 43% non cementati, 1% procedure di resurfacing e 2% teste grandi metallo con metallo. L’età media dei pazienti è stata di 67.4 anni (0.2 anni in più rispetto ai report del 2011). Il 60% dei pazienti erano donne. I pazienti che hanno fatto resurfacing erano più
giovani con età media 53.3 anni. Il BMI è aumentato da un valore di 27.4 a 28.7 in questi ultimi 8 anni. In Italia invece, secondo gli ultimi dati del19
Registro Nazionale
Artroprotesi RIAP
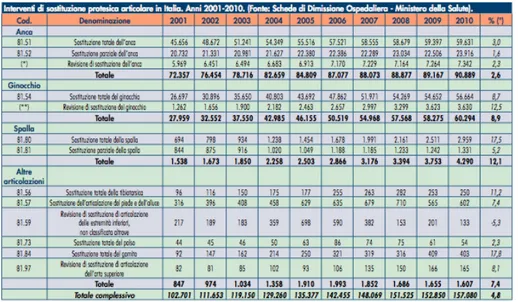
(GIOT Giugno 2013; 39:90-‐95) si effettuano ogni anno quasi 160.000 interventi di artroprotesi in 750 strutture, con un incremento medio annuo di circa il 5% e un costo totale stimato in circa 1 miliardo di euro per il solo DRG (Diagnosis Related Group) chiurgico. Secondo un’analisi del database SDO 2001-‐2010, disponibile presso l’Ufficio di Statistica dell’ISS, per i codici ICd9-‐CM (International Classificat Diseases) articolare, in Italia c’è stato un netto incremento di interventi chirurgici di sostituzione protesica di anca, passando da circa 46.000 primi impianti nel 2001 a circa 60.000 primi impianti nel 2011, con un incremento netto del 3%. (Tab. 2). Dopo aver analizzato attentamente questi dati, appare evidente che l’elevato numero dei pazienti coinvolti, l’impatto sulla qualità della vita e l’impegno sanitario fanno assumere a questo tipo di chirurgia un importante valore e l’eventuale fallimento rappresenta a livello mondiale un problema socio-‐ economico molto grave. Fortunatamente la sostituzione protesica è comunque un intervento di chirurgia ortopedica maggiore con un discreto margine di successo, arrivando secondo alcuni studi ad un indice di soddisfazione dei pazienti maggiore del 90-‐95% dopo 15 anni dall’operazione (Roder et al. 2003). In alcuni casi invece è stato dimostrato comunque un miglior trend di soddisfazione da 6 mesi fino a qualche anno per poi decrescere con l’avazare degli anni. Il monitoraggio degli impianti è, quindi, fondamentale per comprendere i motivi del loro succeso o del loro fallimento ed eventualmente per apportare modifiche che possano migliorarene la longevità.
Tab. 2: SDO 2001-‐2010, disponibile presso l’Ufficio di Statistica dell’ISS, per i codici ICd9-‐CM
1.2 Cenni di biomeccanica dell’anca protesizzata
L’anca umana, durante la normale deambulazione, subisce un carico ciclico che può esercitare sui componenti protesici forze da tre a cinque volte quelle del peso corporeo. Durante le attività più strenue, come la corsa o l'arrampicata, l'articolazione è invece esposta a forze maggiori, fino a dodici volte quelle del peso corporeo. L'analisi biomeccanica di queste forze ha spinto gli ingegneri progettisti a posizionare i componenti protesici in modo tale da massimizzare il sostegno dell'impianto, nel corso di tutto il ciclo di deambulazione. Gli impianti protesici sono pensati per avvicinarsi il più possibile alla funzione dell'articolazione naturale. Tuttavia, le considerazioni inerenti alla tribologia protesica e la loro produzione dettano delle caratteristiche nelle componenti protesiche che possono limitare il raggiungimento di questo obiettivo20. Nel progettare la protesi occorre tenere in considerazione dei requisiti anatomici, funzionali e di biocompatibilità che derivano dallo studio del normale funzionamento dell’articolazione sana e dall’esperienza clinica. Una protesi deve:
• consentire il movimento;
• supportare i carichi a cui è sottoposta l’articolazione mostrando buona resistenza alla fatica meccanica e all’usura garantendo, quindi, un tempo di vita medio-‐lungo; • essere biocompatibile;
• essere tecnologicamente perfetta (possibilità di esser sottoposta a microlavorazioni che consentano la migliore adattabilità al sito d’impianto);
• avere requisiti chirurgici quali: facilità di inserzione e di posizionamento dei componenti, minimizzazione del trauma chirurgico e possibilità di eseguire un re-‐ intervento.
Prima di descrivere in dettaglio i principali fattori che giocano un ruolo importante nella biomeccanica dell’anca, preme fare alcune considerazioni sull’assetto biomeccanico locale che si delinea a seguito dell’impianto di una artroprotesi. Nel caso di sostituzione protesica, i carichi sono trasmessi dalla protesi all’osso e generano in quest’ultimo una distribuzione di tensioni nettamente diversa da quella fisiologica, che dipende dalla configurazione geometrica della protesi, dalle caratteristiche meccaniche dei materiali (rigidità dello stelo) e dal tipo di interfaccia (cementata / non cementata). Le maggiori differenze fra anca normale ed anca protesizzata si verificano soprattutto per il sovvertimento della distribuzione delle
tensioni nella zona prossimo mediale del femore. Nelle articolazioni naturali, le forze vengono trasmesse, attraverso le superfici articolari, le inserzioni muscolari e quelle legamentose, alle strutture dell'osso spongioso e corticale. L'inserimento di una protesi altera questa distribuzione e crea sollecitazioni che non hanno alcun corrispettivo fisiologico. Si determina una vera e propria inversione del normale pattern di distribuzione delle sollecitazioni; infatti, mentre nei femori naturali la massima sollecitazione si ha a livello prossimo-‐mediale, nei femori protesizzati la distribuzione dei carichi è diversa, con una marcata riduzione delle sollecitazioni nella zona prossimo mediale, più accentuata quando la protesi è sprovvista di colletto (riduzione fino al 90%), ed un accentuato incremento al di sotto della punta dello stelo, dove si registrano le sollecitazioni massime. Questo effetto di schermatura del carico, noto come Stress Shielding, dipende dal diverso modulo di elasticità di femore e stelo protesico e si manifesta sotto forma di aree di apposizione e riassorbimento osseo secondo la legge di Wolff21: l’osso si rimodella in funzione delle forze che su di esso si esercitano per cui nelle zone sottoposte a carico si registra l’apposizione di nuovo osso, mentre le aree prive o con minor sollecitazioni vanno incontro a riassorbimento. Questo principio ha un carattere puramente descrittivo e non è stato finora possibile giungere a una determinazione quantitativa della legge stessa. Sono stati però definiti alcuni comportamenti di massima che si sviluppano successivamente all’inserimento dello stelo:
• Le deformazioni longitudinali, nella regione ossea prossimo-‐mediale, sono inferiori a quelle fisiologiche, mentre sono superiori nella parte distale; questo effetto è più evidente nelle protesi non cementate ed in particolare in quelle con rivestimento poroso esteso su tutta la superficie dello stelo, con le quali si assiste spesso ad un’ipertrofia della corticale;
• Le deformazioni circonferenziali, sono più elevate, rispetto ai valori "fisiologici" (negli steli a press-‐fit si ha un aumento delle tensioni circonferenziali pari al 125%) e, al contrario di quelle longitudinali, la loro distribuzione non sembra modificabile variando la rigidezza dello stelo;
• Sono presenti elevate sollecitazioni torsionali intorno all'asse longitudinale della protesi e l’influenza del peso del paziente sulle sollecitazioni nella parte prossimale è superiore a quello di altri parametri;
• All'interfaccia osso-‐impianto si hanno sollecitazioni di taglio e compressione. Nelle protesi con finitura superficiale, le sollecitazioni di taglio vengono equilibrate dall’azione dei microincastri, ed in quelle con superficie liscia dall’attrito, con un coefficiente stimato intorno a 0,5. Se presenti, le sollecitazioni di trazione tendono a
separare le superfici contigue dell’osso e della protesi , favorendo il flusso di liquidi e la disseminazione di particelle di usura. A monte di ogni tipo di interazione meccanica protesi-‐osso ci sono i carichi statici e quelli dinamici che agiscono sull’articolazione dell’anca: il peso del corpo è il principale determinante dei carichi statici. I fattori che condizionano l’entità di questi carichi sono rappresentati essenzialmente dal sistema di fissazione delle componenti protesiche (protesi cementate e non cementate), dalla forma dell’impianto e dalle caratteristiche morfometriche dei segmenti scheletrici che ospitano la protesi. I carichi dinamici si sovrappongono a quelli statici durante il movimento articolare modificandone i vettori, non solo in termini di valore assoluto, ma anche di direzione.
1.3 Fissazione delle componenti protesiche
La modalità con cui si ottiene l’ancoraggio dei componenti protesici all’osso incide sulla distribuzione delle forze all’interfaccia osso-‐protesi e, quindi, sulla risposta dell’osso alle nuove condizioni di carico. Esistono due modalità di fissare una protesi all’osso: con cemento – a press-‐fit22-‐23.
a. Cementazione: utilizza quindi il Metilmetacrilato (cemento osseo: Il nome
cemento per ossa indica una classe di materiali a base di Polimetilmetacrilato PMMA ottenuto per polimerizzazione radicalica del Metilmetacrilato MMA utilizzando il Perossido di Benzoile come iniziatore radicalico.) e sfrutta le variazioni delle proprietà fisiche della resina nel suo processo di polimerizzazione; esso viene inserito nella sede ossea che deve ricevere la componente protesica quando è ancora plastico e malleabile, quindi viene introdotta la parte protesica e il cemento viene lasciato indurire. Così, il cemento riempie totalmente lo spazio tra protesi e osso, penetrando anche negli anfratti e nelle irregolarità dell’osso in rapporto alla pressione esercitata al momento della sua introduzione. L’uso del cemento permette una fissazione immediata, in quanto, la presa sull’osso circostante è ampia e diffusa e le forze meccaniche possono essere trasferite dalla protesi alla leva scheletrica. Il cemento quindi non è un materiale adesivo: non aderisce né all’osso, né al metallo dello stelo; il suo impiego primario è quello di sostanza di riempimento negli spazi fra protesi e osso con lo scopo di migliorare la distribuzione degli sforzi trasmessi durante il carico e di assorbire gli urti. La migliore distribuzione
degli sforzi trasmessi riduce la concentrazione degli sforzi stessi e la conseguente necrosi ossea che si osserva con una protesi non cementata mal impiantata. Un secondo scopo dell’uso del cemento è ridurre il dolore dovuto ai micromovimenti relativi tra protesi ed osso. La fissazione immediata e la massimizzazione della superficie di contatto consentono un’ottima stabilizzazione primaria che permette il carico precoce sull’articolazione.
Dato che l’osso e tessuto vivo vascolarizzato, appare evidente che l’inserimento del cemento determina sempre e inevitabilmente un danno per il tessuto fino a formare zone evidenti di necrosi. Queste aree sofferenti e l’alterazione della biomeccanica e del trasferimento dei fisiologici carichi, determinano delle modificazioni dell’organizzazione dell’osso intorno all’impianto, che si svolgono in un arco temporale lungo, fino a 3-‐5 anni dall’intervento. A queste problematiche si sommano due aspetti che bisogna considerare perché possono compromettere la stabilità futura e la resistenza alla fatica meccanica di una protesi cementata. I cementi commerciali hanno ritiri volumetrici dello 0,5-‐1% durante l’indurimento e nei successivi 30 giorni subiscono una espansione volumetrica del 1-‐2% a causa dell’assorbimento di acqua e di lipidi. Qualora il ritiro volumetrico sia maggiore, l’ancoraggio atteso della protesi può venir meno. L’altro aspetto da considerare è la presenza di porosità che dipende molto dalla modalità di mescolamento della componente solida con quella liquida in quanto tale operazione favorisce l’intrappolamento di aria nella miscela. In genere le porosità riducono le proprietà meccaniche del cemento fra cui la resistenza alla fatica meccanica.
b. Press-‐Fit: questa modalità di fissazione è caratterizzata dall’inserimento diretto
della componente protesica (a pressione) realizzando un contatto diretto tra protesi e osso senza interposizione di cemento. Anche con questa tecnica comunque si sviluppa un danno tessutale iniziale, una necrosi ed un rimodellamento fino al raggiungimento di un equilibrio. Questo incastro avviene sia a livello macroscopico (design della protesi) che microscopico (trattamento delle superfici delle componenti). La quantità di superficie dello stelo a contatto con l’osso è un aspetto importante da valutare in quanto essa condiziona non solo la stabilità primaria ma anche la stabilità secondaria poiché si è visto che superficie rugose o porose favoriscono l’apposizione di nuovo osso intorno alla protesi, processo fondamentale per l’osteointegrazione. La stabilità primaria di una protesi non cementata (anche detta protesi a fissazione diretta) è influenzata dalla forma dello stelo, dalla finitura superficiale della protesi e dall’abilità del chirurgo. L’ancoraggio di questo tipo di
protesi richiede una congruenza anatomica difficile da realizzare sia nel canale midollare, sia sulle superfici di osteotomia; questo spiega l’importanza di un planning preoperatorio che guidi, in primo luogo, alla corretta scelta del modello e della taglia della protesi da impiantare. Il particolare meccanismo che permette l’ancoraggio delle protesi non cementate è rappresentato dalla presenza di micro-‐ incastri all’interfaccia osso-‐protesi che, aumentando l’attrito tra le due superfici, contrasta la generazione di movimenti relativi. I tipi di finitura superficiale si basano su due diversi meccanismi che influenzano rispettivamente la stabilità primaria e secondaria:
• stabilità meccanica iniziale (press-‐fit) per ottenere una salda fissazione iniziale che si stabilizza successivamente per l’interposizione di tessuto fibroso. L’ancoraggio dello stelo deriva proprio dai micro-‐incastri tra la superficie di osso e protesi;
• apposizione di osso neoformato (bone ingrowth) sulla superficie porosa di uno stelo metallico. È stato dimostrato che gli osteoblasti preferibilmente proliferano, si differenziano e producono la matrice mineralizzata negli alveoli e nelle scanalature di superfici non biologiche, di dimensioni simili a quelle prodotte dagli osteoclasti in vitro.
1.4 Stabilità primaria e secondaria delle protesi cementate e non
cementate
L’osteointegrazione delle protesi a fissazione diretta presenta aspetti analoghi al processo ripartivo attivato nelle fratture. La differenza fondamentale tra i due eventi è che l’osteointegrazione non unisce due parti di osso, ma un osso alla superficie di un impianto per cui acquistano un’importanza preponderante il materiale (deve essere bioinerte, come il titanio), la superficie e la forma dell’impianto. Una volta attivata, l’osteointegrazione segue uno schema comune in cui si individuano tre stadi:
Formazione di osso fibroso: Il primo tessuto osseo che si forma è il cosiddetto osso
fibroso. Si tratta di un tipo primitivo di tessuto osseo caratterizzato dall’orientamento casuale delle fibrille collagene e da una densità minerale relativamente bassa. La sua peculiarità è che cresce ad una velocità relativamente
elevata, formando un’impalcatura di fibrille e lamine. La formazione di osso fibroso è il processo predominante nelle prime 4-‐6 settimane dopo l’intervento chirurgico.
Adattamento della massa ossea al carico: Nel secondo mese dopo l’intervento,
l’osso acquista maggiore resistenza grazie alla deposizione di tessuto osseo lamellare ed a fibre parallele. Nessuno di questi due tipi di tessuto osseo è in grado di formare un’impalcatura come l’osso fibroso e quindi crescono semplicemente depositandosi su un substrato solido preesistente. Ci sono tre superfici che possono servire come substrato per la deposizione dell’osso a fibre parallele e lamellare: l’osso fibroso, formatosi nel primo stadio dell’ osteointegrazione, una superficie ossea preesistente od intatta e la superficie dell’impianto.
Adattamento della struttura ossea al carico: E’ questa la fase in cui si ha
rimodellamento osseo che rappresenta l’ultimo stadio dell’ osteointegrazione. Esso inizia nel terzo mese circa e, dopo diverse settimane di attività sempre più intensa, rallenta per poi continuare per tutta la vita. Il rimodellamento osseo inizia con il riassorbimento osteoclastico, seguito dalla deposizione di osso lamellare. Dopo 2-‐4 mesi si è formato il nuovo osteone. In uno scheletro sano il riassorbimento e la formazione di tessuto osseo non sono solo accoppiati ma anche in equilibrio, così da mantenere costante la massa scheletrica per un lungo periodo di tempo. Se si determina uno sbilanciamento tra i due, a favore del riassorbimento, si ha un deficit locale di tessuto osseo che può progredire fino a determinare il quadro tipico dell’osteoporosi.
Questa breve descrizione della biologia dell’osteointegrazione e del rimodellamento ha la finalità di introdurre un concetto alla base della stabilità sia delle protesi cementate che non cementate. Sebbene la risposta iniziale dell’osso ai due tipi di impianto è diversa, in quanto il “bone ingrowth” si osserva esclusivamente negli impianti non cementati, nelle fasi successive l’organizzazione in osso lamellare segue percorsi identici nelle due situazioni. Questo fatto è perfettamente coerente con il principio che il rimodellamento è un adattamento della struttura ossea alle forze meccaniche che su di essa agiscono ed appare, pertanto, a distanza di tempo, analogo nei due tipi di fissazione. Ne deriva che la valutazione del supporto strutturale deve far riferimento all’organizzazione complessiva della struttura lamellare del segmento scheletrico che supporta l’impianto e questo vale per entrambi i tipi di protesi. Avere un contatto osso-‐stelo o osso-‐cemento molto esteso non vuol dire scongiurare il rischio di mobilizzazione della protesi perché la misura della stabilità di una protesi è data dal numero e dalla consistenza dei setti ossei che uniscono la superficie endostale con la superficie dell’impianto. Non va dimenticato
inoltre, che la densità ossea periprotesica risultante dall’adattamento dell’osso alle sollecitazioni meccaniche trasmesse dall’impianto, non è immutabile nel tempo: una modificazione del metabolismo dell’osso (osteoporosi, patologie primitive o secondarie) o variazioni delle forze applicate (peso, attività fisica…) possono modificare questo equilibrio dinamico, fino al cedimento meccanico. Questo spiega il razionale dell’utilizzo della DEXA nel follow-‐up degli impianti protesici.
Riassumendo si può concludere che la stabilità primaria è ottenuta al momento dell’impianto, mentre la stabilità secondaria è il risultato della riparazione e del rimodellamento osseo che avvengono durante e dopo il processo di guarigione24. I due tipi di protesi differiscono per i meccanismi che determinano la stabilità primaria25: l’uso del cemento comporta una fissazione immediata, ottenuta con la solidificazione del PMMA. La stabilità primaria delle protesi a fissazione biologica è garantita principalmente dalla forma dello stelo e dai micro-‐incastri osso-‐protesi dipendenti dalla finitura superficiale della protesi; non a caso per questo tipo di protesi si parla di fissazione per incastro (press-‐fit), il quale sia a livello macroscopico (disegno della protesi) che microscopico (trattamento di superficie delle componenti). Fig.1.
Fig. 1 Protesi Cementata Protesi a Press-‐Fit
Capitolo 2
Riassorbimento osseo periprotesico
2.1 Cause di Riassorbimento periprotesico (a livello dello stelo)
La perdita ossea periprotesica e di conseguenza il maggior rischio di fallimento delle protesi di anca (mobilizzazione per cause non infettive dello stelo) è riconducibile principalmente a due meccanismi di azione: Stress shielding e Wear debris.
Stress Shielding -‐ le modificazioni della densità ossea periprotesica che si realizzano
dopo un’artroprotesi d’anca sono l’espressione della risposta dell’osso all’alterazione della distribuzione dei carichi che lo stelo determina sull’ospite. Tale fenomeno è legato alle caratteristiche osso-‐impianto e il riassorbimento osseo che ne deriva è espressione della “legge di Wolff”.
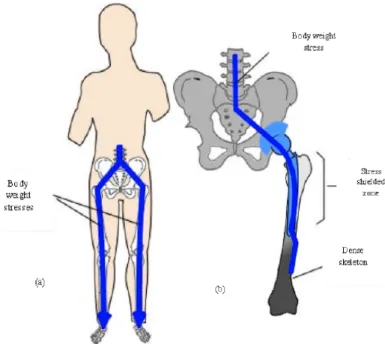
Per Stress Shielding si intende la riduzione della densità ossea (BMD) periprotesica (valutabile principalmente con DEXA) risultante dalla perdita delle normali stimolazioni sull’osso che ospita l’impianto per un processo definito “Load Transfer”26: quando è inserita la protesi, i carichi sono trasmessi dallo stelo
(maggiore rigidezza) e non più dalla porzione prossimale del femore (Fig. 2) e questo alterato trasferimento delle sollecitazioni e degli stimoli meccanici, indebolisce la porzione prossimale metafisaria (riassorbimento osseo) rendendo lo stelo più debole e soggetto a mobilizzazione27.
Nei primi mesi successivi all’impianto, si sviluppa un rimodellamento osseo che appare fondamentale per la fissazione e la stabilità, rappresentando il punto fondamentale per la sopravvivenza e la longevità dell’impianto. Nonostante il crescente interesse verso la definizione dei fenomeni alla base di questi meccanismi, non è ancora chiaro il rapporto tra le caratteristiche biomeccaniche della protesi, del femore che lo ospita e la sua perdita ossea. In modo particolare l’attenzione è stata concentrata sul modulo di rigidezza del femore e delle componenti protesiche non cementate, per individuare una correlazione tra queste e l’entità del rimodellamento osseo28.
A questo proposito, studi recenti29 hanno dimostrato che negli impianti non cementati, la rigidezza assiale del femore è il principale fattore predittivo della perdita ossea: ciò potrebbe quindi dipendere dalla differenza che esiste tra la rigidezza assiale dello stelo e quella dell’osso ospite, mentre la rigidezza antero-‐ posteriore e medio-‐laterale dello stelo e del femore sembrano essere molto più simili.
Nelle protesi cementate invece, la perdita ossea non è dovuta alla rigidezza assiale del femore più di quanto non lo siano gli altri parametri30. Per quanto riguarda i
meccanismi di traduzione del segnale da meccanico (Stress Shielding) in cellulare, l’ipotesi più credibile è che lo stimolo meccanico si traduca in segnale elettrico a livello degli osteociti i quali, lavorando come network intraosseo, andrebbero poi ad attivare le linee cellulari osteoblastiche a seconda delle necessità e delle caratteristiche dell’impianto. Attualmente sono stati meglio identificati alcuni aspetti di questo fenomeno come i meccanismi cellulari alla base dell’attivazione dell’osteoclastogenesi che sembra essere indotta dall’attivazione dell’asse RANK-‐ RANKL. La perdita ossea che si realizza inoltre inizia dal 3 mese dopo l’intervento e tende a stabilizzarsi a 1 anno ma modificazioni dell’organizzazione ossea periprotesica si svolgono in un tempo abbastanza lungo, fino a 3-‐5 anni dall’intervento.
Fig. 2: a) distribuzione fisiologica delle forze di carico. B) trasferimento delle forze di carico alla protesi.
Infine vorrei precisare che dopo posizionamento dello stelo protesico, la sollecitazioni che si tramettono e la distribuzione dei carichi (influenzata dai diversi moduli di elasticità) possono determinare oltre che il fenomeno dello stress shielding anche altri meccanismi biomeccanici come: Load Sharing, detto anche condivisione di carico che è una ripartizione del peso tra l’osso e la protesi, in modo tale che la sua distribuzione sia funzione diretta della rigidità dei due materiali coinvolti; Stress-‐bypass che è una situazione in cui il carico viene completamente trasferito distalmente e oltre a determinare un riassorbimento prossimale crea un effetto punta distale doloroso per il paziente.
Mobilizzazione asettica 31-‐32-‐33 -‐ Razione infiammatoria indotta da usura dei materiali (Schema 1): L’osteolisi periprotesica indotta dai materiali di usura ricopre, quindi, un ruolo dominante come fattore responsabile del fallimento clinico degli impianti, sia perché è la principale causa della mobilizzazione delle componenti sul versante acetabolare e su quello femorale, sia perché è il più importante processo correlato alle fratture patologiche del femore e dell’acetabolo dopo artroprotesi di anca. Eventi, questi, che rendono imprescindibile una revisione chirurgica. I fenomeni a essa correlati generalmente cominciano a manifestarsi a 5 anni dall’intervento chirurgico. La sua incidenza è in aumento progressivo ed è stato calcolato che oltre il 25% di tutti gli impianti protesici mostra segni di mobilizzazione asettica. In generale i materiali utilizzati per la costruzione delle protesi articolari e impiantati con funzione sostitutiva di parti dell’apparato locomotore sono inerti verso le cellule; infatti, prima dell’utilizzazione in campo clinico essi vengono te-‐ stati per valutare la reattività biologica delle cellule e dei tessuti verso gli stessi (prove di biocompatibilità). Il problema della reazione da corpo estraneo non è, perciò, abitualmente collegato alla tossicità nonostante per situazioni specifiche legate al rilascio ionico delle particelle metalliche, anche questo aspetto sia stato documentato in colture in vitro di fibroblasti. Il punto principale attorno al quale si sviluppa tutta la problematica della reazione da corpo estraneo è rappresentato dalla fagocitosi, vale a dire dalla capacità dell’organismo d’includere all’interno del citoplasma specifiche cellule sostanze o corpuscoli non riconosciuti come costituenti propri dello stesso organismo. La finalità della fagocitosi è la degradazione enzimatica del materiale estraneo con l’eliminazione o la riutilizzazione delle subunità più semplici quali amminoacidi, zuccheri ecc. Nel caso delle particelle di usura prodotte dalle protesi, nessuna di esse può essere degradata o ridotta a unità semplici dagli enzimi delle cellule, pertanto esse attivano una produzione
enzimatica che si autoalimenta e si amplifica nel tempo producendo la necrosi per autolisi delle stesse cellule deputate alla fagocitosi. La liberazione degli enzimi lisosomiali nell’ambiente pericellulare porta alla modificazione dei tessuti interessati dal fenomeno: nel caso del tessuto osseo, la risposta alla carica enzimatica è svolta dai macrofagi per autolisi e il riassorbimento della matrice ossea cui fa riferimento il termine “osteolisi” è comunemente usato per descrivere i più tipici aspetti radiologici della mobilizzazione delle protesi articolari. Questo meccanismo è alla base della maggior parte delle mobilizzazioni asettiche e non ha nulla a che fare con il processo infiammatorio che caratterizza tanta parte della patologia umana: infatti, lo studio dei tessuti periprotesici dopo revisione per mobilizzazione asettica evidenzia un’estesa proliferazione di macrofagi che hanno fagocitato le particelle d’usura e che infiltrano i tessuti connettivi periprotesici, siano essi l’osso, i vasi, il tessuto fibroso o quello adiposo, ma non si osservano le cellule tipiche dell’infiammazione, vale a dire i polimorfonucleati neutrofili e i linfociti. Quando, occasionalmente, si osservano accumuli locali di linfociti o franchi infiltrati purulenti, si deve sospettare un’infezione batterica sovrapposta, evento a rischio elevato negli accumuli di tessuto di granulazione da corpo estraneo.
Schema 1:Fagocitosi delle particelle di usura e tentativo di digestione enzimatica da parte delle cellule fagocitarie (Macrofagi)
È possibile analizzare alcuni aspetti della reazione da corpo estraneo alle particelle di usura che permettono una comprensione più approfondita di quanto osservato in campo clinico:
§ La possibilità da parte di un macrofago di fagocitare una particella e di includerla all’interno dei lisosomi per tentare la degradazione enzimatica è condizionata dalle dimensioni della stessa: infatti se questa supera le dimensioni del macrofago la si troverà inclusa nel citoplasma di una cellula gigante, ma comunque in posizione extralisosomiale. Se le sue dimensioni sono ancora superiori essa verrà incapsulata da una membrana fibrosa che in genere comprende anche cellule giganti. In entrambi i casi non vi è la stimolazione di produzione enzimatica. La conseguenza è che solo le particelle di piccole dimensioni e compatibili per l’inclusione lisosomiale sono veramente attivatrici del processo osteolitico sull’osso.
§ A parità di volume usurato delle componenti protesiche il numero di particelle è inversamente proporzionale alla loro dimensione, pertanto le particelle più piccole attiveranno un numero più alto di macrofagi.
§ Esiste un meccanismo di drenaggio tramite i vasi linfatici dell’ambiente periarticolare (protesizzato) ai linfonodi, alla milza e al fegato, per cui una limitata e lenta produzione di particelle di usura può essere compensata e drenata per via linfatica evitando l’accumulo locale, che è il responsabile dell’osteolisi e del deterioramento della fissazione meccanica.
§ Il meccanismo di produzione delle particelle di usura deve essere primariamente ricercato alle superfici di scivolamento tra le componenti protesiche e segue le leggi della fisica. Tuttavia, l’elaborato assemblaggio delle componenti degli inserti e delle modalità di fissazione ha moltiplicato le possibili zone di origine di aree di usura o corrosione, spesso non individuabili all’analisi radiografica anche più elaborata, ma che divengono evidenti all’osservazione delle componenti rimosse . § Una volta innescata la produzione di particelle di usura in una protesi articolare è
irreversibile; solo la riduzione dell’attività e delle sollecitazioni meccaniche potrebbero influire sull’evoluzione del processo, ipotesi però teorica poiché significa annullare i vantaggi acquisiti con l’intervento.
Analizzando nel dettaglio il fenomeno della mobilizzazione asettica provocata da reazione infiammatoria indotta da materiale di usura, è possibile definire:
Caratteristiche morfologiche ed istologiche34-‐49: il tessuto presente nelle zone di
polimetilmetacrilato, mentre è caratterizzato dalla presenza di macrofagi e cellule giganti da corpo estraneo sul versante che invade l’osso corticale. La componente cellulare appare molto varia con presenza di istiociti, cellule giganti, linfociti, plasmacellule e neutrofili. Le particelle di cemento acrilico e i frammenti di polietilene sono inglobati negli istiociti/macrofagi o nelle cellule giganti che realizzano foci di attività cellulare all’interno della membrana periprotesica (26). Dalla continua fagocitosi dei frammenti di usura deriva la produzione, da parte del-‐ le cellule attivate, di citochine proinfiammatorie ed enzimi proteolitici, che si ritiene possano danneggiare l’osso e la cartilagine e attivare cellule del sistema immunitario, in particolar modo l’interleuchina 1 (IL-‐1) e il tumor necrosis factor α (TNFα), che so-‐ no potenti mediatori del riassorbimento osseo (27), e citochine attivate dal sistema immunitario più recentemente identificate come il PDGF e IL-‐11 (28). Queste citochine agiscono come segnali di attivazione per i linfociti, dai quali derivano interleuchina 2 (IL-‐2), interleuchina 6 (IL-‐6) e interferone β (IFN-‐β), che possono influenzare l’attività degli osteoclasti e il rimodellamento osseo (29). Infine è importante sottolineare che un altro fattore fondamentale per l’entità della risposta infiammatoria sono le dimensioni delle particelle di usura; infatti piccole particelle (dimensione < 0.5 μm) hanno maggior capacità di provocare reazione infiammatoria. Meccanismo cellulare50-‐51: Normalmente la massa ossea è frutto di
un equilibro esistente tra apposizione di osso (osteoblasti) e suo riassorbimento (osteoclasti). Il rilascio di mediatori pro-‐infiammatori (sviluppati nei tessuti a causa dei detriti di usura) quindi, determina uno stato di infiammazione cronica che altera il sistema RANKL e l’osteoclastogenesi modificando in modo significativo il fissaggio dell’impianto. Quindi si può concludere che la perdita ossea periprotesica che si realizza a breve e a lungo termine con i fenomeni dello stress shielding e della lisi da detriti, è l’evento che maggiormente condiziona la “longevità” di un impianto protesico e quindi la buona riuscita dell’intevento. La valutazione della ridistribuzione della densità minerale ossea è , quindi, un dato importantissimo per la diagnosi precoce dei processi clinicamente (Albanese et al. 2009) inizialmente silenti che potranno portare alla mobilizzazione delle componenti protesiche.