Materiali e metodi
2
MATERIALI E METODI
2.1
Valutazione dell’accrescimento degli isolati di Trichoderma spp.
Per la stesura di questa tesi è stato utilizzato un numero rappresentativo di isolati
appartenenti al genere Trichoderma (circa 150), provenienti dalla collezione del
Dipartimento di Coltivazione e Difesa delle Specie Legnose “G. Scaramuzzi” (DCDSL),
Sezione di Patologia Vegetale, Facoltà di Agraria (Università di Pisa), e un isolato
fitopatogeno di Rhizoctonia solani (RT32, AG-4, isolato da tabacco),
gentilmente fornito
dal Dr. Rosario Nicoletti (Istituto Sperimentale per il Tabacco, Scafati), (Fig. 2.1).
Fig. 2.1 – Piastre Petri contenenti un isolato di T. harzianum (a sinistra) ed un isolato di R. solani (a destra).
I diversi isolati di Trichoderma spp. sono stati analizzati per la loro capacità di crescita a
24°C, temperatura ottimale di R. solani, con cui sono stati confrontati. Dischi di PDA
(Potato Dextrose Agar, Difco, 39 g L
-1), di 8 mm di diametro, sono stati prelevati
sterilmente dai margini delle colonie in attivo accrescimento e posizionati al centro di
nuove piastre contenenti terreno PDA. Le piastre contenenti ciascun ceppo di
Trichoderma sono state incubate al buio a 24°C (3 repliche per ciascun ceppo). Le
Materiali e metodi
misure degli accrescimenti sono state fatte ogni 8 ore misurando il diametro della colonia
e la velocità di crescita è stata espressa in mm h
-1. I 15 isolati di Trichoderma che hanno
mostrato la velocità di crescita maggiore, sono stati utilizzati in successivi esperimenti, al
fine di valutarne l’attività come agenti di controllo biologico e studiarne i meccanismi
d’azione nei confronti di R. solani. Tutti gli isolati fungini usati in questo lavoro sono
stati conservati sott’olio minerale a 4°C su PDA.
2.2
Valutazione dell’attività di biocontrollo del “damping off” causato da R. solani
da parte dei quindici isolati di Trichoderma spp.
I quindici ceppi di Trichoderma (T390, T4917, T4940, T4955, T4956, T5864, T5865,
T6736, T6741, T6744, T6753, T6755, T6762, T6772 e T6776), selezionati in base alla
velocità di crescita a 24°C, sono stati saggiati in due esperimenti indipendenti condotti al
fine di valutare la loro abilità di riduzione della moria dei semenzali su ravanello
(Raphanus sativus L.) in presenza di R. solani nel terreno. Le due prove sono state
eseguite utilizzando terriccio commerciale da invaso non sterile. Nella tabella di seguito
sono riportati gli isolati fungini utilizzati nelle due prove .
Specie N. Isolato Matrice
T. viride 4955 T. harzianum 6753 Colignola T. harzianum 6744 Colignola T. harzianum 6755 Colignola T. spDAOM230011 5865
T. aureoviride 390 Terreno (San Rossore)
T. harzianum 4917 T. harzianum 4956 Colignola T.spDAOM167068 5864 T. harzianum 4940 Colignola T. harzianum 6776 Colignola T. harzianum 6741 Colignola
Materiali e metodi
T. harzianum 6762 Colignola
T. harzianum 6736 Colignola
T. harzianum 6772 Colignola
Tab. 2.1 - Elenco degli isolati di Trichoderma spp.
Nella prova 1, il terriccio è stato inoculato contemporaneamente con ciascuna
combinazione antagonista-patogeno, mentre nella prova 2 l’inoculo di R. solani è
avvenuto tre giorni dopo l’inoculo di Trichoderma.
Per l’inoculo, Trichoderma spp. e R. solani sono stati fatti crescere su PDA per una
settimana a 24°C e successivamente metà piastra Petri di ogni isolato fungino è stata
addizionata a 1500g di terriccio non sterile. In ciascun vaso (10cm x 10cm x 10cm)
contenente il terriccio inoculato, sono stati seminati 10 semi di ravanello. I vasi sono stati
incubati a 24°C in alternanza luce-buio (12 h/12 h) e dopo 15 giorni sono state registrate
le percentuali di emergenza e di piantine sane. In entrambe le prove sono state allestite tre
repliche per ciascuna combinazione antagonista-patogeno. Come controlli sono stati usati
vasi contenenti terriccio inoculato solo con R. solani, terriccio inoculato con ciascun
ceppo antagonista e terriccio non inoculato, (3 repliche per ciascuna tesi). Nella tabella
2.2 è riportata la composizione del terriccio Klasmon Potground H impiegato nelle prove
di biocontrollo.
Carbonio di origine biologica 35%
Azoto organico 0,8%
Sostanza organica 90%
pH (CaCl2) 5,0-6,0
pH (H20)) 5,5-6,5
C.E. 40 mS m-1(+ 25%)
Ammontare del fertilizzante aggiunto NPK 14:16:18 1,5 Kg m-3
Tab. 2.2 – Composizione Klasmon Potground H; gli elementi sono riportati in percentuale in peso sulla sostanza secca. Si tratta di un substrato specifico per la semina in vassoi alveolati di colture orticole, è a base di torba neutra ottenuta da torbe nere e torbe bionde di sfagno.
Materiali e metodi
2.3
Valutazione della Capacità Saprofitica Competitita (CSA) e controllo della
malattia
In base ai risultati ottenuti dagli esperimenti di biocontrollo, i quattro isolati di
Trichoderma harzianum (T4040, T4956, T6741 e T6776), selezionati sulla base della
capacità di permettere un’emergenza delle piantine di ravanello superiore al 70% in
presenza del ceppo patogeno di R. solani, sono stati utilizzati in un test di competizione
per il substrato, utilizzando pezzetti di paglia come esca, in accordo con il metodo
ottenuto dalla modificazione del protocollo di Cambridge (Ahmad and Baker, 1987;
Vannacci et al., 1989). La paglia, proveniente da piante di frumento mature e sane
(Triticum aestivum L.), è stata gentilmente fornita dal Centro Interdipartimentale di
Ricerche Agro-Ambientali “E. Avanzi” (Pisa) e conservata in condizioni di aria secca per
sei mesi. In esperimenti precedenti (di cui non si mostrano i dati), sulla paglia era stata
accertata la presenza di un microbiota fungino comprendente ceppi indigeni di
Trichoderma spp. Sulla base di queste informazioni, la paglia è stata immersa in una
piccola quantità di acqua di rubinetto e sterilizzata per due volte in autoclave per 20
minuti a 121°C, dopo essere stata tagliata in segmenti di 2 cm di lunghezza in
corrispondenza del nodo. Ciascuna combinazione isolato-antagonista è stata inoculata in
terriccio sterilizzato, come descritto nel § 2.2. Trascorse 24 ore dall’inoculo, 80g di
terriccio sono stati trasferiti in bicchieri di plastica (7,5cm diametro superiore, 8,5cm
altezza, 4,5cm diametro inferiore) e sedici unità di paglia sterile di frumento sono state
interrate casualmente in ciascun bicchiere. La prova è stata condotta con tre repliche per
ciascuna combinazione antagonista-patogeno. Come controllo è stato usato terriccio
inoculato soltanto con R. solani, (3 repliche). Al terreno è stata aggiunta acqua sterile fino
al raggiungimento della capacità di campo (precedentemente calcolata) e ciascun
Materiali e metodi
bicchiere, al fine di mantenerne il livello di umidità, è stato coperto con metà piastra
Petri. I bicchieri sono stati incubati a 24°C in alternanza luce-buio (12 h/12 h) per 16
giorni. Dopo 48 ore, ogni due giorni, per 16 giorni, le sedici unità esca sono state rimosse
da ciascun bicchiere, sciacquate sotto acqua corrente, disinfettate in superficie con una
soluzione di NaClO (1% di cloro attivo) ed etanolo (50% v/v) per 5 minuti e sciacquate in
abbondante acqua sterile. Al fine di valutare la capacità di colonizzazione della paglia da
parte di R. solani in presenza degli antagonisti, i pezzetti di paglia, sono stati piastrati su
terreno selettivo per R. solani, PDA O15 (PDA contenente streptomicina solfato 50 ppm,
bacitracina solfato 7500 u.i. L
-1; imexazolo 0,3g L
-1; Octave“Aventis”15ppm) e incubati a
25°C. Trascorsi 10 giorni è stata registrata la percentuale di colonizzazione dell’unità di
substrato da parte di R. solani (Fig. 2.2)
Fig. 2.2 – Pezzetti di paglia piastrati su PDA O15, recuperati da bicchieri contenenti terreno inoculato solo con R. solani.
. Dopo ciascun rilievo, il terriccio privato delle esche è stato recuperato e sono stati
seminati dieci semi di ravanello in ciascun bicchiere, incubati a 24°C in alternanza
luce-buio (12 h/12 h). Dopo 23 giorni sono state calcolate le percentuali di emergenza e di
piantine sane; come controllo è stato usato terriccio non inoculato (Fig. 2.3).
Materiali e metodi
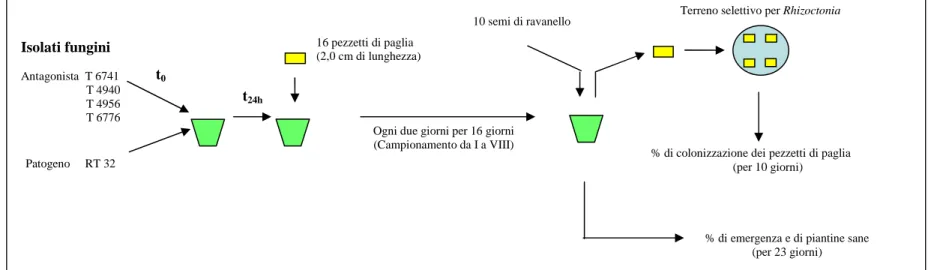
Fig. 2.3 - Ciascun isolato di Trichoderma è stato co-inoculato con R. solani in terriccio sterilizzato e dopo 24 ore sono stati interrati 16 pezzetti
di paglia. Ogni due giorni le unità esca sono state rimosse e piastrate su terreno selettivo per Rhizoctonia. Dopo ogni prelievo, 10 semi di ravanello sono stati seminati nei contenitori dai quali era stata recuperata la paglia. Sono state, quindi, rilevate la capacità di colonizzazione della paglia da parte di
Rhizoctonia e l’andamento della malattia.
Isolati fungini Antagonista T 6741 T 4940 T 4956 T 6776 Patogeno RT 32 t24h 16 pezzetti di paglia (2,0 cm di lunghezza)
Ogni due giorni per 16 giorni (Campionamento da I a VIII)
Terreno selettivo per Rhizoctonia 10 semi di ravanello
% di colonizzazione dei pezzetti di paglia (per 10 giorni) t0
% di emergenza e di piantine sane (per 23 giorni)
Materiali e metodi
2.4
Accrescimento dei quattro isolati di T. harzianum, a diversi valori di potenziale
idrico e pH.
Al fine di valutare gli effetti di alcuni fattori abiotici sulla crescita dei quattro isolati di
Trichoderma harzianum (T4940, T4956, T6741 e T6776) e confrontarli con il
comportamento di R solani, è stato allestito un test in vitro utilizzando diversi valori di
potenziale idrico e di concentrazione idrogenionica (pH). Tutti gli esperimenti sono stati
realizzati su PDA (Potato Dextrose Agar), addizionato di diversi composti come di
seguito descritto, per ottenere i valori di potenziale idrico e pH desiderati.
Potenziale idrico: Il substrato (PDA) utilizzato nella prova, prima della sterilizzazione, è
stato modificato, utilizzando come agenti osmotici NaCl o saccarosio a diverse
concentrazioni ( 0,5 M, 1,0 M, 1,5 M e 2 M). In Tab. 2.3 sono riportati i valori di
potenziale idrico, per ciascuna delle concentrazioni utilizzate. Come controllo sono state
usate piastre di PDA non modificato. Dischi di PDA, di 8 mm di diametro, prelevati dal
margine delle colonie in attiva crescita degli isolati di Trichoderma harzianum (T4040,
T4956, T6741 e T6776) e Rhizoctonia solani, sono stati posizionate al centro delle
piastre. Le piastre sono state incubate a 24°C al buio (tre repliche per ciascun terreno di
crescita) e la misura dei diametri delle colonie è stato registrata ogni 8 ore per i controlli e
ogni 24 ore per tutte le altre condizioni. Le velocità di crescita sono state espresse come
mm h
-1.
Substrato M Wp (Mpa) PDA / -0,300 PDA + NaCl 0,5 -2,496 PDA + NaCl 1,0 -4,935 PDA + NaCl 1,5 -7,303 PDA + NaCl 2,0 -9,820Materiali e metodi
PDA + Saccarosio 0,5 -1,722 PDA + Saccarosio 1,0 -3,713 PDA + Saccarosio 1,5 -6,824 PDA + Saccarosio 2,0 -11,600Tab. 2.3 – Molarità (M) e corrispondenti valori di potenziale idrico (Wp) dei vari substrati impiegati.
* In accordo con Sommers et al. (1970).
pH: per la prova è stato usato PDA tamponato, prima della sterilizzazione, a diversi
valori di pH (3.0, 4.0, 5.0, 6.0 e 7.0), usando citrato fosfato (acido citrico 1M/NaH
2PO
42M) in diverse combinazioni. Dischi PDA, di 8 mm di diametro, prelevati dai margini
delle colonie in attiva crescita degli isolati di Trichoderma harzianum (T4040, T4956,
T6741 e T6776) e Rhizoctonia solani sono state posizionate al centro di piastre contenenti
i diversi substrati. Le piastre sono state incubate al buio a 24 °C ed ogni 24 ore sono stati
misurati i diametri delle colonie, gli accrescimenti radiali orari sono stati espressi in mm
h
-1. Al termine del periodo di incubazione, sono stati misurati i valori di pH del substrato
di crescita per verificare eventuali possibili variazioni dovute alla crescita del fungo.
2.5
Micoparassitismo dei quattro isolati di Trichoderma nei confronti di R. solani
Al fine di valutare le capacità micoparrassitarie dei quattro isolati di Trichoderma
harzianum (T4040, T4956, T6741 e T6776) nei confronti di Rhizoctonia solani (RT32) è
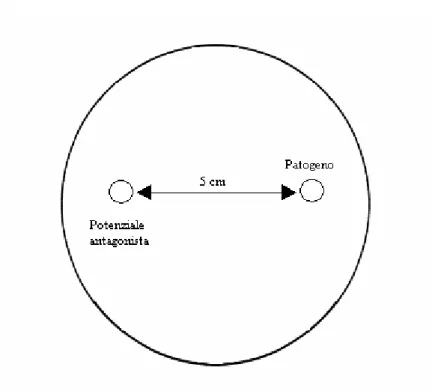
stato allestito un test in vitro. Dischetti di micelio (ø 8 mm) di ciascun Trichoderma e del
patogeno, prelevati dal bordo di colonie in attivo accrescimento su PDA, sono stati
posizionati ai lati opposti (5 cm di distanza) di una piastra Petri, contenente PDA o WA,
su cui era stata precedentemente stesa una membrana di cellophane sterilizzata (121°,40’,
2 volte), (Fig. 2.4).
Materiali e metodi
Fig. 2.4 - Dischetti di micelio (ø 8 mm) dell’antagonista e del patogeno, prelevati dal bordo di colonie in attivo accrescimento su PDA, posizionati ai lati opposti (5 cm di distanza) di una piastra Petri, contenente PDA o WA