Indice
1. INTRODUZIONE ... 1
1. L’Ozono ... 2
1.1 Aspetti generali dell’inquinamento atmosferico... 2
1.2 L’ozono stratosferico ... 3
1.3 L’ozono troposferico ... 5
1.4 Aspetti ambientali dell’ozono troposferico. ... 12
2. Esposizione acuta all’ozono ... 15
2.1 Ingresso nella pianta e reazioni iniziali ... 15
2.2 Percezione dello stress e primi sintomi ... 18
2.3 Complessità della rete dei segnali di difesa e morte programmata delle cellule (PCD) ... 24
2.3.1 Acido Salicilico e monossido di azotoga ... 24
2.3.2 L’Acido Jasmonico ... 25
2.3.3 L’Etilene ... 26
2.3.4 Visione generale delle reti del segnale ... 28
3. I fattori di trascrizione WRKY ... 31
3.1 Origine dei geni WRKY ... 32
3.2 Caratteristiche della superfamiglia WRKY ... 33
3.2.1 Dominio wrky e w box... 33
3.2.2 Regolazione della trascrizione ... 37
3.3 Complessità della famiglia WRKY in Arabidopsis ... 37
3.4 Ruolo biologico dei fattori WRKY... 38
3.4.1 Comportamento dell’espressione dei geni WRKY... 39
3.4.2 Target dei geni WRKY... 40
3.4.3 .Ruolo dei fattori WRKY nella difesa delle piante ... 40
4.Le proteine chinasiche trans- membrana ... 42
4.1 Proteine RLK: identificazione, classificazione e struttura primaria ... 42
4.2 WAK: caratteristiche generali ... 44
4.3 Classificazione delle proteine WAK ... 45
4.4 Organizzazione genomica... 46
4.5 Caratteristiche strutturali delle proteine WAK ... 47
4.6 Espressione organo-specifica e ruoli delle proteine WAK ... 48
1. L’Ozono
1.1 Aspetti generali dell’inquinamento atmosferico
L’ atmosfera terrestre è formata da una miscela di gas, costituita per il 78.09% da azoto (N2), per il 20.94% da ossigeno (O2) e per meno dell’1% da altri gas presenti in tracce, come anidride carbonica (CO2), monossido di carbonio (CO), anidride solforica (SO2), monossido e diossido di azoto (NO e NO2), ozono (O3), etc. La concentrazione di questi ultimi gas presenti in tracce ha subito dei cambiamenti notevoli negli ultimi 200 anni, da quando cioè le attività antropologiche (rivoluzione industriale, uso di combustibili fossili per ottenere energia,…) hanno cominciato ad incidere concretamente sulle emissioni di inquinanti nell’aria, e può sembrare incredibile come la variazione della composizione di questo 1% di atmosfera abbia causato notevoli problemi a livello di qualità della vita sulla terra.
Considerando che per inquinamento intendiamo un cambiamento indesiderato delle caratteristiche fisiche, chimiche e biologiche dell’ambiente, l’inquinamento dell’aria si riferisce alla situazione in cui la presenza di certe quantità di particolari sostanze nell’atmosfera alteri le normali condizioni ambientali e di salubrità dell’aria, rendendole tali da costituire pericolo diretto o indiretto per la salute dell’uomo, alterare le risorse biologiche e gli ecosistemi ed i beni materiali, pubblici e privati.
Risulta evidente come l’inquinamento atmosferico possa essere determinato sia dall’immissione in atmosfera di nuove sostanze sia dalla variazione nella concentrazione di sostanze già normalmente presenti. In particolare è possibile distinguere gli inquinanti atmosferici in: sostanze ossidanti (NOx, O3), sostanze riducenti (SO2, H2S), acidi (HF, H2SO4, H2SO3, HCl, HNO3) e fitoeffettori (etilene, erbicidi, fitofarmaci). Un’altra importante distinzione è fatta tra inquinanti primari e secondari. Gli inquinanti primari sono immessi direttamente nell’ambiente in seguito ai processi che li hanno prodotti. Successivamente alla loro emissione in atmosfera, essi vanno incontro a processi di diffusione, trasporto e deposizione. Sono soggetti, inoltre, a processi di trasformazione
chimico-fisica che possono portare alla formazione degli inquinanti secondari, nuove specie chimiche che spesso risultano più tossiche e a più vasto raggio d'azione rispetto ai composti originari.
Le sorgenti di tali sostanze possono essere naturali (aerosol marini, degradazione biologica, eruzioni vulcaniche, ecc.) oppure antropiche (traffico veicolare, produzioni e trasformazioni industriali e, in generale, tutte quelle attività che implicano processi di combustione).
L’inquinamento dell’aria di origine antropica è cambiato seguendo di pari passo i cambiamenti avvenuti a livello storico: inizialmente era il fumo prodotto dalla combustione del carbone nella rivoluzione industriale, poi è “diventato” lo smog prodotto dall’utilizzo di petrolio, dei composti ottenuti dalla sua raffinazione e dei gas naturali, in cui gli inquinanti diventano i gas di scarico e i prodotti dello “smog fotochimico” (che si produce in atmosfera quando reazioni fotochimiche coinvolgono ossidi dell’azoto e idrocarburi e che rappresenta una forma di inquinamento estremamente dannosa in generale e per gli ecosistemi naturali in particolare).
Negli ultimi anni le rapide modificazioni della composizione atmosferica (e, come già accennato, in particolare di quell’1%) dovute all’aumento dei composti inquinanti stanno determinando reazioni a livello globale, quali innalzamento delle temperature, aumento delle radiazioni UVB, aumento delle piogge acide,…; diventa così estremamente importante acquisire consapevolezza in merito e cercare di intervenire e interagire a livello internazionale.
1.2 L’ozono stratosferico
L’ozono (O3, un allotropo dell’ossigeno) è un gas dall’odore pungente, di colore debolmente azzurro, fortemente ossidante ed altamente instabile.
L’ozono si trova naturalmente nell’atmosfera (figura 1.1) in due zone distinte, nella troposfera (dai 10 ai 15 Km dalla superficie terrestre) in percentuali dell’ordine di 0,02-0,03 mg/m3, e nella stratosfera (dai 10-15 ai 40 Km); in questa ultima zona forma uno
strato chiamato ozonosfera. La sua quantità nei diversi strati varia con le stagioni (è maggiore in primavera) e con la latitudine (è minima all’equatore).
Nella stratosfera l’ O3 si forma in seguito ad una serie di reazioni chiamate complessivamente meccanismo di Chapman; questo prevede una iniziale fotolisi dell’ O2 (1.1), che avviene quando le radiazioni ultraviolette (caratterizzate da una lunghezza d’onda inferiore ai 242 nm) colpiscono la stratosfera, che porta alla formazione di ossigeno atomico, il quale poi reagisce velocemente con altre molecole di O2 (1.2) producendo così O3.
O2 + h? ? O + O (1.1) O + O2 ? O3 (1.2) O3 + h? ? O2 + O (1.3) (h? indica l’energia radiante/luminosa)
Tutte le reazioni che portano a formazione e decomposizione dell’ O3 (1.1-1.3) hanno luogo ripetutamente e la presenza dello strato di ozono è assicurata dall’equilibrio tra esse.
Al contrario quando l’ O3 si combina con ossigeno atomico due molecole di O2 sono prodotte e il ciclo si blocca.
O3 + O ? O2 + O2 (1.4) Fig.1.1 : stratigrafia dell’atmosfera
Generalmente la 1.4 ha una velocità di reazione molto più bassa rispetto alle precedenti, ma può essere velocizzata dalla presenza di alcune specie chimiche riversate dall’uomo nell’ambiente, ed è ciò che determina l’impoverimento dell’ozonosfera; questo ha coinciso con la formazione del “famoso” buco dell’ozono e con tutti i problemi che da esso derivano.
È infatti noto ormai da tempo l’indispensabilità dell’ozono stratosferico per l’esistenza della vita sulla Terra, in quanto in grado di neutralizzare, assorbendola come spiegato tramite il meccanismo di Chapman, la componente ultravioletta della radiazione solare, estremamente dannosa per tutti gli organismi viventi.
1.3 L’ozono troposferico
Scendendo verso la troposfera il livello di UV diminuisce, in quanto queste radiazioni non riescono a penetrare l’atmosfera, di conseguenza il meccanismo di Chapman non può aver luogo e anche i livelli di ozono diminuiscono.
Fino agli anni ’70 si pensava che l’ O3 troposferico derivasse quasi esclusivamente dalla stratosfera per scambi gassosi tra le due zone (Junge, 1962); il tasso al quale l’ozono viene trasferito dalla stratosfera alla troposfera è diverso per i due emisferi e varia da 2.5 a 9*1010 mol/(cm2*s) (Chameides e Lodge, 1992).
La produzione fotochimica di O3 era considerata incidente solo nelle aree altamente inquinate delle regioni urbane, ma basandosi su studi successivi (Crutzen,1973; Fisherman et al., 1979) è stato dimostrato che in realtà tale produzione tramite ossidi dell’azoto (NOx, emessi dal traffico veicolare, dagli impianti di combustione delle industrie, dalle
centrali termoelettriche, dagli inceneritori di rifiuti ecc) e composti organici volatili (VOC, prodotti dalle diverse attività antropiche, in particolar modo dal traffico veicolare) influisce in modo consistente sulla quantità di O3 nella troposfera (Warneck, 1999), addirittura circa il 50% nell’emisfero settentrionale.
In condizioni normali, cioè in assenza di inquinamento dell’aria, le massime concentrazioni di ozono a livello del suolo sono di 0.03 ppm; in ambiente urbano, come detto, all’ozono di origine naturale si aggiunge anche quello di origine antropica, prodotto
per azione dei raggi solari attraverso reazioni che coinvolgono le sostanze no cive sopraelencate presenti nell’aria che respiriamo.
In estate gli NOx e gli idrocarburi volatili (VOC) vengono immessi nell’atmosfera in grandi quantità e nelle ore di massima insolazione reagiscono formando biossido di azoto (NO2). La molecola di NO2 viene facilmente scissa dalla radiazione solare con formazione di un atomo di ossigeno (Stockwell et all., 1997):
NO2 + h? (295 nm = ? < 430 nm) ? NO + O (1.5) L’atomo di ossigeno reagisce istantaneamente con una molecola di ossigeno con formazione di ozono:
O + O2 ? O3 (1.6)
L’ozono tende a reagire facilmente con il monossido di azoto distruggendosi immediatamente e riformando NO2 che torna in ciclo:
O3 + NO ? NO2 + O2 (1.7)
In teoria l'ozono dovrebbe formarsi e distruggersi subito dopo, purtroppo invece, le molecole di NO vengono catturate più rapidamente dagli idrocarburi (VOC) , emessi soprattutto dalle benzine, e pertanto l’ozono prodotto rimane nell’atmosfera che respiriamo.
Nelle ore serali invece, con le ulteriori emissioni del traffico e la diminuzione dell’insolazione, l’ozono viene lentamente decomposto dall’ossido di azoto.
Le altre reazioni di formazione dell’ozono nella troposfera, come detto, sono a carico dei VOC (Rao et al., 2000a):
CH4 + 4O2 + 2h ? = HCHO + H2O + 2O3 (1.9)
RH + 4O2 + 2h ? = R*CHO + H2O + 2O3 (1.10)
Come si può notare, i diversi idrocarburi portano alla formazione di diverse quantità di O3, ad esempio la degradazione di alcuni di essi determinano un aumento dei rispettivi radicali liberi reattivi nell’atmosfera e quindi anche ad un amplificazione dell’O3. Per questo è stato valutato per molti VOC il potenziale di creazione fotochimica di ozono (POCP), in quanto le diverse sostanze volatili emesse durante le attività antropiche possono essere raggruppate in categorie, ognuna con una diversa propensione a formare ozono tramite i meccanismi fotochimici (Derwent et al., 2006).
L’azione della radiazione luminosa sulle molecole di O3 , come vis to, libera un ossigeno che può reagire con vapore acqueo e formare così radicali ossidrilici (OH•) (Colvile, 2002).
Quando questi attaccano molecole organiche, danno origine ad una serie di reazioni in cui partecipa anche l’NO e il risultato è tipicamente l’ossidazione di due o tre ma anche più molecole di NO a NO2. L’OH• è rigenerato e quindi in grado di partecipare ad ulteriori cicli di reazioni. La maggior parte dell’ NO2 nell’atmosfera è prodotta tramite la reazione 1.7, cosicché la fotolisi dell’ NO2 rigenera semplicemente l’O3 consumato inizialmente, ma se l’ NO2 si forma in seguito alla degradazione di idrocarburi conseguente all’attacco del OH•, non viene consumato nessun O3, e come quindi la fotolisi dell’ NO2 genera nuovo O3.
Quindi appare chiaro come siano questi due inquinanti (NOx e idrocarburi), subendo vari cicli di reazioni, a portare ad un aumento dell’ O3 sulla superficie terrestre; per questo l’ O3 è definito “inquinante secondario”, in quanto non direttamente emesso nell’atmosfera ma risultante da reazioni che coinvolgono quelli definiti “inquinanti primari” (appunto NOx e VOC).
Negli ambienti urbani altri composti reattivi quali alcheni e idrocarburi aromatici (non sempre di origine antropica) sono presenti, e risultano essere tra i principali precursori
dell’O3, costituendo poi insieme agli inquinanti primari, una miscela altamente tossica definita “smog fotochimico”.
La concentrazione troposferica di O3 (e dei suoi precursori) é soggetta ai processi di trasporto meteorologici della stratosfera, ai processi fotochimici delle varie zone e ai trasporti anche a grande distanza (Stockwell et al.,1997), cosicché anche regioni remote (zone rurali e forestali) possono essere coinvolte; infatti questo tipo di inquinamento risulta particolarmente legato ai fattori climatici e temporali;
- varia durante la giornata, con bassi livelli durante la notte (momento in cui è più bassa la radiazione luminosa) e massimi nel pomeriggio (momento in cui nelle città il traffico aumenta) (Chameides et al.,1997), e durante le stagioni, in cui si denota un picco nei mesi tra aprile e luglio (in entrambi gli emisferi), in quanto caratterizzati da alte temperature, alta pressione e da una certa stabilità climatica (Oltmans and Levy, 1994);
- differenze riguardano anche l’altitudine: a parità di temperature si riscontrano concentrazioni maggiori di O3 in città situate ad altitudini maggiori (es. Città del Messico) a causa della presenza di una più forte radiazione luminosa (McKee, 1993).
Oggigiorno conveniamo tutti con l’idea di “livello critico”, come ha messo in evidenza l’Organizzazione Mondiale per la Salute (WHO, World Health Organization): questo è stato identificato dalla Commissione Economica delle Nazioni Unite per l’Europa (UN-ECE) come la quantità di sostanze inquinanti oltre la quale si manifestano effetti negativi nelle piante (prese come indicatori biologici, in quanto dimostrano sensibilità e “rapida” risposta alla presenza di inquinanti nell’aria), e identificato con il livello limite di 40 ppb oltre cui possono essere attesi su di esse importanti effetti biologici. Questo limite è stato chiamato AOT40 (Accumulation Hourly Concentration Over a Threshold of 40 ppb). Per avere dati sulla relazione “diminuzione di produzione/ esposizione all’O3“ sono disponibili soprattutto due sistemi:
. l’indice AOT40: descritto sopra e che considera l’ O3 ambientale
. l’indice di flusso attraverso gli stomi: considera la dose di O3 assorbita dagli stomi di una pianta in un certo tempo
In molti casi quest’ultimo riflette maggiormente la situazione reale: varia tra le varie specie e a seconda delle condizioni ambientali, e assume come soglia un certo valore di flusso sotto al quale l’ozono non determina effetti e che può essere considerato come il livello di O3 che la pianta è in grado di detossificare (Karlsson et al., 2004; Uddling et al., 2004). Data la maggiore adattabilità di quest’ultimo sistema, sembra preferibile il suo utilizzo nella valutazione delle relazioni esposizione/risposta all’ozono sia per zone diverse (anc he nei casi di valutazioni di impatto locali) che nel tempo (anche negli anni a venire). Con l’indice AOT40 infatti sono numerose le variabili che non possono essere considerate, quali differenze ontogenetiche tra le varie specie, differenze geografiche e climatiche delle varie zone, future modificazioni globali del clima (Ashmore, 2005).
In molte regioni del mondo c’è una chiara evidenza che i livelli di O3 presenti siano già abbastanza alti da ridurre la produzione agricola (Turcsànyi et al., 2000a), da causare cambiamenti nella composizione genetica delle piante domestiche e selvatiche (Barnes et al., 1999) e predisporre le foreste a danni causati da fattori di stress secondari (Barnes et al., 2002). Nell’emisfero boreale le concentrazioni di ozono troposferico vanno dalle 20 alle 60 ppb (1 ppb= 1 nl*l-1), con alcuni picchi superiori ai 250 ppb (Stockwell et al., 1997; Kley et al., 1999).
Dall’analisi delle misurazioni storiche dei livelli di O3, emerge che negli ultimi duecento anni si è verificato più che un raddoppiamento della concentrazione troposferica di ozono; vari studi si sono basati su modelli globali per esaminare l’impatto dell’aumento continuo di NOx (dovuto per esempio ai trasporti continentali) sulle future concentrazioni di O3 (Collins et al., 2000) ed è stato suggerito per l’emisfero settentrionale un incremento dello 0.5-2% annuo delle sue concentrazioni (Vingarzan, 2004).
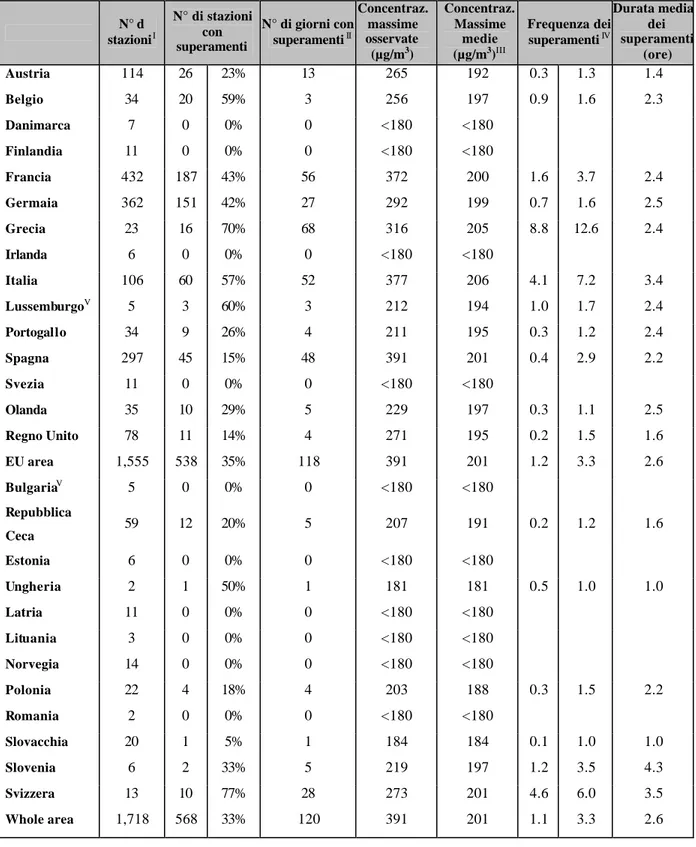
La tabella 1.1 è un quadro riassuntivo dei livelli di ozono troposferico per nazione nella primavera-estate 2002 registrati dallo European Environment Agency.
Tabella 1.1 Sommario per l’estate 2002 (periodo aprile -agosto) dell’analisi stato per stato della concentrazione di ozono che eccede la soglia dei 180 µg/m3 all’ora.
I. Numero di stazioni analizzate per le rilevazioni nel quadro della direttiva dell’ozono.
II. Numero dei giorni del calendario durante i quali almeno un superamento della soglia è stato osservato III.…Media di tutte le concentrazioni massime registrate durante le eccedenze.
IV.…Colonna di sinistra: media su tutte le stazioni valutate; colonna di destra: media tra tutte le stazioni che hanno riportato almeno una eccedenza.
Tabella 1.1 N° d stazioniI N° di stazioni con superamenti N° di giorni con superamentiII Concentraz. massime osservate (µg/m3) Concentraz. Massime medie (µg/m3)III Frequenza dei superamentiIV Durata media dei superamenti (ore) Austria 114 26 23% 13 265 192 0.3 1.3 1.4 Belgio 34 20 59% 3 256 197 0.9 1.6 2.3 Danimarca 7 0 0% 0 <180 <180 Finlandia 11 0 0% 0 <180 <180 Francia 432 187 43% 56 372 200 1.6 3.7 2.4 Germaia 362 151 42% 27 292 199 0.7 1.6 2.5 Grecia 23 16 70% 68 316 205 8.8 12.6 2.4 Irlanda 6 0 0% 0 <180 <180 Italia 106 60 57% 52 377 206 4.1 7.2 3.4 LussemburgoV 5 3 60% 3 212 194 1.0 1.7 2.4 Portogallo 34 9 26% 4 211 195 0.3 1.2 2.4 Spagna 297 45 15% 48 391 201 0.4 2.9 2.2 Svezia 11 0 0% 0 <180 <180 Olanda 35 10 29% 5 229 197 0.3 1.1 2.5 Regno Unito 78 11 14% 4 271 195 0.2 1.5 1.6 EU area 1,555 538 35% 118 391 201 1.2 3.3 2.6 BulgariaV 5 0 0% 0 <180 <180 Repubblica Ceca 59 12 20% 5 207 191 0.2 1.2 1.6 Estonia 6 0 0% 0 <180 <180 Ungheria 2 1 50% 1 181 181 0.5 1.0 1.0 Latria 11 0 0% 0 <180 <180 Lituania 3 0 0% 0 <180 <180 Norvegia 14 0 0% 0 <180 <180 Polonia 22 4 18% 4 203 188 0.3 1.5 2.2 Romania 2 0 0% 0 <180 <180 Slovacchia 20 1 5% 1 184 184 0.1 1.0 1.0 Slovenia 6 2 33% 5 219 197 1.2 3.5 4.3 Svizzera 13 10 77% 28 273 201 4.6 6.0 3.5 Whole area 1,718 568 33% 120 391 201 1.1 3.3 2.6
1.4 Aspetti ambientali dell’ozono troposfe rico.
Mentre l’O3 stratosferico svolge un ruolo positivo per la vita sulla terra, la sua presenza nella troposfera determina effetti decisamente negativi sugli organismi. Le conseguenze sul clima si riferiscono generalmente all’effetto serra: la luce sola re colpisce la terra, che ne assorbe una parte e ne riflette la porzione infrarossa; l’ O3, insieme agli altri gas inquinanti, assorbe questa radiazione infrarossa e ne riflette nuovamente più del 90% sulla superficie terrestre, provocandone così un incremento della temperatura.
L’O3 produce effetti negativi sulla salute dell’uomo e ciò fu riscontrato già nel 1851, quando vari studi descrissero i sintomi che esposizioni prolungate di O3 provocavano sui polmoni. Solo negli Stati Uniti sono circa 100 milioni le persone che vivono in zone dove sono preseti livelli di questo gas superiori ai limiti accettati, con notevole pericolo quindi soprattutto per i bambini, gli anziani, le persone con malattie polmonari e cardiache e persino per le persone sane che svolgono attività all’aria aperta.
L’O3 danneggia persino i materiali non biologici, quali fibre tessili e tinture, provocando rottura dei legami insaturi carbonio-carbonio, così le prime sono meno resistenti, mentre le seconde tendono a sbiadire. Tutto ciò in un ambiente come un museo può risultare estremamente pericoloso per le opere, per questo da vari anni utilizzano filtri ai carboni attivi e sistemi di aerazione (Coldback and MacKanzie, 1994).
Le piante sono i più sensibili bersagli dell’azione tossica dell’ O3, ma in generale è possibile affermare che siano loro a percepire (rispondendo con sintomi specifici) per prime problemi ambientali causati dalla presenza di inquinanti atmosferici. Verso la metà degli anni ’40, nella zona di Los Angeles, sintomi insoliti furono riscontrati sulle foglie di varie piante, sintomi che non potevano essere ricondotti a nessuna malattia o fattori di stress conosciuti. Fu in quel contesto che, in seguito a varie analisi ed osservazioni empiriche, fu attribuita la colpa all’ O3 (Richards et al., 1958). Oggi è assodato il suo ruolo consistente , da solo o in associazione con altri inquinanti gassosi, nel provocare danno alle piante sia naturali che coltivate nei paesi industrializzati (Bergmann et al., 1999).
I sintomi sulle piante sono difficili da definire (Woodwell et al.,1988); in generale comunque determina
(1) macchie visibile sulla superficie fogliare
(2) diminuzione di produttività, relativamente alla qualità/quantità di frutti, fibre e materia legnosa
(3) cambiamenti metabolici
(4) diminuzione della capacità di risposta ad altri fattori di stress (5) accelerazione dei processi di senescenza (Heath and Taylor, 1997).
Per quanto riguarda i danni visibili sulle foglie, la comparsa di caratteristici spot sul lato inferiore è uno dei sintomi ben associati all’esposizione ad alte concentrazioni di ozono, ma altri tipi di “lesioni” (clorosi, necrosi,…) possono essere facilmente confusi con i sintomi legati ad altri fattori. In ogni modo, il danno fogliare indotto da ozono è la principale risposta che viene presa come parametro per la valutazione dei danni ad esempio sulle foreste (Bortier et al., 1997). Nelle piante erbacee tra i sintomi si riscontrano anche spot chiari, zone clorotiche più o meno grandi e clorosi anche a livello intervasale (Nouchi, 2002), a differenza di altri generi, come graminacee e leguminose, dove gli spot sono di dimensioni minori, in numero maggiore e hanno colorazione rosso- marrone.
Le piante non rispondono tutte nello stesso modo all’ O3; le più sens ibili sviluppano subito effetti di varia intensità e proprio la velocità di comparsa delle lesioni viene considerata per valutare il livello di sensibilità a questo gas (Lee, 1999a). Nei casi di esposizione cronica all’ O3, i sintomi generalmente non sono subito evidenti, ma dopo periodi prolungati si può presentare un ingiallimento delle foglie esposte, con conseguente prematura cadute delle stesse.
Anche la riduzione di produttività della pianta spesso viene usata come parametro per la valutazione dell’inquinamento dell’aria, tramite misura diretta della perdita di materiale (Heath and Taylor, 1997), che in agricoltura è direttamente traducibile in una perdita di guadagno. La diminuzione di produttività di una pianta è associata inoltre ad una diminuzione della sua fitness ambientale (ridotta vitalità) che può renderla più suscettibile agli stress biotici e abiotici (Sandermann, 2000).
Tra gli indicatori dello stress da inquinamento, il più difficile da valutare è quello che concerne le alterazioni metaboliche (Heath and Taylor, 1997), in quanto non visibili ad occhio nudo e spesso difficili da rintracciare. Per questo vengono presi in considerazione a questo scopo quei processi fisiologici misurabili quantitativamente, come riduzione di fotosintesi e di traspirazione, che portano come conseguenza una perdita di produzione.
Alle basse concentrazioni di ozono (più simili a quelle naturali) si riscontra in genere un accelerato invecchiamento, dovuto ad una precoce abscissione delle foglie e ad altri cambiamenti durante lo sviluppo (a livello metabolico). In ogni modo, a seconda della specie e del binomio concentrazione/tempo di esposizione a cui sono sottoposte, nelle piante si verificano due comportamenti diversi in risposta a trattamento acuto o cronico con l’ozono (Kangasjärvi, 1994; Pell et al., 1997; Schraunder et al., 1997; Rao et al., 2000; Dizengremel, 2001; Long and Naidu 2002).
L’esposizione di tipo acuto prevede alte concentrazioni di O3 (150-300 ppb) per un periodo relativamente breve (4-6 h), come può accadere nei siti più inquinati, e causa rapidamente l’insorgere di danni (necrosi) sulla superficie fogliare. Questo modo della pianta di reagire velocemente è simile alla risposta ipersensibile (HR, hypersensitive response), risultato dell’interazio ne incompatibile pianta-patogeno.
L’esposizione di tipo cronico invece prevede basse concentrazioni di O3 (= 100 ppb) per periodi relativamente lunghi (giorni o mesi). Il danno sarà meno evidente, dipendente dalla specie e può includere anche sintomi quali clorosi e prematura senescenza (Pelle t al., 1997). In questo caso diminuisce la produttività dell’intera pianta prima della comparsa di sintomi evidenti sulle foglie (Heath and Taylor, 1997).
2. Esposizione acuta all’ozono
2.1 Ingresso nella pianta e reazioni iniziali
L’ozono reagisce con le piante:
? in fase solida (es. con i componenti cuticolari della foglia) ? in fase gassosa (es. con gli idrocarburi emessi dalla pianta)
? in fase liquida (cioè nel mezzo acquoso extracellulare in cui si discioglie per reagire con lipidi, proteine e altri componenti cellulari)
Le reazioni in fase liquida e in fase solida sono entrambe molto rilevanti, ma la ricerca si è focalizzata principalmente sulle reazioni in fase liquida, perché la dissociazione dell’O3 nella matrice extracellulare delle foglie (apoplasto) determina i maggiori effetti sulla pianta (Mudd, 1996).
L’ozono entra nelle foglie attraverso gli stomi aperti, così come fanno la CO2 e l’O2 per il normale metabolismo della pianta (fotosintesi e respirazione). L’ingresso dei gas è strettamente correlata al grado di apertura e dal numero e alla dimensione degli stomi presenti sulla foglia (Lyons et al., 1999), oltre che alle condizioni climatiche; ad esempio in condizioni di elevata umidità gli stomi sono più aperti e la pianta è così più sensibile agli inquinanti dell’aria.
Quando l’O3 raggiunge l’apoplasto può reagire con i composti volatili emessi dalla pianta (fase gassosa), quali etilene o molecole più complesse come isoprene e propene; anche queste interazioni fanno parte dei meccanismi che portano al danno. Dentro la foglia comunque la maggior parte dell’O3 è assorbito nella matrice acquosa sottostante la cavità stomatica (Lyons et al., 1999) e inizia a reagire con le pareti cellulari, la membrana plasma tica e con gli ioni idrossilici dell’acqua portando alla formazione di specie attive dell’ossigeno (AOS) quali perossido di idrogeno (H2O2), radicali idroperossilici (HO2•), radicali superossido (•O2-), radicali ossidrilici (•OH-).
1- O3 + OH- ? •O2- + HO2• (2.1) 2- O3 ? H2O2 (2.2) 3- •O2- + H+ ? HO2• HO2• + HO2• ? H2O2 + O2 (2.3) HO2• ? H+ + •O2 -•O2- + HO2• + H2O ? H2O2 + OH- + O2
(1) Reazione di Waiss; (2) Ozonolisi; (3) Dismutazione (Rao et al., 2000)
Queste reazioni iniziano così un meccanismo ciclico di decomposizioni dell’O3:
Fig.1.2 meccanismo ciclico di decomposizione dell’ozono in acqua, come può verificarsi anche per le pareti cellulari (da Long and Naidu, 2002)
È stato scoperto che alcune di queste reazioni possono essere influenzate (accelerate o rallentate) dalla concomitante presenza nell’apoplasto di molecole donatrici di elettroni; ad esempio la formazione del radicale ossidrilico è incrementata dalla presenza di gruppi tiolici, ammine, composti fenolici (come l’acido caffeico) e dello ione metallico F2+ (reazione 2.4):
F3+ + •O2- ? F2+ + O2
L’aumentare della quant ità di •OH aumenta la produzione di superossido e quindi la propagazione del ciclo (figura 1.2).
La reazione diretta tra ozono e molecole organiche è chiamata ozonolisi. La parete cellulare contiene gruppi fenolici, olefine e proteine, la membrana plasma tica è costituita da proteine e fosfolipidi, di cui alcuni insaturi; appare perciò chiaro come siano estremamente numerosi i potenziali punti di attacco per reazioni di ossido-riduzione (Pell et al., 1997), sia direttamente causate dall’ozono che indirettamente dalle AOS:
? doppi e tripli legami carbonio-carbonio: soggetti ad ozonolisi, a dare due residui aldeidici e H2O2 (Long and Naidu, 2002)
? lipidi insaturi: a formare H2O2, aldeidi e radicali organici
? residui aminoacidici: soprattutto tre sono sensibili, in particolare l’ozonolisi porta all’apertura dell’anello pirrolico del triptofano e ossida il gruppo solfidrilico (-SH) di cisterna e metionina formando un ponte disolfide (-S-S-)
? Danni indiretti: l’OH• attacca tutte le componenti del plasmalemma ed è in grado di ossidare rapidamente quasi tutte le molecole organiche, ad esempio:
? Ai legami C-H rimuove l’idrogeno per formare acqua lasciando un elettrone spaiato sul carbonio, quindi un carbonio radicalico in grado di reagire con l’ossigeno molecolare e ind urre l’auto-ossidazione delle membrane
? Con legami C-C l’ OH• si addiziona alla catena facilitando l’idrolisi del legame e alterando così drasticamente la struttura molecolare
? Può attaccare i residui aminoacidici formando un radicale decarbossilato (Fossey et al., 1995).
Così, si sostiene che le AOS siano in grado di alterare le proprietà fisico-chimiche del plasmalemma agendo su di esso con questi meccanismi, iniziando con la perossidazione dei fosfolipidi (Pauls and Thompson,1980) a alterando così il flusso del Ca2+ e degli altri ioni (Clayton et al., 1999) che insieme determinano la distruzione dei meccanismi cellulari.
Nell’apoplasto certi composti possono servire come importanti linee di difesa primarie contro l’O3. Primo tra tutti sembra essere l’ascorbato, il soluto più abbondante in esso presente che reagisce con •OH per formare il suo radicale libero e con l’O3 e l’H2O2 per formare gli acidi monodeidroascorbico (MDHA) e deidroascorbico (DHA). La sua capacità di rimuovere i radicali durante l’esposizione all’O3 dipende dalla continua rigenerazione dell’ascorbato tramite reazioni che avvengono nella cellula o sul plasmalemma e ciò è confermato dalla presenza di un sistema mediato da carrier che regola lo scambio ascorbato/DHA e che mostra una più spiccata affinità per il secondo composto (Horemans et al., 2000). Esiste anche una MDHA-riduttasi legata alla membrana che velocizza la rigenerazione dell’ascorbato nell’apoplasto.
Altri sistemi: la presenza di superossido dismutasi (SOD) negli spazi intercellulari accelera la rimozione di •O2- formando come risultato ossigeno e H2O2 (Long and Naidu, 2002), il quale poi è rimosso dall’ascorbato perossidasi o da perossidasi sulla parete cellulare; composti fenolici (es. le fumarine) e poliamine che si trovano nell’apoplasto attuano un efficiente controllo dei radicali liberi quando coniugati ad acido idrossicinnamico ( Lyons et al., 1999).
2.2 Percezione dello stress e primi sintomi
In caso di esposizione estremamente acuta, il plasmalemma sarà danneggiato al punto da perdere la sua semipermeabilità (Heath, 1997), fondamentale per permettere il mantenimento dell’equilibrio ionico, seguita quindi da plasmolisi e da morte cellulare “incontrollata” (Long and Naidu, 2002); con questo termine ci si riferisce alla morte cellulare che segue ad una situazione estremamente stressante e si verifica rapidamente e indipendentemente da qualsiasi attività cellulare (O’Brien et al., 1998).
Con esposizioni croniche e acute ma di minore intensità si ha invece una risposta “ordinata” della pianta, che si determina tramite regolazione genica (attivazione, sovra/sotto-espressione, disattivazione) che porta a specifici comportamenti: morte “attiva”
delle cellule, accelerazione della senescenza e tutta una serie di eventi che si possono interpretare come risposte di difesa, quali ad esempio una maggiorata capacità di contrastare le AOS (Pell et al., 1997). Per morte “attiva” delle cellule si intende la morte cellulare programmata (Programmed Cell Death, PCD), che è determinata da una serie di specifici processi che si scatenano dentro la cellula (Dat t al., 2003) e che possono includere anche meccanismi che si verificano tipicamente durante l’apoptosi delle cellule animali.
Vari studi hanno suggerito un nuovo quadro in cui si indica che nel trattamento acuto l’ozono agisce come un elicitore abiotico di una risposta ipersensibile HR (Rao et al., 2000a), ovvero quel meccanismo di difesa che si attiva durante l’interazione incompatibile tra un ospite ed un patogeno avirulento ; tale sistema è assente nelle interazioni compatibili, quelle cioè in cui il patogeno è virulento (compatibile) e si ha quindi lo sviluppo della malattia.
La HR consiste nel suicidio programmato intorno al sito di attacco/invasione del patogeno, e prevede la morte della cellula ospite e l’attivazione trascrizionale dei geni di difesa sia delle cellule direttamente interessate che in quelle circostanti.
Si spiega perciò la morte indotta da O3 come il risultato della attivazione di questa risposta da parte delle AOS originatesi dalla degradazione dell’O3 nell’apoplasto (Overmyer et al.,2003) e che agiscono perciò in primis come molecole segnale. Le stesse mimano poi il “burst ossidativo” delle piante, primo segnale della ricognizione di un patogeno avirulento, che consiste nella rapida, massiva e temporanea attivazione del metabolismo ossidativo immediatamente dopo un certo fattore di stress biotico o abiotico (evento paragonabile al “burst respiratorio” delle cellule animali).
Perciò l’esposizione acuta determina ne lle piante una produzione in due fasi delle AOS: la prima (a livello della parete cellulare e della membrana plasmatica) dovuta alle reazioni iniziali dell’O3 nell’apoplasto, la seconda (a livello citosolico) dovuta all’induzione del burst ossidativo, che riguarda in particolare la produzione di H2O2 e di •O2- e che già da sola è sufficiente ad indurre la PCD. Nel 2002, Wohlgemuth et al. hanno svolto uno studio su 7 cultivar di pomodoro, 12 accessioni di Arabidopsis, 2 di Rumex e 1 di Malva, riguardante l’accumulazione delle AOS e le lesioni causate dell’O3, riscontrando una
chiara correlazione spaziale (dipendente dalla specie) tra l’accumulazione di H2O2 o di •O2 -e tra i danni d-ell’O3.
Il tipo di AOS che si viene a formare maggiormente è diversa a seconda della specie e ciò fa sorgere la domanda del perchè la morte cellulare è correlata al H2O2 in alcuni casi e in altri all’•O2-, e quale sia il meccanismo primario di produzione delle AOS (Overmyer et al.,2003).
Spesso l’accumulo di queste non si presenta in modo uniforme sulla superficie fogliare, ma si localizza maggiormente nelle zone vicine ai vasi (xilematici- floematici), e non è ben chiaro se ciò dipende dalla loro maggiore esposizione ai segnali diffusi in maniera sistemica o se siano proprio regioni deputate ad contrastare i patogeni che si diffondo dentro la pianta tramite il sistema vascolare (Langebartels et al., 2002a). Inoltre si pensa che, data la diversità delle risposte tra le varie specie, ci siano diversi percorsi enzimatici che portano all’accumulo delle specie attive dell’ossigeno; in figura 1.3 sono schematizzati quattro processi enzimatici che possono essere coinvolti nella loro produzione nell’apoplasto di mono e dicotiledoni:
- NAD(P)H ossidasi trans- membrana plasmatica
- POD (perossido dismutasi) extracellulare pH-dipendente - diamine e poliamine ossidasi
- ossalato ossidasi
(Lamb and Dixon, 1997; Murphy et al., 1998; Bolwell, 1999; Sebela et al., 2001; Scheel, 2002).
Fig. 1.3. B A C D A C A C A C A C
Fig. 1.3: Sistemi enzimatici responsabili della produzione apoplastica di AOS (da Langebartels et al., 2002a). A, apoplasto; AC, adenilato ciclasi; C, citoplasma; RH, specie riducente durante l’azione della POD.
Negli schemi A e B è raffigurato un modello per l’attivazione della perossidasi apoplastica e della NADPH ossidasi (Langebartels et al, 2002a); in entrambe i casi le interazioni ligando-recettore avvengono attraverso proteine-G direttamente o via adenilato-ciclasi per aprire i canali ionici. Nel modello B il flusso di ioni porta alla alcalinizzazione della matrice extracellulare necessaria per il funzionamento della POD e l’affluenza del calcio può essere collegata tramite la CDPK (proteina chinasica Ca-dipendente) alla secrezione di molecole riducenti (RH). Nel modello A invece la NADPH ossidasi è attivata o direttamente dal Ca++ o indirettamente da una PKC (proteina chinasi C) o da una CDPK.. Meccanismi alternativi sono raffigurati nelle immagini C e D dove sono coinvolte ammine ossidasi, che catalizzano la deaminazione ossidativa di diamine alifatiche e poliamine producendo H2O2, e ossalato ossidasi, che trasformano ossalato e ossigeno in H2O2 e CO2 (Langebartels et al, 2002a; Wohlgemuth et al., 2002).
Esistono anche meccanismi intracellulari di produzione delle AOS, che comprendono processi mitocondriali, perossisomici e cloroplastici (Fleury et al., 2002; Wohlgemuth et al., 2002).
Come accennato precedentemente, alte concentrazioni di AOS uccidono le cellule della pianta a causa della loro tossicità, ma i meccanismi di difesa cellulare e i meccanismi che a livello sistemico portano alla morte programmata delle cellule sono AOS dipendenti, ovvero si azionano in presenza di piccole quantità ad esempio di H2O2 e •O2- : a basse concentrazioni agiscono cioè da molecole segnale (Vranovà et al., 2002).
È stato dimostrato nel 2002 (da Hoeberichts and Woltering) che la PCD indotta dalle AOS dipende, oltre che da queste, anche dal bilanciamento tra la loro produzione e quella di monossido di azoto (NO), utile inoltre per comprendere il meccanismo con cui H2O2 e •O2 -regolino la morte cellulare. Ad esempio, in sospensioni cellulari di soia il rapporto tra NO e H2O2 determina l’attivazione della morte cellulare programmata (Delledonne et al.,
2001). Inoltre si è visto che il perossinitrito che si forma dalla reazione tra •O2- e NO non induce morte cellulare, come invece fa negli animali; in questo sistema, produzioni eccessive di •O2- o di NO possono servire a prevenire l’accumulazione di NO e H2O2 richieste, appunto, per l’attivazione della PCD. È stato così proposto il modello di figura 1.4 in cui il NO è consumato prima che possa reagire con H2O2 se l’equilibrio tra NO e •O2- è in favore del secondo, mentre nel caso contrario, il •O2- è consumato prima che possa dismutare in perossido di idrogeno: questo sistema porta così alla formazione di perossinitrito (ONOO-), intermedio non essenziale nella morte cellulare mediata da H2O2/NO.
Non molto è ancora noto su come le AOS, che come è stato appena discusso hanno il ruolo di molecole segnale, siano percepite e diano il via alla traduzione del segnale nelle cellule
A
B
C
Fig.1.4: Modello delle interazioni tra NO e
AOS (Delledonne et al., 2001):
A: concentrazioni bilanciate, quindi la
concomitante presenza di NO e H2O2 porta all’attivazione della PCD, anche se una parte di NO va a reagire formando ONOO-;
B: •O2
presente in rapporto maggiore rispetto ad NO, del quale non ne resta per poter reagire con H2O2 ? PCD non si attiva;
C: NO presente in rapporto maggiore
rispetto ad •O2-, quindi non ne resta per poter essere convertita dalla SOD in H2O2 ? PCD non si attiva.
vegetali, in ogni modo la fosforilazione proteica reversibile e la mobilizzazione dello ione calcio sono componenti ubiq uitarie dei meccanismi di cascata del segnale negli eucarioti.
Il H2O2 sembra essere un potente attivatore della cascata del segnale di MAPK (mitogen actived protein chinasi) che portano all’induzione di geni specifici della risposta a stress nelle cellule fogliari, ad esempio in Arabidopsis thaliana, e che rappresentano uno dei più importanti sistemi di trasduzione degli stimoli dentro la cellula (Zhang e Klessing, 2001). Sono infatti le vie attraverso cui le cellule eucariotiche rilasciano (o trasportano ) messaggi extra-cellulari al citosol e quindi al nucleo che dirigono divisione e differenziazione cellulare, il metabolismo e le risposte a stress sia biotici che abiotici, incluse le risposte di difesa come il burst ossidativo e la morte cellulare.
2.3 Complessità della rete dei segnali di difesa e morte
programmata delle cellule (PCD)
L’attivazione dei geni di difesa da parte delle AOS e la morte cellulare necessitano di ulteriori mediatori della modulazione del segnale. Varie molecole segnale sono state proposte come regolatori della cinetica delle risposte di difesa delle piante, tra cui l’acido salicilico (SA), l’acido jasmonico (JA), il monossido di azoto (NO) e l’etilene hanno ricevuto particolari attenzioni dai biologi vegetali. Le piante infatti sono dotate di componenti regolatorie per controllare l’intensità di ognuno di questi pathways e per mediare le interazioni che intercorrono tra di essi (Clarke et al., 2000; Greenberg et al., 2000; Overmyer et al., 2000; Rao et al., 2000a, 2001; O’Donnel et al., 2001; Baieret al., 2005; Kangasjärvi et al., 2005).
L’acido salicilico (SA) è il principale fenilpropanoide prodotto in conseguenza a vari stress biotici e abiotici, ozono compreso (Rao et al., 2000b), e nonostante il preciso modo di azione sia ancora in fase di studio, è ben nota la sua capacità di induzione di numerose reazioni di difesa, come cambiamenti nello stato redox della cellula, difesa e morte cellulare (Klessing et al., 2000): l’accumulo di alti livelli di AOS e SA è tra i maggiori fattori che portano alla PCD indotta da ozono (Rao et al., 2000b) e, in ogni caso, si riscontrano frequentemente relazioni dirette con la formazione di lesioni fogliari (Overmyer et al., 2003), come riscontrato in seguito a vari studi su piante di Arabidopsis e tabacco con alterata capacità di produzione e di accumulo di SA in risposta all’ozono (Rao et al., 2000b; Örvar et al., 1997a). Questi studi hanno anche dimostrato che la morte cellulare si può verificare in due modi: in alcuni casi è dovuta all’induzione della PCD, in altri dalla mancata induzione di difese antiossidanti sufficienti a prevenire l’accumulo di intermedi tossici; studi paralleli hanno confermato questo ultimo punto anche in ibridi di pioppo differentemente sensibili all’O3 (Koch et al., 1998).
Uno dei principali modi di azione proposti per l’SA è il suo effetto inibitorio su enzimi che metabolizzano il H2O2, quali la catalasi e l’ascorbato perossidasi; ciò porterebbe così ad un aumento dei livelli delle AOS e quindi all’attivazione dei pathways di difesa (Klessing et al., 2000).
C’è una chiara evidenza di come molecole segnale che inducono la morte cellulare, quali NO e AOS (ad esempio H2O2), siano coinvolte nella regolazione di step chiave nella biosintesi dell’SA durante le infezioni da patogeni (Draper, 1997; Delledonne et al., 2001). Dato che l’O3 stimola l’attivazione dell’enzima che catalizza la sintesi del monossido di azoto (NOS), si ha così che nelle piante esposte al gas venga ind irettamente stimolata anche la sintesi dell’acido salicilico (Rao et al., 2000a), con tutto ciò che ne consegue.
2.3.2 L’Acido Jasmonico
L’acido jasmonico (JA) è un ciclopentone derivato dall’acido linolenico; insieme ai suoi esteri metilici costituisce una classe di molecole segnale che nelle piante sono coinvolte nei
processi di sviluppo, oltre che indotte da un ampio spettro di stress biotici e abiotici (Turner et al., 2003).
Considerando che l’aumentata produzione di AOS induce la produzione di fosfolipasi (Chapman, 1998) e di acido linolenico, si è supposto che l’O3 porti indirettamente ad un aumento della biosintesi di JA nelle piante; tale tesi è stata avvalorata da vari studi tra cui uno effettuato su ibridi di pioppo (Koch et al., 2000), in cui l’incremento del composto si è riscontrato dopo sole poche ore di trattamento con l’ozono. Rao e collaboratori (2000b), utilizzando mutanti di Arabidopsis per la sintesi di JA, hanno scoperto che questa molecola gioca un ruolo importante nella modulazione della morte cellulare indotta da ozono e dipendente da SA: l’acido jasmonico infatti interferisce con il pathway di quest’ultimo (il segnale dell’JA funziona da antagonista del segnale dell’SA) e attenua la produzione di AOS, lasciando inalterati i meccanismi di difesa cellulare.
L’JA sembra inoltre avere un ruolo nel contenere la propagazione delle lesioni AOS-dipendente; geni marker inducibili da JA sono stati usati per cercare di comprendere questo aspetto, e sembra che l’azione sia espletata tramite l’induzione di geni codificanti recettori per l’etilene. L’aumento di queste proteine porta ad una riduzione di sensibilità nei suoi confronti, quindi anche ad una riduzione dell’accumulo delle AOS etilene-dipendenti: tutto ciò si traduce in un blocco della propagazione delle lesioni (Rao et al., 2000b).
2.3.3 L’Etilene
L’etilene nelle piante è un ormone gassoso che regola molti processi durante le varie fasi di sviluppo (compresa la senescenza) e di risposta a stress (Wang et al., 2002; Klee, 2004); è inoltre coinvolto nella regolazione della morte cellulare programmata (PCD), sia in alcune fasi della crescita della pianta che in risposta a meccanismi inducibili (Hatfield and Bennett, 1997; Lund et al., 1998). I geni coinvolti nella sua biosintesi sono raggruppabili in famiglie, in cui si trovano riuniti i vari geni o set di geni che rispondono ai diversi momenti dello sviluppo della pianta o agli attacchi ambientali.
La produzione di etilene nelle piante avviene per via enzimatica attraverso la conversione della S-adenosilmetionina (SAM) via acido 1-amminociclopropan-1-carbossilico (ACC).
La formazione di ACC da SAM è catalizzata dall’enzima ACC sintasi (ACS) e tale reazione rappresenta spesso uno step limitante, come anche la formazione di etilene dall’ACC catalizzata dall’ACC ossidasi (Nakajima, 2002a). Il danno indotto alle foglie dall’esposizione ad ozono è preceduto da un rapido aumento dell’attività dell’enzima ACS, del contenuto in ACC e dell’emissione di etilene, tutti fattori richiesti per l’accumulo di AOS e l’insorgere delle lesioni (Overmyer 2000; Moeder 2002; Nakajima, 2002b; Rao et al., 2002).
In caso di esposizione acuta all’O3, nelle piante si verifica un incremento della produzione di etilene entro i primi 30 minuti e rappresenta perciò una delle prime risposte allo stress, che precede inoltre le sintesi di JA e SA. Wang e collaboratori (2002) hanno comunque messo in luce l’importanza che riveste il pathway del segnale dell’SA per una ottimale induzione della sintesi etilenica in risposta al gas, e che etilene e SA agiscono sinergicamente per conseguire la morte cellulare indotta dall’ozono.
Usando mutanti di Arabidopsis (Overmyer et al.,2000) si è dimostrato che due sono i processi che controllano lo sviluppo di lesioni indotte dall’O3: l’inizio della loro comparsa (etilene- indipendente) e la loro propagazione (etilene-dipendente, in cui cioè l’ormone riveste il ruolo di modulatore della diffusione).
Più precisamente sono tre i processi coinvolti nello sviluppo delle lesioni: primo l’induzione della morte cellulare, secondo la propagazione del meccanismo di morte cellulare alle cellule strettamente vicine alla prima, e terzo il contenimento della morte cellulare e quindi delle lesioni fogliari (Rao et al., 20001, 2002). Overmyer e collaboratori (2003) proposero un modello che assegnava all’SA un ruolo centrale nello stimolare la formazione delle lesioni in piante esposte ad O3 (Rao et al., 2000b); durante le prime morti cellulari il segnale dell’JA è soppresso da SA ed etilene. Da questo sito iniziale l’intensa produzione di etilene si diffonde alle cellule circostanti rendendole competenti per la PCD. Ciò porta alla sintesi di JA che attiva un contenimento delle lesioni da esso dipendente; l’JA può antagonizzare il diffondersi delle lesioni in diversi modi, ad esempio tramite soppressione della sintesi dell’SA o attenuando la sensibilità delle cellule all’etilene.
L’etilene induce cambiamenti che portano ad un aumento di espressione dei geni associati alla senescenza (SAGs) e ad una diminuzione di quelli codificanti per proteine fotosintetiche (Long and Naidu, 2002). Infatti una “senescenza prematura” (ovvero una lenta morte celulare) corrisponde a quello che accade nell’esposizione cronica all’O3, durante la quale la produzione di etilene è incrementata in modo non massivo (Pell et al., 1997), mentre nel caso dell’esposizione acuta ha luogo una morte cellulare rapida che porta al formarsi di lesioni necrotiche, similarmente alla risposta ipersensibile; sembra comunque che sia richiesto il raggiungimento di un livello critico di AOS e SA (entrambi necessari per la produzione di etilene) per perché si abbia il verificarsi di quest’ultimo caso (Rao and Davis, 1999). Detto questo possiamo riassumere dicendo che nelle piante in cui, in risposta all’O3, si accumulano alti livelli di AOS e SA sia più frequente una risposta simile alla HR, mentre in quelle in cui si accumulano bassi livelli di questi due composti sia più comune l’insorgere di una prematura senescenza (Rao et al., 2001).
2.3.4 Visione generale delle reti del segnale
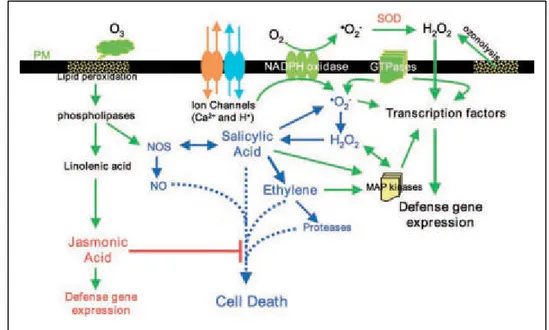
I pathway del segnale di JA, SA ed etilene rivestono un ruolo molto importante nella modulazione della morte cellulare e delle risposte di difesa delle piante indotte dall’O3. In figura 1.5 è riportato un ipotetico modello di come queste vie si intersechino tra loro in una rete complessa.
Fig 1.5: ipotetico
modello
rappresentante la rete dei segnali (da Rao et al., 2001). PM, membrana plasmatica.
Una volta entrato nei tessuti della cellula tramite gli stomi, l’O3 reagisce inizialmente con le molecole organiche che costituiscono la parete cellulare e la membrana plasmatica, generando AOS tramite ozonolisi. Si determinano così dei cambiamenti nelle caratteristiche fisico-chimiche della membrana e di conseguenza delle alterazioni nel flusso ionico che possono avere come risultato l’attivazione del burst ossidativo, che genera specie attive dell’ossigeno come H2O2 e •O2-: tutti questi fattori attivano tutta una sere di cascate del segnale che portano all’attivazione di MAP-chinasi, GTP-binding proteins e l’alterazione dei livelli di molecole segnale quali Ca2+, Sa, JA e etilene. Le AOS derivate da O3 modificano l’attività delle fosfolipasi, portando ad un aumento dei livelli di NO e SA; quest’ultimo potenzia l’amplificazione del feedback derivato dall’abbondanza di AOS, NO, SA, ed etilene, tutti promotori della morte cellulare (linee blu in figura 1.5). L’etilene, come visto precedentemente, induce proteasi e lipasi che promuovono la senescenza, che altro non è che una lenta morte cellulare. Dall’altra parte, i cambiamenti indotti dall’O3 nell’acido linolenico possono favorire la biosintesi di JA e di metil- jasmonato , entrambi composti che attenuano la morte cellulare senza interferire con le risposte di difesa della pianta (linee rosse in figura 1.5). Mentre l’interazione tra AOS, NO e SA indotte dall’O3 determinano l’originarsi e il propagarsi delle lesioni, il valore del bilancio tra il segnale dell’JA ed i regolatori positivi della morte cellulare modula l’intensità di formazione delle lesioni, appunto, e permette alle piante di adattare le loro risposte in maniera specifica contro concomitanti fattori ambientali e necessità di sviluppo.
Tra le molecole segnale correlate alle risposte di difesa, solo l’etilene è stato studiato in modo più approfondito nelle specie arboree (Koch et al., 2000), mentre le altre sono state identificate principalmente in specie erbacee. Considerando che le molecole caratterizzate in queste ultime variano abbastanza tra le diverse specie e che le piante arboree hanno caratteristiche uniche che le differenziano dalle erbacee (longevità, processi che portano alla formazione del legno), è possibile che gli alberi presentino sistemi di difesa e di trasmissione del segnale diversi da quelli delle specie erbacee.
Il preciso ruolo delle AOS nella morte programmata delle cellule (PCD) è ancora materia di studio (Loake, 2001), nonostante sia chiaro la loro importanza chiave in tale processo. Ciò è dovuto al fatto che alcune AOS, ed in particolare il H2O2, siano implicate nell’induzione di molte e diverse risposte di difesa delle piante, perciò ci si domanda se i pathways del segnale che portano alla morte cellulare non si sovrappongano con quelli attivati durante il normale sviluppo, gli stress ambientali e gli attacchi dei patogeni (Wang et al., 1996).
3. I fattori di trascrizione WRKY
Le proteine WRKY costituiscono una famiglia di fattori di trascrizione estremamente numerosa; la loro presenza è stata riscontrata solo nelle piante e, dato l’elevato numero di membri che ne fanno parte e le molte differenze presenti tra di essi, si sostiene che la loro origine risalga addirittura ai primi eucarioti (Eulgem et al., 2000).
Queste proteine hanno tutte una regione comune lunga circa 60 amino acidi (dominio WRKY) che comprende sia la sequenza del motivo conservato WRKY (WRKYGQK, da cui prende il nome questa famiglia di fattori di trascrizione) che il motivo zinc finger-like.
Il loro sito di legame sul DNA è stato ben definito: i fattori WRKY mostrano un’alta affinità di legame verso la sequenza chiamata W box , (C/T)TGAC(T/C) (Eulgem et al., 2000), anche se in alcuni casi è stata riscontrata una preferenza di legame diversa. L’attività di legame W box dipendente dalle necessita sia del motivo aminoacidico WRKY che dei residui di cisteina e istidina del domini WRKY , che coordinano tetraedricamente un atomo di zinco (Maeo et al., 2001).
Nonostante la forte conservazione del loro dominio di legame al DNA, le strutture delle proteine WRKY sono altamente divergenti e possono pertanto essere classificate in gruppi distinti che riflettono anche le loro diverse funzioni.
Molto non si sa però dei processi fisiologici e programmi di sviluppo che necessitano dell’attività delle proteine WRKY; essendo fattori di trascrizione dovrebbero agire dirigendo e regolando l’espressione spaziale e temporale di specifici geni, assicurando una appropriata risposta cellulare a stimoli interni ed esterni (Ülker e Somssich, 2004). Ad esempio sembrano essere coinvolte in vari programmi fisiologici unici delle piante, inclusi la difesa da patogeni, la senescenza e lo sviluppo di tricomi.
3.1 Origine dei geni WRKY
Fino ad oggi, le proteine WRKY sono state trovate esclusivamente nelle piante, facendo pensare ad un loro ruolo importante nel processo evolutivo: in generale l’evoluzione biologica dalle forme ancestrali alle forme di vita più evolute è connessa ad un aumento delle capacità regolatorie, evidenziando una correlazione positiva tra compelesssità di un organismo e proporzione dei geni coinvolti nei processi di informazione. L’aumento della complessità biologica coincide perciò con la comparsa o l’espansione di gruppi di geni regolatori, come quelli della famiglia WRKY.
In tutte le piante superiori analizzate sono stati trovati numerosi membri appartenenti ai tre gruppi principali di questa famiglia, i quali differiscono per il numero di domini WRKY e nel pattern del motivo zinc finger-like (Eulgem et al., 2000); nelle piante inferiori sequenze EST (expressed sequence tags: sequenza espressa etichettata) sono state identificate in felci e muschi.
In Physcomitrella patens si sono isolati ulteriori rappresentanti delle WRKY, rivelando che questo muschio contiene 12 geni WRKY. Interessante è stato scoprire che nonostante nelle piante superiori i membri del gruppo-III comprendano il 20% della famiglia, nessuno ne è stato trovato in P. patens.
In Arabidopsis circa tutti i membri del gruppo-III rispondono a diversi stress biotici, suggerendo che questo gruppo si sia formato tardi nelle piante terrestri, forse come conseguenza di una aumentata pressione ambientale.
L’alga verde Chlamydomonas reinhardtii contiene solo un gene WRKY, appartenente al gruppo-I che codifica per due domini WRKY la cui espressione è basate sulla presenza di EST. Ricerche tramite il data base GeneBank rivelano l’esistenza di sequenze simili alle WRKY del gruppo-I in due eucarioti non fotosintetici, una muffa ed un protista unicellulare: ciò implica che i geni del gruppo-I possono rappresentare la forma ancestrale e che i geni WRKY si sono originati qualcosa come 1.5-2 miliardi di anni fa negli eucarioti, quindi prima della divergenza del philum dei vegetali. Il perché si siano espansi così enormemente nelle piante mentre in animali e lieviti si siano persi lungo la linea del tempo ancora non è chiaro.
3.2 Caratteristiche della superfamiglia WRKY
I primi cDNA di proteine WRKY sono stati clonati da patata dolce (Ipomea batatas; SPF1), avena selvatica (Avena fatua; ABF1,2) e da prezzemolo (Petroselinum crispum; PcWRKY1,2,3) e Arabidopsis (ZAP1) basati sulle proprietà delle proteine codificate di legarsi allo specifico motivo (C/T)TGAC(T/C) sul DNA, conosciuto come W box (Ishiguro and Nakamura, 1994; Rushton et al., 1996; Pater et al., 1996)
Il nome WRKY per la famiglia identificata deriva dal dominio chiamato appunto WRKY, costituito da 60 amino acidi, comune e altamente conservato tra queste proteine; i membri della famiglia sono fattori di regolazione della trascrizione con preferenza di legame per le W box, ma con il potenziale di regolare differentemente l’espressione di vari geni target (Eulgem et al., 2000)
3.2.1 Dominio wrky e w box
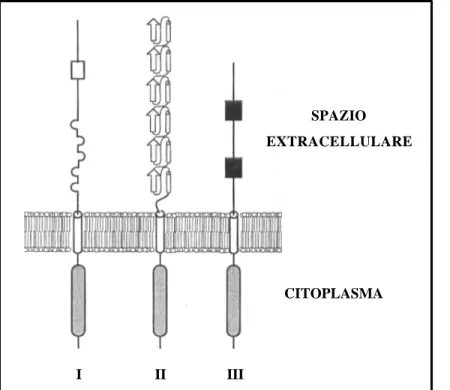
Il dominio WRKY è definito dalla sequenza aminoacidica conservata WRKYGQK, a monte di un motivo di legame per lo zinco (figura 1.10) (Rushton et al, 1995). Data la chiara preferenza di legame per lo stesso motivo sul DNA, è stato assunto che il dominio WRKY costituisca il dominio di legame sul DNA; lo zinco in ogni caso riveste una notevole importanza in questo processo, che è stata compresa per mezzo di esperimenti in vitro in cui si è visto che l’utilizzo di sostanze in grado di chelare i metalli abolivano in queste proteine la capacità di legarsi al DNA (Rushton et al, 1995; Pater et al., 1996; Hara et al., 2000). Nonostante questo però ancora non è stato dimostrato che lo zinco sia realmente complessato nel dominio WRKY, e neppure quali siano le funzioni dell’eptapeptide WRKYGQK.
Le proteine WRKY possono essere classificate sia in base al numero di domini WRKY che posseggono sia in base alle caratteristiche del motivo di zinc finger-like. Le WRKY con due domini appartengono al gruppo I mentre la maggior parte delle proteine con un solo dominio al gruppo II; generalmente i domini di questi due gruppi hanno lo stesso tipo di
motivo per lo zinco, il cui pattern del potenziale ligando per il metallo è unico tra tutti i motivi descritti (C–X4–5–C–X22-23–H–X1–H; figura 1.10) (Berg and Shi, 1996).
In un piccolo sottogruppo di WRKY il motivo zinc finger-like è diverso dai due gruppi precedenti: invece del pattern C2-H2, il loro dominio WRKY contiene il motivo C2-HC (C– X7–C–X23–H–X1–C; figura 1.10) e per tale differenza, sono state raggruppate in un gruppo separato, il gruppo III. Queste proteine legano specificatamente diverse W box.
Fig. 1.10: Comparazione tra le sequenze dei domini WRKY di proteine AtWRKY. Le sequenze codificanti la sequenza
WRKYGQK del peptide sono state trovate tramite i programmi tblastn e blastp (Altschul et al., 1997) in database per sequenze genomiche e EST. I gap (puntini) sono stati inseriti per ottenere un allineamento ottimale. I residui altamente conservati dentro ognuno dei maggiori gruppi sono in rosso, e i potenziali ligandi per lo zinco (zinc finger-like) evidenziati in nero. Per ogni (sotto)gruppo, la posizione di un introne conservato è indicata da una freccia (da Eulgem et
I due domini WRKY del gruppo I sembrano avere funzioni distinte. Come è stato mostrato per SPF1, ZAP1 e PcWRKY1, il legame alle specifiche sequenze dei loro DNA target è mediato principalmente dal dominio WRKY C-terminale (Ishiguro and Nakamura, 1994; Pater et al., 1996; Eulgem et al, 1999), mentre la funzione di quello N-terminale ancora non è stata chiarita. Dato però che la regione esterna al dominio C-terminale contribuisce a rafforzare il legame sul DNA, il dominio N-terminale potrebbe partecipare anch’esso al processo di legame, incrementando l’affinità o la specificità dei loro siti target. In alternativa quest’ultimo motivo potrebbe fornire un’interfaccia per le interazioni proteina-proteina, funzione riconosciuta ai motivi zinc finger-like (Mackay and Crossley, 1998), permettendo così una maggiore efficienza del legame attraverso interazioni con altre proteine associate al DNA. I singoli domini WRKY dei membri del gruppo II e III hanno una sequenza più simile a quella del dominio C-terminale dei membri del gruppo I, facendone supporre una funzionalità equivalente.
La conservazione del dominio WRKY è rispecchiata dalla conservazione degli affini elementi W box cis–acting. La sequenza (C/T)TGAC(T/C) di questi elementi contiene il nucleo TGCA invariato, essenziale per il funzionamento e il legame con le WRKY. Le W box mediano la risposta trascrizionale a elicitori derivati da patogeni (Rushton et al.,1996) e sono presenti nei promotori di molti geni delle piante associati alla difesa (Rushton and Somssich, 1998). L’interazione delle proteine WRKY con le W box può essere rego lata post-trascrizionalmente, come ad esempio può accadere in tabacco tramite trattamento con fosfatasi alcalina (Yang et al., 1999).
Dal punto di vista sterico, nonostante la preferenza di legame delle WRKY nei confronti delle W box, l’affinità di questo legame varia al variare dei diversi membri della famiglia queste. Le sequenze fiancheggianti il nucleo TGCA delle seconde può essere parzialmente responsabile della specificità, mentre per quanto riguarda le proteine WRKY, essendo caratterizzate da una notevole variabilità nelle strutture complessive, l’accesso a certi promotori può essere ristretto solo a quei membri che meglio si adattano alla forma tridimensionale di tale complesso (Eulgem et al., 2000). Le proteine WRKY, possono poi interagire tra loro formando dei dimeri funzionali, come confermato dalla scoperta di strutture chiamate leucine-zippers che se rimosse portano ad una diminuzione della funzionalità nella regolazione dell’espressione (Eulgem et al., 2000).
3.2.2 Regolazione della trascrizione
ZAP1 e PcWRKY1, 4 e 5 possono attivare la trascrizione in lievito (Pater et al., 1996; Eulgem et al., 1999), una caratteristica confermata per ZAP1 e PcWRKY1 in cellule vegetali (Pater et al., 1996; Eulgem et al., 1999). Anche se deve ancora essere stud iata in dettaglio, la struttura primaria delle WRKY possiede molti domini che potenzialmente possono attivare o reprimere la trascrizione; una caratteristica comune a tanti di questi domini è la predominanza di certi amino acidi, come alanina, glutammina, prolina, serina e treonina (Triezenberg, 1995; Hanna-Rose and Hansen, 1996).
3.3 Complessità della famiglia WRKY in Arabidopsis
La grande quantità di sequenze genomiche e di cDNA disponibili per Arabidopsis ha portato a comprendere la grande complessità della famiglia delle proteine WRKY in questa specie, presa perciò come modello.
I geni AtWRKY sono distribuiti casualmente nei 5 cromosomi e, da analisi preliminari, sembrano essere presenti in singola copia; molte di queste putative proteine WRKY sono rappresentate da EST, dimostrando che i corrispondenti geni sono espressi. In Arabidopsis fino ad oggi sono stati trovati 72 geni espressi per fattori WRKY che in base al numero e alla sequenza dei loro domini WRKY, le rispettive proteine sono state assegnate ai tre gruppi principali prima descritti. In base a studi filogenetici, è stato scoperto che il gruppo II può essere a sua volta suddiviso in 5 sottogruppi (IIa-e) (Eulgem et al., 2000). Tale riclassificazione è confermata dalla presenza di 10 ulteriori motivi strutturali conservati in alcuni membri della famiglia AtWRKY. Ognuno di questi motivi si ritrova solo in alcuni sottogruppi, ognuno dei quali sembra essere definito da combinazioni di tali motivi (Eulgem et al., 1999). In certi casi, le loro sequenze possono rivelare informazioni sulla funzione che svolgono.
Nei membri del gruppo I è presente un motivo D conservato nella porzione N-terminale che può essere fosforilato dalla MPK4, una MAP-chinasi che reprime il segnale dell’acido
salicilico (Andreasson et al., 2005). Una caratteristica evidente di questo motivo è infatti un pattern conservato di dimeri “serina-prolina”, sito di attacco preferenziale per le MAP-chiansi, su cui operano la fosforilazione (Davis, 1993).
Nel gruppo IIa si ritrova invece il motivo N-teminale leucine-zipper che permette la omo- e la etero- dimerizzazione tra i membri di questo sottogruppo (Xu et al., 2006). L’abilità dei fattori WRKY IIa di formare combinazioni di dimeri, con funzioni potenzialmente diverse, può almeno in parte spiegare i dati contrastanti riguardanti una positiva (Wang, Amornsiripanitch and Dong, 2006) o negativa (Xu et al., 2006) regolazione della resistenza basale contro P. syringae.
Tra i membri del gruppo IId si ritrova uno zinc cluster, appena prima del dominio WRKY; mutazioni interne alla sequenza di questo motivo determinano un ridotto legame del fattore di trascrizione AtWRKY11 alla W box, facendo pensare perciò ad un suo ruolo nell’aumentare l’affinità con il DNA (Eulgem et al., 2000; Babu et al., 2006).
Una ulteriore caratteristica comune a tutti i geni WRKY, è la presenza di un introne all’interno alla regione codificante il dominio WRKY singolo dei gruppi II e III e quello C-terminale del gruppo I (Eulgem et al., 2000); la sua posizione è altamente conservata (indicata dalla freccia in figura 1.10).
Un piccolo numero di proteine AtWRKY non rientrano nettamente in nessun sottogruppo; ad esempio la AtWRKY10 presenta un solo dominio WRKY ma sembra rassomigliare maggiormente ai membri del gruppoI, il che potrebbe essere spiegato ipotizzando che abbia subito la perdita del dominio WRKY N-terminale in un secondo momento.
3.4 Ruolo biologico dei fattori WRKY
Molti ricerche sono state portate avanti nel tentativo di capire il processo di regolazione attuato dalla proteine WRKY, ad esempio mediante studi sull’espressione genica. Dato che molti geni WRKY subiscono a loro volta una regolazione a livello trascrizionale, il loro
pattern di espressione può aiutare la comprensione delle funzioni regolatorie dei fattori codificati in particolari condizioni biologiche. Una piena comprensione del ruolo biologico svolto da questi fattori richiede però anche l’identificazione dei geni target dei quali l’espressione (Eulgem et al, 2000).
3.4.1 Comportamento dell’espressione dei geni WRKY
Alcuni dati mostrano la proprietà di molte proteine WRKY di possedere funzioni regolatorie in risposta ad infezione di patogeni ed altri stress (Somssich and Hahlbrock, 1998). L’effettiva risposta di difesa della pianta contro microrganismi patogeni è associata alla attivazione combinata di una ampia varietà di geni, che si verifica in tempi diversi. Dati sperimentali riportano un aumento indotto dei livelli di WRKY come mRNA, proteina e attività di legame al DNA in seguito ad infezione della pianta da parte di virus (Wang et al., 1998), batteri, oomiceti (Eulgem et al., 1999) elicitori fungini (Cormack et al., 2002) e da sostanza segnali come l’acido salicilico (Yang et al., 1999); l’espressione è up-regolata anche in risposta a ferite (Hara et al.,2000) ed in seguito a stimolazioni meccaniche sui protoplasmi (Gus-Mayer et al., 1998).
L’accumulazione indotta dell’mRNA di WRKY è spesso estremamente rapida e transiente ciò indica il ruolo che le proteine WRKY hanno nel regolare i geni di risposta secondari, i cui prodotti portano avanti le reazioni di protezione e difesa (Cormack et al., 2002):.
Studi comparativi sull’espressione effettuati con vari geni AtWRKY, hanno suggerito per certi membri della famiglia un ruolo nella regolazione della senescenza (Robatzek and Somssich, 2002); ad esempio piante di Arabidopsis transgeniche per il promotore AtWRKY6 legato al gene reporter GUS hanno mostrato un notevole accumulo del promotore nelle foglie senescenti, in maniera analoga a quanto avviene in seguito a stress biotico, facendo ipotizzare l’esistenza di meccanismi regolatori comuni tra questi due processi fisiologici (Quirino et al, 1999).