2
ISCHEMIA CEREBRALE
L’ischemia cerebrale rappresenta una delle maggiori cause di morte e di invalidità nel mondo. Per ischemia si intende la mancanza di un adeguato afflusso di sangue al cervello e si verifica quando la circolazione sanguigna viene interrotta a causa di un’ostruzione dell’arteria che irrora il tessuto cerebrale. Per questo motivo è possibile che, a seconda della parte cerebrale colpita, alcune funzioni (motorie, cognitive, del linguaggio) ne risultino indebolite o che vengano addirittura compromesse.
Gli emboli e i trombi sono le cause dell’ischemia cerebrale. I trombi tendono a formarsi in vasi sanguigni danneggiati soprattutto dall’aterosclerosi, cioè da depositi di sostanze grasse sulle pareti arteriose interne, che tendono a restringere il lume del vaso. Lo stesso risultato si verifica quando nel sistema circolatorio si forma un grumo di sangue, l’embolo, che viaggia nel flusso, si fissa nell’arteria cerebrale e, se sufficientemente grande, blocca la corrente sanguigna verso il cervello.
Il cervello, essendo privo di riserve di ossigeno e di glucosio, è particolarmente sensibile e vulnerabile nei confronti del danno ischemico. I neuroni, privati di ossigeno e sostanze nutrienti, anche solo per pochi minuti, esauriscono rapidamente le proprie riserve energetiche, ed iniziano a morire. Il tessuto cerebrale esposto al danno ischemico, può avviarsi a morte con due modalità:
morte di tipo necrotico, costituita da una rapida sequenza di eventi cellulari che avvengono in un ristretto spazio temporale causandone la lisi;
morte di tipo apoptotico, una morte ritardata e programmata, caratterizzata da un’attiva sintesi proteica.
L’85% degli ictus è su base ischemica, mentre per la restante parte se ne riconosce un’eziologia emorragica e, per quanto meno comune, è più frequentemente fatale. Quando un vaso sanguigno del cervello si rompe, il sangue si riversa nei tessuti cerebrali circostanti danneggiando le cellule. Tutte le aree cerebrali circostanti che
3
si trovano oltre l’emorragia non ricevono più sangue e subiscono lo stesso danno dell’ictus ischemico.
Figura 1: Rappresentazione schematica di ictus emorragico e ictus ischemico
Nell’ischemia cerebrale si verifica una riduzione dell’apporto di ossigeno e di glucosio al sistema nervoso centrale. Questo processo determina un danno cerebrale attraverso una varietà di meccanismi molecolari e cellulari. Comunemente l’ischemia cerebrale viene classificata in:
ischemia globale
ischemia focale
L’ischemia globale è l’espressione di una riduzione del flusso ematico cerebrale estesa al cervello o alla maggior parte di esso, mentre quella focale determina una diminuzione del flusso sanguigno in una regione cerebrale specifica.
Il primo evento nel corso dell’ischemia è l’inibizione della catena di trasporto elettronico e quindi della fosforilazione ossidativa. Di conseguenza si verifica una drastica perdita di ATP. Tale perdita modifica significativamente il mantenimento
4
dell’omeostasi intracellulare. Le pompe ioniche ATP-dipendenti (Na+
/K+-ATPasi) in assenza dei substrati energetici sono inibite e ciò compromette il fisiologico mantenimento del gradiente di concentrazione transmembrana in quanto il potassio intracellulare fuoriesce dalla cellula, mentre il sodio extracellulare si accumula a livello intracellulare. Il risultato è una depolarizzazione della membrana che determina l’attivazione dei canali per il calcio voltaggio-dipendenti.
Un evento chiave della cascata ischemica è l’eccessivo rilascio degli amminoacidi eccitatori (EAA). L’apertura dei canali per il calcio determina un flusso intracellulare di tale ione che stimola il rilascio del glutammato a livello dei terminali presinaptici con conseguente attivazione di eventi citoplasmatici e nucleari implicati nel danno cellulare [1].
Il glutammato è il più importante neurotrasmettitore ad azione eccitatoria del sistema nervoso centrale. Esercita la propria azione mediante l’attivazione di classi diverse di recettori ed è rimosso dalla fessura sinaptica mediante un meccanismo sodio-dipendente ad opera di sistemi di ricaptazione altamente specifici situati sulle membrane delle cellule nervose. I recettori del glutammato si distinguono in:
1. recettori metabotropici, costituiti da un recettore accoppiato ad altre proteine e responsabili di reazioni enzimatiche;
2. recettori ionotropici, che controllano l’apertura dei canali ionici.
I recettori ionotropici sono complessi polimerici costituiti da 4,5 subunità e ciascuna di esse contribuisce alla formazione di un canale ionico transmembrana che si apre all’interazione con il glutammato.
In base alla loro affinità per il glutammato, vengono distinte due classi principali di recettori ionotropici:
recettori a bassa affinità, o non-NMDA (non leganti il N-metil-D-aspartato) i quali a loro volta si suddividono in recettori AMPA e recettori KAINATO;
recettori ad alta affinità, o NMDA (leganti il N-metil-D-aspartato). Sono connessi ad un canale ionico per il sodio e calcio e possiedono, oltre a quello per il glutammato, anche un sito di legame per la glicina.
5
L’attivazione del recettore avviene solo in presenza del legame di entrambi i trasmettitori e di una depolarizzazione della membrana cellulare di entità tale da vincere il blocco del canale voltaggio-dipendente prodotto dagli ioni magnesio.
Numerosi studi sperimentali hanno dimostrato le proprietà neurotossiche del glutammato. L’attivazione recettoriale comporta un incremento delle concentrazioni di calcio intracellulare [2], il quale attiva numerosi enzimi, tra cui fosfolipasi A2 (PLA2), ciclo ossigenasi (COX), ossido nitrico sintasi (NOS), che portano a morte cellulare tramite la produzione di radicali liberi.
Le specie reattive dell’ossigeno (ROS), come l’anione superossido, sono molecole prodotte anche in condizioni fisiologiche ma rivestono un ruolo particolarmente importante nel processo degenerativo dell’ischemia. I radicali liberi vengono generati da altre cascate biochimiche e sono responsabili dei danni alla membrana (perossidazione lipidica), al DNA (mutagenesi), e alle proteine con conseguente morte cellulare.
Le cellule neuronali, compromesse dall’eccessiva attivazione dei recettori per il glutammato, dall’eccesso di ioni calcio, dalla formazione di radicali liberi e da tutti gli eventi che ne conseguono, possono andare incontro a necrosi o ad apoptosi.
6
OSSIDO NITRICO SINTASI (NOS)
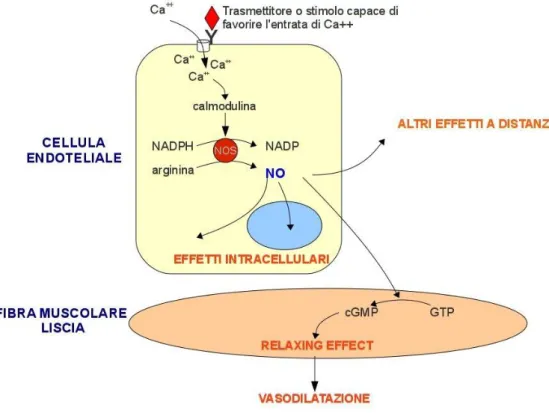
L’ossido nitrico sintasi (NOS) è un enzima dimerico costituito da un dominio ossigenasico all’azoto terminale contenente eme e un gruppo reduttasico al carbonio terminale [3]. La NOS sintetizza ossido nitrico (NO) attraverso l’ossidazione dell’L-arginina in L-citrullina con un meccanismo calcio/calmodulina-dipendente.
Sono state identificate 3 isoforme della NOS che sono prodotte da 3 geni distinti e che hanno diverse localizzazioni, regolazioni, proprietà catalitiche, sensibilità agli inibitori.
Sono comunemente chiamate:
• n-NOS, nota come NOS-I e NOS-1 perché identificata per prima e situata nei tessuti neuronali;
• i-NOS, chiamata anche NOS-II e NOS-2, è l’isoforma inducibile in una vasta gamma di cellule e tessuti;
• e-NOS, chiamata anche NOS-III e NOS-3 perché situata nei tessuti endoteliali.
ISOFOMA PROTEINE Ca
2+
DIPENDENZA ESPRESSIONE
DISTRIBUZIO NE TESSUTI
n-NOS 160 Ca2+ dipendente Costitutiva
sistema nervoso centrale i-NOS
130 Ca2+ indipendente Inducibile macrofagi e-NOS 135 Ca2+ dipendente Costitutiva Cellule
endoteliali
Figura 2: Rappresentazione delle isoforme dell’ossido nitrico sintasi
Queste isoforme si distinguono anche in base alla dipendenza allo ione calcio. In particolare la n-NOS e la e-NOS sono calcio dipendenti e sono responsabili della produzione di piccole quantità di NO in risposta a stimoli fisiologici. La i-NOS,
7
indotta da fattori immunologici , è continuamente attiva e rilascia NO per un lungo periodo indipendentemente dai livelli di calcio. Infatti e-NOS e n-NOS provocano piccole variazioni di NO in risposta a transitori aumenti di calcio intracellulare mentre la forma i-NOS provoca una continua produzione di NO finchè il substrato è presente e può essere appunto definita come calcio-indipendente.
L’attivazione degli enzimi e-NOS e n-NOS è indotta soprattutto da sostanze quali l’acetilcolina, la bradichinina, la serotonina mentre l’attivazione della i-NOS è promossa da interferone g, citochine ed endotossine batteriche.
Un’ulteriore differenza tra le isoforme e-NOS e n-NOS rispetto alla isoforma i-NOS è data dalla regolazione della loro espressione. Le e-i-NOS e n-i-NOS sono espresse a livelli basali nelle cellule; la i-NOS è invece assente e la sua espressione è indotta a livello trascrizionale [4]. Inoltre l’espressione di questa isoforma è regolata dai livelli di NO stesso in quanto è in grado di legarsi al fattore citosolico NF-KB impedendone la sua traslocazione nel nucleo e quindi la stimolazione della trascrizione del gene per la i-NOS [5]. Questa differenza ha portato alla definizione di ‘costitutive’ per la n-NOS ed e-NOS e ‘inducibile’ per la i-NOS
.
8
Oltre alle tre comuni isoforme, esiste un’altra isoforma dell’enzima denominata NOS mitocondriale (mt-NOS) presente all’interno dei mitocondri ed espressa costitutivamente. La mt-NOS è legata alla membrana interna dei mitocondri ed interagisce attraverso il suo dominio PDZ con la citocromo c ossidasi e con il complesso I della catena di trasporto mitocondriale. In condizioni fisiologiche la produzione di NO, da parte della mt-NOS, ha importanti implicazioni nel mantenere il metabolismo cellulare poiché è in grado di modulare il consumo di ossigeno nei mitocondri attraverso il suo legame irreversibile con la citocromo c ossidasi. Al contrario, elevate concentrazioni di NO, possono causare l’inibizione irreversibile della catena di trasporto mitocondriale, indurre stress ossidativo e portare alla morte cellulare [6].
La reazione più importante catalizzata dalla NOS è la sintesi dell’ossido nitrico a partire dall’amminoacido L-arginina in una reazione multistep con formazione di L-citrullina e NO. L’enzima per funzionare utilizza O2 come altro reagente e come cofattori FAD, NADPH, FMN (flavin adenin di nucleotide) e BH4 (tetraidrobiopterina) [7]. La biosintesi dell’NO operata dalla NOS si articola in due passaggi successivi: il primo passaggio consiste nell’ossidazione dell’L-arginina a N-idrossidell’L-arginina (NHA) che utilizza un equivalente di NADPH e di O2; nel secondo passaggio l’NHA viene convertita in NO e L-citrullina utilizzando 0,5 equivalenti di NADPH ed una molecola di O2.
Figura 4: Sintesi dell’ossido nitrico
NH N H2 NH N H3 + COO -NH N H2 N N H3 + COO -OH NH N H2 O N H3 + COO
-+
NADPH O2 NADPH O2L-Arginina L-Idrossiarginina L-Citrullina
9
OSSIDO NITRICO (NO)
L’ossido nitrico, NO, si è rivelata una delle molecole più interessanti degli ultimi vent’anni, in grado di regolare funzioni fisiologiche e fisiopatologiche di tipo cardiovascolare, immuno-infiammatorio e neuronale. Nel 1980 Furchgott e Zawadzki scoprirono che c’era una sostanza prodotta dalle cellule endoteliali della muscolatura liscia, che era in grado di stimolare la vasodilatazione in seguito a stimolazione con acetilcolina. Questo principio venne genericamente chiamato EDRF ‘endothelium derived relaxing factor’. Esso è capace di provocare rilassamento delle cellule muscolari lisce dei vasi vicini ed è prodotto dall’endotelio con una breve emivita. L’analisi e il confronto delle proprietà farmacologiche e biochimiche di questa molecola, dimostrarono che EDRF e NO coincidevano. Questa scoperta rese definitivamente credibile il fatto che l’NO fosse una molecola potenzialmente importante nella biologia molecolare.
L’ossido nitrico prodotto dalla e-NOS è il più importante vasodilatatore endogeno. Il meccanismo attraverso cui esplica la sua azione è l’ attivazione della guanilato ciclasi solubile (GCS) e il conseguente accumulo della guanosin-monofosfato ciclico (GMPC).
In condizioni fisiologiche, la e-NOS è regolata dalla concentrazione di calcio intracellulare ed è attivata da acetilcolina e bradichinina. L’NO che diffonde dalle cellule endoteliali, stimolate in modo opportuno, induce il rilassamento della muscolatura del vaso sanguigno, attraverso l’attivazione della GCS : una proteina eterodimerica formata da una subunità α e una β, ciascuna con un gruppo eme che è in grado di legarsi all’NO formando un complesso Fe-NO. La formazione di tale complesso induce un cambiamento conformazionale dell’enzima tale da attivarlo e portare all’accumulo di GMPC, un noto secondo messaggero in grado di stimolare la protein-chinasi G (PKG) ed i canali ionici GMPC-dipendenti, coinvolti nel rilassamento muscolare. La PKG fosforila i recettori dell’IP3 (inositolo trifosfato) noti come InSP-3, situati sulla superficie del reticolo sarcoplasmatico (SR) delle cellule muscolari liscie e sul reticolo endoplasmatico (RE) delle cellule endoteliali, impedendone il legame con l’IP3. Ciò impedisce il
10
rilascio del calcio dall’SR o dal RE, inibendo la contrazione della muscolatura liscia e inducendo cosi il rilassamento della muscolatura liscia.
In seguito ad una adeguata stimolazione, le cellule endoteliali producono NO che in parte raggiunge la muscolatura liscia causando vasodilatazione e in parte diffonde nel compartimento ematico, riducendo l’aggregazione delle piastrine e l’adesività dei leucociti alle pareti dei vasi sanguigni.
11
NO E FUNZIONI BIOLOGICHE
Oltre all’effetto primario sull’endotelio, all’NO è riconosciuto un ruolo di mediatore biochimico in numerose funzioni:
• a livello cerebrale controlla l’apprendimento e la memoria; • a livello gastrointestinale modula le secrezioni e la motilità;
• a livello respiratorio regola il tono della muscolatura liscia bronchiale; • a livello renale modula l’autoregolazione del flusso ematico;
• a livello del sistema riproduttivo promuove il rilasciamento della muscolatura liscia del corpo cavernoso, tramite l’inibizione della fosfodiesterasi 5, contribuendo in questo modo a migliorare la funzione erettile, variamente compromessa nell’impotenza maschile.
L’NO nel SNC ha un ruolo fondamentale non solo come neuromodulatore ma anche come neurotrasmettitore [8]. La neurotrasmissione mediata da NO, in analogia con la trasmissione adrenergica e colinergica, è definita nitrergica. Come le prime due, quest’ultima media il rilassamento della muscolature liscia dei sistemi respiratori e gastrointestinale e del tratto urogenitale.
Quando il potenziale d’azione raggiunge le terminazioni nervose, l’entrata di calcio attraverso i canali calcio voltaggio-dipendenti porta all’attivazione della n-NOS localizzata a livello citoplasmatico. Contrariamente a quanto avviene per gli altri neurotrasmettitori l’NO, una volta prodotto, non viene depositato nelle vescicole sinaptiche ma è immediatamente rilasciato.
12
Figura 6: Neurotrasmissione nitrergica (NO-mediata)
L’NO ha un ruolo predominante anche nel sistema immunitario. Infatti è parte integrante della risposta infiammatoria contro agenti patogeni, virus e cellule tumorali. Nel sistema immunitario l’NO è prodotto in vari tipi cellulari dalla i-NOS la quale è attivata da una serie di citochine infiammatorie come TNF-α (tumor necrosic factor alpha) attraverso una regolazione di tipo trascrizionale. Infatti il promotore del gene per la i-NOS contiene siti di legame per il fattore trascrizionale NF-KB ( nuclear factor kappa B), il quale è in grado di avviare la trascrizione della i-NOS per azione dei macrofagi.
13
TOSSICITA’ DELL’OSSIDO NITRICO
L’NO è una molecola ad elevata reattività che pur svolgendo molteplici funzioni fisiologiche indispensabili per la regolazione delle funzioni cellulari, è potenzialmente tossica. La tossicità è legata alle sue caratteristiche chimico-fisiche. L’NO è chimicamente ed elettricamente instabile, in quanto l’atomo d’azoto realizza due legami covalenti con l’atomo di ossigeno impegnando solo due dei tre elettroni di cui dispone. Il terzo elettrone dell’atomo d’azoto rimane pertanto spaiato. Tale assetto conferisce all’NO le caratteristiche di un RADICALE LIBERO, ossia una specie chimica molto reattiva. Si tratta di molecole composte da atomi instabili, che presentano un elettrone in meno negli orbitali più esterni. L’elettrone mancante spinge l’atomo ad attirare elettroni da altri atomi in modo da raggiungere la configurazione assoluta: il processo di trasferimento di elettroni è alla base della produzione di energia nelle cellule. La pericolosità di queste specie reattive sta nell’innesco di reazioni a catena in quanto ogni molecola che cede un elettrone ad un atomo instabile a sua volta dovrà riacquistare l’elettrone perduto da un altro atomo, generando vere e proprie catene alla ricerca della stabilità chimica.
Esistono due tipologie di radicali liberi: ROS (reacting oxygen species) e RNS (reacting nitrogen species)
1. ROS rappresentano i prodotti dalla reazione dell’ossigeno i quali a sua volta si distinguono in:
radicali liberi dell’ossigeno (ad esempio lo ione superossido O2- e il radicale ossidrilico OHº) contengono uno o più elettroni spaiati; - le specie non radicaliche (ad esempio il perossido di idrogeno H2O2).
I ROS possono essere generati in diversi distretti cellulari sia in condizioni fisiologiche sia in risposta a vari stimoli. Le maggiori fonti di ROS sono i mitocondri, il reticolo endoplasmatico, la membrana cellulare e il citosol. La catena di trasporto degli elettroni mitocondriale, associata alla fosforilazione ossidativa, rappresenta la maggior fonte di ATP. Durante questo processo
14
metabolico, gli elettroni che fluiscono lungo la catena di trasporto, sfuggono dai processi metabolici e, interagendo con l’ossigeno, generano O2-.
H2O2 non è una molecola in grado di provocare grossi danni, ma la sua tossicità deriva dalla capacità di interagire con i metalli di transizione e formare il radicale OHº che è, al contrario, molto reattivo e capace di danneggiare irreversibilmente le macromolecole cellulari.
2. RNS rappresentano i prodotti dalla reazione dell’azoto.
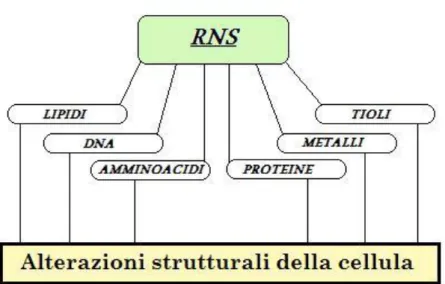
Gli RNS originano dall’interazione dell’NO con le specie reattive dell’ossigeno, in particolare l’interazione dell’NO con l’anione superossido (O2-), porta alla formazione di un composto molto tossico, il perossinitrito (ONOO-) [9].
O2- + NO → ONOO
Gli RNS, allo stesso modo dei ROS, possono reagire con tutte le biomolecole: il DNA, i tioli, gli amminoacidi, i lipidi, le proteine, i metalli, portando all’ossidazione e alla nitrazione.
Fin quando la presenza di radicali liberi nel nostro organismo è proporzionale alla quantità di antiossidanti (sostanze in grado di combattere gli effetti dannosi di tali radicali), l’organismo si trova in una condizione di equilibrio perfetto. L’azione dannosa dei radicali liberi inizia ad avvertirsi quando aumenta la concentrazione di radicali e diminuisce la concentrazione di antiossidanti che ne possono contrastare gli effetti [10].
I radicali liberi, specialmente il O2- e il ONOO- e i non-radicali come H2O2, possono essere generati in quantità tali da soffocare i sistemi enzimatici endogeni, come il superossido dismutasi (SOD) e il glutatione ridotto (GSH). Una superproduzione di ROS corrisponde allo stress ossidativo e quella di RNS prende il nome di stress nitrosativo. In entrambi i casi si ha una condizione patologica causata dallo squilibrio fisiologico fra la produzione e l’eliminazione da parte dei sistemi di difesa antiossidanti, di specie chimiche ossidanti [11]. E’ un processo deleterio per tutte le funzioni cellulari, compresi il DNA, lipidi, membrana e proteine inducendo la morte cellulare tramite la necrosi o l’apoptosi.
15
L’interazione dei radicali liberi con le biomolecole cellulari provoca [12]: Denaturazione delle proteine strutturali;
Perossidazione lipidica degli acidi grassi con alterazione delle membrane; Modificazione e rottura delle catene nucleotidiche degli acidi nucleici e comparsa di mutazioni. In particolare le alterazioni a livello del DNA producono l’accumulo di proteina p53 e la conseguente stimolazione dell’espressione della proteina p21, direttamente coinvolte nell’arresto del ciclo cellulare.
Figura 7: Effetti tossici dei radicali liberi
L’effetto citotossico dell’NO può essere mediato anche dall’interazione delle specie reattive con i mitocondri con conseguente inibizione reversibile della respirazione mitocondriale dove il principale bersaglio dell’NO è l’enzima citocromo c ossidasi, o attraverso l’inattivazione irreversibile degli enzimi mitocondriali (complessi I,II,III della catena respiratoria).
16
PATOLOGIE NEURODEGENERATIVE
La produzione elevata di RNS, lo stress nitrosativo e lo stress ossidativo, sono stati osservati in numerosi stati patologici. Infatti i prodotti di ossidazione dell’NO e dell’ossigeno, sono stati riscontrati ad elevate concentrazioni, nelle malattie cardiovascolari (ischemia cerebrale, ictus, infarto) ma anche nelle malattie degenerative (Morbo di Parkinson, Alzheimer e Huntington) e in alcune forme tumorali [13].
Figura 8: Conseguenze dello stress ossidativo
Lo stress ossidativo è un importante fattore che agisce nelle prime fasi del Morbo di Alzheimer (AD) causando degenerazione delle cellule [14]. Questa malattia è la principale causa di demenza negli anziani e si manifesta clinicamente con una progressiva perdita della memoria, del linguaggio, con alterazioni comportamentali e problemi sociali. Nei tessuti cerebrali di pazienti affetti da Alzheimer si può riscontrare un accumulo di placche senili contenente la proteina Aβ (beta amiloide) e ammassi neuro fibrillari, principalmente costituiti da filamenti elicoloidali appaiati. Meno del 5% dei casi di AD ha un esordio precoce ed è legato a mutazioni genetiche del precursore della Aβ (AβPP) [15]. Il restante 95% dei casi riguarda una forma tardiva della malattia, dove l’invecchiamento e,
17
quindi, una maggior produzione di radicali liberi, sono i fattori principali di rischio [16].
NO è inoltre implicato nella neurotossicità dopaminergica nel Morbo di Parkinson (PD) tramite l’attivazione dei recettori NMDA con un meccanismo calcio/calmodulina-dipendente. Si tratta di una patologia dovuta ad una degenerazione cronica e progressiva di alcune strutture del sistema extrapiramidale, in particolare della sostanza nigra situata a livello del mesencefalo dove viene prodotta la dopamina (neurotrasmettitore essenziale per il controllo dei movimenti corporei) con conseguente perdita delle striature dopaminergiche. La neurotossina 1-metil-4-fenil-1,2,3,6-tetraidropiridina (MPTP) è la causa principale delle lesioni a livello dei neuroni dopaminergici del SNC. Il meccanismo alla base di questa neurotossicità coinvolge il suo metabolita attivo, lo ione 1-metil-4-fenil piridinio (MPP+) [17] . Il sequestro di MPP+ nei neuroni dopaminergici [18] causa una crisi energetica attraverso l’inibizione del complesso I mitocondriale e porta ad una deplezione di ATP [19]. La crisi energetica mitocondriale genera un aumento della produzione di radicali liberi [20], che è direttamente collegata ad elevate quantità di calcio [21]. Lo stress ossidativo è uno dei principali fattori che causa neurodegenerazione dopaminergica, in quanto, nei tessuti cerebrali dei pazienti affetti da PD, è stato notato un aumento di livelli di ferro, una diminuzione di GSH, disturbi delle funzioni mitocondriali nel SNC, come una diffusione di lipidi, proteine e dei prodotti di ossidazione del DNA.
18
NEUROPROTEZIONE DELL’OSSIDO NITRICO
Contrariamente agli effetti dannosi che l’NO e i suoi derivati possono apportare alle macromolecole biologiche, l’NO a basse concentrazioni, dimostra una forte capacità neuroprotettiva che questa molecola può esercitare sia a livello cardiovascolare sia a livello cellulare.
L’NO, prodotto dalla e-NOS, agisce sulla muscolatura liscia dei vasi sanguigni provocando vasodilatazione con conseguente abbassamento della pressione arteriosa ed aumento del flusso ematico. Proprio per questo è fondamentale per il benessere del sistema cardiovascolare e per la prevenzione delle patologie derivanti dal blocco del flusso sanguigno come ictus ed infarto.
Inoltre, sempre a basse concentrazioni, può funzionare da antiossidante intracellulare in molti sistemi biologici. L’NO nelle malattie neurodegenerative non svolge solo un’azione dannosa, ma ricopre un ruolo importante nel sistema di difesa antiossidante indispensabile per bloccare lo stress ossidativo. Può infatti prevenire la formazione dei ROS reagendo con O2- e portando alla formazione del ONOO- il quale viene rapidamente convertito in nitrato in assenza di altre specie reattive.
In conclusione, l’NO è una molecola in grado di svolgere funzioni diverse e contrapposte in rapporto alla sua concentrazione e al sito di produzione: ad alte concentrazioni può provocare effetti tossici, mentre a basse concentrazioni può portare effetti benefici agendo da secondo messaggero e da antiossidante.
19
INIBITORI OSSIDO NITRICO SINTASI
L’NO ad elevate concentrazioni, promosso dallo stress nitrosativo e con formazione di radicali liberi, induce al danno ischemico. Farmaci inibitori della NOS agiscono da falsi substrati della NOS e sono inibitori selettivi della produzione di NO. Alcuni inibitori possiedono una maggior affinità nei confronti di una isoforma ma sono comunemente denominati selettivi, anche se questo termine è usato indiscriminatamente [22]. L’applicazione di inibitori della NOS causa una riduzione significativa del volume dell’infarto sia a livello corticale sia a livello subcorticale.
Figura 9: Influenza degli inibitori della NOS sulla lesione del volume dell’infarto
Studi clinici, condotti sugli animali, hanno evidenziato che il trattamento farmacologico con inibitori selettivi NOS, in modelli di ischemia, è efficace sia prima dell’insorgenza dell’ictus, sia durante la comparsa dell’episodio, con conseguente effetti benefici [23].
Gli inibitori non selettivi non sono molto utili in terapia in quanto non riescono a ridurre il danno ischemico, a differenza degli inibitori selettivi per la n-NOS e i-NOS che diminuiscono l’area necrotica. E’ molto probabile che gli effetti benefici degli inibitori non selettivi siano limitati perché inibiscono la e-NOS. Di
20
conseguenza essi possono aggravare l’ischemia cerebrale aumentando l’aggregazione piastrinica e dei leucociti e la pressione sanguigna. Quindi gli inibitori non selettivi della NOS non sono agenti di prima scelta per il trattamento dell’ischemia cerebrale.
La L-nitroarginina è un inibitore 250 volte più selettivo per n-NOS rispetto alla i-NOS, ma manca di selettività nei confronti di e-NOS [24]. E’ stato dimostrato che a causa della sua mancata selettività per e-NOS, produce una estesa ipertensione negli animali provocando cosi alcuni effetti collaterali [25]. Tuttavia, l’impressionante selettività verso la n-NOS e i-NOS, insieme alla sua capacità di oltrepassare la barriera emato encefalica, hanno permesso di considerarla come molecola di riferimento per gli inibitori della NOS. E’ un inibitore competitivo della NOS, a causa della sua somiglianza strutturale al substrato.
Una caratteristica comune della maggior parte degli analoghi è la presenza di un gruppo amminico legato alla catena laterale dell’amminoacido (Figura 10). Il più potente analogo è la L-nitroarginina-L-2,4-diaminobutirammide (1).
Altrettanto interessanti sono i derivati L-nitroarginina-L-lisinammide (2) e D-lisil-D-nitroargininammide (3) che hanno attività simile, anche se la selettività è variata.
Infine l’analogo D-2,4-diaminobutiril-D-nitroarginammide (4) è meno potente e selettivo rispetto a 1 [26].
21 N H NHNO2 N H N H2 O OH N H NHNO2 N H N H2 O NH O NH2 NH2 1 NH2 N H2 O NH NH2 O NH NHNO2 N H N H NHNO2 N H N H2 O NH NH2 NH2 O N H2 O NH NH2 O NH NHNO2 N H NH2 2 3 4
Figura 10: Analoghi della L-nitroarginina
Un irrigidimento di tali strutture non ha portato ad un sostanziale miglioramento
per quanto riguarda l’attività, la selettività e la potenza, ad eccezione del composto 5. La sostituzione del gruppo diaminobutiramide con la pirrolidina (5), provoca una maggiore potenza e selettività rispetto al composto 1.
(n-NOS)Ki=120nM n-NOS/e-NOS=1538 n-NOS/i-NOS=192 N H NHNO2 N H N H2 O NH N H CONH2 5
Figura 11: Analogo più potente del composto 1
22
Una nuova classe di inibitori della NOS comprende piccole molecole non peptidiche, quali i composti 6, 7 e 8 caratterizzati da una elevata potenza (di ordine nM) e una buona selettività per n-NOS/e-NOS e n-NOS/i-NOS .
Figura 12: Derivati non peptidici
N N H NH NH2 N H2 6 (n-NOS)Ki=390 nM n-NOS/e-NOS=1110 n-NOS/i-NOS=150 N N H NH NH N H2 Cl 7 (n-NOS)Ki= 70nM n-NOS/e-NOS=540 n-NOS/i-NOS=78 (n-NOS)Ki=53 nM n-NOS/e-NOS=491 n-NOS/i-NOS=74 N N H NH NH N H2 F 8
23
Infine un’ ultima classe di inibitori selettivi per la NOS comprendono i composti presi come riferimento nella mia tesi. Sono derivati tiofenici (9 e 10) o derivati furanici (11 e 12) con la presenza di una porzione indolica. Presentano ottime proprietà inibitorie per la n-NOS.
IC50 n-NOS= 1.88 µM IC50 e-NOS= 32.6 µM IC50 i-NOS= 58 µM e-NOS/n-NOS= 17 IC50 n-NOS= 0.92 µM IC50 e-NOS= 51.1 µM IC50 i-NOS= 20 µM e-NOS/n-NOS= 56 IC50 n-NOS= 1.78 µM IC50 e-NOS= 54 µM IC50 i-NOS= 58 µM e-NOS/n-NOS= 31 IC50 n-NOS= 2.24 µM IC50 e-NOS= 97.4 µM IC50 i-NOS= 55 µM e-NOS/n-NOS= 43
Figura 13: Inibitori selettivi n-NOS
N H NH S N NH Me 9 N H NH S N NH Me 10 N H NH O N NH Me 11 N H NH O N NH Me 12
24
DONATORI DI OSSIDO NITRICO
La prima evidenza che ha portato a includere l’NO nella famiglia dei messaggeri che mediano la trasmissione nervosa nel sistema nervoso centrale deriva dall’osservazione che il glutammato, che agisce attraverso i recettori NMDA ( N-metil-D-aspartato), aumenta rapidamente la conversione dell’arginina in citrullina e NO nei tessuti cerebrali. La spiegazione di tale fenomeno deriva dal fatto che la stimolazione dei recettori NMDA favorisce l’entrata del calcio nell’ambiente intracellulare e porta all’aumento della produzione di NO da parte della n-NOS [27], che è un enzima calcio dipendente. L’eccessivo ingresso di ioni calcio attraverso i recettori NMDA è stato associato alla neurotossicità di una grande varietà di agenti nocivi [28]. In queste condizioni infatti i livelli di glutammato sembrano rimanere patologicamente elevati per periodi prolungati, attivando cosi in maniera persistente i recettori NMDA e, consentendo al calcio intracellulare, di raggiungere livelli citotossici. Questi effetti possono pertanto essere contrastati dall’impiego di inibitori dei recettori NMDA. Una serie di studi preliminari, basata sull’impiego di antagonisti del recettore NMDA, ha dimostrato la loro efficacia nel ridurre il danno ischemico. A tal proposito gioca un ruolo fondamentale l’ossido nitrico. Infatti, una volta prodotto, l’NO è in grado di diffondere liberamente e raggiungere tutte le sue molecole bersaglio. Queste sono principalmente cisteine reattive, come ad esempio l’NMDA. L’NO è in grado di legarsi ai gruppi tiolici del NMDA [29] promuovendo la S-nitrosilazione, una reazione chimica che avviene spontaneamente in presenza di alte concentrazioni di NO senza l’assistenza di enzimi. L’interazione con queste proteine porta essenzialmente ad un cambiamento conformazionale e ad una successiva modulazione della loro funzione promuovendo l’inibizione irreversibile del recettore NMDA [30].
Dal momento che il glutammato, attraverso i meccanismi precedentemente descritti, regola i processi di neurodegenerazione, si ritiene che l’uso di appropriati farmaci, quali donatori di ossido nitrico, che agiscono su tali recettori, possano alleviare o prevenire il progredire dei processi neurodegenerativi che si verificano nel corso del danno ischemico.
25
Figura 14: Farmaci donatori NO
Vasodilatatori NO-dipendenti, come la Nitroglicerina, potrebbero essere utilizzati nel trattamento farmacologico in quanto capaci sia di migliorare il flusso sanguigno, sia di rilasciare NO che reagisce con i gruppi tiolici portando ad una diminuzione della tossicità del glutammato [31].
Oltre all’NMDA, l’NO è in grado di interagire con altre cisteine reattive, le Caspasi (Cysteine Aspartyl Proteases), proteine coinvolte nella cascata eccitotossica che segue l’attivazione del recettore NMDA [32]. Le caspasi appartengono alla famiglia delle proteasi che hanno una cisteina nel sito attivo e idrolizzano proteine a livello dei residui dell’acido aspartico. Sono formate da due subunità che formano un eterodimero e, due di questi dimeri, si uniscono per formare il tetramero attivo. L’apoptosi è eseguita da tali proteine che attivano la cascata proteolitica. Si può dire che l’apoptosi abbia inizio con l’attivazione delle caspasi in conseguenza a segnali di diverso tipo che indicano la necessità che una determinata cellula venga eliminata.
ONO2 O2NO ONO2 NITROGLICERINA O N S R S-NITROSOTIOLO N N N OH O C H3 C H3 DIETILAMMINA NONOATES O N N+ O HN-3-MORFOLINOSIDNONIMINE S-NITROSO-N-ACETILPENICILLAMINE O CH3 N H O OH S N O C H3 CH3
26
Le caspasi si distinguono in:
1. Caspasi iniziatrici o pro-caspasi che operano all’inizio e sono attivate da stimoli extracellulari e dal rilascio del citocromo c nel citosol;
2. Caspasi effettrici che sono responsabili della rottura proteolitica di importanti substrati citoplasmatici e nucleari.
Un incremento dei livelli apoptotici e quindi dell’attività delle caspasi è frequentemente osservato nei siti del danno cellulare nelle malattie acute (ischemia, infarto) e in quelle croniche (Morbo di Parkinson, Morbo d’Alzheaimer, Morbo di Huntington). In particolare numerosi studi hanno consolidato l’importanza dell’attivazione delle caspasi nell’ischemia indotta da danno cerebrale, in quanto le caspasi giocano un ruolo centrale nella morte neuronale dopo ischemia cerebrale [33].
L’NO interagendo con i gruppi tiolici delle caspasi, tramite una S-nitrosilazione, promuove l’inattivazione di tali proteine rallentando cosi, l’apoptosi [34]. E’ importante notare che questa S-nitrosilazione avviene solo su caspasi già attive, quindi in una situazione in cui il programma apoptotico è stato già innescato. Questo fenomeno impedisce la degradazione della proteina antiapoptotica Bcl-2 ed il rilascio del citocromo c utile nell’attivazione delle caspasi [35]. Si tratta di un altro meccanismo di protezione dal danno ischemico indotto da n-NOS che causa inibizione irreversibile delle caspasi. Tale inibizione, avendo come obiettivo quello di ridurre la morte cellulare e quindi il tessuto danneggiato, è considerato un buon trattamento farmacologico in quanto il danno cerebrale si riduce dopo induzione di ischemia.
La scoperta del ruolo biologico dell’NO ha fornito le basi per comprendere il meccanismo d’azione di farmaci donatori di ossido nitrico ed ha suggerito anche di affiancare all’uso di questi farmaci una terapia a base di L-arginina, fornendo quindi il substrato metabolico per generare endogeneticamente NO [36]. Tuttavia, nonostante si siano condotti parecchi studi clinici nell’ambito delle patologie cardiovascolari, l’utilizzo di L-arginina si è rivelato poco efficace ed è in declino. Probabilmente la mancata efficacia della somministrazione di L-arginina, è dovuta alle molteplici vie di metabolismo di questo amminoacido alternative a quella catalizzata dalla NOS.
27
Negli ultimi anni, gli studi sull’NO, hanno identificato una serie di nuovi donatori di NO, oggi in fase di sviluppo, per il trattamento di svariate patologie. I farmaci identificati sono una combinazione di alcuni farmaci antiinfiammatori non steroidei ( FANS ) e di esteri nitrici. In presenza del corredo enzimatico di cellule e tessuti avviene una idrolisi che porta alla formazione del FANS di partenza e di un rilascio lento di NO. Grazie a questo approccio sono stati cosi ottenuti nuovi antiinfiammatori donatori di NO, denominati NO-NSAID (a nitric oxide-releasing nonsteriodal antiinflammatory) [37] che non includono danno gastrico, grazie all’attivazione del microcircolo e all’inibizione dei processi infiammatori quali l’adesione leucocitaria. Molto interessanti sono alcuni derivati del flurbiprofene che, grazie alla buona penetrazione della barriera emato encefalica, agiscono in modelli di infiammazione sperimentale. Risultati incoraggianti ottenuti in modelli sperimentali, quali animali transgenici portatori di placche di β-amiloide, hanno aperto la strada a studi tuttora in corso su pazienti affetti da Morbo di Alzheimer.
Figura 15: Farmaci NO-NDAID
O CH3 F ONO2 O OH CH3 F FLUBIPROFENE HTC-1026
28
In definitiva, una possibile discrepanza tra i risultati clinici e preclinici è che questi trattamenti devono essere effettuati nell’arco di pochi minuti o di poche ore dall’inizio dell’insulto ischemico, evenienza difficile da realizzare clinicamente nell’uomo. In generale la strategia terapeutica è finalizzata alla riduzione dei danni istopatologici conseguenti all’anossia cerebrale attraverso un aumento della sopravvivenza dei neuroni. L’intervento terapeutico, non potendo recuperare le cellule nervose distrutte dall’evento lesionale, deve essere finalizzato a ridurre l’estensione dell’area di necrosi.
PROSPETTIVE FUTURE
Gli studi condotti sull’NO hanno dimostrato come esso sia davvero coinvolto nella regolazione di processi fisiopatologici rilevanti [38] in quanto capace di indurre tossicità ma nello stesso tempo di essere utilizzato come meccanismo di neuroprotezione [39] e che, farmaci attivi sulla sua via metabolica e di trasduzione del segnale, possano essere utilizzati in terapia.
L’NO a basse concentrazione è in grado di indurre effetti benefici sia nelle malattie cardiovascolari svolgendo un’azione vasodilatante, sia nelle malattie neurodegenerative in quanto è grado di funzione da antiossidante verso i ROS. Le alte concentrazioni dell’NO, invece sono la causa principale delle degenerazioni di tali malattie con conseguente aumento dello stress ossidativo, dannoso per le macromolecole biologiche.
Su questa base sono stati sintetizzati nuovi farmaci, i quali sono ancora in fase di sviluppo. Sono dotati della combinazione di inibitori selettivi NOS con donatori di NO.
Una superproduzione dell’isoforma neuronale della NOS (n-NOS) con conseguente superproduzione dell’NO, è implicata in molte malattie neurodegerative in quanto capace di indurre stress ossido tramite i suoi radicali
29
liberi. L’inibizione selettiva verso la n-NOS ha permesso la sviluppo di nuovi agenti terapeutici.
Farmaci donatori di NO, agiscono con un altro meccanismo d’azione. Sono in grado di legarsi al recettore NMDA, coinvolto nella neurotossicità di una grande varietà di agenti nocivi, e agire da antagonisti verso tale recettore, riducendo in questo modo il danno ischemico. Inoltre sono anche in grado di interagire con i gruppi tiolici delle caspasi promuovendo l’inattivazione di queste proteine, coinvolte nell’apoptosi, riducendo la morte neuronale e il danno cerebrale.
Nella mia tesi di laurea sono stati presi in considerazione questi farmaci duali (NO-NOS) per lo sviluppo di nuovi agenti neuroprotettivi nelle malattie neurodegenerative.