Materiali e metodi
2.1 Sedimenti
Campionamento
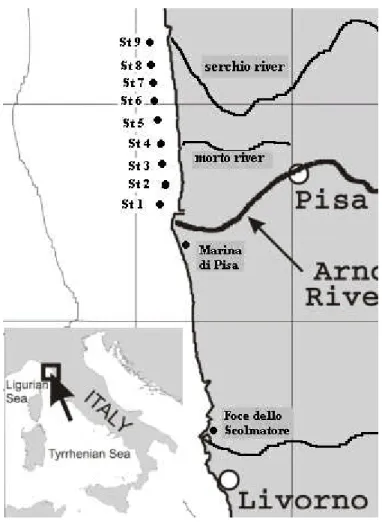
Le stazioni da noi scelte sono mostrate in figura 2.1 con le rispettive coordinate, indicate nella tabella sottostante:
Stazione Coordinate Distanza dalla costa (m)
Marina di Pisa
Latitudine Longitudine 0 43°40'54" N 10°16'07"E Foce Scolmatore 43°34'80" N 10°18'00"E 0 Stazione 1 43°41'50" N 10°16'60"E 500 Stazione 2 43°42'00" N 10°16'53"E 500 Stazione 3 43°43'10" N 10°16'45"E 500 Stazione 4 43°44'09" N 10°16'45"E 500 Stazione 5 43°44'32" N 10°16'39"E 500 Stazione 6 43°44'87" N 10°16'29"E 500 Stazione 7 43°45'20" N 10°16'17"E 500 Stazione 8 43°45'54" N 10°16'02"E 500 Stazione 9 43°45'97" N 10°15'39"E 500
Figura 2.1: Ubicazione delle stazioni di campionamento
Il campionamento costituisce la fase preliminare di ogni tipo di analisi e deve essere svolto con molta correttezza per evitare di condizionare i risultati di tutte le operazioni successive. Il sedimento, utilizzato per la preparazione degli elutriati, è stato prelevato con una benna in acciaio inossidabile, appositamente realizzata nel nostro laboratorio. I sedimenti venivano posti in contenitori di polietilene accuratamente lavati con soluzioni acidulate (HNO3, 10%), conservati al buio, a 4 C, per un periodo non superiore a due settimane. I sedimenti sono stati raccolti a circa 500 m dalla costa per tutte le stazioni ad eccezione delle stazioni alla Foce dello Scolmatore e a Marina di Pisa, per le quali il sedimento è stato raccolto lungo la costa.
Preparazione degli elutriati
Per ottenere gli elutriati il sedimento è stato mescolato all’acqua di mare naturale in un rapporto 1:4; il rapporto è stato calcolato utilizzando il peso secco del sedimento che è stato determinato mettendone una quota (2 gr) in stufa a 60 C fino a peso costante. L’elutriazione è stata eseguita mediante agitazione vigorosa a 500 rpm per 24 h mediante un agitatore verticale modello STIRRER type BS (VELP Scientifica, BIO CLASS). Al termine delle 24 h la fase acquosa è stata separata dai sedimenti attraverso una prima fase di decantazione (30 minuti), seguita da una fase di centrifugazione (15 min; 7000rpm) e successiva filtrazione del sopranatante con filtri da 0,45 m (Millipore).
L’elutriato così ottenuto veniva immediatamente utilizzato per il biosaggio oppure mantenuto a -20C.
2.2 Colture algali
Colture di mantenimento
In questo lavoro sono state utilizzate le seguenti microalghe: Phaeodactylum
tricornutum (Bohlin), Thalassiosira weissflogii (Grunow in Van Hemck) Fryxell &
Haxle e Skeletonema costatum (Greville) Cleve (diatomee), Dunaliella tertiolecta (Butcher) (alga verde) ed Emiliania huxleyi (Lohnamm) Hay & Mohler (coccolitoforide), acquistate presso il centro “Culture Collection of Algae and Protozoa”, Dunstoffuoge Marine Laboratory, UK. La coltivazione in laboratorio di
queste alghe unicellulari fitoplanctoniche avviene in condizioni axeniche, in camera termostatata, regolata ad una temperatura di 21 C, sotto illuminazione con luce fluorescente (100M fotoni m-2s-1) con un ritmo luce:buio di 16:8 h.
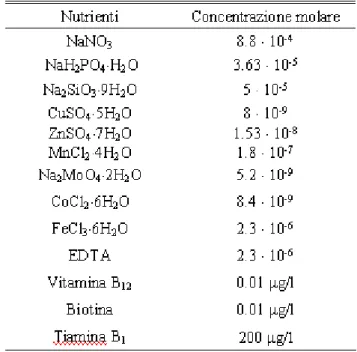
Il terreno di coltura è costituito da acqua di mare naturale, arricchita con nutrienti. Nella tabella 2.1 sono elencate le quantità di nutrienti da aggiungere all’acqua di mare, in accordo con il mezzo f/2 leggermente modificato (Guillard, 1975).
Tabella 2.1: Terreno di coltura in acqua naturale: modificazione del mezzo f/2 (Guillard, 1975).
L’acqua di mare è stata prelevata a largo dell’isola Capraia, nell’arcipelago toscano, ad una profondità poco inferiore al livello superficiale, filtrata su membrane Sartorius a porosità 0.45 m, mediante un sistema di filtrazione a pressione e trasferite in contenitori di polietilene. Allo scopo di evitare qualsiasi contaminazione, il prelievo ed il condizionamento dei materiali, quali recipienti e filtri, sono stati effettuati seguendo le modalità indicate da Mart (1976). L’acqua di mare filtrata è stata poi conservata in
camera fredda ad una temperatura di circa +4 C fino al momento della sua utilizzazione.
Il terreno di coltura è stato sterilizzato sotto cappa sterile a flusso laminare mediante l’uso di un set di filtrazione, precedentemente sottoposto a trattamento in autoclave, con filtri del tipo Sartorius a porosità di 0.2m sterilizzati singolarmente.
Allo scopo di mantenere le cellule in una fase di crescita esponenziale, le colture cellulari sono state mantenute inoculando ogni sette giorni un’aliquota da una coltura madre in un nuovo terreno di coltura sterile.
Conta cellulare
Le conte cellulari venivano eseguite al microscopio ottico invertito (Zeiss) per mezzo della “camera di Thoma”. Al microscopio si osserva un reticolo costituto da 16 campi, a loro volta divisi in 16 quadratini. In tutto si hanno 256 quadratini, che corrispondono ad una superficie di 0.64 mm2, ovvero ad un volume di 64 × 10-6cm3. Le cellule sono state contate all’interno dei 16 campi e per stimare la densità cellulare, espressa in num di cellule/ml è stata utilizzata la seguente proporzione:
N cellule contate : 64 × 10-6cm3= x : 1cm3
Calcolo del biovolume
Per confrontare le specie, che sono molto diverse in volume l’una dall’altra, è stata fatta la normalizzazione per unità di biovolume. Utilizzando un vetrino calibrato per la misura delle due dimensioni cellulari, è stato calcolato il biovolume tenendo conto della forma geometrica delle cellule in base alle formule “proposte” da Hillebrand et al
(1999). I biovolumi medi, per ogni singola specie, sono stati quantificati calcolando la media dei biovolumi misurati per i singoli individui (n = 10).
Calcolo della velocità di crescita
La crescita delle colture in fase esponenziale è stata valutata attraverso la conta cellulare al momento dell’inoculo (t0) e dopo 6 giorni. La velocità di crescita (), espressa come
raddoppiamenti/giorno, è calcolata tramite la seguente equazione: = 1/t log2(N/N0)
dove t è il tempo di crescita espresso in giorni, N e N0sono i numeri di cellule calcolati,
rispettivamente, al tempo t ed al tempo zero.
2.3 Procedura sperimentale
Esperimenti a breve termine
Per i test a breve termine (5 ore), sono state preparate precolture di ogni specie algale, utilizzando, come mezzo di coltura, acqua di mare naturale arricchita con NaNO3 e
NaH2PO4in concentrazioni di 8.8 × 10-4M e 3.6 × 10-5 M, rispettivamente (equivalenti
alle concentrazioni di N e P nel mezzo f/2). Le precolture sono state preparate inoculando un opportuno volume di colture di mantenimento, prelevato dal settimo al decimo giorno di crescita, tale da ottenere una concentrazione cellulare iniziale di 5-7 × 104 cellule/ml per P. tricornutum, 3-5 × 104 cellule/ml per S. costatum, 3-5 × 103 cellule/ml per T. weissflogii, 5-7 × 104 cellule/ml per D. tertiolecta e 1-3 × 104 cellule/ml per Emiliania huxleyi. Alla fine della fase di crescita esponenziale (7-9
giorni), veniva misurata la densità cellulare, e quindi veniva calcolato l’esatto volume di precolture da aggiungere nel mezzo di esposizione ai metalli (elutriati o acqua di mare naturale con aggiunta di metallo) per ottenere opportune densità cellulari. Prima della risospensione cellulare, le aliquote calcolate di precolture venivano ridotte di volume mediante filtrazione (con filtri a porosità di 1.2m) in modo da non superare mai il 5% del volume del mezzo di esposizione. Questa procedura è stata scelta per evitare una eccessiva diluizione del mezzo di esposizione con l’aggiunta di elevati volumi di precoltura. Abbiamo anche evitato di portare a secco le cellule sul filtro per non indurre eventuali stress alle alghe, prima dell’incubazione. Gli esperimenti di induzione delle PC sono stati effettuati in condizioni di luce continua a 21C, per 5 h.
Esperimenti di incubazione a breve termine sono stati condotti sia in acqua di mare naturale arricchita di metalli pesanti, che in elutriati di sedimenti marini.
Le concentrazioni dei metalli aggiunti all’acqua di mare erano le seguenti: 0, 5, 10, 15, 20, 30, 40, 60, 80 e 100 nM per il Cd; 0, 25, 50, 75, 100, 150, 200, 250 e 300 nM per il Cu; 0, 25, 50, 75, 100, 125, 150 e 200 nM per il Pb. Le concentrazioni di elutriato aggiunti all’acqua di mare erano dello 0, 25, 50, 75, 100%.
Il volume del mezzo di esposizione era di 200 ml e le densità cellulari erano: 5 × 105 cellule/ml per P. tricornutum, 3× 105cellule/ml per S. costatum, 4 × 104cellule/ml per T.
weissflogii, 5 × 105 cellule/ml per D. tertiolecta e 2 × 105 cellule/ml per Emiliania
huxleyi.
Tutti i mezzi di esposizione venivano arricchiti di nitrati e fosfati, in concentrazioni equivalenti a quelle del mezzo f/2, per evitare che una carenza dei maggiori nutrienti potesse limitare la sintesi dei peptidi. Infatti alcuni autori (Ahner et al, 2002) riportano
che una carenza di N e P limita l’assimilazione del solfato che a sua volta può limitare la sintesi dei tioli non proteici.
Esperimenti a lungo termine
La produzione di fitochelatine è stata valutata in esperimenti a lungo termine nei quali colture di P. tricornutum, T. weissflogii e S. costatum sono state fatte crescere per 6 giorni in mezzi di coltura contenenti elutriati di sedimenti marini. Tali terreni di coltura, costituiti dall’elutriato al 100% oppure diluito con acqua di mare dal 25 al 75%, venivano arricchiti dei nutrienti (N, P e Si in concentrazioni equivalenti a quelle del mezzo f/2) e sterilizzati seguendo la stessa procedura utilizzata per il mezzo di mantenimento. Nel mezzo di coltura così sterilizzato sono stati inoculati volumi opportuni delle colture di mantenimento in modo da ottenere una concentrazione iniziale di 1 × 104 cellule/ml per P. tricornutum, 5 × 103 cellule/ml per S. costatum, 1× 103 cellule/ml per T. weissflogii. Dopo 6 giorni di crescita algale, le colture sono state sottoposte alla conta cellulare ed è stata calcolata la velocità di crescita.
Allo scopo di valutare la produzione di PC in funzione della crescita cellulare sono state confrontate due specie di microalghe, P. tricornutum e T. weissflogii. Un volume opportuno delle rispettive colture di mantenimento di ciascuna specie è stato inoculato nel 100% di elutriato, ottenuto dal sedimento prelevato alla Foce dello Scolmatore. Al momento dell’inoculo le densità cellulari per T. weissflogii erano di 1 × 102 cellule/ml, 5 × 102 cellule/ml, 1 × 103 cellule/ml, 3 × 103 cellule/ml e 5 × 103 cellule/ml e per P.
tricornutum erano di 5 × 102
giorni di esposizione, per tutte le colture è stata calcolata la velocità di crescita, , espressa in raddoppiamenti/giorno.
2.4 Determinazione dei gruppi tiolici non proteici
Dopo l’esposizione ai metalli le microalghe sono state filtrate, mediante filtri a membrana con porosità di 1.2m, e risospese in 1.5 ml di 0.1 M HCl / 5 mM acido di etilenetriamminopentacetico (DTPA) (composto che lega i metalli) in modo da dissociare i complessi metallo-PCn. Le cellule risospese sono state distrutte mediante
sonicazione (Sonopuls Ultrasonic Homogenizer, Baldelin) per 3 minuti con cicli ripetuti di 0.3 secondi, mantenendo il campione in un bagno a ghiaccio. Le cellule omogeneizzate sono state centrifugate (19000 g, 45 minuti) ed il sopranatante è stato usato per la determinazione dei tioli. I tioli non proteici (glutatione e fitochelatine) sono stati determinati e quantificati mediante cromatografia liquida ad elevate prestazioni (HPLC), con una colonna a fase inversa, dopo derivatizzazione con il tracciante fluorescente monobromobimano (mBrB; Fahey and Newton, 1987; Newton et al, 1981). Per la derivatizzazione dei gruppi tiolici è stata seguita la procedura indicata da Rijstenbil and Wijnholds (1996), con alcune modifiche. In una provetta oscurata sono stati messi 400 l di sopranatante a cui si sono aggiunti 200 l di 0.4 M acido 4-(2-idrossietil)-piperazina-1-propano-sulfonico (HEPPS) / 5 mM DTPA, pH 9, e 20 l di Tris (2-carbossietil) fosfina (TCEP) 10 mM, per ridurre i gruppi tiolici ossidati: è stato verificato che, in queste condizioni, una quantità di 100 pmoli di glutatione ossidato (GSSG) veniva quantitativamente convertita in glutatione ridotto (GSH) (Morelli e
Scarano, 2001). Questa reazione è stata fatta avvenire al buio per 15 minuti a 45C. Di seguito vengono aggiunti 40l di mBrB 10mM in acetonitrile a cui seguono 15 minuti di incubazione a 45 C. Successivamente si aggiungono 40 l di Cys 100mM, con lo scopo di far reagire il mBrB in eccesso: in questo modo è stato ridotto il numero di picchi che possono interferire durante l’analisi (Ahner et al, 1995): anche per questa reazione sono necessari 15 minuti di incubazione a 45 C. Infine, la reazione è stata bloccata con l’aggiunta di 40 l di acido metasulfonico (MSA) 2M. La miscela di derivatizzazione conteneva, in tutto, 740l.
I derivativi sono stati separati su una colonna a fase inversa Alltech C-18 5 m (250 mm × 4.6 mm) e rivelati ad una lunghezza d’onda di emissione a 470 nm (lunghezza d’onda di eccitazione = 380 nm). L’eluente era composto da una miscela di due solventi: il solvente A era costituito da acido trifluoroacetico (TFA, 0.1%) e rappresentava il solvente acquoso, mentre il solvente B era costituito da 100% acetonitrile e rappresentava il solvente idrofobico. Per l’eluizione dei campioni è stato programmato un gradiente lineare che portava la concentrazione di B dal 10% al 12% in 15 minuti e dal 12% al 28% nei successivi 40 minuti. Poiché le fitochelatine sono dei polimeri, più lunga è la catena più sarà idrofobica la molecola: in questo modo, quando si aumenta la percentuale dell’eluente B, vengono separati prima i composti più polari e poi, man mano che cambia la concentrazione di B, quelli più apolari (polimeri a catena più lunga). La velocità del flusso in colonna dell’eluente era di 1 ml × min-1. Prima di iniettare un nuovo campione, la colonna è stata pulita portando l’eluente al 100% di acetonitrile per 5 minuti e riequilibrata passando al 10% di acetonitrile per 10 minuti.
Il tempo di ritenzione delle fitochelatine è stato confrontato con campioni standard di PC2, PC3 e PC4 ottenuti da Silene vulgaris (Friederich et al, 1998), gentilmente forniti
dal Prof. M.H. Zenk, dell’Università di Monaco (Germania).
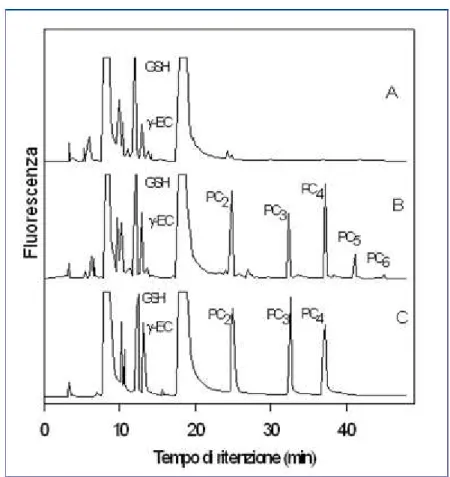
In figura è riportato un esempio in cui si vedono i cromatogrammi relativi alla cromatografia ad alta prestazione (HPLC) di tioli non proteici in estratti cellulari ottenuti da colture di P. tricornutum. Nel cromatogramma A le cellule di P. tricornutum non sono state esposte ad alcun metallo (sono presenti il glutatione, ed il dipeptide -Gly-Cys costitutivi nelle cellule vegetali). Il cromatogramma B si riferisce a cellule di
P. tricornutum esposte al Cd: sono presenti fitochelatine identificabili dal tempo di
ritenzione. Il cromatogramma C si riferisce ad una miscela di tioli standard. Il picco che eluisce a 8.5 minuti corrisponde ad un eccesso di cisteina e gli altri picchi non identificati sono dovuti ad altri reagenti.
Il tempo di ritenzione delle PC5 e PC6 è stato calcolato dalla relazione lineare tra il
tempo di ritenzione dei peptidi standard ed il log di n, dove n è il numero di-Glu-Cys dipeptidi presenti negli oligomeri, come riportato da Gekeler et al. (1988).
Figura 2.1: Cromatogrammi relativi alla cromatografia ad alto rendimento (HPLC) di tioli non proteici in estratti cellulari ottenuti da colture di P. tricornurum non esposte (A) ed esposte al Cd (B). Il cromatogramma C si riferisce ad una miscela di tioli standard. Il picco che eluisce a 8.5 minuti corrisponde ad un eccesso di cisteina e gli altri picchi non identificati sono dovuti ad altri reagenti.
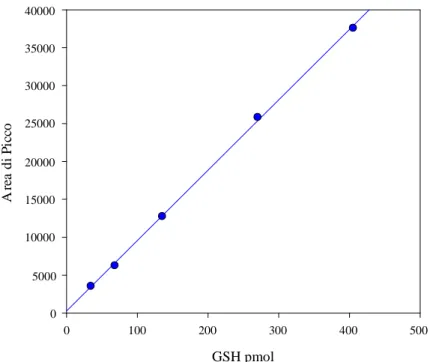
Le fitochelatine sono state quantificate utilizzando il rapporto tra area di picco e concentrazione delle soluzioni standard di GSH. Tale rapporto è risultato lineare nell’intervallo di concentrazione di GSH da 4 a 400 pmol; in figura 2.2 è riportata la retta di calibrazione: il limite di rilevabilità era vicino a 1 pmol. La concentrazione totale di PC cellulare era espressa come somma delle unità -Glu-Cys quantificate in ogni picco cromatografico relativo alle fitochelatine.
GSH pmol 0 100 200 300 400 500 A re a d i P ic co 0 5000 10000 15000 20000 25000 30000 35000 40000
Figura 2.2: Calibrazione del GSH
La quantità di fitochelatine veniva normalizzata per cellula utilizzando la seguente formula:
dove V è il volume e MD è la miscela di derivatizzazione.
Tale quantità è stata poi trasformata in moli per unità di volume cellulare, sulla base dei biovolumi di cellule di controllo riportati in tabella 3.2 (sezione Risultati e discussione).
Il sistema HPLC consisteva di due pompe Shimadzu LC-10 AD, una valvola di iniezione Rheodyne 7725 collegata ad un loop da 100 l ed un rivelatore di
fluorescenza Shimadzu RF-10 AXL. I cromatogrammi sono stati elaborati su PC utilizzando il software Chromatoplus.
2.5 Determinazione del metallo
Per la determinazione della concentrazione dei metalli in tracce nelle acque è stata utilizzata la voltammetria di ridissoluzione anodica (AVS) con elettrodo (catodo) a film di mercurio. Le tecniche polarografiche sono molto sensibili; tale sensibilità è dovuta ad una prima fase di “preconcentrazione” in cui i vari ioni metallici presenti in soluzione subiscono una riduzione chimica (Me2+ + 2e- = Me0) in seguito all’applicazione di un potenziale elettrico costante superiore a quello necessario per far avvenire le reazioni di riduzione relative ad ogni singolo metallo. I metalli ridotti formano un amalgama con l’elettrodo (catodo) di Hg. La quantità di metallo che si deposita all’elettrodo è funzione del tempo di elettrolisi. Alla fine dell’elettrolisi la soluzione viene fatta riposare per alcuni secondi, dopo di che il potenziale applicato viene fatto diminuire nel tempo in modo tale che i vari metalli depositati sull’elettrodo si riossidino (Me0= Me2++ 2e-) e tornino in soluzione rendendo libere le cariche elettriche che determinano una corrente. L’intensità di corrente è proporzionale alla quantità di metallo che si è riossidato e quindi a quello che si era depositato all’elettrodo nella prima fase di deposizione e in definitiva alla concentrazione del metallo in soluzione. Dalla conoscenza del potenziale al quale si verifica l’ossidazione del metallo, si ottiene una identificazione qualitativa del tipo di metallo presente in soluzione. Le misure voltammetriche sono state condotte a pH 2 (aggiunta di 50ldi HCl Suprapur in 20 ml di campione) per la determinazione
della concentrazione totale del metallo disciolto, e a pH 8 per la determinazione della frazione labile.
La concentrazione dei metalli determinata a pH naturale (pH 8), comprende solo il metallo ionico e tutto quello che deriva dai complessi più labili in base alla reazione di riduzione che avviene all’elettrodo:
MeL L2 -+ Me2+ Me + 2e
-Per determinare anche la frazione di metallo legata stabilmente a molecole organiche è necessario procedere con trattamenti quali l’acidificazione (pH 2) in modo tale da spostare anche i complessi più stabili.
Le misure voltammetriche sono state condotte con un polarografo Metrohm model 646 VA in connessione con uno stativo 647 VA, equipaggiato con un sistema convenzionale a tre elettrodi, consistente di un elettrodo ausiliario di carbone vetroso, di un elettrodo di riferimento ad Ag/AgCl/KCl (3M) a doppia giunzione e di un elettrodo di lavoro costituito da un disco di carbone vetroso (3 mm) sul quale viene depositato uno strato sottile di mercurio (MFE). Il film di mercurio veniva ottenuto depositando per 600 sec a Edep = -1 V una soluzione 510-5M di Hg(NO3)2, dopodichè la cella elettrolitica veniva
lavata con acqua Milli-Q ed utilizzata per le successive misure dei campioni. Il tempo di deposizione era di 300 sec ed il potenziale di deposizione Edep= -1 V
2.6 TOC
Le misure del TOC (Total Organic Carbon) sono state effettuate nel nostro laboratorio con un analizzatore di carbonio, Shimadzu 5000 TOC Analyser, in accordo al metodo indicato in Santinelli et al (2002).
2.7 Reagenti
Tutti i reagenti erano di grado analitico: DTPA, GSH, cisteina, mBrB sono stati acquistati da Fluka; TCEP da Molecular Probes; HEPPS da Sigma; MSA, di grado Suprapur, da Merk; HCl, di grado Suprapur, acetonitrile e TFA, di grado HPLC, Cu(NO3)2, CdCl2 e Pb(NO3)2 da Carlo Erba. TCEP e mBrB erano preparati
giornalmente, mentre le altre soluzioni sono state preparate settimanalmente e conservate, al buio, in camera fredda a +4 C. Tutta la vetreria (beute, celle polarogrfiche, ecc.) è stata lavata, attraverso vari passaggi, con acido nitrico di grado reagente (acquistato da Carlo Erba) diluito al 10% con acqua milli-Q.