3. Caratterizzazione chimico-fisica delle
fuliggini – Metodiche e procedure
sperimentali
INTRODUZIONE
Sono state effettuate alcune indagini di laboratorio su tre campioni di fuliggini e due tipi di carbone provenienti da diverse centrali termoelettriche presenti in Italia.
Le fuliggini sono poi state sottoposte ad una lisciviazione acida in modo da ridurre il loro contenuto di materia volatile.
In Tabella 3.1 si riporta la simbologia impiegata in seguito per le fuliggini tal quali, lisciviate ed i carboni.
Tab. 3.1. Elenco dei campioni
CAMPIONE SIGLA
T1 tal quale T1TQ
T1 lisciviato T1L
SE tal quale SETQ
SE lisciviato SEL
M2 tal quale M2TQ
M2 lisciviato M2L
South African Coal SA
Per ciascun campione di fuliggine tal quale o lisciviata si è provveduto a determinare: • la composizione chimica mediante ICP AES;
• il tenore di carbonio (C), idrogeno (H), azoto (N) e zolfo (S) mediante analisi CHNS; • il potere calorifico tramite carbonio e idrogeno contenuto e tramite DTA;
• la distribuzione granulometria;
• la struttura morfologica e microanalisi mediante SEM-EDS;
• i profili di combustione mediante analisi termogravimetriche e le analisi termocinetiche;
3.1. LISCIVIAZIONE DELLE FULIGGINI
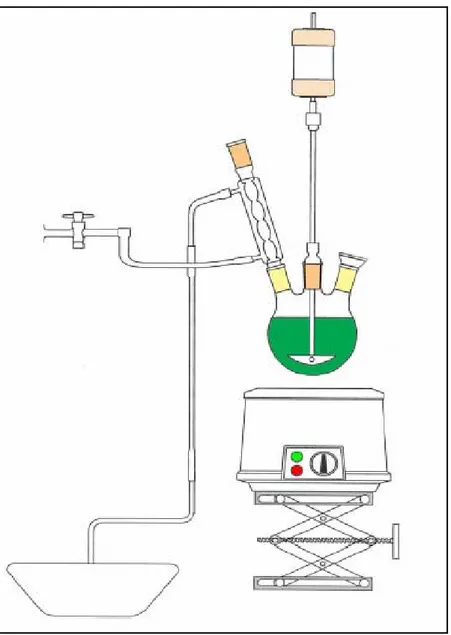
La lisciviazione acida dei campioni di fuliggine è stata condotta in un pallone in Pirex® a tre colli da 1000 cc dotato di condensatore a ricadere. Nel pallone vengono miscelati 30 g di fuliggine, preventivamente essiccata in stufa alla temperatura di 105°C per 24 h e setacciata (< 300µm), con H2SO4 2M nel rapporto di 7 cc/g fuliggine. La sospensione è
mantenuta in agitazione ad una temperatura di 100°C per 60 minuti [3.1]. L’agitazione della sospensione è realizzata mediante agitatore mosso da un motore elettrico; la temperatura è mantenuta mediante un manto riscaldante.
Fig. 3.1. Apparecchiatura sperimentale usata per la lisciviazione.
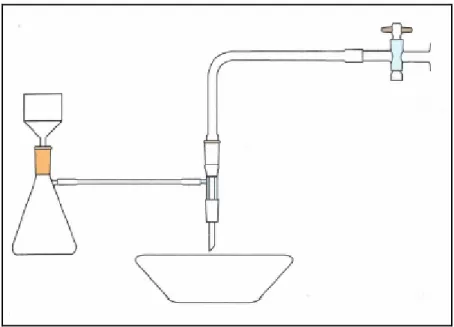
La sospensione ottenuta è poi filtrata ed il pannello è sottoposto a ripetuti lavaggi con acqua distillata.
Fig. 3.2. schema dell’apparato utilizzato per la filtrazione sottovuoto.
Successivamente il pannello solido ottenuto viene essiccato in stufa per 24 ore e setacciato a d<300 µm per le prove di caratterizzazione.
3.2. CARATTERIZZAZIONE CHIMICA
3.2.1. Analisi con ICP-AES
In un recipiente di teflon all’interno di un’autoclave di acciaio inossidabile viene miscelato 1 g di campione di fuliggine tal quale o lisciviata con 15 cc di HNO3 e 5 cc di
HF. L’autoclave così caricata viene posta in stufa alla temperatura di 120-125° C per 2h, quindi, dopo raffreddamento, viene aperta e si aggiungono, agitando, 25 g di H3BO3, che
reagisce con l’acido fluoridrico. La sospensione ottenuta viene filtrata sotto vuoto ed il pannello viene lavato più volte con acqua distillata fino a portare la soluzione filtrata ad un volume di 100 cc. Tale soluzione viene analizzata mediante ICP-AES.
La spettroscopia atomica coinvolge una radiazione elettromagnetica (luce) che è assorbita o emessa dagli ioni, atomi che possiedono una certa carica, presenti in un campione.
Per valutare gli elementi in tracce, il campione è decomposto da un calore intenso, in una nube di gas caldi contenenti atomi liberi degli elementi d’interesse. Nella spettrofotometria ad emissione atomica (AES) il campione è sottoposto a temperature tanto alte da provocare sia la dissociazione in atomi, sia un’elevata eccitazione collisionale. Quando gli atomi o ioni hanno raggiunto uno stato eccitato, essi possono decadere in stati più bassi con transizioni energetiche di tipo termico o radioattivo. In AES l’intensità della luce emessa a specifiche lunghezze d’onda è misurata ed utilizzata per determinare le concentrazioni degli elementi d’interesse.
Per valutare la concentrazione di un certo elemento, inizialmente si valutano l’intensità delle emissioni all’ICP dell’elemento di interesse in soluzioni note. Si ricavano delle curve che correlano concentrazione ed intensità di emissione, note come curve di calibrazione. Una volta ottenute tali curve, confrontandole con l’emissione della soluzione campione, è possibile conoscere la concentrazione dell’elemento.
3.2.2. Analisi elementare
L’analisi elementare consiste nella determinazione del contenuto di C, H, N e S.
La determinazione del contenuto di carbonio, idrogeno e azoto è stata effettuata utilizzando uno strumento CARLO ERBA DP200. Il campione da analizzare viene trattato in ossigeno a circa 1000°C; i gas di combustione ottenuti (CO2 e H2O) sono analizzati con
un rilevatore I.R. ed a termoconducibilità. Lo strumento viene tarato con miscele gassose standard. Il contenuto di S totale è misurato mediante analizzatore LECO SC 432 DR I.R.
3.2.3. Potere calorifico
E’ stato ipotizzato che la frazione di incombusti sia costituita da carbonio e idrogeno, trascurando la presenza di altri elementi quali azoto e zolfo; per il calcolo sono stati utilizzati i dati ricavati mediante l’analisi CHN.
Il potere calorifico del carbonio trovato in letteratura risulta pari a 7831 kcal/kg [3.2]; questo dato è riferito alle condizioni di combustione completa, ossia alla formazione di CO2 secondo la reazione:
C + O
2→ CO
2Il potere calorifico dell’idrogeno trovato in letteratura risulta pari a 33887 kcal/kg [3.2]; questo dato è riferito alle condizioni di combustione completa e alla formazione di acqua allo stato liquido (potere calorifico superiore). La reazione di combustione, che avviene, è:
H
2+ ½ O
2→ H
2O
(l)L’equazione utilizzata per il calcolo del potere calorifico superiore è la seguente:
33887 100 2 7831 100⋅ + ⋅ ⋅ = C H PCS
dove: P.C.S. è il potere calorifico superiore in kcal/kg di fuliggine; C è la percentuale in peso di carbonio sul campione;
H è la percentuale in peso di idrogeno sul campione.
Il PCI (potere calorifico inferiore) è ottenuto sottraendo al PCS la quota energetica dovuta alla condensazione dell’acqua presente (l’acqua è ottenuta allo stato vapore).
Il PCI è stato calcolato anche tramite analisi termica differenziale (DTA) descritta nel paragrafo (3.5.3) ed i risultati sono stati confrontati tra loro
3.3. CARATTERIZZAZIONE MORFOLOGICA
3.3.1. Distribuzione granulometria
E’ stata effettuata un’indagine sulla distribuzione granulometrica di ciascun campione a disposizione mediante l’apparecchiatura FRITSCH particle sizer Analisette 22.
La fuliggine in esame viene posta in un becher con alcool isopropilico in modo da agevolare la bagnabilità dei campioni, successivamente è posta all’interno di un portacampione contenuto nell’apparecchiatura, viene prelevata da tale recipiente mediante una pompa e fatta passare attraverso un raggio laser.
La scelta del fluido di trasporto dipende dalle caratteristiche delle particelle da analizzare; in questo caso l’alcool, utilizzato al posto dell’acqua, evita che alcuni composti (es. solfati) presenti nelle fuliggini possano sciogliersi alterando la misurazione.
La particella investita dal raggio genera un cono d’ombra la cui ampiezza dipende dalle dimensioni della particella stessa.
Dalle dimensioni e dal numero dei coni d’ombra rilevati viene determinata la distribuzione granulometrica del campione analizzato.
3.3.2. Analisi mediante SEM-EDS
Un microscopio a scansione elettronica (SEM – JEOL 5600 LV) abbinato a spettrometro ad energia dispersa (EDS) è stato impiegato per l’analisi morfologica e la microanalisi dei vari campioni.
3.4. CARATTERIZZAZIONE TERMOANALITICA
3.4.1. Termobilancia
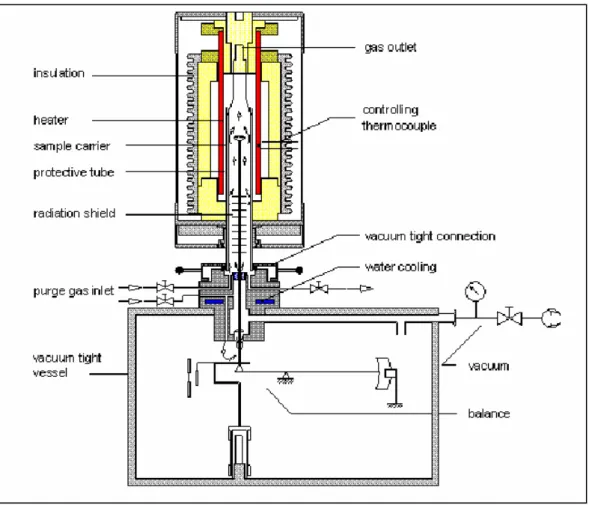
Le termoanalisi sono state effettuate utilizzando una termobilancia Netzsch STA 409, collegato ad un PC, che permette di eseguire simultaneamente sia l’analisi termogravimetrica (TGA) che l’analisi termica differenziale (DTA).
Lo strumento consente di registrare la variazione del peso del campione in funzione dell’aumento di temperatura; dai dati ottenuti è possibile ricavare dei grafici (perdita di peso vs. temperatura) definiti curve termogravimetriche (TG). Dalle TG è possibile estrapolare le curve DTG, dette profili di perdita di peso, mediante la derivata prima del segnale rilevato.
riscaldamento (curve DTA), permettendo così di individuarne l’esotermicità o l’endotermicità delle stesse.
L’apparecchiatura è costituita da un forno cilindrico riscaldato elettricamente in cui possono circolare gas sia inerti che ossidanti. Al suo interno si trova il porta-campione che poggia su una bilancia di precisione che permette di misurare e registrare continuamente la diminuzione del peso del campione.
I campioni sono posti in crogioli di allumina e riscaldati a velocità costante nella termobilancia in diverse condizioni:
• flusso di gas (azoto, aria e miscele N2, O2, CO2) pari a 150 cc/min (STP);
• velocità di riscaldamento di 2,4, 8, 20 °C/min.
Si riporta in Figura 3.3 una rappresentazione della termobilancia utilizzata per le analisi.
3.4.2. Analisi termogravimetriche
Sui campioni di fuliggini tal quale e lisciviate sono state effettuate una serie di analisi termogravimetriche al fine di valutarne il comportamento termico ed il tenore di incombusti. Le analisi sono state condotte in:
• Azoto;
• Miscela B (6% O2, 10% CO2, 84% N2);
• Miscela C (12% O2, 10% CO2, 78% N2);
• Aria.
Le prove termogravimetriche per la valutazione degli incombusti sono state effettuate riscaldando ciascun campione a velocità costante (8°C /min), da temperatura ambiente a 900°C in aria ed in azoto.
3.4.3. Potere calorifico
E’ stato determinato il PCI di ciascun campione in esame mediante analisi termica differenziale (DTA); tale risultato è stato confrontato con il potere calorifico valutato in base al contenuto di C e H nei campioni (paragrafo 3.3).
Sulle curve ottenute mediante l’analisi termica differenziale (DTA) la combustione è individuata da uno o più picchi esotermici e l’area dei picchi di ciascuna curva è proporzionale alla quantità di calore sviluppato durante la combustione. Il programma di elaborazione dei dati utilizzato ha permesso di calcolare l’area di ciascun picco e, di conseguenza, il calore sviluppato.
Il sistema è stato tarato effettuando più prove con combustibili a potere calorifico noto. I combustibili standard utilizzati come riferimento sono i due carboni aventi potere calorifico rispettivamente di 6600 kcal/kg (campione SA) e di 7260 kcal/kg (campione MAP) .
-10 -8 -6 -4 -2 0 2 4 200 400 600 800 0 20 40 60 80 100 Pe rd it a d i pes o (%) Temperatura (°C)
Temperatura media di ignizione C B TG DTG A Ve loc it à di pe rdita di pe so (%/m in ) 3.4.4. Profili di ignizione
Molteplici sono i fattori che possono influenzare la valutazione della temperatura di ignizione, tra cui il peso del campione, la velocità di riscaldamento, il flusso di gas, ecc.
Nella presenta tesi si valuta una temperatura media di ignizione utilizzando le curve TG e DTG, le condizioni a cui vengono ricondotte le prove sono:
• flusso di gas 150 cc/min; • peso campione ≈ 10 mg
• velocità di riscaldamento 2, 4, 8 ,20 K/min; • atmosfere con 21, 12, 6 % di ossigeno.
Si riporta in Fig. 3.4 un esempio della procedura utilizzata.
Sulla curva DTG si individua il punto A (●) corrispondente alla temperatura di massima velocità di perdita di peso, a tale temperatura sulla curva TG si individua il punto B (■) corrispondente al punto di flesso, si traccia quindi la tangente in questo punto. Si traccia poi la tangente relativa al tratto iniziale della curva TG, il punto di intersezione C (▲) delle due tangenti individua il punto medio di ignizione.
Le prove condotte a varie velocità di riscaldamento ed in varie atmosfere ossidanti ci hanno permesso di individuare correlazioni tra temperatura media di ignizione e velocità di riscaldamento e atmosfera ossidante.
3.4.5. Analisi termocinetica
Attraverso la modellazione delle curve termogravimetriche sperimentali è possibile ricavare una equazione cinetica che fornisca l’andamento della conversione nel tempo a varie temperature [3.3 - 3.6].
Considerando una generica reazione di combustione che a partire da un combustibile A solido genera un prodotto volatile V e un residuo solido C:
A → C + V
La relativa curva termogravimetrica risulta essere la seguente (Fig.3.5):
Si definisce conversione ad un generico istante “t” il rapporto: f 0 0
M
M
M
M
−
−
=
α
dove: Mo è la massa del campione iniziale
Mf è la massa del campione a fine reazione M è la massa del campione al generico istante “ t “.
La variazione della conversione nel tempo è esprimibile tramite una espressione del tipo:
)
(
f
K
dt
d
α
⋅
=
α
dove: f(α) è una funzione che può assumere diverse forme a seconda del meccanismo ipotizzato e K è la costante cinetica (1/sec).
L’effetto della temperatura è introdotto mediante la costante K secondo l’equazione di Arrhenius: RT / E
e
A
K
=
⋅
− (1)dove: E è l’energia di attivazione in kJ/mole A è il fattore preesponenziale Si ha quindi:
)
(
f
e
A
dt
d
α
=
⋅
−E/RT⋅
α
(2)Per l’analisi di ciascun campione sono state effettuate tre termogravimetrie nelle medesime condizioni operative, eccezion fatta per la velocità di riscaldamento che è stata opportunamente variata (2, 4, 8 °C/min).
L’elaborazione cinetica dei dati sperimentali è stata condotta tramite un apposito software (NETZSCH Termokinetics) [3.7]. Tale programma utilizza modelli cinetici predefiniti ed attraverso metodi di calcolo iterativi valuta l’equazione cinetica, con i relativi parametri, che meglio fitta la curva termogravimetrica sperimentale. La bontà del
fittine viene stimata mediante un coefficiente di correlazione R. Valori di R > 0,999 esprimono l’applicabilità del modello.
Confrontando i parametri cinetici così ottenuti è possibile condurre una valutazione comparativa sulla reattività dei campioni.
Si riportano nella Tabella 3.2 le espressioni cinetiche predefinite disponibili sul software NETZSCH.
3.4.6. Scala di reattività
Una volta valutato il modello ed i relativi parametri cinetici è possibile simulare il comportamento del campione in condizione isoterme. Quindi si può estrapolare, il tempo necessario per raggiungere una fissata conversione (α=0.8).
I dati ottenuti sono stati rappresentati su dei grafici, mettendo in ordinata il tempo scala logaritmica ed in ascissa l’inverso della temperatura (1000/T con T espresso in K).
Tab. 3.2. Equazioni cinetiche predefinite contenute nel software
Code f(α) Reaction type
A. Deceleratory α-time curves
A.1 based on geometrical model
R2 2
1
) 1 (
2⋅ −α two-dimensional phase boundary reaction
R3 3
2
) 1 (
3⋅ −α three-dimensional phase boundary reaction A.2 based on diffusion mechanism
D1 α ⋅ 2 1 one-dimensional diffusion D2 ) 1 ln( 1 α − − two-dimensional diffusion D3 (1 )32 [1 (1 )31] 1 2 3⋅ −α ⋅ − −α − Jander’s type D4 3 1 1 ] 1 ) 1 [( 2 3⋅ −α − − − Ginstling-Brounstein Type
A.3 based on “order of reaction”
F1 (1−α) first-order reaction
F2 (1−α)2 second-order reaction
Fn (1−α)n nth-order reaction
C1-X (1−α)⋅(1+Kcat⋅X) first-order reaction with autocatalysis Cn-X (1−α)n ⋅(1+Kcat⋅X) nth-order reaction with autocatalysis
B. Sigmoid α-time curves
A2 2 1 )] 1 ln( [ ) 1 ( 2⋅ −α ⋅ − −α two-dimensional nucleation A3 3 2 )] 1 ln( [ ) 1 ( 3⋅ −α ⋅ − −α three-dimensional nucleation An n n n ) 1 ( )] 1 ln( [ ) 1 ( − − − ⋅ − ⋅ α α Avrami-Erofeev
B1 α⋅(1−α) simple Prout-Tompkins equation
Riferimenti
[3.1] C. Brocchini, “Recupero di Vanadio da ceneri da combustibili di oli
pesanti”, Tesi A.A. 1998-1999, Dipartimento di Ingegneria Chimica
dell’Università di Pisa.
[3.2] R. H. Perry, “Perry’s Chemical Engineers’ Handbook”, Seventh Edition, McGraw-Hill International Editions (1998).
[3.3] Wesley W. M., Wendlant B., “Thermal Analysis“, 3th ed. John Wiley & Sons Inc., pp. 57 – 83.
[3.4] Brown M., “Introduction to Thermal Analysis”, Chapman & Hall 1998. [3.5] Fridman H. L., “Kinetic Analysis”, Polym. Sci, 1964, C6 pp. 183 – 192. [3.6] Brown M. E., Phillipotts E. J., “Non-Isotermal Kinetics”, J. Chem. Educ.,
1978, pp. 55, 556.